La homeostasis de la piel, cuya regulación molecular es aún bastante desconocida, está íntimamente relacionada con la función de las células madre epidérmicas. El programa SkinModel-CM, auspiciado por la Comunidad de Madrid, reúne 5 grupos de investigación con el propósito de desarrollar nuevos modelos experimentales in vitro e in vivo para analizar la función de ADN metiltransferasa 1, la endoglina y la podoplanina en la actividad de las células madre epidérmicas y en la homeostasis y el cáncer cutáneos. Estos nuevos modelos comprenden tanto cultivos organotípicos 3D, como ratones inmunodeficientes con la piel humanizada y ratones modificados genéticamente. Otro objetivo del programa es el uso de ratones con la piel humanizada como modelo para reconstruir enfermedades cutáneas, tales como el síndrome de Gorlin y el xeroderma pigmentoso, con el objeto de optimizar nuevos protocolos de intervención mediante la terapia fotodinámica.
Homeostasis, whose regulation at the molecular level is still poorly understood, is intimately related to the functions of epidermal stem cells. Five research groups have been brought together to work on new in vitro and in vivo skin models through the SkinModel-CM program, under the auspices of the Spanish Autonomous Community of Madrid. This project aims to analyze the functions of DNA methyltransferase 1, endoglin, and podoplanin in epidermal stem cell activity, homeostasis, and skin cancer. These new models include 3-dimensional organotypic cultures, immunodeficient skin-humanized mice, and genetically modified mice. Another aim of the program is to use skin-humanized mice to model dermatoses such as Gorlin syndrome and xeroderma pigmentosum in order to optimize new protocols for photodynamic therapy.
Aunque la piel es el órgano más extenso y accesible de nuestro cuerpo, los procesos biológicos que regulan su homeostasis no son aún bien comprendidos. La piel no es una simple barrera para protegernos de los agentes nocivos externos y prevenir la pérdida de agua, sino uno de los tejidos más complejos y dinámicos de nuestro organismo. No es exagerado afirmar que la piel es tan compleja como el sistema nervioso, aunque la primera se diferencia del segundo en un aspecto esencial: mientras que el cerebro no puede sustituir las neuronas dañadas, la piel se renueva constantemente y es capaz de reparar una herida, repoblando el tejido con nuevas células. El conocimiento de los fundamentos biológicos y moleculares que gobiernan la arquitectura, diferenciación y regeneración de la piel es crucial para comprender las enfermedades cutáneas y encontrar los remedios adecuados. La investigación básica o, dicho de otra manera, los esfuerzos en ambas direcciones, del laboratorio a la clínica y de la clínica al laboratorio (lo que se conoce como investigación traslacional) han hecho avanzar sustancialmente los estudios dermatológicos. Sirva como ejemplo la identificación de 15 nuevos loci de susceptibilidad a la psoriasis, aumentando a 36 el número de genes asociados con esta enfermedad, en individuos de la población europea, realizada recientemente por varios consorcios internacionales de investigadores1. Muchos de estos genes están asociados con la inmunidad innata y son compartidos por otras enfermedades autoinmunes, lo que pone de manifiesto la importancia de la piel en la defensa inmune innata y adquirida.
Los estudios de oncología molecular han permitido identificar vías de señalización intracelular claves en el cáncer cutáneo. Un ejemplo es la frecuente activación de la ruta de las proteínas cinasas activadas por mitógenos (MAPK) en el melanoma maligno como consecuencia de mutaciones en el gen BRAF (el homólogo de mamíferos del oncogén v-raf del virus de sarcoma murino identificado en el cerebro) o NRAS (el homólogo en mamíferos del virus de sarcoma de rata identificado en el neuroblastoma)2. También merece destacarse el hallazgo de la vía de señalización hedgehog como la responsable de la formación de carcinomas de células basales (CCB)3. Estos avances han permitido la identificación de nuevas dianas farmacológicas y la incorporación a la oncología clínica dermatológica de tratamientos más selectivos e individualizados, como el vemurafenib —un inhibidor de la proteína BRAFV600E mutante (la mutación BRAF mayoritaria en este tipo de neoplasia)— en el melanoma4, o el vismodegib —un antagonista de la proteína de membrana Smo (Smoothened) implicada en la activación de la vía hedgehog— para el tratamiento del CCB avanzado5.
La enfermedad cutánea engloba casi un 20% de la atención médica en asistencia primaria, y el cáncer de piel es la neoplasia de mayor incidencia en la población. Además de las enfermedades cutáneas no neoplásicas más frecuentes, como dermatitis, acné, psoriasis, etc., existen más de 400 enfermedades hereditarias de baja prevalencia, conocidas como genodermatosis, las cuales, en conjunto, dan cuenta de un porcentaje significativo de la consulta dermatológica. La etiología de muchas de estas enfermedades es bien conocida, pero en otros casos las causas son complejas y estamos aún lejos de comprenderlas en profundidad. A pesar de los avances en el diagnóstico y en el conocimiento de la biología molecular de muchos procesos patológicos cutáneos, no se ha producido un avance similar en los tratamientos. Por ejemplo, en el cáncer de piel la resección quirúrgica, acompañada de quimio y/o radioterapia, sigue siendo la práctica más extendida. Esto se debe, en parte, a la falta de modelos experimentales adecuados para ensayar nuevos fármacos o nuevas terapias, lo que sería muy aconsejable antes de ir a costosos y, a menudo, infructuosos ensayos clínicos.
La piel constituye un modelo biológico fascinante para la ciencia básica, que trasciende a la propia dermatología. La epidermis fue el primer órgano dónde se identificaron in situ células madre mediante la técnica de retención del marcaje (véase más adelante) y, junto con el sistema hematopoyético, es el tejido donde las células madre están mejor caracterizadas. Además, la piel ha puesto de manifiesto una estrecha relación entre células madre y cáncer, por un lado, y células madre y envejecimiento, por otro. La bioingeniería o ingeniería de tejidos ha revolucionado la investigación dermatológica aportando nuevos modelos experimentales in vitro e in vivo para el estudio de la mayoría de las genodermatosis y el ensayo de nuevas terapias. En este sentido, el desarrollo de modelos de ratón con piel humanizada ha permitido reproducir experimentalmente enfermedades cutáneas humanas en el ratón.
SkinModel es el nombre de una plataforma que ha reunido 5 grupos de investigación de la Comunidad de Madrid (CM), ubicados en el Hospital Santiago Ramón y Cajal, Universidad Autónoma de Madrid, Centro de Investigaciones Energéticas Medioambientales y Tecnológicas (CIEMAT) y Consejo Superior de Investigaciones Científicas (CSIC), en torno a un programa científico común. Este programa consiste en el desarrollo de nuevos modelos celulares y animales para investigar mecanismos moleculares implicados en la regulación de la homeostasis epidérmica y para reproducir determinadas enfermedades cutáneas que permitan ensayar nuevos abordajes terapéuticos.
Células madre y homeostasis epidérmicaEn los organismos eucariotas pluricelulares las células madre o troncales constituyen una población celular muy definida, caracterizada por 2 propiedades únicas: la capacidad de diferenciarse dando lugar a uno o más tipos celulares y la capacidad de autorrenovarse, originando células con el mismo potencial de diferenciación. En mamíferos estos tipos celulares pueden ser de origen embrionario o adulto. Las células madre embrionarias ejercen su actividad un corto periodo de tiempo durante el desarrollo del óvulo fecundado, originando todas las capas germinales embrionarias que posteriormente darán lugar a los tejidos del organismo adulto. Por su parte, las células madre adultas son responsables de mantener el equilibrio homeostático de los tejidos del organismo adulto; es decir, de mantener la tasa de recambio de los diferentes tipos celulares de cada tejido y de regenerar o reparar el tejido tras sufrir un daño. Estas células, que se localizan en lugares específicos denominados nichos, son capaces de diferenciar para producir todos los tipos celulares que componen el tejido que mantienen6. El nicho es un elemento clave en la regulación funcional de las células madre adultas. Las células somáticas que integran el nicho de un tejido interaccionan con las células madre residentes, estableciendo la señalización molecular que regula su actividad proliferativa y diferenciadora.
El conocimiento de la biología de las células madre ha experimentado un interés creciente en biomedicina. La medicina regenerativa contempla el uso clínico de células madre —ya sean de origen embrionario o adulto— como una herramienta para generar in vitro nuevos órganos o tejidos que reemplacen el tejido dañado del paciente. La posibilidad de revertir una célula somática de un individuo adulto al estado pluripotencial de una célula embrionaria (una estrategia conocida en inglés como induced pluripotent stem cells o células iPS) ha atraído un enorme interés debido a su utilidad virtual en la medicina regenerativa. Esta técnica, sin embargo, presenta algunos problemas, ya que implica la introducción de genes exógenos, habitualmente silentes en el organismo adulto, cuya reexpresión en los tejidos puede acarrear efectos nocivos impredecibles, tales como la formación de un tumor7. Por otra parte, la utilización de células madre embrionarias totipotenciales, o con características embrionarias, es un tema controvertido desde el punto de vista ético, debido al uso de embriones humanos y a la posibilidad de clonación reproductiva para crear individuos completos genéticamente idénticos. Una alternativa interesante para soslayar estos problemas es la utilización de células madre residentes en los tejidos adultos, capaces de originar una variedad de linajes celulares (incluidos linajes distintos a los que componían el tejido original), pero sin posibilidad alguna de producir un organismo completo. Una premisa para la utilización correcta de estas células en la medicina regenerativa es un conocimiento amplio de su biología y de la de su entorno (su nicho).
Se ha descrito recientemente que, para algunos tipos de cáncer, las células que tienen la capacidad de iniciar la formación de un nuevo tumor son solo una minoría de las células que lo forman; la mayoría de las células tumorales son células diferenciadas que han perdido la capacidad de autorrenovarse in vivo. Estas observaciones han dado lugar al concepto de «célula madre cancerígena o tumoral», un nuevo paradigma en oncología, que ha originado una fuerte controversia, sobre todo en lo que se refiere al diseño de nuevas estrategias terapéuticas8, ya que esta subpoblación de células iniciadoras del tumor, o células madre cancerígenas, parece ser resistente a la quimio y radioterapia convencionales.
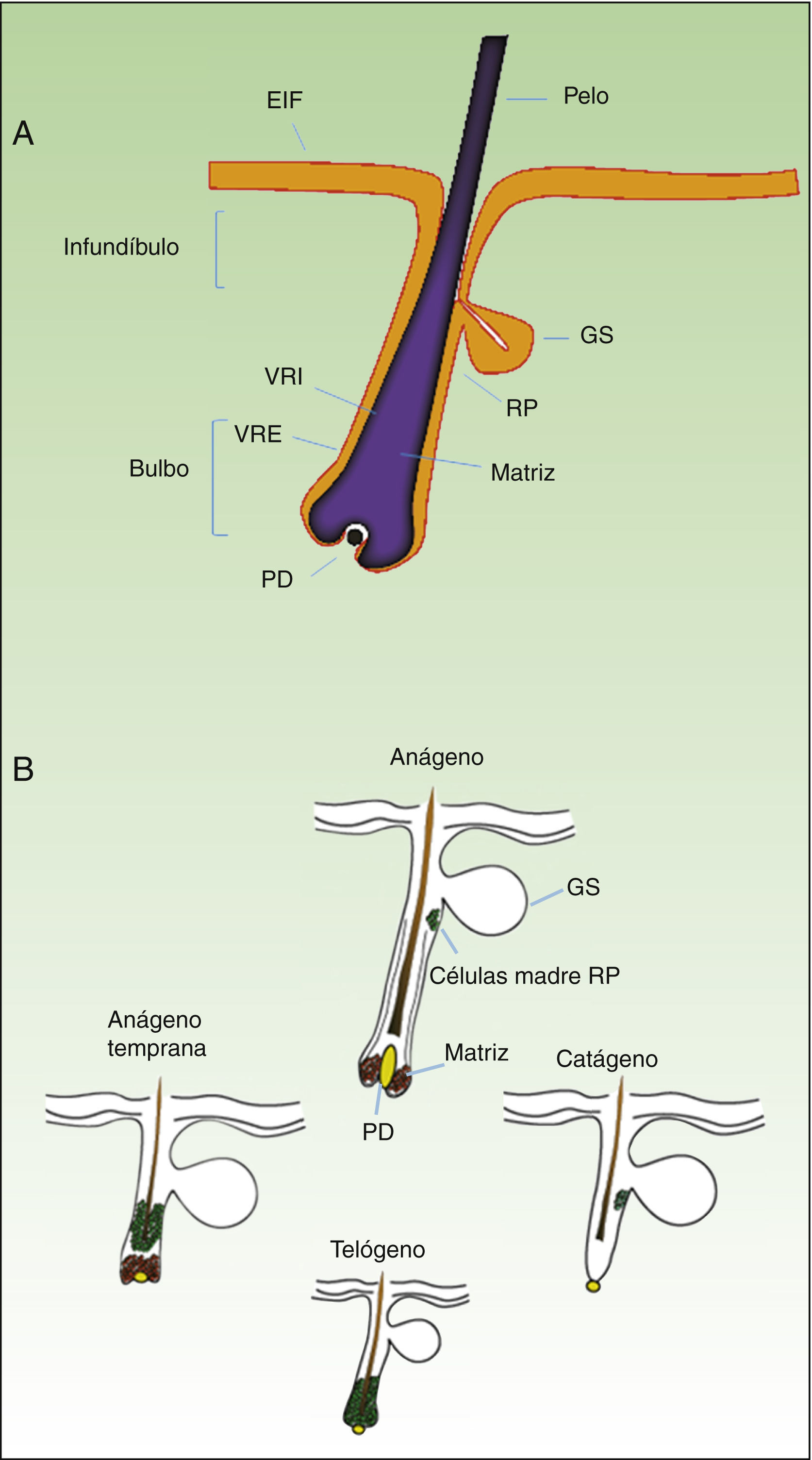
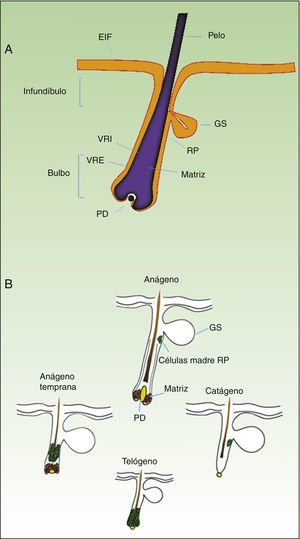
Como se ha mencionado anteriormente, el control homeostático de la epidermis es el resultado de la actividad de una pequeña población de células madre multipotenciales que se dividen raramente y poseen un elevado potencial de diferenciación. Esta población responde a las necesidades fisiopatológicas del tejido, originando un gran número de células progenitoras con un elevado poder de replicación y una baja capacidad de diferenciación que se extiende por el estrato basal de la epidermis, constituyendo una población celular transitoriamente amplificada (transit amplifying cells [TA]). Cotsarelis et al. fueron los primeros en demostrar que la región prominente (bulge) del folículo piloso (fig. 1A) constituye un nicho de células madre epidérmicas9. Estos autores aprovecharon la baja tasa proliferativa de las células madre in vivo para identificarlas. Así, tras administrar timidina tritiada a ratones para que se incorporara al ADN celular durante la replicación, y tras dejar transcurrir un período de tiempo lo suficientemente largo, solo las células madre de la región prominente del folículo fueron capaces de retener el marcaje radiactivo (por esa razón se denominaron label retaining cells [LRC]). Estudios más recientes sugieren que el folículo piloso contiene otras poblaciones de células madre, algunas de ellas más activas que las LRC de la región prominente10,11. También se ha demostrado la presencia de células progenitoras en el estrato basal de la epidermis interfolicular. Actualmente, el significado de esta gran variedad de poblaciones de células madre epidérmicas localizadas en distintas zonas del folículo (región prominente, infundíbulo, papila dérmica) y de la epidermis interfolicular, que expresan marcadores proteicos específicos, es un tema sujeto a debate. En cualquier caso, estas células producen los linajes celulares que forman el folículo piloso, la glándula sebácea y la epidermis. Las células progenitoras de la región prominente del folículo no solo contribuyen a la regeneración del pelo, sino que participan en la cicatrización de heridas, ya que son capaces de emigrar a la epidermis interfolicular y diferenciar a queratinocitos10. Esta población de células progenitoras exhibe una vigorosa multipotencia y es capaz de diferenciar in vitro no solo a queratinocitos, sino también a neuronas, glía, melanocitos y células mesenquimáticas12. Además, esta población participa in vivo en los procesos angiogénicos que tienen lugar en la piel.
A. Representación esquemática de un folículo piloso. B. El ciclo del folículo piloso.
EIF: epidermis interfolicular; GS: glándula sebácea; PD: papila dérmica; RP: región prominente; VRE: vaina radicular externa; VRI: vaina radicular interna.
Adaptado de: Goldstein y Horsley11 y Mistriotis y Andreadis12.
El folículo piloso constituye un modelo biológico muy bien caracterizado en el ratón para el estudio de la biología de las células madre epidérmicas y de las señales implicadas en el diálogo molecular que se establece entre el epitelio folicular y el tejido adyacente, lo que se denomina como interacción epitelio-mesénquima. El ciclo de crecimiento del folículo piloso en el ratón, que a diferencia de lo que sucede en humanos ocurre de forma sincrónica durante un período de tiempo después del nacimiento, está regulado de forma estricta a través de sus 3 fases: anágeno (crecimiento activo), catágeno (regresión) y telógeno (reposo)13. Estas fases afectan exclusivamente a la parte inferior del folículo, mientras que la parte superior de este, incluida la región prominente, permanece intacta y es la zona permanente del folículo (fig. 1B). Durante la primera transición telógeno-anágeno, las señales moleculares provenientes de la papila dérmica (de origen mesodérmico) inducen la división asimétrica de las células madre localizadas en la base de la zona permanente del folículo, lo que origina, además de nuevas células madre, una población activa de células TA, que migran y diferencian para formar un bulbo alrededor de la papila dérmica, el cual avanza hacia el interior de la dermis originando la zona cíclica del folículo. Hacia la mitad de la fase de anágeno las células madre localizadas en la región prominente abandonan el ciclo y retornan a su estado habitual de quiescencia. La fase de anágeno termina cuando el potencial proliferativo de las células TA se agota; entonces, se inicia la fase de catágeno, en la que el bulbo se degrada y la papila dérmica se retrae y asciende hasta ponerse en contacto con la región prominente (figs. 1B y 2). Este ascenso es crucial para el establecimiento de futuras interacciones epitelio-mesénquima entre la papila dérmica y la región prominente que van a desencadenar una nueva entrada en anágeno.
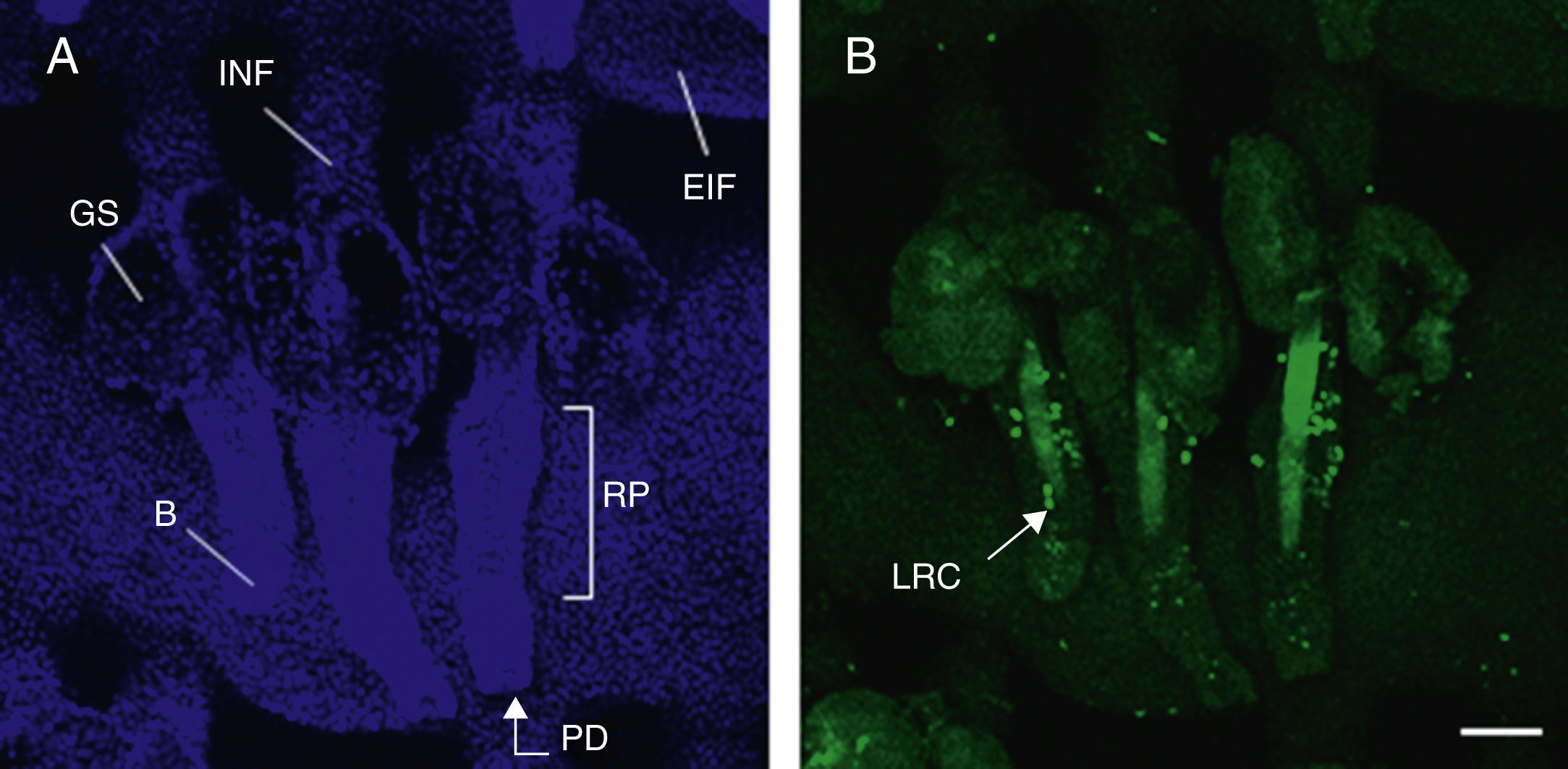
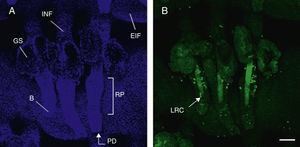
Morfología del folículo piloso. Imágenes de microscopia confocal (proyecciones máximas) de montajes in toto de la epidermis de la cola de ratones.
A. Triplete de folículos pilosos; tinción nuclear con Höechst 33258.
B: bulbo; EIF: epitelio interfolicular; GS: glándula sebácea; INF: infundíbulo; PD: papila dérmica; RP: región prominente.
B. Detección de las células madre en la región prominente del folículo piloso mediante inmunofluorescencia. Tras el marcaje a largo plazo utilizando 5-bromo-2′-deoxiuridina (BrdU), las células madre epidérmicas se identificaron en función de su capacidad para retener durante largos períodos de tiempo la marca de este análogo de nucleótido incorporado en su ADN, por lo que se denominan label retaining cells (LRC). Barra de escala: 100μm.
Durante la última década se ha acometido la caracterización rigurosa de los mecanismos moleculares que regulan la actividad del folículo piloso. Así, ha podido establecerse que la vía de señalización Wnt/β-catenina desempeña un papel clave en el ciclo del folículo, activando las células madre de la región prominente e induciendo la transición de la fase de telógeno a la fase de anágeno13,14. Por otro lado, la vía TGF-β/BMP/Smads es también esencial para la correcta regulación del ciclo del pelo13–15. Las proteínas morfogenéticas del hueso (Bone Morphogenetic Proteins [BMP]) son secretadas al comienzo de la fase de telógeno por células localizadas en la dermis y en la región prominente, induciendo la entrada de las células madre en un estado de quiescencia y favoreciendo la transición del folículo a la fase de reposo. Asimismo, distintos factores de la familia TGF-β están implicados en la entrada del folículo en la fase de telógeno. Existe, por tanto, un equilibrio entre las señales estimuladoras e inhibidoras reguladas secuencialmente por estas vías de señalización a lo largo del ciclo del pelo, el cual depende, en última instancia, de un estricto control de la actividad de las células madre de la región prominente del folículo. Sin embargo, se desconocen aún muchos de los mecanismos que regulan la actividad de estas vías.
Recientemente, se ha puesto de manifiesto que distintos mecanismos epigenéticos dependientes de las ADN metiltranferasas pueden ejercer un papel esencial en el control de la señalización mediada por Wnt/β-catenina16. Uno de los objetivos del programa SkinModel-CM es analizar la relevancia de la ADN metiltransferasa 1 (Dnmt1) en la señalización de Wnt/β-catenina y su impacto en la actividad de las células madre epidérmicas. Por otro lado, algunos miembros del consorcio han demostrado que endoglina, un receptor auxiliar de TGF-β/BMP, tiene una importante función en la homeostasis epidérmica y en el cáncer cutáneo, ya que regula la señalización inducida por factores de la familia de TGF-β a través de proteínas Smad17. Por esa razón, otra de las líneas de investigación del programa SkinModel-CM es analizar la función de endoglina en la regulación de la actividad de las células madre epidérmicas. Ambos objetivos, Dnmt1 y endoglina, implican la generación de nuevos modelos experimentales con ratones modificados genéticamente.
Modelos experimentales: el ratónEl ratón es el animal preferido para la investigación dermatológica. Ello es debido a su bajo coste, facilidad de manipulación y a que la piel del ratón está organizada de una manera similar a la humana (aunque también presenta diferencias importantes, como veremos más adelante). Los modelos de ratón han contribuido de una manera decisiva a los avances que han experimentado áreas importantes de la dermatología, como la inmunología y el cáncer. En lo que al cáncer se refiere es necesario mencionar las grandes aportaciones que ha hecho el modelo de la carcinogénesis química de piel de ratón, con la formulación de conceptos tales como: iniciación, promoción y progresión tumoral, el cual ofrece un sistema operativo para analizar los mecanismos moleculares implicados en estas etapas18,19.
En el modelo de la carcinogénesis química de piel de ratón se induce la aparición de tumores cutáneos mediante la aplicación de agentes químicos en la piel de los animales; generalmente una dosis única de un mutágeno iniciador, como el dimetilbenzantraceno, seguido de aplicaciones repetidas de un promotor tumoral, tal como el éster del forbol TPA20. Mediante este protocolo se originan numerosos papilomas benignos, la mayoría de los cuales son reabsorbidos en la piel cuando cesa el estímulo promotor. No obstante, una fracción de estos tumores (que varía según la cepa del ratón) progresa espontáneamente a carcinomas de células escamosas (CCE) malignos. Este modelo fue el primero en proporcionar una demostración experimental de la implicación causal de un oncogén Ras en la iniciación de la carcinogénesis19 y, desde entonces, ha venido siendo utilizado de una manera generalizada para examinar la función de otros genes en la iniciación y/o progresión tumoral21. Es, además, un sistema excelente para el estudio genético de la susceptibilidad al cáncer o, dicho de otra manera, para la identificación de genes asociados con una mayor resistencia o sensibilidad a la carcinogénesis22.
El modelo de la carcinogénesis de piel de ratón ha sido determinante para que el programa SkinModel-CM contemple el estudio de la función de podoplanina y endoglina en la homeostasis de la piel. Podoplanina (también conocida como antígeno PA2.26, aggrus o T1α) se identificó como una glucoproteína de la superficie de queratinocitos basales de la epidermis interfolicular y de los folículos pilosos, cuya expresión se induce durante la cicatrización de heridas y la carcinogénesis de la piel23. Sus niveles aumentan de forma significativa en CCE pobremente diferenciados, muy agresivos. Estudios posteriores revelaron que podoplanina promueve la migración/invasión celular y es capaz de inducir una transición epitelio-mesénquima en queratinocitos premalignos y otras células epiteliales24,25. Por lo que respecta a endoglina (CD105), la aplicación de un protocolo de carcinogénesis química con DMBA y TPA en la piel de ratones heterocigotos para esta proteína (Eng+/−) produjo un fenotipo singular: una reducción en el rendimiento global de tumores y una drástica aceleración de la progresión maligna hacia la formación de carcinomas indiferenciados26. Este fenotipo es similar al que obtuvo varios años antes el grupo de Rosemary Akhurst con ratones transgénicos que sobreexpresan TGF-β1 en la epidermis27. Los resultados obtenidos por este grupo se utilizaron como una prueba de concepto para establecer una doble función de TGF-β1 en la carcinogénesis: como supresor en las etapas tempranas del desarrollo tumoral y como promotor de la malignidad28. El fenotipo carcinogénico de ambos tipos de ratón: haploinsuficientes para endoglina y que sobreexpresan TGF-β1, es el mismo debido a que endoglina actúa atenuando la señalización de TGF-β1, tanto en queratinocitos como en otras células epiteliales29.
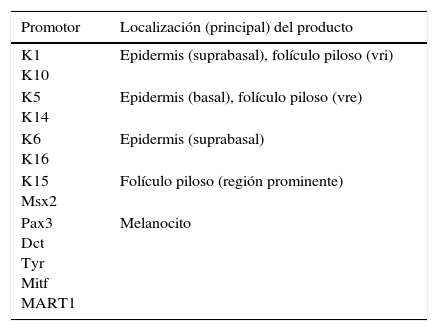
Modelos genéticos con ratones mutantes para la investigación dermatológicaCon el desarrollo de las modernas técnicas de manipulación genética, que condujeron a la generación de los ratones transgénicos y knockout30,31 surgieron los primeros modelos experimentales con ratones modificados genéticamente. Con ellos fue posible conseguir la expresión (o ausencia) de un gen determinado en prácticamente todos los tejidos del organismo. No obstante, pronto se hizo evidente la necesidad de restringir la modificación introducida en el embrión y dirigir la expresión del transgén a un tejido en particular, para prevenir posibles efectos inespecíficos y, en algunos casos, evitar la muerte del animal. La expresión restringida del gen exógeno en el animal se consiguió utilizando promotores genéticos específicos de tejido. En el caso de la epidermis los promotores más utilizados son los de genes que codifican las queratinas K14, K5, K1 o K10. También se han utilizado con éxito promotores de otros genes epidérmicos, tales como los de loricrina e involucrina, y promotores específicos de los melanocitos (tabla 1). El uso de estos promotores no está exento de problemas, ya que las queratinas epidérmicas se expresan también en otros epitelios estratificados y, además, sus promotores se activan durante la embriogénesis tan pronto como se forma la epidermis, lo que puede conducir a anomalías en el crecimiento del animal, e incluso causar su muerte, si la expresión del transgén no es tolerable. Estas dificultades se han intentado solventar mediante el uso de promotores inducibles, como el del gen que codifica la queratina K6 (tabla 1), normalmente inactivo en la epidermis, el cual se activa durante la cicatrización de heridas o mediante estímulos hiperproliferativos, tales como la depilación y la aplicación de TPA32,33. Otras estrategias han utilizado sistemas inducibles por tetraciclina (Tet-On y Tet-Off)34. Estos modelos han sido decisivos para demostrar la implicación de algunos oncogenes y genes supresores en el cáncer cutáneo y en procesos inflamatorios de la piel35.
Promotores de genes utilizados para dirigir la expresión de transgenes a la piel de ratones modificados genéticamente
| Promotor | Localización (principal) del producto |
|---|---|
| K1 K10 | Epidermis (suprabasal), folículo piloso (vri) |
| K5 K14 | Epidermis (basal), folículo piloso (vre) |
| K6 K16 | Epidermis (suprabasal) |
| K15 Msx2 | Folículo piloso (región prominente) |
| Pax3 Dct Tyr Mitf MART1 | Melanocito |
Dct: dopacromo tautomerasa; K: queratina; MART1: proteína melan; Mitf: factor de transcripción asociado a la microftalmia; Msx2: homóloga del homeobox 2; Pax3: paired box 3; Tyr: tirosinasa; vre: vaina radicular externa; vri: vaina radicular interna.
Adaptado de Schneider34.
Un análisis más preciso de la función de un gen se ha conseguido mediante su mutagénesis condicional con el sistema Cre-LoxP36. Esta tecnología permite la inactivación completa de un gen (lo que conduce a la pérdida constitutiva de la proteína correspondiente, knockout) o la sustitución de un gen por la misma secuencia génica con una mutación cuyo efecto in vivo se quiere analizar o, incluso, la sustitución de un gen por una secuencia no relacionada con este para ponerla bajo el control de sus elementos reguladores (knockin). Estos cambios tienen lugar en un tejido determinado y ocurren de una manera controlada en el tiempo. Al igual que en los modelos con ratones transgénicos, la utilización de los promotores de los genes de las queratinas K14 y K5 como secuencias reguladoras para dirigir la expresión de la recombinasa Cre a la epidermis es un procedimiento muy utilizado en la investigación dermatológica34. El cruce posterior de estas líneas transgénicas con una línea de ratón que contenga el gen de interés flanqueado por sitios loxP (floxed), los cuales son reconocidos por la enzima Cre, conduce a la escisión del gen y al ligamiento de los extremos cortados del ADN (o, dependiendo de la orientación de los sitios loxP, a la inversión de la secuencia) en las células que expresan la queratina correspondiente. El control temporal de la expresión de la recombinasa se consigue utilizando una proteína Cre fusionada a un dominio mutado al que se une un ligando del receptor de progesterona (PR) o, más frecuentemente, del receptor de estrógeno (ER). De esta manera, la Cre fusionada a ERT solo puede entrar en el núcleo en presencia del esteroide sintético tamoxifeno, pero no bajo la influencia de los esteroides endógenos. El sistema Cre-loxP se ha utilizado también con bastante éxito para identificar la progenie celular de una célula troncal o progenitora (lineage tracing)37. Con este propósito, la recombinasa Cre se dirige a un tipo celular determinado con la finalidad de activar la expresión de un gen testigo que conduzca al marcaje permanente de la célula progenitora y de todos sus descendientes. Los marcajes más utilizados son la proteína verde fluorescente (Green Fluorescent Protein [GFP]) o la β-galactosidasa. Esta estrategia ha hecho posible la identificación y el aislamiento de queratinocitos de distintas regiones del folículo piloso que presentan características de células madre6,10.
En el programa SkinModel-CM estamos desarrollando modelos con ratones knockout condicionales (inducibles) para las proteínas Dnmt1, endoglina y podoplanina, utilizando ratones K14.Cre-ERT2 y Krt1-15.CrePR1. En los primeros la recombinasa Cre se encuentra bajo el control del promotor de la queratina K14 y, por lo tanto, su expresión puede inducirse (por tamoxifeno) en los queratinocitos del estrato basal de la epidermis interfolicular y de la vaina radicular externa de los folículos pilosos, causando la pérdida del gen correspondiente en estas células. En los segundos, Cre está bajo el control de la queratina K15, y su expresión se induce (mediante un análogo sintético de progesterona) en queratinocitos de la región prominente del folículo piloso.
Si bien los modelos con ratones modificados genéticamente han aportado beneficios enormes a la investigación dermatológica básica y traslacional, incluso las manipulaciones genéticas más sofisticadas han fallado a la hora de reproducir fielmente muchas de las enfermedades cutáneas humanas. Esto se debe, en gran medida, a las diferencias anatómicas y funcionales que existen entre la piel humana y la del ratón. La epidermis humana está formada por 6-10 estratos de queratinocitos y es más gruesa que la del ratón (∼3 estratos). Por otra parte, la piel del ratón presenta un abundante pelaje y está densamente poblada de folículos pilosos: el folículo piloso desempeña un papel determinante en la fisiología cutánea del ratón, mientras que su función es menos aparente en la piel humana, salvo en determinadas regiones anatómicas. Estas diferencias se traducen, por ejemplo, en discrepancias en relación con los cambios genéticos implicados en la transformación neoplásica. Así, en el modelo de la carcinogénesis química de piel de ratón, la fuerza conductora de la carcinogénesis son las mutaciones en el oncogén H-Ras38, y el tipo de tumor predominante es el papiloma, una lesión exofítica que no se produce en la piel humana, salvo en presencia de algunos tipos de virus del papiloma. Por otro lado, en el cáncer cutáneo no melanoma humano, la frecuencia de mutaciones en oncogenes Ras es relativamente baja39. Otro ejemplo que marca la diferencia entre ratones y humanos es que, en el ratón, la reparación del daño producido en el ADN por la radiación solar, mediante el mecanismo conocido como escisión global de nucleótidos (G-NER), es menos relevante que en la piel humana, de ahí que para reproducir experimentalmente el síndrome del xeroderma pigmentoso en el ratón se requieran dosis de radiación ultravioleta (UV) extremadamente altas.
Modelos organotípicos. Bioingeniería de la pielComo se mencionaba más arriba, la piel se renueva de forma natural gracias a la existencia de las células madre. Es posible preservar in vitro este potencial regenerador utilizando equivalentes cutáneos tridimensionales (3D). Para ello se requiere, básicamente, un componente celular, que puede ser simple o complejo, dependiendo de la variedad de tipos celulares que se incorporen (el componente celular básico lo aportan los queratinocitos de la epidermis y los fibroblastos dérmicos) y una matriz/andamio que consiste, generalmente, en un biopolímero natural o sintético que sirve de sostén al conjunto celular y le confiere su estructura 3D.
El colágeno es el componente principal de la matriz extracelular dérmica y, por esa razón, el colágeno i, fácil de obtener, debería ser el componente idóneo para generar el andamiaje dérmico en los equivalentes cutáneos. No obstante, la utilización del colágeno en cultivos organotípicos está restringida a la fabricación de superficies pequeñas de piel alogénica para utilizarlas en algunas aplicaciones clínicas y experimentales. En el programa SkinModel-CM preferimos utilizar la fibrina. Algunos investigadores, miembros de este consorcio, comprobaron, en el año 1998 que la fibrina obtenida a partir del fibrinógeno de un crioprecipitado plasmático sirve de soporte para el crecimiento de fibroblastos humanos dérmicos y dota al cultivo de una estructura 3D40. En este mismo estudio se demostró que la fibrina (con fibroblastos embebidos en su seno) constituye un excelente sustrato para el cultivo de queratinocitos humanos, y podía sustituir a una base de células dérmicas irradiadas letalmente, que era el procedimiento utilizado habitualmente para el cultivo in vitro de células madre epidérmicas. Es muy probable que el éxito de la fibrina para los cultivos organotípicos de piel humana se deba a que esta proteína forma, junto con otras proteínas plasmáticas, la matriz temporal sobre la que las células de la piel proliferan y migran durante la cicatrización de heridas. La utilización de la fibrina (y otras mejoras de los sistemas existentes) nos ha permitido producir grandes áreas de piel humana bioingenierizada destinadas a la regeneración de la piel de pacientes con quemaduras extensas y profundas40,41. Mediante esta tecnología hemos creado también modelos de ratón con piel humanizada para el estudio de algunos tipos de enfermedades dermatológicas (véase más abajo).
Una característica importante de los cultivos organotípicos de piel en 3D es que permite la estratificación de la epidermis cuando el equivalente epidérmico, los queratinocitos, se exponen al aire (quedando el equivalente dérmico en contacto con el medio de cultivo). Seguramente la estrategia que consigue imitar, en los equivalentes cutáneos 3D, una estratificación de la epidermis más fiel a la que ocurre de forma natural en la piel humana sea utilizar como andamiaje dermis humana desvitalizada y libre de células repoblada con fibroblastos humanos vivos. No obstante, también se consigue una estratificación aceptable de la epidermis con las matrices de colágeno o fibrina. Los equivalentes cutáneos humanos en 3D pueden recapitular fenómenos patológicos, tales como la invasión tumoral o la formación de ampollas características de síndromes de fragilidad cutánea, como las epidermólisis ampollosas. También pueden reproducirse síndromes como el xeroderma pigmentoso. Las principales desventajas de los cultivos organotípicos son: su corta duración y la ausencia de gran parte de los componentes celulares mesenquimáticos presentes en la piel natural. Aunque la utilización del ácido hialurónico como un componente adicional de la matriz ha permitido prolongar la vida útil de los equivalentes cutáneos con matrices de fibrina42, los modelos in vitro de piel bioingenierizada no son los adecuados para estudios o ensayos terapéuticos de larga duración, que requieren un recambio celular continuo a expensas de ciclos de proliferación-diferenciación a partir de células madre o de progenitores epidérmicos tempranos. En estos casos es imprescindible recurrir a los modelos in vivo de ratón con piel humanizada.
Sistemas quiméricos de ratones inmunodeficientes con piel humanizada como modelos preclínicos de enfermedades cutáneasLos trasplantes en ratones inmunodeficientes de equivalentes cutáneos 3D generados con células de pacientes dermatológicos que han llevado a cabo investigadores del consorcio SkinModel-CM (así como los realizados por otros laboratorios) han permitido reproducir de forma duradera numerosas enfermedades cutáneas genéticas y adquiridas43 (tabla 2). Los modelos más sencillos son los que utilizan células derivadas de pacientes con enfermedades hereditarias monogénicas, tales como las epidermólisis ampollosas. Existe un grupo de enfermedades raras, como el síndrome de Gorlin y el xeroderma pigmentoso, cuyos defectos genéticos afectan a la función de células troncales epidérmicas y conducen a la formación acelerada de neoplasias cutáneas. Estas dolencias tienen una relevancia especial para nuestro programa, y su reconstrucción en modelos de ratón con piel humanizada va a ser utilizada para ensayar abordajes terapéuticos novedosos, como la terapia fotodinámica (véase más adelante).
Enfermedades modelizadas a partir de células de pacientes mediante ingeniería tisular cutánea y trasplante a ratones inmunodeficientes
| Enfermedad | Referencia |
|---|---|
| Epidermólisis ampollosa distrófica recesivaa | Gache et al.44 |
| Epidermólisis ampollosa juntural (laminina 332)a | Di Nunzio et al.45 |
| Paquionoquia congénita | García et al.46 |
| Síndrome de Nethertona | Di et al.47 |
| Xeroderma pigmentosoa | García et al.48 |
| Síndrome de Gorlin | García et al.43 |
| Ictiosis lamelar | Aufenvenne et al.49 |
| Disqueratosis congénita | NP |
| Melanoma familiar | NP |
| Psoriasis | Guerrero-Aspizua et al.50 |
NP: no publicado.
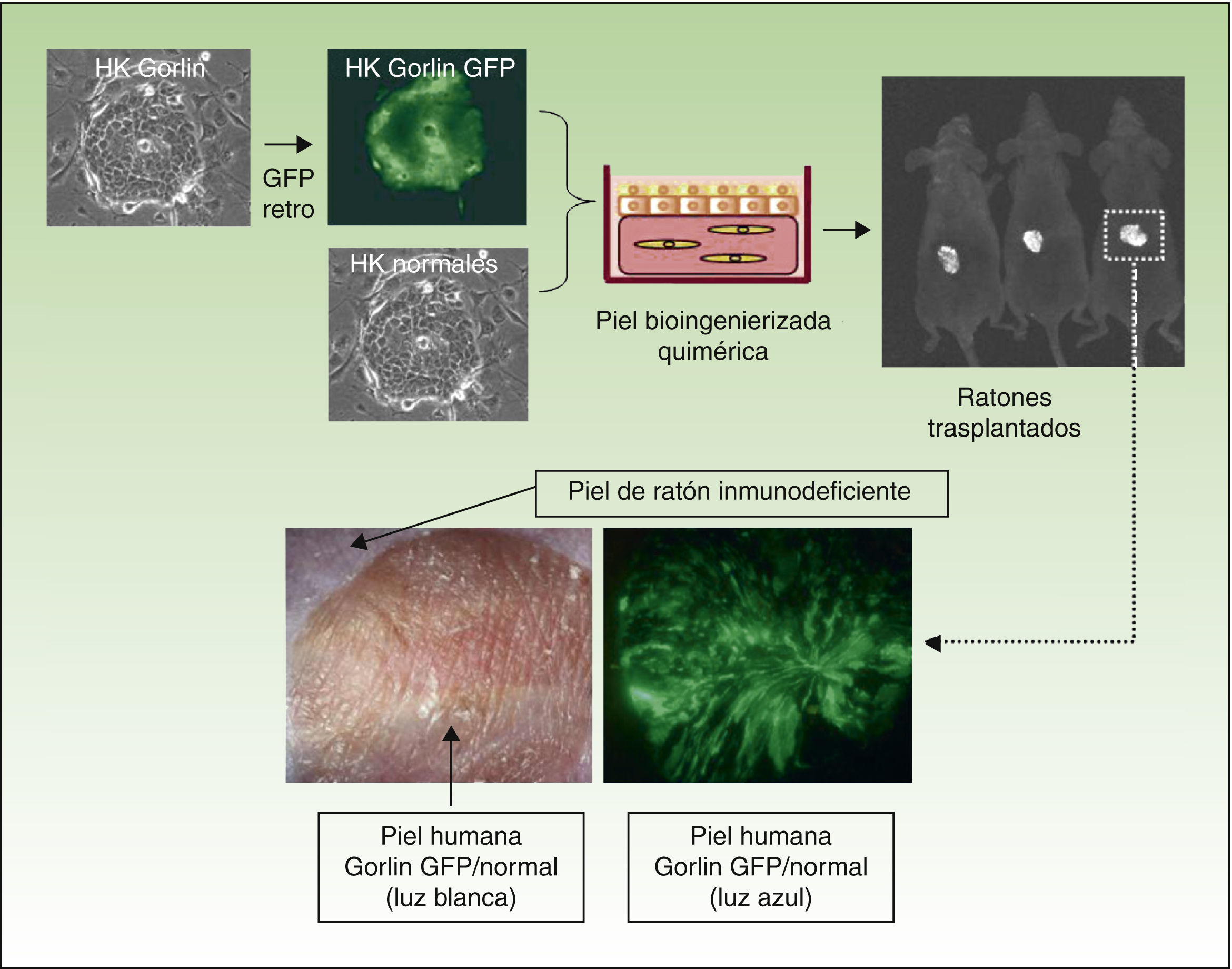
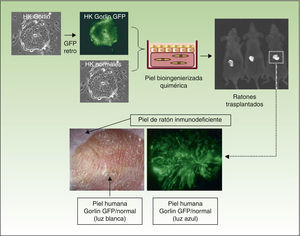
La versatilidad inherente a este sistema experimental permite regenerar piel humana quimérica, ya que los equivalentes celulares pueden introducirse «a la carta»; por ejemplo, combinaciones de queratinocitos provenientes de pacientes y de donantes sanos, queratinocitos provenientes de pacientes y fibroblastos de donantes sanos, etc. La figura 3 muestra la regeneración en ratones inmunodeficientes de una piel humana a partir de una combinación (1:1) de queratinocitos de un paciente con síndrome de Gorlin, que expresan GFP, y queratinocitos normales sin marcar. Estos modelos ofrecen la posibilidad de utilizar queratinocitos y/o fibroblastos humanos a los que previamente se les ha introducido una modificación genética. Esta estrategia ha permitido validar abordajes preclínicos de terapia génica ex vivo44,45,47 o conseguir la regeneración de la epidermis a partir de una única célula madre epidérmica51. El programa SkinModel-CM contempla, también, desarrollar estrategias de sobreexpresión y silenciamiento de los genes que codifican endoglina y podoplanina, para analizar sus efectos en la regeneración y arquitectura de la piel, así como en procesos neoplásicos y de cicatrización de heridas.
Regeneración de una piel quimérica en ratones inmunodeficientes. Queratinocitos humanos normales y de un paciente con síndrome de Gorlin (marcados con GFP mediante infección con un retrovirus) fueron ensamblados en equivalentes cutáneos bioingenierizados y trasplantados a ratones inmunodeficientes. La piel regenerada (paneles inferiores) muestra la presencia de zonas fluorescentes debidas a los queratinocitos Gorlin y no fluorescentes debidas a la regeneración de piel a expensas de los queratinocitos normales.
El sistema experimental de pieles humanas quiméricas regeneradas en ratones inmunodeficientes permite, además, evaluar la eficacia de nuevas terapias para lesiones cutáneas, tanto tumorales como no tumorales. Dentro de estos tratamientos el programa SkinModel-CM está especialmente interesado en la terapia fotodinámica (TFD), que en dermatología se emplea principalmente en queratosis actínicas y CCB superficiales, lesiones no melanóticas con una elevada incidencia en la población mundial52,53.
La TFD utiliza compuestos fotosensibilizadores (FS) exógenos, los cuales se acumulan preferentemente en las células tumorales. La posterior irradiación del tumor con luz visible de una longitud de onda adecuada, ocasiona la formación de especies reactivas de oxígeno (ROS), que producen la muerte selectiva de las células tumorales. Es decir, la destrucción del tejido tumoral viene ocasionada por la combinación de 3 elementos no tóxicos per se: el FS, la luz y el oxígeno54.
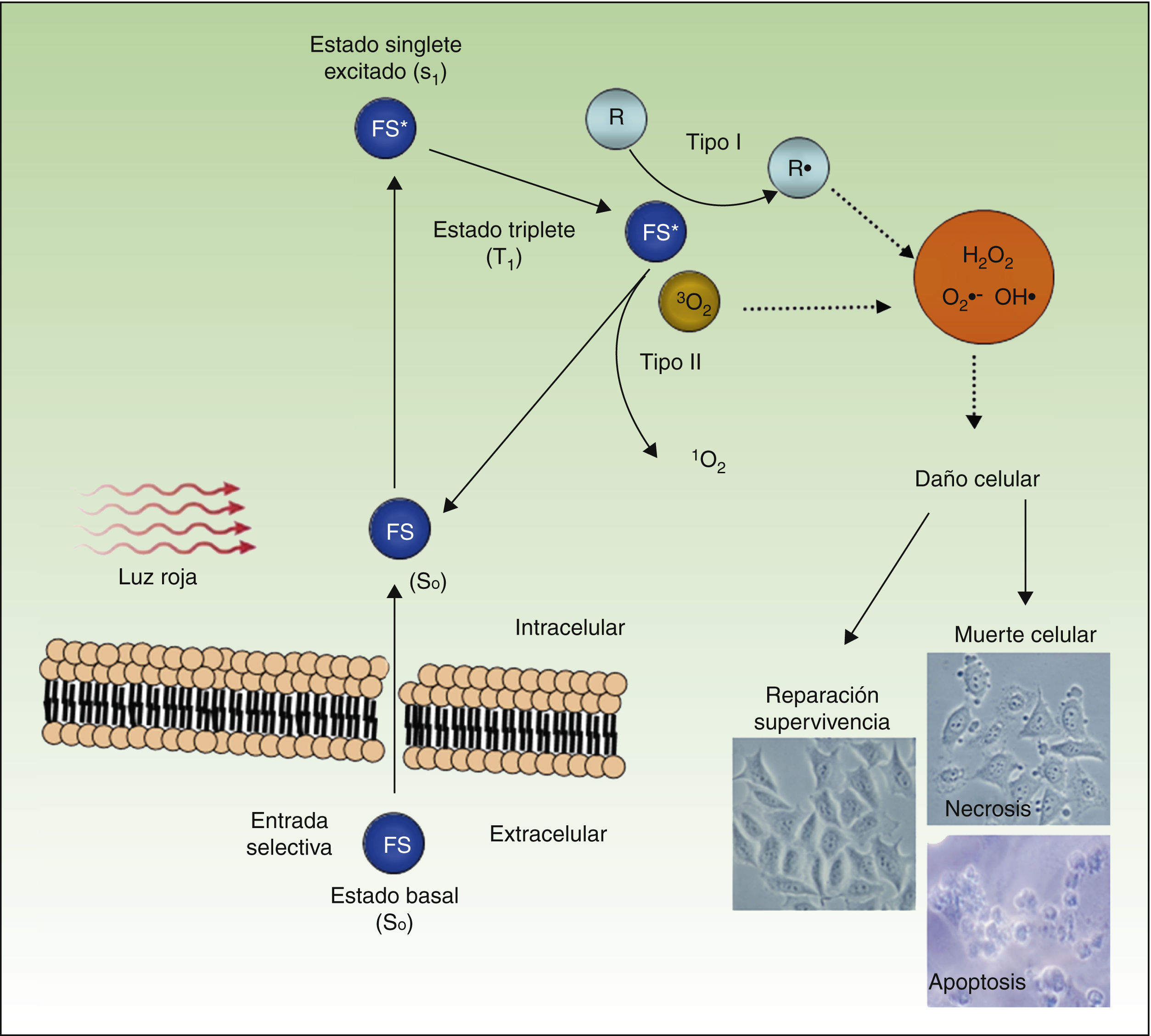
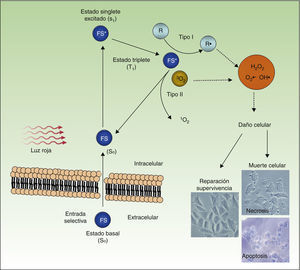
En la figura 4 se representa el mecanismo de acción de la TFD: el FS, en su estado fundamental S0, es excitado por la luz roja a un estado energético S1, que puede pasar al estado triplete T1. La transferencia de energía desde el estado excitado T1 al oxígeno molecular (O2) genera oxígeno singlete (1O2) (reacción fotoquímica de tipo ii). El FS en el estado T1 también puede transferir su carga a otras moléculas distintas de oxígeno (reacción fotoquímica de tipo i) formándose otras ROS, tales como el anión superóxido (•O2−), el radical hidroxilo (•OH) y el peróxido de hidrógeno (H2O2). La mayoría de los FS que se utilizan en TFD actúan mediante reacciones fotoquímicas de tipo ii y, por lo tanto, el responsable de la muerte celular es el oxígeno singlete 1O2.
Mecanismo de acción de la TFD. La TFD requiere la combinación de 3 elementos: el FS, la luz y el O2. El FS en su estado fundamental (So) absorbe luz y pasa a un estado excitado (S1), al cual sigue una transición al estado triplete (T1). La transferencia de energía al O2 a través de reacciones tipo i y ii genera ROS, que ocasiona estrés oxidativo y daño celular, el cual, si no es reparado, conduce a la muerte de la célula.
La TFD ocasiona la muerte de la célula tumoral por un efecto citotóxico directo, afectando a distintos orgánulos o estructuras celulares, tales como el núcleo, las mitocondrias, la membrana plasmática, los lisosomas y el citoesqueleto. También puede actuar indirectamente como consecuencia de la destrucción de la vasculatura del tumor55,56.
Los FS más utilizados son compuestos del grupo de las porfirinas, como el derivado de hematoporfirina que se ha utilizado para el tratamiento de tumores localizados en tejidos accesibles a la luz, las neoplasias de pulmón, vejiga, esófago y, especialmente, las cutáneas54. Otros nuevos FS aprobados para su uso en la clínica son: el derivado de la clorina temoporfina o precursores de FS como el ácido 5-aminolevulínico (ALA) y su derivado metilado (MAL)57–59. Estos 2 últimos son los más utilizados para el tratamiento de tumores cutáneos. El ALA es metabolizado en el interior de la célula para formar un intermediario de la síntesis del grupo hemo, protoporfirina ix (PpIX), el cual es un potente FS que absorbe la luz visible en la zona roja del espectro. ALA y MAL se han utilizado en el tratamiento de lesiones cutáneas benignas y malignas: queratosis actínicas, carcinoma in situ (o enfermedad de Bowen), CCB y CCE60. La TFD es especialmente recomendable para tratar lesiones extensas, como las que ocurren en pacientes inmunosuprimidos, los cuales son proclives a desarrollar tumores cutáneos. Otras lesiones como los queratoacantomas, las queilitis actínicas, los linfomas B y T, la enfermedad de Paget y los sarcomas de Kaposi también pueden beneficiarse de esta terapia.
El programa SkinModel-CM pretende generar modelos de enfermedades cutáneas preneoplásicas y neoplásicas que permitan evaluar la eficacia de la TFD; en particular, los modelos de Gorlin (para el tratamiento del CCB) y del XP (para el tratamiento del CCE). El marcaje con GFP de los queratinocitos Gorlin, en el modelo de ratón con piel humanizada presentado en la figura 3, va a permitir comparar macroscópicamente el efecto de la TFD sobre los queratinocitos transformados (fluorescentes) y los queratinocitos normales (no fluorescentes). De la misma manera, evaluaremos el efecto de la TFD en modelos de XP. Por último, el programa SkinModel-CM también contempla utilizar la TFD en procesos de regeneración cutánea. Experimentos in vitro con queratinocitos humanos inmortalizados mostraron que la TFD (utilizando ALA como FS), en condiciones en las que se induce una baja producción de ROS, promueve la proliferación celular, activando la expresión de ciclina D1 por un mecanismo dependiente de la quinasa Src61. Asimismo, la producción de bajos niveles de ROS en la piel de ratones in vivo tiene un potente efecto estimulador y movilizador de las células madre epidémicas residentes en la región prominente del folículo piloso, que se manifiesta, entre otros efectos, en una activación del ciclo de crecimiento del pelo y una aceleración en el proceso de regeneración de la epidermis tras una quemadura.
Conclusiones y perspectivasEl conocimiento de los mecanismos que controlan la homeostasis de la piel y la biología de las células madre epidérmicas ha experimentado un gran avance en las últimas décadas, gracias, en parte, al desarrollo de modelos in vivo con ratones utilizando las tecnologías transgénicas y knockout de manipulación genética. No obstante, extensas lagunas persisten aún y existe un gran número de preguntas que no encuentran una respuesta satisfactoria. Por ejemplo: ¿tras la división de una célula madre, qué señales determinan el que una o las 2 células hijas permanezcan en el estado indiferenciado?, ¿por qué en la epidermis y sus anejos existen tantas subpoblaciones celulares con características de células madre?, ¿qué mecanismos promueven la diferenciación de los queratinocitos del estrato basal de la epidermis al estrato espinoso?
Uno de los problemas capitales que enfrenta la investigación clínica dermatológica es la reproducción de enfermedades cutáneas humanas con modelos celulares y animales susceptibles a la manipulación experimental y al ensayo de nuevos abordajes terapéuticos. En este sentido, los modelos de injerto de piel humana bioingenierizada en ratones inmunodeprimidos han proporcionado una plataforma robusta para el estudio de un amplio número de enfermedades cutáneas, incluidos algunos tipos de cáncer. Sin embargo, el esfuerzo de los investigadores para desarrollar equivalentes cutáneos que imiten con mayor fidelidad la complejidad de la piel humana debe continuar. El programa SkinModel-CM pretende contribuir a este futuro esperanzador de la investigación dermatológica analizando nuevos mecanismos y proteínas potencialmente implicadas en la activación y movilización de las células madre epidérmicas, desarrollando nuevos modelos in vivo, con ratones modificados genéticamente y ratones con la piel humanizada, para investigar la implicación de estas proteínas en la homeostasis y enfermedad cutáneas, y para reproducir algunos procesos patológicos cutáneos y ensayar nuevas pautas de tratamiento con terapia fotodinámica.
FinanciaciónEl consorcio SkinModel-CM está financiado por la Comunidad de Madrid (programa S2010/BMD-2359).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos agradecer calurosamente el trabajo realizado por los miembros y colaboradores de nuestros laboratorios, que con su trabajo de cada día han hecho posible que el programa SkinModel sea una realidad.