La citoquina IL-31 es una neurocitoquina que estimula las neuronas sensoriales relacionadas con el picor, contribuye a la inflamación, la disfunción y remodelación de la barrera epidérmica. Al interrelacionar los sistemas inmunológico y nervioso constituye un factor clave en el tratamiento de dermatitis atópica y del prurigo nodular. Nemolizumab es un anticuerpo monoclonal humanizado que bloquea la subunidad α del receptor de la IL-31 y modula la respuesta neuroinmunitaria, bloquea directamente la señalización del prurito y alivia rápidamente el prurito, controlando la inflamación y reduciendo la gravedad del eccema en dermatitis atópica y las lesiones pruriginosas del prurigo nodular al restaurar la función epitelial y promover la integridad de la barrera cutánea.
Este artículo resume la nueva información relacionada con las funciones de la IL-31 y presenta la evidencia y resultados disponibles hasta el momento de los ensayos clínicos de nemolizumab en dermatitis atópica y prurigo nodular.
Interleukin 31 (IL-31) is a neurocytokine that stimulates sensory neurons involved in pruritus. It contributes to skin barrier inflammation, dysfunction, and remodeling. As the immune and nervous systems are interrelated, IL-31 has a key role in the treatment of atopic dermatitis and prurigo nodularis. Nemolizumab is a humanized monoclonal antibody that blocks the α subunit of the IL-31 receptor, modulates the neuroimmune response, and rapidly alleviates itching by directly blocking signaling. It reduces inflammation and lesion severity in atopic dermatitis and prurigo nodularis by restoring epithelial function and promoting skin barrier integrity.
This review synthesizes the latest information on the functions of IL-31 and presents the current evidence, including clinical trial results, on the use of nemolizumab in the treatment of atopic dermatitis and prurigo nodularis.
La dermatitis atópica (DA) es una enfermedad inflamatoria crónica heterogénea en su presentación y donde una deficiente función barrera dérmica, disbiosis cutánea y una respuesta inmunológica anormal generan lesiones eczematosas intensamente pruriginosas y que ocasiona un ciclo de rascado-picor-inflamación-alteración epitelial (RPIA) que dificulta la resolución de la patología1–3. Del mismo modo, el prurigo nodular (PN) comparte con la DA la aparición de lesiones escoriadas aisladas y altamente pruriginosas (de número y diámetro variable) que involucra, a través de un proceso inflamatorio, una sensibilización de las neuronas que procesan el picor y el desarrollo de ciclo de RPIA que empeora la patología4,5.
Un nexo común en estos trastornos es la citoquina IL-31. Se definió la IL-31 como una «citoquina pruritogénica» debido a sus altos niveles tisulares y séricos en pacientes con enfermedades pruriginosas y alérgicas, y a un potencial vínculo entre los sistemas inmunológico y neuronal para inducir el prurito; pero los efectos de la IL-31 no se limitan a la inducción de prurito, sino que tienen un amplio espectro incidiendo en la estimulación directa de las neuronas sensoriales relacionadas con el picor, actuando como una citoquina proinflamatoria, inmunomoduladora y con efecto directo sobre una remodelación alterada del tejido epitelial (ciclo RPIA)6–12.
Por ello, la IL-31 se ha convertido en un objetivo clínico clave para la farmacoterapia biológica como es el caso de nemolizumab que es un anticuerpo monoclonal humanizado que bloquea el receptor α de la IL-31 (IL-31RA) y evitando así la actividad biológica de la IL-31 e interrumpiendo el ciclo RPIA clave en estos trastornos13.
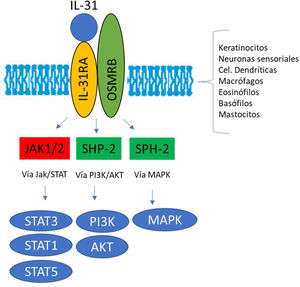
La IL-31 y el complejo IL-31RLa IL-31 fue descrita por primera vez por Dillon et al. en 2004. Se observó que los ratones que sobreexpresaban IL-31 desarrollaban prurito grave, alopecia y lesiones cutáneas. La IL-31 es una tetra-helicoidal de cadena corta perteneciente a la familia de citoquinas IL-6. A esta familia pertenecen entre otras el factor inhibidor de la leucemia, oncostatina M (OSM), cardiotropina-1, IL-6 y IL-11. Estas citoquinas participan en el crecimiento neuronal, en el metabolismo óseo, en el desarrollo cardíaco y en la regulación inmunitaria, así como en la diferenciación de células T.
La IL-31 es secretada mayoritariamente por linfocitos células T de memoria CD4+CLA+de tipo Th26,14,15 y también por otros tipos celulares como macrófagos, mastocitos, monocitos, células dendríticas, eosinófilos y basófilos6.
El receptor IL-31R es un complejo heterodimérico formado por el receptor α IL-31R y por el receptor β de la oncostatina M (OSMR), mientras que el resto de miembros de la familia de citoquinas IL-6 tienen en común la cadena de glucoproteína 130 (gp130). La IL-31 se une a la subunidad α del IL-31R, pero no a la subunidad OSMR en el complejo IL-31R. Sin embargo, tras acoplarse, OSMR convierte a IL-31R en un receptor de alta afinidad y aumenta la unión de IL-317,11,16. La unión de la IL-31 a este receptor da como resultado la fosforilación y la activación de una triple cascada intracelular: a) las Janus Kinasa 1 y 2 (JAK1/JAK2) junto a sus transductores de señal y activadores de la transcripción 1, 3 y 5 (STAT1, STAT3 y STAT5) (en mayor medida 3 que 1 y 5), b) la vía de la proteinquinasa B (PI3K/AKT) y c) la vía de proteinquinasa activada por mitógenos (MAPK)7,9,13,16(fig. 1). Una amplia variedad de células epiteliales, neuronales e inmunes como son queratinocitos, fibroblastos, células dendríticas, mastocitos, macrófagos, basófilos, eosinófilos y neuronas periféricas y de los ganglios de la raíz dorsal (GRD), expresan este receptor IL-31R por lo que su activación producirá efectos directos e indirectos sobre el picor, la inflamación y la alteración de la barrera cutánea entre otros16–20.
La IL-31 y el prurito cutáneoLa sensación de prurito en la piel viene mediada por fibras nerviosas de pequeño tamaño, como las fibras-C, originadas en las neuronas de los GRD y, que se transmiten a la médula espinal, al hipotálamo y finalmente al cerebro (los nervios periféricos no expresan receptor IL-31R). Existen múltiples agentes pruritógenos aparte de la IL-31, como la IL-13, la IL-4, la histamina, la catepsina S y la cloroquina entre otros11,21,22. Las neuronas GRD expresan el receptor IL-4Rα para la IL-4 e IL-13 que son también citoquinas pruriginosas y que incrementan el potencial de acción evocado de la histamina y de la IL-31 participando en la formación del picor23.
El picor inducido por la vía de la histamina (histamina/HIR) o de la cloroquina (cloroquina/MrgprA3) por ejemplo, requieren del polipéptido natriurético b (PPNB), del péptido liberador de la gastrina (PLG) y sus receptores para transmitir la señal de prurito por la médula espinal. Por el contrario, el picor inducido por IL-31 precisa de la neuroquinina B (NQB) en lugar del PPNB para liberar PLG. Tal vez por ello, el picor inducido con IL-31 no se atenúa significativamente con antihistamínicos, dexametasona o tacrolimus11,24,25.
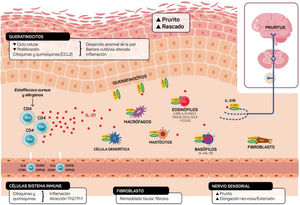
Además de mediar en la sensación de prurito, la IL-31 también estimula la elongación y la ramificación de las pequeñas neuronas GRD. Esta elongación es dependiente de la activación de STAT3 e independiente del receptor de potencial transitorio V1 (TRPV1)11,26. Ello sugiere que la IL-31 puede promover sensibilidad a estímulos mínimos como el picor mantenido y contribuir a la hipersensibilidad característica de la DA11,26 (fig. 2).
Ilustración esquemática del papel de la IL-31 en la piel. IL-31 es producida principalmente por las células Th2. Su receptor es un heterodímero de la IL-31RA y OSMRB expresado en múltiples células, incluyendo células inmunológicas, queratinocitos y neuronas periféricas. El ciclo del rascado-picor-inflamación-alteración epitelial (RPIA) ocurre durante la inflamación de la piel atópica.
Los queratinocitos de la piel expresan en abundancia los receptores de la IL-31RA y OSMR16. En ellos la IL-31 reduce el ciclo y la diferenciación celular junto a la expresión de proteínas barrera como la filagrina, involucrina y citoqueratina 10, lo que altera la función barrera cutánea y, a su vez, incrementa la expresión de IL-1α, IL-20 y IL-24 que contribuye también a la alteración de la formación de la barrera cutánea y permite la penetración de alérgenos e irritantes.
Por otro lado, la IL-31 potencia la inflamación induciendo la expresión de varias quimioquinas en queratinocitos que son atrayentes de linfocitos de memoria Th2 como CCL17/TARC y CCL22/MDC, además de CCL19/MIP-3β, CCL23/MIP-3, CCL4/MIP-1β (fig. 2).
El receptor IL-31R está expresado en monocitos, macrófagos, células dendríticas, eosinófilos, mastocitos y basófilos y su activación provoca diferentes efectos. En los basófilos la estimulación por IL-31 provoca que se secreten grandes cantidades de IL-4 e IL-13 en lugar de histamina. Esto es relevante ya que la IL-4 provoca la diferenciación de células T en Th2 (potentes secretoras de IL-31) y podría actuar como señal activadora en las inflamaciones cutáneas tipo 2. En eosinófilos y células dendríticas induce la secreción de un set de citoquinas proinflamatorias y quimioquinas (TNF-α, IL1β, IL-6, CXCL1, CXCL8, CCL2, CCL5 y CCL22) incrementada en presencia de queratinocitos pero no fibroblastos6,10,27. A través de estas moléculas, la IL-31 puede atraer a la zona inflamada a neutrófilos (CXCL1, CXCL8), células dendríticas (CCL2), Th1 (CCL5) y Th2 (CCL2) o promover angiogénesis, inflamación (CXCL1, CXCL8) y/o modelación del tejido (CCL2, IL-6). Otras citoquinas (TNF-α, IL1β, IL-6) pueden afectar a las funciones de las células T, células B y células dendríticas, así como activar otras células epiteliales a su alrededor. Varias células inmunes a su vez producen IL-31: Los eosinófilos pueden liberar también IL-13, e incrementar dicha liberación en presencia de citoquinas Th2, así como los mastocitos, basófilos, macrófagos, monocitos y células dendríticas6,28,29. De esta forma la inflamación por IL-31 puede amplificarse por varios de estos bucles en células del sistema inmune6. El remodelado tisular se produce como consecuencia de episodios de inflamación crónica asociados a respuesta Th2. En la dermatitis atópica las lesiones liquenificadas han estado sometidas a remodelado tisular. La expresión de IL-31RA se encuentra aumentada en fibroblastos de tejido fibrótico así como los niveles de IL-31 en plasma de pacientes con fibrosis30. La IL-31 afecta la expresión génica de mecanismos de proliferación e inducción de colágeno de tipo y fibroblastos cutáneos. Por esta razón el bloqueo de Il-31 puede ser beneficiosa en estas situaciones.
Visto en conjunto, la IL-31 se muestra como un regulador clave entre sistema inmunitario, el sistema nervioso y la piel (fig. 2).
Existen varias moléculas en diversas fases de investigación que tienen como diana la IL-31. Paradójicamente en veterinaria ya se dispone en la práctica clínica de Lokivetmab, anticuerpo monoclonal caninizado dirigido a bloquear la IL-31 y aprobado para el tratamiento del prurito asociado a la dermatitis alérgica y al tratamiento de las manifestaciones clínicas de la dermatitis atópica en perros31.
Por lo que respecta a investigación en humanos se dispone de información de tres moléculas BMS-981164, vixarelimab y el objeto de la presente revisión nemolizumab. BMS-981164 es un anticuerpo discontinuado cuyo ensayo clínico en Fase I (NCT01614756) finalizó en una etapa temprana y no se han publicado los resultados. Vixarelimab (KPL-716) es un anticuerpo anti-OSMR actualmente en investigación y que ha demostrado en un ensayo clínico fase IA/ IB una mejoría del EASI y en las escalas de prurito comparado con placebo32.
La inhibición de la IL-31 en DA y prurigo nodular: nemolizumabEl picor es el síntoma más perjudicial en la DA y el PN, causa que los pacientes se rasquen persistentemente y entren en el ciclo de RPIA. Esto tiene como consecuencia directa alteraciones del sueño, de la calidad de vida (CDV) así como de su desempeño diario2–5. De esta forma, en los pacientes con PN y DA moderada o grave el objetivo terapéutico primario debe ser el bienestar a través del control del prurito, la mejora de la dermatitis (reduciendo la inflamación y restaurando la función barrera cutánea) así como la mejora objetiva del sueño y de la CDV como resultado final.
Nemolizumab es un anticuerpo monoclonal humanizado que al administrarse por vía subcutánea se une a la subunidad α del receptor de la IL-31 y bloquea la activación del receptor celular. En la actualidad ya se dispone de varias evidencias clínicas publicadas33–39 con resultados relevantes (tabla 1).
Resumen de los EECC del anti-IL-31R nemolizumab. Fases 1 y 2 y 3 en DA y PN
| IndicaciónAutor | Diseño | Crit. inclusión Tratamiento/control, n | Objetivo | Resultados | Tolerabilidad |
|---|---|---|---|---|---|
| Dermatitis atópicamoderada a graveNemoto O et al.33 | Fase1 Escalado de dosis. (0,003-3 mg/kg).Fase1b0,3/1/3 mg/kgÚnica inyección vs. PL | Mal control con tto. tópico previo, BSA≥5%, EVA Prurito≥5 e IGA≥327 NE /9 PL | SeguridadTolerabilidadEficacia(EVA prurito, eficiencia en sueño y uso hidrocortisona) | Buen perfil de seguridad.Reducción significativa del prurito (-50% aprox.) con NE, vs. PL (-20% aprox.) a la semana 4;Incremento calidad del sueño (+80% aprox.) NE vs. PL (+50% aprox.);Reducción significativa uso hidrocortisona con NE | Buen perfil de seguridad con solo una dosis |
| Dermatitis atópicamoderada a graveRuzicka T et al.34 | Fase 20,1/0,5/2 mg/kg c4s y2 mg/kg c8s vs. PL12 semanas seguimiento | Mal control con tto. tópico previo, EASI≥10, EVA PruritoS≥5 e IGA≥3216 NE/53 PL | Eficacia EVA pruritoEASI, SCORAD, IGA, BSA, PVRS, SD-VAS, reducción uso CT | Reducción significativa del prurito del -43,7% con 0,1 mg/kg, -59,8% con 0,5 mg/kg y -63,1% con 2 mg/kg c4s, y del -20,9% con placebo, en la semana 12.Significativa mejora con NE en el resto de parámetros | Tolerabilidad similar a placebo. La exacerbación de la DA y el edema periférico es más frecuente con NE. |
| Dermatitis atópicamoderada a graveKabashima K et al.35 | Fase 20,1/0,5/2 mg/kg c4s y2 mg/kg c8s vs. PL52 semanas seguimiento (estudio extensión de 43) | Mal control con tto. tópico previo, EASI≥10, EVA Prurito S≥5 e IGA≥3131 NE/37 PL | Eficacia EVA pruritoEASI, SCORAD, IGA, BSA, PVRS, SD-VAS, reducción uso CT | Reducción significativa del prurito del -73% con 0,1 mg/kg, -89,6% con 0,5 mg/kg y -74,7% con 2 mg/kg c4s y del -79 con 2 mg/kg c8s, en la semana 64. La reducción en el prurito se incrementó con el tiempo de tratamiento desde las 14 a las 64 semanas.Se mantuvo o incrementó la mejora con NE en el resto de los parámetros a las 64 semanas. Mejora de EASI75 en más del 65% de los pacientes con 0,1/0,5/2 mg/kg c4s y del EASI75 en 2 mg/kg c8s a las 64 semanas. | Tolerabilidad mantenida a largo plazo. La exacerbación de la DA, nasofaringitis, IRTS, incremento CK, el edema periférico y la reacción local por inyección fueron los más frecuente con NE |
| Dermatitis atópicamoderada a graveSilverberg M et al.36 | Fase 2b10/30/90mg c4s vs. PL(con esteroides tópicos)24 semanas seguimiento | Mal control con tto. tópico previo, EASI≥12, PPNRS≥7, IGA=3-4 y BSA≥10%169 NE /37 PL | Eficacia EASIIGA, PPNRS BSA, SCORAD, Sleep disturbance NRS, DLQI, EQ5D, HADS, reducción uso CT | Mejora significativa del EASI. Dosis de 30mg la más efectiva (-66,8% NE vs. 43,1% PL; p<0,01 a 16 semanas) (-68,8% NE vs. 52% PL; p=0,016 a 24 semanas) con diferencias significativas desde semana 8 (p≤0,01). A las 16 semanas consigue EASI50 en 59,6% vs. 36,8% (30mg NE vs. PL; p=0,016) y EASI75 en 45,6% vs. 26,3% (30mg NE vs. PL; p=0,014). A las 24 semanas consigue EASI50 en 66,7% vs. 43,9% (30mg NE vs. PL; p=0,014) y EASI75 en 45,6% vs. 26,3% (30mg NE vs. PL; p=0,014).Reducción significativa del prurito del -67,3% con NE 30mg y esteroide tópico, y del -35,8% con placebo y esteroide tópico, en la semana 24; con diferencias desde la semana 1 (p<0,01).Mejora del IGA, PPNRS, Sleep Sisturbance NRS, DLQI, EQ5D y HADS. NE redujo el uso de CT en un 30-40% vs. PL. | Perfil seguridad y tolerabilidad similar a placebo. Los AE relacionados con el tratamiento fueron nasofaringitis e IRTS. |
| Dermatitis atópicamoderada a graveMihara R et al.37 | ExploratorioBasado en pacientes del ensayo clínico Fase 2 34,35 | Mal control con tto. tópico previo, EASI≥10, EVA Prurito≥5 e IGA≥3 | Mejora productividad y actividadAnálisis exploratorio WPAI-AD | Mejora significativa de la productividad laboral y reducción del deterioro de la actividad, en la semana 64. Las mejoras vs. PL se observan ya desde la semana 4 y se mantienen desde la semana 12 hasta la 64. La mejora en el WPA-ADI se correlaciona fuertemente con la mejora del prurito y calidad del sueño (PVRS, SD-VAS) | No se valoraba |
| Dermatitis atópicamoderada a graveKabashima K et al.38 | Fase 360mg vs. PL (con esteroides tópicos)16 semanas seguimiento | IPR score≥3, EVA Prurito≥5, EASI≥10143 NE /72 PL | Eficacia EVA pruritoEVA prurito diario (hasta semana 4), EASI, ISI, DLQI, NRS, POEM, WPAI-AD | Reducción significativa del prurito del -42,8% con NE 60mg y esteroides tópicos vs. -21.42% con PL y esteroides tópicos; p<0,001 a 16 semanas. Reducción del EASI -49% vs. 33,2%; DLQI 40% vs. 21%, ISI 55% vs. 21; NE y PL respectivamente a las 16 semanas. Cambio significativo en la EVA prurito con NE desde el día 2. | Tolerabilidad similar a placebo. Incremento CK y la reacción local por inyección fueron más frecuentes con NE |
| Prurigo nodularmoderado a graveStänder S et al.39 | Fase 20,5 mg/kg c4s vs. PL12 semanas seguimiento | Fase 2PPNRS≥7; más de 20 nódulos.34 NE/36 PL | EFICACIA PPNRS (medio y máximo) a la semana 4, PVRS, 7-Ítem prurigo Score, IGA, DLQI | Reducción significativa del prurito del -53% con NE 0,5 mg/kg, y del -20,2% con PL, en la semana 4; p<0,001. Un 24% vs. 11% de pacientes (con un 75% lesiones curadas) y 29% de pacientes con prurigo nulo o casi vs. 0% en NE vs. PL en la semana 4 | Tolerabilidad similar a placebo. Mayores síntomas digestivos (dolor abdominal y diarrea) y musculoesqueléticos |
BSA: Body Surface Area Affected; CT: corticoides tópicos; DLQI: Dermatology Life Quality Index; EASI: Eczema Area and Severity Index; EQ5D: EuroQoL 5-Dimension; HADS: Hospital Anxiety and Depression Scale; IGA: Investigator Global Assessment; IPR: Inadequate Pruritic Response score; ISI: Insomnia Severity Index NE: nemolizumab; PL: placebo; POEM: patient-oriented eczema measure; PPNRS: Daily Peak Pruritus Numeric Rating Scale; PVRS: Pruritus verbal rating scale; SCORAD: Scoring Atopic Dermatitis; SD-VAS: Sleep-Disturbance Visual Analogue score; WPAI-AD: Work Productivity and Activity Impairment-Atopic Dermatitis.
En el primer estudio en humanos con dosis única en fase 1/1b, nemolizumab mostró una buena tolerabilidad y una reducción significativa del prurito de alrededor del 50% en la semana 433. En este estudio, que constó de tres fases, se estudiaron dosis de 0,003mg a 3mg por kg, en pacientes adultos sanos, para: a) realizar el escalado de dosis y valorar la seguridad y tolerabilidad (primera fase), de 0,3mg, 1mg y 3mg por kg de peso en paciente sano vs. placebo, b) para valorar seguridad y tolerabilidad de las dosis escogidas (segunda fase) y c) una tercera fase a la que se sumaba el análisis de eficacia de esas mismas dosis en pacientes adultos con DA frente a placebo. En esta fase, a la reducción del prurito se sumó una mejora significativa en la calidad del sueño (alrededor del 80%) y una reducción significativa en el uso de hidrocortisona tópica frente a placebo33.
Un estudio fase 2 valoró la eficacia y seguridad de nemolizumab, a dosis de 0,1, 0,5 y 2mg por kg cada 4 semanas (c4s) así como una dosis exploratoria de 2mg kg cada 8 semanas (c8s), tanto a corto plazo (12 semanas)34 vs. placebo como a largo plazo (extensión de 52 semanas y 64 semanas en total)35. A las 12 semanas se observó una reducción significativa del prurito de aproximadamente un 60% (-43,7% con 0,1mg/kg, -59,8% con 0,5mg/kg y -63,1% con 2mg/kg c4s, y del -20,9% con placebo; p<0,05) que se incrementó hasta aproximadamente un 80% a las 64 semanas (-73% con 0,1mg/kg, -89,6% con 0,5mg/kg y -74,7% con 2mg/kg c4s y del -79% con 2mg/kg c8s). Un rápido descenso en la escala visual analógica (EVA) del picor se observó ya desde la primera semana de administración (desde el tercer día las gráficas se separan claramente con un descenso promedio de las 3 dosis de un 20% vs. 5% con placebo). El porcentaje de cambio medio desde el inicio en EASI, SCORAD, BSA afectada, alteraciones del sueño e IGA mantuvo en incremento los valores registrados desde las 12 hasta las 64 semanas. Alcanzaron una EASI75 a las 64 semanas aproximadamente el 70% de los pacientes con nemolizumab (68%, 68%, 66% con 0,1, 0,5, 2mg/kg c4s respectivamente y un 74% con 2mg/kg c8s). Esta mejora se correspondió con una reducción en el uso de corticoides tópicos (CT) proporcional a la dosis administrada35.
Para facilitar la práctica clínica se estudió una única dosis base independiente del peso. Un modelo de simulación sobre el análisis farmacocinético y farmacodinámico (PK/PD), respaldaba el uso de una dosis única mensual de entre 25 y 50mg c4s para pacientes por debajo de 110 y 135kg. La escala analógica visual de prurito simulado apoyó utilizar esta optimización de dosis durante las siguientes fases del programa de desarrollo clínico de nemolizumab40.
Un ensayo clínico fase 2b analizó la efectividad y seguridad de 10, 30 y 90mg de nemolizumab administrados c4s vs. placebo ambos añadidos a CT durante 24 semanas de seguimiento36. Se observó una mejora significativa del EASI en todas las dosis, siendo la de 30mg la más efectiva. Nemolizumab 30mg c4s redujo el EASI a las 16 semanas en -66,8% vs. 43,1% y a las 24 semanas en -68,8% vs. 52% (p=0,016 y p<0,01 para nemolizumab y placebo respectivamente). Se registraron reducciones significativas en el EASI desde la semana 8 (p≤0,01). A las 16 semanas se consiguió el objetivo del EASI50 en el 59,6% vs. 36,8% de los pacientes (nemolizumab vs. placebo; p=0,016) y del EASI75 en el 45,6% vs. 26,3% de los pacientes (nemolizumab vs. placebo; p=0,014). A las 24 semanas alcanzaron un EASI50 el 66,7% vs. 43,9% (vs. placebo; p=0,014) y un EASI75 el 45,6% vs. 26,3% (vs. placebo; p=0,014) de los pacientes. Respecto al picor, nemolizumab presentó una reducción del prurito del -67,3% vs. -35,8% con placebo en la semana 24 evidenciando diferencias significativas vs. placebo ya desde la semana 1 de administración (p<0,01). El IGA, PPNRSR, Sleep Disturbance NRS, DLQI, EQ5D y HADS mejoraron y se redujo el uso de CT en un 30-40% vs. placebo36. La dosis de 30mg está actualmente bajo evaluación en varios ensayos pivotales de fase 3. Los resultados de estos estudios aportarán información sustancial sobre la dosificación clínica de nemolizumab.
Se ha publicado un ensayo fase 3 realizado con la dosis de 60mg c4s vs. placebo, ambos con CT (lo más parecida a la práctica clínica real) y un seguimiento de 16 semanas. La reducción del prurito mediante EVA fue el objetivo principal. A las 16 semanas se redujo significativamente el prurito del -42,8% vs. -21,42% (nemolizumab vs. placebo; p<0,001) y también el EASI (-49% vs. -33,2%), DLQI (40% vs. 21%) e ISI (55% vs. 21%). Se registró diariamente el prurito durante la semana 1 lo que permitió detectar diferencias significativas en la EVA media desde el día 2 tras la inyección de nemolizumab.
Se ha publicado un metaanálisis de la eficacia y seguridad de nemolizumab en DA41. Nemolizumab produjo mejoras significativas en la eficacia y seguridad en varios índices clínicos de la DA y una disminución significativa del EASI en comparación con placebo y una reducción significativa de la puntuación SCORAD en el grupo de nemolizumab vs. placebo. En el grupo de nemolizumab, la EVA para prurito fue de -3,95 (IC del 95%: -5,56 a -2,37; p <0,001). Se mostró una disminución significativa en la puntuación media de la BSA en nemolizumab en comparación con el control (DE=-0,19; IC del 95%=-0,35 a -0,03; p=0,019), en EASI (DME=-0,31; IC del 95%=-0,45 a -0,17; p=<0,001) y en la IGA (RR, 0,81; IC del 95%=-0,65 a -1,01; p=0,064)41.
La evidencia recoge la elevada eficacia de nemolizumab en el alivio del prurito33–38,39, así como su rapidez de acción desde la primera inyección, llegando tener diferencias desde el segundo día tras la inyección38, lo que se traslada a una rápida mejora en el EASI (significativa desde la semana 836). Un reciente estudio cuantificó la velocidad a la que los fármacos sistémicos para la DA reducen el prurito42. Se calculó el valor TIMEACLIR-Itch para representar el tiempo hasta una reducción significativa del picor. Nemolizumab alcanzó el TIMEACLIR-Itch más rápidamente que los agentes biológicos dirigidos a IL-4 o a IL-4/13 y con una rapidez comparable a los inhibidores de moléculas pequeñas (JAK), demostrando el papel que tiene la IL-31 en la generación de prurito y el papel que desempeñan los inhibidores de JAK en la mejora del prurito42.
Estos datos parecen aclarar el papel clave de la IL-31 como causante de picor, inflamación y alteración de la barrera cutánea y remodelado de la piel. Nemolizumab rompe el ciclo de rascado-picor-inflamación-alteración cutánea (RPIA) y su rapidez de acción sobre el picor se traduce rápidamente en mejora de la calidad del sueño, mejora de la dermatitis (EASI y SCORAD) y mejora de la CDV (DLQI). Este rápido alivio del picor y de la calidad del sueño se correlacionó con una mejora en la productividad en el trabajo y reducción de las limitaciones en la actividad37. Los pacientes del estudio de fase 234,35 respondieron al cuestionario Work Productivity an Activity Impairment-Atopic Dermatitis (WPAI-AD). Nemolizumab mejoró la productividad y la actividad significativamente ya desde la semana 4 y se mantuvo hasta la 64. La mejora del WPA-ADI se correlacionó directamente con la magnitud de la reducción del prurito y mejora de la calidad del sueño37. La gravedad de la DA o los valores de CDV influyen en el WPAI-AD pero en menor medida, y recalcan que el control rápido del prurito y de la calidad del sueño deben ser el primer objetivo en el control de este tipo de pacientes.
Nemolizumab ha sido estudiado en PN moderado y grave en un estudio fase 2 de 12 semanas de duración a una dosis de 0,5mg/kg c4s vs. placebo39. La variable principal fue el cambio porcentual, desde el inicio, en la puntuación máxima promedio para el prurito en la escala de calificación numérica en la semana 4. Los resultados secundarios incluyeron medidas adicionales de picor y gravedad de la enfermedad hasta las 12 semanas. La puntuación inicial de prurito fue de 8,4 en cada grupo. En la semana 4, el prurito se redujo en -4,5 puntos (-53,0%) vs. -1,7 puntos (-20,2%) con nemolizumab vs. placebo; P <0,001 (el cambio en el prurito a favor de nemolizumab se manifestó ya desde el segundo día tras la inyección, -10,3% vs. -4,4%). Un 29% de los pacientes con nemolizumab declaró presentar picor nulo o casi nulo vs. ninguno de ellos en el grupo placebo. Respecto a las lesiones del PN, el 24% de los pacientes presentó un 75% de las lesiones curadas con nemolizumab vs. 11% de pacientes con placebo. La calidad del sueño valorado por el NRS Sleep Quality mejoró ya desde la primera semana (-23,4% vs. -5,1%) y se amplió a las 4 semanas (-56,4% vs. –26,6) con nemolizumab vs. placebo. A las 12 semanas no cambiaron los valores de prurito respecto a la semana 4, nemolizumab presentó una mayor reducción en el número medio de lesiones (-12,6 vs. -6,1) y se observó una mejora en la CDV medida por DLQI frente a placebo (59% vs. 31% de los pacientes presentaron un cambio clínico importante mínimo de 4 puntos).
Nemolizumab. Tolerabilidad y seguridadLa tolerabilidad y seguridad de nemolizumab ha sido evaluada en los estudios y en el metaanálisis antes mencionado. En general, nemolizumab presentó una buena seguridad y una tolerabilidad comparable a placebo en los estudios de DA a corto plazo (12, 16 o 24 semanas)33,34,36,38 que se mantuvo a largo plazo (64 semanas)35.
De entre los efectos secundarios relacionados con el tratamiento se encontraron el empeoramiento de la DA y el edema periférico (el empeoramiento de la DA no se correlacionó con la eficacia en la reducción del prurito y los mecanismos subyacententes no están claros), alteraciones de la creatin quinasa (CK), infecciones no dermatológicas (nasofaringitis, infección del tracto respiratorio superior y gastroenteritis), y la reacción local por la inyección (la aparición de reacción local por inyección se redujo con el uso continuado del producto)35.
En el estudio de PN39, nemolizumab mostró un perfil de seguridad y tolerabilidad similar a placebo. Los efectos adversos relacionados con el tratamiento fueron la nasofaringitis y la infección del tracto respiratorio superior, síntomas digestivos (dolor abdominal y diarrea), así como musculoesqueléticos (artralgias, dolor de espalda, fibromialgia y dolor en la mandíbula).
ConclusionesLa citoquina IL-31 es un regulador clave de múltiples mecanismos de las enfermedades inflamatorias crónicas de la piel como la DA y el NP. Con su papel clave en la estimulación directa de las neuronas sensoriales relacionadas con el prurito y contribuyendo a la inflamación y a la alteración de la barrera cutánea remodelado, la IL-31 es una citoquina que comunica la respuesta del sistema inmunitario de la piel con el nervioso.
Por su mecanismo de acción, nemolizumab, modula la respuesta neuroinmunitaria, bloqueando directamente la señalización del prurito y aliviando rápidamente el picor sensorial, controlando la inflamación y reduciendo la gravedad del eccema en DA y de las lesiones pruriginosas del PN al restaurar la función epitelial y promover la integridad de la barrera cutánea.
En los ensayos clínicos nemolizumab demuestra significativamente que bloquear la IL-31 conlleva una mayor reducción del prurito vs. placebo durante un período de hasta 64 semanas en pacientes con DA moderada o grave que no habían tenido una respuesta adecuada a los fármacos tópicos y antihistamínicos, así como mejoras en las variables típicas de valoración de estos trastornos como EASI, SCORAD, DLQI e IGA.
Nemolizumab se presenta como una nueva alternativa que brindará a los dermatólogos el control de la enfermedad que necesitan para transformar los días y las noches de los pacientes con DA y PN.
FinanciaciónLa redacción de la revisión ha contado con el soporte de una beca de investigación de laboratorios Galderma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.