La morfea postradioterapia es una entidad poco frecuente descrita mayoritariamente en mujeres con cáncer de mama. El uso creciente de la radioterapia en el tratamiento del cáncer de mama, así como la similitud clínica de la morfea con otros cuadros tales como la radiodermitis, la fibrosis postradiación o la recidiva tumoral, obligan al dermatólogo al conocimiento de esta entidad. Presentamos una serie de 6 mujeres, con una media de edad de 64,2 años y un tiempo medio de latencia entre la radioterapia y la morfea de 9,5 años. Cuatro de las 6pacientes presentaban algún trastorno de base autoinmune (artritis reumatoide, síndrome de Sjögren, vitíligo y enfermedad de Crohn) entre sus antecedentes. Hasta el momento actual no se han encontrado factores de riesgo que predispongan al desarrollo de morfea tras el tratamiento con radioterapia, si bien parece que presentar algún trastorno de base autoinmune puede condicionar la aparición de morfea en pacientes tratados con radioterapia.
Postirradiation morphea is an uncommon entity that has been mostly described in women with breast cancer. The increasing use of radiotherapy to treat breast cancer and the clinical similarities between morphea and other conditions, such as radiodermatitis, postirradiation fibrosis, and tumor recurrence, highlights the need for dermatologists to be familiar with this entity. We present a series of 6 women with a mean age of 64.2 years and a mean latency of 9.5 years between radiotherapy for breast cancer and onset of morphea. Four of the patients had a history of autoimmune disease: rheumatoid arthritis, Sjögren syndrome, vitiligo, and Crohn disease. No specific risk factors for postirradiation morphea have been identified to date, although it would appear that a history of autoimmune disease could be associated with an increased risk of morphea in patients treated with radiation therapy.
La morfea postradioterapia (MPR), también conocida como morfea radioinducida, es una rara complicación de la radioterapia. Descrita por primera vez en 1989, existen alrededor de 70 casos publicados, la mayoría de ellos en mujeres con cáncer de mama tratadas con radioterapia1.
La MPR se manifiesta inicialmente como una placa eritematosa y edematosa que aparece en la zona radiada, e incluso en áreas adyacentes. Posteriormente se observa una tendencia hacia la fibrosis, caracterizada por la induración y retracción de la piel afectada, la cual adquiere un tinte violáceo en la periferia, dejando áreas centrales blanquecinas con pérdida de anejos2.
Se estima que la incidencia de la MPR es de 2 casos por cada 1.000 mujeres con cáncer de mama tratadas con radioterapia3. Este dato contrasta con la incidencia de 2,7 casos de morfea por cada 100.000 en la población general4.
El creciente uso de radioterapia asociada a cirugía conservadora en el tratamiento del cáncer de mama2, así como la similitud clínica de la MPR con otros cuadros clínicos tales como la radiodermitis, la fibrosis o la paniculitis postradiación, o la recidiva tumoral, obligan al conocimiento de esta entidad poco conocida y probablemente infradiagnosticada5.
Describimos una serie de 6 casos de MPR en pacientes con cáncer de mama, 4 de ellas con enfermedad autoinmune asociada.
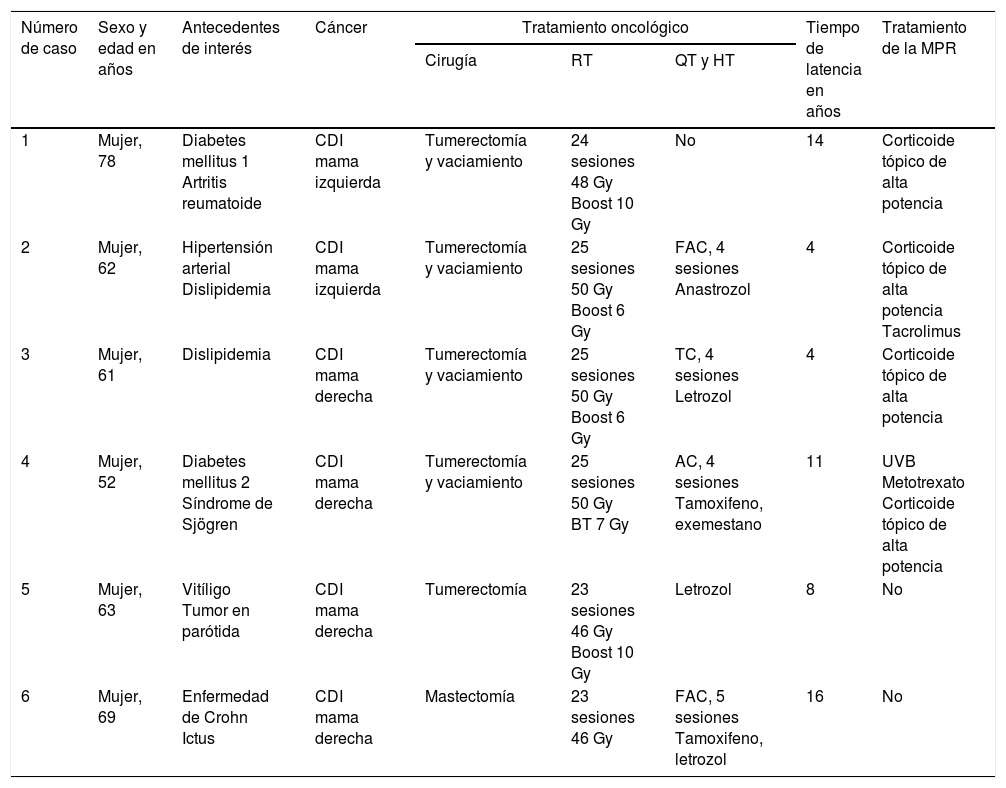
Casos clínicosSe revisaron los casos de MPR remitidos al Servicio de Dermatología de nuestro hospital entre los años 2013 y 2016: se encontró un total de 6 pacientes con dicha entidad. Todos correspondieron a mujeres con cáncer de mama diagnosticadas y tratadas entre los años 2000 y 2015. Los datos referentes a la edad, antecedentes personales, tipo de cáncer y tratamiento oncológico recibido por las pacientes, así como el tiempo transcurrido entre la radioterapia y la aparición de la MPR, se muestran en la tabla 1. La media de edad fue de 64,2 años, y el tiempo medio de latencia entre la radioterapia y la morfea fue de 9,5 años. Cuatro pacientes presentaban antecedentes personales previos de enfermedades autoinmunes.
Antecedentes de interés y tiempo de latencia entre radioterapia y aparición de MPR en nuestra serie
| Número de caso | Sexo y edad en años | Antecedentes de interés | Cáncer | Tratamiento oncológico | Tiempo de latencia en años | Tratamiento de la MPR | ||
|---|---|---|---|---|---|---|---|---|
| Cirugía | RT | QT y HT | ||||||
| 1 | Mujer, 78 | Diabetes mellitus 1 Artritis reumatoide | CDI mama izquierda | Tumerectomía y vaciamiento | 24 sesiones 48 Gy Boost 10 Gy | No | 14 | Corticoide tópico de alta potencia |
| 2 | Mujer, 62 | Hipertensión arterial Dislipidemia | CDI mama izquierda | Tumerectomía y vaciamiento | 25 sesiones 50 Gy Boost 6 Gy | FAC, 4 sesiones Anastrozol | 4 | Corticoide tópico de alta potencia Tacrolimus |
| 3 | Mujer, 61 | Dislipidemia | CDI mama derecha | Tumerectomía y vaciamiento | 25 sesiones 50 Gy Boost 6 Gy | TC, 4 sesiones Letrozol | 4 | Corticoide tópico de alta potencia |
| 4 | Mujer, 52 | Diabetes mellitus 2 Síndrome de Sjögren | CDI mama derecha | Tumerectomía y vaciamiento | 25 sesiones 50 Gy BT 7 Gy | AC, 4 sesiones Tamoxifeno, exemestano | 11 | UVB Metotrexato Corticoide tópico de alta potencia |
| 5 | Mujer, 63 | Vitíligo Tumor en parótida | CDI mama derecha | Tumerectomía | 23 sesiones 46 Gy Boost 10 Gy | Letrozol | 8 | No |
| 6 | Mujer, 69 | Enfermedad de Crohn Ictus | CDI mama derecha | Mastectomía | 23 sesiones 46 Gy | FAC, 5 sesiones Tamoxifeno, letrozol | 16 | No |
AC: adriamicina+ciclofosfamida; BT: braquiterapia; CDI: carcinoma ductal infiltrante; FAC: fluorouracilo+adriamicina+ciclofosfamida; Gy: gray; HT: hormonoterapia; MPR: morfea postradioterapia; QT: quimioterapia; RT: radioterapia; TC: docetaxel+ciclofosamida; UVB: ultravioleta B.
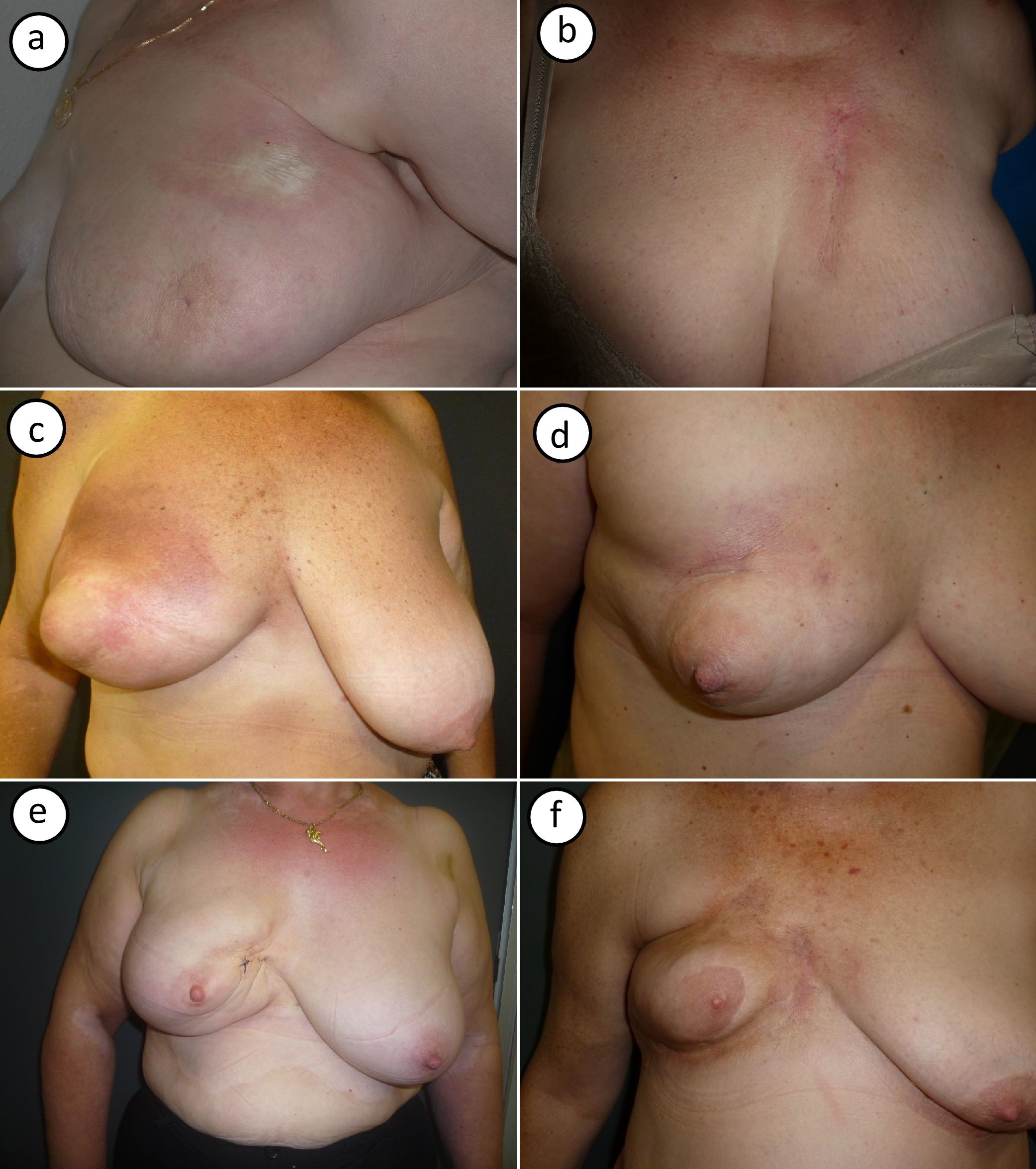
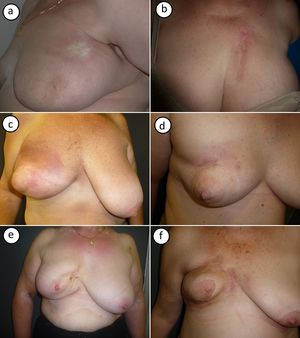
Las imágenes clínicas de los casos recogidos se muestran agrupadas en la figura 1. La MPR se presentó en su forma típica como placas de color marfil y borde violáceo (fig. 1 a) o como una placa indurada a la palpación con signos de radiodermitis en superficie (fig. 1 b). En otros 2 casos se observó en su fase inicial inflamatoria, con eritema e induración generalizada de la mama (fig. 1 c y d). Las formas más tardías presentaron retracción mamaria con hiperpigmentación postinflamatoria (fig. 1 e y f).
Imagen clínica de los casos de morfea postradioterapia. a) Caso número 1: morfea localizada en parte superior de la mama, cerca de la axila. Placa redondeada indurada, de superficie lisa y color marfil con borde violáceo. b) Caso número 2: morfea localizada en parte superior de la mama. Placa muy indurada sobre zona de radiodermitis. c y d) Los casos números 3 y 4 muestran una morfea en fase inflamatoria que afecta toda la mama. Inflamación con eritema e induración generalizada de la mama, respetando la zona del pezón. e y f) Los casos 5 y 6 muestran una morfea en una fase más residual. Importante retracción mamaria e hiperpigmentación postinflamatoria.
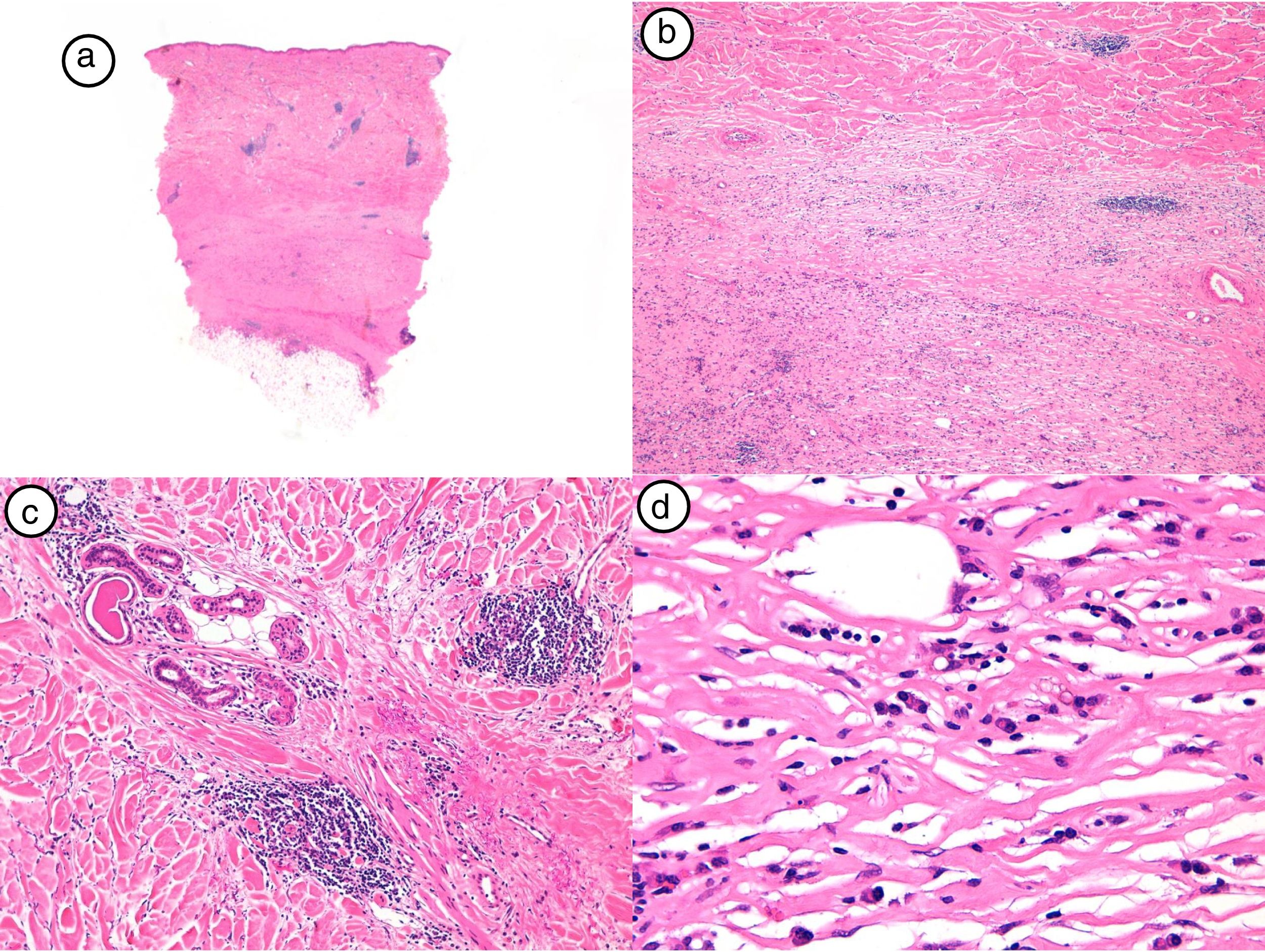
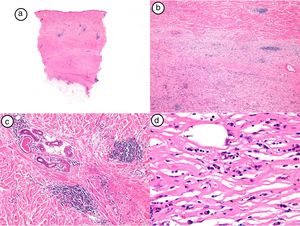
El diagnóstico de MPR fue confirmado con biopsia cutánea y estudio anatomopatológico, que mostró un infiltrado inflamatorio de predominio linfocitario y de distribución perianexial y perivascular en las lesiones más inflamatorias, junto con un engrosamiento dérmico a costa del depósito de haces anchos de colágeno. En las lesiones más evolucionadas se observó la ausencia de anejos. La epidermis se encontraba respetada o ligeramente adelgazada. La figura 2 muestra los hallazgos histológicos típicos de la MPR en su fase inicial inflamatoria.
Hallazgos histológicos de la biopsia del caso número 4. a) Imagen panorámica con una dermis muy engrosada y poco tejido celular subcutáneo (HE, x4). b) Detalle del engrosamiento de los haces de colágeno (HE, x40). c) Detalle del infiltrado inflamatorio perianexial (HE, x40). d) Células plasmáticas y linfocitos como componentes fundamentales del infiltrado inflamatorio (HE, x40).
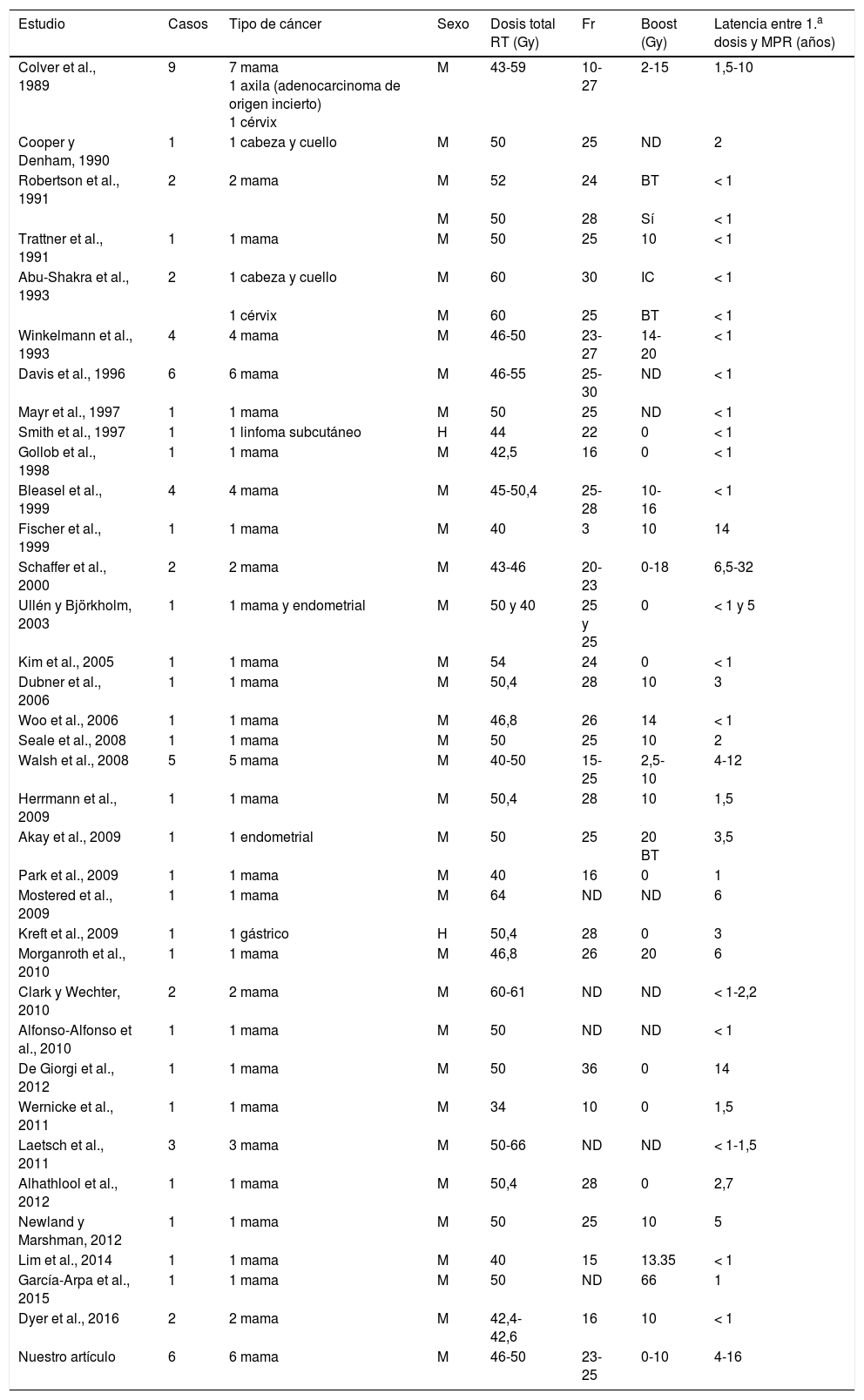
La MPR fue inicialmente descrita por Colver et al. en 1989, en una serie de 9 mujeres, 7 de las cuales habían recibido radioterapia como parte del tratamiento del cáncer de mama que padecían6. Desde entonces se han publicado casos aislados de MPR que se encuentran agrupados, junto a nuestra serie clínica, en la tabla 2. La mayor parte de los casos corresponden a mujeres que recibieron radioterapia como tratamiento adyuvante de su cáncer de mama.
Reporte de casos de morfea postradioterapia publicados desde 1989
| Estudio | Casos | Tipo de cáncer | Sexo | Dosis total RT (Gy) | Fr | Boost (Gy) | Latencia entre 1.a dosis y MPR (años) |
|---|---|---|---|---|---|---|---|
| Colver et al., 1989 | 9 | 7 mama 1 axila (adenocarcinoma de origen incierto) 1 cérvix | M | 43-59 | 10-27 | 2-15 | 1,5-10 |
| Cooper y Denham, 1990 | 1 | 1 cabeza y cuello | M | 50 | 25 | ND | 2 |
| Robertson et al., 1991 | 2 | 2 mama | M | 52 | 24 | BT | < 1 |
| M | 50 | 28 | Sí | < 1 | |||
| Trattner et al., 1991 | 1 | 1 mama | M | 50 | 25 | 10 | < 1 |
| Abu-Shakra et al., 1993 | 2 | 1 cabeza y cuello | M | 60 | 30 | IC | < 1 |
| 1 cérvix | M | 60 | 25 | BT | < 1 | ||
| Winkelmann et al., 1993 | 4 | 4 mama | M | 46-50 | 23-27 | 14-20 | < 1 |
| Davis et al., 1996 | 6 | 6 mama | M | 46-55 | 25-30 | ND | < 1 |
| Mayr et al., 1997 | 1 | 1 mama | M | 50 | 25 | ND | < 1 |
| Smith et al., 1997 | 1 | 1 linfoma subcutáneo | H | 44 | 22 | 0 | < 1 |
| Gollob et al., 1998 | 1 | 1 mama | M | 42,5 | 16 | 0 | < 1 |
| Bleasel et al., 1999 | 4 | 4 mama | M | 45-50,4 | 25-28 | 10-16 | < 1 |
| Fischer et al., 1999 | 1 | 1 mama | M | 40 | 3 | 10 | 14 |
| Schaffer et al., 2000 | 2 | 2 mama | M | 43-46 | 20-23 | 0-18 | 6,5-32 |
| Ullén y Björkholm, 2003 | 1 | 1 mama y endometrial | M | 50 y 40 | 25 y 25 | 0 | < 1 y 5 |
| Kim et al., 2005 | 1 | 1 mama | M | 54 | 24 | 0 | < 1 |
| Dubner et al., 2006 | 1 | 1 mama | M | 50,4 | 28 | 10 | 3 |
| Woo et al., 2006 | 1 | 1 mama | M | 46,8 | 26 | 14 | < 1 |
| Seale et al., 2008 | 1 | 1 mama | M | 50 | 25 | 10 | 2 |
| Walsh et al., 2008 | 5 | 5 mama | M | 40-50 | 15-25 | 2,5-10 | 4-12 |
| Herrmann et al., 2009 | 1 | 1 mama | M | 50,4 | 28 | 10 | 1,5 |
| Akay et al., 2009 | 1 | 1 endometrial | M | 50 | 25 | 20 BT | 3,5 |
| Park et al., 2009 | 1 | 1 mama | M | 40 | 16 | 0 | 1 |
| Mostered et al., 2009 | 1 | 1 mama | M | 64 | ND | ND | 6 |
| Kreft et al., 2009 | 1 | 1 gástrico | H | 50,4 | 28 | 0 | 3 |
| Morganroth et al., 2010 | 1 | 1 mama | M | 46,8 | 26 | 20 | 6 |
| Clark y Wechter, 2010 | 2 | 2 mama | M | 60-61 | ND | ND | < 1-2,2 |
| Alfonso-Alfonso et al., 2010 | 1 | 1 mama | M | 50 | ND | ND | < 1 |
| De Giorgi et al., 2012 | 1 | 1 mama | M | 50 | 36 | 0 | 14 |
| Wernicke et al., 2011 | 1 | 1 mama | M | 34 | 10 | 0 | 1,5 |
| Laetsch et al., 2011 | 3 | 3 mama | M | 50-66 | ND | ND | < 1-1,5 |
| Alhathlool et al., 2012 | 1 | 1 mama | M | 50,4 | 28 | 0 | 2,7 |
| Newland y Marshman, 2012 | 1 | 1 mama | M | 50 | 25 | 10 | 5 |
| Lim et al., 2014 | 1 | 1 mama | M | 40 | 15 | 13.35 | < 1 |
| García-Arpa et al., 2015 | 1 | 1 mama | M | 50 | ND | 66 | 1 |
| Dyer et al., 2016 | 2 | 2 mama | M | 42,4-42,6 | 16 | 10 | < 1 |
| Nuestro artículo | 6 | 6 mama | M | 46-50 | 23-25 | 0-10 | 4-16 |
El intervalo de tiempo entre el tratamiento con radioterapia y la aparición de la morfea va desde pocos meses hasta varios años tras su finalización: han sido publicados casos de MPR con un periodo de latencia de hasta 32 años. Sin embargo, la mayoría de los casos de MPR descritos en la literatura tienen lugar durante el primer año tras el tratamiento con radioterapia7. Por el contrario, en nuestro estudio, el tiempo medio de latencia fue de 9,5 años, con un rango de entre 4 y 16 años. La hipótesis más aceptada para explicar este periodo de latencia señala que los neoantígenos inducidos por la radioterapia pasan desapercibidos para el sistema inmune hasta que se dé un fenómeno de reactividad cruzada, tras una infección, por ejemplo, y el sistema inmune sea capaz de reconocer entonces estos nuevos antígenos en la piel7.
Varios estudios publicados hasta la fecha han buscado la posible existencia de algún factor de riesgo que predisponga al desarrollo de MPR. Sin embargo, ni la dosis total alcanzada, ni la dosificación ni el número total de sesiones parecen estar relacionados con el riesgo de desarrollarla3,8. Tampoco la edad o las reacciones cutáneas agudas durante la radioterapia parecen ser factores de riesgo para el desarrollo de MPR8,9.
No obstante, hemos encontrado que 4 de las 6 pacientes de nuestra serie presentaban en sus antecedentes alguna enfermedad de base autoinmune. Correspondieron a casos de artritis reumatoide, síndrome de Sjögren, vitíligo y enfermedad de Crohn. En 2011 Laetsch et al. presentaron una paciente con antecedentes de liquen escleroso y atrófico cutáneo-vulvar y alopecia areata, que desarrollo una lesión compatible con MPR. Estos autores señalan por primera vez la posibilidad de que los enfermos con enfermedades autoinmunes tengan mayor riesgo de desarrollar trastornos del tejido conectivo tras la radioterapia10. Otros trabajos también han descrito casos de morfea radioinducida en individuos con antecedentes de morfea y psoriasis11 y síndrome CREST12. Sin embargo, la mayoría de los casos publicados hasta la fecha no hacen referencia a los antecedentes personales de los pacientes con MPR.
Por otro lado, parece que los pacientes con enfermedades del tejido conectivo tienen mayor riesgo de presentar complicaciones derivadas del uso de la radioterapia. En 1991, Varga et al. presentaron 4 casos de esclerosis sistémica que desarrollaron fibrosis grave en áreas de irradiación, con compromiso cutáneo y visceral, 3 de los cuales fallecieron por complicaciones derivadas de dicha fibrosis13. Lin et al. describieron que los pacientes con enfermedades del tejido conectivo tenían mayor riesgo de toxicidad tardía por radioterapia que el resto de la población general. La incidencia fue especialmente significativa en aquellos con lupus eritematoso sistémico y con esclerodermia, con tasas de toxicidad tardía grave por radioterapia del 35,3% y del 10%, respectivamente, frente a controles (4,8% y 3,9%, respectivamente)14.
Así mismo, la radioterapia puede desencadenar o exacerbar enfermedades del tejido conectivo: se han descrito casos de paniculitis esclerosante, penfigoide ampolloso, pénfigo vulgar, dermatomiositis y lupus eritematoso sistémico inducidos por la radioterapia10. Por todo ello, sería recomendable realizar una historia reumatológica a los pacientes que vayan a ser tratados con radioterapia, dado el aparente mayor riesgo de exacerbación de las enfermedades de tejido conectivo y de complicaciones derivado del uso de la radioterapia15.
Respecto del tratamiento de la MPR, los estudios publicados al respecto arrojan resultados dispares: han sido utilizados corticoides tópicos, intralesionales y orales, inhibidores de la calcineurina, fototerapia e inmunosupresores. Sin embargo, el uso de dichos tratamientos en la MPR no siempre es satisfactorio, con buena respuesta en algunos casos, pero con refractariedad al tratamiento en otros1.
Como conclusión, la MPR es una entidad poco frecuente con una incidencia que probablemente vaya en aumento en los próximos años. Presentamos la segunda mayor serie sobre MPR publicada hasta la fecha, en la que destaca la alta proporción de pacientes con enfermedades autoinmunes entre sus antecedentes personales previos. Son necesarios más estudios que valoren si esta condición es un factor de riesgo para la aparición de morfea tras la radioterapia, principalmente en pacientes con cáncer de mama, o si existen otros factores de riesgo todavía no descritos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.