La microscopia confocal ex vivo es un sistema de procesamiento de tejidos que permite el análisis histológico inmediato de tejidos extirpados por medio de láseres diodo con distintos espectros de longitud de onda. En estudios previos la microscopia confocal ex vivo reduce el tiempo de análisis de márgenes de forma muy notable, con una sensibilidad y especificidad respecto a la histopatología del 88% y 99%, respectivamente. Recientemente se ha desarrollado una nueva tecnología que es capaz de proveer imágenes digitales con mayor velocidad y mejor resolución que las obtenidas en los dispositivos previos. Mediante el método de fusión (láseres de fluorescencia y reflectancia que escanean simultáneamente), se reproduce con una tinción digital la hematoxilina y eosina de forma inmediata en cada imagen. La implementación de esta nueva tecnología ha abierto definitivamente una puerta en el diagnóstico inmediato de tejidos.
The ex vivo confocal microscope is an imaging system designed to analyze freshly excised tissue using two diode lasers with different wavelengths. The technique can dramatically reduce margin analysis times and offers a sensitivity of 88% and a specificity of 89% relative to histopathology. A new technology has recently been developed that produces images more quickly and with a higher resolution than before. By means of a fusion mode that combines simultaneously scanned fluorescence and reflectance images, it produces digitally stained images that simulate the effect of hematoxylin-eosin staining. Application of this new technology has opened the door to real-time tissue diagnostics.
La microscopia confocal es una técnica de imagen que permite la visualización de tejidos en tiempo real tanto de manera in vivo (MCiv) como ex vivo (MCev). Esta técnica se fundamenta en la utilización de luz láser que, pasando por un sistema de lentes, refleja la imagen microscópica de la lesión de manera inmediata en un monitor adyacente por medio de un software y permite el diagnóstico de lesiones con resolución celular de 0,5 a 1,0μm.
Existen diferencias básicas entre las técnicas de MCiv y MCev. La primera es una técnica no invasiva en la que los tejidos se visualizan en un plano horizontal con una sola fuente de luz láser diodo de 830nm de longitud de onda. Este plano de visualización proporciona cortes horizontales paralelos a la superficie cutánea con un máximo de penetración de 250μm en profundidad.
Las imágenes se obtienen debido a contrastes naturales de moléculas como la melanina o la queratina que refractan intrínsecamente. La MCiv puede ser empleada para facilitar el diagnóstico de lesiones sospechosas, para seleccionar la mejor localización para la obtención de tejido mediante biopsia, o para la delimitación preoperatoria de márgenes quirúrgicos en lesiones de bordes mal delimitados (p.ej., lentigo maligno)1–3.
Para la realización de MCev es necesaria la exéresis y escaneo de la lesión. El tejido extirpado puede ser observado tanto en un plano horizontal, como en el caso de la MCiv, como en un plano vertical, lo que permite la correlación con su correspondiente lámina histopatológica. Los equipos actuales de MCev emplean dos fuentes de luz láser con longitudes de onda distintas, 488nm y 785nm, correspondientes a luz láser de fluorescencia y de reflectancia respectivamente.
En un primer estudio de MCev de 2001, Rajadhyaksha et al. con la dirección médica de Gónzalez4 describieron las primeras imágenes obtenidas a partir de carcinomas basocelulares extirpados mediante cirugía micrográfica de Mohs. En este mismo estudio se menciona por primera vez la necesidad de realizar alguna técnica de tinción para obtener imágenes con mejor calidad, empleando entonces ácido acético al 10% como método para destacar la presencia de núcleos del resto del tejido circundante.
En el año 2004, se comprueba la utilidad de esta misma técnica para encontrar tumor residual en carcinomas basocelulares y carcinomas escamosos mediante cirugía micrográfica de Mohs5. No obstante, no es hasta el año 20096,7 que se introduce la utilización de naranja de acridina como agente de contraste nuclear, permitiendo un excelente contraste entre el tumor, que pasa a brillar, y el tejido circundante, que se observa más oscuro.
A partir de ese momento, se lograron avances en dicha técnica y se ha mostrado que es capaz de reducir hasta en 1/3 el tiempo operatorio durante una cirugía de Mohs, sustituyendo de manera fiable el uso del criostato8, al mismo tiempo que se han descrito criterios para diferenciar un carcinoma basocelular o un carcinoma escamoso de otras estructuras adyacentes9–13.
Estudios realizados en diversos tipos de tumores cutáneos han confirmado la superioridad de MCev en la evaluación de los márgenes quirúrgicos en tiempo real y sin mayor infraestructura requerida, tornándose una eficiente herramienta en la práctica clínica en centros donde se dispone de esta tecnología. También permite determinar la persistencia tumoral después de la realización de procedimientos destructivos tales como láser14, o de encontrar presencia de tumor residual en carcinomas escamosos13 o en tumores del aparato ungueal15.
La indicación más estudiada hasta el momento actual reside en su uso durante la cirugía micrográfica de Mohs. En este sentido, la MCev tiene una aplicabilidad clínica demostrada inmediata acortando en nuestra experiencia al menos en 2/3 los tiempos operatorios con una sensibilidad y especificidad del 88% y 99%, respectivamente, y un valor predictivo positivo del 98% y negativo del 97%8.
La aplicación de esta técnica va incluso mucho más allá de las aplicaciones en dermatología quirúrgica, con recientes publicaciones realizadas en patología inflamatoria16–18. Fuera del ámbito de la dermatología, se han publicado recientemente los hallazgos de MCev en carcinoma de mama, cerebro, pulmón, tiroides, colon, ganglios linfáticos, esófago y mucosa oral, entre otros19,20.
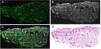
EquipamientoEl VivaScope 2500® (Lucid Inc., Rochester, NY, EE. UU.) fue uno de los primeros dispositivos utilizados para la obtención de imágenes en microscopia MCev de uso clínico. Este equipo contaba con un láser de fluorescencia (488nm) y dos de reflectancia (830nm y 658nm), por lo que el equipo escaneaba la imagen con cada uno de los láseres, prolongando el tiempo final de cada examen. Durante los últimos 2 años se ha desarrollado un nuevo dispositivo, la 4.a generación VivaScope® (MAVIG GmbH, Múnich, Alemania), con una mayor capacidad de resolución en visualización de tejidos y, por primera vez, la combinación de reflectancia (con un láser de 785nm) y de fluorescencia (488nm) en la misma imagen (fig. 1). Esto permite obtener de forma simultánea imágenes de fusión, en la que se combina la fluorescencia y la reflectancia, generando imágenes bicolores semejantes a las de hematoxilina y eosina convencionales (video 1 en material adicional)21,22. Las mismas pueden ser analizadas en cada modo de forma separada o combinadas, siendo esta última lo que se denomina técnica de fusión (fig. 2). Este equipo ofrece las imágenes de alta resolución del tejido entre 3 y 7 minutos después de comenzar el escaneo del mismo y permite su estudio en el quirófano y en el laboratorio de anatomía patológica en el mismo momento a través de un servidor que conecta ambos terminales.
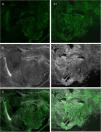
Preparación, tinción y escaneo de la muestraEl tejido obtenido de la exéresis completa o de una biopsia parcial de una lesión es enjuagado en solución salina para evitar artefactos de imagen producidos por la sangre. A continuación, se procede a sumergir el tejido en naranja de acridina 1mmol/L durante 20 segundos, se aclara en abundante solución salina hasta la eliminación del exceso de tinción, se vuelve a sumergir en ácido acético al 50% durante 20 segundos, y finalmente se vuelve a aclarar en solución salina (fig. 3). En muestras de tejido de gran tamaño es necesario prolongar el tiempo de contacto del mismo con la tinción de naranja de acridina, ya que de lo contrario no será suficiente para poder visualizar la tinción de los núcleos en el 100% de la muestra. En tumores compactos suelen ser necesarios más de 20 segundos para obtener una tinción real de toda la muestra, debido a que los núcleos de algunos tumores, como los de células melanocíticas, muestran más dificultad para captar adecuadamente la tinción con naranja de acridina.
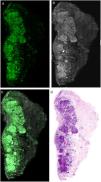
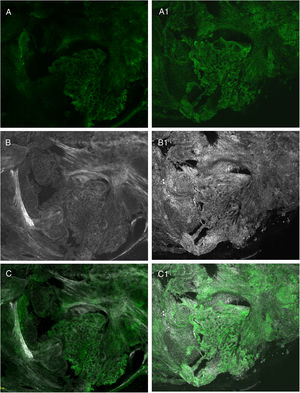
Estudios recientes han demostrado que el uso de una técnica combinada de diferentes tinciones como el acético y el naranja de acridina y mediante imágenes de fusión permite mejorar aún más la calidad de la imagen final, aumentando la nitidez de las estructuras y posibilitando la visualización de características que aún no estaban descritas21,23 (fig. 4).
Comparación entre diferentes tinciones: A) fluorescencia con naranja de acridina; A1) fluorescencia con naranja de acridina y ácido acético; B) reflectancia con naranja de acridina; B1) reflectancia con naranja de acridina y ácido acético; C) fusión con naranja de acridina; C1) fusión con naranja de acridina y ácido acético.
Cuando se ha completado el proceso de tinción, se coloca la muestra teñida encima de una lámina portaobjetos y se aplica un cubreobjetos que mediante la aplicación de cola de silicio, arcilla modeladora o nuevos dispositivos desarrollados para tal efecto (J.P., J.M.) permiten fijar firmemente la muestra previamente al escaneo de la misma (fig. 5). Durante la aplicación del cubreobjetos debe prestarse especial atención a eliminar cualquier burbuja de aire de la preparación, aplicando para ello una presión uniforme en toda la superficie que será escaneada, y de esta forma poder obtener imágenes completas de la epidermis, dermis e hipodermis. Antes de iniciar la toma de imágenes con el VivaScope 2500 4th Gen® (MAVIG GmbH, Múnich, Alemania), se deberá aplicar una cantidad suficiente de gel de ecografía sobre el objetivo que transmitirá la luz láser. En este momento el operador, técnico o incluso el propio cirujano, determinará el «punto cero» de escáner. Este punto se refiere a la profundidad a la que las estructuras tisulares pueden ser enfocadas en su máxima nitidez y homogeneidad de tonos, previamente al inicio del proceso de escaneo. La intensidad de cada láser se ajusta para obtener la luminosidad y homogeneidad adecuada de la imagen final resultante.
Finalmente, se visualiza el tejido escaneado seleccionado mediante el láser de fluorescencia, de reflectancia o de fusión o a través de tinción digital. Este proceso de escaneo puede ser detenido en cualquier momento, con el objetivo de reposicionar el tejido, y reiniciarse en múltiples ocasiones sin dañar el tejido.
En resumen, los pasos fundamentales para obtener un correcto proceso de captación de imágenes son los siguientes: tinción adecuada del tejido, fijación firme y homogénea de la muestra sobre la lámina que permita escanear el 100% de la superficie, e identificación del «punto cero» adecuado.
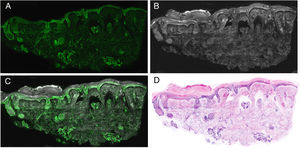
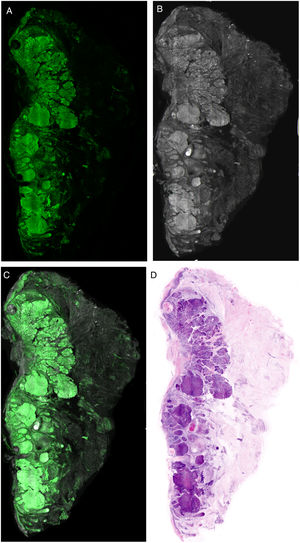
Interpretación de las imágenesLas imágenes resultantes muestran diferentes características según el láser que se utilice, dándonos claves vitales para el diagnóstico. Cuando se observa la imagen obtenida en el modo de fluorescencia, las mismas mostrarán fundamentalmente características nucleares además de algunos elementos dérmicos refráctales, como las fibras elásticas (fig. 6A). Tanto el citoplasma como la mayor parte de la dermis son menos evidentes. Por otro lado, en el modo de reflectancia, se visualizan con mayor nitidez las fibras colágenas y el estroma peritumoral (fig. 6B). Las características morfológicas observadas, por ejemplo, en los carcinomas basocelulares se correlacionan con los mismos cambios observados en las preparaciones histopatológicas convencionales (hematoxilina y eosina) (fig. 6 D). De esa manera, características como la empalizada celular, la hendidura peritumoral o la reacción estromal, así como cambios en los núcleos, el aumento de la relación núcleo/citoplasmática o el pleomorfismo celular pueden observarse de manera semejante a las imágenes de tinción digital de hematoxilina y eosina. Además, diferentes algoritmos de procesamiento de imágenes de tinción digital recientemente descritos ayudan a mejorar la calidad de tonos e interpretación de las mismas22. Si considerarnos el análisis de las imágenes en los diferentes láseres, en el láser de reflectancia aparecerán características que no son observadas en el láser de fluorescencia. Es por este mismo motivo que las imágenes de fusión enriquecen la interpretación global no solo de estructuras tumorales, sino también de los cambios estromales y peritumorales21,23 (fig. 6).
Por otro lado, es importante que en aquellos estudios en los que no se visualizan estructuras tumorales se determine si se ha logrado escanear la totalidad de la muestra para así tener la seguridad real de que estamos ante un verdadero negativo.
En conclusión, la utilización de la microscopia MCev con el VivaScope 2500 4th Gen® (MAVIG GmbH, Múnich, Alemania) abre un amplio abanico de posibilidades de aplicación tanto en dermatología como en patología general, representando una transformación relevante en la forma de procesar los tejidos desde hace más de 100 años. Con esta tecnología se reduce a escasos minutos el proceso de obtención de imágenes semejantes a las obtenidas del tejido en parafina, con lo que se simplifica el estudio morfológico de los tejidos y lo hace más aplicable a la práctica clínico-quirúrgica habitual.
FinanciaciónEl presente trabajo ha sido financiado por la Comisión Europea bajo el 7.o Framework Programme, Diagnoptics.
Conflicto de interesesLos dos primeros autores participan en investigación con MAVIG®.
A todo el equipo de cirugía dermatológica del Hospital Clínic de Barcelona.