La infección por SARS-CoV-2 se ha convertido rápidamente en una pandemia con importantes implicaciones en ámbitos sanitarios, económicos, políticos y culturales en todo el planeta. La enfermedad que produce, llamada COVID-19, es considerada actualmente una patología florida y de obligatorio manejo multidisciplinario por todas las especialidades médicas y de servicios de salud.
Este artículo presenta una revisión bibliográfica de las variadas manifestaciones cutáneas a causa de la COVID-19. Posteriormente, se mencionan los diversos engranajes fisiopatológicos que se han postulado hasta el momento y su posible relación con los hallazgos de la enfermedad en la piel. Por último, se propone una clasificación de las manifestaciones cutáneas según mecanismos fisiopatológicos de base y pronóstico de la enfermedad.
The rapid spread of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infections soon led to a pandemic with serious health, economic, political, and cultural repercussions across the globe. The disease caused by SARS-CoV-2, coronavirus disease 2019 (COVID-19), is a multisystemic disease that requires a multidisciplinary approach involving specialists from all fields and levels of care. In this article, we review the literature on the diverse cutaneous manifestations associated with COVID-19. We also describe the pathophysiologic mechanisms proposed to date and their possible association with these manifestations. Finally, we propose a system for classifying the cutaneous manifestations of COVID-19 according to their underlying pathophysiologic mechanisms and prognosis.
En diciembre del 2019, las autoridades sanitarias chinas reportaron múltiples cuadros respiratorios en habitantes de la provincia de Wuhan, la gran mayoría de ellos trabajadores de un pequeño local de comida marítima1. En un lapso corto se logró tipificar el agente causal: un virus de la familia Coronaviridae, cuyo origen es probablemente zoonótico y cuyo hospedero inicial es el murciélago2. Pronto se le concede el nombre de SARS-CoV-2, para diferenciarlo de los otros dos virus de la familia Coronaviridae, también causantes de pandemias en este siglo, el SARS-CoV-1 y el MERS3,4.
A pesar de tener una tasa de letalidad del 2,3%5, comparativamente menor que la del SARS-CoV-1 (9,5%) y que la del MERS (34,4%)6, el SARS-CoV-2 logró expandirse de manera rápida por fuera de China, debido a su alta tasa de contagio, la cual se explica por una mayor carga viral en el tracto respiratorio, superior en comparación con la del SARS-CoV-17. También influyen su capacidad de mantenerse como aerosol en el aire por más de 3horas, sobrevivir por 72horas en muchas superficies y tener un período de incubación relativamente corto, inferior a 2 semanas8.
Los reportes iniciales señalaron que la mayoría de los pacientes manifestaban síntomas como fiebre, rinorrea, tos sin expectoración, astenia y adinamia9. Una pequeña proporción de pacientes necesitaron hospitalización por cuadro de neumonía severa. El grupo de Wu et al. reportó una cohorte de 70.000 pacientes3 con infección por SARS-CoV-2. Estos investigadores demostraron que el 14% de los pacientes presentan un cuadro de neumonía severa (disnea, taquipnea, desaturación y disminución en la fracción PAFI); el 5% de estos casos son considerados críticos y requieren manejo en unidad de cuidados intensivos (UCI), con una tasa de mortalidad del 2,3% en población general y hasta del 14% en mayores de 80años. Estos resultados fueron comprobados con estudios posteriores de grupos europeos10.
Entre los factores de riesgo más importantes para presentar un curso tórpido de la infección se encuentran ser hombre, padecer diabetes, hipertensión arterial y sufrir enfermedades pulmonares y cardiovasculares crónicas11,12. Cabe destacar que la población pediátrica menor de 10años presenta síntomas leves de la enfermedad, con una tasa de complicaciones o letalidad mucho menor que la de la población adulta13.
Información procedente de Asia, Europa y Estados Unidos evidencia que la infección por SARS-CoV-2 presenta una gran gama de manifestaciones dermatológicas, al comienzo consideradas inespecíficas; sin embargo, con el aumento en los reportes, se ha podido encontrar un aparente patrón de presentación, que incluso puede estar relacionado con el pronóstico de esta infección. El presente artículo presenta una revisión de la literatura de las variadas manifestaciones cutáneas hasta ahora reportadas en pacientes con infección por SARS-CoV-2. Posteriormente, se mencionan los diversos mecanismos fisiopatológicos e hipótesis actuales que pueden explicar las manifestaciones en piel.
ResultadosManifestaciones cutáneas en COVID-19Infección por SARS-CoV-2 y aparición de exantemas inespecíficosExisten 39 especies de coronavirus, de las cuales 7 afectan al ser humano14. Salvo el SARS-CoV-1, el SARS-CoV-2 y el MERS, estos virus (HCoV-229E, HCoV-OC43, HCoV-NL63 y HCoV-HKU1) causan cuadros respiratorios leves, como el resfriado común. Probablemente muchos de estos virus, al igual que otros virus respiratorios, se asocien a exantemas virales, que no se identifican al no realizarse pruebas diagnósticas específicas.
El primer reporte en la literatura en el cual se manifiesta algún hallazgo cutáneo en pacientes con COVID-19 fue la cohorte analizada por Guan et al., publicado en febrero del 202015. En esta cohorte de 1.099 pacientes con infección por SARS-CoV-2, 2 pacientes presentaron lesiones en la piel; los autores no especificaron qué tipo de exantema ni las características clínicas ni temporales de estas lesiones, por lo que este hallazgo pasó parcialmente desapercibido. Luego, desde Tailandia, se reportó un paciente16 con curso clínico inicial de «rash morbiliforme y múltiples petequias», sumado a trombocitopenia, con diagnóstico inicial de infección por virus del dengue y manejo ambulatorio; no obstante, el paciente consultó nuevamente por síntomas respiratorios, con el diagnóstico confirmado de SARS-CoV-2 por RT-PCR (reacción en cadena de la polimerasa transcriptasa reversa). Esta publicación incitó a médicos con pacientes con infección por SARS-CoV-2 bajo su cuidado a indagar sobre las manifestaciones dermatológicas en ellos17,18.
La primera gran descripción de pacientes con manifestaciones cutáneas se reportó en Italia19; 88 casos de pacientes con COVID-19, de los cuales 18 tuvieron cualquier tipo de clínica en la piel (20,4%), 8 de ellos durante su hospitalización y 10 luego del egreso; 14 pacientes manifestaron un «exantema eritematoso»; 3 pacientes, lesiones clínicas de urticaria generalizada; y un paciente, hallazgos de erupción variceliforme. La gran mayoría de pacientes presentaron las lesiones en el tronco, una importante proporción de ellas asintomáticas, y curso benigno autorresolutivo, sin relación con la severidad del cuadro. Por desgracia no se tomaron fotografías de ninguna de las lesiones, por políticas sanitarias del hospital al momento del estudio.
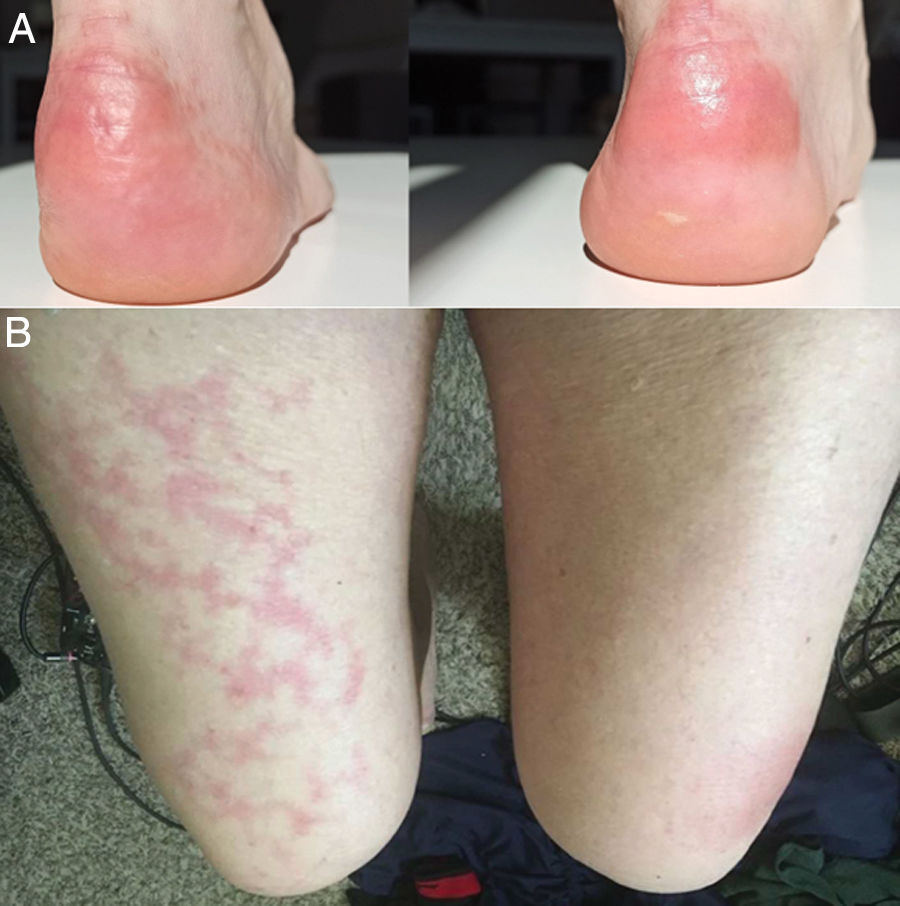
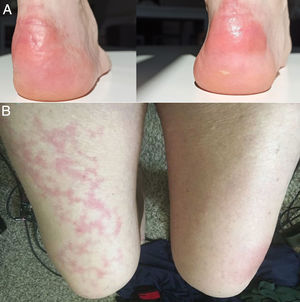
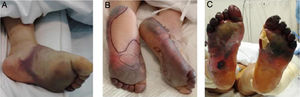
Con el pasar de los días, se describieron nuevos casos de pacientes con infección confirmada y con una amplia gama de manifestaciones: placas eritemo-amarillentas pruriginosas en talones (fig. 1A)20; eritema morbiliforme que respeta zonas acrales21; exantema morbiliforme maculopapular generalizado de progresión céfalo-caudal22; lesiones urticariformes23,24; exantemas que por su distribución recuerdan reacciones medicamentosas flexurales e intertriginosas25; e incluso pacientes con lesiones de livedo reticularis en extremidades inferiores (fig. 1B)26. Al igual que en los casos anteriores, no se realizaron biopsias, debido al seguimiento de protocolos sanitarios y por la evolución benigna y autorresolutiva.
A) Placas eritematoamarillentas infiltradas en talones. Fuente: Estébanez et al.20. B) Hombre de 67años con livedo reticularis unilateral en el muslo derecho. Concomitantemente, el paciente presenta hematuria macroscópica. La hematuria y el livedo resuelven en menos de 24horas. Fuente: Manalo et al.26.
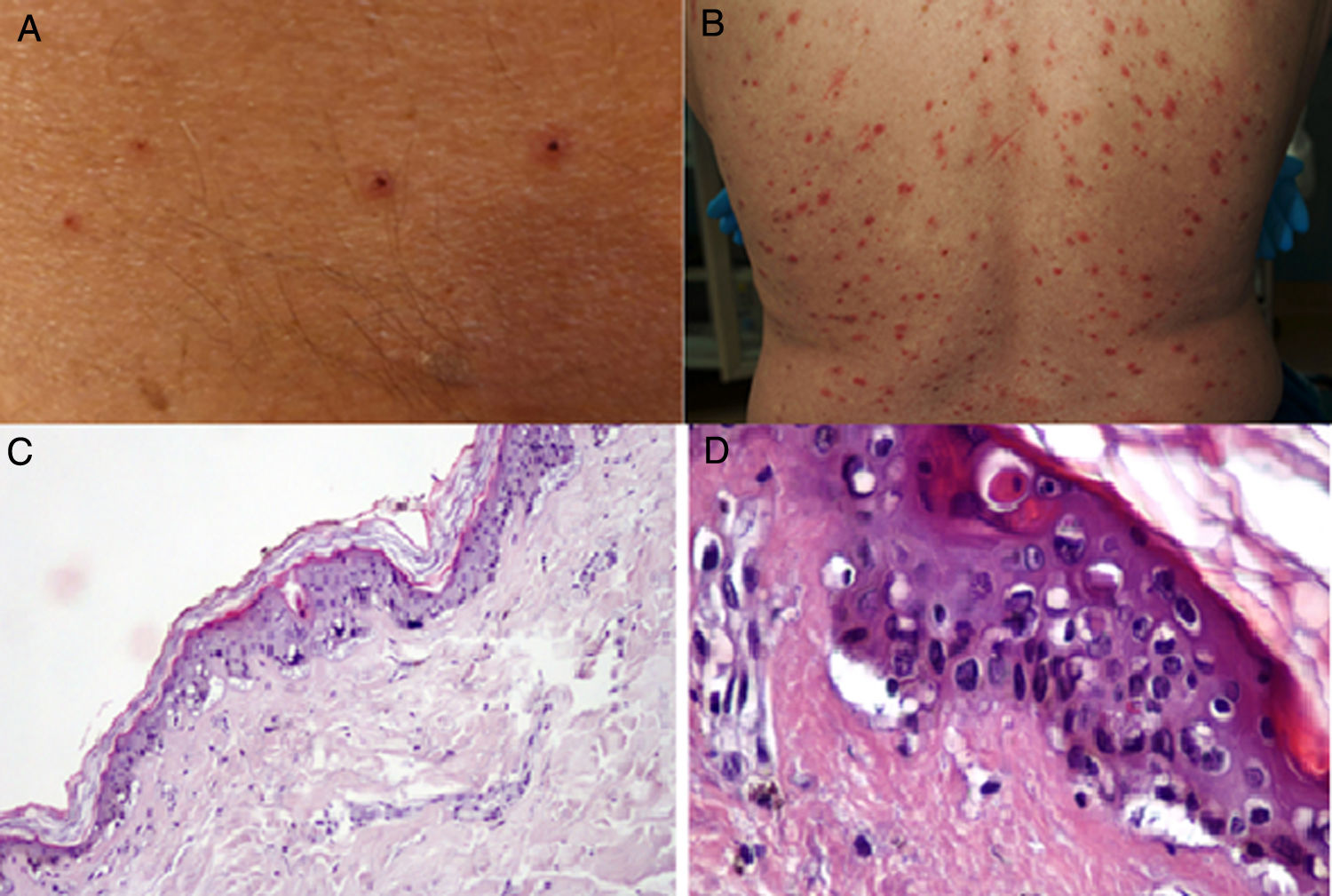
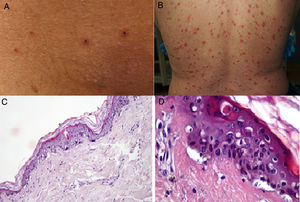
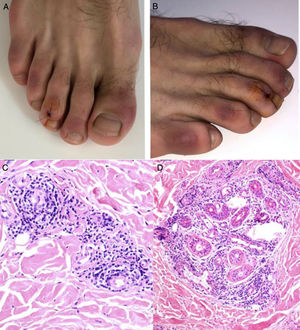
Durante el mes de abril, la revista Journal of the American Academy of Dermatology comunicó una serie de 22 pacientes27 con diagnóstico de infección por SARS-CoV-2, quienes desarrollaron, aproximadamente 3 días después del inicio de los síntomas sistémicos, un exantema variceliforme, de curso benigno, con un lapso de 8 días desde el inicio hasta la resolución de los hallazgos cutáneos, sin cicatrices residuales. Con respecto a las características asociadas a los sujetos, la mayoría de los pacientes eran de sexo masculino (72,7%), con una edad media de 60años; las lesiones variceliformes tenían predominio de vesículas, diseminadas en el 72,7% de los casos y difusas en el 27,3%, con compromiso constante en el tronco. En los resultados no se reportó compromiso facial o mucoso (fig. 2A y B). El síntoma más común fue prurito leve en casi la mitad de los pacientes. Se realizó biopsia de piel en 7 pacientes, con hallazgos histopatológicos compatibles con una infección aguda viral (fig. 2C y D). Los autores de este reporte de casos proponen este tipo de exantema como una manifestación específica de infección por SARS-CoV-2, lo cual puede servir al personal médico como un indicio para sospecha ante un paciente con síntomas leves de la infección.
A y B) Pacientes con COVID-19 con exantema papulovesicular en tronco. En la imagen de la izquierda (A) se aprecian vesículas con costra varioliforme central. C y D) Cambios histopatológicos de pacientes con infección por COVID-19 y exantema variceliforme. C) Leve atrofia epidérmica, hiperqueratosis en canasta, degeneración vacuolar de la membrana basal con queratinocitos hipercromáticos multinucleados y disqueratinocitos. HE 10×. D) En mayor aumento se aprecia la alteración vacuolar con queratinocitos desorganizados con maduración alterada, queratinocitos multinucleados con células disqueratóticas. HE 40×.
Fuente: Marzano et al.27.
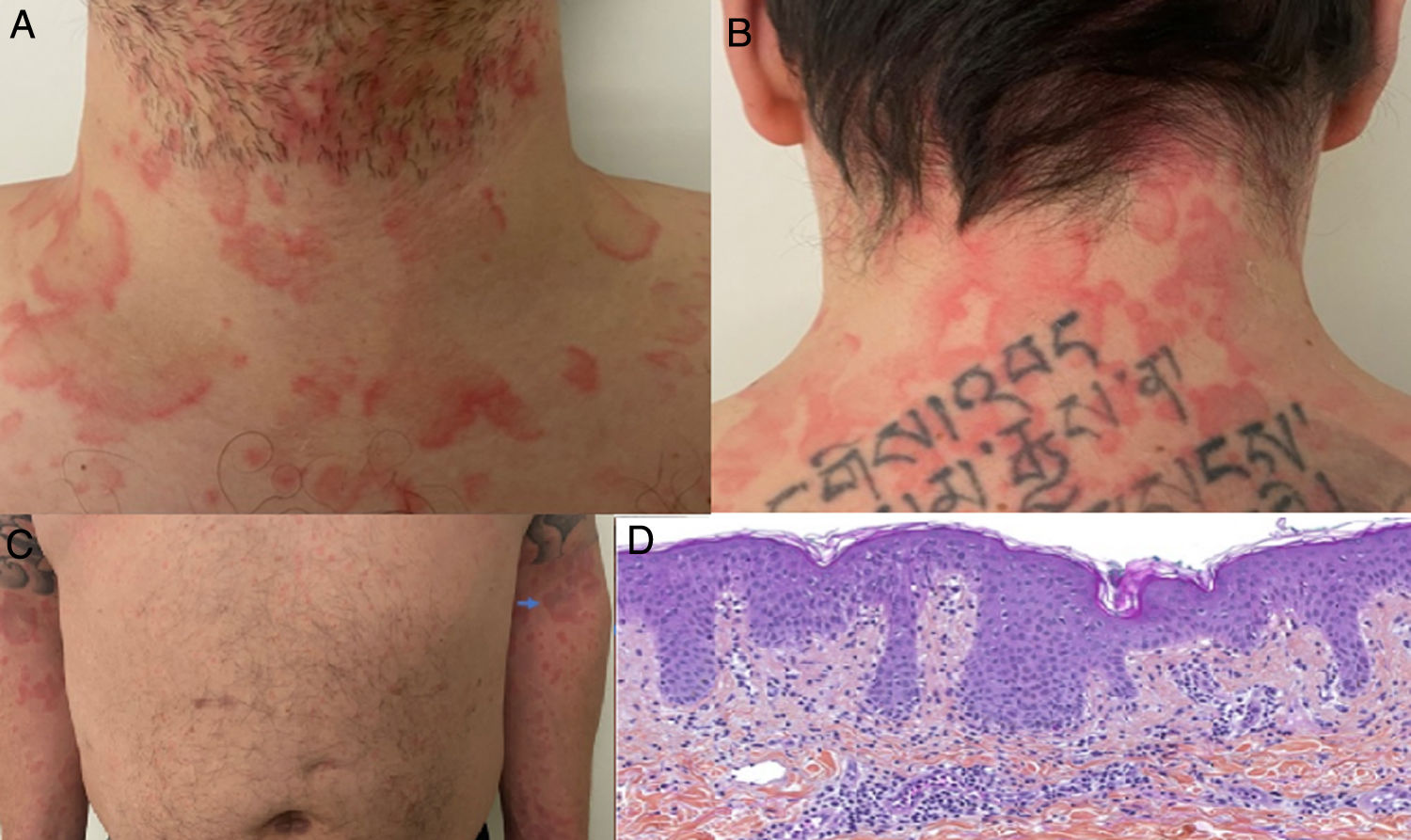
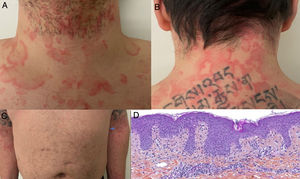
Ulteriormente, se divulgó el caso de un hombre en la cuarta década de la vida, con prueba molecular positiva para SARS-CoV-2, con cuadro clínico consistente en picos febriles y aparición concomitante de placas fijas eritematoedematosas no pruriginosas anulares, circinadas y policíclicas en cuello, tórax, abdomen y miembros superiores, de manera simétrica (fig. 3A-C); estas lesiones resolvieron después de 7 días. Se realizó biopsia de piel con hallazgos compatibles con exantema viral (fig. 3D)28.
A y B) Placas anulares y circinadas eritematoedematosas en cuello anterior y posterior. C) Se observa patrón simétrico de distribución en miembros superiores. D) Infiltrado linfocítico perivascular superficial, edema de dermis papilar, espongiosis leve, dermatitis de interfase vacuolar y liquenoide, polimorfonucleares ocasionales en el infiltrado dérmico. HE 10×.
Fuente: Amatore et al.28.
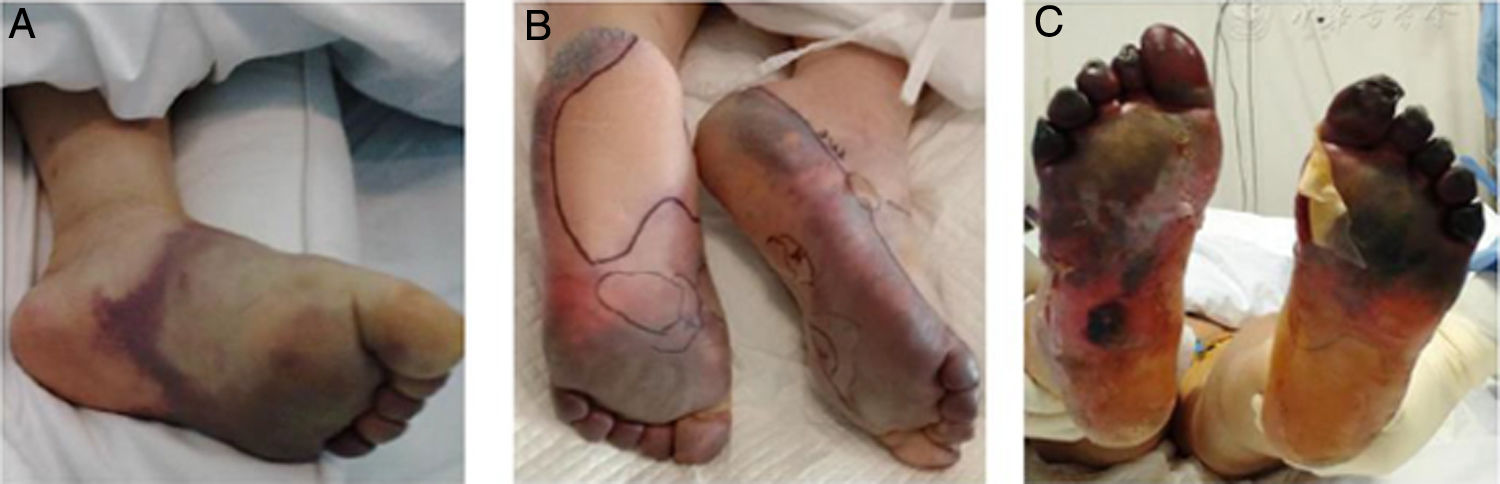
El grupo de origen chino liderado por Zhang29 publicó una evaluación retrospectiva de 7 pacientes ingresados en la UCI de un hospital en Wuhan por neumonía crítica por SARS-CoV-2. Estos pacientes presentaron múltiples fenómenos isquémicos acrales, como acrocianosis, púrpura retiforme y gangrena (fig. 4). Se realizó la evaluación de paraclínicos al momento del ingreso hospitalario, cuando presentaron estos fenómenos cutáneos y luego del uso de terapia anticoagulante; se evidenciaron alteraciones en el dímero D, en el fibrinógeno y en los productos de este último, en relación con los eventos secuenciales descritos y con tasa de mortalidad del 71,42%. Desde ese momento se plantea la hipótesis de un estado hipercoagulable per se en los pacientes con infección por SARS-CoV-2.
Exacerbación progresiva en un paciente con COVID-19 y fenómenos isquémicos acrales, desarrollando ampollas y finalmente gangrena seca en los pies.
Fuente: Zhang et al.29.
Paralelamente en Europa, Oriente Medio y Estados Unidos, se estudiaron múltiples casos de pacientes con lesiones similares a perniosis, en personas jóvenes en contacto estrecho con pacientes con COVID-19 o con síntomas altamente sugestivos, sin la necesaria confirmación de infección por SARS-CoV-2. Los cuadros mencionados presentaban multitud de síntomas, entre los más importantes dolor y ardor cutáneo, con un curso autorresolutivo benigno y sin complicaciones por neumonía asociada a SARS-CoV-230–32.
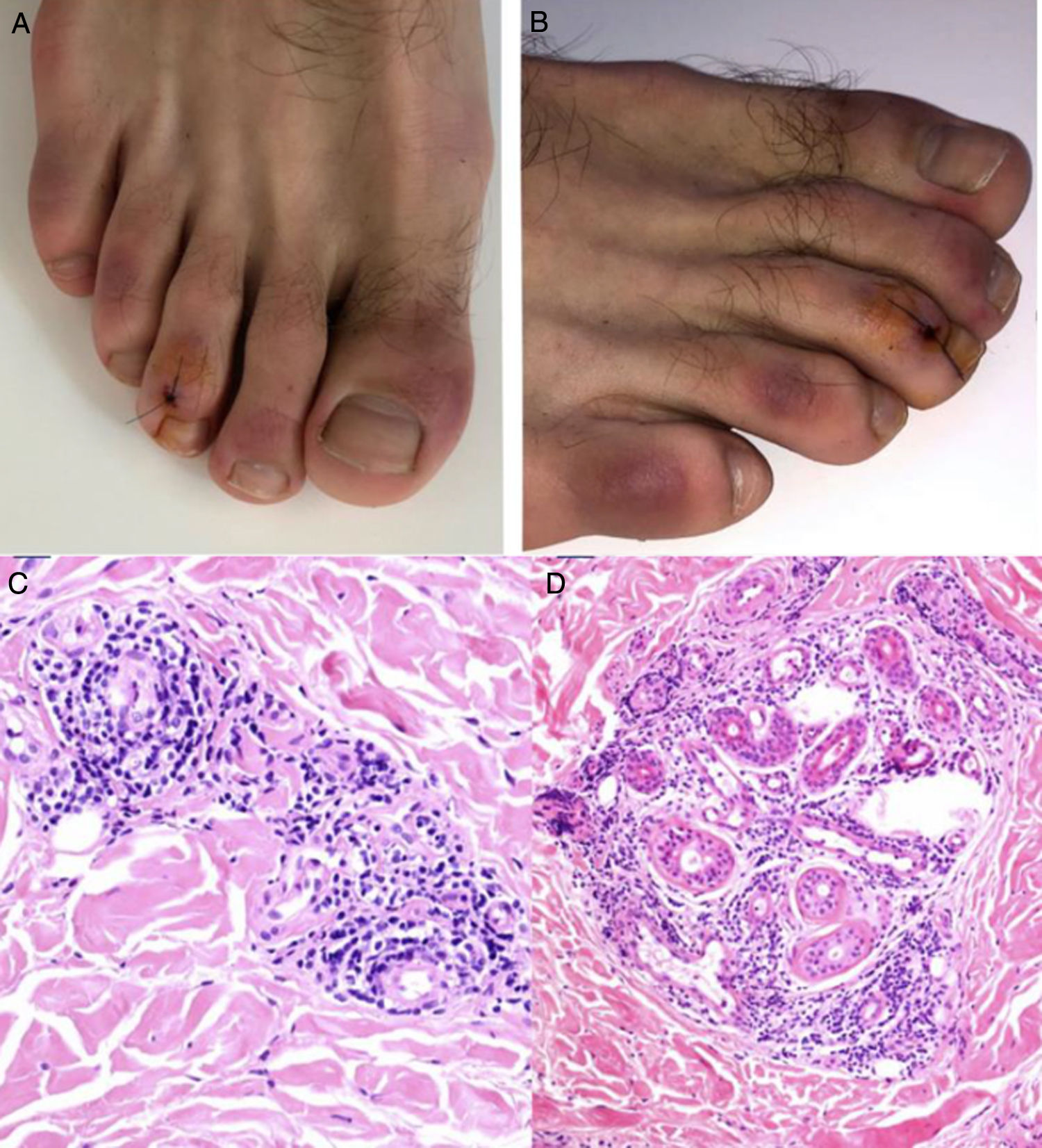
El grupo de Kolivras et al.33 reportó el caso de un adulto joven con placas violáceas de comienzo abrupto, dolorosas en dedos y regiones laterales de los pies (fig. 5A y B), con síntomas prodrómicos respiratorios altos, 3 días antes de las lesiones. Se realizó una biopsia de la lesión con hallazgos compatibles con lupus pernio (fig. 5C y D). El resultado del hisopado nasofaríngeo al ingreso fue positivo para SARS-CoV-2.
A y B) Placas violáceas infiltradas con fondo eritematoso en las regiones dorsal de los dedos y lateral de los pies. C y D) Biopsia de lesión en el tercer dedo del pie derecho, HE. C) Se observa infiltrado linfocítico con ocasionales células plasmáticas en estrecho contacto con los vasos, sin evidencia de fibrina o trombos. HE 40×. D) Se observa un infiltrado periecrino. HE 40×.
Fuente: Kolivras et al.33.
Debido al gran impacto de la pandemia en el continente europeo, múltiples grupos reportan estudios con el objetivo de caracterizar las lesiones acrales similares a perniosis en contexto de COVID-1934. En Italia, Recalcati et al.31 y Tosti et al.35 encontraron que estas lesiones son más comunes en población joven (78,5% ocurren en niños), con compromiso de los pies en un 71% de los casos, sin síntomas sistémicos, autorresolutivas con laboratorios normales. En Francia36, se estudiaron 277 pacientes en un lapso de 3 semanas; 142 pacientes (80%) presentaron lesiones acrales; de estos, 106 (75%) con máculas y pápulas eritematovioláceas, edematosas dolorosas compatibles con lesiones de lupus pernio. El grupo liderado por Fernández-Nieto37 caracterizó una cohorte de 132 pacientes no hospitalizados con lesiones acroisquémicas durante 5 semanas. Señalaron una edad media de 19,9años; el 40,9% de los casos ocurrieron en contacto cercano con pacientes infectados por SARS-CoV-2, un 14,4% con COVID positivo. Más del 90% de las lesiones ocurrían en los dedos; el 81,8%, en los pies. Como en los casos previamente mencionados, la aparición de estas lesiones se acompañó de un curso benigno de la enfermedad.
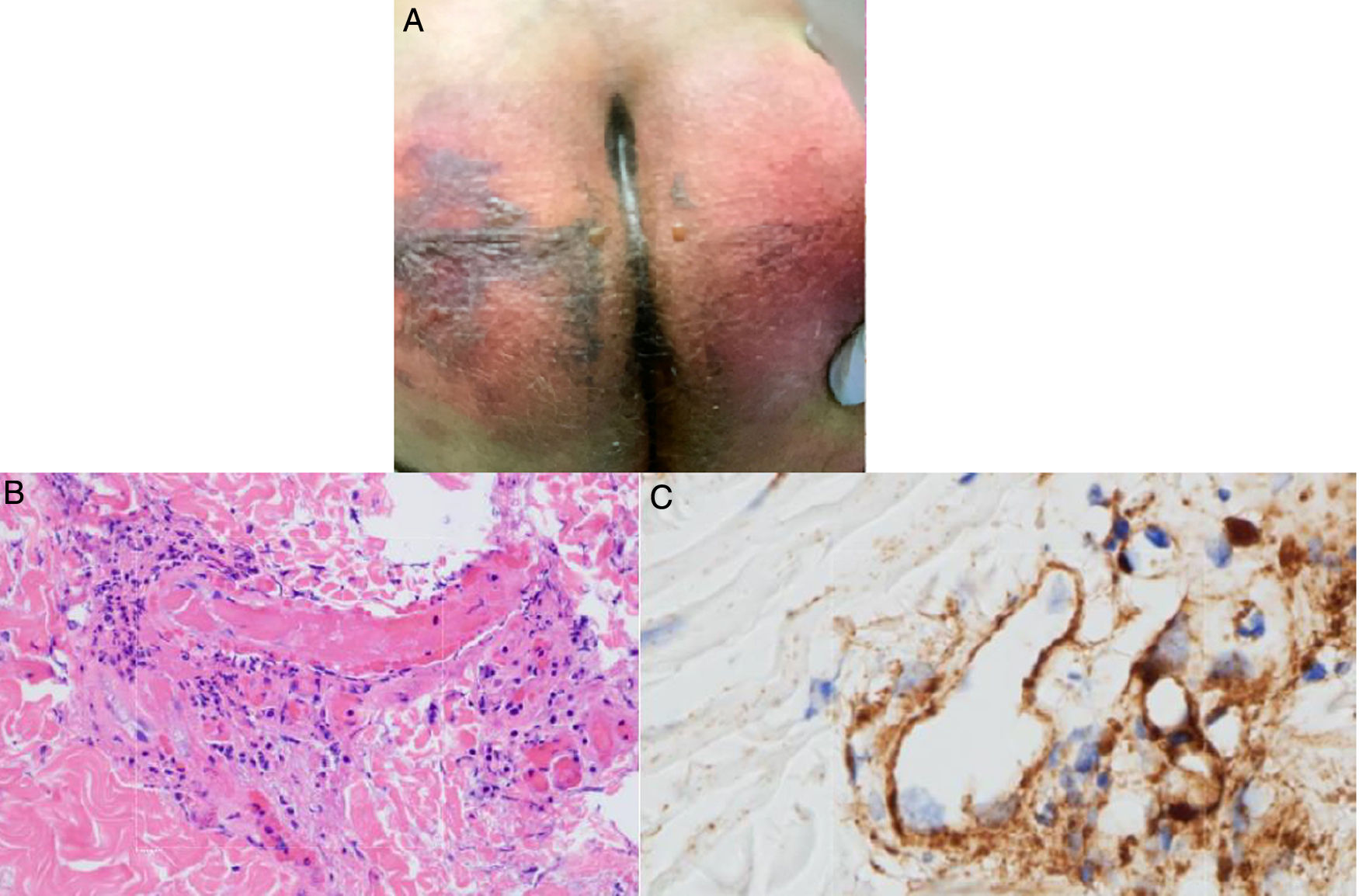
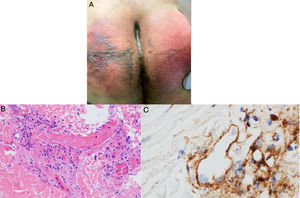
El grupo de Magro et al.38 evaluó a pacientes con COVID-19 y manifestaciones cutáneas relacionadas con un estado procoagulante o microangiopático. A 3 pacientes que desarrollaron púrpura retiforme o livedo racemoso en el transcurso de su enfermedad respiratoria (fig. 6A) se les relacionó con niveles elevados de dímero D, por lo tanto, se les realizó biopsias de piel encontrando vasculopatía trombogénica pauciinflamatoria con depósitos de complemento C5b-9 y C4d (fig. 6B y C). Así parte la hipótesis de una relación entre los mecanismos dependientes de vías de complemento alterna y dependiente de lectina y fenómenos trombóticos en pacientes con infección por SARS-CoV-2, con la subsecuente explicación del porqué existen fenómenos procoagulantes en otros órganos39.
A) Paciente masculino de 32años con púrpura retiforme en glúteos 4 días posteriores al inicio de soporte ventilatorio mecánico por falla respiratoria aguda asociada a SARS-CoV-2. B) Biopsia de piel con una gran trombosis vascular pauciinflamatoria con daño de células endoteliales. HE 40×. C) Depósitos de C5b-9 dentro de la microvasculatura. Diaminobencidina 40×.
Fuente: Magro et al.38.
La British Journal of Dermatology entregó a la comunidad científica los resultados del estudio40 de 375 pacientes españoles con infección confirmada por SARS-CoV-2, o con sospecha de contagio con síntomas compatibles, y con manifestaciones cutáneas adicionales sin explicación clara sobre su causalidad. Los pacientes fueron evaluados en un lapso de 2 semanas y se consideraron las características clínicas encontradas, la temporalidad con respecto a los síntomas, las particularidades demográficas de los pacientes y su relación con el curso y pronóstico de la infección. A partir de estas evaluaciones, el grupo liderado por Galván Casas propone una clasificación de las manifestaciones cutáneas de COVID-19 organizada en 5 patrones clínicos: 1) «pseudochilblain» en un 19% de los pacientes; 2) «vesicular» en un 9%; 3) «urticariforme» en un 19%; 4) «maculopapular» en un 47%, y 5) «vasculonecrótico» en un 6% del total de los pacientes. Se encontró que este último patrón, que engloba las lesiones livedoides y necróticas, aparece en pacientes ancianos (edad media de 63años) con un curso severo de la infección (mortalidad del 10%), mientras que las lesiones eritematoedematosas con vesículas o pústulas en zonas acrales, «pseudochilblain», aparecen en su gran mayoría luego del inicio de los síntomas respiratorios, en un 59% de los casos, en pacientes jóvenes (edad media de 21,8años), con un curso benigno de la infección por SARS-CoV-2, con una tasa de mortalidad del 0%, tasa igual a las reportadas en las variantes «vesicular» y «urticariforme», mientras que la tasa de sobrevida de los pacientes con lesiones «maculopapulares» fue del 98%. Los datos del estudio son concordantes con los publicados por otros autores, en especial con respecto al curso benigno de las lesiones «pseudochilblain»30–33.
Hallazgos fisiopatológicosFisiopatología de la infección por SARS-CoV-2 y la posible relación con sus manifestaciones cutáneasLos pacientes con infección por SARS-CoV-2 complicada con pronóstico desfavorable presentan leucocitosis, neutrofilia, linfopenia, trombocitopenia, aumento en los niveles de lactato deshidrogenasa, de procalcitonina, así como alteración en los valores de dímero D y de productos de degradación del fibrinógeno41, que, en algunos casos, configuran hallazgos compatibles con un síndrome de coagulación intravascular diseminada (CID)42. Por otro lado, Lippi y Favaloro43 hallaron una asociación directamente proporcional de los niveles de dímero D con respecto a la gravedad de la neumonía y de los síndromes de dificultad respiratoria aguda secundarios a infección por SARS-CoV-2; datos congruentes con otros reportes9, en los que se evidencia una relación del dímero D elevado y la mortalidad con respecto a COVID-19.
En los seres humanos, la ferritina tiene una función protectora durante la infección, puesto que disminuye la cantidad de hierro disponible para diversos patógenos44, lo cual explica su incremento en estados de inflamación45. Los niveles de ferritina se encuentran elevados de gran manera en los pacientes con neumonía severa por SARS-CoV-2, y se correlacionan con desenlaces negativos con respecto a morbimortalidad46.
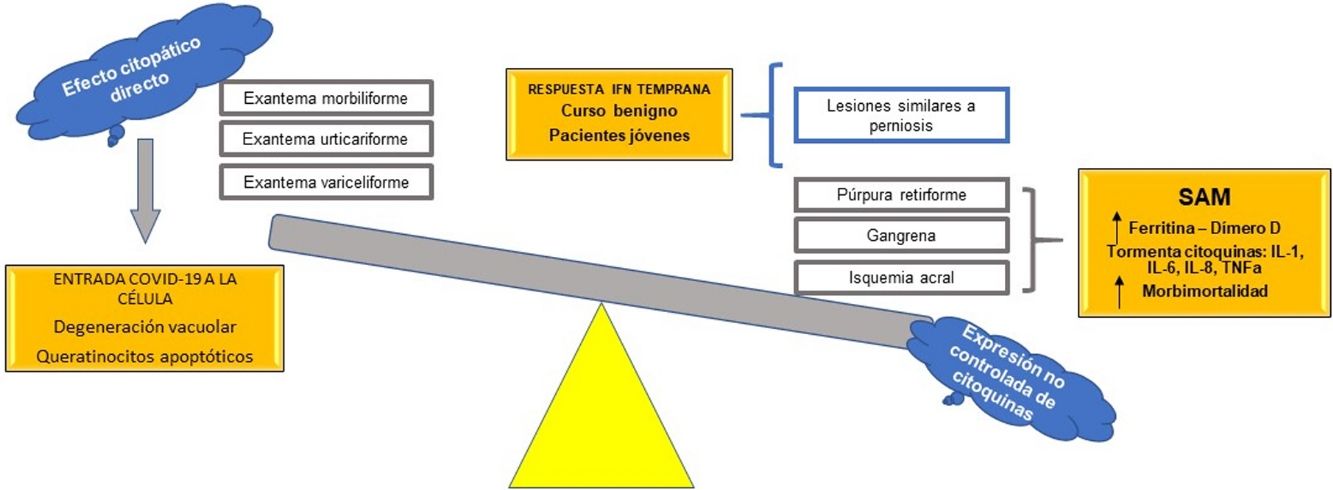
Como se ha mencionado, los cambios en las variables bioquímicas son diversos; sin embargo, todos llevan a un mismo punto: características similares al de un síndrome de activación macrofágica (SAM)47. Aquí radica la importancia de las células de la línea blanca, en especial de los linfocitos T y los macrófagos en la respuesta inmune hipercitoquinética y trombótica asociada a COVID-19.
Macrófagos y linfocitos T como piedra angular de las lesiones acrales isquémicas en COVID-19Los estudios iniciales para la tipificación del nuevo coronavirus identificaron al receptor de superficie celular de la enzima convertidora de angiotensina tipo 2 (ACE2, por sus siglas en inglés) como el receptor clave en la patogénesis de la infección2. El virus lo utiliza para entrar en las células de los seres humanos, sin afinidad alguna hacia otros receptores que utilizan distintas familias de coronavirus, como el receptor de la dipeptidil peptidasa 4 (DPP4)48.
El receptor ACE2 se encuentra en la superficie de células epiteliales pulmonares, en los enterocitos del intestino delgado, en las células endoteliales de venas y arterias y en las células del músculo liso arterial de múltiples órganos, entre ellos la piel49. La replicación del virus dentro de las células causa daño celular directo con liberación de alarminas proinflamatorias (efecto viral directo); sumado a esto, las partículas virales pueden crear respuestas inmunes innatas, que incluyen la activación de macrófagos alveolares y de la cascada del complemento a través de la vía de la lectina38,50.
La activación del complemento y las diversas respuestas inmunes permiten el reclutamiento de leucocitos, con una proliferación exagerada de linfocitos y con liberación masiva de citoquinas proinflamatorias (IL-1B, IL-6, IL-8), de interferón gamma y de factor de necrosis tumoral (TNF) alfa, entre otros. El interferón gamma en grandes cantidades activa los macrófagos y libera ferritina45; la IL-6 produce fiebre en los individuos51 y hemofagocitosis que conduce a pancitopenia47,52. Al mismo tiempo, los macrófagos liberan el factor activador del plasminógeno, por lo que puede ser uno de los múltiples mecanismos que explicarían los episodios trombóticos y la elevación del dímero D53, junto con otros hallazgos como el papel de la presencia de anticuerpos antifosfolípidos en pacientes con COVID-19 severa sin comorbilidades54. Los grupos dirigidos por Bowles55 en Reino Unido y por Connel en Estados Unidos56 ratifican los hallazgos de anticuerpos antifosfolípidos, en especial del anticoagulante lúpico, en pacientes con infección por SARS-CoV-2. Esto puede explicar los fenómenos acrales isquémicos —a excepción de las lesiones tipo perniosis—, necrosis e incluso los hallazgos de livedo reticularis y racemoso en algunos pacientes con infección por SARS-CoV-2, con respuestas trombóticas multisistémicas concomitantes.
Otra hipótesis que explica los cambios sistémicos y cutáneos es la llamada sepsis viral en COVID-1957, la cual se plantea a partir de los múltiples hallazgos de daño multiorgánico en las autopsias de pacientes que mueren por síndrome de dificultad respiratoria aguda por SARS-CoV-258. Al parecer, la gran cantidad de citoquinas liberadas, en especial el TNF alfa, inducen la muerte de las células infectadas por vías dependientes de apoptosis, sumado a la aparente capacidad del SARS-CoV-2 de infectar a los linfocitos T, lo que genera la linfopenia en estos pacientes.
Hay evidencia suficiente que soporta el daño directo por SARS-CoV-2 sobre la célula endotelial, con posterior inflamación endotelial difusa, la cual ocasiona apoptosis del endotelio vascular59, creando el interrogante sobre si la infección por SARS-CoV-2 es realmente una enfermedad netamente endotelial60. A favor de esta teoría se encuentran la mortalidad descrita en pacientes con antecedentes de diabetes mellitus o enfermedad cardiovascular crónica infectados por este nuevo coronavirus y los hallazgos isquémicos, en especial, acrales en la piel.
Relación entre el interferón y lesiones compatibles con perniosisSe ha observado que los pacientes con infección por SARS-CoV-2 que presentan lesiones compatibles con perniosis30–32 presentan un curso benigno de la infección, a diferencia de los pacientes con fenómenos isquémicos acrales severos, como gangrena29 o púrpura retiforme38; también se reporta que los pacientes con este curso más benigno pertenecen a la población más joven. La explicación puede estar en el interferón tipo I.
En su publicación, Kolivras et al.33 hacen énfasis en la gran respuesta del interferón tipo I en los pacientes con COVID-19, como en muchas infecciones virales agudas61. El interferón tipo I se encuentra elevado en el lupus eritematoso, así como en las interferonopatías, como el síndrome de Aicardi-Goutières, en el cual se presentan fenómenos microangiopáticos distales62. Se propone que es la respuesta temprana del interferón tipo I la causante de estas lesiones acrales, respuesta que al mismo tiempo presenta un curso clínico benigno, por la función antiviral de esta citoquina. Por otro lado, puesto que una respuesta prematura del interferón tipo I es capaz de suprimir la liberación no controlada de citoquinas proinflamatorias diversas, disminuyendo la posibilidad de una «tormenta de citoquinas», los pacientes ancianos, o con comorbilidades que alteren la función de su sistema inmunológico, son capaces de generar solo una respuesta de interferón tardía, con la subsecuente liberación de citoquinas y la expresión de un síndrome de activación macrofágica, liberación de ferritina y de dímero D, con lesiones isquémicas acrales verdaderas y un pronóstico mucho peor.
DiscusiónLa pandemia actual por COVID-19 ha significado un reto de enormes proporciones para los profesionales de la salud, con la tarea de reconocer toda la gama de manifestaciones clínicas que presentan los pacientes infectados. Esta enfermedad es multisistémica y la piel no es ajena a sus manifestaciones, con la gran ventaja de que reconocerlas permitiría una sospecha temprana del diagnóstico en unos casos y, en otros, una aproximación evolutiva a la enfermedad que incluso podría orientarnos sobre qué tipo de respuesta inmune o complicaciones está presentando cada paciente.
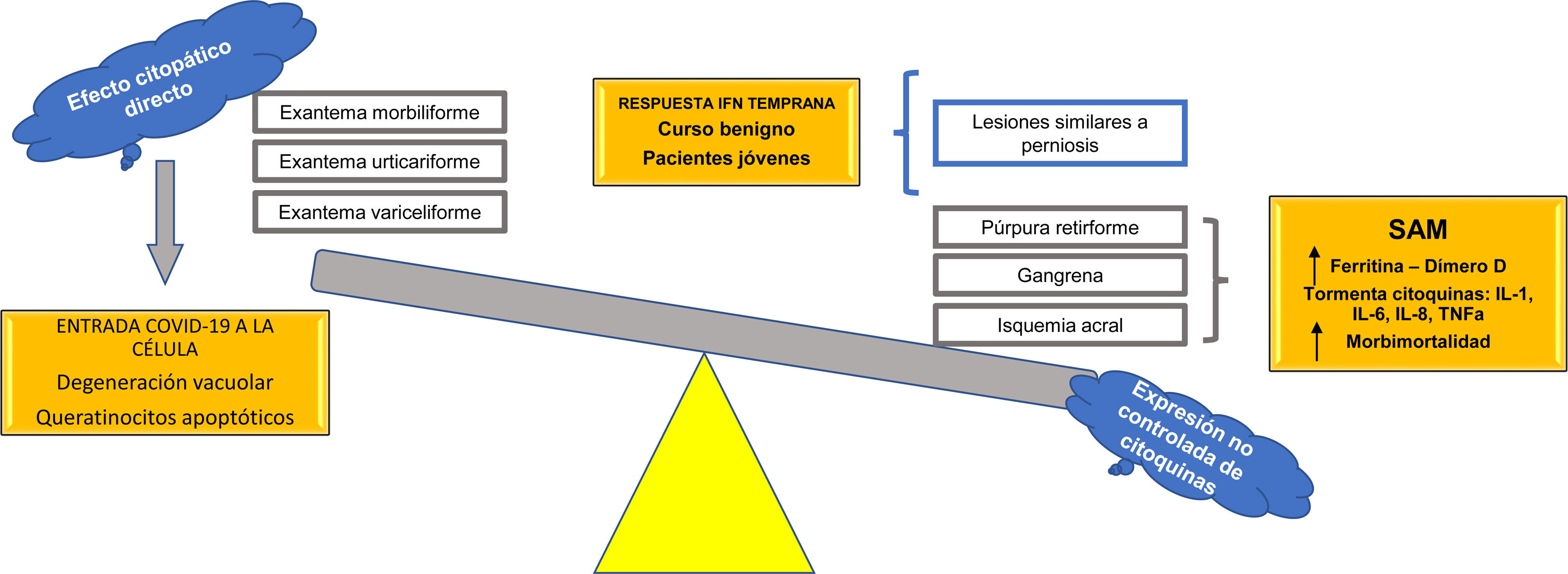
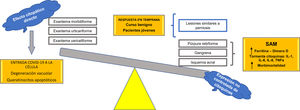
Se propone, con base en las hipótesis fisiopatológicas que explican las diversas expresiones clínicas de la COVID-19, clasificar estas expresiones en dos grupos: 1) las que se basan principalmente en un efecto citopático viral directo sobre las células del organismo —como los queratinocitos, que son comunes a muchas infecciones virales conocidas (exantema morbiliforme, urticariforme, semejante a ciertas reacciones medicamentosas, variceliforme)— y 2) las secundarias a la hiperexpresión no controlada de citoquinas en el organismo por alteración de células específicas de la línea blanca, como los linfocitos T y los macrófagos. Así, este último grupo se subdividiría en dos: a) las que se caracterizan por un fenómeno similar al síndrome de activación macrofágica (isquemia acral, gangrena, púrpura retiforme, livedo racemoso), con un pronóstico ominoso con relación a la morbimortalidad de los pacientes, y b) las manifestaciones cutáneas relacionadas con un pronóstico benigno autorresolutivo en pacientes jóvenes, por activación de una respuesta temprana al interferón tipo I (lesiones similares a perniosis) (fig. 7). Esta hipótesis es una de las primeras en la literatura científica que logra explicar la relación entre las más importantes manifestaciones cutáneas y su fisiopatología, con su subsecuente clasificación y valor pronóstico.
Se estima de vital importancia que todos los médicos, enfermeros, terapeutas respiratorios, personal de salud en preparación, e incluso la población en general, conozcan la relación entre la infección por SARS-CoV-2 y la piel, con sus variadas manifestaciones, para propender hacia una búsqueda activa, un estudio minucioso y la generación de nuevos conocimientos científicos que ayuden a caracterizar la fisiopatogenia de esta enfermedad y lograr así un acercamiento al desarrollo de terapias eficaces y protocolos en salud que permitan mitigar las complicaciones de esta infección.
FinanciaciónEl presente trabajo no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los profesionales de la salud que han sido parte de la primera línea de atención de pacientes con COVID-19; su aporte a la historia de la medicina es invaluable.