El linfoma anaplásico de células grandes asociado a implantes mamarios (breast implant-associated anaplastic large cell lymphoma [BIA-ALCL]) es un linfoma de células T, muy infrecuente, con una incidencia creciente en las últimas décadas. La forma de presentación más común es un aumento del volumen mamario debido a un seroma periprotésico. A continuación, se describe una paciente que inició con unas lesiones cutáneas en la zona intermamaria, una forma de presentación muy rara del BIA-ALCL, apenas descrita en la literatura1.
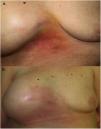
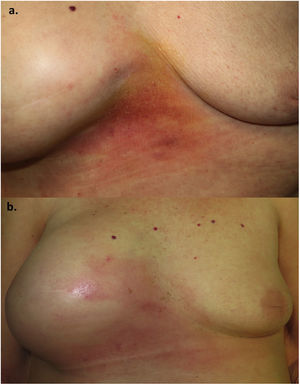
Una mujer de 70 años fue remitida a nuestra consulta por la aparición de una placa eritematosa, indurada y con ligera descamación superficial en zona intermamaria junto con un aumento del volumen de la mama derecha (fig. 1). La paciente había presentado un carcinoma de mama derecha 5 años antes, por lo que fue tratada con mastectomía y reconstrucción mediante una prótesis mamaria, y se encontraba en tratamiento actual con hormonoterapia. En la mamografía de control realizada 4 meses antes no se habían objetivado signos de recidiva, al igual que la ecografía, en la que se observaban ondulaciones con una posible colección periprotésica pero sin hallazgos sospechosos de malignidad. Además, la paciente refería astenia y una pérdida considerable de peso en los últimos meses. Se realizó una biopsia cutánea donde se observó una dermatitis espongiótica con un infiltrado linfohistiocitario perivascular superficial y profundo, sin la presencia de células neoplásicas, con una tinción para citoqueratina 19 y para CD30 negativas.
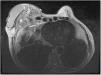
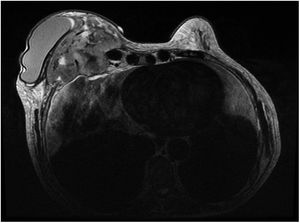
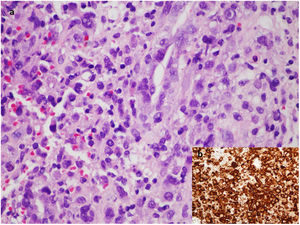
Ante la sospecha de una metástasis cutánea de su cáncer de mama o de una complicación protésica, se solicitó una resonancia magnética en la que se observó una masa retroprotésica con una invasión de la pared torácica hasta el mediastino (fig. 2). La punción del líquido periprotésico mostró unas células neoplásicas de gran tamaño, CD30(+), CD3 (+) y ALK (–), que confirmaron el diagnóstico de BIA-ALCL (fig. 3). Dada la presencia de una enfermedad extramamaria, se administró quimioterapia sistémica (ciclofosfamida, hidroxidaunorubicina y prednisona) y brentuximab, previo al tratamiento quirúrgico con explante de la prótesis y capsulectomía.
a) Imagen microscópica del bloque celular de líquido periprotésico con tinción de hematoxilina/eosina a aumento×60 en la que se observan células neoplásicas de gran tamaño, pleomórficas, dispuestas sueltas o en pequeños grupos discohesivos sobre un fondo de tejido inflamatorio de granulación. b) Estudio de inmunohistoquímica altamente positivo para CD30.
El BIA-ALCL es un trastorno linfoproliferativo producido por células malignas que se encuentran infiltrando la cápsula o en el líquido periprotésico. La edad media al diagnóstico es de 52,5 años y la media de tiempo desde el implante de la prótesis y el diagnóstico del BIA-ALCL es de 9 años2. Se manifiesta como un seroma periprotésico en el 86% de los casos2, aunque también se puede presentar como una masa, un nódulo o una adenopatía, y es muy infrecuente la aparición de lesiones cutáneas1.
En la literatura solo se han descrito 2casos de BIA-ALCL que se manifestaron inicialmente con lesiones cutáneas1,3. Elswick y Nguyen1 describieron un caso de BIA-ALCL que se presentó con un eritema y una tumefacción de la mama acompañado de un aumento de los reactantes de fase aguda en el análisis de sangre. El estudio histológico cutáneo fue negativo para malignidad, por lo que se plantearon que la etiología de las lesiones cutáneas era debida a una infección periprotésica concomitante con el linfoma. No obstante, en el caso publicado por Alcalá et al.3, el hallazgo de células neoplásicas CD30+en la histología de los nódulos cutáneos, resultó la clave diagnóstica para diferenciar el BIA-ALCL de una recidiva de cáncer de mama. Asimismo, en el registro PROFILE2 se ha descrito que 19 de los 186 pacientes del estudio, durante el transcurso de la enfermedad, presentaron lesiones cutáneas asociadas a otros síntomas sistémicos, en 12 de ellos descritas como enrojecimiento de la piel. En el resto, no se especificó el tipo de lesión cutánea, sin realizarse en ninguno de ellos diagnóstico histológico.
A excepción del caso de Alcalá et al., tanto en nuestro caso como en los revisados en la literatura, no hay cambios clínicos ni microscópicos específicos de esta entidad, debiéndose sospechar ante una paciente portadora de prótesis con aumento del volumen mamario y aparición de lesiones cutáneas, principalmente eritema.
Se postula que la etiología del BIA-ALCL es multifactorial, influyendo el tipo de prótesis sobre una base genética predispuesta y una posible sobreinfección crónica periprotésica en forma de biofilm bacteriano4.
Muy recientemente se ha publicado un protocolo clínico para la detección del BIA-ALCL por parte del Ministerio de Sanidad español donde se recomienda realizar inicialmente una ecografía con punción y análisis citológico y microbiológico del líquido periprotésico5. Microscópicamente, se caracteriza por una proliferación de células linfoides muy pleomórficas con abundante citoplasma y un núcleo irregular3. Para confirmar el diagnóstico es necesario realizar un estudio inmunohistoquímico donde, característicamente, todas las células neoplásicas son CD30 (+) y ALK (–)3,6.
Al diagnóstico, el BIA-ALCL se presenta generalmente en forma de una enfermedad localizada y tiene un excelente pronóstico tras la escisión quirúrgica7. La diseminación extracapsular es muy infrecuente, detectándose en la revisión de Brody et al.8 únicamente 18 casos de 173 pacientes, teniendo 9 de ellos un pronóstico fatal8.
Describimos un nuevo caso de BIA-ALCL en estadio avanzado que, además del aumento del volumen mamario, presentó lesiones cutáneas y un síndrome constitucional que requirió tratamiento quimioterápico previo a la cirugía.
Aunque se trata de una condición infrecuente, el número de casos que se han comunicado en los últimos años se ha incrementado de manera exponencial8. Por ello, se debe resaltar la importancia de conocer esta entidad ya que, ante un diagnóstico precoz y el hallazgo de enfermedad localizada, el BIA-ALCL tiene un pronóstico indolente con el explante de la prótesis y la capsulectomía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.