Se han publicado pocos casos de carcinoma espinocelular (CE) de células claras, aunque creemos que es frecuente observar células claras en los CE.
Material y métodosHemos estudiado 249 CE. Analizamos distintas variables clínicas e histológicas. Hemos usado diversas técnicas de inmunohistoquímica (método de inmunoperoxidasa) para valorar si existía diferenciación anexial.
ResultadosObservamos 96 CE con más de un 25 % de células claras. Existe más cantidad de células claras en los CE desarrollados o «no incipientes» y en los derivados de enfermedad de Bowen (EB). Describimos dos patrones histológicos: a) células claras alrededor de las perlas córneas del CE, que se asocia a la existencia de queratosis actínica como lesión previa y a signos indirectos de virus del papiloma humano (VPH) en infundíbulos pilosos, y b) células claras que simulan diferenciación anexial, relacionado con EB como lesión previa. También hemos encontrado 19 carcinomas con verdadera diferenciación anexial.
ConclusionesEs frecuente observar células claras en los CE, aunque solo algunos presentan una gran cantidad. El desarrollo de células claras en los CE sería progresivo y solo aparecería en los CE más desarrollados. Cuando se observan células claras en los CE, se tiende a pensar que existe diferenciación anexial, sin embargo, en la mayoría de casos se trataría solo de EB de células claras que infiltra estructuras anexiales normales. En un pequeño porcentaje de casos (7,6 % en nuestro estudio) sí existe verdadera diferenciación anexial. Por otra parte, el patrón histológico descrito como células claras alrededor de perlas córneas prácticamente nos descartaría dicha diferenciación.
Although few cases of squamous cell carcinoma (SCC) with clear cells have been published, we believe that these cells are often present in SCC.
Material and methodsWe studied 249 SCCs, analyzing a number of clinical and histological variables. Various immunohistochemical techniques (immunoperoxidase method) were used to determine whether adnexal differentiation was present.
ResultsThere were 96 SCCs with a proportion of clear cells of over 25 %. Advanced or established SCCs and SCCs associated with Bowen disease contained a larger proportion of clear cells. We defined 2 histological patterns: a) clear cells around the keratin pearls of SCCs arising from pre-existing actinic keratosis and with indirect signs of human papilloma virus infection in hair follicles; and b) clear cells that simulate adnexal differentiation in lesions arising on pre-existing Bowen disease lesions. There were also 19 carcinomas with true adnexal differentiation.
DiscussionClear cells are frequently observed in SCC, though large numbers of clear cells are present only in certain SCCs. The appearance of clear cells in SCCs is progressive and they are only present in more advanced SCC. The presence of clear cells is suggestive of adnexal differentiation; however, in the majority of cases, their presence is due to infiltration of normal adnexal structures by the cells of pagetoid Bowen disease. True adnexal differentiation exists only in a small percentage of cases (7.6 % in our study). The histological pattern described as clear cells around keratin pearls practically rules out this differentiation.
Kuo1 describió 6 casos de carcinoma espinocelular (CE) de células claras como un subtipo de CE que simula un carcinoma sebáceo. El número de casos publicados de CE de células claras (CEccl) es muy escaso, apenas 12 o 14 casos2-8; nuestra opinión es que probablemente este subtipo de CE esté infradiagnosticado y sea más frecuente de lo que refleja la literatura.
Las células claras es un término descriptivo que hace referencia a la apariencia clara del citoplasma en las tinciones con hematoxilina/eosina (H/E). Algunos autores refieren que las células claras se deberían a depósitos de glucógeno2; otros, basándose en estudios con microscopia electrónica, concluyen que estas células serían el resultado de cambios degenerativos del citoplasma («degeneración hidrópica» 1,5, confluencia de vacuolas5, o bien degeneración de los lisosomas9,10).
Son muchos los tumores cutáneos que pueden presentar células claras, tanto benignos (acantoma de células claras, tricolemoma, hidradenoma de células claras, siringoma de células claras, dermatofibroma de células claras, etc.) como malignos (carcinoma basocelular de células claras, carcinoma sebáceo, hidroadenocarcinoma de células claras, carcinoma tricolemal, porocarcinoma ecrino de células claras, fibroxantoma atípico de células claras, carcinoma mioepitelial de células claras, melanoma de células balonizantes, las metástasis del carcinoma renal, etc.)2-5.
Respecto a la etiopatogenia del CEccl, algunos trabajos 1,8,11 refieren que podría tratarse de diferenciación anexial; 3 de los 6 casos descritos por Kuo 1 habían sido diagnosticados previamente de carcinoma sebáceo. Lee et al11 describen un tumor, indistinguible de un CEccl, pero que en realidad se trataba de un carcinoma tricolemal. Igualmente, Liegl et al8, tras estudiar con microscopia electrónica sus 5 casos de CEccl localizados en el pene, concluyen que se trata de carcinomas con diferenciación glandular.
Por otro lado, la infección por el virus del papiloma humano (VPH) puede provocar vacuolización citoplasmática y cambios similares a los coilocitos, dando un aspecto de célula clara12,13. También se ha descrito que el VPH podría provocar «pseudoqueratinización tricolemal», dando una falsa apariencia de queratinización tricolemal en algunas lesiones12,14.
Material y métodoHemos analizado 248 CE extirpados en el Hospital Vega Baja (Orihuela, Alicante) durante un periodo de 5 años.
Aunque a un mismo paciente se le extirparan varios CE, para nuestro estudio hemos considerado cada uno de ellos como un caso individual. Definimos como células claras aquellas que presentaban un citoplasma amplio, de aspecto «vacío» o «espumoso» con la tinción de H/E. No consideramos como células claras aquellas que únicamente presentaban una tinción citoplasmática eosinófila o anfófila más débil, ni tampoco las células vidriosas del queratoacantoma. Incluimos como CEccl los CE con más de un 25 % de células claras, especificando si presentaban entre un 25–50 %, un 50–75 % o más de un 75 %.
No se incluyeron en el estudio: los CE que podían ser recidivas de CE extirpados previamente, aquellos en los que no se observó relación con la epidermis, los CE localizados en labio, en región ano-genital o en mucosas, ni aquellos CE en que no era posible un buen análisis de la preparación histológica (borde libre tumoral muy escaso, biopsias parciales, curetaje y electrocoagulación, etc.).
Hemos analizado distintas variables clínicas e histológicas para su posterior estudio estadístico. Las variables clínicas analizadas fueron:
- 1.
Edad.
- 2.
Sexo.
- 3.
Localización y localización fotoexpuesta.
- 4.
Pacientes con inmunodepresión conocida.
Obtuvimos las variables histológicas del análisis del tumor y de la zona adyacente al mismo, determinando:
- 1.
Porcentaje de células claras: medición semi-cuantitativa de la cantidad de células claras observada (casos sin células claras, menos de un 25 %, entre un 26 y un 50 %, de un 51 a un 75 %, más de un 75 %). Posteriormente esta variable se reagrupó en CE sin células claras o con menos de un 25 % por un lado, y en más de un 26 % de células claras por otro.
- 2.
Si las células claras se disponían siguiendo algún patrón histológico de distribución (para esta variable consideramos todos los CE con células claras, incluyendo también el intervalo de 0 a 25 % de células claras).
- 3.
Posible lesión preexistente (queratosis actínica, enfermedad de Bowen, queratoacantoma, otros).
- 4.
Presencia de elastosis solar (degeneración basófila del colágeno) y si esta alcanzaba hasta dermis reticular superficial, media o profunda.
- 5.
Tumor incipiente o «poco desarrollado»: consideramos como tumores incipientes los CE que no se «alejan» de la epidermis o de la lesión preexistente y aquellos en que el CE invasor era más pequeño que la lesión preexistente.
- 6.
Signos histológicos indirectos de VPH: existencia de granos de queratohialina más grandes y numerosos (localizados en citoplasma y núcleo), papilomatosis, pseudoparaqueratosis (núcleos redondeados en capa córnea) y/o coilocitosis12,15. También determinamos si estos signos indirectos de VPH se localizaban en los infundíbulos pilosos o en epidermis inter-infundibular. En un mismo caso pueden coexistir varios signos indirectos de infección por VPH o en ambas localizaciones.
Se realizaron varias tinciones inmunohistoquímicas mediante la técnica de inmunoperoxidasa con el fin de descartar y/o confirmar la diferenciación anexial en algunos casos. Usamos la tinción EMA (antígeno de membrana epitelial) cuando pensamos que podía existir diferenciación sebácea (células malignas claras, con citoplasma microvacuolado EMA positivo16, que recuerdan las glándulas sebáceas normales). Usamos la tinción CEA (antígeno carcinoembrionario) y EMA para comprobar si existía diferenciación ductal (existencia de formaciones tipo «luces», CEA o EMA positivas, con cutícula, rodeadas de células malignas o bien luces intracitoplasmáticas unicelulares16,17). En estos casos también usamos la tinción con citoqueratina 7 (CK-7) para descartar diferenciación hacia el ovillo sudoríparo secretor, ecrino o apocrino (positividad en las formaciones luminales 18). Por último, usamos la tinción CD34 cuando sospechamos que podía existir diferenciación tricolemal (queratinización abrupta y células claras con membrana celular gruesa, CD34 positiva19).
También hemos utilizado la tinción inmunohistoquímica p16 para estudiar esta tinción en algunos CE y en sus lesiones preexistentes20.
Como control interno de estas tinciones inmunohistoquímicas hemos utilizado16,17:
- 1.
CEA: conducto excretor de las glándulas ecrinas o apocrinas normales.
- 2.
EMA: las glándulas sebáceas normales, el conducto excretor de las glándulas normales o algunas membranas celulares.
- 3.
CD34: los endotelios vasculares o las estructuras foliculares normales19.
- 4.
p16: las glándulas ecrinas y las células de la matriz folicular y sebácea20.
- 5.
Citoqueratina 7 (CK-7): los ovillos secretores de las glándulas ecrinas y apocrinas normales18.
Los datos fueron procesados mediante el paquete estadístico SPSS 12.0 para Windows.
Realizamos un estudio estadístico para comprobar si existía relación entre algunas de estas variables clínico-patológicas y una mayor o menor cantidad de células claras, o con algún patrón histológico de distribución de las células claras. En un principio comenzamos a valorar si existía relación entre las distintas variables mediante la prueba de Chi-cuadrado de Pearson y mediante el análisis de la varianza (ANOVA). Sin embargo, la mayoría de las relaciones que encontramos dependían de que existieran otras variables. Para evitar esto, realizamos varios análisis de regresión logística. Estos análisis de regresión logística nos permiten calcular la odds ratio (OR) y así estimar la asociación de cada variable de forma independiente, es decir, eliminando la posibilidad de que una variable confunda o dependa de otras21.
Los casos dudosos o que no permitiesen un buen análisis de alguna variable se consideraron como «no valorables» y no se incluyeron en el estudio estadístico.
Técnica de reacción en cadena de la polimerasaSe realizó la técnica de la reacción en cadena de polimerasa (PCR) a 23 lesiones, 17 CE con evidentes signos histológicos indirectos de infección por el VPH, 3 verrugas vulgares y 3 condilomas acuminados genitales (uno de ellos con CE invasor en la base).
Si la técnica era positiva para el ADN del VPH (bien de tipo alfa o mucoso, bien de tipo beta o como los de la epidermodisplasia verruciforme), entonces se llevaba a cabo un tiraje específico del VPH (técnica de singled PCR modificada). Se utilizaron dos controles internos, uno para comprobar que la técnica de PCR estaba bien realizada y otro para comprobar que el ADN de la muestra no se hubiera desnaturalizado («muestra inhibida»). Obtuvimos unos resultados no valorables, ya que 16 de los 23 casos tenían el ADN desnaturalizado («muestras inhibidas»), por lo que no continuamos analizando más casos con PCR.
ResultadosHemos incluido 248 lesiones en nuestro estudio; de las 248 lesiones estudiadas, 19 fueron diagnosticadas de CE con diferenciación anexial (o carcinomas anexiales propiamente dichos). Con el propósito de realizar un estudio más homogéneo desde el punto de vista histológico, se analizó de forma independiente este subgrupo de 19 carcinomas con diferenciación anexial.
Descripción de la muestraEl resto de CE (229 lesiones) correspondía a 199 pacientes (a 15 pacientes se les extirparon 45 CE), aunque en nuestro estudio hemos considerado cada lesión como un caso independiente; 160 CE correspondían a hombres y 69 a mujeres.
La edad media era de 73,4 años y la mayoría de las lesiones (un 87 %) estaban localizadas en zonas fotoexpuestas, siendo la localización más frecuente la cabeza y el cuello.
En casi todos los CE se objetivó una intensa elastosis solar (esta llegaba hasta dermis reticular media o profunda en 182 CE, un 82 %). En la mayoría de CE se observó una queratosis actínica (QAct) como lesión previa (186 lesiones); observamos una enfermedad de Bowen (EB) en 25 CE y queratoacantoma (QTm) en 39 CE. En algunos casos coexistían varias lesiones preexistentes (en 31 CE coexistían QAct y QTm y en 5 se observó QAct y EB). En prácticamente todos los CE (224 CE) observamos signos histológicos indirectos de infección por VPH; únicamente en 5 casos no los observamos. En la mayoría de las lesiones coexistían varios de estos signos indirectos atribuibles a infección por VPH.
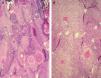
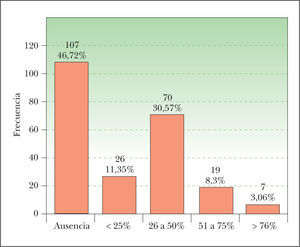
Porcentaje de células clarasObservamos células claras en 122 CE (fig. 1). Hay que destacar únicamente que la mayoría de los casos corresponde al intervalo de 26 a 50 % de células claras, mientras que solo 7 lesiones (3,06 %) presentan más de un 75 % de células claras. En 107 CE no observamos células claras.
Se observa relación independiente entre:
- 1.
Los CE con menos de un 25 % de células claras se relacionan con QTm como lesión preexistente; odds ratio = 15,63 (intervalo de confianza [IC]95%: 3,12-76,92), y en ellos observamos signos indirectos de VPH localizados en epidermis inter-infundibular; OR = 6,45 (IC95 %: 2,79-14,93).
- 2.
Los CE con más de un 26 % de células claras se relacionan con EB como lesión preexistente; OR = 7,550 (IC95 %: 2,205-25,854). Además suelen ser tumores desarrollados o «no incipientes»; OR = 2,56 (IC95 %: 1,29-5,10).
- 3.
Si analizamos los CE con o sin células claras (en vez de menos y más de un 25 %) se observa relación con las mismas variables.
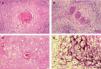
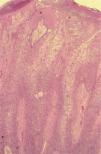
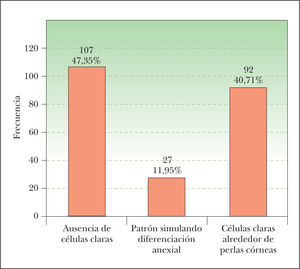
Para describir el patrón histológico de distribución de las células claras hemos considerado todos los CE con células claras (incluyendo el intervalo de 0 a 25 % de células claras). Hemos encontrado dos patrones histológicos (fig. 2): un primer patrón con células claras distribuidas alrededor de perlas córneas del CE (92 lesiones, 40,71 %) (figs. 3, 4 y 5B) y un segundo patrón con células claras y aparente diferenciación anexial (27 lesiones, 11,95 %) (fig. 6). Hubo 3 casos que no se podían incluir en ninguno de estos patrones histológicos. Por último, en 107 lesiones, un 47,35 %, no observamos células claras.
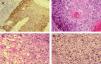
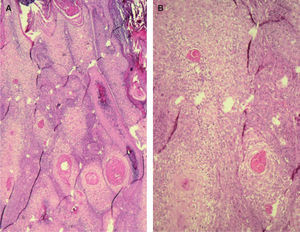
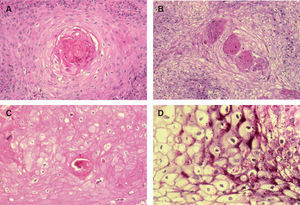
A. Detalle de células claras alrededor de perlas córneas, hematoxilina/eosina (H/E) ×200. B. Carcinoma espinocelular (CE) en axila similar al patrón histológico de células claras alrededor de perlas córneas. H/E ×200. C. CE en glande similar también a este patrón histológico. Coilocitosis, H/E × 200. D. Coilocitosis en un CE de células claras. PAS positivo remarcando el halo perinuclear. PAS ×400.
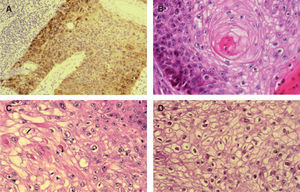
A. Positividad con tinción p16 en enfermedad de Bowen infiltrando estructuras anexiales normales, p16 ×200. B. Patrón de células claras alrededor de perlas córneas similar a diferenciación tricolemal. Hematoxilina/eosina (H/E) ×400. C. Células claras en CE simulando células sebáceas. Hematoxilina/eosina (H/E) ×400. D. Células claras con membrana celular gruesa, similares a las células tricolemales. H/E ×400.
Observamos relación independiente entre:
- 1.
El patrón histológico descrito como «aparente diferenciación anexial» se relaciona con EB como lesión preexistente; OR = 166,67 (IC95 %: 27,03-1.000).
- 2.
El patrón histológico descrito como «células claras alrededor de perlas córneas» se relaciona con QAct como lesión previa; OR = 12,877 (IC95 %: 3,375-49,133), y con la observación de signos indirectos de VPH localizados en los infundíbulos pilosos; OR = 9,547 (IC95 %: 1,787-50,994).
No hemos encontrado relación significativa entre algún patrón histológico o entre una mayor o menor cantidad de células claras y el resto de variables clínico-patológicas estudiadas, y cuando hemos encontrado otras relaciones significativas (prueba de Ji-cuadrado), en realidad dependían de la existencia de otras variables (como EB o QAct), según pudimos comprobar con los análisis de regresión logística.
Patrón histológico «aparente diferenciación anexial» y tinción inmunohistoquímica p16Excede los objetivos de este trabajo analizar los hallazgos obtenidos con la tinción inmunohistoquímica con p16, tanto en CE como en sus principales lesiones preexistentes (QAct, QTm y EB); únicamente queremos destacar que observamos una intensa positividad (nuclear y citoplasmática) con la tinción de p16 en 25 de 28 lesiones bowenoides estudiadas: 14 de 16 EB positivas y 11 de 12 QAct bowenoides positivas. Los CE invasores derivados de estas lesiones bowenoides positivas también mostraban una tinción positiva con la tinción p16.
Tanto las células de las EB como las de las QAct bowenoides invadían anejos normales; esta invasión resaltaba con la tinción de p16 (fig. 5A). De los 27 CE con patrón histológico de «aparente diferenciación anexial», 22 correspondían a anejos normales invadidos por las células bowenoides (esto fue objetivado tras la tinción con p16, positiva en las células bowenoides). Los otros 5 CE que presentaban este patrón histológico correspondían a tumores con «dudosa» o «aparente» diferenciación anexial, pero que no fue demostrada tras utilizar varias tinciones inmunohistoquímicas (CEA, EMA, CD34, CD10 y CK-7), por lo que no fueron incluidos en el subgrupo de carcinomas con diferenciación anexial.
Carcinomas con diferenciación anexialRespecto al subgrupo de 19 carcinomas en que sí que demostramos diferenciación anexial, únicamente resaltamos que en estos 19 carcinomas se sospechó diferenciación anexial (de tipo luminal-ductal, sebácea, tricolemal) con la tinción H/E, diferenciación que fue confirmada con las tinciones inmunohistoquímicas. Encontramos 12 tumores con diferenciación luminal y sebácea, por lo que concluimos que se trataba de una diferenciación sebo-apocrina, basándonos en el origen embriológico común de la unidad pilo-sebáceo-apocrina22. Otros 5 carcinomas con diferenciación luminal se diagnosticaron de porocarcinomas ecrinos (dos casos), y 3 carcinomas con diferenciación hacia el ovillo sudoríparo secretor (CK-7 positivos)18. También encontramos un carcinoma tricolemal y un quiste tricolemal proliferante maligno, ambos positivos con la tinción CD3419.
La mayoría de estos carcinomas anexiales tenía una gran cantidad de células claras (más de un 26 % en 15 carcinomas, más de un 51 % en 10 de ellos), datos significativamente superiores si los comparamos con el resto de CE de nuestro estudio (p = 0,002 y p = 0,000). En cuanto al patrón histológico, 15 de estos casos correspondían al patrón tipo diferenciación anexial, un caso al de células claras alrededor de perlas córneas y otro no tenía células claras; dos casos no tenían un patrón histológico bien definido.
Respecto al resto de variables clínico-patológicas, comparamos este subgrupo de 19 carcinomas con el resto de CE (229 lesiones), pero no observamos diferencias significativas. Unicamente existen diferencias en que ninguno de estos carcinomas era incipiente (p = 0,000).
Tinción PAS y PAS diastasaSolamente hemos revisado 17 CEccl que ya tenían realizadas con anterioridad las tinciones PAS y PAS diastasa: 13 casos (76,5 %) eran positivos con la tinción PAS (PAS diastasa negativas). Observamos positividad citoplasmática difusa en la mayoría del tumor, en 9 de 11 lesiones bowenoides (6 EB y 5 QAct bowenoides). El resto corresponde a 4 de 6 CEccl con patrón histológico de células claras alrededor de perlas córneas, si bien la positividad en estos casos era focal (solo en algunas áreas del tumor) y en la zona periférica del citoplasma celular, resaltando el halo perinuclear de estas células (coilocitosis)12,15 (fig. 4D).
DiscusiónDescripción de la muestraLos datos clínicos de los CE estudiados son superponibles a los que aparecen en otros estudios previos: predominio de varones, de edad avanzada (la edad media, 73,4 años, es ligeramente superior a la de otros trabajos23). La localización en zonas fotoexpuestas (un 87 % en nuestra muestra, aproximadamente un 90 % en otros trabajos23,24) o la localización más frecuente en la cabeza y el cuello, también son datos similares a los de otros estudios25. Igualmente, en nuestro trabajo la lesión previa predominante es la QAct (observamos QAct aislada o junto a otras lesiones previas en un 82,67 %), y en otros estudios encuentran QAct en la epidermis adyacente al CE invasor en un 72 %26 o un 82,2 %27 de los casos. La existencia de QAct como lesión predominante y la gran elastosis solar observada podría indicarnos el tipo de exposición solar de estos pacientes: de acuerdo con otros estudios, estos CE se relacionarían con exposiciones solares crónicas y mantenidas, o «exposición solar de tipo laboral»28.
En casi todos los CE hemos observado signos histológicos atribuibles al VPH; esta alta incidencia de signos de VPH podría tener relación con los signos de intenso daño solar crónico observados, y la consiguiente inmunodepresión, al menos localizada, que se podría asociar a este daño solar crónico29,30. Además, muchos de estos signos indirectos de VPH podrían corresponder a VPH de tipo cutáneo, no oncogénicos. Por otra parte, estos hallazgos podrían apoyar el posible papel del VPH en la oncogénesis del CE, sobre todo en pacientes inmunodeprimidos (aunque también en inmunocompetentes con un intenso daño solar crónico, como los de nuestro estudio)29,30. Lamentablemente no hemos podido demostrar la existencia del VPH mediante PCR, posiblemente por deficiencias en la técnica empleada o en las muestras (la mayoría tenía el ADN desnaturalizado)30.
Porcentaje de células clarasExisten muy pocos casos de CEccl publicados en la literatura; Kuo1 estudia 229 CE y solo encuentra 6 CEccl (un 2,6 %). Estos 6 casos están compuestos por células claras casi en su totalidad, ya que no consideró como CEccl los que tenían células claras de manera focal. En nuestro estudio (sin considerar el subgrupo de 19 carcinomas con diferenciación anexial) hemos observado células claras en los CE con bastante frecuencia (122 CE con células claras, un 53,3 %). Sin embargo, solo hemos encontrado 26 CE (11,36 %) con más de un 50 % de células claras, y solo 7 (3,06 %) con más de un 75 % de células claras. Esta proporción de tumores con gran cantidad de células claras es superponible a la encontrada por Kuo1. En definitiva, pensamos que es frecuente observar células claras en los CE, aunque solo algunos de ellos presentan una gran cantidad de células claras.
Los CE invasores derivados de EB presentarían más cantidad de células claras. La EB de células claras se produce por cúmulos de glucógeno31, igual que en algunos de nuestros casos (como pudimos comprobar con la tinción PAS). Los CE que aparecen en la profundidad de algunos QTm o aquellos con signos de infección por el VPH en epidermis inter-infundibular presentarían menos cantidad de células claras (más bien se trataría de CE sin células claras). En este sentido, durante la observación de las preparaciones histológicas, observamos que tanto los CE derivados de QTm como aquellos con signos indirectos de infección por el VPH similares a una verruga plana («signos de infección por el VPH en epidermis inter-infundibular») o a una verruga vulgar, tendían a ser CE de tipo «clásico» o queratinizantes, con poca cantidad o sin células claras.
La existencia de menos células claras en los CE incipientes y de más cantidad en los CE avanzados nos sugiere que el desarrollo de células claras en los CE (bien sea por acumulación de glucógeno, por efectos citopáticos del VPH o por otras causas) sería un proceso progresivo que precisa tiempo y solo aparecería en los CE más desarrollados.
Patrón histológico de células claras alrededor de las perlas córneasEn nuestro estudio, la mayoría de CE con células claras corresponde al patrón histológico descrito como células claras alrededor de las zonas queratinizantes y/o de las perlas córneas (92 lesiones, 40,71 %) (figs. 3, 4 y 5A). Este patrón histológico se asocia con la existencia de signos histológicos de infección por el VPH en los infundíbulos pilosos y de QAct como lesión previa. Estas asociaciones nos podrían indicar que existe relación entre este patrón histológico y la radiación solar, ya que, por un lado, se ha descrito un incremento del VPH en los folículos pilosos (y por tanto en infundíbulos) en relación con la exposición solar32,33, y por otro, las QAct se localizan habitualmente en zonas fotoexpuestas31. Sin embargo, dos de los casos con este patrón histológico estaban localizados en zonas no fotoexpuestas (axila y tronco), por lo que no tenían elastosis solar y sí evidentes signos indirectos de infección por el VPH (fig. 4B). Además, este patrón es similar histológicamente a los CE «basaloides» de vulva, que se ha demostrado que se asocian con la existencia del VPH13. Para comprobar esto analizamos 9 CE localizados en la región ano-genital y, efectivamente, 7 de ellos eran similares a los descritos como patrón histológico de células claras alrededor de las perlas córneas (fig. 4C). Todo esto nos sugiere que la posible existencia de VPH sería un factor imprescindible para el desarrollo de este patrón histológico, mientras que la QAct o el daño solar crónico sería un factor sobreañadido.
Por otro lado, este patrón histológico de células claras alrededor de perlas córneas puede tener cierta similitud con la queratinización tricolemal o con los cambios que se observan en el tricolemoma16,17,19 (fig. 5B y D) (los casos con dudosa diferenciación tricolemal se podrían confirmar o descartar con la tinción CD34)19. Se ha descrito que los VPH pueden provocar «pseudoqueratinización tricolemal», dando una falsa apariencia tricolemal a algunas lesiones12,14. Es posible que el aspecto tricolemal de algunos CE que presentan este patrón histológico esté provocado por la existencia del VPH. En nuestro estudio, este patrón se asocia con la existencia de signos indirectos de infección por el VPH en infundíbulos, lo que apoyaría esta hipótesis. Además, la tinción PAS era positiva en 4 de 6 CEccl que presentaban este patrón histológico (positividad alrededor del halo perinuclear, en áreas de coilocitosis del tumor), lo que apoyaría la existencia de infección por el VPH en estos CEccl (fig. 4D). En definitiva, la mayoría de células claras de nuestro estudio se asocia con este patrón histológico y sería el resultado de efectos citopáticos de determinados VPH (bien coilocitosis o vacuolización citoplasmática12,15, bien pseudoqueratinización tricolemal12,14).
Patrón histológico de aparente diferenciación anexial. Carcinomas anexialesDescribimos este patrón en 27 CEccl que parecía que tenían diferenciación anexial (no confirmada posteriormente), basándonos en el hallazgo de luces rodeadas de células malignas, o áreas con aparente diferenciación sebácea o tricolemal16,17 (fig. 6). Tras la tinción inmunohistoquímica con p16 (positiva en la mayoría de lesiones bowenoides, igual que en otros estudios34), comprobamos que prácticamente todos estos casos correspondían a EB o QAct bowenoide infiltrando estructuras anexiales normales y, por tanto, solamente simulaban diferenciación anexial (fig. 5A). Aunque esta observación podría parecer lógica, en algunos tumores comprobamos con la tinción p16 cómo las células bowenoides invadían conductos sudoríparos, rodeando la luz normal (este tipo de invasión había sido interpretado inicialmente como posible diferenciación luminal). Es decir, la tinción con p16 nos permitiría diferenciar si se trata de verdadera diferenciación anexial o bien de células bowenoides infiltrando anejos normales.
Además, las células claras parecen células sebáceas o tricolemales en algunos casos (fig. 5C y D); este patrón histológico se asocia con la existencia de EB y en ella existen más cantidad de células claras. Todo esto también favorecería que este patrón histológico aparente diferenciación anexial.
En definitiva, los CE que aparentaban diferenciación anexial correspondían casi en su totalidad a EB o QAct bowenoide, ya que estas lesiones se asocian con más cantidad de células claras e infiltran estructuras anexiales normales. Ahora bien, los 19 carcinomas en los que verdaderamente existía diferenciación anexial también presentaban una mayor cantidad de células claras. Es decir, cuando se observan bastantes células claras en un CE puede tratarse de una EB simulando diferenciación anexial, pero habría que descartar que se trate verdaderamente de un carcinoma anexial.
Por otra parte, en nuestro trabajo, la observación del patrón histológico descrito como células claras alrededor de las perlas córneas prácticamente descartaría que exista diferenciación anexial (independientemente de la cantidad de células claras observada): de los 92 CE que presentaban este patrón histológico, solo en 3 casos (un 3,26 %) sospechamos que pudiera existir diferenciación anexial (no confirmada posteriormente); asimismo, en el subgrupo de los 19 carcinomas anexiales, solo uno de ellos presentaba hallazgos similares al patrón de células claras alrededor de perlas córneas. En cualquier caso, si existen signos histológicos de probable diferenciación luminal, tricolemal y/o sebácea, se deberían realizar tinciones inmunohistoquímicas para confirmarla o descartarla16-19. La importancia clínica de todo esto es que los carcinomas con diferenciación anexial podrían tener un comportamiento clínico más agresivo, con tendencia a recidivar o a metastatizar (como el porocarcinoma35 o el carcinoma sebáceo36,37), o bien asociarse a un pronóstico excelente pese a la apariencia histológica (como el carcinoma tricolemal)38.
En nuestro estudio, de las 248 lesiones analizadas, 19 correspondían a carcinomas con diferenciación anexial, un 7,66 %. Desde un punto de vista metodológico, puede ser discutible la decisión de estudiar estos 19 carcinomas como un subgrupo independiente, aunque no queríamos analizar estos carcinomas anexiales con el resto de CE. Como son tumores histológicamente diferentes, pensamos que la relación con las diversas variables también podía ser diferente y que podría «alterar» los resultados de nuestro estudio. Posteriormente comprobamos que no existen diferencias significativas entre este subgrupo y el resto de CE en cuanto a la mayoría de variables clínico-patológicas, con la excepción de que estos tumores presentaban más cantidad de células claras; esto podría tener relación con que ninguno de ellos era incipiente (igual que ocurre en los CEccl, el desarrollo de células claras en estos tumores también precisaría tiempo y, por tanto, los tumores más desarrollados o «no incipientes» tendrían más cantidad de células claras).
En resumen, la observación de células claras, por su aspecto histológico, induce a pensar que pueda existir diferenciación anexial en un CE. Sin embargo, en la mayoría de los casos no es así, sino que se trata de una EB infiltrando anejos normales, como objetivamos tras la tinción inmunohistoquímica con p16; además, la EB se asocia a más cantidad de células claras, lo que aumenta la apariencia anexial de estos casos. Por otra parte, el patrón histológico descrito como células claras alrededor de las perlas córneas prácticamente descartaría que exista diferenciación anexial, independientemente de que se observe una mayor o menor cantidad de células claras. Hemos encontrado 19 carcinomas con verdadera diferenciación anexial (un 7,66 %), que además presentaban más cantidad de células claras que el resto de CE. Puesto que el pronóstico clínico de estos carcinomas con diferenciación anexial podría ser diferente al de los CE35-38, consideramos que es importante descartarlos.
Por último, serían necesarios más estudios, con un tamaño muestral mayor, a ser posible multicéntricos o de tipo prospectivo, para comprobar nuestros resultados.
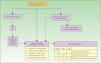
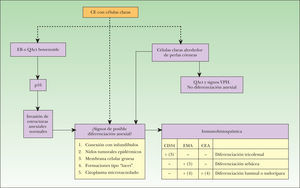
En la figura 7 exponemos un posible algoritmo diagnóstico en los CE con células claras.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Este trabajo recibió el Premio de investigación «August C. Stiefel» 2007-2008.