INTRODUCCIÓN
Trichosporon beigelii fue descrito por Beigel en 1865 como el agente etiológico de la piedra blanca, una infección micótica superficial del tallo del pelo. No obstante, puede manifestarse como una infección diseminada, habitualmente mortal. La mayoría de los casos sistémicos han sido descritos en huéspedes inmunodeprimidos con neutropenia, particularmente con neoplasias hematológicas.
Trichosporon es un género de blasidiomiceto filogenéticamente cercano a Cryptococcus con el que comparte polisacáridos de la cápsula y antígenos comunes. Se distingue morfológicamente por hifas verdaderas y artroconidias (1). Existe confusión terminológica en la literatura ya que hasta la clasificación de Gueho en 1992 (1) el agente etiológico de las trichosporinosis sistémicas se denominaba T. beigelii. Este nombre es incorrecto, ya que las manifestaciones localizada y diseminada de trichosporinosis están causadas por distintas especies patógenas. Éstas son: T. ovoides, T. inkin, T. asahii, T. asteroides (Fissuricella filamenta), T. cutaneum y T. mucoides. Clínicamente se manifiestan como piedra blanca, micosis superficiales y diseminadas (1). El T. asahii es el responsable de los casos diseminados, que evolucionan fatalmente en situación de neutropenia y ausencia de fagocitosis (2).
Se describe un caso de infección sistémica por T. asahii en una paciente de 40 años afecta de una leucemia mieloide aguda de evolución fatal.
DESCRIPCIÓN DEL CASO
Mujer de 40 años que padecía una leucemia mieloide aguda tipo M2 de 1 año de evolución, sometida a trasplante autólogo de medula ósea. A los 3 meses del trasplante presentó infección por Pseudonona aureoginosa en el catéter de Hickman, por lo que se le retiró y se realizó tratamiento con ciprofloxacino durante 14 días. Ingresó por dolor en el trayecto del catéter, petequias en miembros inferiores y sospecha de recidiva. Se instauró tratamiento con ciprofloxacino y evolucionó con febrícula, disfagia y mejoría de la zona del catéter. El noveno día se retiró el ciprofloxacino y comenzó con fiebre alta, iniciándose tratamiento con antibioterapia empírica. El día decimoprimero, ante la confirmación de recidiva de su leucemia, se realizó tratamiento citostático con citarabina y daunomicina. El día vigésimo primero reapareció la fiebre alta tras 4 días afebril; en la radiografía de tórax se apreció un leve infiltrado intersticial bilateral. Se realizaron cultivos de sangre y esputo y se añadió al tratamiento anfotericina a dosis profilácticas. El día vigésimo tercero se informó de la presencia de levaduras en el esputo y la anfotericina se aumento a dosis de 1 mg/kg.
La paciente nos refirió que 3 semanas antes del ingreso había aparecido una lesión cutánea en maléo-lo externo de pie derecho, después en labio superior y otras lesiones, 3 días antes del ingreso, en brazos y piernas.
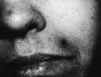
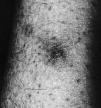
En la exploración física se observaron máculas purpúricas y pápulas con el centro hemorrágico y necrótico en cara (Fig. 1), antebrazos y piernas (Fig. 2) y úlceras necróticas en maléolo externo derecho y labio superior. Las lesiones eran escasas y asintomáticas.
FIG. 1.--Pápulas necróticas en zona perioral y nasal.
FIG. 2.--Pápula necrótica en pierna derecha.
A su ingreso la fórmula leucocitaria mostró 1,63 × 109/l leucocitos con 0,11 ×109/l neutrófilos y la biopsia de médula ósea confirmó la recidiva de la neoplasia. Tras el tratamiento citostático estaba en aplasia con 0,059 ×109/l leucocitos y 0 neutrófilos. En la radiografía de tórax se apreció un infiltrado intersticial bilateral, con cultivo de una levadura en el esputo.
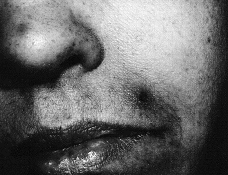
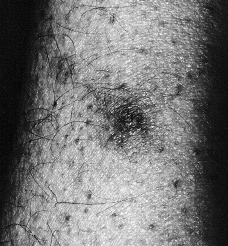
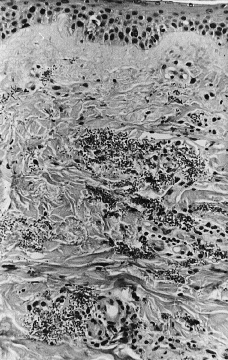
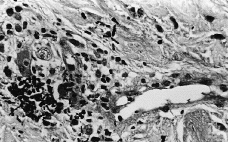
Se realizó biopsia cutánea para estudio histopatológico y cultivo. En 48 horas se recibieron los cultivos en sangre y piel con crecimiento de Trichosporon asahii, por lo que se añadió fluconazol al tratamiento. La paciente quedo afebril, pero se mantuvo la pancitopenia, con disnea y anuria, falleciendo 5 días después. El estudio histológico confirmó el tromboembolismo micótico que ocupaba la luz y pared vascular, que con la tinción de PAS ponía de manifiesto numerosas hifas y conidias (Figs. 3 y 4).
FIG. 3.--Presencia de abundantes hifas y esporas en zonas perivasculares de dermis media.
FIG. 4.--Hifas en luz vascular y zona extravascular. (PAS, ×400.)
DISCUSIÓN
La infección diseminada por Trichosporon es una micosis reconocida cada vez con más frecuencia en pacientes neutropénicos, especialmente con neoplasias hematológicas, tratados con citostáticos (3-6).
El hábitat natural del Trichosporon es el suelo, el agua estancada y libre y las excreciones de los animales. También puede encontrarse en la flora de la piel normal y aparato respiratorio. Se ha aislado en homosexuales en el 15,5% de cultivos de heces. Coloniza a un 3,7% de los pacientes neutropénicos y es posible cultivarlo en las muestras de heces, orina y piel. En un 23% de éstos causa diseminación (1). Las puertas de entrada más probables son el tracto digestivo y el aparato respiratorio, cuyos epitelios quedan dañados después del tratamiento citostático (4, 5). La piel es otra vía de entrada a través de catéteres de Hickman y cánulas periféricas (6). La presentación más frecuente es en pacientes con neoplasias hematológicas, que han recibido terapia mielosupresora y se encuentran en neutropenia (3-6, 7). En los casos sin neutropenia se ha descrito endocarditis en pacientes sometidos a cirugía de prótesis valvular (8) y drogodependientes por vía intravenosa (9) y peritonitis en pacientes dializados (10). La hemacromatosis, con la sobrecarga de hierro que conlleva, es otro factor de riesgo reconocido para la infección, ya que el T. asahii crece con más facilidad en medios con suplemento de hierro (4). Los casos descritos en pacientes con SIDA son escasos y están relacionados con la neutropenia, en el curso de tratamientos por neoplasias asociadas (11, 12) y con relaciones homosexuales (13).
La presentación clínica de la infección está determinada por el número de polimorfonucleares del paciente. Con neutropenia, la diseminación es lo habitual y se manifiesta sin síntomas específicos, con fiebre que no responde a la antibioterapia empírica. Con un número adecuado de polimorfonucleares, la neumonia es la infección más frecuente; ésta puede quedar limitada o puede producir fungemia con implicación de otros órganos vitales que, por orden de frecuencia, son el riñón, hígado y bazo (3).
La afectación cutánea se ha encontrado en el 10,5 al 55% de los casos en forma de pápulas y nódulos purpúricos y necróticos o de exantema maculopapuloso difuso en tronco y extremidades (3-5).
El diagnóstico de trichosporinosis diseminada no se sospecha en el 26% de los pacientes, realizándose en el examen post morten (3). Los hemocultivos son positivos en el 50-100% de los casos diseminados (3, 5). Si existen lesiones en la piel, el estudio histológico y cultivo de la pieza son diagnósticos (3-6). Del mismo modo muestras extraídas de pulmón, riñón e hígado han resultado positivas (3). No existen pruebas serológicas especificas. Recientemente con técnicas de la reacción en cadena de la polimerasa se ha detectado el ADN específico de T. asahii y T. mucoides en un 64% de casos diseminados (14, 15). Mediante inmunohistoquímica se ha identificado el Trichosporon en cortes de tejidos usando antisuero de conejo (16).
El tratamiento de la trichosporinosis diseminada es inútil si la neutropenia no se remonta, siendo su pronóstico infausto (7, 17, 18). De esta forma el Trichosporon se ha hecho resistente a la anfotericina y a los antimicóticos azólicos utilizados (1-7). Nuevas moléculas, como el triazol D0870, se encuentran actualmente en investigación (19). Futuras estrategias de tratamiento van dirigidas a aumentar el número de granulocitos mediante transfusiones y uso de factores estimulantes de las colonias de granulocitos y de granulocitos macrófagos (5).