Para el control de la lesión inflamatoria de la dermatitis atópica, y secundariamente del prurito, se utilizan corticosteroides tópicos, pero su empleo está limitado por las reacciones adversas.
ObjetivosEl objetivo primario del estudio fue evaluar si el tratamiento diario con extracto de Polypodium leucotomos permitiría reducir el uso de corticosteroides tópicos en niños y adolescentes con dermatitis atópica. Secundariamente se valoró el consumo de antihistamínicos orales, así como la evolución de la enfermedad.
Pacientes y métodosSe ha realizado un ensayo clínico en fase iv, multicéntrico, aleatorizado y doble ciego de extracto de Polypodium leucotomos, controlado con placebo, en 105 pacientes de 2 a 17 años de edad, con dermatitis atópica de intensidad moderada e indicación de corticosteroides tópicos. Los pacientes recibieron durante 6 meses extracto de Polypodium leucotomos o placebo por vía oral añadidos al protocolo terapéutico habitual, y se calculó el porcentaje de días en que se utilizaban corticosteroides tópicos u otros tratamientos para la dermatitis atópica.
ResultadosEl extracto de Polypodium leucotomos redujo de modo no significativo el uso de corticosteroides tópicos (11±12% de días), comparado con placebo (12±11%). El porcentaje de días en los que los pacientes requirieron antihistamínicos orales fue significativamente menor con extracto de Polypodium leucotomos (mediana de 4,5% días) que con placebo (13,6%) (p=0,038). También se redujo el porcentaje de pacientes que tomaron antihistamínicos orales.
ConclusionesEl tratamiento prolongado con extracto de Polypodium leucotomos aporta beneficios relevantes para los pacientes en edad pediátrica con dermatitis atópica que precisan tratamiento farmacológico para controlar la lesión inflamatoria y reducir el prurito.
Topical corticosteroids are used to treat inflammation and relieve itching in atopic dermatitis, but their use is limited by adverse reactions.
ObjectivesThe main aim of this study was to investigate whether daily treatment with Polypodium leucotomos extract would reduce the use of topical corticosteroids in children and adolescents with atopic dermatitis. We also analyzed oral antihistamine use and changes in disease severity.
Patients and methodsWe performed a phase IV randomized, double-blind, placebo-controlled, multicenter trial involving 105 patients aged between 2 and 17 years who were receiving topical corticosteroids to treat moderate atopic dermatitis. The patients were randomized to receive, in addition to their standard treatment, Polypodium leucotomos extract or placebo (both in capsule form) for 6 months. The percentage of days on which topical corticosteroids and other atopic dermatitis treatments were used was calculated.
ResultsUse of Polypodium leucotomos extract did not significantly reduce the mean (SD) percentage of days on which topical corticosteroids were used (11% [12%] vs 12% [11%] for placebo). A significant reduction was, however, observed for oral histamine use (median percentage of days, 4.5% in the Polypodium leucotomos group and 13.6% in the placebo group [P= .038]). The percentage of patients who used oral antihistamines was also lower in the Polypodium leucotomos group.
ConclusionLong-term treatment with Polypodium leucotomos extract has benefits for children and adolescents with atopic dermatitis who require pharmacologic treatment to reduce inflammation and relieve itching.
La dermatitis atópica es una enfermedad inflamatoria crónica de la piel, caracterizada por prurito intenso, piel seca, inflamación y exudado, que frecuentemente se asocia con asma, rinitis alérgica, alergia a alimentos e infecciones secundarias recurrentes de la piel; los primeros síntomas se desarrollan habitualmente durante la infancia, y aproximadamente el 50% de los casos se diagnostica en el primer año de vida1–3. En los países desarrollados afecta aproximadamente al 10-15% de los niños menores de 5 años en algún momento, y la prevalencia en la edad infantil es del 10 al 30%2,4. Aunque la enfermedad suele ser de escasa gravedad, puede alterar significativamente la calidad de vida de los niños y los adultos; su impacto familiar y económico puede ser superior al de la psoriasis y equivalente a otras patologías graves como la diabetes mellitus de comienzo temprano1,2,4,5.
El tratamiento de la dermatitis atópica está relativamente consensuado en nuestro país1,2,6–8. En términos generales, los objetivos del tratamiento son reducir el prurito, controlar la lesión inflamatoria y prevenir las recaídas. Para controlar el prurito se utilizan antihistamínicos H1 como tratamiento de primera elección. Para el control de la lesión inflamatoria se utilizan corticosteroides tópicos en administración diaria durante la fase de brote o exacerbación aguda, e inhibidores de la calcineurina en diferentes pautas1,2,6,7. Para prevenir las recidivas se utilizan recomendaciones higiénico-dietéticas, tratando de evitar el contacto con desencadenantes y alérgenos, incluidos alimentos, así como desencadenantes inespecíficos tales como el calor y la humedad excesivos.
El empleo de corticosteroides tópicos puede estar limitado o restringido por las reacciones adversas en el lugar de administración1,2,6–9. También se han descrito, con mucha menor frecuencia, efectos adversos sistémicos de mayor gravedad6,10. Aproximadamente el 70-80% de los padres y cuidadores de niños con eczema atópico están preocupados por los efectos adversos de los corticosteroides tópicos, lo que reduce la adherencia al tratamiento: aproximadamente el 25% de ellos no aplican los corticosteroides tópicos por la ansiedad que les origina6. Como alternativas a los corticosteroides se han desarrollado nuevos agentes farmacológicos para el tratamiento de la inflamación, como los inhibidores de calcineurina en administración tópica, pero aún existen dudas sobre la seguridad de estos productos en tratamientos a largo plazo11.
El extracto de Polypodium leucotomos es un producto farmacológico autorizado y comercializado en España desde hace años, y está indicado para el tratamiento de la dermatitis atópica, tanto en adultos como en niños, sin limitación de edad. El propósito de este ensayo clínico es evaluar si la administración diaria de extracto de Polypodium leucotomos, añadido al tratamiento habitual, puede reducir el uso de corticosteroides tópicos y de antihistamínicos en el tratamiento de la dermatitis atópica moderada en pacientes de 2 a 17 años de edad que precisan estos medicamentos por presentar brotes de la enfermedad.
MetodologíaPacientes y aleatorizaciónSe ha realizado un ensayo clínico en fase iv, multicéntrico, aleatorizado y doble ciego de extracto de Polypodium leucotomos controlado con placebo administrado por vía oral durante 6 meses. Se ha realizado en 9 centros de la Comunidad Valenciana (ver la composición del Grupo de Trabajo de Anapsos en Dermatitis Atópica en el anexo 1). La aleatorización fue 1:1, realizada mediante un programa informatizado previamente al estudio, y estratificada por centros. Los Comités Éticos de Investigación Clínica correspondientes revisaron y aprobaron el protocolo (EudraCT 2008-006422-33), que recibió la autorización preceptiva de la Agencia Española de Medicamentos y Productos Sanitarios y cumple las normas éticas de la Declaración de Helsinki de 2008. Todos los padres o tutores legales, y los mayores de 12 años, dieron su consentimiento por escrito antes de ser incluidos en el estudio.
Los pacientes debían tener una edad igual o superior a 2 años y ser menores de 18 años, y cumplir los criterios diagnósticos de Hanifin y Rajka de dermatitis atópica12. Para valorar la gravedad del proceso se ha utilizado el índice Scoring Atopic Dermatitis (SCORAD)13. En la realización de este estudio los pacientes debían presentar una puntuación de 20 a 40, ambos inclusive, en el índice SCORAD y, además, debían utilizar o presentar indicación de uso de corticosteroides tópicos para el tratamiento de los brotes de dermatitis atópica.
Criterios de exclusiónLos criterios principales de exclusión fueron: embarazo o lactancia; tratamiento actual con fototerapia para la dermatitis atópica; tratamiento en los 2 meses previos al estudio con extracto de Polypodium leucotomos, corticosteroides sistémicos, otros inmunosupresores sistémicos o citostáticos; tratamiento con antimicrobianos sistémicos en los 4 días previos al estudio; fiebre; enfermedades alérgicas graves; patologías relacionadas con procesos de inmunodeficiencia o cáncer; contraindicación para cualquiera de los medicamentos en estudio según lo establecido en sus fichas técnicas; alergia conocida a parabenos; otras patologías dermatológicas que pudieran dificultar la evaluación de la dermatitis atópica o precisasen el empleo continuado de corticosteroides tópicos; y pacientes que hubiesen participado en estudios de investigación con fármacos en los 3 meses previos. Las mujeres en edad fértil debían comprometerse a utilizar algún método anticonceptivo eficaz si mantenían una vida sexual activa o la iniciaban durante el ensayo. Se estableció la retirada de los pacientes que durante el estudio precisasen corticosteroides sistémicos más de 5 días si eran menores de 10 años, o más de 7 días si su edad era de 10 a 17 años.
TratamientoLos pacientes recibieron bajo un doble enmascaramiento extracto de Polypodium leucotomos (Anapsos® cápsulas de 120mg, fabricado por Especialidades Farmacéuticas Centrum S.A.), o placebo de apariencia similar al preparado de extracto de Polypodium leucotomos, y elaborado por el mismo laboratorio. La pauta de tratamiento del extracto de Polypodium leucotomus se ha adaptado siguiendo las recomendaciones de estudios previos, diferenciando los siguientes grupos: menores de 6 años, de 6 a 12 años y mayores de 12 años14,15. Los niños menores de 6 años recibieron 2 cápsulas del medicamento en una toma por la noche (240mg/día de extracto de Polypodium leucotomos o equivalente de placebo). Los niños de 6 a 12 años recibieron tres cápsulas del medicamento, en dos tomas al día: una cápsula por la mañana y dos cápsulas por la noche (360mg/día). Los mayores de 12 años recibieron 4 cápsulas del medicamento en dos tomas al día: dos cápsulas por la mañana y dos cápsulas por la noche (480mg/día).
Para el tratamiento de los brotes se utilizó metilprednisolona aceponato en emulsión al 0,1% aplicado en capa fina una vez al día sobre la zona afectada. Para el tratamiento sintomático de la sequedad cutánea se utilizó un tratamiento coadyuvante emoliente con leche hidratante después del baño. En el caso de requerir corticosteroides sistémicos se administró deflazacort 0,25 a 1,5mg/kg día. Para el tratamiento del prurito se ha elegido desloratadina como antihistamínico, debido a que se presenta en forma de comprimidos y jarabe, con dosificación adaptable a todos los rangos de edad de los pacientes del estudio; se administra una sola vez al día, y por su baja sedación minimiza la influencia de estos fármacos sobre el parámetro de sueño de la escala SCORAD. Se utilizó en jarabe o comprimidos, con la siguiente pauta: niños de 2 a 5 años 2,5ml de jarabe una vez al día (1,25mg de desloratadina);niños de 6 a 11 años 5ml una vez al día (2,5mg); y mayores de 12 años un comprimido (5mg) una vez al día.
Metodos y parámetros de evaluaciónUna vez realizada la visita de inclusión en el estudio (visita basal), y asignado el tratamiento, se programaron 13 visitas, que tuvieron lugar cada 15 días desde el comienzo del tratamiento. Para la recogida de la información sobre el consumo de medicamentos, número de brotes y acontecimientos adversos se facilitó un diario que los padres o tutores debían cumplimentar de modo detallado, reflejando estrictamente y objetivamente el empleo de medicamentos y la aparición de problemas de salud nuevos. Se realizaron análisis de bioquímica sanguínea y de orina de modo programado antes y al final del estudio. Además se llevó a cabo un test de embarazo en todas las pacientes en edad fértil antes del estudio, en cada visita mensual y al final del mismo.
La variable primaria del estudio fue el porcentaje de días en que se utilizaban corticosteroides tópicos durante los 6 meses de tratamiento con extracto de Polypodium leucotomos o placebo añadidos al protocolo terapéutico habitual. Las variables secundarias preespecificadas y con recogida sistematizada de los datos fueron: cuantificación del consumo de antihistamínicos; evolución en el índice SCORAD y en la impresión clínica global (ICG) al mes y a los 2, 3, 4, 5 y 6 meses de tratamiento; cuantificación del tiempo que transcurre desde la aleatorización hasta la aparición de un nuevo brote; cambio en el número de brotes respecto a la media notificada de los dos meses previos a la visita en que se inicia el estudio; y registro de acontecimientos adversos. Se consideró como brote la exacerbación de la enfermedad que pudo cuantificarse, tras la valoración del cuaderno diario y la exploración y la entrevista con el paciente o tutor, con un ICG≥4, o que precisó la aplicación de corticosteroides tópicos al menos durante 3 días. Se denominó una tanda de uso de corticosteroides a cada uno de los periodos de días, independientemente del número de días, en que se aplicó un tratamiento con corticosteroides tópicos sin interrupción de la pauta establecida.
Tratamiento estadísticoLos datos y resultados globales descriptivos se expresan como la media± desviación estándar para las variables cuantitativas continuas. En el caso de las variables categóricas se presentan los números correspondientes, junto con los porcentajes, y los datos finales del tiempo hasta la aparición de un nuevo brote se expresan como mediana y rango. Todas las evaluaciones se realizaron mediante análisis por intención de tratar, entre los pacientes incluidos en el estudio, y por protocolo, entre los que completaron el seguimiento. Para el análisis por intención de tratar, en los pacientes que abandonaron el estudio se arrastró hasta el final del mismo la última valoración realizada. El porcentaje de días en que se utilizaron corticosteroides tópicos o antihistamínicos se calculó como el número de días en tratamiento dividido por el número de días del estudio. Los dos grupos se compararon utilizando el test de Wilcoxon con un nivel de significación estadística del 5%. Para comparaciones múltiples se realizaron correcciones mediante el método de Bonferroni. Para el cálculo del tamaño muestral se utilizaron los datos previos de estudios realizados en adultos con diagnóstico similar y gravedad moderada, en los que el grupo tratado con placebo utilizó corticosteroides tópicos el 37,2±34,6% de los días durante los 6 meses del estudio16,17. Asumiendo una reducción del 60% de los días en tratamiento con corticosteroides tópicos en el grupo tratado con extracto de Polypodium leucotomos, con unas pérdidas estimadas del 20% de sujetos del estudio, se precisaban 53 pacientes por grupo para poder detectar esas diferencias como estadísticamente significativas con una potencia del estudio del 80%.
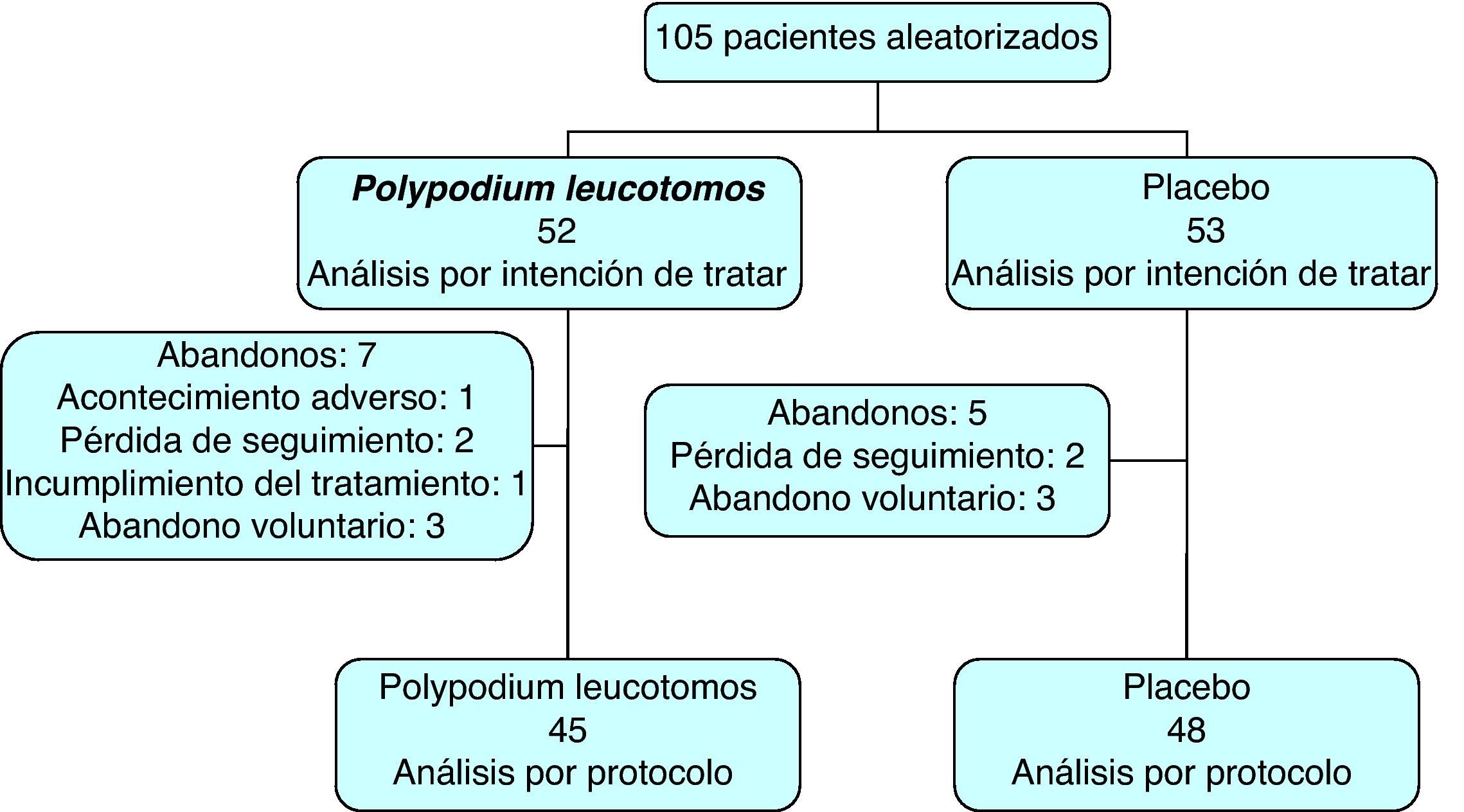
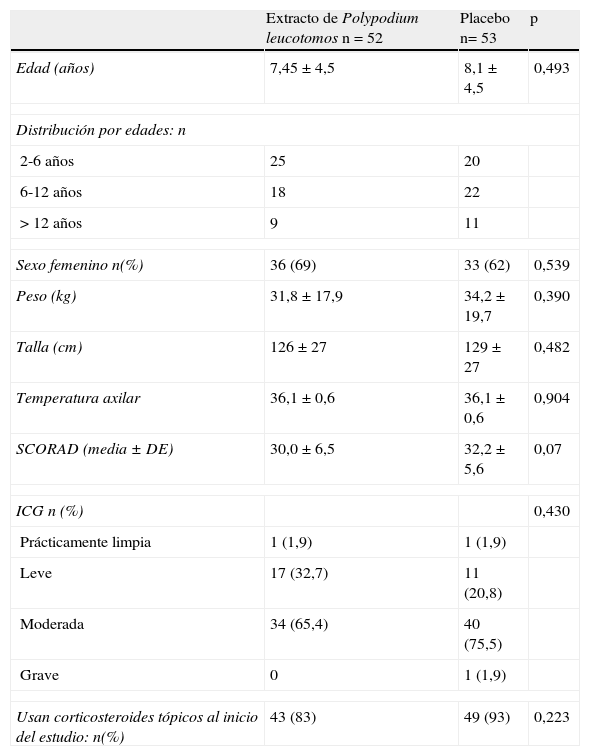
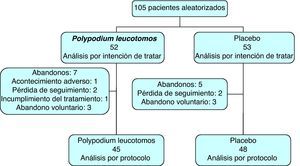
ResultadosPoblación incluida en el estudioSe incluyeron en el estudio 105 pacientes, de los que 69 eran mujeres. De ellos, 93 finalizaron los 6 meses de tratamiento (89%), siendo similar el número de abandonos en el grupo tratado con extracto de Polypodium leucotomos y en el grupo que recibió placebo. Del total de pacientes 52 fueron asignados al grupo de extracto de Polypodium leucotomos y 53 al de placebo (fig. 1). La puntuación SCORAD media fue de 31 (IC 95%: 30-32). La ICG se calificó como leve-moderada en un 97% de los casos. La edad de los pacientes fue de 8±4 años (rango: 2-17), y el peso 33,2±18,8kg, con una temperatura axilar de 36,1±0,6°C. Todos los pacientes cumplieron los criterios de Hanifin-Rafka, y en la mayor parte de los casos presentaban los 4 criterios mayores. El 88% de los pacientes del estudio estaban usando corticosteroides tópicos en el momento de la visita basal. No hubo diferencias significativas en los parámetros demográficos ni en las variables clínicas relacionadas con la dermatitis atópica o su evolución en los pacientes asignados al grupo de extracto de Polypodium leucotomos frente a los asignados al grupo placebo (tabla 1).
Características basales de los pacientes del estudio
| Extracto de Polypodium leucotomos n=52 | Placebo n= 53 | p | |
| Edad (años) | 7,45±4,5 | 8,1±4,5 | 0,493 |
| Distribución por edades: n | |||
| 2-6 años | 25 | 20 | |
| 6-12 años | 18 | 22 | |
| > 12 años | 9 | 11 | |
| Sexo femenino n(%) | 36 (69) | 33 (62) | 0,539 |
| Peso (kg) | 31,8±17,9 | 34,2±19,7 | 0,390 |
| Talla (cm) | 126±27 | 129±27 | 0,482 |
| Temperatura axilar | 36,1±0,6 | 36,1±0,6 | 0,904 |
| SCORAD (media±DE) | 30,0±6,5 | 32,2±5,6 | 0,07 |
| ICG n (%) | 0,430 | ||
| Prácticamente limpia | 1 (1,9) | 1 (1,9) | |
| Leve | 17 (32,7) | 11 (20,8) | |
| Moderada | 34 (65,4) | 40 (75,5) | |
| Grave | 0 | 1 (1,9) | |
| Usan corticosteroides tópicos al inicio del estudio: n(%) | 43 (83) | 49 (93) | 0,223 |
ICG: impresión clínica global;n: número de pacientes;p: significación estadística de las diferencias; SCORAD: Scoring Atopic Dermatitis Index.
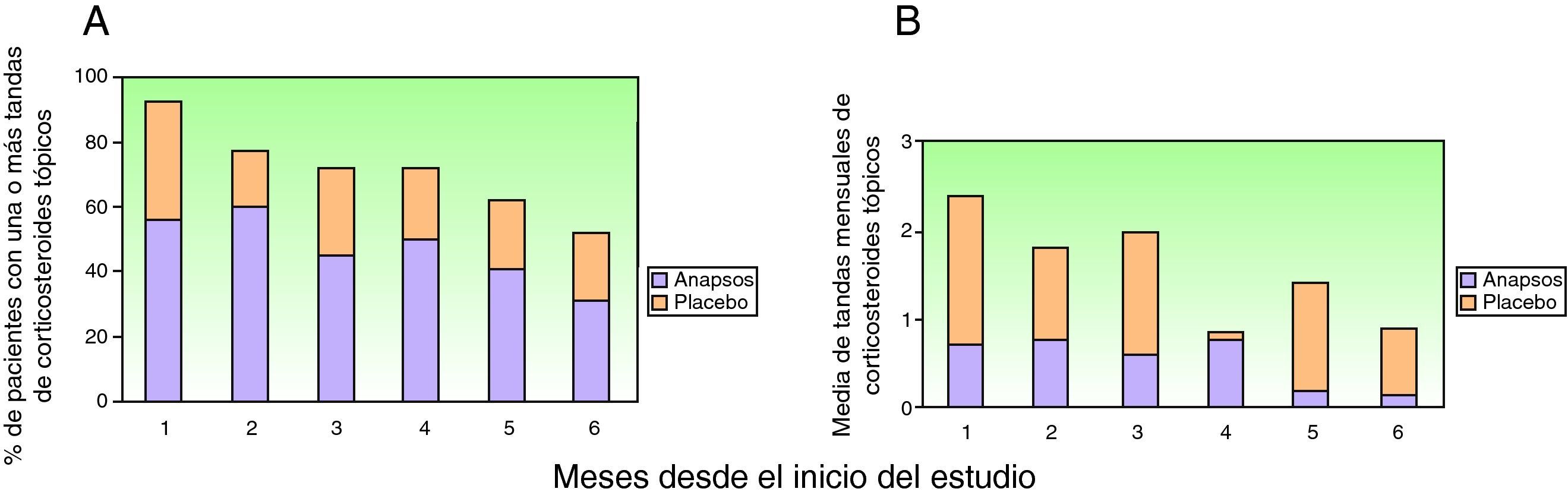
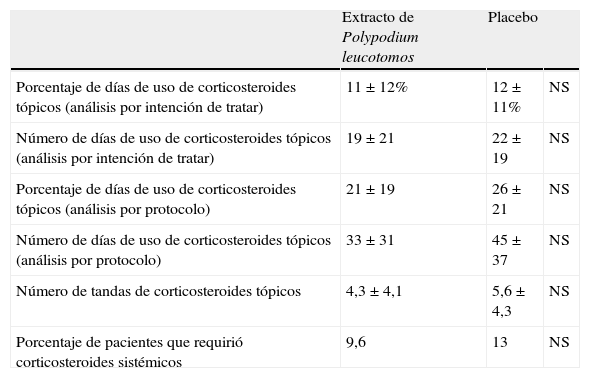
El grupo tratado con extracto de Polypodium leucotomos utilizó corticosteroides tópicos durante 11±12% de los días, frente a 12±11% del grupo placebo, diferencia que no fue estadísticamente significativa (p=0,2) (tabla 2). En la misma tabla puede observarse que, analizada con distintos parámetros, la utilización de corticosteroides tópicos fue menor en el grupo tratado con extracto de Polypodium leucotomos, pero las diferencias no alcanzaron en ninguno de los casos un valor estadísticamente significativo. En la figura 2 se muestra que tanto el porcentaje de pacientes que a lo largo del estudio requirió corticosteroides tópicos, como la media de las ocasiones en que recibió tratamiento (tandas de tratamiento), fueron inferiores en el grupo de extracto de Polypodium leucotomos, sin que esta disminución haya sido estadísticamente significativa.
Utilización de corticosteroides por los pacientes durante el estudio
| Extracto de Polypodium leucotomos | Placebo | ||
| Porcentaje de días de uso de corticosteroides tópicos (análisis por intención de tratar) | 11±12% | 12±11% | NS |
| Número de días de uso de corticosteroides tópicos (análisis por intención de tratar) | 19±21 | 22±19 | NS |
| Porcentaje de días de uso de corticosteroides tópicos (análisis por protocolo) | 21±19 | 26±21 | NS |
| Número de días de uso de corticosteroides tópicos (análisis por protocolo) | 33±31 | 45±37 | NS |
| Número de tandas de corticosteroides tópicos | 4,3±4,1 | 5,6±4,3 | NS |
| Porcentaje de pacientes que requirió corticosteroides sistémicos | 9,6 | 13 | NS |
NS: diferencia no significativa.
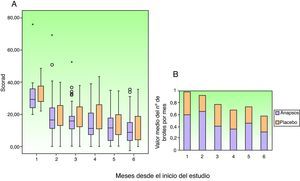
Como puede observarse en la figura 2, los pacientes asignados al grupo placebo y al grupo tratado con Polypodium leucotomos fueron reduciendo progresivamente el uso de corticosteroides tópicos a lo largo de los 6 meses de estudio. En el grupo tratado con placebo los cambios de cada mes frente al mes anterior no fueron significativos en ningún momento del estudio, pero en el grupo de extracto de Polypodium leucotomos sí fue relevante y significativa la reducción en el uso de corticosteroides tópicos observada en el segundo mes respecto al primero (mediana de uso: 13,8 días en el primer mes frente a 7,2 días el segundo mes; p=0,012), y en el quinto mes respecto al cuarto (mediana de uso: 6 días en el cuarto mes frente a 3 días en el quinto mes; p=0,012).
Cuando se evalúa el porcentaje de días de uso de corticosteroides tópicos en cada mes, respecto al uso de corticosteroides tópicos del primer mes, se observa en el quinto mes del estudio una reducción de un 36% en el grupo de extracto de Polypodium leucotomos frente a una reducción del 9% en el grupo placebo (p=0,02).
El ajuste de los datos en función de la época estacional no modificó las diferencias de modo relevante.
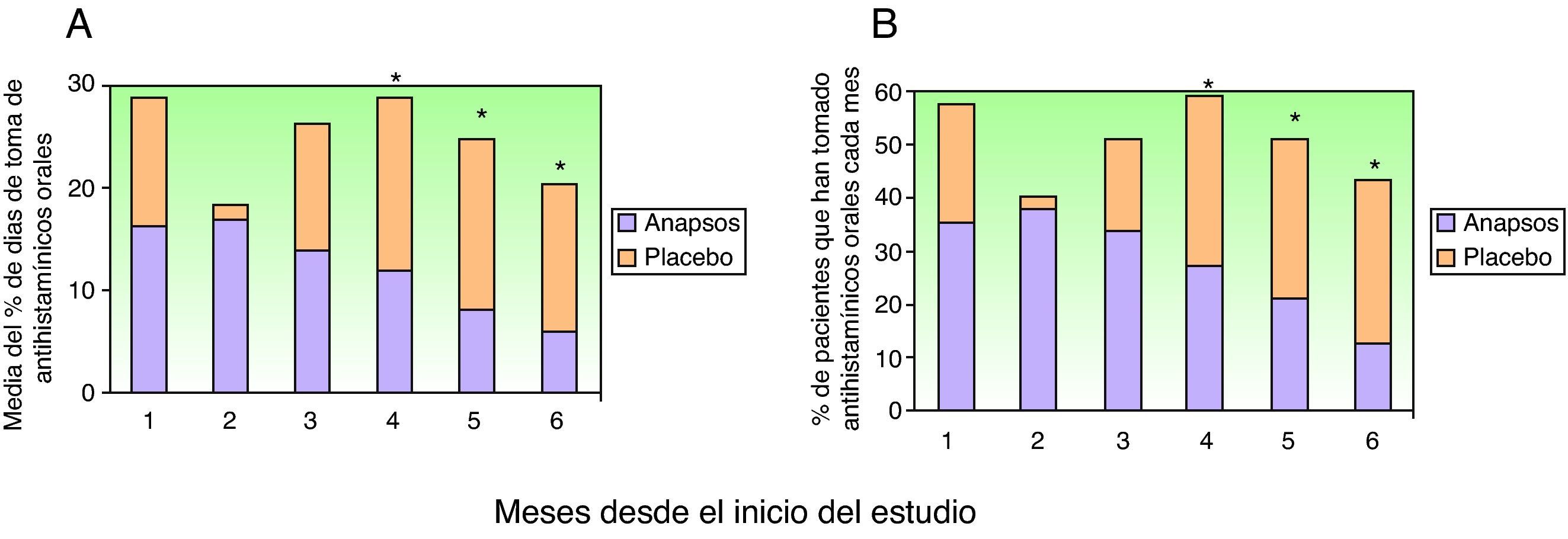
Eficacia en cuanto al uso de antihistamínicosEl consumo de antihistamínicos y de corticosteroides sistémicos se valoró del mismo modo que el descrito para el análisis del consumo de corticosteroides tópicos. El porcentaje de días que los pacientes tomaron desloratadina durante los 6 meses del estudio fue significativamente menor en los pacientes tratados con extracto de Polypodium leucotomos (mediana de 4,5% días; mínimo de 0 y máximo de 66,5%) (14±19%) que en los pacientes que recibieron placebo (mediana de 13,6% días; mínimo de 0 y máximo de 86,4%) (21±22%) (p=0,038). Cuando se comparó el porcentaje de días de uso de desloratadina en cada mes del estudio la diferencia favorable al extracto de Polypodium leucotomos es apreciable el primer mes, y estadísticamente significativa los meses 4, 5 y 6 (fig. 3 A). También el porcentaje de pacientes que han tomado antihistamínicos orales es menor en el grupo tratado con extracto de Polypodium leucotomos que en el tratado con placebo. Esta diferencia se observa claramente a partir del primer mes, y es estadísticamente significativa a partir del tercer mes de tratamiento (meses cuarto, quinto y sexto del estudio) (fig. 3 B).
Consumo de antihistamínicos orales durante los 6 meses del estudio. A. Valor medio mensual del porcentaje de días en que los pacientes han tomado antihistamínicos orales, en uno y otro grupo. B. Porcentaje de pacientes que toman antihistamínicos orales cada mes. *p<0,05 cuando se comparan los datos del mismo mes entre ambos grupos.
Respecto al empleo de corticosteroides sistémicos el 13% de los pacientes tratados con placebo requirieron la administración de corticosteroides sistémicos, frente al 9,6% de los tratados con extracto de Polypodium leucotomos, diferencia que no fue estadísticamente significativa.
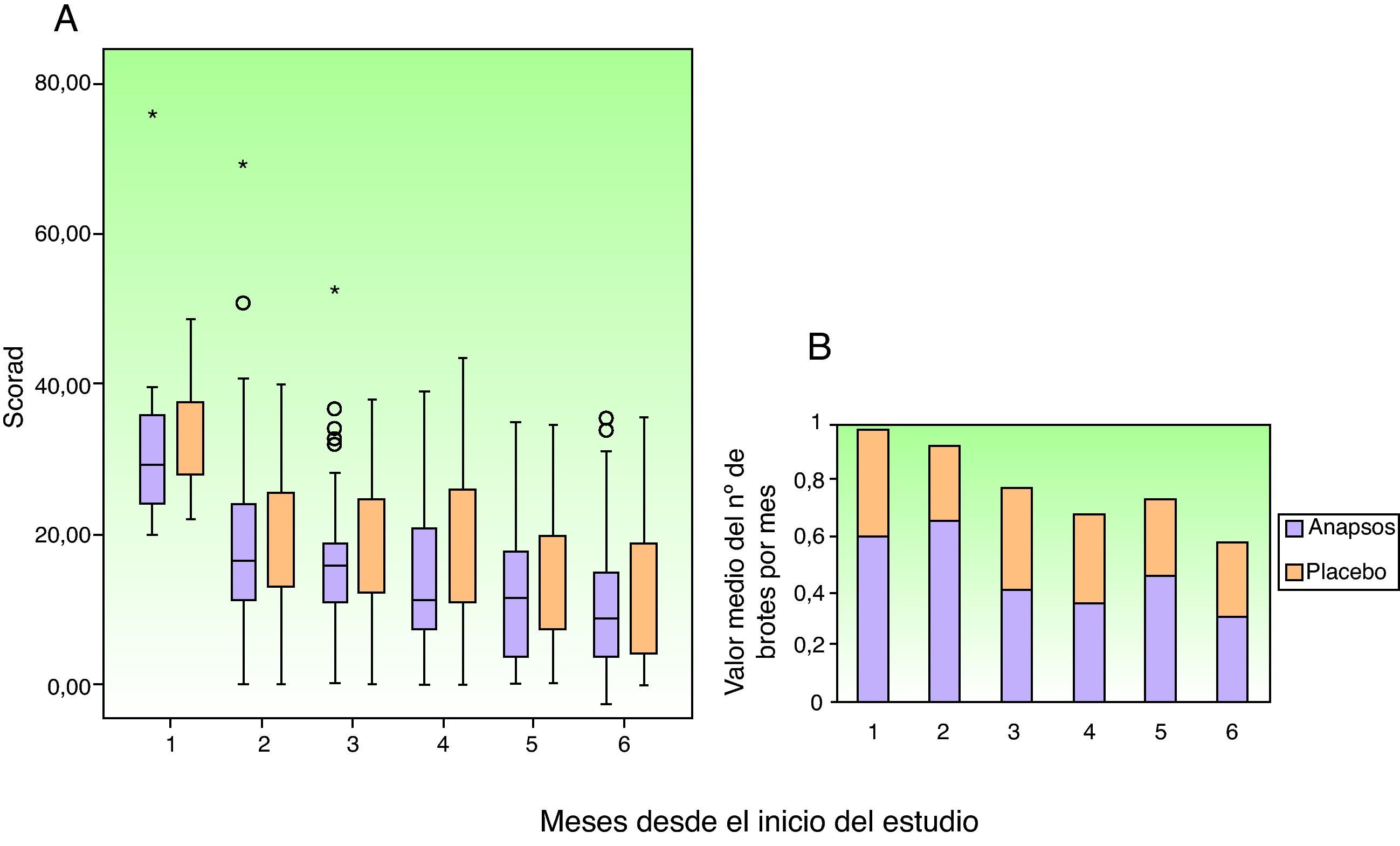
Evolución de los pacientesLa figura 4 muestra la evolución del índice SCORAD y del número de brotes, ambos evaluados en cada visita mensual. Como puede observarse, la evolución del índice SCORAD es similar para ambos grupos. Los distintos componentes del índice SCORAD (extensión e intensidad de las lesiones, prurito y somnolencia), también evolucionaron de modo similar. El número de brotes en total, y en cada visita, es inferior con extracto de Polypodium leucotomos, aunque la diferencia frente a placebo no es muy alta, y en ningún momento alcanza significación estadística. Tampoco se observaron diferencias significativas entre los grupos en el tiempo hasta el primer brote (con una mediana de 0,5 meses en ambos grupos) o en la reducción progresiva de la gravedad de la enfermedad valorada mediante ICG. En total se produjeron a lo largo del ensayo 463 eventos adversos, 218 en el grupo tratado con extracto de Polypodium leucotomos y 223 en el grupo que recibió placebo. En ambos grupos la mayoría de los eventos fueron calificados como leves. Los acontecimientos adversos moderados fueron más frecuentes en el grupo placebo (14 pacientes, frente a 7 con extracto de Polypodium leucotomos) (tabla 3). Solo un paciente presentó un acontecimiento adverso grave (diarrea con deshidratación); este paciente pertenecía al grupo de placebo.
Acontecimientos adversos moderados-graves durante el estudio
| Polypodium leucotomos (n=7) | Placebo (n=15) | ||
| Moderados | • Crisis de broncoespasmo• Edema labial• Varicela• Resfriado• Faringoamigdalitis (2)Resfriado con tos | • Diarrea• Gripe-bronquitis (3)• Fiebre (2)• Faringoamigadalitis (2)• Brote agudo de atopia• Prurito intenso• Tinea capitis• Sobreinfección de eccema• Dolor de espalda• Adenitis mesentérica | NS |
| Graves | • Diarrea con deshidratación | NS |
NS: diferencia no significativa.
El extracto de Polypodium leucotomos es un producto farmacológico que aumenta la proporción de linfocitos CD8+ supresores18, modifica la liberación de citocinas inhibiendo la proliferación de monocitos y de interleucina 1ß, modificando la producción de citocinas por linfocitos T, incrementando las células CD4+ y CD3-CD16+CD56+19,20, y estimulando la proliferación y activación de linfocitos T supresores, a la vez que reduce el efecto de las moléculas de adhesión CD11, CD18 y CD62-L21. El extracto de Polypodium leucotomos actúa eficazmente en distintos procesos inflamatorios22 y atópicos23, y en particular en la dermatitis atópica15,24,25. Los resultados de este estudio muestran que el tratamiento prolongado con extracto de Polypodium leucotomos aporta beneficios para los pacientes en edad pediátrica con dermatitis atópica cuantificada entre 20 y 40 mediante el índice SCORAD, y que precisan de tratamiento con corticosteroides tópicos y antihistamínicos. El efecto más relevante de extracto de Polypodium leucotomos se refiere a la reducción en el consumo de antihistamínicos, tanto en el porcentaje de días de uso de estos medicamentos como en el porcentaje de pacientes que lo utilizan. Los pacientes tratados con extracto de Polypodium leucotomos muestran una evolución en el índice SCORAD, ICG y número de brotes que manifiestan una mejoría de la enfermedad, similar al grupo placebo pero con un consumo menor de corticosteroides y antihistamínicos, lo que indica un efecto beneficioso del extracto de Polypodium leucotomos en administración continuada para el tratamiento de la dermatitis atópica, asociado al tratamiento estándar de primera línea, con potencial relevancia clínica.
El estudio estaba planteado con el objetivo primario de demostrar una reducción en el porcentaje de días de utilización de corticosteroides tópicos. El extracto de Polypodium leucotomos en administración regular mantenida redujo el número y el porcentaje de días de uso de corticosteroides tópicos, y también el porcentaje de pacientes que requirieron corticosteroides sistémicos, pero la diferencia con placebo no fue estadísticamente significativa.
En otros estudios con un diseño similar los pacientes del grupo control mantenían durante el estudio el consumo de corticosteroides de modo más constante y similar al consumo al inicio del mismo. Esos estudios presentan algunas diferencias metodológicas con el actual que pueden ser relevantes, entre ellas que no se permitía el uso de antihistamínicos en los pacientes que no podían garantizar una pauta terapéutica estable durante el estudio; o en otros casos se protocolizaba el empleo de corticosteroides tópicos, en vez de antihistamínicos, para el prurito16,17. En consecuencia, el empleo de corticosteroides tópicos en dichos estudios fue mayor en el grupo control, y en esas condiciones es más probable que las diferencias inducidas por los tratamientos en estudio alcancen la significación estadística.
El hecho de que el índice SCORAD y el componente del prurito de dicho índice sea similar en ambos grupos indica que el extracto de Polypodium leucotomos puede controlar este síntoma de modo más eficaz que las pautas a demanda de antihistamínicos, a la vez que reduce su consumo. El efecto beneficioso de extracto de Polypodium leucotomos se manifiesta en el primer mes del estudio, y va incrementándose en los últimos meses. La elevada seguridad del medicamento, que no induce un aumento de riesgo perceptible en las condiciones del estudio, permite establecer estas pautas regulares mantenidas de tratamiento. Finalmente, aunque en este estudio se ha utilizado un antihistamínico con baja capacidad de paso de la barrera hematoencefálica, es habitual que en la práctica asistencial se empleen antihistamínicos de primera generación, más sedantes y con mayor probabilidad de efectos adversos en la población pediátrica7,8. Los datos obtenidos sugerirían que el extracto de Polypodium leucotomos podría reducir el riesgo de efectos adversos asociados a estos medicamentos al disminuir su consumo, aunque esta hipótesis solo podrá aceptarse si se demuestra en ensayos clínicos diseñados con este fin.
FinanciaciónPromotor: ASAC Pharma. Laboratorios Centrum S. A. Alicante.
Este proyecto ha sido cofinanciado por el Fondo Europeo de Desarrollo Regional FEDER, dentro del Programa Operativo Fondo Tecnológico 2007-2013-Unión Europea CDTI.
Conflicto de interesesLa Dra. Ana Ramírez-Bosca está contratada en ASAC Pharma.
El Dr. Pedro Zapater ha sido investigador clínico para ASAC Pharma, Novartis, MSD, Generfarma y Atral.
El Dr. Joaquín Díaz-Alperi está contratado en ASAC Pharma.
El Dr. José F. Horga ha sido investigador clínico y ha impartido conferencias para ASAC Pharma, Novartis, MSD, Generfarma, Atral, Bioibérica, Abbott, Pfizer y Lundbeck.
La Dra. Isabel Betlloch, el Dr. Francisco Albero y la Dra. Asunción Martínez declaran no tener ningún conflicto de intereses.
Francisco Albero: Dermatología, Hospital Virgen de los Lirios de Alcoy (Alicante). Milagros Azorín: Dermatología, Centro de Especialidades Babel de Alicante. Isabel Betlloch: Dermatología, Hospital General Universitario de Alicante. Pedro Devesa: Dermatología, Hospital General Universitario de Elche (Alicante). Joaquín Díaz-Alperi: ASAC PHARMA, Alicante. Pedro M. Genovi: Dermatología, Hospital Marina Baixa (Alicante). José F. Horga: Unidad de Farmacología Clínica, Hospital General Universitario de Alicante e Instituto de Bioingeniería de la Universidad Miguel Hernández (Elche, Alicante). Asunción Martínez: Dermatología, Centro Dermatológico Estético de Alicante. Concha Más: Dermatología, consulta privada (Alicante). Conrad Pujol: Dermatología, Hospital Universitario La Fe, Valencia. Ana Ramírez: Dermatología, Centro Dermatológico Estético de Alicante. Eugenio Salgado: Dermatología, consulta privada (Alicante). Pedro Zapater: Unidad de Farmacología Clínica, Hospital General Universitario de Alicante, Instituto de Bioingeniería, Universidad Miguel Hernández (Elche, Alicante).
Al final del artículo se adjunta un Anexo 1 con los miembros del grupo de trabajo.