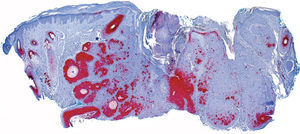
La inmunotinción selectiva con calretinina evidencia la capa más interna de la vaina radicular externa del folículo piloso normal, difícil de distinguir con la tinción de hematoxilina-eosina.
ObjetivoConocer si calretinina nos permite identificar neoplasias anexiales con diferenciación hacia la vaina radicular externa del folículo piloso.
Material y métodosHemos analizado el patrón de inmunotinción para calretinina en 49 biopsias de distintas neoplasias anexiales cutáneas con diferenciación folicular.
ResultadosQuince de las 49 tinciones correspondían a tricolemomas/queratosis folicular invertida, observándose positividad con calretinina en el epitelio de las áreas más superficiales de la lesión y en los remolinos escamosos; 10 quistes tricolémicos con positividad en su pared, tres carcinomas basocelulares con positividad variable dependiendo del tipo de diferenciación folicular de cada variante, un panfoliculoma con positividad focal, dos hamartomas sebáceos infundíbulo-quísticos con positividad en el conducto excretor de las glándulas sebáceas, dos pilomatricomas y tres tumores tricolemales proliferantes con positividad en las capas celulares cercanas a la luz de las estructuras quísticas, 9 tricoblastomas/tricoepiteliomas, dos quistes infundibulares, un poro dilatado de Winer y dos acantomas de la vaina folicular resultaron negativos.
ConclusiónEl estudio inmunohistoquímico de la calretinina nos permite identificar neoplasias anexiales del folículo piloso o componentes de éste, con diferenciación hacia la vaina radicular externa del folículo piloso.
Selective immunostaining for calretinin labels the innermost layer of the outer root sheath of normal hair follicles, which is difficult to distinguish with hematoxylin-eosin staining.
ObjectiveThe aim of this study was to determine whether immunohistochemistry for calretinin allows identification of cutaneous adnexal tumors with follicular differentiation towards cells of the outer root sheath.
Material and methodsWe analyzed the staining pattern for calretinin by immunohistochemistry in 49 biopsies of cutaneous adnexal tumors with follicular differentiation.
ResultsFifteen biopsies corresponded to trichilemmomas/inverted follicular keratosis and had staining for calretinin in the epithelium of the most superficial areas of the lesions and in squamous eddies. Ten were trichilemmal cysts, which displayed staining of the cyst wall. Three were basal cell carcinomas with variable staining according to the type of follicular differentiation in each variant. One was a panfolliculoma that had focal staining. Two were folliculosebaceous cystic hamartomas with staining of the excretory duct of the sebaceous glands. Two pilomatricomas and 3 proliferative trichilemmal tumors had positive staining in the cellular layers close to the lumen of the cystic structures. Nine trichoblastomas/trichoepitheliomas, 2 infundibular cysts, 1 dilated pore of Winer, and 2 acanthomas of the follicular sheath were negative for calretinin.
ConclusionImmunohistochemistry for calretinin allows identification of cutaneous adnexal tumors of the hair follicle or a component of the follicle with differentiation towards cells of the outer root sheath.
El calcio es un mensajero intracelular que actúa principalmente por medio de una serie de proteínas con capacidad para fijar el calcio. Existen dos grupos principales de proteínas ligadoras o fijadoras de calcio: aquellas similares a la calmodulina pertenecientes a la familia EF hand, que contiene el dominio EF-hand en su estructura permitiendo establecer interacciones con dos átomos de calcio, y aquellas que unen calcio y fosfolípidos que han sido agrupadas bajo el nombre genérico de anexinas.
La calretinina es una proteína ligadora o fijadora de calcio de 29 KDa que pertenece a la familia EF-hand, a la que también pertenece la proteína S-100 y parvalbúmina, entre otras. Se caracteriza estructuralmente por la presencia de 6 dominios EF hand. El gen de la calretinina presenta un 60 % de homología con la calmodulina y su función principal es la de tampón al prevenir un aumento excesivo de calcio intracelular1. Se ha demostrado la presencia de calretinina en momentos concretos del ciclo celular, en concreto en la fase G1 (o primera fase de crecimiento) y en la mitosis asociada al cinetocoro que permite una distribución normal de los cromosomas en la división celular.
En la actualidad se realiza el estudio inmunohistoquímico de calretinina como marcador de diferenciación mesotelial en neoplasias, donde desempeña un importante papel en el diagnóstico diferencial histopatológico entre mesotelioma maligno y metástasis de adenocarcinoma de las membranas serosas1.
Mediante la inmunotinción con calretinina Lugli et al2 estudiaron 5.233 muestras de tejidos normales y tumorales, y estos autores no encontraron positividad en tumores anexiales de la piel (0 de 35 muestras), angiosarcoma (0 de 3), hemangioma capilar (0 de10), hemangioma epitelioide (0 de 2), tumor de células gigantes de la vaina tendinosa (0 de 29), tumor glómico (0 de 7), sarcoma de Kaposi (0 de 18), lipoma (0 de 35), histiocitoma benigno (0 de 13), dermatofibrosarcoma protuberans (0 de 3) y nevus melanocíticos (0 de 18) entre otros. Sin embargo, observaron ligera positividad en el carcinoma espinocelular (7,7 %) y melanoma maligno (4,7 %). En otro estudio se analizaron mediante hematoxilina-eosina y calretinina 24 quistes foliculares sin encontrar inmunorreactividad para la calretinina3.
Estructuralmente la unidad folículo-sebácea-apocrina está constituida por:
- 1.
Folículo piloso propiamente dicho, incluyendo el tallo piloso, donde se distinguen tres segmentos: el infundíbulo, el istmo y el segmento inferior. Solamente el segmento inferior muestra cambios llamativos durante el ciclo folicular (parte móvil o transitoria del folículo), mientras que el istmo y el infundíbulo no presentan modificaciones (parte fija o permanente del folículo).
- 2.
Una o más glándulas sebáceas.
- 3.
En algunas regiones anatómicas una glándula apocrina.
- 4.
Fibras de músculo liso que constituyen el músculo erector del pelo.
- 5.
El disco piloso.
- 6.
Fibras nerviosas perifoliculares.
El infundíbulo está tapizado por un epitelio prácticamente idéntico al de la epidermis, con una hilera basal de células columnares dispuestas en empalizada, 4 ó 5 capas de queratinocitos que aumentan su grado de queratinización a medida que se aproximan a la luz del infundíbulo, una capa granulosa bien desarrollada y constituida por una o dos hileras de células aplanadas con abundantes gránulos de queratohialina, y una capa córnea hojaldrada, basófila y ortoqueratósica.
El istmo está tapizado por un epitelio constituido por una hilera periférica de queratinocitos dispuestos en empalizada sobre una gruesa membrana basal, de 4 a 5 capas de queratinocitos poligonales de citoplasma amplio y eosinófilo que queratinizan a medida que se aproximan al canal folicular, y esta queratinización se hace evidente sólo en la porción superior del istmo, donde ya ha desaparecido la vaina radicular interna completamente queratinizada y descamada, y solo entonces puede tener lugar la queratinización de la vaina radicular externa, dando lugar a una queratina eosinófila, compacta, ortoqueratósica y de borde serrado u ondulado que se produce sin la formación de una capa granulosa previa.
El bulbo folicular constituye la porción más profunda del segmento inferior del folículo piloso. En un folículo en anagen este segmento inferior muestra una morfología en tenaza abrazando los fibrocitos de la papila folicular.
Las células matriciales son las que van a dar origen a varios tubos celulares concéntricos que constituyen las capas del tallo piloso y de la vaina radicular interna del folículo, que de dentro a fuera son: médula del pelo, corteza del pelo, cutícula del pelo, cutícula de la vaina radicular interna, capa de Huxley y capa de Henle. Al nivel del segmento inferior del bulbo de un folículo en anagen estas células matriciales aparecen como células epiteliales inmaduras, con núcleo grande, redondo, vesiculoso, monomorfo, nucleolo prominente y escaso citoplasma. Son células con una intensa actividad proliferativa, y por tanto es frecuente observar figuras de mitosis. Habitualmente se observan melanocitos dendríticos intercalados entre éstas y las células epiteliales matriciales.
La primera capa de la vaina radicular interna que se evidencia como capa independiente es la de Henle, que está constituida por una única hilera de células y es la más externa. La capa de Henle muestra gránulos de tricohialina y es la primera en queratinizarse, coincidiendo con un ensanchamiento de la vaina radicular externa. La capa de Huxley, situada inmediatamente por dentro de la capa de Henle, está constituida por dos hileras de células, que empiezan a cargarse de gránulos de tricohialina, que pierde posteriormente queratinizándose completamente. La capa más interior de la vaina radicular interna es la cutícula, que está constituida por una única hilera celular y sólo adquiere gránulos de tricohialina a partir del nivel donde la capa de Henle los pierde. Cuando estas tres capas de la vaina radicular interna se han queratinizado por completo se fusionan entre sí, apareciendo una única capa de queratina anfófila o débilmente basófila, que asciende verticalmente entre la cutícula del pelo por dentro y la vaina radicular externa por fuera, hasta alcanzar el istmo donde se descama y desaparece.
El tallo piloso o pelo se origina a partir de las células del centro de la matriz y área supramatricial, que son aquellas células matriciales que están situadas inmediatamente por encima de la punta de la papila folicular. Estas células matriciales maduran a medida que ascienden, alargándose y perdiendo su núcleo. Las células de las tres capas del tallo piloso (médula, corteza y cutícula del pelo) queratinizan sin formar gránulos de tricohialina.
Se considera que una neoplasia cutánea muestra diferenciación folicular cuando sus células reproducen en mayor o menor medida alguna de las estructuras histológicas del folículo piloso normal en cualquiera de las fases del ciclo folicular.
Material y métodosEn este estudio se han seleccionado 49 biopsias de distintas neoplasias anexiales cutáneas con diferenciación folicular, tanto benignas como malignas, que hemos clasificado siguiendo los criterios propuestos por Requena et al4. Por lo tanto, hemos considerado que la queratosis folicular invertida y el tricolemoma son básicamente la misma entidad, y que ambas corresponden a verrugas vulgares con diferenciación tricolémica, y por ello las hemos englobado en un único grupo. Lo mismo hemos hecho con el tricoepitelioma, el tricoepitelioma desmoplásico y el linfadenoma cutáneo (tricoblastoma adamantoide), neoplasias que hemos considerado variantes histopatológicas del tricoblastoma, porque muestran diferenciación hacia células germinativas foliculares y un abundante estroma fibrocítico que reproduce la papila folicular y las vainas de tejido conectivo perifolicular. El resto de los tumores anexiales cutáneos con diferenciación folicular que hemos estudiado han sido denominados utilizando la nomenclatura habitual de la mayoría de las publicaciones.
Primero se investigó el patrón de inmunotinción para calretinina en la piel normal y sus anejos; posteriormente se estudió la positividad inmunohistogénica de las células neoplásicas con anticuerpos anticalretinina (marcador del citoplasma celular) en cada una de las muestras. Se clasificó la intensidad de la tinción con calretinina de forma semicuantitativa en 1, 2 y 3 y se determinaron las que mostraban inmunorreactividad. Las neoplasias que no mostraban positividad para calretinina se les asignó el valor 1, a las focalmente positivas se les asignó el valor 2 y a las claramente positivas les fue asignado el valor 3 (tabla 1).
Resultados obtenidos con la inmunotinción con calretinina
| Tumor | Número | 3* | 2** | 11*** |
| Tricolemoma/queratosis folicular invertida | 15 | 15 | 0 | 0 |
| Quiste tricolémico | 10 | 10 | 0 | 0 |
| Carcinoma basocelular | 3 | 1 | 1 | 1 |
| Panfoliculoma | 1 | 0 | 1 | 0 |
| Tricoblastoma/tricoepitelioma | 9 | 0 | 9 | 0 |
| Hamartoma quístico folículo sebáceo | 2 | 2 | 0 | 0 |
| Pilomatricoma | 2 | 0 | 2 | 0 |
| Tumor tricolemal proliferante | 3 | 0 | 3 | 0 |
| Quiste infundibular | 2 | 0 | 2 | 0 |
| Poro dilatado de Winer | 1 | 0 | 0 | 1 |
| Acantoma de la vaina folicular | 2 | 0 | 0 | 2 |
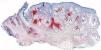
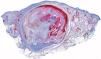
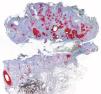
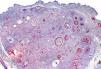
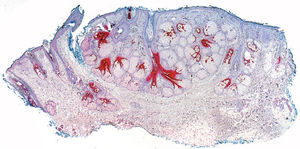
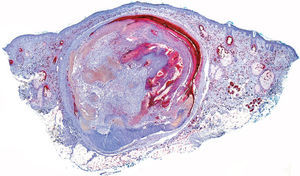
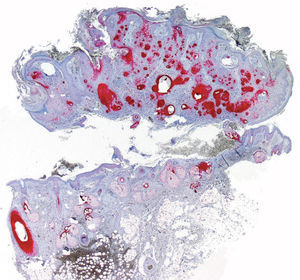
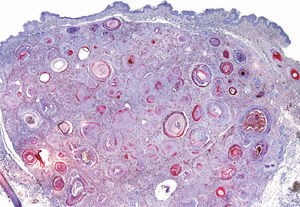
De las 49 biopsias estudiadas 15 eran tricolemomas/queratosis foliculares invertidas, 10 quistes tricolémicos, tres carcinomas basocelulares, un panfoliculoma, 9 tricoblastomas/tricoepiteliomas, dos hamartomas quísticos folículos-sebáceos, dos pilomatricomas, tres tumores tricolemales proliferantes, dos quistes infundibulares, un poro dilatado de Winer y dos acantomas de la vaina folicular (fig. 1). En los 15 tricolemomas/queratosis folicular invertida se observó positividad en los dos tercios del epitelio de las áreas superficiales de la lesión y en los remolinos escamosos, resultando claramente negativas las hileras basales (fig. 2). Los 10 quistes tricolémicos mostraban intensa positividad en toda la pared del quiste, excepto en la hilera basal del epitelio del tumor. En los tres carcinomas basocelulares con diferenciación folicular se obtuvieron resultados variables dependiendo del tipo de diferenciación folicular que presentaban, observando un carcinoma basocelular con diferenciación adenoide-quística con intensa positividad del epitelio tumoral, un carcinoma basocelular superficial con positividad focal de la hilera periférica de los islotes tumorales y uno basocelular con diferenciación matricial que resultó absolutamente negativo para calretinina. Un panfoliculoma mostró positividad focal en el epitelio que delimitaba la luz de los quistes con diferenciación tricolémica y negatividad en el resto del epitelio tumoral. Se estudiaron 9 tricoblastomas/tricoepiteliomas observándose positividad focal en el epitelio tumoral y dos hamartomas quísticos folículo-sebáceos con intensa positividad en el conducto excretor de las glándulas sebáceas (fig. 2), dos pilomatricomas que mostraban positividad en las hileras celulares próximas a las células sombra que, a su vez, resultaban negativas para calretinina, al igual que las células de la capa basal del epitelio tumoral (fig. 3), tres tumores tricolemales proliferantes que mostraban positividad para las células del epitelio tumoral cercano a la luz, dos quistes infundibulares, un poro dilatado de Winer y dos acantomas de la vaina folicular que no mostraban inmunorreactividad para calretinina.
El folículo piloso está compuesto por una estructura en capas concéntricas, que de fuera hacia dentro son: la vaina radicular externa, la vaina radicular interna y el tallo piloso. La vaina radicular externa no tiene una población celular homogénea. Mediante estudios ultraestructurales se distinguen dos tipos de capas: a) una capa externa formada por varias hileras de células cuboideas con gran cantidad de glucógeno en su citoplasma y b) una capa interna formada por una única hilera de células, relacionada estrechamente con la capa de Henle de la vaina radicular interna. Esta última fue descrita por Ito5 como la capa más interna de la vaina radicular externa y denominada por Orwin6 «capa compañera», debido a su estrecha relación con la capa de Henle.
Aunque aún no está completamente claro, probablemente las células que constituyen la vaina radicular externa del folículo piloso no se originan a partir de células matriciales del bulbo, sino que descenderían desde el extremo inferior del istmo o desde el bulge (punto de inserción del músculo erector del pelo) con cada nuevo anagen hasta al canzar el extremo inferior del folículo piloso4. Así pues, con cada nuevo anagen las vainas radiculares del folículo piloso muestran un sentido contrario en su maduración: la vaina radicular externa desciende desde el istmo hacia la dermis profunda para recubrir la vaina radicular interna del segmento inferior, mientras que las células de la vaina radicular interna y el tallo piloso propiamente dicho maduran a medida que ascienden hacia la superficie. Se piensa que la capa compañera se mueve en conjunción con la vaina radicular interna en su maduración, es decir, desde el bulbo hacia el istmo4. Al final de la diferenciación, al nivel del límite superior del istmo, ambas capas, la vaina radicular interna y la capa compañera cornificada, se degradan y descansan en la luz folicular, mientras que las células de la vaina radicular externa presentan una queratinización tricolémica.
En un estudio reciente Poblet et al7 demostraron que la capa compañera presentaba unas características desde el punto de vista morfológico y bioquímico que la hacían única y distinta de otras capas del folículo piloso porque:
- 1.
La capa compañera consiste en una única hilera de células aplanadas, a diferencia de las múltiples capas de células cuboideas que forman la vaina radicular externa.
- 2.
Las células de la capa compañera se unen a las de la capa de Henle (mediante desmosomas) y no a las que forma la vaina radicular externa (huecos intercelulares sin desmosomas). Hnakawa et al8 han descrito recientemente la expresión de desmogleína 1 y 3 en la capa compañera de los folículos pilosos del ratón, demostrando la importancia de dicha capa en el mecanismo de anclaje del pelo en anagen al folículo.
- 3.
Las células de la capa compañera no contienen grandes cantidades de glucógeno en su citoplasma, en contraste con las que forman la vaina radicular externa. Tampoco contienen gránulos de tricohialina, a diferencia de las células de la vaina radicular interna9.
- 4.
Las células de la capa compañera acumulan un material similar a la queratina, principalmente frente a la capa de Henle10.
- 5.
La capa compañera expresa una única citoqueratina — K6hf— durante la diferenciación celular11, en contraste con las células que componen tanto la vaina radicular externa como la interna.
- 6.
Algunos marcadores inmunohistoquímicos son positivos en la capa compañera y en las células que componen la vaina radicular externa: Ki-6712, inhibidor activador del plasminógeno tipo II13, proteína microtubular asociada tipo II14 y calretinina5.
Se han propuesto varias hipótesis acerca de la función de la capa compañera. Orwin et al6 postularon que podría tener una función de nutrición de las células de la vaina radicular interna, y probablemente también interviene en la diferenciación y eventual destrucción en el canal piloso. Otra posible función de esta capa es la de mantenimiento de la integridad de ambas vainas radiculares del folículo piloso, la interna y la externa. Ito10 propuso que, teniendo en cuenta su crecimiento circunferencial y perpendicular al tallo piloso, la capa compañera sujeta y cubre las estructuras internas del folículo piloso como un «aro en torno a un barril». Winter et al15 encontraron que una mutación del gen específico de la queratina K6hf de la capa compañera podía ser un factor de riesgo para la pseudofoliculitis de la barba, sugiriendo que la alteración en la queratina K6hf puede alterar la integridad mecánica de la capa compañera y su unión a la vaina radicular interna.
La función de la calretinina también es desconocida. La regulación calcio dependiente es importante para controlar la homeostasis intracelular de calcio, y se piensa que es esencial para el desarrollo de todo tipo de folículos pilosos16. Se ha demostrado que las proteínas fijadoras de calcio están implicadas en el ciclo de progresión y diferenciación y pueden desempeñar un papel importante en la activación de las células madre en el comienzo de la regeneración del folículo17. Algunos componentes de la subfamilia S100 pueden no sólo modular la homeostasis de calcio intracelular durante la diferenciación en el ciclo folicular, sino que también pueden cumplir otras funciones, como la del control de la reorganización de la red de queratina18.
Evaluando la expresión inmunohistoquímica de la calretinina en el diagnóstico de las metástasis cutáneas del mesotelioma, Poblet et al7 observaron como hallazgo adicional que la calretinina es un marcador selectivo de la capa más interna de la vaina radicular externa, apareciendo positiva por encima del bulbo, antes de la queratinización de la capa de Henle y desapareciendo la positividad justo antes de la disgregación de la vaina radicular interna debida a la apoptosis. La inmunotinción con calretinina de la capa compañera persiste incluso en los folículos en catagen7.
Entre las 49 lesiones estudiadas hemos analizado 10 quistes tricolémicos, que han mostrado intensa positividad en todo el espesor del epitelio de la pared del quiste. Teniendo en cuenta que la tinción con calretinina sirve para identificar la capa más interna de la vaina radicular externa o capa compañera, es lógico pensar que el quiste tricolémico, cuya pared es idéntica al epitelio de la vaina radicular externa del istmo de un folículo piloso en anagen o al saco epitelial retraído que representa la involución del segmento inferior de un folículo en catagen, presente intensa positividad.
Quince lesiones estudiadas correspondieron a tricolemomas/queratosis folicular invertida, cuyo epitelio muestra una diferenciación similar a la de la vaina radicular externa del segmento inferior de un folículo piloso en anagen. Se observó positividad para los dos tercios de epitelio cercano a la superficie de la lesión, así como en los remolinos escamosos. No existe unanimidad respecto al origen de los denominados remolinos escamosos que se observan en el espesor de los lóbulos epiteliales en las lesiones, aunque de acuerdo con Draluck y Ackerman19 cortes seriados de estas estructuras demuestran en muchos casos su continuidad con una glándula sebácea adyacente, por lo que podría tratarse de conductos sebáceos hiperplásicos atrapados en el interior de la lesión que desarrollan una metaplasia escamosa en su interior. Poblet et al en su estudio hicieron referencia a la inmunorreactividad de calretinina en otras células de la piel, en concreto las que delimitan el conducto excretor de las glándulas sebáceas7. Por lo tanto, la positividad de los remolinos escamosos observada con la tinción con calretinina en nuestro estudio apoya la teoría de Draluck y Ackerman sobre la naturaleza sebácea ductal de estos remolinos escamosos (fig. 4).
El hamartoma quístico folículo-sebáceo probablemente representa lesiones de tricofoliculoma de largo tiempo de evolución. Contiene prácticamente la totalidad de los componentes de un folículo piloso normal, aunque distribuidos de manera aberrante. Los dos casos analizados en este estudio mostraron positividad para calretinina en el conducto excretor de las glándulas sebáceas que componen este hamartoma.
El panfoliculoma está constituido en su mayor parte por células foliculares germinativas y células matriciales, y además muestra diferenciación hacia la vaina radicular externa del folículo piloso al nivel del tallo y del istmo, gránulos de tricohialina, queratina azul-grisácea compacta similar a la que produce la vaina radicular interna queratinizada, islotes amarillo-anaranjados refráctiles de células sombra y pequeños quistes como expresión de diferenciación infundibular tapizados por células espinosas, una capa granulosa bien desarrollada y con gránulos de queratohialina y conteniendo queratina hojaldrada basófila y ortoqueratósica. En nuestro estudio observamos positividad focal para calretinina en la hilera de células que delimita la luz de los quistes con diferenciación tricolemial.
El diagnóstico de carcinoma basocelular con diferenciación folicular puede establecerse cuando uno o más de sus componentes reproducen alguna de las estructuras del folículo piloso normal en cualquiera de sus tres fases del ciclo folicular. Se distinguen carcinomas basocelulares remedando gérmenes foliculares embrionarios, con diferenciación infundibular, diferenciación tricolémica o hacia la vaina radicular externa, diferenciación hacia la vaina radicular interna, matricial y diferenciación folicular en anagen. En nuestro estudio se incluyeron tres carcinomas basocelulares con diferenciación folicular, obteniéndose distintos resultados (fig. 5). Un carcinoma basocelular adenoide-quístico mostraba intensa positividad en todo el epitelio tumoral, un carcinoma basocelular superficial mostraba positividad focal en la hilera periférica del epitelio tumoral y carcinoma basocelular con diferenciación matricial que resultó calretinina negativa.
En los tricoblastomas/tricoepiteliomas el grado de diferenciación folicular es variable de unas lesiones a otras, e incluso de unos cortes a otros dentro de la misma lesión.
Los estudios inmunohistoquímicos han demostrado un patrón de citoqueratinas en los islotes epiteliales del tumor similar al de las células de la hilera celular periférica de la vaina radicular externa del folículo piloso normal, en el segmento comprendido entre la parte del segmento permanente y la parte alta del segmento transitorio20. Se ha demostrado que tanto el tricoblastoma como el carcinoma basocelular expresan de forma constante citoqueratinas CK6hf, CK14 y CK1721. Estos hallazgos sugieren que ambas neoplasias se diferencian hacia la vaina radicular externa del folículo piloso. En nuestro estudio hemos analizado 9 tricoblastomas/tricoepiteliomas, encontrando que la mayoría del epitelio tumoral era calretinina negativo, con discreta positividad focal, hallazgo que apoya la diferenciación hacia las capas más externas de la vaina radicular externa demostrada por los estudios inmunohistoquímicos (fig. 6).
El pilomatricoma es una neoplasia folicular constituida fundamentalmente por epitelio matricial y supramatricial. Las células de los pilomatricomas muestran un patrón de expresión de citoqueratinas similar al de las células de la corteza del tallo piloso y a las de la vaina radicular externa del folículo piloso normal. En los dos pilomatricomas incluidos en este estudio observamos positividad en las hileras celulares cercanas a las células sombra, resultando negativo el resto del tumor, lo que coincide con la expresión de citoqueratinas similares a las de la vaina radicular externa del folículo piloso normal (fig. 3).
El tumor tricolemal proliferante es una neoplasia predominantemente sólida, en la que se distinguen algunas formaciones quísticas, adoptando un patrón en «panal de abeja». El epitelio que reviste cada una de estas estructuras quísticas muestra unas características histológicas similares a las de la vaina radicular externa del folículo piloso al nivel del istmo, o a las del segmento inferior de un folículo piloso en fase catagen avanzada. Los tres tumores tricolemales proliferantes incluidos en este estudio mostraban positividad para calretinina en las capas celulares cercanas a la luz de las estructuras quísticas.
En el estudio histológico del quiste infundibular se observa una cavidad unilocular, tapizada por epitelio poliestratificado con la misma estructura histológica que la epidermis. El análisis de dos quistes infundibulares con la tinción de calretinina no ha detectado positividad en alguna de las estructuras que componen este quiste.
El poro dilatado de Winer está compuesto por uno o más infundíbulos foliculares contiguos, dilatados. La pared está constituida por epitelio infundibular, con una capa granulosa bien desarrollada, y a partir de la pared se proyectan radialmente crestas epidérmicas alargadas que penetran en la dermis adyacente. En nuestro estudio la inmunotinción de esta lesión con calretinina resultó negativa.
El acantoma de la vaina folicular está constituido por lóbulos epiteliales de crecimiento radial, compuesto por células semejantes a las del epitelio de la vaina radicular externa a nivel del istmo folicular, y pueden mostrar empalizada celular periférica. Los dos ejemplos de acantoma de la vaina folicular incluidos en este estudio han resultado intensamente positivos.
En contraste con los resultados obtenidos por Lugli et al2, que no observaron positividad de calretinina en los tumores anexiales de la piel (0 de 35 muestras), nosotros hemos apreciado que algunas neoplasias anexiales con diferenciación folicular, en concreto hacia la vaina radicular externa y más específicamente hacia su capa más interna, muestran positividad con este marcador. Una de las razones por las que se puede observar la tinción de las capas suprabasales de los tumores anexiales es que la calretinina interviene en el ciclo celular, y por tanto se expresaría en las situaciones en las que existe un control anormal del ciclo celular. También hemos demostrado la expresión de calretinina en las glándulas sebáceas, fundamentalmente en el conducto excretor en algunas de ellas.
ConclusionesLa tinción selectiva con calretinina ayuda a distinguir la capa compañera de la vaina radicular externa, de morfología y fisiología diferente al resto de las capas de esta vaina radicular, y que es difícil de evidenciar con la tinción de hematoxilina-eosina. Además nos permite identificar las neoplasias anexiales foliculares o componentes de éstas, con diferenciación hacia la vaina radicular externa. También permite determinar la participación del conducto sebáceo en algunas de estas morfologías.
Futuros estudios con calretinina pueden contribuir a conocer mejor la patogénesis de las enfermedades inflamatorias del folículo piloso, las neoplasias anexiales cutáneas con diferenciación folicular y los síndromes ectodérmicos con anomalías del folículo piloso.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses.