En esta segunda parte se describen las características de los 3 tipos de estudios fotobiológicos: el fototest, la fotoprovocación y la prueba del fotoparche. Se detalla la metodología, los resultados esperados y la utilidad clínica de estos métodos en las distintas fotodermatosis estudiadas. Estos estudios son esenciales para la inducción de fotoadaptación o fototolerancia que se emplea para los casos más invalidantes.
The second of this series describes the characteristics of 3 types of photobiologic studies: the light test, the photochallenge test, and the photopatch test. We explain how the tests are carried out, the expected results, and their clinical usefulness in various photodermatoses. These tests are needed before attempting to induce adaptation (skin hardening or light tolerance) in the most debilitating cases.
Los estudios fotobiológicos agrupan al conjunto de pruebas realizadas en la piel del paciente con la finalidad de determinar tanto el grado de sensibilidad a la luz como las diferentes respuestas cutáneas anómalas. A continuación detallaremos los tipos de estudios que se realizan en la clínica y la interpretación de sus resultados en cada una de las fotodermatosis idiopáticas y exógenas.
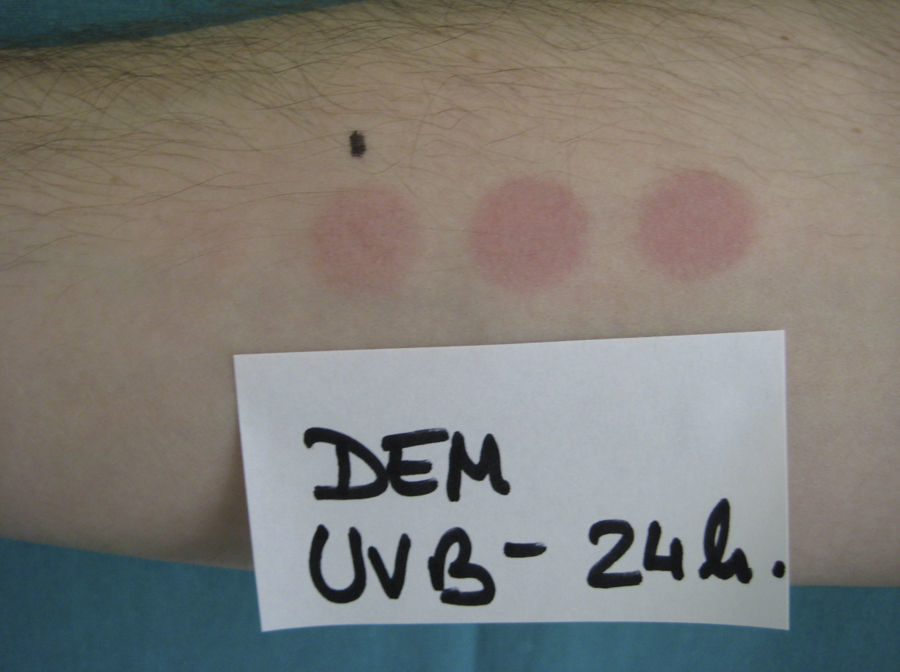
Tipos de estudios fotobiológicosFototestEl fototest es la exposición de un área de la piel a una dosis conocida de luz del espectro UV o visible, seguida de la observación, el registro y la interpretación de la respuesta de la zona irradiada (eritema, habón o pigmentación) en un tiempo preestablecido (por lo general, 24h).
Mediante el empleo de dosis progresivas de radiación lumínica podemos establecer el umbral a partir del cual se desencadenan las distintas respuestas biológicas: la dosis eritematosa mínima (DEM), la dosis urticariana mínima (DUM), la pigmentación inmediata o la dosis mínima de bronceado. Estos 2 últimos son 2 parámetros poco empleados en la práctica clínica, pero tienen aplicaciones a nivel experimental o para la determinación del factor de protección solar de los filtros solares.
Tiene diversas aplicaciones clínicas:
- -
Diagnósticas: para confirmar la urticaria solar (US) o la presencia de fotosensibilidad (umbral de respuesta a la luz disminuido) en algunas fotodermatosis idiopáticas como la dermatitis crónica actínica (DCA), la fototoxicidad sistémica. También puede ayudar a caracterizar algunas fotodermatosis secundarias endógenas, como la protoporfiria eritropoyética o las formas fotosensibles del lupus eritematoso (túmido y subagudo).
- -
Terapéuticas: para calcular la dosis de inicio en las distintas modalidades de fototerapia usadas para la desensibilización de las fotodermatosis (el 30-70% de la DEM).
- -
Pronósticas o de control de respuesta: el fototest realizado en distintos momentos de la evolución puede servir para monitorizar la respuesta a los tratamientos empleados en las fotodermatosis; por ejemplo, puede determinar cambios en la fotosensibilidad de la US tras el inicio del tratamiento con fototerapia o inmunomoduladores.
Idealmente debe realizarse en zonas generalmente no expuestas al sol. El Grupo Español de Fotobiología (GEF) ha establecido la zona lumboglútea como electiva para realizar el fototest, aunque otros autores aceptan la cara volar del brazo o el antebrazo, o el abdomen. Los antihistamínicos y los antiinflamatorios no esteroideos (AINE) deben ser retirados al menos 2 días antes de la prueba; los corticoides, los psoralenos, la clorpromazina y las dosis altas de vitaminas, la semana previa; y la cloroquina y los inmunosupresores, al menos un mes antes del fototest.
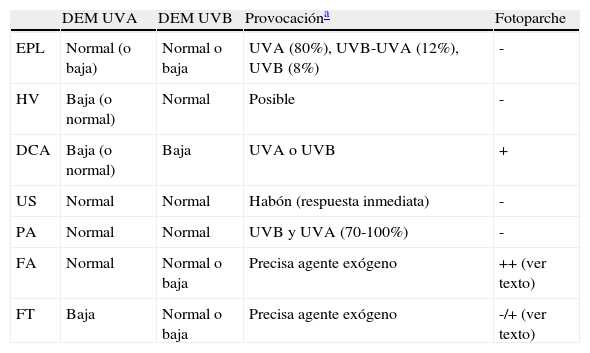
La DEM para una determinada radiación del espectro ultravioleta es la dosis de radiación (enJ/cm2) mínima que se necesita para producir un eritema (fig. 1). Puesto que la radiación UVB es la responsable del eritema, y siempre que no se especifique lo contrario, la DEM es la reacción eritematosa a UVB. Las alteraciones clínicas de la piel inducidas por la radiación UVA se consideran reacciones anómalas a UVA. El eritema se valora generalmente con una exploración visual, pero cuando los márgenes son imprecisos o difusos pueden ser necesarios sistemas cuantitativos más objetivos, como el láser doppler de perfusión1.
Debido a que casi el 100% de la radiación efectiva de producción de eritema es UVB, se emplean comúnmente lámparas fluorescentes de UVB de banda ancha. No obstante, a pesar de su fácil manejo, estabilidad de emisión y bajo coste, la calidad espectral de dichas lámparas poco tiene que ver con la irradiancia solar incidente en la superficie de la tierra, por lo que el mejor sistema empleado para dicho test son los simuladores solares, ya que bajo una buena selección de filtros de interferencia lumínicos se puede llegar a una muy aproximada simulación solar. El uso de este tipo de filtros de interferencia permite conocer también el efecto eritematógeno del UVA solar seleccionando filtros que corten longitudes de onda por debajo de 315-320nm. Los bancos de lámparas fluorescentes que emiten UVA generalmente no tienen la irradiancia suficiente para provocar eritema (salvo que el paciente tenga una clara disminución del umbral a esta parte del espectro, como pasa en algunas reacciones fototóxicas), por lo que se recomienda valorar la fotosensibilidad a UVA mediante el uso de monocromadores, siempre que se disponga de ellos. Hay que recordar que cualquier reacción de la piel a cualquier fuente de luz visible es siempre patológica.
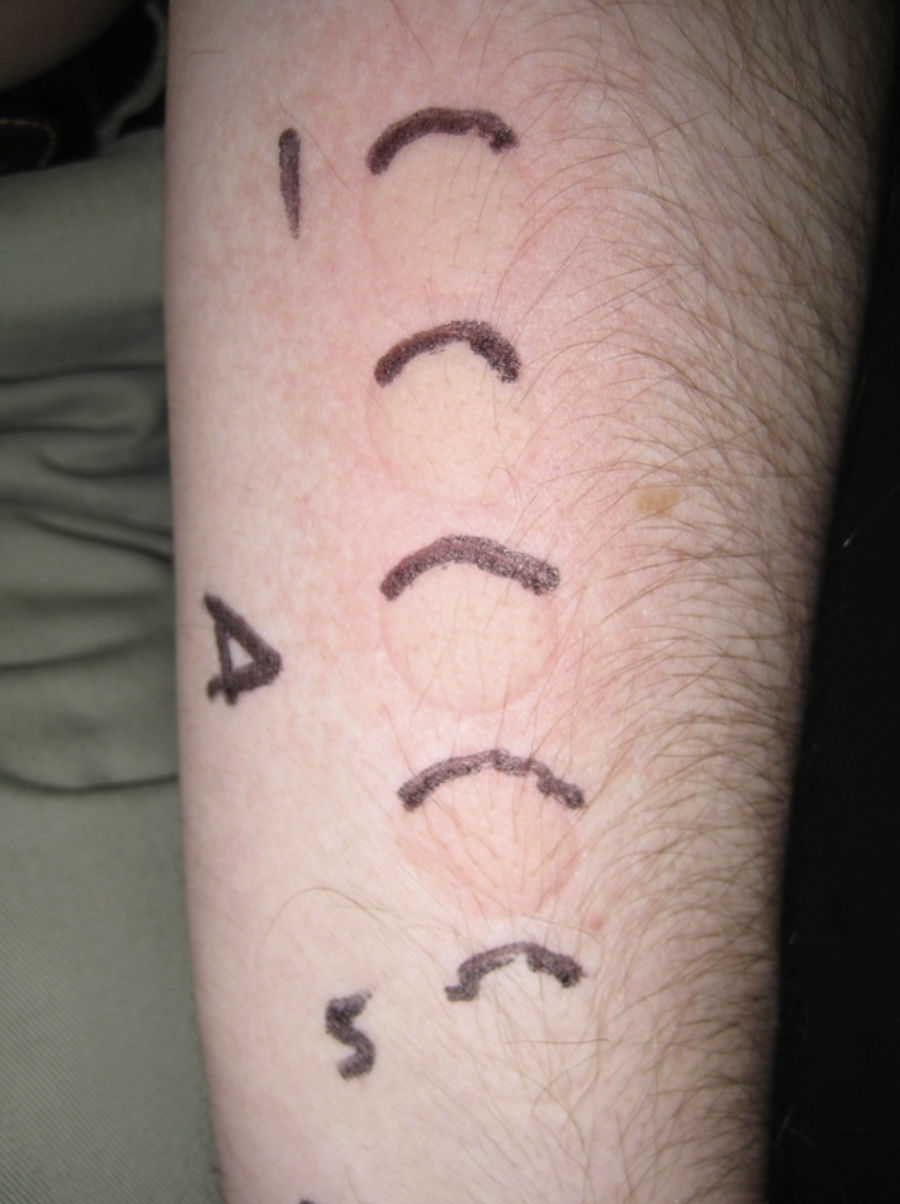
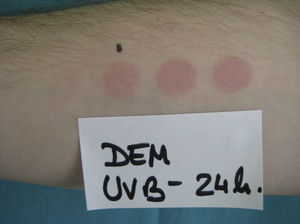
La DUM es la dosis de radiación mínima que se necesita para producir un habón localizado exclusiva o principalmente en la zona irradiada. Debe referirse al espectro de acción (EA): UVB, UVA, luz visible, infrarroja, o una combinación de ellas (fig. 2). Las fuentes de luz visible o luz infrarroja no permiten medir la dosis de irradiación en J/cm2. A diferencia de lo que sucede para medir la DEM, la respuesta suele aparecer a los pocos minutos de la exposición y desaparecer entre 30 y 90min tras el cese de la misma. Existen respuestas retardadas (a veces de varias horas) como consecuencia de la existencia de espectros de inhibición.
Dosis urticariana mínima en una urticaria solar.
Respuesta habonosa. DUM obtenida mediante una lámpara fluorescente con 5 spots y un filtro que permite determinar la dosis de exposición según el tiempo de contacto con la piel (Gigatest UVB, Medisun, Francia). (Fotografía cedida por el Dr. Diego de Argila. Hospital La Princesa, Madrid.)
En sentido estricto, el fototest en la US es en realidad un test de fotoprovocación. Es difícil de estandarizar debido a una serie de variables individuales como son el fototipo, el grado de bronceado, la zona de provocación o factores alimentarios (como ciertos colorantes). Para determinar el EA, el European Dermatology Forum recomienda usar un simulador solar o un monocromador para la exposición de 3 zonas diferentes de los glúteos a 6J/cm2 de UVA, a 60mJ/cm2 de UVB y a un proyector de diapositivas durante 10min. Se ha establecido una escala de 6 puntos para graduar la respuesta: 0: no reacción; (+): solo eritema perceptible (correspondería a la DUM);+: eritema localizado en las zonas irradiadas; ++: eritema más allá del área irradiada; +++: habón en alguna parte de la zona irradiada; ++++: habón en toda la zona irradiada. La exposición a dosis crecientes de UV permite determinar la DUM.
FotoprovocaciónEs la exposición repetida de un área de la piel a una dosis preestablecida de una banda más o menos estrecha del espectro electromagnético con objeto de reproducir las lesiones clinicopatológicas del proceso que se desea estudiar. Debe realizarse en zonas generalmente no fotoexpuestas y en un área más grande que la del fototest (preferiblemente 5×8cm), pues las respuestas a veces son papulosas y dispersas y podrían infravalorarse si se radiaran campos más pequeños.
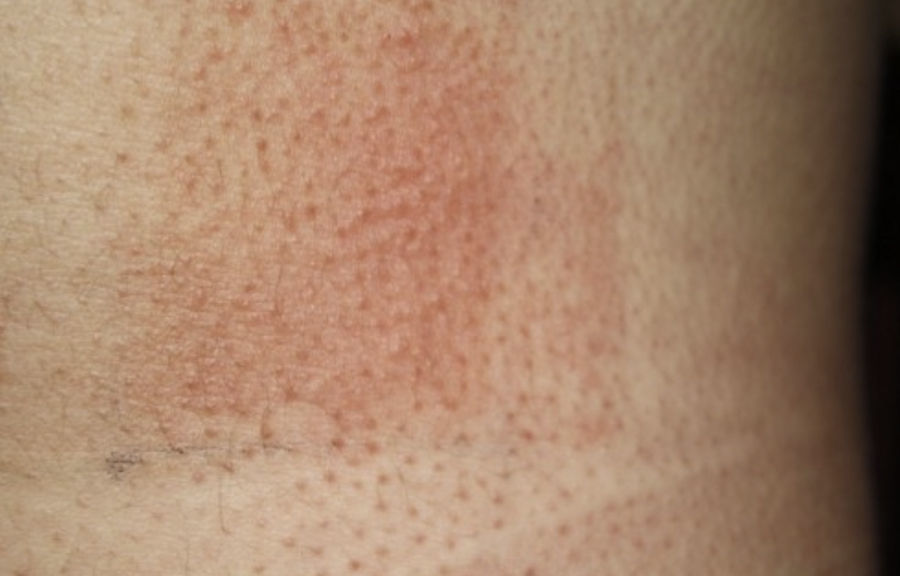
Para la fotoprovocación de la erupción polimorfa lumínica (EPL) se ha propuesto un protocolo de irradiación durante 3 días seguidos de un área de 5×8cm de piel previamente expuesta con fuentes policromáticas de UVA a dosis de 60-100J/cm2 (fig. 3) y de UVB a dosis de 1,5 veces la DEM UVB, realizando lecturas a las 24 y 72h2. Otros autores consiguen fotoprovocar en el brazo con dosis inferiores de UVA (10-20J/cm2 durante 4 días) y UVB de banda estrecha (UVBBE) (0,4 y 0,8J/cm2, de 2 a 4 días) usando luces fluorescentes colocadas en un dispositivo cilíndrico en el que se introduce el miembro3. Es importante distinguir las lesiones provocadas del eritema cuando se radia con UVB. La mejor época para provocar las lesiones de EPL es el principio de la primavera, antes de las importantes exposiciones solares del verano.
Para la fotoprovocación de lesiones de DCA se recomienda la radiación durante 3 días seguidos de un área de 5×8cm de piel no expuesta al sol con fuentes de UVA (dosis de 0,5; 1; 5; 10; 20 y 30J/cm2) y de UVB (dosis de 0,5; 1; 1,5 veces la DEM UVB), realizando lecturas a las 24, 48, 72h, y a la semana2. Se recomienda hacer la fotoprovocación antes que la prueba del fotoparche. Sin embargo, el fototest en estos pacientes es generalmente muy elocuente; las DEM son muy bajas, y las reacciones anómalas a la radiación UVA, la norma, por lo que a menudo no es necesario realizar la fotoprovocación para establecer el diagnóstico.
Los resultados de la fotoprovocación varían ampliamente según las series, lo que, unido a lo laborioso y prolongado de la prueba, hace que tenga una utilidad práctica limitada. Puede ser útil en los casos de EPL con una historia clínica confusa, o en las formas fotosensibles de lupus eritematoso4.
FotoparcheLa prueba del fotoparche se realiza cuando la historia clínica y la exploración física sugieren un cuadro clínico de fotosensibilidad en el que pueden estar implicadas diversas sustancias químicas exógenas. Es una técnica indicada en el diagnóstico de la dermatitis de contacto fotoalérgica, y en la evaluación de algunas fotodermatosis idiopáticas (como la DCA) o inexplicables por la historia clínica.
Es, por lo general, compartida por las unidades de fotobiología y de contacto5. El fotoparche se ha realizado en diferentes centros con diferencias significativas en la metodología, incluyendo las clases de alérgenos utilizados, el vehículo, la concentración, el tiempo de oclusión, la dosis y el tipo de irradiación, el periodo de lectura, y la interpretación de los resultados. Un grupo de dermatólogos y fotobiólogos europeos se reunió para estandarizar la mayoría de estos parámetros y facilitar la comparación de los resultados en diferentes centros5. Sin embargo, la composición y modificación de los alérgenos en las diferentes series de fotoalérgenos depende de la zona geográfica y de la presencia de los mismos en un periodo de tiempo determinado. En los últimos años se han publicado varias series de fotoparche para establecer su frecuencia y observar cuáles son los alérgenos responsables de la fotoalergia6–12.
El GEF publicó los resultados de un estudio de fotoalérgenos y acordó incluir en la próxima serie de fotoparche la mayoría de los AINE y filtros solares comercializados en España13. En un estudio múticéntrico europeo se confirmó que la batería europea de fotoalérgenos deberá contener filtros solares y AINE14.
Actualmente la técnica se realiza mediante la aplicación oclusiva de las series descritas de alérgenos, por duplicado, durante 2 días, habitualmente en la parte superior de la espalda, al lado de la columna vertebral, en varios soportes. A las 48h (D2) las series de parches se levantan y se anota cualquier reacción cutánea. Posteriormente se cubre con material opaco una de las series duplicadas, y la otra se irradia con 5J/cm2 de UVA, medida con un radiómetro. En los pacientes con DCA puede ser necesario irradiar con dosis suberitematógena de UVA para evitar la confusión con reacciones anómalas a UVA. Tras confirmar las reacciones cutáneas después de la irradiación, se realiza otra lectura en D4 (2 días después de la irradiación) y se valoran las reacciones de acuerdo con la escala consensuada por el Grupo de Investigación Internacional de Dermatitis de Contacto (tabla 1). En caso de duda en la lectura en D4, se realizará otra adicional en D715.
Intensidad de las reacciones cutáneas del fotoparche según la escala del Grupo de Investigación Internacional de la Dermatitis de Contacto
| - | No reacción |
| +/- | Reacción dudosa (solo eritema) |
| + | Reacción débil positiva (eritema, infiltración, pápulas) |
| ++ | Reacción positiva intensa (eritema, infiltración, pápulas, vesículas) |
| +++ | Reacción muy intensa (eritema, infiltración, vesículas, ampollas) |
El tipo de lámpara utilizado, el tiempo de oclusión y la dosis de irradiación son parámetros importantes que hay que tener en cuenta al realizar el fotoparche. Se ha confirmado que el tipo de lámpara utilizado para la irradiación puede afectar los resultados8. La fuente ideal de luz debe emitir un espectro continuo de radiación UVA (320 a 400nm) con suficiente irradiancia para generar de 5 a 10J/cm2 en un tiempo razonable (de pocos minutos)16. En un estudio se analizaron 3 aparatos diferentes con espectro de emisión distintos utilizados en la prueba del fotoparche. Se demostró que el aparato que emitía radiación UVA de amplio espectro era el más sensible17. Se ha confirmado en un trabajo posterior que con la irradiación con UVA se obtienen más reacciones positivas15.
Tradicionalmente, en las unidades de eccema de contacto el fotoparche se irradiaba 2 días después de la aplicación oclusiva, mientras que en las unidades de fotobiología la irradiación se realizaba 24h después. Se ha demostrado que la técnica de irradiación de los alérgenos 2 días después de la aplicación oclusiva es más sensible para detectar la fotoalergia18.
La dosis de irradiación en la mayoría de los estudios varía entre 1 y 10J/cm2. En algunos trabajos19,20 se ha recomendado una dosis de 5J/cm2 para realizar el fotoparche. En 2004 el GEF acordó seguir las recomendaciones del European Task Force for fotopatch test irradiando con 5J/cm213. En el trabajo recientemente publicado por Kerr14, se ha irradiado con 5 y 2,5J/cm2, obteniéndose un porcentaje de resultados mucho más alto con la primera opción, por lo que si no hay contraindicación, 5J/cm2 debería ser la dosis elegida.
La concentración óptima para realizar el fotoparche con los filtros solares se ha consensuado en los últimos años. Actualmente la mayoría se parchean al 10% en vaselina. La benzofenona-4 no debe parchearse a una concentración superior al 2% en vaselina por los falsos positivos que puede provocar21. Sin embargo, los estudios realizados con filtros solares22,23 han demostrado que la mayoría de las reacciones cutáneas están producidas por los efectos irritativos de los filtros y sus excipientes.
Propuesta de esquema para un estudio fotobiológicoNo existen guías o protocolos consensuados para la realización de los estudios fotobiológicos. Como se mencionó previamente, es difícil controlar todas las variables individuales y circunstanciales del paciente para que estos estudios sean fiables y repetibles.
Algunos autores proponen, en base a su experiencia, el siguiente esquema de estudio24:
- -
El día 1 se realiza un fototest con UVB, UVA y luz visible con lectura inmediata para identificar la posible aparición de habones. También se colocan 2 baterías duplicadas de fotoalérgenos.
- -
El día 2 se realiza la lectura de la DEM UVB y se expone una de las series de fotoalérgenos a una dosis de 5-10J/cm2 de UVA o bien al 50% de la DEM UVA.
- -
Los días 3 y 5 se realizarán las lecturas de las baterías irradiadas y no irradiadas del fotoparche.
Sin embargo, no todas las pruebas están indicadas en todos los pacientes, y una cuidadosa historia clínica permite, por lo general, la sospecha de una fotodermatosis, lo que orientará la selección apropiada de pruebas que son precisas para su estudio.
Aplicación clínica de los estudios fotobiológicosResultados y utilidad de los estudios en las distintas fotodermatosisLas respuestas esperables a los estudios fotobiológicos de las diversas fotodermatosis idiopáticas se resumen en la tabla 2.
Respuestas esperables al fototest y la prueba del fotoparche
| DEM UVA | DEM UVB | Provocacióna | Fotoparche | |
| EPL | Normal (o baja) | Normal o baja | UVA (80%), UVB-UVA (12%), UVB (8%) | - |
| HV | Baja (o normal) | Normal | Posible | - |
| DCA | Baja (o normal) | Baja | UVA o UVB | + |
| US | Normal | Normal | Habón (respuesta inmediata) | - |
| PA | Normal | Normal | UVB y UVA (70-100%) | - |
| FA | Normal | Normal o baja | Precisa agente exógeno | ++ (ver texto) |
| FT | Baja | Normal o baja | Precisa agente exógeno | -/+ (ver texto) |
DCA: dermatitis crónica actínica; DEM: dosis eritematosa mínima; EPL: erupción polimorfa lumínica; FA: fotoalergia; FT: fototoxicidad; HV: hidroa vacciniforme; PA: prurigo actínico; US: urticaria solar; UVA: ultravioleta A; UVB: ultravioleta B.
Adaptada de Byalite 2009 (Br J Dermatol. 2009;161 Suppl 3: 61-8).
El mejor método diagnóstico de la EPL es una historia clínica cuidadosa, detallando la relación entre la reacción cutánea, la exposición lumínica y la evolución de las lesiones. El problema se presenta cuando estos pacientes, que acuden a la consulta a menudo semanas o meses después de la reacción cutánea, tienen una historia clínica no concluyente. El estudio fotobiológico (fototest y fotoprovocación) puede ser, en estos pacientes, una buena herramienta diagnóstica y predictiva para determinar su gravedad3,25–27.
Los pacientes con EPL suelen tener un umbral normal de fotosensibilidad, es decir, la sensibilidad a UVA y la DEM UVB son generalmente normales, aunque pueden estar reducidas en las formas más graves. Sin embargo, un estudio restrospectivo de 110 casos de EPL mostró una DEM UVB disminuida en el 43% de los varones, pero no de las mujeres25.
Los resultados de la fotoprovocación son poco consistentes en las distintas series de pacientes con EPL26. Algunos estudios encuentran dificultades para provocar lesiones de EPL en la mayoría de los pacientes26. En otros, la fotoprovocación puede ser positiva hasta en el 93% de los casos, la mayoría de los cuales es inducido por UVA o por UVA y UVB, y solamente una minoría exclusivamente por UVB25,27. En una serie de 68 pacientes, se consiguió fotoprovocar una EPL en el 56% de los casos con lámparas fluorescentes de UVA, en el 50% de los casos con UVBBE, y en el 80,9% de los pacientes cuando se usaban ambas fuentes de luz3; sin embargo, solo consiguieron fotoprovocar con UVB de banda ancha el 18% de ellos. La capacidad de provocación con UVA se asoció a la juventud de los pacientes y a los valores de DEM más bajos3.
El EA y la dosis de provocación pueden variar en un mismo paciente a lo largo del tiempo, probablemente como consecuencia de diferencias estacionales27. Algunos autores sugieren que incluso podría variar en los distintos tipos de lesiones de la EPL28.
La mayor proporción de UVA/UVB durante la primavera en climas templados podría explicar la mayor incidencia de EPL en estos países que en las zonas tropicales29. Además, el uso de fotoprotectores que protegen del eritema, pero no de los efectos de la radiación por UVA, podría conllevar una mayor exposición solar, lo que podría explicar, en parte, la falta de eficacia de estos agentes para prevenir las lesiones de EPL29. Por otro lado, un ensayo controlado, abierto, intraindividual, con estudios de fotoprovocación, demostró, sin embargo, que los filtros solares que protegen tanto para UVB como para UVA son eficaces para prevenir la EPL30.
La respuesta a la fotoprovocación permite evaluar el tipo de lesión que predomina en la EPL (pápula, placa, vesícula o eritema) y realizar biopsias de las respuestas a la luz para realizar el correlato clinicopatológico2. Sin embargo, otros autores encuentran que la provocación con fuentes artificiales o dosis suberitematógenas de sol natural ofrece resultados contradictorios y difíciles de interpretar, como consecuencia del gran número de variables (dosis de irradiación, localización de la exposición, grado de tolerancia del paciente en ese momento, etc.)24.
La alta proporción de pacientes con EPL con pruebas de fotoparche positivas a fragancias y filtros solares encontrada en una serie25 podría deberse, tal y como opinan sus autores, a una mayor exposición a estos productos de estos pacientes. Pero también podría tratarse de confusiones entre los verdaderos fotoeccemas de contacto por filtros solares y la EPL, dado que la mayor parte de los pacientes con este tipo de fotoeccema no suelen atribuir la reacción cutánea al uso de cremas solares.
Hidroa vacciniformeLa mayoría de los casos tiene un EA en UVA, muy pocos en UVB31. La fotosensibilidad a UVA está reducida en algunos pacientes, aunque puede ser normal.
La irradiación repetida de UVA de amplio espectro a dosis de 30, 50 y 75J/cm2 tanto en zonas afectadas como respetadas de hidroa vacciniforme (espalda o brazos) puede provocar lesiones eritematovesiculosas histológicamente idénticas a las provocadas por la luz solar en estos pacientes, con un proceso similar de cicatrización24. También se han podido fotoprovocar las lesiones en la mucosa oral con 10J/cm22.
Urticaria solarLa realización del fototest permite conocer el EA (UVB, UVA, luz visible, o una combinación de ellas) y el grado de fotosensibilidad mediante la determinación de la DUM. Cualquier respuesta inmediata habonosa tras cualquiera de los 3 tipos de luz debe considerarse positiva.
La mayor parte de los casos son provocados por la luz visible (hasta el 57%) con o sin la participación de UVA32. Hasta el 20% tienen un EA amplio que incluye UVB, UVA y luz visible, pero las US inducidas solamente por UV son raras32. Existen diferencias geográficas o étnicas, de manera que los pacientes europeos parecen más sensibles a la UV o a los espectros amplios (UV-luz visible) que los japoneses, que lo son a la luz visible exclusivamente33. Se han descrito también casos con EA en el rango infrarrojo31. El EA suele ser el mismo a lo largo de los años de evolución de la enfermedad, aunque ocasionalmente se expande hacia las longitudes de onda mayores34.
Algunos pacientes presentan una inhibición de la respuesta habonosa cuando la piel irradiada con el EA vuelve a irradiarse inmediatamente después con una longitud de onda mayor (de 500 a 630nm)35. Es lo que se conoce como el espectro de inhibición, que se ha demostrado hasta en el 68% de las series japonesas y que probablemente sea el resultado del bloqueo que esta luz ocasiona en la unión del fotoproducto a la IgE o al mastocito36. Podría explicar aquellos casos en los que no puede fotoprovocarse la US mediante fuentes artificiales y sí con la fotoexposición natural37,38, y también aquellos con una respuesta diferida (incluso de horas tras la exposición). Además, podría tener un papel en la inducción de fototolerancia tras la irradiación repetida con fuentes usadas en la fototerapia.
También se ha observado que algunos pacientes con EA en el rango de UVA pueden experimentar un aumento de la intensidad y la extensión de la respuesta habonosa si son irradiados previa, simultánea o inmediatamente después con una luz de longitud de onda mayor que el EA (en el rango visible)39,40. Es lo que se conoce como el espectro de aumento (EAU), que no de adición, pues no sucede cuando se invierte el orden de la irradiación. Probablemente, la preirradiación con luz visible ocasiona una activación del cromóforo que de esta forma puede absorber más EA. El EAU (presente hasta en el 29% de los pacientes) podría explicar los pequeños cambios en la fotosensibilidad de algunos pacientes, incluso diarios, medidos mediante la DUM, si bien estos suelen ser de escasa relevancia clínica34. La interacción entre el EA y el EAU podría hacer que pequeñas exposiciones al sol provoquen la US en pacientes que precisan, en cambio, grandes dosis de radiación de fuentes artificiales para responder31.
Es importante tener en cuenta que un fototest negativo a una única fuente de luz, o incluso a varias, no descarta el diagnóstico de US. En estos casos es imprescindible la exposición natural al sol cenital de la parte superior del tronco durante 15-30min, preferiblemente durante la primavera o el otoño.
Dermatitis crónica actínicaSalvo en las fases muy iniciales en las que la enfermedad es poco sintomática, el fototest (realizado con simulador solar u otras fuentes de amplio espectro) es casi siempre anormal en la DCA41. La mayoría de los pacientes son sensibles a la UVB, pero se han descrito casos ocasionados por UV de amplio espectro e incluso por UVA exclusivamente. Hay muy pocos casos inducidos exclusivamente por luz visible, en una banda alrededor de 600nm, y aunque estos pacientes no cumplirían los criterios diagnósticos de DCA, algunos autores aceptan que podría tratarse de casos especiales con diferentes cromóforos42.
La DEM UVB está casi siempre disminuida a las 24h, pero la reacción no es solo eritematosa, sino papulosa o eccematosa, y muy pruriginosa. El pico de la reacción aparece entre las 7 y las 24h del fototest. En ocasiones, la extensión de las lesiones a gran parte del tegumento hace difícil escoger la zona de piel para realizarlo. Si el cuadro es muy intenso, en ocasiones es recomendable mantener al enfermo durante varios días en una habitación en penumbra para poder suspender los corticoides tópicos o sistémicos o la medicación inmunosupresora sin ocasionar un indeseado agravamiento de la sintomatología. Un fototest normal obliga a descartar otros procesos similares, como la dermatitis atópica o seborreica fotoagravada o el linfoma cutáneo de células T.
Diferentes alérgenos y fotoalérgenos, muchos aerotransportados, pueden iniciar y mantener la DCA, siendo apropiado realizar el estudio con pruebas epicutáneas y fotoparche. La frecuencia de alergia de contacto con reacciones positivas a uno o más alérgenos puede ocurrir hasta en el 80% de los pacientes43–48. El estudio debe realizarse con una serie de alérgenos amplia, que incluya la serie estándar de alérgenos de cada país, medicaciones tópicas, filtros solares, y serie de plantas. Los alérgenos de contacto con más reacciones positivas son las oleorresinas de las plantas compuestas, metales, fragancias, colofonia, antioxidantes de las gomas, sesquisulfuro de fósforo y filtros solares, según los resultados obtenidos en las diferentes series estudiadas43–48.
Hay que tener en cuenta que en algunos pacientes el fotoparche no es posible realizarlo con dosis de UVA de 5J/cm2 porque con esta dosis pueden desarrollar una respuesta eritematosa anormal en las zonas irradiadas. En estos pacientes es preciso relizar el fotoparche irradiando con una dosis suberitematógena de UVA en función de la DEM UVA del paciente. Es importante parchear al paciente cuando el cuadro clínico esté inactivo para evitar falsos positivos que pueden aparecer en el contexto del síndrome de la espalda irritable.
La DCA es un cuadro clínico persistente en el que la fotosensibilidad solo se resuelve en un 20% de pacientes después de 10 años, según el estudio de una cohorte atendida en un centro de referencia terciario49. La resolución de la alergia de contacto en las series en las que se ha estudiado es excepcional49,50, y evitar el contacto con estas sustancias y una fotoprotección adecuada son necesarias para la mejoría progresiva de las lesiones clínicas49. Aquellos pacientes que presentan una fotosensibilidad intensa o una alergia de contacto a múltiples alérgenos no relacionados tienen un pronóstico peor49.
Prurigo actínicoLas DEM UVA y UVB en el fototest son generalmente normales51.
Con luz monocromática puede encontrarse una fotosensiblidad anormal a la UVB con dosis de 50-60mJ/cm2 hasta en dos tercios de los pacientes mejicanos con prurigo actínico51. Se han podido reproducir experimentalmente las lesiones con 3-5mJ/cm2 al día de UVB durante 15 días, y con 2,5J/cm2 al día de UVA durante 10 días51. Las lesiones fotoprovocadas son similares a las de la EPL52.
Fotosensibilidad exógena (inducida por medicamentos y otros agentes químicos): fototoxicidad y fotoalergiaLas reacciones fototóxicas se diagnostican mediante la realización del fototest durante el uso del agente sospechoso y después de haberlo suspendido. La normalización de una DEM disminuida al suspender el fármaco sospechoso confirma la fototoxicidad debida al mismo y permite identificar el agente responsable en pacientes polimedicados. Debe realizarse en una zona sin lesiones (no fotoexpuesta). Clásicamente se presenta como una fotosensibilidad muy reducida a UVA (y, mucho menos frecuente, a UVB) durante la toma de la medicación, y que se normaliza días después de la suspensión de la misma.
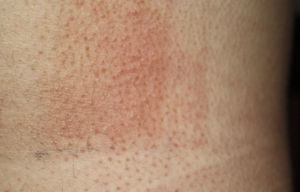
Las reacciones fototóxicas y fotoalérgicas deben estudiarse mediante la prueba del fotoparche (fig. 4). Las reacciones a esta prueba deben ser interpretadas de acuerdo con el siguiente esquema8,10:
- 1.
Fotoalergia de contacto, cuando el alérgeno del lado irradiado es positivo y el otro no muestra ninguna reacción.
- 2.
Alergia de contacto, cuando el alérgeno es positivo en el lado irradiado y en el no irradiado.
- 3.
Negativo, cuando no se produce ninguna reacción en ningún lado.
- 4.
Alergia de contacto fotoincrementada, cuando la reacción cutánea es más intensa en el lado irradiado.
- 5.
Alergia de contacto fotoinhibida, cuando la reacción cutánea es menos intensa en el lado irradiado.
- 6.
Reacción irritativa, cuando la morfología y el patrón evolutivo son característicos de la irritación.
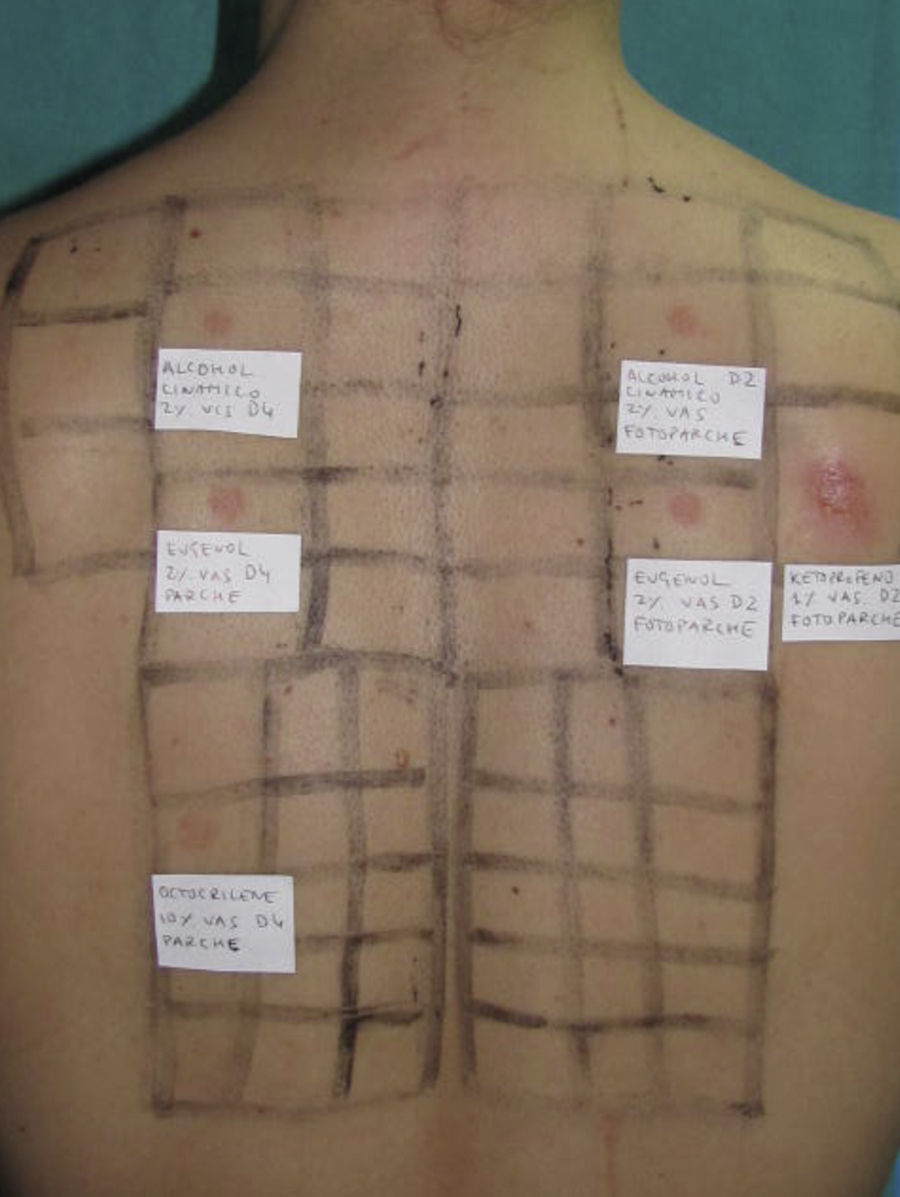
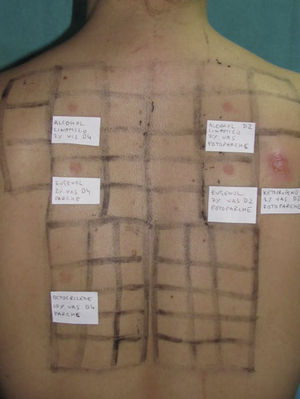
Prueba del fotoparche.
Batería de filtros solares y componentes de la mezcla de fragancias i. Fotoeccema alérgico de contacto por AINE: fotoparche positivo al ketoprofeno. La reacción al octocrilene (batería de filtros solares) en la zona del parche es probablemente irritativa y la negatividad en la zona del fotoparche podría explicarse por un posible efecto inhibidor de UVA.
En un intento por diferenciar la respuesta fotoalérgica de la fototóxica se han descrito 4 patrones morfológicos en el fotoparche: una respuesta típica «in crescendo» de fotoalergia, una respuesta «in decrescendo» con positividad inmediata de fototoxicidad, una respuesta «en meseta» y otra «combinada» con patrón inmediato y retardado de naturaleza desconocida53.
Finalmente, el aspecto clave del fotoparche es la determinación de la relevancia de las reacciones positivas en función de la historia clínica, la presencia del alérgeno y la existencia de una relación temporal entre la exposición UV y la aparición de la fotosensibilidad. En las décadas de los 60 y 70, las salicilanilidas halogenadas y los fenoles clorinados (fenticlor) utilizados como antibacterianos en jabones fueron los fotoalérgenos que con más frecuencia resultaban positivos. La fragancia musk ambrette fue retirada del mercado hace años, aunque puede ser importada de productos asiáticos54, y ser relevante en casos de fotoalergia de contacto.
Actualmente la frecuencia de las reacciones positivas en el fotoparche es baja5,13,53. Los filtros solares8 y los AINE9 están implicados en la mayoría de las dermatitis de contacto fotoalérgicas, seguidos de la mezcla de fragancias10, prometacina11 y algunas plantas48,55. En nuestro medio, el ketoprofeno ocupa el primer lugar en la lista de fotoalérgenos, seguido a distancia de la bencidamida y el etofenamato13. Además, la mezcla de fragancias no suele producir reacciones fotoalérgicas, sino de contacto. También en otros países es frecuente la fotoalergia por ketoprofeno, como en Bélgica56 y Suecia57, siendo consecuencia, al menos en parte, de los hábitos de prescripción y de la capacidad fotosensibilizante propia de la molécula58. Tiene reacción cruzada con la benzofenona-3, con el aldehído cinámico de la mezcla de fragancias, y con el fenofibrato56,57. En un estudio multicéntrico europeo publicado en 2012 se observa que el ketoprofeno, el etofenamato, el octocrileno y el butil metoxidibenzoilmetano son las sustancias químicas responsables de la mayoría de las fotoalergias de contacto14.
La fotoadaptación o fototolerancia cutánea («skin hardening»)Se sabe que la exposición a pequeñas dosis de radiación UV induce un cierto grado de fotoprotección natural. La fotoadaptación o «skin hardening» es un fenómeno utilizado para el uso de la fototerapia preventiva en el manejo del paciente con una fotodermatosis o fotosensibilidad14,59. Su aplicación terapéutica está bien establecida en la EPL y en la US.
Su mecanismo es desconocido, pero se ha atribuido a un incremento de la síntesis de melanina, a un engrosamiento del estrato córneo, a una disminución del hipotético antígeno, o a una combinación de todos estos factores. Pero sin duda existe participación de mecanismos inmunológicos. Se ha demostrado que la radiación UV induce cambios en las células de Langerhans y otras células inflamatorias de la piel (linfocitos, macrófagos y neutrófilos).
Los estudios fotobiológicos son esenciales a la hora de establecer el grado de fotosensibilidad de cada paciente para poder determinar la dosis inicial y los incrementos de la fototerapia para inducir fototolerancia.
Erupción polimorfa lumínicaLas alteraciones observadas en pacientes con EPL pueden ser revertidas tras la exposición repetida a UVB, que mejora las respuestas migratorias de estas células inducidas por UV en estos pacientes, especialmente en aquellos en los que la fotoprovocación es positiva60.
En estos pacientes, la mayor proporción de UVB/UVA durante los meses estivales podría explicar la reducción del número de lesiones a finales de dicho periodo, como resultado del efecto inhibitorio de la inmunosupresión ocasionada por la UVB en la piel61. La fototerapia de tipo UVBBE o PUVA realizada durante la primavera puede inducir tolerancia y prevenir el número y la intensidad de los brotes de ciertas fotodermatosis, sin que se hayan encontrado diferencias significativas en la eficacia de ambos tipos61,62. La UVBBE puede incluso inducir un incremento del umbral de fotosensibilidad a la UVA en aquellos pacientes que la tienen disminuida, es decir, mejora la fotosensibilidad a UVA, además de prevenir la aparición de lesiones de EPL14. Los pacientes generalmente precisan mantener breves exposiciones diarias al sol o a las fuentes artificiales de la fototerapia durante el periodo estival. Los resultados de la fotodesensibilización son independientes de la presencia o no de fototolerancia natural (fotoexposición solar) recogida en la historia de estos pacientes62.
Urticaria solarLa fototolerancia observada en la US podría estar en relación con la fotoinhibición de las respuestas observada antes o después de la irradiación con longitudes de onda mayores que las del EA. Estas podrían actuar fotoinactivando el alérgeno endógeno o estabilizando la membrana del mastocito, la principal célula efectora. Sin embargo, el hecho de que la fotoinhibición se produzca tras la preirradiación con el EA conduce a pensar que el mecanismo podría radicar en algún tipo de bloqueo o interferencia de la unión del fotoalérgeno, la IgE y el mastocito, o disminuyendo la producción de IgE patógena63.
Se ha conseguido inducir tolerancia en pacientes con US mediante fototerapia UVA64, con dosis crecientes y repetidas de UVA durante 2-3 días65, combinando PUVA como inductor y UVA de mantenimiento66, y con UVBBE67. Se usan pautas de 8 a 15 sesiones y en todos los casos los pacientes deben seguir haciendo exposiciones diarias cortas durante el verano. No parece que la inducción de fototolerancia dependa del EA, pero debería realizarse una determinación de DUM UVA y UVB para determinar la dosis de inicio y los incrementos. En cualquier caso, dicha tolerancia suele perderse en pocos días, por lo que se recomienda mantener una dosis de exposición regular al sol o en las cabinas de fototerapia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del Comité de Experimentación Humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los sujetos incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo no ha recibido financiación de ningún tipo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.