Los pacientes con carcinoma basocelular (CB) tienen riesgo de CB subsiguientes. El imiquimod podría reducir dicho riesgo mediante su efecto sobre el campo de cancerización.
ObjetivoExaminar la capacidad de imiquimod para reducir CB subsiguientes.
MétodosEstudio de cohorte retrospectivo de los pacientes con CB tratados en nuestro centro entre 2003 y 2011. Se establecieron 2 grupos según hubieran sido tratados con cirugía o imiquimod. Se comparó entre ambos la aparición de nuevos CB, analizando la proximidad del segundo CB respecto al primero (local, mismo territorio linfático, misma región anatómica, otro territorio) y el tiempo transcurrido entre el primer y segundo tumor. Para el análisis de los datos se emplearon estudios de supervivencia.
ResultadosSe revisaron 623 pacientes: 550 tratados con cirugía (88,3%), 2 con crioterapia y 71 con imiquimod (11,4%). Doscientos veintisiete pacientes (36,4%) presentaron un segundo CB (38,2% en el grupo cirugía, 23,9% en el grupo imiquimod, p=0,02). La función de riesgo (hazard ratio) de sufrir un segundo CB cuando fueron tratados con cirugía comparado con imiquimod fue 2,13 (1,28-3,53). El imiquimod mostró menor riesgo de segundo CB a nivel local, regional y en el territorio linfático. Limitaciones: la naturaleza retrospectiva del estudio y el número de pacientes tratados con imiquimod fue limitado.
ConclusionesEl tratamiento del CB con imiquimod podría reducir el riesgo de segundos CB. Este efecto podría permanecer hasta 2 años y se presentaría en los campos de cancerización local, regional y linfático. Creemos que el concepto de campo de cancerización debería extenderse no solo a nivel local, sino también regional y linfático.
Patients with basal cell carcinoma (BCC) have an increased risk of subsequent BCCs. It is possible that imiquimod might reduce this risk by acting on the cancerization field.
ObjectiveTo examine the ability of imiquimod to reduce subsequent BCCs.
MethodsRetrospective cohort study of patients with BCC treated at our hospital between 2003 and 2011. The patients were divided into 2 groups depending on whether they had been treated with surgery or with imiquimod. Comparing the 2 groups, we analyzed the development of new BCCs, the time that elapsed between first and subsequent tumors, and the site of occurrence of the second BCC with respect to the first one (local, same lymphatic drainage basin or anatomic region, or other). Survival methods were used to analyze the data.
ResultsWe reviewed the charts of 623 patients. Of these, 550 had been treated with surgery (88.3%) and 71 with imiquimod (11.4%). Overall, a second BCC occurred in 36.4% of patients (n=227). The rate of occurrence was 38.2% in the surgery group and 23.9% in the imiquimod group (P=.02). The hazard ratio for the occurrence of a subsequent BCC was 2.13 (95% CI, 1.28-3.53) for patients treated with surgery compared with those treated with imiquimod. Imiquimod reduced the risk of a second BCC locally, regionally, and in the lymphatic drainage area. Our findings are limited by the retrospective nature of our study and the small number of patients treated with imiquimod.
ConclusionsImiquimod may reduce the risk of subsequent BCC in patients treated for BCC and its effect could last for up to 2 years in local, regional and lymphatic cancerization fields. We believe that the cancerization field concept should be expanded to include not only the local area, but also the pertinent anatomic region and the regional lymphatic drainage area.
El carcinoma basocelular (CB) es el tumor humano más frecuente y su incidencia mundial se ha incrementado sobremanera en las últimas décadas1. Los pacientes con un CB previo tienen mayor riesgo de padecer un segundo y subsiguientes CB. El riesgo de sufrir un segundo CB se estima en un 22-50%2–5.
La exposición solar es el principal factor de riesgo para el cáncer de piel. Cuando un cáncer de piel aparece el área alrededor del tumor primario ha recibido un daño solar similar, de modo que esta área tiene teóricamente un riesgo muy similar de desarrollar un nuevo cáncer de piel. Este concepto ha sido denominado campo de cancerización, y se ha descrito para muchos tumores epiteliales6–8. Sin embargo, la presencia de un campo de cancerización para el CB es discutida8.
El tratamiento convencional para el CB es la cirugía. Entre otros tratamientos alternativos se encuentra la inmunoterapia local, que puede curar el CB mediante una estimulación local de la inmunidad. Entre las inmunoterapias locales el imiquimod tópico al 5% ha sido aprobado para el tratamiento de pequeños CB superficiales en adultos, mostrando una tasa de curación de 43-100%.9
El imiquimod actúa como un agente inmunoterapéutico local, activando la inmunidad innata y adquirida10,11. Un efecto del imiquimod sobre el campo de cancerización se ha demostrado en las queratosis actínicas7.
Presentamos un estudio retrospectivo explorando la capacidad del imiquimod, cuando es utilizado para tratar el CB, para inhibir el desarrollo de nuevos CB en el área tratada, en el campo de cancerización o fuera del mismo.
Material y métodosEl estudio fue realizado en un hospital de segundo nivel que atiende una población mayoritariamente urbana de 130.000 personas.
Se diseñó un estudio retrospectivo de comparación de 2 grupos de tratamiento para el CB (cirugía versus imiquimod). Las historias de los pacientes con un CB confirmado histológicamente tratado en nuestra institución se revisaron de forma retrospectiva. Se recogió la fecha y tipo de tratamiento (cirugía versus imiquimod) para el primer CB confirmado histológicamente entre enero de 2003 y diciembre de 2011. Al tratarse de un estudio retrospectivo no se pudo registrar de forma sistemática el motivo de indicación de cirugía versus imiquimod para cada caso, siendo siempre a criterio del facultativo que atendió al paciente. Cuando fue utilizado el imiquimod se instauró la pauta de 5 días por semana durante 6 semanas.
Se recogieron también las principales variables que pueden influir en la aparición de CB subsiguientes de acuerdo con lo publicado en estudios previos (edad, sexo, número de CB previos o simultáneos). En los datos de seguimiento de los tumores se incluyó: fecha del segundo CB histológicamente confirmado, si se presentó; proximidad del segundo CB respecto al primero (local, mismo territorio linfático, misma región anatómica, otro territorio); meses de seguimiento (hasta el diagnóstico del segundo CB, alta, última revisión rutinaria o pérdida de seguimiento). El seguimiento se finalizó a los 60 meses. Los pacientes con un seguimiento menor a 3 meses fueron excluidos. Los CB diagnosticados antes de 3 meses posteriores al primero fueron considerados sincrónicos al mismo. Las recurrencias no fueron registradas como segundos CB.
Se definieron 3 niveles de campo de cancerización alrededor del primer CB: local, linfático y regional. Consideramos que el segundo CB se presentó localmente cuando apareció a una distancia igual o inferior a 5cm del primero; en territorio linfático cuando el primer y el segundo CB pertenecían al mismo territorio de drenaje linfático; regional cuando apareció en el mismo territorio anatómico, considerando los siguientes territorios: cabeza y cuello, tórax anterior, tórax posterior, abdomen, lumbar, extremidades superiores y extremidades inferiores. Cuando el segundo CB no se presentó en la misma área anatómica que el primer tumor se consideró fuera del campo de cancerización.
Se semicuantificó el grado de inflamación provocada por el imiquimod en 3 categorías: discreta —ningún cambio en la pauta de tratamiento—; moderada —no cambios en la pauta, adición de crema de corticoides-antibiótica—; intensa —retirada de tratamiento temporal o definitiva—.
Para el análisis de los datos se emplearon estudios de supervivencia, con estimación del riesgo con el método de Kaplan-Meier; el evento en el estudio de supervivencia correspondió a la confirmación de un segundo CB; se utilizó el modelo de riesgos proporcionales de Cox para estimar la influencia de las variables. Para la comparación de datos categóricos se emplearon los tests de Chi cuadrado y el test exacto de Fisher. El nivel de significación se estableció en 0,05. Los datos fueron analizados con el paquete estadístico SPSS (SPSS Inc, Chicago, IL, EE. UU., versión 19.0) para Windows.
ResultadosSe revisaron las historias de 623 pacientes, 349 hombres y 274 mujeres, con una media de edad de 67,8 (desviación estándar 12,9).
Cuatrocientos ochenta y cuatro tumores se localizaron en la cabeza y el cuello, 101 en el tronco, 37 en las extremidades y uno no registrado. Quinientos cincuenta tumores fueron tratados quirúrgicamente (88,3%), 2 mediante crioterapia y 71 (11,4%) con imiquimod. Las características basales de los pacientes se reflejan en la tabla 1.
Características basales de los pacientes en ambos grupos de tratamiento
| Tratamiento | |||
| Imiquimod (%) | Cirugía (%) | ||
| N | 71 | 550 | |
| Media edad | 67,61 | 67,95 | |
| Sexo | Hombres | 35 (49,30) | 312 (56,73) |
| Mujeres | 36 (50,70) | 238 (43,27) | |
| Media CB previos | 0,95 | 0,37 | |
| CB inicial múltiple (≥3) | 8 (11,27) | 20 (3,64) | |
| Localización | Cabeza y cuello | 51 (72,86) | 432 (78,55) |
| Tronco | 14 (20) | 87 (15,82) | |
| Extremidades | 5 (7,14) | 31 (5,64) | |
| Tipo histológico | Superficial | 34 (47,89) | 95 (17,27) |
| Infiltrante | 22 (30,99) | 278 (50,55) | |
| Nodular | 1 (1,41) | 170 (30,91) | |
| No especificado | 14 (19,72) | 7 (1,27) | |
CB: carcinoma basocelular.
De 71 CB tratados con imiquimod 34 fueron superficiales, 22 infiltrantes, uno nodular y 14 de tipo histológico no especificado. La tasa de curación fue del 85,9% (61 de 71). De los 10 casos que precisaron cirugía complementaria 3 fueron superficiales, 5 infiltrantes y 2 de tipo no determinado. Un caso recurrió a los 3 años (infiltrante). La tasa de curación para el CB superficial fue 31 de 34 (91%) y para el CB infiltrante 16 de 22 (72%).
De 623 pacientes 227 (36,4%) presentaron un segundo CB. Doscientos diez de 550 pacientes tratados con cirugía (38,2%) sufrieron un segundo CB,y 17 de 71 (23,9%) en el grupo imiquimod (p=0,02).
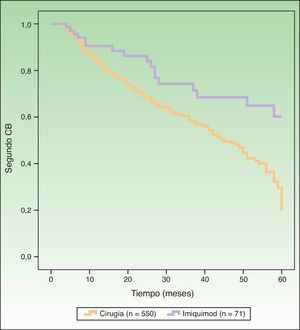
La figura 1 muestra las curvas de supervivencia, reflejando el riesgo de segundo CB en pacientes tratados con cirugía versus imiquimod. El análisis univariante incluyendo el tipo de tratamiento como la variable de comparación mostró un riesgo estadísticamente mayor de padecer un segundo CB con la cirugía (función de riesgo [HR] 2,16; IC 95%: 1,31-3,59; p=0,0026). En el análisis multivariante se incluyeron como variables el tipo de tratamiento (cirugía/imiquimod), edad, sexo, CB previos múltiples (3 o más) y CB simultáneos múltiples (3 o más). Dicho análisis identificó como factores pronósticos de mayor riesgo de segundo CB la mayor edad, el sexo masculino, múltiples CB previos y tratamiento con cirugía (HR: 2,13; IC 95%: 1,28-3,53; p=0,0032) (tabla 2).
Análisis multivariante del riesgo de segundo CB
| Variable | Función de riesgo (HR) | IC 95% | p |
| Tratamiento (cirugía vs imiquimod) | 2,13 | 1,28-3,53 | 0,0032 |
| Edad | 1,02 | 1,00-1,03 | 0,0003 |
| Género (masculino) | 1,34 | 1,02-1,75 | 0,033 |
| CB previo múltiple (≥3) | 2,13 | 1,32-3,44 | 0,002 |
| CB inicial múltiple (≥3) | 1,62 | 0,98-2,67 | 0,055 |
CB: carcinoma basocelular.
Los pacientes que no presentaron el evento (segundo CB) en el estudio fueron 396 (63,6%), de los cuales 29 estaban libres de segundo CB al alta, 300 estaban siendo controlados en el momento de la revisión de las historias y 67 (10,7% del total del grupo) fueron pérdidas de seguimiento.
Practicamos el mismo análisis en el subgrupo de pacientes con CB únicamente superficiales, con el fin de homogeneizar los 2 grupos respecto a la indicación del imiquimod por ficha técnica; la curva de supervivencia fue prácticamente igual a la del grupo completo (datos no presentados), mostrando un mayor riesgo de segundo CB en el grupo de cirugía (HR de 2,17); no demostró diferencias significativas por no ser la n suficientemente grande (IC 95%: 0,82-5,75; p=0,11). El mismo análisis comparando el grupo imiquimod completo con CB superficiales en el grupo cirugía sí mostró diferencias (HR: 2,21; IC 95%: 1,22-3,99; p=0,008).
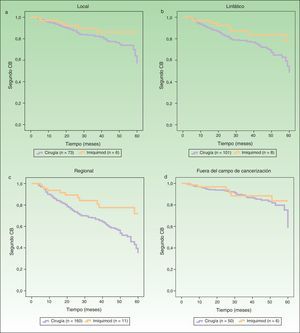
Las figura 2 A-C representan las curvas de supervivencia mostrando el riesgo de segundos CB en los campos de cancerización local, linfático y regional del primer CB, comparando el grupo cirugía versus imiquimod. La figura 2 D refleja el riesgo de segundo CB fuera del campo de cancerización del primer tumor. El análisis univariante mostró diferencias significativas en los campos de cancerización linfático y regional, y una tendencia en el campo de cancerización local a favor de un efecto protector con el tratamiento con imiquimod. El riesgo de segundo CB fuera del campo de cancerización no fue distinto entre los grupos cirugía e imiquimod (tabla 3).
Riesgo de segundo CB comparando cirugía e imiquimod en los campos de cancerización local, linfático, regional y fuera del campo de cancerización
| N° Eventos | Función de riesgo (HR) | IC 95% | p | ||
| Imiquimod (n=71) | Cirugía (n=550) | ||||
| Local | 6 | 73 | 2,12 | 0,91-4,97 | 0,08 |
| Linfático | 8 | 101 | 2,23 | 1,07-4,65 | 0,03 |
| Regional | 11 | 160 | 2,47 | 1,33-4,59 | 0,004 |
| Fuera del campo de cancerización | 6 | 50 | 1,59 | 0,66-3,83 | 0,29 |
CB: carcinoma basocelular.
La mayoría de segundos CB aparecieron en los 2 primeros años tras el diagnóstico del primero (73% en el grupo cirugía, 47% en el grupo imiquimod). Examinamos el tiempo de efecto del imiquimod en el riesgo de segundos CB. A los 12 y 24 meses después del primer CB se encontró una tendencia a un efecto protector del imiquimod (a los 12 meses 8,5% de segundos CB comparado con 15,2% en el grupo cirugía; a los 24 meses 2,8% versus 10%); las diferencias fueron estadísticamente significativas a los 24 meses (p=0,049). En tiempos mayores no hubo diferencias, aunque los datos en este caso estaban limitados por un número escaso de casos.
También calculamos el efecto del grado de inflamación provocada por el imiquimod en el riesgo de padecer un segundo CB. No encontramos diferencias (grado 1 27,3% de segundos CB; grado 2 20,7%; grado 3 22,2%; p=0,127).
DiscusiónEn el presente trabajo hemos encontrado un efecto del imiquimod en el campo de cancerización en el tratamiento del CB en comparación con la cirugía. La HR de padecer un segundo CB al ser tratado con cirugía, comparado con imiquimod, fue de 2,16 (1,31-3,59) en el análisis univariante y de 2,13 (1,28-3,53) en el multivariante.
Como era de esperar, las otras variables pronósticas descritas en trabajos previos (mayor edad, género masculino, CB previo múltiple) mostraron también un efecto significativo sobre el riesgo de segundo CB.
En la literatura se ha descrito el efecto de imiquimod en el campo de cancerización con las queratosis actínicas7,8. Sin embargo, con la excepción de un caso reportado12, no hemos hallado estudios en el CB.
El imiquimod estimula la inmunidad innata y celular por la vía del receptor 7 toll like13, e induce apoptosis de las células neoplásicas en el CB. Promueve la secreción de citocinas en el lugar de aplicación, la movilización y activación de células dendríticas plasmocitoides, la movilización y activación de las células de Langerhans en los ganglios linfáticos, la activación de linfocitos T citotóxicos específicos y la acumulación de células tumoricidas en el área tratada10.
Los principales efectos del imiquimod son locales; sin embargo, hay evidencias que muestran que sus efectos van más allá del área de aplicación14. De hecho, se ha demostrado la presencia de niveles sanguíneos de imiquimod tras su aplicación tópica15 y diversos artículos reportan efectos sistémicos después de su aplicación tópica16,17. En nuestra práctica hemos tenido la ocasión de ver algún paciente con clínica pseudogripal al ser tratado con imiquimod.
La radiación ultravioleta actúa no solo localmente en la piel, sino que también ejerce efectos inmunosupresores en los ganglios linfáticos, inhibiendo la función presentadora de antígenos de las células de Langerhans18; ello podría causar un efecto de campo de cancerización más allá del área que ha sido directamente irradiada por los utravioletas. Por otro lado, el mecanismo de acción del imiquimod en los ganglios linfáticos justifica un efecto más allá del campo de cancerización local. Nosotros hipotetizamos que podría existir un efecto en el campo de cancerización no sólo local, sino también regional y linfático. Akkilic-Materna et al. describieron un paciente en el que el imiquimod aplicado para una queratosis actínica curó un CB en la misma región linfática, e introdujeron el concepto de campo de cancerización linfático19.
En nuestro estudio el efecto de campo de cancerización del imiquimod estuvo presente no solo localmente, sino también a nivel regional y en el área de drenaje linfático. Aunque las diferencias en el campo local de cancerización no fueron significativas se encontró una clara tendencia, y de haber contado con un mayor número de casos tratados con imiquimod probablemente se habría alcanzado la significación estadística. En el caso del área de drenaje linfático es conocida la gran variabilidad según los pacientes, y ello supone una limitación en su valoración retrospectiva; sin embargo, los resultados encontrados son paralelos a los que analizan el efecto del imiquimod a nivel regional, siendo el nivel regional mucho más fácil de definir incluso retrospectivamente. Nuestros hallazgos permiten pensar que el imiquimod puede reducir el riesgo de padecer un segundo CB en el campo de cancerización donde es aplicado, incluyendo el territorio de drenaje linfático y la misma región anatómica, expandiendo el concepto de campo de cancerización no solo en las inmediaciones del tumor.
En las queratosis actínicas un año después del tratamiento con imiquimod la tasa de aclaramiento es del 61-73%20,21. En el presente trabajo hemos observado que a los 12 y 24 meses después del tratamiento del primer CB las tasas de segundos CB fueron menores con imiquimod que con cirugía, llegando a la significación estadística al segundo año. Este hallazgo tiene su importancia, ya que el 73% de segundos CB en el grupo de cirugía aparecieron antes de los 24 meses. Así, el imiquimod podría añadir un beneficio adicional reduciendo el riesgo en el período con mayores posibilidades de sufrir un segundo CB. Otros estudios han demostrado que los segundos CB aparecen a menudo en el primer año tras el diagnóstico del primer tumor2,3.
El tratamiento del CB infiltrante con imiquimod está fuera de ficha técnica. En nuestra serie un considerable número de CB infiltrantes, 22, fueron tratados con imiquimod. En la práctica clínica el imiquimod puede ser visto como una oportunidad para evitar una cirugía agresiva, eliminando o por lo menos reduciendo el tamaño tumoral, independientemente del carácter superficial o infiltrante de la lesión. Por otro lado, está descrito que cuando son tratados con imiquimod una proporción de pacientes reciben tratamiento sin biopsia previa22, y probablemente algunos de ellos pueden aparentar ser superficiales y ser realmente infiltrantes. Es más, la biopsia de un CB infiltrante puede venir informada de CB superficial según el área biopsiada23.
La tasa de curación del CB con imiquimod en el presente trabajo (pacientes sin recurrencia y sin necesidad de cirugía complementaria tras imiquimod) fue del 84,5% (91% en CB superficial, 72% en CB infiltrante). Estos porcentajes son similares a los publicados en otros estudios9,11,22. La mediana de seguimiento en nuestro estudio para los pacientes tratados con imiquimod fue de 32,9 meses, y observamos solo una recurrencia, a los 3 años; ello es de interés, ya que hay una falta de seguimiento a largo plazo en los estudios publicados.
Los pacientes con CB tienen un alto riesgo de desarrollar segundos y subsiguientes CB. Así, el cáncer de piel no melanoma se viene observando cada vez más como una enfermedad crónica24, y sería deseable el desarrollo de estrategias para reducir la incidencia de nuevos tumores. Algunos estudios argumentan que la aparición de CB subsiguientes es independiente de la adopción de medidas preventivas5,25. Así, los pacientes deben ser seguidos durante un tiempo que, pudiendo ser variable, debe ser prolongado.
Nuestros resultados apoyarían la utilización de imiquimod para el tratamiento del CB superficial, añadiendo el beneficio de la reducción de segundos tumores. Sin embargo, la no curación fue del 15%; así, pensamos que la cirugía sigue siendo el tratamiento de elección, y que la decisión de tratar con imiquimod debe ser individualizada. No obstante, los pacientes con CB múltiples podrían recibir un beneficio adicional al ser tratados con imiquimod.
El estudio tiene algunas limitaciones, como su carácter retrospectivo, con lo que no podemos determinar si el perfil de carcinoma basocelular que se escogió para tratamiento con cirugía o imiquimod fue distinto. En la tabla 1 se aprecian ciertas diferencias entre ambos grupos, entre las que destacan el mayor número de CB superficiales en el grupo imiquimod, como corresponde a su indicación. Observamos también una mayor proporción de pacientes con antecedentes de CB múltiple previo y con CB múltiple inicial en el grupo imiquimod, lo que en realidad supondría un mayor riesgo inicial de CB subsiguientes en el grupo imiquimod, a pesar de lo cual encontramos en realidad una disminución de nuevos tumores con dicho tratamiento.
El hecho de que el número de casos tratados con imiquimod fue limitado no permitió validar estadísticamente algunos de los hallazgos. El estudio de un mayor número de casos idealmente en un ensayo prospectivo aleatorizado permitiría contrastar estos hallazgos con un mayor grado de evidencia científica.
Concluímos que el tratamiento del CB con imiquimod podría reducir el riesgo de segundos CB, que su efecto podría permanecer hasta 2 años y se presentaría en los campos de cancerización local, regional y linfático. Además queremos señalar que, partiendo de nuestros hallazgos, pensamos que el concepto de campo de cancerización debería entenderse no solo afectando el área local, sino también a la de drenaje linfático y a la regional.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.