En un pasado no muy distante, en los Estados Unidos de América se consideraba la dermatitis por contacto una entidad que afectaba principalmente a la población adulta. Este diagnóstico era distintivamente menos habitual entre niños, comparado con adultos, principalmente debido a la creencia de que en los niños, el sistema inmune era inmaduro y que en general estaban expuestos a una menor cantidad de alérgenos. Con esto en mente, la baja prevalencia comunicada en el pasado se debe también en parte a que la mayoría de los niños afectados no fueron, y aún no son, apropiadamente evaluados por medio de pruebas epicutáneas. Mientras que la prueba del parche en niños requiere ciertas modificaciones de la técnica, la información internacional de la última década, y los datos estadounidenses comunicados en el último año, indican que la dermatitis por contacto en la población pediátrica es una condición común e igualmente prevalente en niños que en adultos.
In the not so distant past, in the United States contact dermatitis was considered to be a condition that affected mainly adults. The diagnosis was certainly less often rendered in pediatrics, mainly because it was believed that a child's immune system was immature and that children were generally exposed to fewer allergens. With this in mind, we can attribute the low prevalence formerly reported for this disease partly to the fact that most affected children were not (and are still not) evaluated using appropriate skin tests. Patch testing in children requires certain modifications, but the international literature of the last decade and US data published in the past year indicate that contact dermatitis is a common condition in the pediatric population and that the prevalence is similar in children and adults.
En un pasado no muy distante, en los Estados Unidos de América se consideraba la dermatitis por contacto una entidad que afectaba principalmente a la población adulta. Este diagnóstico era distintivamente menos habitual entre niños, comparado con adultos, principalmente debido a la creencia de que en los niños, el sistema inmune era inmaduro y que en general estaban expuestos a una menor cantidad de alérgenos. Con esto en mente, la baja prevalencia comunicada en el pasado se debe también en parte a que la mayoría de los niños afectados no fueron, y aún no son, apropiadamente evaluados por medio de pruebas epicutáneas. Mientras que la prueba del parche en niños requiere ciertas modificaciones a la técnica, la información internacional de la última década y los datos estadounidenses comunicados en el último año indican que la dermatitis por contacto en la población pediátrica es una condición común e igualmente prevalente en niños que en adultos1.
Prevalencia de la dermatitis por contacto en niñosEs un hecho que tanto la dermatitis por contacto alérgica (DCA) como la irritativa (DCI) ocurren en la población pediátrica. Información reciente muestra que la DCA es responsable de hasta un 20% de todas las dermatitis observadas en la niñez2,3. A pesar de la considerable cantidad de información disponible en la literatura médica, la incidencia y prevalencia reales de la alergia (sensibilización) por contacto y la DCA en niños y adolescentes es en gran parte desconocida. La prevalencia de punto de la alergia por contacto (prueba de parche positiva en un paciente asintomático) varía entre un 13 y un 24%4–6, la cual es considerablemente menor que las tasas observadas en poblaciones pediátricas seleccionadas (pacientes sintomáticos). Mientras tanto, la tasa de prevalencia actual de la DCA (definida como una prueba de parche positiva que es clínicamente pertinente a la dermatitis experimentada en una persona sintomática) varía de un 14 a un 77% entre los niños remitidos para la prueba de parche por sospecha clínica de dermatitis por contacto1,7–9.
La mayoría de los estudios de DCA en niños han sido realizados en centros europeos1,5,6,8, con sólo un pequeño número de estudios realizados en Norte América10,11. Es por lo tanto difícil comparar los resultados de dichos estudios, porque en general utilizan diferentes criterios incluyendo la edad, la concentración de los químicos estudiados y la duración de la aplicación de los parches, entre otros12. No obstante, basado en los estudios disponibles, existe una sospecha general de que la DCA está incrementándose en la población pediátrica13.
DiagnósticoEl primer paso en el diagnóstico de la DCA es una historia clínica y ambiental detallada del niño (tabla 1). Para llegar al diagnóstico se necesita un índice alto de sospecha ya que la DCA puede ser difícil de diferenciar clínica e histopatológicamente de otras dermatosis eccematosas. Además, la DCA no siempre se presenta clínicamente como eccema.
Evaluación necesaria para realizar el diagnóstico de DCA en niños
| I. Alto índice clínico de sospecha si existe: |
| Nueva dermatitis en una distribución no-atópica (reacciones localizadas y/o persistentes en las manos, pies y área perioral) |
| Empeoramiento de dermatosis endógenas |
| Dishidrosis de manos y pies |
| Dermatitis que no responde a terapias estandarizadas |
| II. Historia clínica detallada basada en: |
| Datos demográficos del paciente (edad, género, historia de atopia, etc.) |
| Historia médica y medicamentosa |
| Productos de higiene personal utilizados por el niño (champú, jabón, pañitos húmedos, etc.) |
| Ambiente en el hogar (productos de aseo personal utilizados por los padres, etc.) |
| Ambientes donde el niño se desarrolla (escuela, jardín infantil, hogar —sillas y escritorios utilizados en la escuela, colchones de dormir, materiales de aseo—, etc.) |
| Deportes o hobbies (baseball, hockey, fútbol, buceo, pintura, escultura, etc.) |
| Asociación temporal de la dermatitis con exposiciones ambientales (por medio de la historia clínica) |
| III. Examen físico y evaluación integral: |
| Distribución corporal de la dermatitis |
| Hallazgos negativos importantes |
| IV. Selección de los alérgenos que han de ser evaluados teniendo en cuenta: |
| La limitada área para la aplicación de los parches dada la pequeña espalda infantil |
| Selección de los alergenos más probables basada en la historia de exposición recurrente a un mismo alergeno a partir de una o más fuentesa |
| V. Selección y aplicación de los alérgenos: |
| Uso de la menor cantidad de alérgenos posibles sin comprometer la habilidad de detectar el alérgeno clínicamente relevanteb |
| Aplicación de los parches en la espalda (y en la parte interna de los brazos en caso necesario) |
| Cambiar los parches entre 24 y 48 horas |
| Evaluación a las 48 y 72 horas |
| VI. Establecer la relevancia clínica |
| Designar qué alérgenos son los más probablemente responsables de los hallazgos clínicos |
| Identificar cuál de los alérgenos se encuentra en el medio ambiente del niño afectado |
| VII. Crear una estrategia para evitar el contacto con los alérgenos responsables |
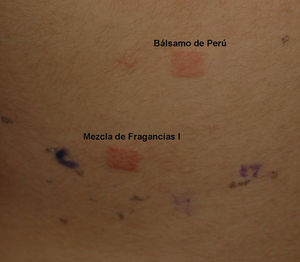
Este es el “arte”: por ejemplo, los marcadores de alergia a fragancias o saborizantes como son: a) la mezcla de fragancias I o II; o b) el Myroxylon perairae (bálsamo de Perú) deben ser probados durante la prueba del parche si la madre utiliza fragancias, si hay fragancias presentes en los productos de higiene personal utilizados por el niño (por ejemplo champú, loción del cuerpo, baño de burbujas) y si el niño consume de manera frecuente agentes saborizantes (por ejemplo salsa de tomate, canela, vanilla, etc.).
Este es el “truco”: ser capaz de examinar al paciente por medio de un panel extensivo, integral y personalizado, que ayude a identificar los alérgenos causales de la dermatitis a pesar del pequeño tamaño de la espalda infantil. ^Evaluación por medio del parche en niños- Recomendaciones del Grupo Alemán de dermatitis por contacto (DKG)22. Modificada de Jacob SE et al28.
La DCA en niños debe siempre formar parte del diagnóstico diferencial de cualquier tipo de dermatitis crónica, persistente o que empeora a pesar de tratamientos adecuados. Sin embargo, en los Estados Unidos la mayoría de los niños con dermatitis crónica no son estudiados por medio de la prueba epicutánea del parche, lo cual genera ambigüedad acerca de la prevalencia exacta de la DCA en la población pediátrica14. Esto es sin duda desafortunado, puesto que la prueba epicutánea del parche puede ayudar a la identificación del alérgeno causante y se ha demostrado que a partir de esta identificación y de la subsecuente prevención del contacto con el alérgeno causal la DCA mejora y con ello la calidad de vida del paciente15.
Prueba del parche en PediatríaLa prueba del parche, denominada también prueba epicutánea, es considerada el “patrón oro” en el diagnóstico de la DCA, y se debe realizar cuando exista tanto una sospecha clínica como una historia sugestiva. En los Estados Unidos existen dos pruebas del parche (kits) comercialmente disponibles y aprobadas por la Food and Drug Administration (FDA) como herramientas diagnósticas en población adulta: la prueba epicutánea de superficie fina para uso rápido (TRUE test) que contiene hasta la fecha 28 alérgenos más un control negativo en los 3 paneles disponibles (paneles 1.1., 2.1 y 3.1); y la prueba Hermal/ Trolab que consiste en 20 alérgenos. Hasta el tiempo de preparación de este manuscrito ninguna de estas pruebas diagnósticas cuenta con la aprobación para su uso en niños en los Estados Unidos; además, contienen un número limitado de alérgenos, contribuyendo a que una gran parte de casos de DCA en niños no sean detectados16.
Por su parte, la prueba de parche integral (conocida en ingles como comprehensive patch testing) puede ser elaborada en función de las necesidades específicas de cada paciente, seleccionándose el número y naturaleza de los alérgenos basándose en la historia clínica y la distribución específica de la dermatitis de cada paciente.
Además de la falta de aprobación de los kits estándares para su uso en la población pediátrica, Jacob et al17 encontraron que un número significativo de reacciones positivas observadas en los pacientes examinados por medio de la prueba del parche integral, con series expandidas de alérgenos, no hubiesen podido ser detectadas usando únicamente los paneles estándar del TRUE test o el Hermal test. Así mismo, Zug et al10 destacan la importancia del uso de paneles de alérgenos expandidos en niños que no mejoran después de haber sido investigados con la prueba inicial del TRUE test.
Los efectos adversos más comunes con la prueba del parche incluyen reacciones adversas en el sitio de la respuesta positiva al alérgeno examinado, prurito, ardor, edema, eritema, reacciones vesiculares y menos comúnmente hipo o hiperpigmentación o la permanencia excesiva de una prueba positiva. La reactivación de la dermatitis en los lugares previamente afectados es común y no es considerada una reacción adversa. Si extrapolamos los estudios en la población adulta, la posibilidad de generar sensibilización activa por medio de la aplicación epicutánea de los alérgenos es muy baja16. Otros efectos adversos de mayor seriedad, como las reacciones anafilactoides, ocurren raramente.
Protocolo para la prueba epicutánea del parche: selección de alérgenos e interpretación de resultadosNo existe ninguna serie estándar de alérgenos universalmente aceptada para su uso en adultos o en niños; sin embargo, las series estándares sirven como base primaria para la selección de alérgenos. La selección cuidadosa e individualizada de los alérgenos que se sospechan causantes de la dermatitis debe estar basada en el cuadro clínico y en la historia de exposición de cada individuo en quien se sospeche que padece DCA.
Los diferentes grupos clínicos actualizan regularmente sus paneles estándares y los ajustan en función de los alérgenos más comúnmente detectados en su población de base18. Independientemente de los paneles de investigación seleccionados, es importante tener en mente que nuevos productos con ingredientes potencialmente alergénicos son continuamente introducidos en el mercado, además de que las fuentes de exposición a un mismo químico generalmente varían entre individuos, lo cual genera la necesidad de que los paneles estándar sean continuamente revisados18.
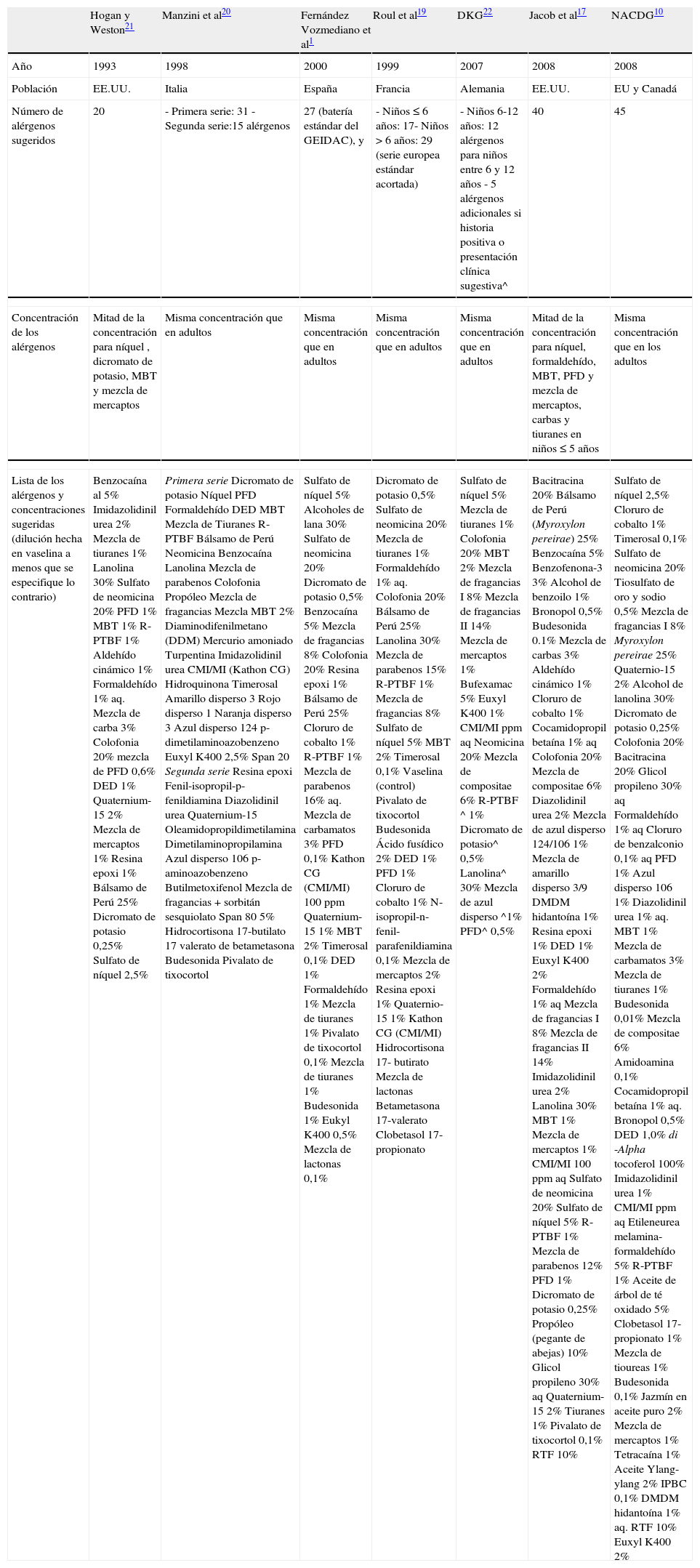
Ejemplos de los diferentes paneles pediátricos sugeridos para la detección de niños con sospecha de DCA incluyen: las series estándares acortadas para niños diseñadas por Roul et al19; las “series pediátricas” desarrolladas por Manzini et al20 consistentes en las 31 sustancias mas comúnmente sensibilizadoras en los niños evaluados en su clínica italiana; los parches estándares para la evaluación de la DCA en Pediatría propuestos por Hogan y Weston21; la serie pediátrica de investigación básica desarrollada por Jacob17 que funciona como una base a partir de donde se pueden seleccionar alérgenos para la realización de la prueba del parche en la población pediátrica de los Estados Unidos; el panel propuesto por la NACDG10 (Grupo Norteamericano de Dermatitis por Contacto) consiste en los 45 alérgenos que con mayor frecuencia dieron reacciones positivas y relevantes en sus estudios de niños; y la serie de 12 alergenos estándar para niños entre 6 y 12 años, recomendada por el Grupo Alemán de Investigación de Dermatitis por Contacto22 (DKG) (tabla 2).
Series de parches pediátricos sugeridos para la detección de niños con sospecha de DCA
| Hogan y Weston21 | Manzini et al20 | Fernández Vozmediano et al1 | Roul et al19 | DKG22 | Jacob et al17 | NACDG10 | |
| Año | 1993 | 1998 | 2000 | 1999 | 2007 | 2008 | 2008 |
| Población | EE.UU. | Italia | España | Francia | Alemania | EE.UU. | EU y Canadá |
| Número de alérgenos sugeridos | 20 | - Primera serie: 31 - Segunda serie:15 alérgenos | 27 (batería estándar del GEIDAC), y | - Niños ≤ 6 años: 17- Niños > 6 años: 29 (serie europea estándar acortada) | - Niños 6-12 años: 12 alérgenos para niños entre 6 y 12 años - 5 alérgenos adicionales si historia positiva o presentación clínica sugestiva^ | 40 | 45 |
| Concentración de los alérgenos | Mitad de la concentración para níquel , dicromato de potasio, MBT y mezcla de mercaptos | Misma concentración que en adultos | Misma concentración que en adultos | Misma concentración que en adultos | Misma concentración que en adultos | Mitad de la concentración para níquel, formaldehído, MBT, PFD y mezcla de mercaptos, carbas y tiuranes en niños ≤ 5 años | Misma concentración que en los adultos |
| Lista de los alérgenos y concentraciones sugeridas (dilución hecha en vaselina a menos que se especifique lo contrario) | Benzocaína al 5% Imidazolidinil urea 2% Mezcla de tiuranes 1% Lanolina 30% Sulfato de neomicina 20% PFD 1% MBT 1% R-PTBF 1% Aldehído cinámico 1% Formaldehído 1% aq. Mezcla de carba 3% Colofonia 20% mezcla de PFD 0,6% DED 1% Quaternium-15 2% Mezcla de mercaptos 1% Resina epoxi 1% Bálsamo de Perú 25% Dicromato de potasio 0,25% Sulfato de níquel 2,5% | Primera serie Dicromato de potasio Níquel PFD Formaldehído DED MBT Mezcla de Tiuranes R-PTBF Bálsamo de Perú Neomicina Benzocaína Lanolina Mezcla de parabenos Colofonia Propóleo Mezcla de fragancias Mezcla MBT 2% Diaminodifenilmetano (DDM) Mercurio amoniado Turpentina Imidazolidinil urea CMI/MI (Kathon CG) Hidroquinona Timerosal Amarillo disperso 3 Rojo disperso 1 Naranja disperso 3 Azul disperso 124 p-dimetilaminoazobenzeno Euxyl K400 2,5% Span 20 Segunda serie Resina epoxi Fenil-isopropil-p-fenildiamina Diazolidinil urea Quaternium-15 Oleamidopropildimetilamina Dimetilaminopropilamina Azul disperso 106 p-aminoazobenzeno Butilmetoxifenol Mezcla de fragancias + sorbitán sesquiolato Span 80 5% Hidrocortisona 17-butilato 17 valerato de betametasona Budesonida Pivalato de tixocortol | Sulfato de níquel 5% Alcoholes de lana 30% Sulfato de neomicina 20% Dicromato de potasio 0,5% Benzocaína 5% Mezcla de fragancias 8% Colofonia 20% Resina epoxi 1% Bálsamo de Perú 25% Cloruro de cobalto 1% R-PTBF 1% Mezcla de parabenos 16% aq. Mezcla de carbamatos 3% PFD 0,1% Kathon CG (CMI/MI) 100 ppm Quaternium-15 1% MBT 2% Timerosal 0,1% DED 1% Formaldehído 1% Mezcla de tiuranes 1% Pivalato de tixocortol 0,1% Mezcla de tiuranes 1% Budesonida 1% Eukyl K400 0,5% Mezcla de lactonas 0,1% | Dicromato de potasio 0,5% Sulfato de neomicina 20% Mezcla de tiuranes 1% Formaldehído 1% aq. Colofonia 20% Bálsamo de Perú 25% Lanolina 30% Mezcla de parabenos 15% R-PTBF 1% Mezcla de fragancias 8% Sulfato de níquel 5% MBT 2% Timerosal 0,1% Vaselina (control) Pivalato de tixocortol Budesonida Ácido fusídico 2% DED 1% PFD 1% Cloruro de cobalto 1% N-isopropil-n-fenil-parafenildiamina 0,1% Mezcla de mercaptos 2% Resina epoxi 1% Quaternio-15 1% Kathon CG (CMI/MI) Hidrocortisona 17- butirato Mezcla de lactonas Betametasona 17-valerato Clobetasol 17-propionato | Sulfato de níquel 5% Mezcla de tiuranes 1% Colofonia 20% MBT 2% Mezcla de fragancias I 8% Mezcla de fragancias II 14% Mezcla de mercaptos 1% Bufexamac 5% Euxyl K400 1% CMI/MI ppm aq Neomicina 20% Mezcla de compositae 6% R-PTBF ^ 1% Dicromato de potasio^ 0,5% Lanolina^ 30% Mezcla de azul disperso ^1% PFD^ 0,5% | Bacitracina 20% Bálsamo de Perú (Myroxylon pereirae) 25% Benzocaína 5% Benzofenona-3 3% Alcohol de benzoilo 1% Bronopol 0,5% Budesonida 0.1% Mezcla de carbas 3% Aldehído cinámico 1% Cloruro de cobalto 1% Cocamidopropil betaína 1% aq Colofonia 20% Mezcla de compositae 6% Diazolidinil urea 2% Mezcla de azul disperso 124/106 1% Mezcla de amarillo disperso 3/9 DMDM hidantoína 1% Resina epoxi 1% DED 1% Euxyl K400 2% Formaldehído 1% aq Mezcla de fragancias I 8% Mezcla de fragancias II 14% Imidazolidinil urea 2% Lanolina 30% MBT 1% Mezcla de mercaptos 1% CMI/MI 100 ppm aq Sulfato de neomicina 20% Sulfato de níquel 5% R-PTBF 1% Mezcla de parabenos 12% PFD 1% Dicromato de potasio 0,25% Propóleo (pegante de abejas) 10% Glicol propileno 30% aq Quaternium-15 2% Tiuranes 1% Pivalato de tixocortol 0,1% RTF 10% | Sulfato de níquel 2,5% Cloruro de cobalto 1% Timerosal 0,1% Sulfato de neomicina 20% Tiosulfato de oro y sodio 0,5% Mezcla de fragancias I 8% Myroxylon pereirae 25% Quaternio-15 2% Alcohol de lanolina 30% Dicromato de potasio 0,25% Colofonia 20% Bacitracina 20% Glicol propileno 30% aq Formaldehído 1% aq Cloruro de benzalconio 0,1% aq PFD 1% Azul disperso 106 1% Diazolidinil urea 1% aq. MBT 1% Mezcla de carbamatos 3% Mezcla de tiuranes 1% Budesonida 0,01% Mezcla de compositae 6% Amidoamina 0,1% Cocamidopropil betaína 1% aq. Bronopol 0,5% DED 1,0% di -Alpha tocoferol 100% Imidazolidinil urea 1% CMI/MI ppm aq Etileneurea melamina-formaldehído 5% R-PTBF 1% Aceite de árbol de té oxidado 5% Clobetasol 17-propionato 1% Mezcla de tioureas 1% Budesonida 0,1% Jazmín en aceite puro 2% Mezcla de mercaptos 1% Tetracaína 1% Aceite Ylang-ylang 2% IPBC 0,1% DMDM hidantoína 1% aq. RTF 10% Euxyl K400 2% |
Modificada de Jacob SE et al28. ^Evaluación por medio del parche en niños- Recomendaciones del Grupo Alemán de dermatitis por contacto (DKG)22. Myroxylon pereirae es el bálsamo de Perú; bronopol: 2-bromo-2-nitropropano-1,3-diol; CMI/MI: 5-cloro-2-metil-3-isotiazolona / 2-metil-3-isotiazolona (Kathon CG); DED: dihidrocloruro de etilendiamina; DMDM hidantoína: Dimetilol-5,5-dimetil hidantoína; Euxyl K400 (dibromodicianobutano): metil dibromo glutaronitrilo/fenoxietanol; GEIDAC: Grupo Español de Investigación en Dermatitis de Contacto y Alergia Cutánea; IPBC: iodo propinil butil carbamato; lanolina: alcoholes de lana y alcoholes de lanolina; MBT: mercapto-benzo-tiazol; NACDG: North American Contact Dermatitis Group (Grupo Norteamericano de Dermatitis por Contacto); p-dimetilaminoazobenzeno: amarillo de manteca; PFD: parafenildiamina (PPD); R-PTBF: resina de para-terciario-butilfenol-formaldehído; RTF: resina tosilamida-formaldehído (tolueno).span 20: sorbitano mono-laurato; span 80: mono-oleato de sorbitano.
Quaternium-15, diazolidinil urea, imidazolidinil urea, bronopol y DMDM hidantoína constituyen un grupo de conservadores conocidos como los “conservadores liberadores de formaldehído”.
Todas estas series proveen una guía para la investigación de la DCA en niños y orientan respecto a qué alergenos tienen mayor probabilidad de resultar positivos en función de la localidad y la población específica aportada por cada clínica. Adicionalmente, avalan el hecho de que la selección de alérgenos debe estar basada en la presentación clínica y en la historia individual de cada paciente. Muchos autores también abogan por la inclusión de alérgenos suplementarios, los cuales forman parte de paneles especializados extendidos (como por ejemplo: vehículos, tinturas de textiles, plásticos y pegamentos, etc.) basados en la sospecha clínica, y hacen hincapié en la importancia de parchear a los niños con sus propios productos de cuidado personal (como cremas para la zona del pañal, talcos, etc.), además de los medicamentos tópicos que utilicen (cremas, lociones o ungüentos) cuando se consideren potencialmente relevantes.
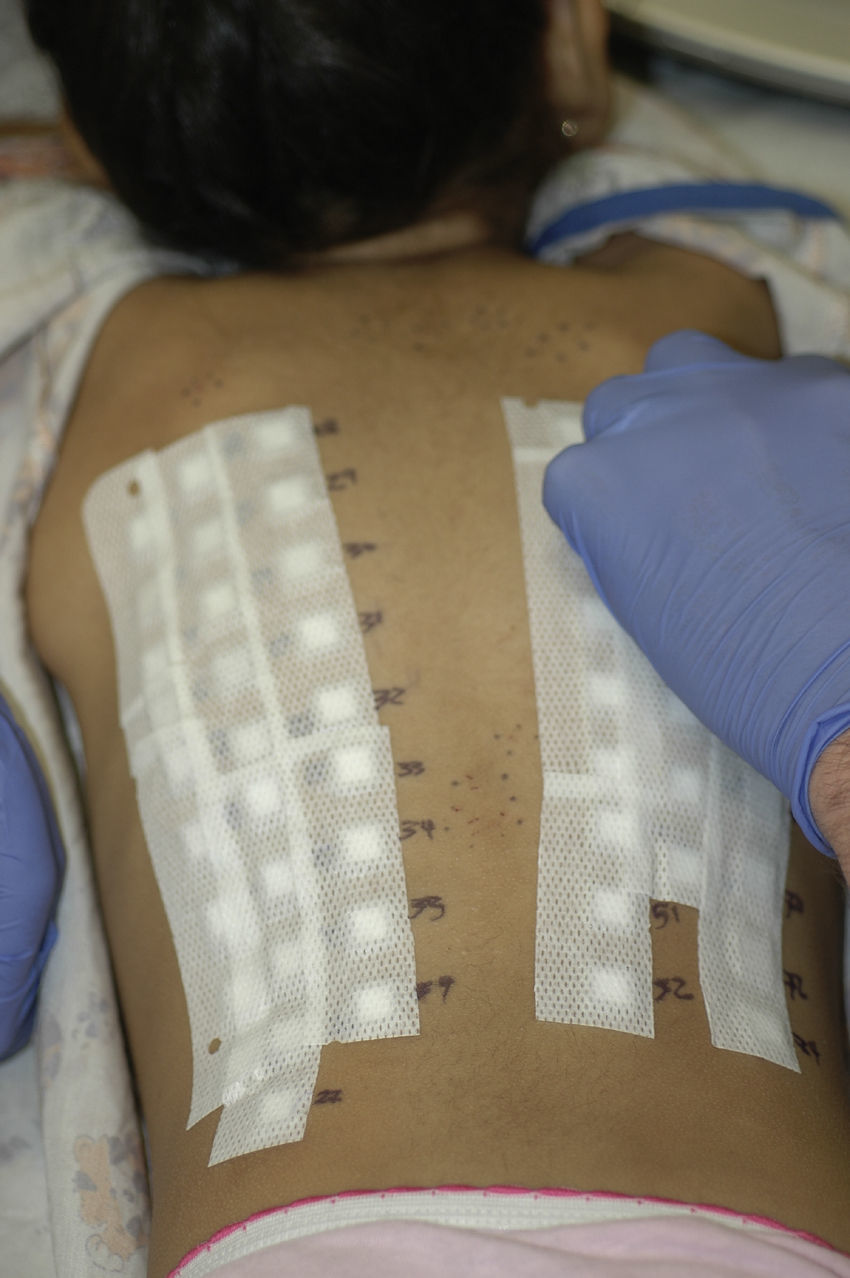
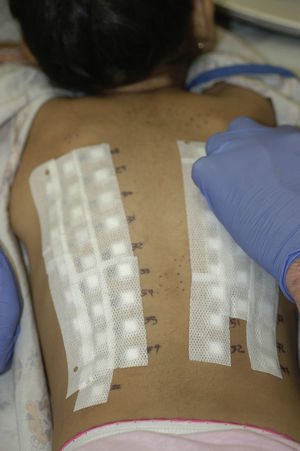
Consideraciones especiales para la prueba del parche en PediatríaLocalización de la aplicación de los parchesUna de de las dificultades intrínsecas de la prueba del parche en Pediatría es la pequeña área anatómica de la espalda de los niños (fig. 1). En algunos casos, los alérgenos (individualmente seleccionados) pueden ser aplicados no sólo en la espalda, sino también en las regiones de flexión de los brazos. Alternativamente, los parches pueden ser aplicados en dos sesiones distintas con un mes de separación23. Como los niños son muy activos debe prestarse especial atención a la hora de asegurar adecuadamente los parches con cinta de gasa o prendas de vestir especiales. El uso de juegos o vídeos para distraer a los niños durante la aplicación de los parches puede ser también de gran ayuda24.
Concentración del alérgenoPor su parte, la concentración a la cual diferentes alérgenos son investigados en la población pediátrica es un motivo de debate. Mientras que muchos estudios sugieren que la misma concentración utilizada en los adultos sea usada en los niños23, se han publicado reacciones irritativas atípicas, especialmente en los pacientes más jóvenes25. En este sentido, Marcussen26 encontró que el sulfato de níquel y el formaldehído en diluciones no irritativas en personas adultas “causaron un alto porcentaje de reacciones irritativas primarias en niños”. En este estudio el porcentaje de reacciones irritativas disminuyó con el incremento de edad, desapareciendo de los 7 a 10 años.
En una tentativa semejante para reducir las lecturas de falsos-positivos de reacciones irritantes Fisher27 recomendó reducir a la mitad las concentraciones de ciertos químicos específicos, en especial formaldehído y níquel, en niños menores de 8 años (de la concentración usual de sulfato de níquel al 5% en vaselina utilizada en adultos, a una concentración del 2,5%; y de la concentración acuosa al 1% de formaldehído utilizada en adultos, a una concentración del 0,5%). En el mismo manuscrito el autor también propone que los preservativos liberadores de formaldehído deben ser probados a la mitad de la concentración que se usa rutinariamente en la prueba del parche en adultos, y que los aditivos del caucho (antioxidantes y aceleradores) como el mercaptobenzotiazol y la mezcla de tiuranos de igual forma deben ser evaluados a la mitad de la concentración en niños menores de 10 años de edad. Fisher reitera que la interpretación de la prueba del parche en niños debe hacerse con “mucho cuidado”, ya que las concentraciones estándar de los químicos usados en los adultos “pueden producir reacciones irritativas no específicas en niños” 27.
El protocolo para la prueba de parche de Jacob28 et al modifica las recomendaciones de Fisher y las aplica a niños menores de 5 años de edad, además de que propone la dilución de la para-fenildiamina (PFD o PPD) a la mitad de la concentración utilizada en adultos. Estos cambios fueron hechos basándose en que, con las concentraciones anteriormente mencionadas, dichos autores han podido inducir reacciones positivas y relevantes en pacientes pediátricos.
Por otro lado, Rietschel y Rosenthal29 analizaron retrospectivamente los resultados de la NACDG de 1984 a 1987 en busca de reacciones irritativas producto de la prueba de parche. En su análisis, un 11% de las reacciones irritativas ocurrieron en el grupo de pacientes mayores de 80 años de edad, un 9% en el grupo de 20 a 64 años y ninguna en el grupo de 0 a 12 años. En función de esto, concluyeron que no es necesario hacer modificaciones a las concentraciones utilizadas en adultos cuando se aplica la prueba del parche a niños, conclusión que es soportada por otros estudios29,30 En 1999 Mortz y Andersen revisaron 17 estudios de DCA en niños (los cuales en conjunto suman un total de 5.728 niños examinados) y concluyeron que “la opinión general hoy en día es que los niños pueden ser evaluados por medio de la prueba del parche a las mismas concentraciones utilizadas en los adultos”31.
Tiempo de lecturaOtra área en la prueba del parche en Pediatría que carece de consenso entre los diferentes autores es el tiempo e intervalos apropiados para la evaluación de la prueba (lectura de las reacciones). La mayoría de los autores están de acuerdo en que los parches deben ser aplicados en la piel sana de la espalda, y deben mantenerse ocluidos durante 48 horas. En la mayoría de los estudios realizados en la población pediátrica las lecturas se realizan en dos ocasiones: el día en que se eliminan los parches, es decir, 48 horas después de la aplicación (día 2 [D2]) y 96 horas después de la exposición epicutánea (día 4 [D4]). Sin embargo, un estudio recomendó que los parches permanecieran ocluidos durante 72 horas y que se realizara una sola lectura a las 72 horas22 (el potencial para la sensibilización activa por exposición más prolongada no ha sido investigada en niños). En su estudio Jacob, Brod y Crawford17 evaluaron a todos los pacientes ≤ 5 años de edad a las 48, 72 y 96 horas después de colocados los parches, y no notaron diferencia alguna entre la lectura a las 72 y las 96 horas. En contraste, el DKG22 propone que los parches sean eliminados a las 24 horas en niños menores de 12 años de edad para reducir la frecuencia de reacciones irritativas, y que las lecturas sean realizadas a las 48 y 72 horas. En acuerdo con el protocolo alemán, Jacob et al28 proponen que una lectura retardada a las 72 horas (y no a las 96) puede ser suficiente.
Morfología de la lecturaIndependientemente del tiempo de lectura de la prueba el resultado se da como negativo o positivo, clasificando los resultados positivos en una escala cuantitativa. El Grupo Internacional de la Investigación de la Dermatitis por Contacto (ICDRG) ha recomendado un sistema de evaluación de 1+ a 3+, donde 1+ representa eritema e infiltración no-vesicular, 2+ representa eritema, infiltración y vesículas y 3+ representa una reacción grave (reacción ampollosa). Las reacciones muy débiles o dudosas son registradas con un signo de interrogación (?), mientras que las reacciones irritativas son registradas como “IR”. Según Rietschel y Fowler32 “Las reacciones irritativas son la némesis de la prueba del parche” dado que son muy difíciles de interpretar. Mientras que muchos libros de texto indican que el evaluador puede decidir acertadamente si una respuesta a la prueba del parche es irritativa o alérgica, basándose simplemente en las características morfológicas, en realidad la morfología de una respuesta a la prueba del parche es en general una guía pobre para determinar si la respuesta es de tipo alérgico o irritativo. En general, una reacción irritativa intensa a la prueba del parche aparecerá tempranamente (durante la primera lectura), estará bien demarcada (similar a una quemadura) y desaparecerá rápidamente (la reacción es muy débil o ya no está presente en la segunda lectura). En contraste, una reacción alérgica intensa usualmente se esparce, desaparece más lentamente y es más claramente eccematosa. No obstante, no existe una manera morfológica exacta para distinguir acertadamente una prueba irritativa débil de una prueba alérgica débil32.
RelevanciaUno de los asuntos más importantes en la prueba del parche pediátrica es cómo interpretar los resultados. Establecer la relevancia clínica de un resultado positivo es crítico. “Hay tan sólo una concordancia parcial entre una prueba del parche positiva y un diagnóstico definitivo de dermatitis por contacto alérgica”31. Una prueba positiva no significa que la DCA exista. Es por esto que existen dos términos distintos para definir una prueba del parche positiva dependiendo de su relevancia clínica. La DCA es la patología clínica en el contexto de una prueba del parche positiva, que es además clínicamente relevante y por lo tanto contributiva a la dermatitis de un paciente sintomático. Mientras que la alergia por contacto es una prueba del parche positiva que no es clínicamente relevante para la dermatitis del paciente sintomático, o una prueba del parche positiva observada en un paciente asintomático (como por ejemplo en aquellos estudios de población sana en los cuales se examina la prevalencia de sensibilización, no de enfermedad).
Determinar la relevancia clínica es por lo tanto esencial para poder declarar la presencia de DCA. En general, la determinación de relevancia clínica está sujeta al conocimiento y al interés del dermatólogo y de los padres del paciente. La relevancia de una reacción positiva es generalmente registrada como actual (que puede ser subdividida en definitiva, probable o posible), pasada, desconocida, o no-pertinente. La relevancia es considerada definitiva si una prueba de uso (ver más adelante) o una prueba del parche con un producto/objeto que contiene el alérgeno sospechado33 (por ejemplo una crema para la zona del pañal o un pedazo de zapato) resulta positiva. La relevancia es considerada probable si el alérgeno identificado por la prueba de parche está presente en los agentes a los que la piel del paciente ha sido expuesta. Y por último, la relevancia es considerada posible si el paciente ha estado potencialmente expuesto a circunstancias en las cuales la piel ha entrado en contacto con ciertos materiales que se sabe contienen al alérgeno causante.
Existen ciertas técnicas que pueden ser utilizadas para establecer la relevancia clínica. Una es evaluar al paciente algún tiempo después de la aplicación de la prueba del parche, para verificar si ha habido mejoría después de evitar el contacto con los alérgenos supuestamente causales. Otra es instruir a los padres del paciente a realizar en casa una “prueba provocativa de uso”, que consiste en que el paciente utilice el producto que se presume causante de la dermatitis, exactamente de la misma forma que cuando la dermatitis apareció33; por ejemplo, aplicando la crema para la irritación del pañal (que se sospecha causante), dos veces al día durante una semana, específicamente en un área delimitada (1cm x 1cm) de la zona del pañal. Si aparece una reacción eccematosa durante el período de prueba, entonces la prueba es considerada positiva y la relevancia clínica se confirma. De manera similar, en una “prueba repetida de aplicación abierta” (ROAT test) se aplican productos de aseo personal que no requieren ser enjuagados, es decir, productos diseñados para permanecer en la piel por un tiempo prolongado, como por ejemplo lociones, cremas, protectores solares, labiales, etc. Estas son aplicados dos veces al día durante una semana en un área de 1 x 1cm marcada en la parte superior del brazo, la cual se examina diariamente en busca de una reacción eccematosa34.
La realización de una sesión educativa antes de la aplicación de la prueba del parche es parte clave del protocolo en Pediatría. El objetivo es educar a los padres acerca de la naturaleza de la dermatitis por contacto y la importancia de evitar el contacto con el alérgeno causante una vez sea identificado, además de proporcionar expectativas reales con respecto al resultado de la prueba del parche, incluyendo la posibilidad de que resulte negativa. Los padres deben además ser instruidos acerca de cómo mantener los parches secos, evitando el baño y todas aquellas actividades que puedan hacer que el niño sude excesivamente. Es también importante que los pacientes discontinúen el uso de medicinas que puedan afectar la prueba, por lo menos dos semanas antes de esta; esto incluye el uso de corticosteroides tópicos o inhibidores de calcineurina sobre el sitio del cuerpo donde los parches serán aplicados. Así mismo, se les debe explicar a los padres que deben volver a la clínica en dos ocasiones: una para quitar los parches y otra para la evaluación final.
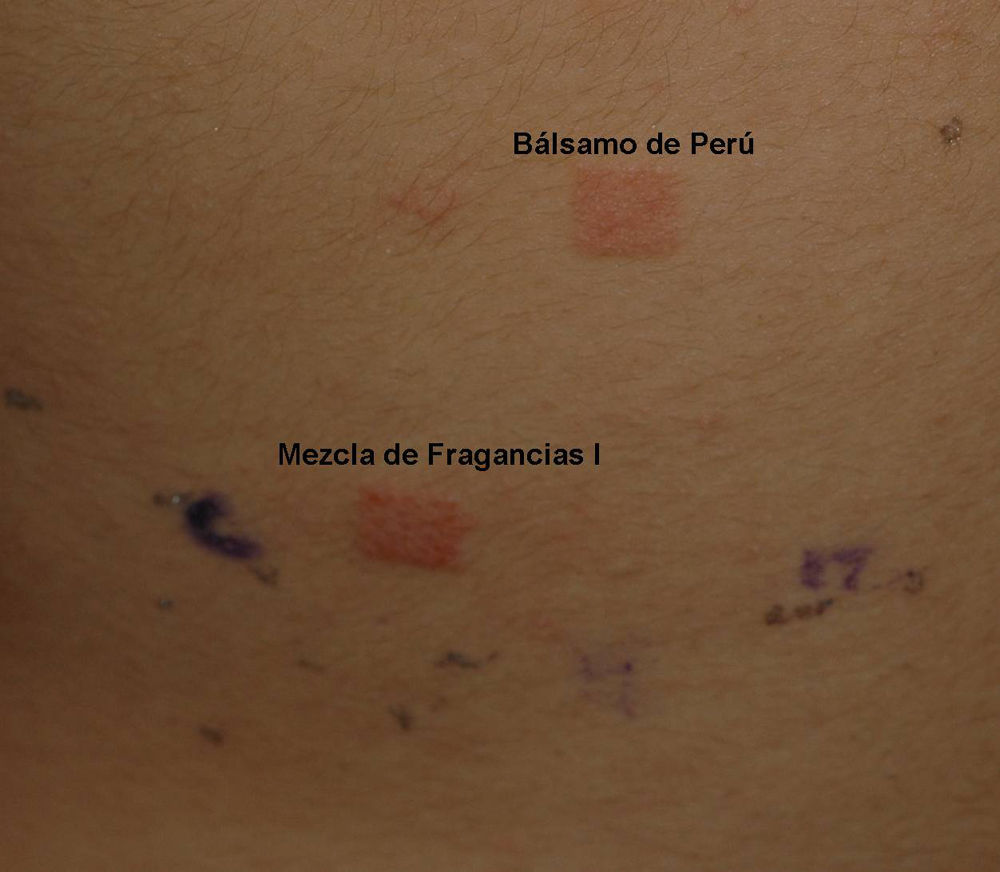
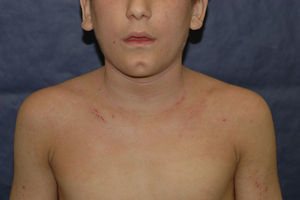
Alérgenos de importancia en la niñezLos niños, al igual que los adultos, son sensibilizados en su mayor parte por alérgenos ubicuos como el níquel y las fragancias (figs. 2 y 3) en la tabla 3 se recogen los 10 alérgenos más comúnmente detectados por medio de la prueba del parche y cuya importancia clínica ha sido recogida en informes internacionales (provenientes de Estados Unidos, Canadá, Europa [Alemania, Italia, Gran Bretaña, Francia, España, Bélgica] y Brasil) selistan en la tabla 3.
Lista de los 10 alérgenos más comunes en niños (EE.UU., Canadá, Europa, Brasil)
| Alérgeno | Descripción | Fuente | Distribución anatómica |
| Sulfato de níquel | Metal | Joyas, botones y broches, gafas, materiales de ortodoncia, teléfonos móviles, llaves, monedas | Cara/ párpados, orejas, cuello, muñecas |
| Neomicina | Antibiótico tópico | Ungüentos antibióticos | Cara, parpados |
| Myroxylon pereirae (bálsamo de Perú)/ mezcla de fragancias | Fragancias | Perfumes y cosméticos, crema dental, enjuagues, agentes saborizantes, tomates | Párpados/ cara, cuello, boca y labios |
| Timerosal | Conservante | Vacunas, cosméticos, antisépticos | Cuerpo y torso |
| Dicromato de potasio | Metal | Cuero teñido, fósforos, cemento, implantes dentales, paños verdes | Manos y área periumbilical |
| Cobalto | Metal | Joyas, botones, broches, cerámicas, cemento, vitamina B12 | Orejas, cuello, área periumbilical, manos |
| Mezcla de tiuranes | Acelerador de caucho | Elásticos en la cintura de la ropa, medias, trajes de baño, zapatos (suelas e interior), guantes, pesticidas | Cintura, pies, manos |
| Lanolina | Emoliente | Emoliente, ceras para la prevenir óxido, jabones, labiales | Manos, cualquier parte del cuerpo en la cual se apliquen emolientes |
| Formaldehído y productos que liberan formaldehído | Conservante | Champú, lociones, cosméticos, telas libres de arrugas | Cara, orejas, manos, tronco |
| Parafenilendiamina | Químico oxidativo | Tinte para el cabello, henna negra adulterada, tatuajes | Línea del cabello, orejas, manos, sitios donde los tatuajes son aplicados |
Fuente: referencias bibliográficas 10,15,17,19,30-33.
La intervención terapéutica más importante es evitar el contacto con el alérgeno causante35. Afortunadamente, en muchas ocasiones dicho alérgeno puede ser correctamente identificado por medio de la adecuada realización de la prueba del parche y la subsecuente prevención del contacto puede conducir a una remisión sostenida de la dermatitis. Si la prueba del parche falla en descubrir el alérgeno causante y el diagnóstico de la DCA aún se sospecha, un diario detallado de las actividades diarias y los productos con los cuales entra en contacto el paciente pueden ayudar a descubrir ciertas pautas de exposición.
Como se mencionó anteriormente, un componente crítico para la correcta prevención del contacto de los alérgenos causales, y por lo tanto para el tratamiento exitoso de la dermatitis por contacto en Pediatría, es la educación del paciente y su familia. Dos de los métodos más utilizados para la educación del paciente y su familia son el uso de literatura comprensible y fácil de leer, con detalles sobre los diferentes alérgenos, dónde pueden encontrarse y cómo evitarlos, y la tutoría verbal provista después de la lectura final de la prueba. Dicha educación permite a los padres evitar apropiadamente los alérgenos, proporcionándoles técnicas para afrontar la dermatitis de sus hijos en el día a día, y ayudarles a controlar las frustrantes recaídas.
Para fomentar el cumplimiento terapéutico se requiere proveer al paciente de alternativas seguras; por ello es esencial que el dermatólogo cuente con conocimiento práctico sobre el contenido de distintos productos que puedan ser seleccionados para excluir los químicos a los que el paciente es alérgico.
En aquellos casos en los cuales prevenir el contacto con el alergeno no ya conllevado mejoría se pueden utilizar tanto tratamientos tópicos como sistémicos. Los corticosteroides tópicos son efectivos, pero pueden causar efectos secundarios a largo plazo36–38 e incluso pueden ser ellos mismos alergénicos. Los inhibidores de calcineurina tópicos (TCI) pueden utilizarse, especialmente en áreas como la cara y zonas intertriginosas. Cuando la dermatitis es especialmente intensa o extensa, afecta las mucosas, o continúa a pesar del tratamiento tópico debe considerarse el uso de agentes sistémicos. En casos agudos o severos pueden utilizarse corticosteroides orales a dosis de 1mg/kg/día39. Es importante considerar que la prednisona es un corticosteroide de la clase “A”, y existen casos de pacientes que han desarrollado reacciones sistémicas después de recibir prednisona por vía oral40,41. Estas reacciones pueden responder a dosis más altas de este mismo corticosteroide o pueden recurrir al disminuir la dosis. Otros antiinflamatorios no esteroideos incluyen medicamentos tales como ciclosporina, metotrexato y azatioprina; se recomienda que el lector se dirija a otros recursos claves para una discusión adicional y más profunda del tema42–44.
Conflicto de interesesLa Doctora Jacob es una investigadora independiente para Smartchoice (Allerderm) los fabricantes de la prueba de TRUE test. El resto de autores declaran no tener ningún conflicto de intereses.