La dermatitis por contacto fotoalérgica (DCFA) a oxibenzona fue por primera vez documentada en 1980, siendo hoy el principal fotoalérgeno de Estados Unidos de América, Canadá y el cuarto en Europa. En Argentina no existen datos ni publicaciones con respecto a esta reacción cutánea.
ObjetivoConocer el porcentaje de pacientes con fotosensibilidad afectados con fotoalergia a oxibenzona.
MetodologíaEstudio descriptivo de corte transversal. Un total de 35 pacientes con reacciones fotosensibles con prueba del fotoparche en el Centro de investigación del Hospital Público San Martín, en la ciudad de La Plata, fueron estudiados durante los años 2015 y 2016.
ResultadosSe observó el 17,14% de DCFA, presentando 5 (14,28%) pacientes al menos una reacción positiva a oxibenzona en el test de fotoparche, 4 pacientes solo en la zona irradiada con 5J/cm2 (de UVA) y solo un paciente tanto en la zona irradiada como en la no irradiada.
ConclusionesLa DCFA a protectores solares compuestos por oxibenzona es frecuente y se presume infradiagnosticada debido a la falta de estudios confirmatorios como la prueba del fotoparche. El porcentaje de sensibilización varía de acuerdo con cada región, sobre todo por las distintas composiciones y costumbres de uso en protectores solares, cosméticos y tratamiento tópico.
Photoallergic contact dermatitis (PACD) to oxybenzone was reported for the first time in 1980. Oxybenzone is the most common photoallergen in the United States and Canada and the fourth most common .in Europe. There are no studies or data on the prevalence of oxybenzone PACD in Argentina.
ObjectiveTo determine the proportion of photosensitive patients with PACD to oxybenzone.
MethodsWe conducted a descriptive cross-sectional study of 35 patients with photosensitivity reactions confirmed by photopatch testing at the Research Center of Hospital Público San Martín in La Plata, Argentina, in 2015 and 2016.
ResultsPACD was identified in 6 patients (17.14%). Five of these (14.28%) had at least one positive reaction to oxybenzone in the photopatch test; 4 had a reaction at irradiated sites only (5 J/cm2 UVA) and one had a reaction at both irradiated and nonirradiated sites.
ConclusionsPACD to sunscreens containing oxybenzone is common and is probably underdiagnosed due to a lack of confirmation by photopatch tests or other diagnostic tools. Sensitization rates vary according to region and are influenced by sunscreen ingredients and variations in the use of sunscreen products, cosmetics, and topical drugs.
La provincia de Buenos Aires, Argentina, tiene cerca de 17 millones de habitantes. En su capital, La Plata, se ubica el Hospital San Martín, el cual brinda atención gratuita a pacientes que acuden de toda la región. En la franja latitudinal 25-35°S del continente americano, se han detectado valores de índice UV de entre 12 y 201. Esto adquiere relevancia debido a que la intensidad solar juega un papel importante en las reacciones de fotosensibilidad. Estas condiciones podrían favorecer la cantidad de casos de reacciones fotosensibles, ya que la energía solar medida in situ es suficiente para desencadenar estos procesos2. En este contexto, personas que trabajan al aire libre se exponen a una posible aparición de reacción fotoalérgica. Por ahora, no se han publicado investigaciones sobre dermatitis por contacto fotoalérgica (DCFA) en esta región del mundo, por lo que resulta de interés contribuir al análisis global de la especialidad de fotodermatología.
La DCFA o fotoalergia es una reacción mediada por el sistema inmunológico a sustancias en contacto con la piel tras la exposición solar. Los cromóforos absorben radiación UVA y se transforman en fotoalérgenos3. Los pacientes en contacto con el agente implicado, tras 12-48h presentan un brote alérgico en las zonas expuestas al sol.
La principal manifestación clínica es un eccema agudo o crónico en las zonas irradiadas de la piel donde se tuvo contacto con la sustancia. Además, pueden aparecer otro tipo de lesiones como liquenoides, urticarianas, similares a eritema polimorfo o quemaduras4. Para hacer un correcto diagnóstico, se debe realizar la prueba del fotoparche (FP)5. La fotoalergia precisa de dos técnicas de diagnóstico: la prueba del parche (usada en dermatitis por contacto) y el fototest (en fotodermatología). Pocos centros en el mundo cuentan con el test de FP, por lo que la DCFA se presume infrecuente6.
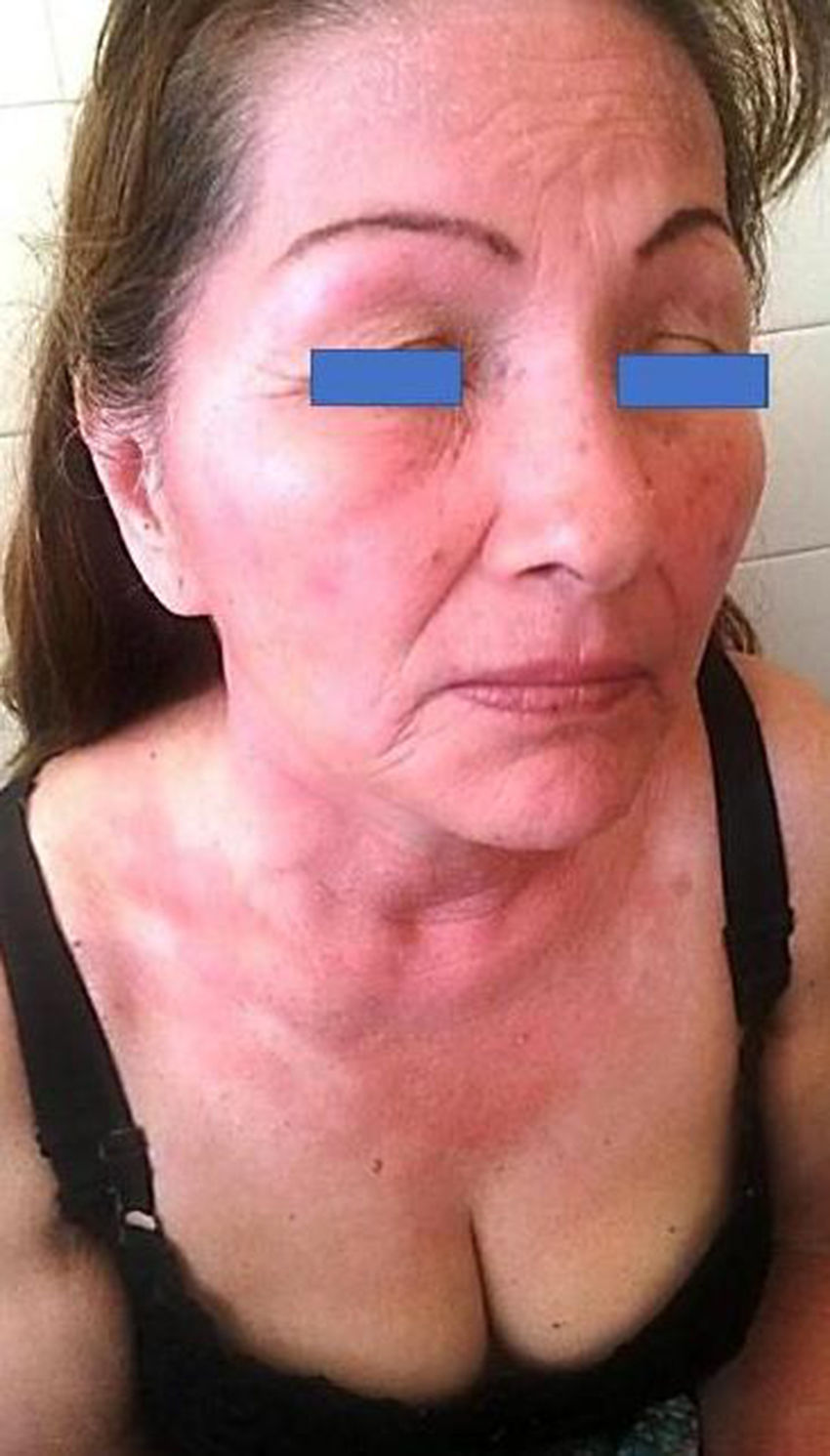
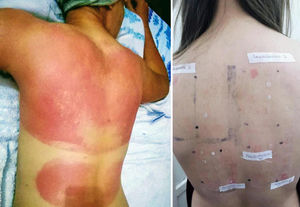
La DCFA respeta zonas anatómicamente protegidas del sol (fig. 1), como son la región submaxilar, los párpados superiores y el pliegue retroauricular7. En Argentina no existen datos epidemiológicos que determinen la prevalencia de la DCFA y sus principales fotoalérgenos. Los protectores solares son imprescindibles en la prevención del fotoenvejecimiento y cáncer de piel, sin embargo, la fotoalergia como reacción adversa suele ser infradiagnosticada8, y uno de sus principales responsables en la actualidad es la oxibenzona9.
Paciente con reacción fotosensibilizada en zonas expuestas debido al uso de protector solar, dado su antecedente de carcinoma basocelular. Se observa la indemnidad de los párpados superiores; otras zonas respetadas sin reacción son los pliegues retroauriculares y la zona inframaxilar inferior.
Se realizó un estudio observacional de corte transversal (Protocolo número 2919/1189/15 CCIS: Ministerio de Salud de la provincia de Buenos Aires) de 445 pacientes observados en la Unidad de Alergias Cutáneas del Servicio de Dermatología del Hospital San Martín de La Plata, de los cuales se seleccionó una muestra de 35 pacientes de ambos sexos de entre 15 y 75 años, que habían presentado uno o más brotes de reacciones fotosensibles. Los pacientes fueron seleccionados de acuerdo con los criterios de inclusión: 1) con erupciones cutáneas fotosensibles, 2) con intolerancia a protectores solares, fragancias, cosméticos y analgésicos locales, 3) con eccemas por contacto en áreas fotoexpuestas, y 4) con diagnóstico de fotodermatosis idiopáticas, dermatitis actínica crónica, prurigo actínico, erupción polimorfa solar, etc. Como criterios de exclusión: 1) pacientes con fotosensibilidad vinculada directamente a enfermedad sistémica (lupus, porfiria) y 2) pacientes que recibieran medicación inmunosupresora o que hubieran colocado esteroides tópicos en su espalda durante el último mes. Como identificación de variables se establecen: 1) los fotoalérgenos sensibilizantes de cada paciente y 2) otras secundarias como la edad y el sexo.
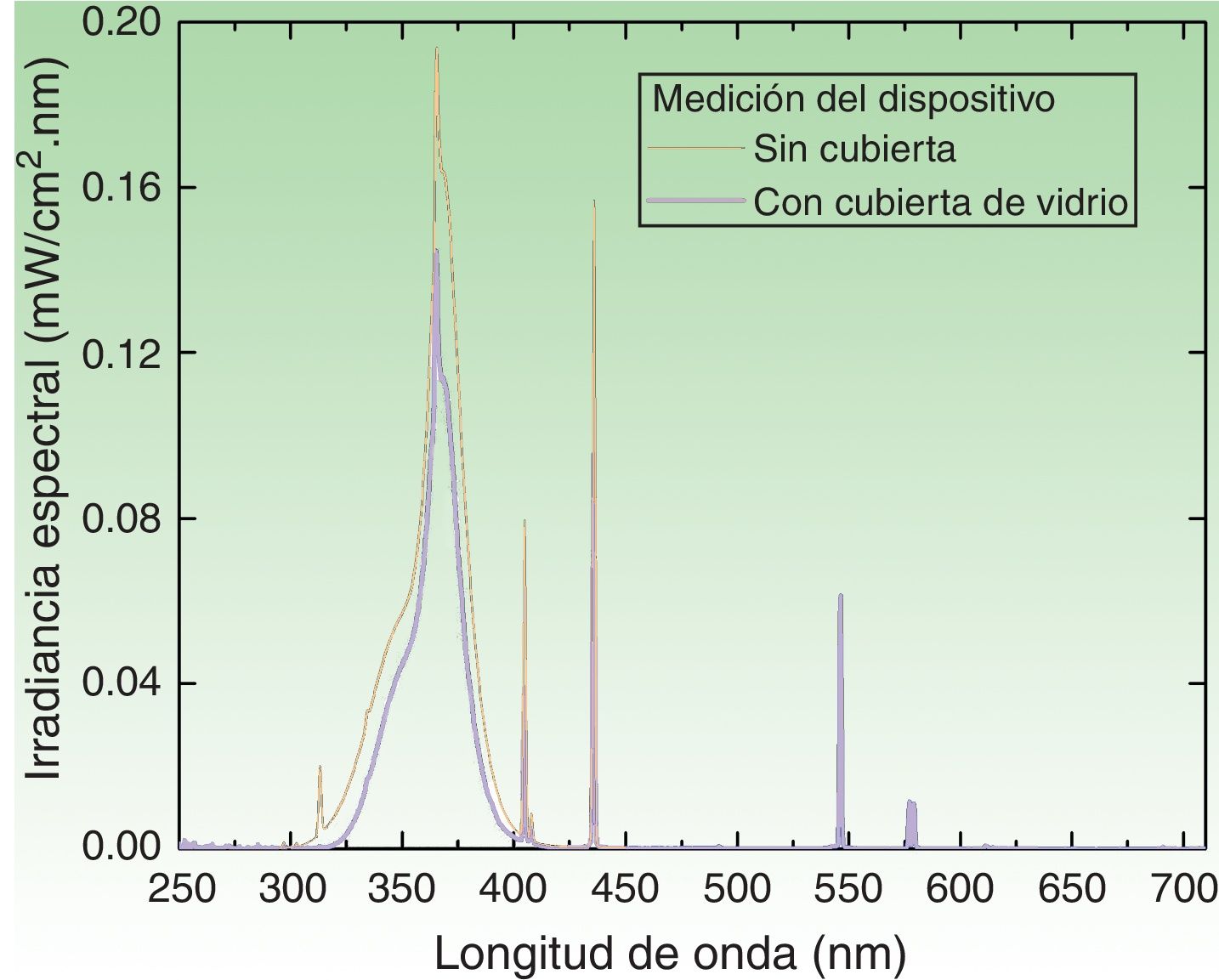
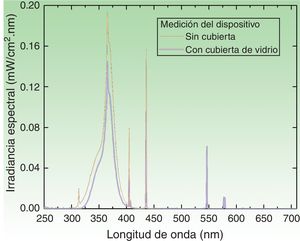
Dispositivo de irradiaciónEl dispositivo de irradiación construido para la aplicación de la dosis UVA (en J/cm2) consiste en una estructura hermética que encuadra un conjunto de tres pares de lámparas intercaladas en su interior. Las lámparas UVA marca Philips® corresponden a tres espectros de emisión cuyos máximos en longitud de onda (λ) se encuentran a 350, 365 y 370nm. La fuente irradia a través de una abertura donde se apoya la zona que contiene los fotoparches. El espectro de emisión de cada lámpara fue medido con dos espectrorradiómetros: Avantes AvaSpec3648 y Optronic OL-756-2 (fig. 2). El espectro de emisión fue integrado de 320 a 400nm, obteniendo un valor instantáneo promedio de irradiancia de [4,7±0,2]mW/cm2. La dosis correspondiente fue de [0,28±0,1]J/cm2 en el intervalo de un minuto. Por consiguiente, el tiempo necesario para acumular la dosis de 5J/cm2 fue de 18min.
Espectro de emisión del dispositivo de irradiación con las 6 lámparas encendidas. Medición de irradiancia espectral sin el protector de vidrio (curva negra) y con el protector interpuesto (curva azul). El tiempo de exposición de 18min (para una dosis de 5J/cm2) fue obtenido con la medición hecha con la cobertura de vidrio, la cual filtra la componente UVB (λ≤320nm) de la fuente.
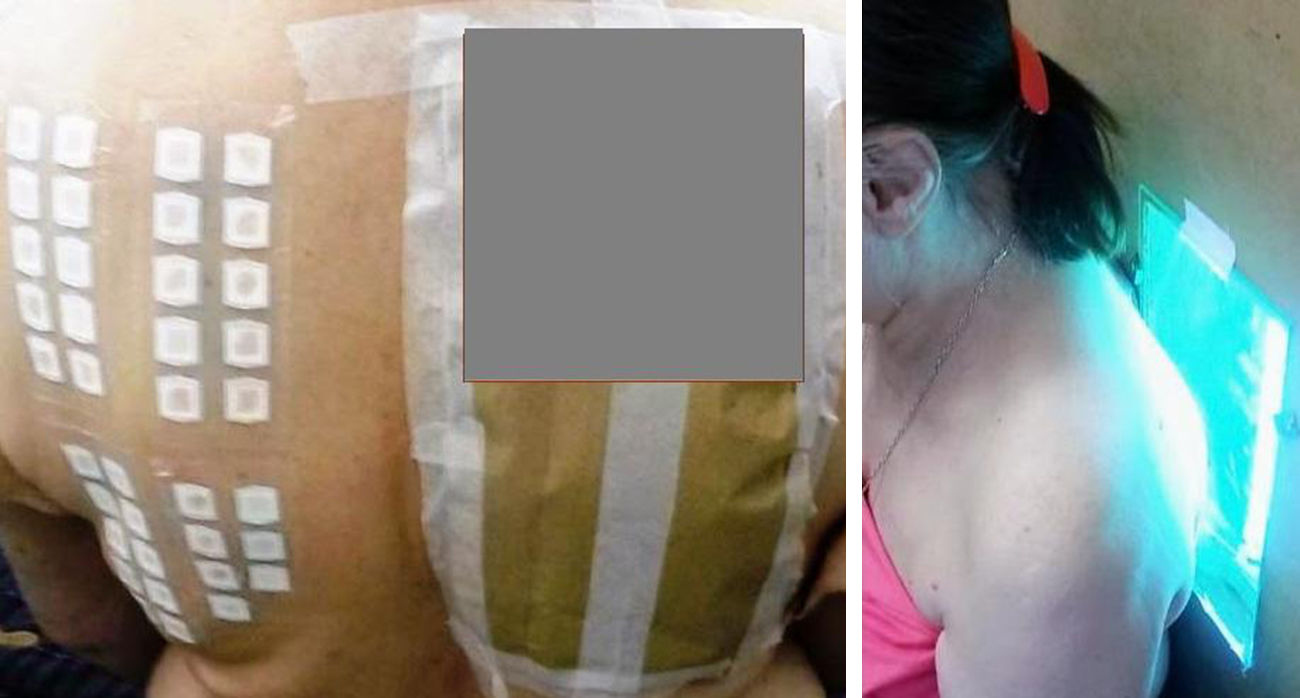
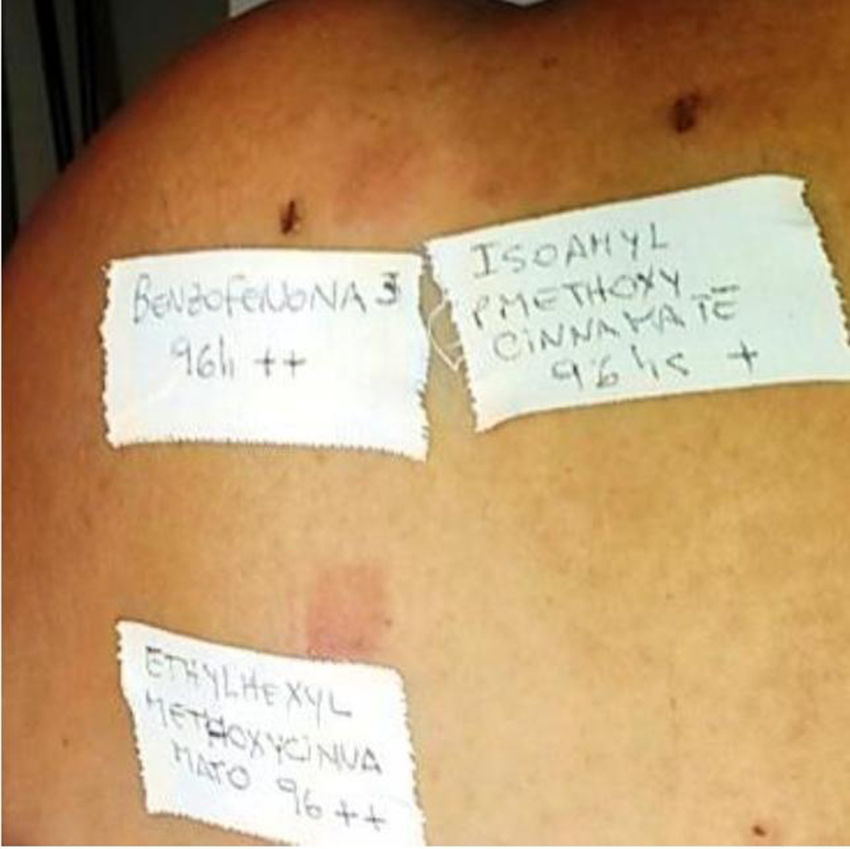
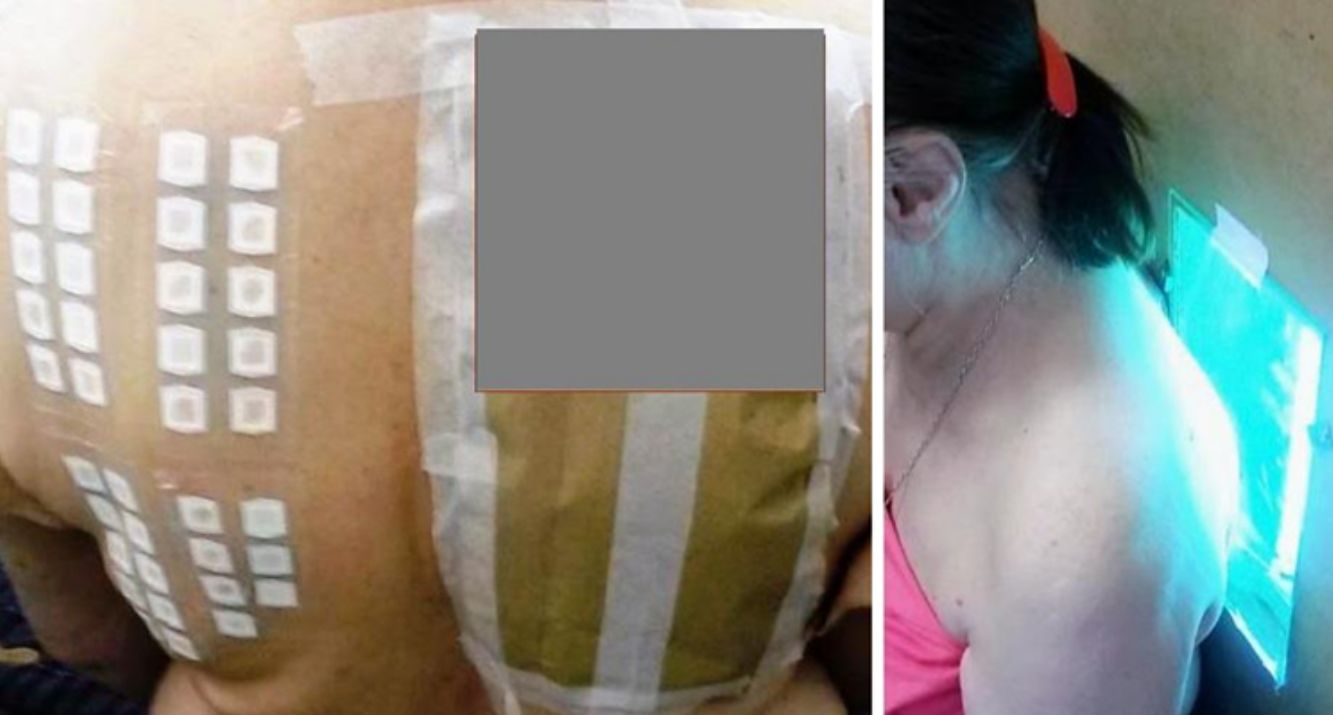
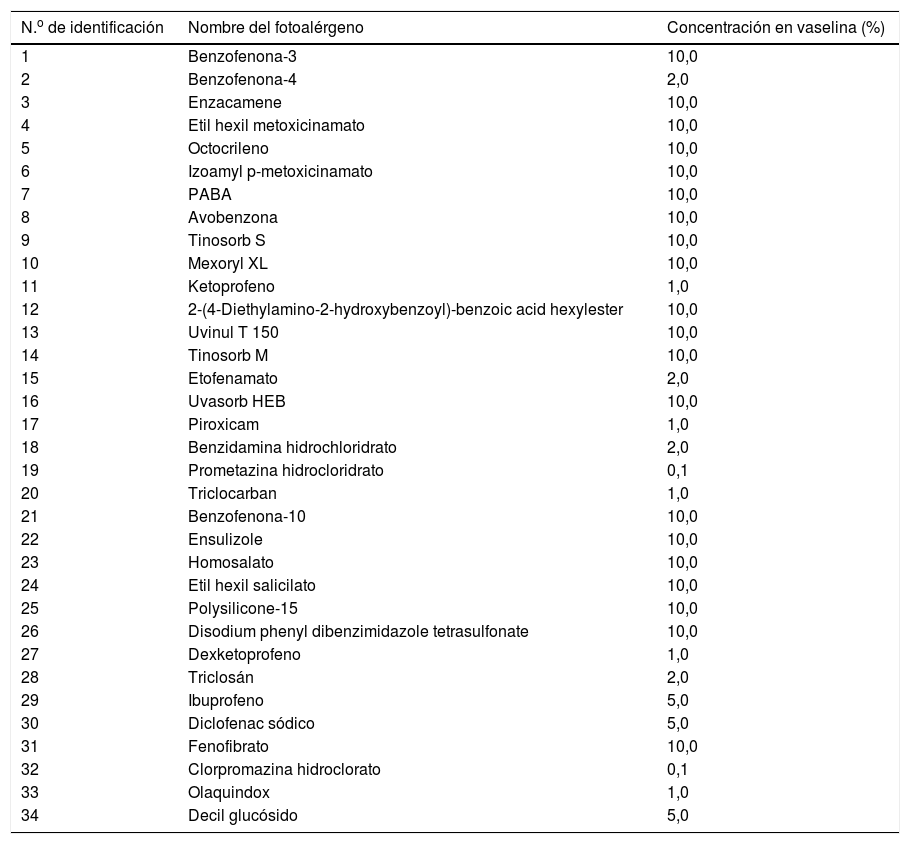
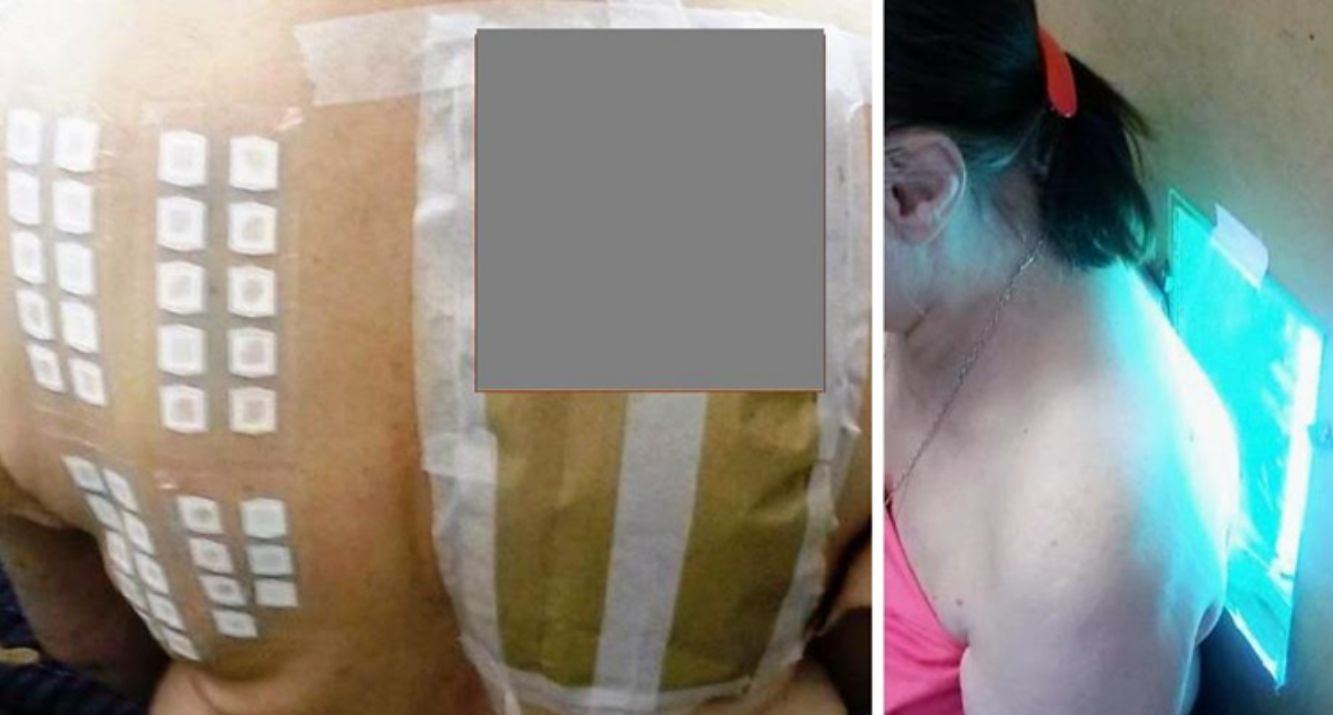
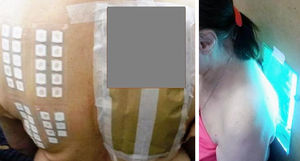
Para la técnica de FP se utilizó la batería de fotoparche europea extendida del Laboratorio Chemotechnique®, la cual comprende 34 fotoalérgenos (de los cuales 19 son compuestos incluidos en protectores solares) y parches IQ-Ultimate (tabla 1). El procedimiento se aplicó en una región no expuesta habitualmente a la radiación solar. Se colocaron dos juegos de parches epicutáneos, uno a la derecha y otro a la izquierda de la espalda, con fotoalérgenos diluidos en vaselina a la concentración protocolizada por el Comité Europeo de fotoparche. Posterior a las 48h de colocación, un solo juego fue irradiado (fig. 3) con el dispositivo construido para este propósito, durante 18min, hasta acumular la dosis preestablecida de 5J/cm2.8. Las lecturas se realizaron a los 30min tras la irradiación y una segunda lectura a las 96h de la colocación de los parches y, finalmente, una tardía a la semana. Se utilizó para valorar los resultados la escala de graduación propuesta por el Grupo Internacional de Investigación de las Dermatitis por Contacto (leve:+; moderado:++; intenso:+++; dudoso:+/–; irritativo: IR).
Batería de fotoparche europea Chemotechnique® extendida y su porcentaje de concentración en vaselina
| N.o de identificación | Nombre del fotoalérgeno | Concentración en vaselina (%) |
|---|---|---|
| 1 | Benzofenona-3 | 10,0 |
| 2 | Benzofenona-4 | 2,0 |
| 3 | Enzacamene | 10,0 |
| 4 | Etil hexil metoxicinamato | 10,0 |
| 5 | Octocrileno | 10,0 |
| 6 | Izoamyl p-metoxicinamato | 10,0 |
| 7 | PABA | 10,0 |
| 8 | Avobenzona | 10,0 |
| 9 | Tinosorb S | 10,0 |
| 10 | Mexoryl XL | 10,0 |
| 11 | Ketoprofeno | 1,0 |
| 12 | 2-(4-Diethylamino-2-hydroxybenzoyl)-benzoic acid hexylester | 10,0 |
| 13 | Uvinul T 150 | 10,0 |
| 14 | Tinosorb M | 10,0 |
| 15 | Etofenamato | 2,0 |
| 16 | Uvasorb HEB | 10,0 |
| 17 | Piroxicam | 1,0 |
| 18 | Benzidamina hidrochloridrato | 2,0 |
| 19 | Prometazina hidrocloridrato | 0,1 |
| 20 | Triclocarban | 1,0 |
| 21 | Benzofenona-10 | 10,0 |
| 22 | Ensulizole | 10,0 |
| 23 | Homosalato | 10,0 |
| 24 | Etil hexil salicilato | 10,0 |
| 25 | Polysilicone-15 | 10,0 |
| 26 | Disodium phenyl dibenzimidazole tetrasulfonate | 10,0 |
| 27 | Dexketoprofeno | 1,0 |
| 28 | Triclosán | 2,0 |
| 29 | Ibuprofeno | 5,0 |
| 30 | Diclofenac sódico | 5,0 |
| 31 | Fenofibrato | 10,0 |
| 32 | Clorpromazina hidroclorato | 0,1 |
| 33 | Olaquindox | 1,0 |
| 34 | Decil glucósido | 5,0 |
De los 35 pacientes evaluados con reacciones fotosensibles, 11 eran varones (37%) y 24 mujeres (63%). El rango de edad fue de 20 a 72 años, siendo el 85% mayor de 40 años. Se observaron 8 pacientes con reacciones positivas en la prueba del FP, 6 de ellos con DCFA (17,14%), siendo 4 de ellos (11,42%) a oxibenzona y ninguno a octocrileno. Se observaron otras reacciones fotoalérgicas a prometazina, clorpromazina, benzofenona-10 (filtro solar), cinamatos: etil hexil metoxicinamato y izoamyl p-metoxicinamato (filtros solares), salicilatos: etil hexil salicilato (filtro solar), Mexoryl XL® (filtro solar), triclosán (antiséptico), dexketoprofeno (antiinflamatorios no esteroideos [AINES]: 2 pacientes) y fenofibratos (hipolipemiante), tal como se detalla en el tabla 2. En particular, la benzofenona-10 presentó reacción fotoalérgica en 2 pacientes con relevancia actual conocida. De los 8 pacientes, 4 (14,3%) presentaron dermatitis alérgica por contacto (DAC), 3 de ellos al decil glucósido (surfactante del Tinosorb M®) y uno a la oxibenzona. Dos de los pacientes presentaron tanto DAC como DCFA, ambas provocadas por protectores solares.
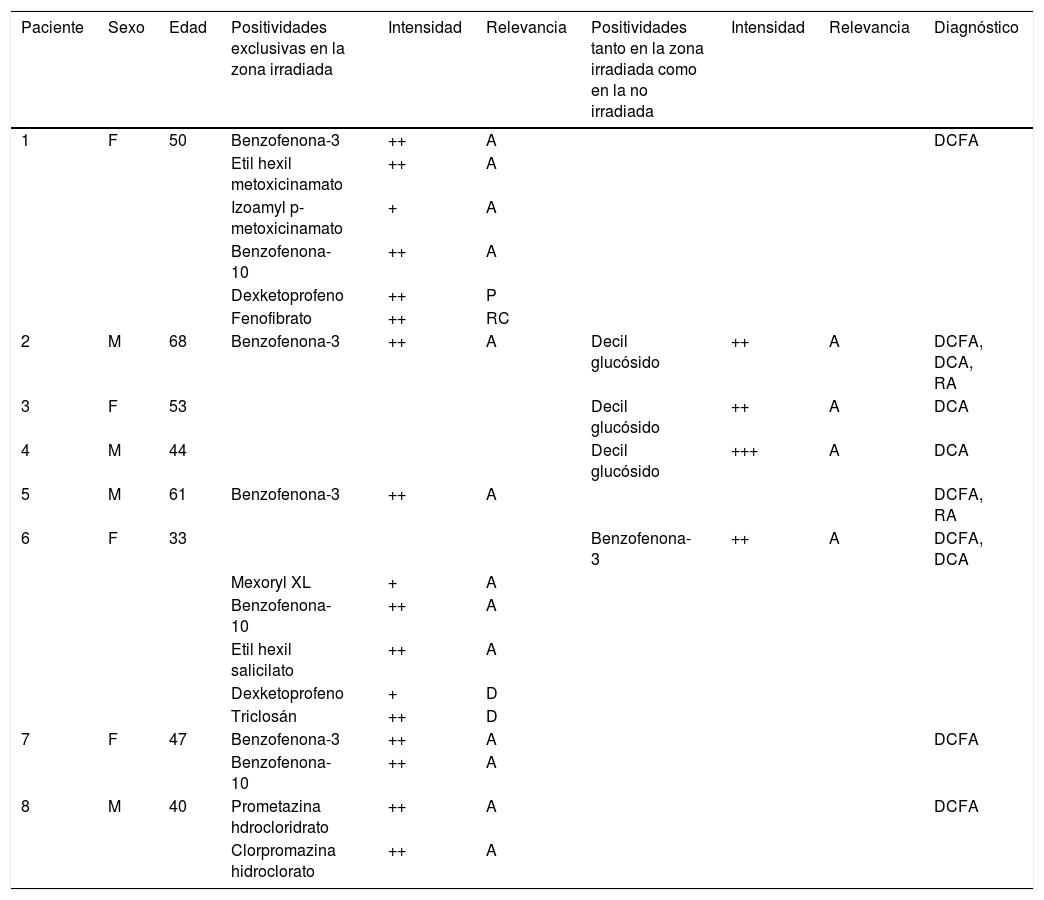
Datos de los pacientes con positividades en la prueba del fotoparche
| Paciente | Sexo | Edad | Positividades exclusivas en la zona irradiada | Intensidad | Relevancia | Positividades tanto en la zona irradiada como en la no irradiada | Intensidad | Relevancia | Diagnóstico |
|---|---|---|---|---|---|---|---|---|---|
| 1 | F | 50 | Benzofenona-3 | ++ | A | DCFA | |||
| Etil hexil metoxicinamato | ++ | A | |||||||
| Izoamyl p-metoxicinamato | + | A | |||||||
| Benzofenona-10 | ++ | A | |||||||
| Dexketoprofeno | ++ | P | |||||||
| Fenofibrato | ++ | RC | |||||||
| 2 | M | 68 | Benzofenona-3 | ++ | A | Decil glucósido | ++ | A | DCFA, DCA, RA |
| 3 | F | 53 | Decil glucósido | ++ | A | DCA | |||
| 4 | M | 44 | Decil glucósido | +++ | A | DCA | |||
| 5 | M | 61 | Benzofenona-3 | ++ | A | DCFA, RA | |||
| 6 | F | 33 | Benzofenona-3 | ++ | A | DCFA, DCA | |||
| Mexoryl XL | + | A | |||||||
| Benzofenona-10 | ++ | A | |||||||
| Etil hexil salicilato | ++ | A | |||||||
| Dexketoprofeno | + | D | |||||||
| Triclosán | ++ | D | |||||||
| 7 | F | 47 | Benzofenona-3 | ++ | A | DCFA | |||
| Benzofenona-10 | ++ | A | |||||||
| 8 | M | 40 | Prometazina hdrocloridrato | ++ | A | DCFA | |||
| Clorpromazina hidroclorato | ++ | A |
Positividades exclusivas en la zona irradiada y positividades tanto en la zona irradiada como en la no irradiada en pacientes mencionados por número de identificación de la tabla 1.
Relevancia. A: actual; D: desconocida; P: pasada; RC: reacción cruzada.
Diagnósticos. DCA: dermatitis por contacto alérgica; DCFA: dermatitis por contacto fotoalérgica; RA: reticuloide actínico.
En los 8 pacientes hubo al menos una reacción con relevancia conocida, 7 pacientes por alérgenos contenidos en protectores solares y uno por psicofármacos (prometazina y clorpromazina). Las reacciones a dexketoprofeno y triclosán tuvieron relevancias desconocidas o pasadas. Por otro lado, el fenofibrato se presentó como reacción cruzada a la oxibenzona en una paciente con fotoalergia a su filtro solar.
La oxibenzona fue positiva en 5 pacientes (14,28%), 4 de ellos con DCFA (11,42%) y solo una paciente con DAC a benzofenona-3, pero además tuvo fotoalergia a Mexoryl XL®, etil hexil salicilato y benzofenona-10. En estos 5 pacientes había benzofenona-3 en los protectores solares implicados, es decir, de relevancia conocida.
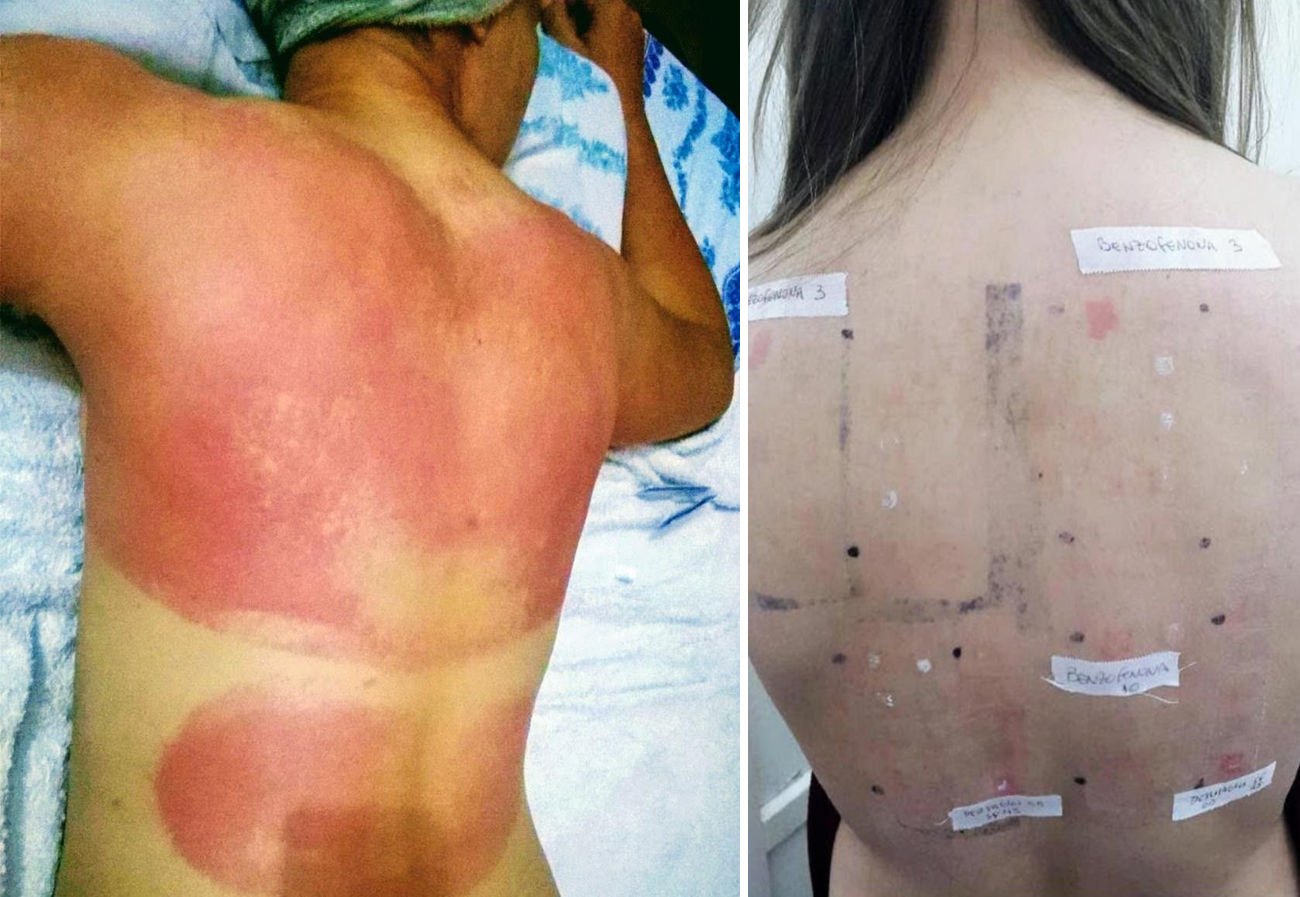
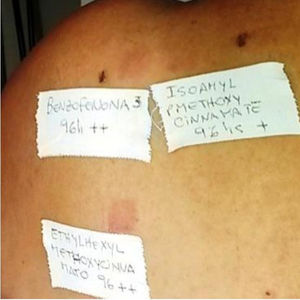
DiscusiónLos protectores solares pueden convertirse en agentes responsables de DCFA (véase un ejemplo de paciente afectado en la figura 4). Actualmente, los principales filtros de protección solar relacionados con DCFA son de tipo orgánico. En los años 80, el ácido paraaminobenzoico (PABA) tuvo una alta incidencia de DCFA10; además se lo relacionó con el incremento de cáncer cutáneo, por lo que actualmente se encuentra en desuso. En los últimos años hubo reportes sobre la utilización de ciertos ésteres de PABA en protectores solares, como el padimato O11.
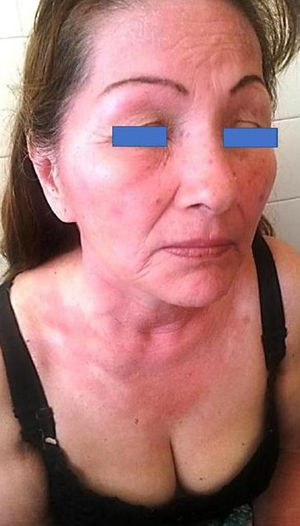
Paciente con reacción de fotosensibilidad tras exponerse al sol con protector solar pediátrico. Paciente con antecedente de intolerancia a cosméticos. Después de la prueba, la paciente presentó reacción de fotosensibilidad a la benzofenona-10 y reacción en zona irradiada y no irradiada a benzofenona-3, ambas sustancias compuestos del protector solar.
Los resultados de varios estudios epidemiológicos en Estados Unidos y Europa sobre DCFA difieren de acuerdo con su prevalencia y a la frecuencia de los principales fotoalérgenos. Esto estaría relacionado con ciertos factores como etnia, clima, ubicación geográfica, costumbres, tiempo de exposición solar y distintos productos de contacto utilizados, entre ellos los protectores solares. En la Clínica Mayo, en una muestra de 182 pacientes, se observó que 54 (29,7%) de ellos correspondían a DCFA. Los principales fotoalérgenos fueron medicamentos, fotoprotectores, fragancias y antisépticos12.
El Grupo de Trabajo Europeo de Fotoparche plantea, por consenso, realizar la prueba de FP con una serie de fotoalérgenos estándar que contiene principalmente protectores solares y medicamentos. El resultado obtenido de un estudio multicéntrico en 30 centros dermatológicos, entre los años 2008 y 2011, indicó que el 19,4% de los pacientes tuvieron una o más reacciones. Los principales agentes causales fueron: benzofenona-3 (oxibenzona), octocrileno y butil-methoxi-dibenzoylmetano (avobenzona); los AINES más frecuentes fueron ketoprofeno y etofenamato. Además, a diferencia de otras regiones donde la oxibenzona lidera como agente causal de DCFA, en Europa el principal fotoprotector implicado fue octocrileno, teniendo en cuenta que esta sustancia es similar en su estructura química al ketoprofeno, el fotosensibilizador europeo más frecuente13.
Un estudio reciente sobre 2.577 pacientes con octocrileno 10% en vaselina, realizado en Alemania, Austria y Suiza, reportó solo 2 casos (0,08% [IC 95: 0,01-0,28%]) de reacciones positivas relevantes a este filtro UVB en prueba del parche sin irradiación. Los autores consideran que en países como Bélgica, Francia, España e Italia las tasas de sensibilización a octocrileno son más altas por el uso frecuente de ketoprofeno tópico el cual actuaría como sensibilizador y a su vez generaría una reacción cruzada. De esta manera se observa un incremento del 0,7% en DAC y del 4% en DCFA a octocrileno en pacientes estudiados, pero no se considera a este como gran sensibilizante14.
Un estudio de fotoparche en Colombia reportó un 20% de prevalencia de DCFA entre los pacientes con fotosensibilidad, valor cercano a estudios europeos. El principal fotoalérgeno resultó ser la oxibenzona, apareciendo en el 15% de los pacientes y el 55% de los casos positivos15. Basado en un análisis previo, se observa una disminución de la sensibilización general a la oxibenzona en 10 años, del 31,7% (2001-2003) al 15% (2011-2013), aparentemente debido a la eliminación de esta sustancia de muchos protectores solares en la región16.
La prometazina y clorpromazina son antipsicóticos que suelen estar implicados en reacciones fotoalérgicas sistémicas por su vía oral de administración y dar reacciones cruzadas entre ellos17. Del mismo modo, en nuestro estudio se detectó un caso que solo recibió prometazina. No solo se observan reacciones fotoalérgicas en la prueba de FP, sino que también pueden diagnosticarse dermatitis por contacto o reacciones retardadas, las cuales aparecen tanto en la zona irradiada como en la no irradiada. Por ejemplo, sensibilización en la zona no irradiada por decil glucósido, un surfactante utilizado en Tinosorb M®, protector solar orgánico de amplio espectro y alta absorción en el rango UV18.
La oxibenzona es un compuesto que absorbe en el rango 290-340nm de amplio uso en cosmética, así como en productos industriales (fig. 5). Esta cetona aromática es soluble en solventes orgánicos e insoluble en agua, puede atravesar la barrera cutánea y sus metabolitos se excretan en orina, luego de la aplicación tópica extendida19. Fue nombrada en el 2014 como alérgeno del año por la Sociedad Americana de Dermatitis por Contacto, además fue hallada en el 68% de 201 fotoprotectores estudiados en los Estados Unidos de América. Aunque podrían existir reacciones cruzadas entre la oxibenzona y otras benzofenonas, el mecanismo aún no está bien determinado. Las benzofenonas evitan la alteración de un producto por radiación UV y suelen utilizarse en protectores solares, champús, geles de ducha, tintura de cabello, jabones, lacas de uña, labiales y humectantes. Además, se encuentran en productos industriales como pinturas, barnices, gomas y plásticos, para extender su durabilidad y reducir la fotodegradación20.
Además, un estudio refiere el caso de una turista que desarrolló una DCFA en muslos anteriores tras exponerse al sol en la playa, debido al contacto con una revista cuya composición de la tinta contenía oxibenzona21. Las manifestaciones clínicas más frecuentes suelen ser eccema por contacto alérgico y DCFA, cuando se utiliza en protectores solares. Otras reacciones adversas descritas son urticaria por contacto y anafilaxia22.
Con respecto a su absorción cutánea o digestiva, debido a su naturaleza lipolítica se ha detectado en leche materna. Incluso, tras 4h de la aplicación tópica, se ha encontrado benzofenona-3 en orina de seres humanos23. Esto ha llevado a la investigación de la posible afectación a nivel reproductivo y ontogénico en seres humanos y en animales expuestos. Existen estudios que han demostrado un efecto estrogénico de las benzofenonas dependiente de la dosis e incluso se plantea la posibilidad de inducir la proliferación de cáncer de mama en pacientes con receptores de estrógenos positivos24,25. Por otro lado, estudios de impacto ambiental han detectado altas concentraciones de oxibenzona en regiones alejadas de zonas turísticas, donde se pueden afectar tanto los peces como los corales26,27.
Nuestros resultados revelan un 17,14% de DCFA, 6 de 35 pacientes estudiados con fotosensibilidad durante 2 años (2015-2016). La oxibenzona fue el filtro UVA orgánico causal más frecuente, observándose en 5 de los 6 casos: 4 fueron reacciones fotoalérgicas y una dermatitis alérgica por contacto, teniendo todos una relevancia conocida en el uso de fotoprotectores. El sexto caso correspondió a un paciente con fotosensibilidad a la prometazina y con reacción cruzada a la clorpromazina debido al tratamiento por vía oral. Por último, se encontraron casos aislados de sensibilización por decil glucósido, surfactante del filtro solar Tinosorb M® incluido en la batería de fotoalérgenos; este no suele comportarse como cromóforo sensibilizador, sino como hapteno de alergia por contacto. No observamos ningún caso de fotoalergia a ketoprofeno ni a octocrileno en nuestro estudio, pero sí 2 a dexketoprofeno sin relevancia conocida.
La fotoeducación contempla aumentar el conocimiento de los protectores solares orgánicos. Respecto al balance riesgo/beneficio de la benzofenona-3, se recomienda utilizar otros filtros UVA, como la avobenzona, sobre todo en embarazadas, lactantes y niños28. El octocrileno es un filtro UVB seguro, aunque debiera evitarse en pacientes pediátricos, especialmente atópicos y con alergia a los analgésicos como ketoprofeno. Se desaconseja el uso de fotoprotectores en lactantes menores de 6 meses de edad, y para mayores utilizar preferentemente filtros inorgánicos (óxido de zinc o dióxido de titanio en sus fórmulas no micronizadas en nanopartículas). Se debe valorar el interrogatorio, la clínica y la opción de hacer pruebas epicutáneas para realizar un diagnóstico certero. Se recomienda la aplicación de la prueba de FP, cuando se presenta un paciente con una reacción fotosensible y/o ante la sospecha de intolerancia a protectores solares.
Nuestros resultados sobre el porcentaje de fotoalergia a oxibenzona son proporcionales a los reportados en Colombia. Esto abre la interrogante sobre las diferencias obtenidas en otros países. Por ejemplo, el ketoprofeno, principal fotoalérgeno en Europa, provoca una reacción cruzada con el octocrileno, colocándolo por encima de la oxibenzona. Es poco habitual el uso de analgésicos no esteroideos tópicos en nuestra región. No obstante, el octocrileno se encuentra en la mayoría de los fotoprotectores comerciales.
Consideramos necesario el estudio permanente de fotosensibilidad, en particular en aquellas personas que muestran intolerancias a protectores solares. Esto permitirá no solo mantener actualizada la información sobre la afectación de nuevos productos comerciales, sino también preservar la salud de nuestros pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores Ipiña A. y Piacentini R. D. agradecen al Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) en Argentina por el apoyo brindado. A los revisores por sus valiosas sugerencias y acotaciones en este trabajo.