INTRODUCCIÓN
Los interferones (IFN) son una familia de citocinas producidas de forma natural en respuesta a la infección viral, la estimulación antigénica y la activación inducida por mitógenos1 . Su nombre deriva de su capacidad para «interferir» en la infección viral e inducir un estado antiviral. Existen varios tipos de IFN según sus propiedades bioquímicas; los principales son el alfa y el gamma (IFN-α y el IFN-α), y pertenecen a dos familias diferentes, con poca homología entre ellas. El IFN-α pertenece a la familia I de los interferones y lo producen los leucocitos y fibroblastos en respuesta a las infecciones virales. El IFN-α es de tipo II, y está producido por los linfocitos T y por las células asesinas naturales (NK) en respuesta a la estimulación antigénica. Existen dos tipos de IFN-α: IFN-α2a e IFN-α2b, con mínimas diferencias entre sus moléculas, lo cual no justifica un análisis por separado de los protocolos que utilizan cada uno de ellos2 .
El IFN-α posee diversos efectos moduladores sobre la respuesta inmunitaria. Los efectos antitumorales se dividen en directos e indirectos3 . Los primeros engloban las acciones antiproliferativas, favorecedoras de la diferenciación e inhibidoras de la síntesis de proteínas por parte de las células tumorales que posee el interferón; los segundos se basan en la capacidad del IFN para potenciar la respuesta inmunitaria frente al tumor. En este sentido, se ha comprobado que el IFN aumenta la expresión de los antígenos tumorales en la superficie de las células neoplásicas, e incrementa la expresión de las moléculas del complejo mayor de histocompatibilidad tipos I y II, que son las encargadas de la presentación de los antígenos por parte de las propias células tumorales y de las células presentadoras de antígenos, respectivamente4 . Todo esto vuelve a las células tumorales más susceptibles frente a los linfocitos del huésped. Además, el IFN-α aumenta la actividad de las células NK y el número de linfocitos CD4 que infiltran el melanoma5 . Finalmente, en los últimos años se ha descubierto que el IFN-α posee una actividad antiangiogénica dependiente de la dosis y del régimen de administración, que también podría estar relacionada con su acción antitumoral6 .
El IFN-α se empezó a utilizar en el tratamiento adyuvante del melanoma a partir de los resultados obtenidos en algunos estudios en fase II en melanoma metastásico. Las respuestas obtenidas en estos estudios oscilaron entre el 10 y el 20 %, y la mayoría eran respuestas parciales7,8 , lo cual desalentó su uso de una manera generalizada en los pacientes con enfermedad metastásica. Sin embargo, se observó que los pacientes con enfermedad no visceral eran los que respondían mejor, lo cual sugiere que los mejores candidatos para el tratamiento con IFN-α serían aquellos con micrometástasis9 .
Los estudios clínicos con IFN-α como tratamiento adyuvante del melanoma se dividen básicamente en tres categorías según la dosis de IFN-α utilizada: a) dosis altas; b) dosis intermedias, y c) dosis bajas (tabla 1). La mayoría de los estudios con dosis bajas han administrado IFN-α2a, y a la inversa, la mayoría de los que utilizan dosis elevadas han empleado IFN-α2b.
DOSIS BAJAS DE INTERFERÓN
Se han encontrado cinco estudios aleatorizados en los que se comparaba el tratamiento con IFN-α en dosis bajas frente a observación10-15 . Las características de los cuatro estudios principales se resumen en la tabla 2. Aunque el tipo de IFN-α utilizado (IFN-α2a) y la dosis (3 millones de unidades [MU] por vía subcu-
TABLA 1. PRINCIPALES REGÍMENES DE INTERFERÓN (IFN) UTILIZADOS EN LOS ENSAYOS CLÍNICOS
tánea, 3 días por semana) fueron los mismos en los cuatro ensayos, existen diferencias entre ellos que hay que destacar y que imposibilitan agrupar a todos los pacientes. Las principales diferencias son el tiempo de tratamiento (entre 1 y 3 años), la existencia o no de un ciclo inicial de inducción y el estadio en el que se encontraban los pacientes incluidos (riesgo intermedio o alto según los estudios).
La Organización Mundial de la Salud (OMS) realizó un estudio con IFN-α2a que incluyó 444 pacientes con melanoma en estadio III, la mitad de los cuales recibieron tratamiento con IFN-α2a (3 MU, 3 veces por semana durante 3 años) y el resto fueron tratados sólo con cirugía. En un análisis preliminar, se observó una ventaja en la supervivencia libre de enfermedad (SLE) y en la supervivencia global (SG) de las mujeres menores de 51 años y los varones mayores de 50 años10 . Sin embargo, una actualización en el seguimiento de estos pacientes a los 5 años no encontró mejoría ni en la SLE ni en la SG11 .
En 1998, el French Cooperative Group on Melano12 publicó los resultados de un estudio aleatorizado con IFN-α2a en dosis bajas durante 18 meses como tratamiento adyuvante en pacientes con melanomas cutáneos con un espesor de Breslow mayor de 1,5 mm12 . Se incluyeron 489 pacientes en el estudio tras realizar la extirpación de la lesión primaria. Ninguno de los pacientes tenía adenopatías palpables; sin embargo, no se realizó disección del ganglio centinela en ningún caso. Tras una mediana de seguimiento de 5 años se encontró un aumento significativo en el intervalo libre de enfermedad, y una tendencia a una mejoría en la SG, que no llegaba a alcanzar significación estadística.
Un estudio multicéntrico austriaco encontró también un aumento en el intervalo libre de enfermedad13 . El protocolo de tratamiento incluía una primera fase de 3 semanas de inducción en la que los pacientes recibían 3 MU de IFN por vía subcutánea diariamente, y posteriormente pasaban a la fase de mantenimiento con la dosis usual de 3 MU, 3 veces por semana, hasta completar un año. Se incluyeron 311 pacientes en este estudio, cuyos melanomas se encontraban en los mismos estadios que en el estudio francés (localizados con Breslow > 1,5 mm) y la mediana de seguimiento fue de 3,4 años.
TABLA 2. PRINCIPALES ESTUDIOS REALIZADOS CON DOSIS BAJAS DE INTERFERÓN (IFN)
Muy recientemente se han publicado los resultados de un estudio en el que 674 pacientes con melanoma primario cutáneo con un espesor mayor o igual a 4 mm y/o metástasis locorregionales (estadios IIB y III) entraron en un ensayo aleatorizado15 . La mitad de los pacientes recibieron tratamiento con IFN-α2a en dosis bajas durante 2 años como máximo, o hasta la recurrencia de la enfermedad, si se producía antes de los 2 años. A los 5 años, 426 pacientes (63 %) habían sufrido una recidiva de la enfermedad (211 tratadas con IFN y 215 del grupo control) y 307 pacientes (46 %) murieron (151 del grupo del IFN y 156 del grupo control). Las tasas de SG y SLE para todo el grupo a los 5 años fueron de 44 y 32 %, respectivamente. No había diferencias estadísticamente significativas en SG o SLE entre los dos grupos.
Este último estudio15 , y una reciente revisión sistemática de todos los estudios publicados antes de 200216 han llegado a la conclusión de la falta de efectividad de las dosis bajas de IFN en el tratamiento adyuvante del melanoma.
DOSIS ALTAS DE INTERFERÓN
El primer estudio con dosis altas de IFN-α se publicó en 1995. Fue realizado en Estados Unidos por el North Central Cancer Treatment Group17 y, a diferencia del resto de estudios con dosis elevadas, utilizó IFN-α2a en lugar de IFN-α2b. El esquema de administración también difería del utilizado en el resto de estudios con dosis elevadas, ya que no tenía una primera fase de inducción de 4 semanas, y las dosis eran de 20 MU/m2 , pero administradas por vía intramuscular, y durante 12 semanas. Se incluyeron pacientes de riesgo intermedio y alto (melanomas localizados con Breslow > 1,69 y melanomas con metástasis ganglionares). En este estudio no se detectaron diferencias en la SLE ni en la SG al comparar el grupo de pacientes tratados con IFN con el grupo que sólo recibió cirugía pero, al analizar por subgrupos, se observó una mejoría estadísticamente significativa en los pacientes con metástasis ganglionares tratados con IFN.
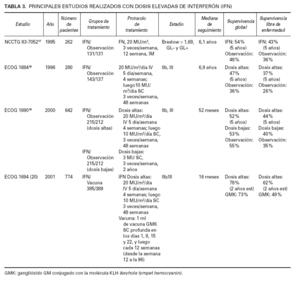
La mayoría de datos del IFN-α en dosis elevadas derivan de tres estudios prospectivos aleatorizados realizados en Estados Unidos por el Eastern Cooperative Oncology Group18-20 . Todos ellos utilizaron lo que se estableció en el primero de ellos como dosis máximas tolerables (protocolo mencionado en la tabla 1: 20 MU/m2 /día de IFN-α2b, por vía intravenosa (IV), 5 días por semana, 4 semanas y, posteriormente, 10 MU/m2 , por vía subcutánea (SC), 3 días por semana, durante 48 semanas). En la tabla 3 se detallan las principales características y resultados de estos estudios. El primero de ellos (ECOG 1684) fue la base para que la Food and Drug Administration (FDA) aprobase el IFN en dosis elevadas como tratamiento adyuvante del melanoma cutáneo localizado de mal pronóstico (Breslow > 4 mm) o con ganglios clínica-mente afectados18 . Este estudio incluyó a 280 pacientes, 143 de los cuales recibieron IFN-α2b en dosis elevadas y 137 en observación. Los pacientes incluidos tenían melanomas de alto riesgo localizados, con metástasis ganglionares (clínicamente palpables o micrometástasis detectadas en linfadenectomía profiláctica), y pacientes con recurrencias ganglionares regionales. Es importante destacar que todos los pacientes de este estudio fueron sometidos a linfadenectomía profiláctica, o tratamiento cuando tenían ganglios palpables. Los resultados de este estudio mostraron un aumento del 42 % en la SLE estimada a los 5 años de los pacientes que recibieron tratamiento frente al grupo control (37 % frente a 26 %; p = 0,023) y, lo que es más importante, una mejora del 24 % en la SG (46 % frente a 37 %; p = 0,0237). La mediana de la SLE de los pacientes tratados con IFN-α frente a los no tratados se incrementó de 1 a 1,7 años, y de igual modo, la mediana de la SG aumentó de 2,8 a 3,8 años. Una gran ventaja de este estudio fue que, al conocer el estado patológico de los ganglios linfáticos de todos los pacientes, se pudo analizar el subgrupo de pacientes más beneficiado por el IFN. En este sentido, los pacientes que más mejoraron con el tratamiento con dosis elevadas de IFN-α fueron aquellos con ganglios metastásicos clínicamente palpables (con una reducción del riesgo de recurrencia estadísticamente significativa; p = 0,0004), seguidos de aquellos con metástasis microscópicas, aunque en éstos la reducción no llegó a alcanzar significación estadística, posiblemente por el pequeño número de pacientes con estas metástasis. Los pacientes con tumor localizado en la piel, sin afectación ganglionar, según el análisis realizado, no se beneficiaron del tratamiento con IFN-α a estas dosis.
Una de las mayores desventajas de este régimen de tratamiento es su toxicidad. De hecho, sólo el 75 % de los pacientes que iniciaron el estudio ECOG 1684 pudieron completarlo. Durante el primer mes, alrededor del 50 % de los pacientes requirieron una disminución de la dosis, y el 67 % de todos ellos tuvieron alguna reacción tóxica grave (grado 3) en algún momento durante el tratamiento. Los efectos secundarios más frecuentes eran síntomas constitucionales de tipo gripal, mielosupresión, sintomatología neuropsiquiátrica y toxicidad hepática; de hecho, dos pacientes murieron por una insuficiencia hepática en el ensayo ECOG 1684.
Con la intención de comprobar si una dosis menor de IFN-α sería capaz de mantener las ventajas en la supervivencia conseguidas con las dosis elevadas, pero disminuyendo su toxicidad, se diseñó un estudio (ECOG 1690) con tres grupos de tratamiento: IFN-α2b en dosis elevadas como en el ECOG 1684, IFN-α2b en dosis bajas (3 MU SC, 3 días por semana durante 2 años) y observación19 . Un total de 642 pacientes integraron el estudio. El tipo de pacientes incluidos era el mismo que en el ECOG 1684, pero no se estableció como requisito la linfadenectomía profiláctica para los pacientes que no tuviesen ganglios clínicamente afectados. Los resultados mostraron un aumento estadísticamente significativo en la SLE a los 5 años entre el grupo tratado con dosis elevadas y el grupo que no recibió tratamiento, mientras que las diferencias entre el grupo tratado con IFN-α2b en dosis bajas y el no tratado no alcanzaron significación estadística (SLE a los 5 años para el grupo de dosis altas del 44 %; para las dosis bajas del 40 %, y del 35 % para el grupo no tratado). Sin embargo, lo más relevante de este estudio fue que no se encontraron diferencias en SG entre los tres grupos (supervivencia estimada a los 5 años para el grupo de dosis altas del 52 %, dosis bajas del 53 %, y observación del 55 %). Al realizar un análisis por subgrupos, el que más se benefició del tratamiento con IFN en dosis elevadas, en cuanto a SLE se refiere, fue el de aquellos pacientes con dos o tres ganglios afectados. La discordancia con los resultados del ECOG 1684 se ha intentado explicar argumentando que el porcentaje de SG del grupo control en el ECOG 1690 fue mucho mayor que en el ECOG 1684 (55 % frente al 36 %). Los autores de estos dos estudios proponen que la mejor supervivencia del grupo control del ECOG 1690 se debe probablemente a que muchos de los pacientes de este grupo que presentaron recurrencias fueron rescatados con IFN-α en dosis elevadas. Sin embargo, y aunque esta explicación podría justificar la diferencia de supervivencia entre el grupo tratado con dosis altas y el grupo control, no se explicaría la ausencia de diferencias en la SG, y muy pequeña en la SLE, entre el grupo tratado con dosis elevadas y el que recibió dosis bajas.
TABLA 3. PRINCIPALES ESTUDIOS REALIZADOS CON DOSIS ELEVADAS DE INTERFERÓN (IFN)
Los defensores de las dosis elevadas de IFN-α utilizan los resultados de un tercer estudio para reafirmarse en la utilidad de este tratamiento. En el estudio en fase III ECOG 1694 se comparó la eficacia de las dosis elevadas de IFN-α2b con una vacuna para el melanoma cuyo principal constituyente era el antígeno del melanoma GM220 . El estudio estaba constituido por 880 pacientes con melanomas en estadios IIB, III o con enfermedad regional recurrente. Al igual que en el estudio ECOG 1690, y a diferencia del ECOG 1684, no se contempló la realización de linfadenectomía profiláctica a todos los pacientes. Este antígeno es un gangliósido de la membrana celular que se había utilizado anteriormente en un estudio aleatorizado, en el que los pacientes que fueron tratados con esta vacuna tuvieron una mejoría en la supervivencia que rozó la significación estadística21 . El análisis posterior de los datos de aquel estudio mostró que un número considerable de los pacientes del grupo control tenían ya previamente anticuerpos antigangliósidos, que eran los que se pretendían generar con la vacuna y, por lo tanto, habrían podido jugar a favor del grupo control. La vacuna utilizada en el ECOG 1694 se denominó GMK , dado que el gangliósido GM2 se conjugó con una molécula KLH (keyhole lympet hemocyanin) que hacía las veces de portadora (carrier) , y como adyuvante se utilizó saponina (QS21). Este estudio tuvo que ser cerrado antes de lo previsto, con una mediana de seguimiento de los pacientes de 16 meses, debido a la existencia clara de una ventaja en la SG (cociente de azar: 1,52; es decir, riesgo de muerte en los tratados con GM2 un 52 % superior a los que recibieron IFN) y en la SLE (cociente de azar: 1,47; es decir, riesgo de recurrencia un 47 % superior en los que recibieron GM2) de los tratados con IFN-α frente a los que recibieron la vacuna. Los pacientes habían sido estratificados según el número de ganglios linfáticos afectados, y el análisis posterior demostró una ventaja en la supervivencia de los tratados con IFN-α en cada uno de los grupos, pero el beneficio era mayor y, de hecho, era el único con significación estadística, en aquellos con ganglios no palpables. Pueden realizarse tres críticas al diseño de este estudio: en primer lugar, la ausencia de un grupo control que no recibiese tratamiento; en segundo lugar, la posibilidad de que éste se cerrara demasiado pronto, y de que la vacuna hubiese podido mostrar ventajas más adelante en el seguimiento de los pacientes; y, por último, la posibilidad de que la vacuna tuviese un efecto perjudicial sobre aquellos que la recibieron, ofreciendo una sensación irreal de ventaja en los tratados con IFN-α. Esto último es poco probable, ya que en el estudio previo con la vacuna de gangliósidos no se observó ningún efecto deletéreo en aquellos que la recibieron, más bien al contrario, los que conseguían generar una respuesta inmunitaria humoral frente a los gangliósidos tenían un mejor pronóstico21 .
Por último, una actualización del estudio ECOG 1684, con una mediana de seguimiento de 12,6 años, ha introducido nuevos interrogantes, ya que mientras la SLE en los pacientes tratados con IFN-α sigue manteniendo la misma ventaja, con significación estadística, frente a los no tratados, la SG muestra una disminución en el nivel de su significación estadística (p = 0,02 a los 7 años, pero del 0,09 a los 12,6 años de seguimiento)22,23 .
De estos tres estudios se puede concluir que:
DOSIS INTERMEDIAS DE INTERFERÓN
El estudio EORTC 18952 es, con diferencia, el mayor en cuanto a número de pacientes incluidos (1388) en melanomas de alto riesgo (IIb y III) con dosis intermedias de IFN-α2b. En este estudio existían dos grupos de tratamiento y un grupo control. Tras un ciclo de inducción de 4 semanas en el que los pacientes recibían IFN en dosis de 10 MU/día por vía subcutánea, durante 5 días/semana, existían dos brazos distintos de mantenimiento: a) 10 MU SC, 3 días por semana, durante un año; b) 5 MU SC, 3 veces por semana, durante 2 años. En un análisis presentado en septiembre de 200325 , y con una mediana de seguimiento de 4,2 años, se encontró que no existían diferencias estadísticamente significativas entre los tres brazos del estudio. Sin embargo, aunque el tratamiento con 10 MU no tenía ningún efecto sobre la SG ni sobre el intervalo sin metástasis a distancia, el protocolo con 5 MU durante 2 años tenía un efecto marginal, que no llegaba a la significación estadística, sobre el intervalo sin metástasis a distancia. La toxicidad de este régimen fue muy aceptable, ya que sólo el 10 % de los pacientes tuvieron una toxicidad de grado 3 o 4, principalmente en forma de fatiga, anorexia y cambios de humor, mientras que los efectos secundarios hematológicos y hepáticos fueron infrecuentes.
CUESTIONES SOBRE EL INTERFERÓN
Los ensayos realizados con IFN-α han planteado una serie de interrogantes que se resumen de la siguiente manera:
Dosis de interferón más adecuadaLas dosis elevadas han conseguido aumentar la SLE de los pacientes con melanoma de alto riesgo en todos los estudios. Sin embargo, se trata de una mejoría discreta, y a costa de una importante toxicidad. Por ello, debe valorarse cada caso, y discutir con el paciente la eficacia del tratamiento y la morbilidad que supone.
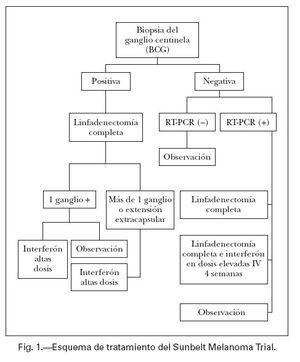
Papel del IFN-αsobre las micrometástasis ganglionaresNo sabemos en la actualidad si los pacientes a los que se realiza el ganglio centinela tienen mejor supervivencia que aquellos en los que se adopta una actitud expectante. Lo que sí es evidente es que el ganglio centinela es un método muy útil para estratificar a los pacientes en diferentes grupos de riesgo, y tratar a estos grupos de una forma más homogénea y racional. El Sunbelt Melanoma Trial es un estudio prospectivo aleatorizado que se está realizando en 79 hospitales, y pretende responder entre otros a una serie de interrogantes sobre el tratamiento con IFN-α en dosis elevadas dependiendo del resultado del ganglio centinela26 . Se han incluido 3.548 pacientes con melanomas con un Breslow igual o superior a 1 mm. La figura 1 resume el esquema de tratamiento de este estudio. Los pacientes se han dividido en dos brazos según el ganglio centinela sea positivo con la histología o inmunohistoquímica (grupo A) o negativo (grupo B). A todos los pacientes del grupo A se les realizó linfadenectomía reglada, y si el único ganglio afectado es el centinela se estratifica a los pacientes en dos grupos: observación sólo, o IFN-α en dosis elevadas. Todos los pacientes en los que se encuentra más de un ganglio afectado o extensión extracapsular son tratados con IFN-α en dosis elevadas. En todos los pacientes en los que el ganglio centinela es negativo, se practica reacción en cadena de la polimerasa (PCR) del ganglio. En el caso de que ésta sea negativa, los pacientes entran en observación. En el caso de que ésta sea positiva, los pacientes son estratificados en tres grupos diferentes: observación, disección ganglionar solo, o disección ganglionar e IFN-α en dosis elevadas durante un mes solamente. Por lo tanto, este estudio pretende responder a tres cuestiones: utilidad del ganglio centinela, utilidad del análisis con RT-PCR (reacción en cadena de la polimerasa-trans-cripción inversa) del ganglio centinela, y también evalúa una nueva pauta de tratamiento con IFN-α en dosis elevadas, por vía intravenosa y durante sólo un mes, en un grupo de pacientes con mínima carga tumoral (histología e inmunohistoquímica negativas, RT-PCR positiva). Los futuros estudios con cualquier tratamiento adyuvante en melanoma deberán estadificar los ganglios de sus pacientes mediante la técnica del ganglio centinela, para poder delimitar mejor los grupos de riesgo, y aquellos que más se benefician del tratamiento27 .
Fig. 1.—Esquema de tratamiento del Sunbelt Melanoma Trial.
Candidatos ideales para el tratamiento con IFN-αLos tres estudios con dosis elevadas de IFN no utilizaron los mismos criterios para estadificar los casos. De hecho, sólo en el ECOG 1684 se evaluaron los ganglios de todos los pacientes (linfadenectomía profiláctica o terapéutica). Los resultados de los tres estudios son diferentes en cuanto al grupo de pacientes que podrían beneficiarse más del tratamiento con IFN-α según se encuentren sus ganglios linfáticos28 . Mientras que el ECOG 1694 mostró que los pacientes con mayor beneficio eran aquellos con ganglios negativos, los ECOG 1684 y ECOG 1690 demostraron que los que más mejoraban eran aquellos con ganglios metastásicos. Probablemente, también se obtendrán datos sobre este punto del Sunbelt Melanoma Trial.
LÍNEAS DE INVESTIGACIÓN EN ADYUVANCIA
Modificaciones de los actuales protocolos de interferónFase de inducción de las dosis elevadas
Basándose en la hipótesis de que la fase de inducción intravenosa del protocolo de Kirkwood con IFN-α en dosis elevadas, puede ser la más relevante para el éxito de este tratamiento, se ha diseñado un estudio (ECOG 1697) en el que se administran sólo las primeras 4 semanas de inducción intravenosa a pacientes con melanoma de riesgo intermedio (T3 1,5 mm, estadio IIA)22 . No se tienen todavía los resultados de este estudio. En la reunión de 2003 de la American Society of Oncology, se comunicaron los resultados de un estudio en el que se repetía este ciclo de 4 semanas de tratamiento 3 veces, dejando un plazo de 3 meses sin tratamiento entre cada ciclo de IFN29 . Se incluyeron 39 pacientes con melanoma, de los cuales cuatro tenían un tumor localizado de elevado espesor y 35 metástasis ganglionares regionales. La toxicidad fue sorprendentemente baja, ya que sólo el 20,6 % desarrollaron toxicidades de grado III/IV, y sólo el 14,7 % precisaron una reducción durante un corto plazo de tiempo de la terapia. A los 12 meses, el 23,3 % de los pacientes habían experimentado una recurrencia de su melanoma. En conclusión, se trata de un protocolo de tratamiento con IFN-α mejor tolerado que las clásicas dosis elevadas, y su eficacia parece similar. Los resultados de este estudio son suficiente soporte para un ensayo aleatorizado con esta pauta de tratamiento, que ya se encuentra en marcha.
Tratamiento a largo plazo
Algunos grupos de investigadores, principalmente de países europeos, apoyan el uso del IFN-α a dosis bajas o intermedias, pero mantenidas durante periodos más largos de tiempo que los hasta ahora analizados. La hipótesis que subyace en estos estudios es que un tratamiento a largo plazo sería más útil que las dosis altas, principalmente basándose en los efectos antiangiogénicos que se ha demostrado que posee el IFN-α en dosis bajas, y que se pierden en dosis elevadas6,30 . En este sentido, el ensayo EORTC 18991, que se encuentra en marcha, investiga el impacto del tratamiento durante 5 años con interferón pegilado (PEG-in-trón) frente a observación en pacientes con melanoma en estadio III25 .
Otros protocolos de adyuvanciaOtras moléculas
Vacunas. Se han evaluado y se está experimentando con múltiples vacunas para tratamiento adyuvante del melanoma: vacunas compuestas por gangliósidos, vacunas peptídicas, vacunas preparadas a partir de células dendríticas pulsadas con antígenos peptídicos, y vacunas preparadas a partir de células tumorales modificadas genéticamente. Su principal ventaja son sus escasos efectos secundarios. Hasta el momento, ninguna de estas vacunas ha conseguido demostrar en ensayos prospectivos una mejoría en la SLE ni en la SG.
Otras citocinas. El factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) es la citocina más prometedora en este ámbito. En 2000 se publicó un estudio en el que se trataron 48 pacientes con melanomas en estadios III y IV tras extirparles las metástasis con GM-CSF por vía subcutánea en ciclos de 28 días31 . Se les administraron 125 g/m2 diariamente durante 14 días, y posteriormente 14 días de descanso, y se repitieron estos ciclos durante un año o hasta la recaída. Al compararlos con controles históricos, se encontró una prolongación estadísticamente significativa en la SLE y en la SG en los pacientes tratados con GM-CSF. Otra ventaja de este tratamiento es su baja toxicidad. En la actualidad se encuentra en marcha una extensión de este protocolo, en el que los pacientes reciben los mismos ciclos de GM-CSF hasta 3 años32 . Se han incluido pacientes en estadios II, III y IV tras extirpación de sus tumores. En un análisis preliminar a los 2 años, la mayor ventaja en SG (comparando con controles históricos de la American Joint Committee on Cancer [AJCC]) se ha encontrado en los pacientes en estadios avanzados (IIIC y IV). La principal crítica de estos trabajos es que no se haya realizado de forma prospectiva con un grupo control tratado solamente con cirugía33 .
Ensayos con vacunas y GM-CSF. El ECOG 4697 evalúa la capacidad del GM-CSF para prolongar la supervivencia y el intervalo hasta la progresión en pacientes con melanoma de alto riesgo (satelitosis, metástasis en tránsito, metástasis ganglionares con extensión extracapsular o metástasis a distancia completamente extirpadas). En un subgrupo de pacientes, este estudio pretende también evaluar el papel de una vacuna compuesta por tres antígenos peptídicos asociados al melanoma, derivados de la tirosinasa, gp-100 y Me-lan-A/MART-1. Dado que el reconocimiento por las células T de estos péptidos se encuentra restringido por la posesión de la molécula del complejo mayor de histocompatibilidad HLA-A2, sólo los pacientes que expresen esta molécula entran en el grupo de la vacuna. De esta manera, los pacientes HLA-A2 negativos se distribuirán aleatoriamente entre GM-CSF (28 g subcutáneos diariamente, durante 14 días, cada 28 días) o placebo. Los pacientes HLA-A2 positivos recibirán GM-CSF, la vacuna peptídica, GM-CSF más la vacuna o placebo33 .
Asociación de interferón con otras moléculas que hayan demostrado actividad antimelanoma
IFN-αen dosis bajas e IL-2. Recientemente, se han publicado los resultados de un estudio combinando IFN-α en dosis bajas con IL-234 . El objetivo de este protocolo era mejorar los pobres resultados del IFN-α en dosis bajas y evitar la toxicidad de las dosis elevadas. Se incluyeron 223 pacientes con melanomas localizados de alto riesgo. Con una mediana de seguimiento de 79 meses no se encontró ninguna diferencia en cuanto a SG ni SLE entre el grupo que recibió tratamiento adyuvante con IFN-α en dosis bajas e IL-2 y el grupo control.
Ensayos de bioquimioterapia. El estudio Intergroup S0008 está comparando en pacientes con ganglios palpables (N2 o N3, estadio IIIB o IIIC), IFN-α en dosis elevadas con un régimen de bioquimioterapia compuesto por IFN-α2b, IL-2, cisplatino, vinblastina y dacarbazina22 .
CONCLUSIONES
De todo lo expuesto pueden extraerse las siguientes conclusiones:
Correspondencia:
Rafael Botella-Estrada. Servicio de Dermatología. Instituto Valenciano de Oncología. Prof. Beltrán Báguena, 8. 46009 Valencia. España. rbot@eresmas.net
Recibido el 15 de julio de 2004. Aceptado el 27 de septiembre de 2004.