Los nevus melanocíticos congénitos son lesiones muy frecuentes, pero que todavía plantean muchas cuestiones que son motivo de controversia. Una revisión sistématica de la literatura sugiere que el riesgo de desarrollar melanoma sobre nevus melanocíticos congénitos gigantes (NMCG) es inferior al que se postuló históricamente. En las series de NMCG más recientes sólo un 2 % de pacientes desarrolló un melanoma y la mayoría lo hizo antes de los 5 años de edad. Por tanto, su tratamiento quirúrgico profiláctico debe ser individualizado en función de la sospecha clínica de melanoma y de las consecuencias estéticas y funcionales.
En revisiones amplias de biopsias de melanoma se han encontrado NMC pequeños asociados en un 7-8 % de los casos. Muchos autores consideran que podrían tener un riesgo de malignización significativo a partir de la segunda década de vida, por lo que recomiendan la vigilancia periódica durante la infancia y la exéresis profiláctica en la pubertad.
Congenital melanocytic nevi are very common lesions that nevertheless pose many controversial questions. A systematic review of the literature suggests that the risk of developing melanoma on giant congenital melanocytic nevi (GCMN) is lower than previously thought given that, in the most recent series of GCMN, only 2 % of patients developed melanoma and most did so before the age of 5 years. Therefore, prophylactic surgery should be considered on an individual basis according to the degree of clinical suspicion of melanoma and the esthetic and functional consequences.
In extensive reviews of series of biopsies of melanoma, small congenital melanocytic nevi have been associated with 7 % to 8 % of cases. Many authors believe that these might represent a significant risk of malignant conversion from 10 years onwards and so recommend regular control visits during infancy and prophylactic exeresis in puberty.
A pesar de los múltiples artículos que existen referidos al nevus congénito, hay muchas preguntas que aún permanecen sin respuesta: ¿cuál es la incidencia real de melanoma en los nevus congénitos gigantes?, ¿es mayor el riesgo de melanoma en los nevus congénitos pequeños y medianos que en los nevus melanocíticos adquiridos?, ¿qué lesiones deberían extirparse?, ¿el tratamiento quirúrgico evita por completo el riesgo de transformación maligna?, ¿cuál es el momento más adecuado para la extirpación?, ¿los tratamientos superficiales que no eliminan completamente la lesión alteran su comportamiento biológico, incrementando el riesgo de desarrollo de melanoma?, etc.
La importancia de encontrar una respuesta a estas preguntas reside en que permitiría llegar a un consenso que facilitara el manejo terapéutico de estos pacientes. En este artículo se presenta una revisión sistemática de la literatura con el objetivo de aclarar algunas de estas cuestiones, examinar de forma crítica las conclusiones, resultados y recomendaciones existentes hasta el momento y proponer nuevos estudios que permitan conocer mejor el pronóstico y significado biológico de estas lesiones.
RevisiónConcepto de nevus melanocítico congénitoPor definición, los nevus melanocíticos congénitos (NMC) son lesiones constituidas por células pigmentadas que se originan durante la ontogénesis y están presentes al nacimiento1. Actualmente se consideran hamartomas derivados de la cresta neural, producidos por mutaciones postzigóticas que determinan defectos en la migración y/o diferenciación celular2.
Histológicamente se diferencian del nevus melanocítico adquirido (NMA) en que:
- 1.
Su tamaño suele ser mayor2-4.
- 2.
En lesiones de niños pequeños el patrón intraepidérmico a menudo es «lentiginoso», con disposición de las células névicas formando una hilera en la unión dermoepidérmica4,5.
- 3.
Tienen una población melanocítica doble 6, con: a) un componente epitelioide que adopta una disposición juntural, expande la dermis adventicial y evoluciona con maduración e involución; b) un componente neuromesenquimal, con células de apariencia linfocitoide que infiltran más profundamente, llegando a los dos tercios inferiores de la dermis y el tejido celular subcutáneo, se disponen entre los haces de colágeno sueltas o formando hileras (en fila india), tienen una tendencia anexocéntrica, angiocéntrica y neurocéntrica y no muestran fenómenos madurativos ni involutivos2,4,5,7.
Sin embargo, algunas lesiones con estas características se hacen ostensibles clínicamente después del nacimiento, por lo que puede ser preferible la denominación «patrón de NMC»4,7,8. Algunos autores se han referido a este subgrupo de nevus como «NMC tardíos», siendo detectables casi siempre antes de los 2 años de vida2.
Por el contrario, algunas lesiones con patrón de NMA denominadas «nevus de aparición temprana o precoz» pueden estar presentes en el momento del nacimiento, lo que justifica también la designación de «patrón de NMA».
Los NMC se han clasificado según su tamaño utilizando varios métodos arbitrarios: superficie, relación con otras estructuras como la palma de la mano, diámetro mayor y dificultad para la exéresis quirúrgica2. Actualmente se emplea la clasificación propuesta por Kopf9: NMC pequeños (< 1,5cm), medianos (> 1,5m ≤ 20cm) y gigantes (≥ 20cm).
Además de estos tres tipos de NMC existen algunas variantes especiales. El término «NMC en vestimenta» se utilizó clásicamente para referirse a los NMC gigantes (NMCG) con un diámetro mayor superior a 40cm y situados en el tronco1. El «NMC dividido del párpado» (kissing nevus) afecta a las porciones adyacentes del párpado superior e inferior del ojo, de tal forma que al cerrar los ojos parece una lesión única. Estos NMC se forman entre la novena y la vigésima semana de gestación, cuando los párpados todavía están fusionados7.
Aunque los NMCG se distinguen fácilmente del resto por su tamaño, los NMC pequeños pueden ser muy similares a los NMA2,3,7. Además, en los NMC pequeños pueden no observarse todas las características histológicas típicas3,8. Clínicamente, los NMC son lesiones ovaladas, con límites bien definidos y superficie lisa, rugosa, papular, verrugosa o cerebriforme7. Con la edad aparece pelo oscuro y grueso, tienden a oscurecerse y pueden desarrollar nódulos en su superficie7.
Los NMC pueden estar asociados a varios síndromes, especialmente los NMCG. Se han descrito casos de síndrome de Carney, síndrome del nevus epidérmico, neurofibromatosis tipo I, síndrome de envejecimiento prematuro, rafe espinal oculto, escoliosis, atrofia, asimetría, elefantiasis e hipertrofia de huesos del cráneo7,10-12. La melanosis neurocutánea (MeNC) o melanocitosis leptomeníngea es un síndrome congénito infrecuente que se caracteriza por la asociación de: a) un NMC gigante (> 20cm en un adulto, > 9cm en el cuero cabelludo o > 6cm en el cuerpo de un niño) o más de tres NMC pequeños asociados con melanosis o melanoma meníngeo; b) ausencia de melanoma cutáneo (excepto en pacientes con lesiones meníngeas benignas demostradas histológicamente); y c) ausencia de melanoma meníngeo (excepto en pacientes con lesiones cutáneas benignas demostradas histológicamente)13.
PrevalenciaEstimar la prevalencia del NMC es difícil, porque las diferencias entre NMC pequeño y NMA no están bien definidas y existen múltiples patrones histológicos entre los NMC2. La prevalencia de NMC confirmados histológicamente varía entre 0,64 y 2,7 %2.
Se estima que la incidencia de los NMCG es de 1/20.000 recién nacidos vivos 14 y que su prevalencia es 0,005 %2. Su localización anatómica más frecuente es el tronco, seguida por las extremidades y la cabeza/cuello15,16. Con frecuencia se asocian con múltiples NMC pequeños satélites (7615-9117 %).
Riesgo de desarrollar melanomaAunque en teoría todos los NMC son susceptibles de malignización, la relación entre el riesgo de desarrollar melanoma y el tamaño del nevus continúa siendo un tema controvertido.
Nevus congénitos gigantesHistóricamente se ha sobreestimado el riesgo de desarrollar melanoma en NMCG, de tal forma que algunos autores18 llegaron a considerar que hasta un tercio de los melanomas que aparecían en la etapa prepuberal se originaban sobre NMCG. Para conocer el porcentaje real de melanomas que aparecen sobre NMC en la infancia hemos realizado una revisión de las principales series de melanomas en la infancia recogidas en la literatura, que incluyen un total de 653 melanomas (tabla 1). Sólo en el 11,8 % de los casos existía un NMC previo, y en muchos de ellos este dato se obtenía retrospectivamente de la historia clínica y no del estudio histopatológico. De estos, un 3,52 % se asociaba a NMCG y un 5,8 % a NMC medianos o pequeños (relación 5:3).
Series de melanoma en la infancia: casos asociados a nevus melanocíticos
| Autor | Año | Número de MM | Edad (años) | NMC(%) | NMCG (%) | NMC medianos y pequeños (%) | Seguimiento (meses) |
| Pratt et al120 | 1981 | 31 | ≤ 21;μ:14 (0,17-20,75) | 12 (38,7 %) | ND | ND | ND |
| Rao et al121 | 1990 | 33 | ≤ 20;μ:12 (0,3-20) | 3 (9,1) % | 3(9,1)% | 0 (0 %) | ND |
| Mehregan et al122 | 1993 | 6 | ≤ 14;μ: 9,1 (2-13) | 2 (33,3 %) | 2 (33,3 %) | 0 (0 %) | ND |
| Tate et al123 | 1993 | 48 | ≤ 20 | 5 (10,4 %) | 1 (2 %) | 4 (8,4 %) | μ: 48 (1-210) |
| Davidoff et al124 | 1994 | 85 | ≤ 18 | 2 (2,4 %) | 2 (2,4 %) | 0 (0 %) | ND |
| Spatz et al125 | 1996 | 60 | ≤ 16;μ: 10,4 (1-16) | 4 (6 %) | ND | ND | μ: 60; (0-324) |
| Naasan et al126 | 1996 | 50 | ≤ 18 | 4 (8 %) | 0 (0 %) | 4 (8 %) | ND |
| Scalzo et al37 | 1997 | 22 | ≤ 15 | ND | ND | 0 (0 %) | ND |
| Saenz et al127 | 1999 | 40 | ≤ 18;μ: 15 (3-17) | 15 (37,5 %) | 2 (5 %) | 13 (32,5 %) | μ: 216 (24-576) |
| Sander et al128 | 1999 | 126 | < 20 | 5 (4 %) | 0 (0 %) | 5 (4 %) | (51-271) |
| Gibbs et al129 | 2000 | 27 | ≤ 16 | 3 (11,1%) | 0 (0 %) | 3 (11,1 %) | μ: 62 (5-108) |
| Schmid-Wendtner et al130 | 2002 | 36 | ≤ 18;μ: 16 (2-17) | 8 (22,2 %) | 8 (22,2 %) | 0 (0 %) | μ: 79,2 |
| Mones et al131 | 2003 | 11 | ≤ 10;μ: 5,2 (1-10) | 0 (0 %) | 0 (0 %) | 0 (0 %) | μ: 19,9 (2-37) |
| De Sá et al132 | 2004 | 32 | ≤ 18;μ: 12,63 (0-18) | 5 (15,6 %) | 5 (15,6 %) | 0 (0 %)* | μ: 43,14 (1,71-198,32) |
| Jafarian et al133 | 2005 | 13 | ≤ 17;(< 10: 7, > 10: 6) | 2 (15,4 %) | 0 (0 %) | 2 (15,4 %) | μ: 26 (7-219) |
| Ferrari et al134 | 2005 | 33 | ≤ 14;μ: 11 (3-14) | 7 (21,2 %) | 0 (0 %) | 7 (21,2 %) | μ: 122 |
| Total | 653 | 77 (11,8 %) | 23 (3,52 %) | 38 (5,81 %) |
Esta sobreestimación del riesgo de malignización se debe probablemente a que existía un sesgo de infrarregistro de los NMCG que no desarrollaban melanoma19,20 y a que muchos NMCG que desarrollaban proliferaciones melanocíticas atípicas se diagnosticaban erróneamente como melanomas21,22.
Existen dos tipos de proliferaciones benignas que pueden aparecer sobre los NMC: los nódulos proliferativos (NP) y las lesiones hamartomatosas22. Los NP tienen un comportamiento biológico benigno23, sobre todo si aparecen en el periodo neonatal. Sin embargo, existe cierta controversia acerca de si los pacientes con NP tienen un mayor riesgo de desarrollar melanoma7.
Clínicamente se distinguen dos tipos de NP22:
- 1.
NP pequeños (< 1cm), que suelen estar presentes en el momento del nacimiento, pero pueden aparecer a lo largo de toda la vida, sobre todo durante la infancia. Suelen estar cubiertos por epidermis intacta y su color varía del rosa pálido al marrón oscuro 22. Histológicamente se corresponden con «NP benignos» o «expansivos»,hipercelulares, bien circunscritos, compuestos por células epiteloides grandes22. Los datos que permiten distinguirlos de un melanoma es que tienen un bajo índice mitótico y no existe atipia celular, infiltrado inflamatorio o necrosis 7,22,24. La transición entre estos nódulos y las células normales del NMC es gradual, a diferencia del melanoma, donde ocurre bruscamente22,25.
- 2.
NP grandes (> 1cm) que presentan un crecimiento muy rápido inicial, ocasionalmente se ulceran y están muy pigmentados22. Histológicamente se corresponden con «nódulos dérmicos tumorales» y «nódulos subcutáneos»22. Pueden estar compuestos por células monomorfas epitelioides, fusiformes, pequeñas22 o balonizadas26. En ocasiones presentan diferenciación neural, mesenquimal o elementos hamartomatosos, incluyendo adipocitos y cartílago 22. Pueden tener un índice mitótico elevado, pero a diferencia del melanoma las mitosis no son atípicas22,27. A veces plantean el diagnóstico diferencial con el nevus azul maligno o el schwannoma epitelioide maligno7. En cambio, los auténticos melanomas suelen estar constituidos por células pequeñas, de escaso citoplasma, que recuerdan a los tumores «blásticos»2 y presentan mitosis atípicas.
A pesar de su aspecto clínico alarmante inicial, con el tiempo estos nódulos involucionan espontáneamente, su tamaño y su actividad mitótica disminuyen de forma progresiva e incluso pueden llegar a desaparecer por completo25,28.
Otro cambio focal que pueden sufrir los NMC en la infancia es la ulceración, en ausencia de datos clínicos o histológicos de malignidad29.
La disparidad de criterios entre las distintas series de melanomas sobre NMCG ha hecho imposible la realización de metanálisis30 y hasta el momento sólo hay 4 revisiones sistemáticas disponibles 1,20,30,31. Hemos ampliado estas revisiones, incluyendo las principales series de NMCG recogidas en la literatura hasta la actualidad (tabla 2). El 46 % de los pacientes con NMCG tenían menos de 10 años en el momento del diagnóstico de melanoma y la edad media era de 14,4 años. El riesgo de desarrollar melanoma varía entre 0-10 % entre las distintas series (media 1,75 %) y la mortalidad fue del 35,2 % durante un periodo medio aproximado de seguimiento de 9,2 años.
Proporción de casos de melanoma sobre nevus congénitos gigantes y mortalidad asociada
| Autores | Año | N.° de NMCG | N.° de MM (% sobre NMCG) | Edad (años)* | Casos de muerte (% sobre NMCG) | Tiempo medio de seguimiento (años) |
| Greeley et al135 | 1965 | 56 | 6 (10,7 %) | 1 año, 1 año, 10 años, 10 años, 30 años, 38 años | 3 (5,36 %) | NA |
| Lorentzen et al136 | 1977 | 151 | 3 (1,98 %) | 28 años, 38 años, 40 años | 3 (1,99 %) | 23 |
| Arons et al137 | 1983 | 46 | 0 (0 %) | NA | NA | ND (1-17) |
| Zitelli106 | 1984 | 6 | 0 (0 %) | NA | NA | 1,25 |
| Quaba y Wallace33 | 1986 | 39 | 2 (5,13 %) | 2 años, 6 años | 2 (5,13 %) | 8,6 |
| Hori et al138 | 1989 | 154 | 7 (4,54 %) | ND | ¿? | ND |
| Ruiz-Maldonado et al10 | 1992 (P) | 80 | 3 (3,75 %) | 8 meses, 2,3 años, y 14 años | 3 (2,5 %) | 4,7** |
| Swedlow et al32 | 1995 | 33 | 2 (6,06 %) | 18 años, 20 años | 2 (6,06 %) | 23,7 |
| Dawson et al139 | 1996 | 133 | 0 (0 %) | NA | NA | 6,7 |
| Ingordo et al140 | 1997 | 157 | 0 (0 %) | NA | NA | NA |
| Egan et al15 | 1998 | 46 | 2 (4,35 %) | 2,7 años, 3,5 años | 1 (2,17 %) | 7,3 |
| Bohn et al98 | 2000 | 12 | 1 (8,3 %) | 5 años | 0 (0 %) | ND (1-16) |
| Foster et al62 | 2001 | 46 | 0 (0 %) | NA | NA | 5 |
| Berg y Lindelof42 | 2003 | 146 | 0 (0 %>)** | NA | 0 (0 %) | 10*** (0-21) |
| Ka et al21 | 2005 | 379 | 0 (0 %) | NA | NA | NA (2-6) |
| Hale et al34 (incluye Gari et al85, Marghoob et al16 DeDavid et al31 y Bittencourt et al17) | 2005 (P) | 205 | 3 (1,46 %)**** | 1 mes, 36 años, 52 años | 1 (0,49 %) | 5,3 |
| Bett60,86 | 2005, 2006 | 1.008 | 19 (1,88 %))***** | Nacimiento, nacimiento, 3 meses, 7 meses, 9 meses, 17 meses, 3 años, 4 años, 7 años, 8 años, 9 años, 24 años, 26 años, 34 años, 39 años, 39 años, 58 años, ND | 4 (0,40 %) | 5,6 |
| Chan29 | 2006 | 39 | 0 (0 %) | NA | NA | 16,9 (1-38) |
| Total | 2.736 | 48 (1,75 %) | 17 (35,2 %) |
Modificada de Krengel et al 1 y Watt et al 30. MM: melanoma; NA: no aplicable; ND: no disponible; NMCG: nevus melanocítico congénito gigante.
En 1989, un paciente fue diagnosticado de minimal-deviation melanoma, pero cuando se revisó el caso en 2003 se diagnosticó de nevus melanocítico congénito con una proliferación nodular benigna;
En la mayoría de los trabajos no se especifica el número total de NMC de la muestra, el tiempo de seguimiento o los casos de melanoma en NMC pequeños o medianos30,32. Tampoco se calcula el riesgo por edad, sexo o localización 32. Otra dificultad para interpretar los resultados de estas publicaciones es la ausencia de uniformidad y la arbitrariedad en la definición del tamaño de los NMCG, el sesgo de selección de los casos de alto riesgo en hospitales terciarios, la disminución del potencial de malignización tras la exéresis parcial o completa de la lesión, la falta de estudios comparativos prospectivos y la presencia de hallazgos histológicos atípicos durante el periodo neonatal15,19-21,30,32,33.
Algunos autores han propuesto que los NMCG de mayor tamaño34 o que se asocian a un mayor número de lesiones satélites34 tienen un mayor potencial de malignización. También se ha descrito que los NMCG que afectan sólo a una extremidad o a la cabeza tienen menos riesgo de desarrollar melanoma34.
Nevus congénitos medianosSahin et al35 realizaron un estudio retrospectivo en 230 NMC medianos, en el que detectaron tres melanomas (1,3 %). En una serie de 239 pacientes con NMC medianos32 no se detectó ningún melanoma durante 25 años de seguimiento. Basándose en estos resultados, algunos autores35 sólo aconsejan su exéresis quirúrgica en casos que sean difíciles de vigilar, debido a su localización (cuero cabelludo), que produzcan alteraciones estéticas importantes o en los que se detecten características clínicas atípicas. Otros36, por el contrario, opinan que son series de pequeño tamaño y escaso tiempo de seguimiento, por lo que es imposible establecer conclusiones.
Nevus congénitos pequeñosAlgunos autores opinan que el riesgo asociado a los NMC pequeños no es superior al relacionado con los NMA. En una revisión de 22 niños con melanoma diagnosticados en un periodo de 30 años 37, no se detectó ningún caso que asentase sobre un NMC previo menor de 5cm de diámetro. Sin embargo, en la literatura hay varios casos aislados de melanomas que aparecieron sobre NMC pequeños en la infancia8,38,39 y en la edad adulta40,41. En una revisión42 de 3.922 NMC (146 de ellos gigantes), sólo un paciente con un NMC de 3 × 3cm desarrolló un melanoma con metástasis y finalmente falleció.
El dilema sobre si la exéresis profiláctica de estas lesiones estaría justificada se planteó por primera vez en 1980 43,44. En 1984 45 se estableció por consenso que la transformación maligna era infrecuente y que sería suficiente realizar controles clínicos periódicos. En 1982 Rhodes et al46 realizaron un estudio histológico retrospectivo de 234 melanomas y encontraron hallazgos sugestivos de NMC asociado en el 8 % de los casos. En otro grupo de 134 pacientes con melanoma, los sujetos referían un NMC previo en el 56 % de los casos47. Esto supone un incremento de 3 a 21 veces el riesgo de desarrollar melanoma a lo largo de la vida, con un riesgo acumulado a los 60 años de entre 0,8 a 4,9 %, respectivamente47. Posteriormente, Betti et al48 examinaron las biopsias de 190 pacientes con melanoma y encontraron datos sugestivos de NMC en un porcentaje similar (7,8 %).
Illig et al49 estudiaron 52 casos de melanomas que aparecieron sobre NMC y encontraron que 48 (92,3 %) de ellos se habían desarrollado sobre NMC menores de 10cm. El 61 % eran melanomas de extensión superficial y la mayoría se localizaban excéntricamente con respecto al NMC. Al contrario que en los NMCG, ninguno de ellos había aparecido en la etapa prepuberal. En una serie de 667 biopsias de melanomas5 se detectó un NMC asociado en 57 (8,5 %) casos, y todos habían sido diagnosticados en la edad adulta. Teniendo en cuenta estos estudios, muchos autores consideran que el riesgo de malignización de los NMC pequeños es significativo a partir de la segunda década de la vida e incrementa progresivamente con la edad50.
Hay autores que consideran que estimar el riesgo de melanoma en los NMC pequeños es difícil. Como comentamos previamente, no existen hallazgos patológicos patognomónicos que permitan distinguir los NMC pequeños de los NMA en todos los casos 4,32. En una revisión de 124 melanomas, Harley et al51 encontraron que el 24 % estaban asociados con un nevus preexistente, de los cuales el 55 % era adquirido y el 28 % correspondía a un NMC pequeño. Sin embargo, en el 17 % de los casos no pudieron realizar esta distinción. Para obtener datos fiables y minimizar el sesgo de infradiagnóstico serían necesarios estudios prospectivos desde el nacimiento32.
Histogénesis del melanoma sobre nevus melanocítico congénitoInicialmente se consideraba que el melanoma podía originarse tanto sobre el componente epidérmico como sobre el componente dérmico de los NMC 34,52,53. Posteriormente se propuso que, puesto que la mayoría de los melanomas que aparecen sobre NMCG se ubican en la dermis, debían tener lugar a partir de las células localizadas a ese nivel7,54.
En este tema ha influido de forma decisiva la consideración de lesiones nodulares proliferativas en el seno de los NMCG como signo de malignización, debido a su apariencia histológica, si bien con posterioridad se ha confirmado su comportamiento biológico benigno25,28.
En la actualidad, muchos autores defienden que sólo el componente juntural tiene potencial de malignización55 y que sobre el componente dérmico de los NMCG no se desarrollan melanomas, u ocurre de forma excepcional56.
Los melanomas que asientan sobre NMC pequeños se originan en la epidermis y recuerdan a un melanoma de extensión superficial o nodular, contiguo a una proliferación melanocítica banal de patrón congénito7,49.
Existen casos descritos de otros tipos de tumores malignos que pueden asentar sobre NMCG, incluyendo el tumor de célula pequeña redondeada pobremente diferenciada, nevus azul celular maligno, diferenciación mesenquimal (rabdomiosarcoma, liposarcoma) y tumor maligno de células fusiformes con diferenciación a células lamelares («pseudomessneriana»)15,57.
Riesgo de desarrollar melanosis neurocutáneaLa MeNC es una complicación infrecuente, con aproximadamente 100 casos recogidos en la literatura hasta el año 200016. En el 91 % de los casos el nevus se localiza en el eje axial posterior58 y en el 78 % presenta fenómeno de satelitosis58. Al igual que para el melanoma, algunos autores sugieren que los NMCG con un mayor número de lesiones satélites tienen más riesgo de desarrollar MeNC34,59. En una serie de 1.008 pacientes con NMCG o MeNC60 se observó que el 7,5 % de los que padecían un NMCG en el tronco presentaban MeNC sintomática, frente a tan sólo el 0,8 % de los que se localizaban en la cabeza o en una extremidad. En el 87 % se observó satelitosis.
Se ha descrito que la prevalencia de MeNC sintomática en pacientes con NMCG es de 11,4 %2. En los pacientes asintomáticos debe utilizarse la resonancia magnética nuclear (RMN)17,58, que detecta afectación del sistema nervioso central (SNC) desde un 4,5 61 al 30 % 60,62,63 de los casos, según la serie consultada. En el 20 % de los casos aparecen alteraciones en el electroencefalograma10.
En el 66 % de los pacientes con MeNC las manifestaciones neurológicas aparecen antes de los 5 años de edad (edad media de presentación: 2 años)58. La mayoría se debe a un incremento de la presión intracraneal, producida por la proliferación de melanocitos leptomeníngeos que bloquean la circulación del líquido cefalorraquídeo (LCR) y su reabsorción en las vellosidades aracnoideas13,16,34. Las más frecuentes son hidrocefalia (3 %) 60, convulsiones (2,7 %)61, papiledema, cefalea, macrocefalia, paresia y retraso mental58,61.
Además, en la MeNC pueden existir síntomas secundarios a otras enfermedades neurológicas asociadas, como tumores intracraneales, hemorragia intracerebral y subaracnoidea y malformaciones de la columna vertebral, como defectos de fusión, lipomas intraespinales, quistes aracnoideos y siringohidromielia12,63. Existen al menos 13 casos descritos en la literatura de asociación con la malformación de Dandy-Walker 12,64-75.
Se estima que la MeNC se asocia a una mortalidad del 92 %13, secundaria al desarrollo de melanoma o al compromiso neurológico producido por el crecimiento progresivo de los melanocitos en el SNC63. En la mitad de los casos la muerte se produce antes de los 5 años (edad media: 3 años)58. En el estudio 60 previamente citado de 1.008 pacientes con NMCG o MeNC, la mortalidad fue del 45 % en aquellos con MeNC sin NMCG asociado, del 2,3 % en los que tenían un NMCG en el tronco y del 0 % para los que el NMCG asentaba en la cabeza o en una extremidad.
En pacientes con MeNC pueden aparecer melanomas sobre el NMCG en un 2,5 % 60 y en el SNC entre el 5017-64 %58, con una mortalidad asociada del 9058-100 %16. En la revisión realizada por DeDavid et al31, el 8,4 % de los pacientes desarrollaron melanomas en el SNC. Todos los casos estaban diagnosticados de MeNC, tenían un NMCG en el eje axial posterior y el 50 % no superaba los 3 años de edad. El 90 % de los pacientes fallecieron y cerca del 50 % lo hicieron antes de los 5 años de edad.
TratamientoEl tratamiento de los NMC continúa siendo un tema controvertido. Hasta el momento no existe un consenso acerca de la edad óptima para su exéresis, indicaciones y modalidad terapéutica.
Existen tres tipos de indicaciones planteadas en la literatura76:
- 1.
Indicación curativa, en el caso en que se sospeche malignización del NMC.
- 2.
Indicación profiláctica, según el riesgo estimado de desarrollar melanoma.
- 3.
Indicación estética para prevenir las consecuencias de la estigmatización psicosocial que puede conllevar este tipo de lesiones.
El motivo principal para extirpar profilácticamente los NMC es evitar el riesgo de malignización. Por lo tanto, el objetivo del tratamiento es maximizar la ablación de las células con potencial maligno con las mínimas secuelas posibles77-79.
El tratamiento de los NMC con fines estéticos también es motivo de debate. Algunos autores defienden la exéresis de los NMCG debido a que se trata de lesiones desfigurantes e inestéticas, que pueden desencadenar secuelas psicológicas, y consideran que las cicatrices derivadas del tratamiento son mejor toleradas por los niños que el propio NMC77.
CirugíaLa exéresis quirúrgica de los NMC es el método más seguro para eliminar las células con potencial de malignización30,80. La incidencia de melanoma sobre NMC sigue un pico bimodal, por lo que el momento idóneo para realizar la exéresis quirúrgica depende del tamaño de la lesión50.
Casi la mitad de los melanomas descritos sobre NMCG aparecen antes de los 5 años, por lo que el tratamiento profiláctico debería realizarse lo antes posible55,30,81. Además, la abstención terapéutica y la vigilancia estrecha es una opción complicada, porque suelen tener una superficie verrugosa y polilobulada, que dificulta la detección precoz del melanoma7,82.
Sin embargo, la implementación de esta recomendación no es sencilla por los siguientes factores:
- 1.
La exéresis completa de los NMCG generalmente requiere múltiples intervenciones quirúrgicas complejas 19,83 y suele producir un déficit estético o funcional30,84.
- 2.
En ocasiones, el número de lesiones satélites es tan elevado que dificulta obtener piel donante para cubrir con un injerto el defecto quirúrgico 19, y el riesgo de melanoma asociado a dichas lesiones es desconocido 85.
- 3.
Es necesario considerar el impacto psicosocial de múltiples hospitalizaciones y actos operatorios en el niño y su familia19,83.
- 4.
Algunos autores 52,53,86 consideran que el tratamiento quirúrgico no elimina completamente el riesgo de desarrollar melanoma en los casos en los que existe MeNC o células que infiltren profundamente hasta la fascia o el músculo.
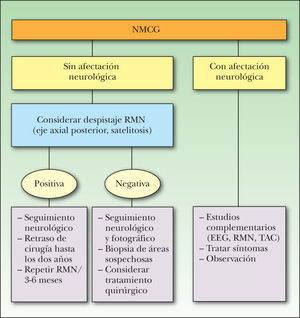
Si existe alguno de estos factores, el paciente es inoperable o la decisión familiar es mantener una actitud expectante, se recomienda el seguimiento estrecho del paciente, con controles fotográficos cada 3-6 meses hasta los 5 años y posteriormente cada 6-12 meses 19,83 (fig. 1)
Algoritmo de manejo de los nevus melanocíticos congénitos gigantes (NMCG). Tomada de Marghoob et al 141. EEG: electroencefalograma; RMN: resonancia magnética nuclear; TAC: tomografía axial computarizada.
Para disminuir las dificultades técnicas y la morbilidad asociada se han realizado avances técnicos en la reparación del defecto quirúrgico durante las últimas décadas, utilizando expansores tisulares 87, cultivos epiteliales para obtener autoinjertos 88 o aloinjertos 89 y sustitutos dérmicos, epidérmicos o de ambas capas 90. Los expansores tisulares están especialmente indicados en el cuero cabelludo, puesto que cualquier otra técnica produce áreas de alopecia cicatricial 91,92. Aporta la ventaja de que permite la reconstrucción con tejido adyacente al defecto y tiene los siguientes inconvenientes: mayor complejidad técnica, necesidad de varios tiempos quirúrgicos y periodo prolongado hasta la eliminación completa de la lesión (1-6 meses), riesgo de complicaciones (infección, isquemia, seromas, hematomas), incomodidad, dolor o intolerancia psicológica 93.
Gosain et al publicaron algoritmos de manejo quirúrgico del NMCG90,94. En situaciones donde la exéresis total de la lesión implicaría una mutilación o una pérdida de función del área afecta, aconsejan la exéresis parcial 94. En los casos donde el NMC pueda ser extirpado en dos o tres intervenciones, sin afectar las estructuras anatómicas contiguas, recomiendan el tratamiento con escisiones seriadas o en varios tiempos, separadas al menos por un intervalo de 6 meses 90. En aquellos en los que la exéresis implique más de tres estadios, recomiendan la expansión tisular durante periodos de 3-6 meses 90. Estos autores defienden la elección de la técnica quirúrgica en función del área anatómica 90,94: en la cabeza recomiendan utilizar colgajos de transposición expandidos desde el área temporal/occipital hacia la línea de implantación del cuero cabelludo, en la cara injertos de piel total expandidos tomados de la fosa supraclavicular, en la parte anterior del tronco abdominoplastia y en la posterior colgajos de transposición o avance expandidos. En las extremidades proximales refieren mejores resultados con colgajos de transposición o pediculados y en las distales con injertos de piel total expandidos94.
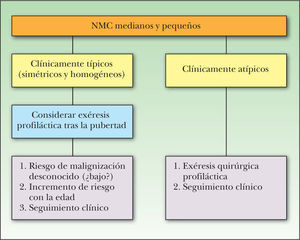
En cuanto a los NMC pequeños hace dos décadas el 50 % de los dermatólogos recomendaba su exéresis precoz y sólo el 27 % su seguimiento 95. Actualmente se considera que el riesgo de malignización durante el periodo prepuberal es muy pequeño, por lo que a menos que se detecten cambios morfológicos en etapas precoces de la vida, o el nevus asiente en localizaciones difícilmente accesibles, se recomienda vigilancia periódica durante la infancia y exéresis profiláctica en la pubertad 8,50,54,55,82,94 (fig. 2). La dermatoscopia puede ser útil en el seguimiento de los NMC 93, pero al contrario que en los NMA, la presencia de bordes policíclicos abruptos no debe ser interpretada como un dato de malignidad 96.
Algoritmo de manejo de los nevus melanocíticos congénitos (NMC) pequeños y medianos. Tomada de Marghoob et al 141.
Siguiendo estas indicaciones, en un estudio retrospectivo 97 realizado en 2002, que incluyó 192 pacientes con NMC, se demostró que el 40 % de los casos habían sido tratados mediante exéresis quirúrgica, y esta fue más precoz cuanto más grande era el tamaño de la lesión. En ningún caso se observó transformación maligna, lo cual puede implicar que las lesiones se extirparon fundamentalmente por motivos estéticos, o puede ser una evidencia indirecta de que el tratamiento quirúrgico realizado a una edad óptima puede disminuir el riesgo de desarrollo de melanoma.
El tema más controvertido es el manejo de los NMC medianos, puesto que no existe suficiente evidencia en la literatura como para adoptar una actitud terapéutica concreta. Algunos autores 7 recomiendan también su extirpación durante la pubertad, para disminuir el riesgo de malignización con el mínimo riesgo anestésico (fig. 2).
Curetaje, dermoabrasión y láserLos tratamientos que sólo eliminan el componente superficial de los NMCG (curetaje,peeling químico, dermoabrasión y láser) consiguen buenos resultados estéticos, aunque en algunos casos puede observarse una repigmentación focal de la lesión clínica e histológicamente atípica 98-100. Existe una controversia notable acerca de la seguridad de estas técnicas y su influencia en el desarrollo de melanoma.
En los estudios en los que se realiza una biopsia cutánea tras estos tratamientos habitualmente se observa persistencia de células névicas 79,91,99-105. Algunos autores consideran que la eliminación de la porción superficial de la lesión no evita el riesgo de malignización 34,106 y que incluso podría aumentarlo, al destruir la capa que actúa de protección frente a la luz UV 104.
Por otro lado, un estudio reciente 55 demostró que las células de la unión dermoepidérmica son las que tienen un mayor índice de proliferación y vascularización, por lo que el curetaje no sólo disminuye el riesgo de malignización al reducir el número de melanocitos de la lesión, sino que además elimina las células biológicamente más «activas». Aunque sólo se han detectado 4 casos de melanoma tras dermoabrasión 42,86,98,107, el corto periodo de seguimiento de la mayoría de los pacientes hace imposible establecer conclusiones en cuanto a la seguridad de estas modalidades terapéuticas.
Para eliminar la mayor parte de los melanocitos se recomienda realizar el curetaje en las dos primeras semanas de vida, puesto que en ese periodo existe un plano de clivaje entre la dermis superficial (donde se localizan la mayor parte de los nevocitos) y la dermis profunda 55,77,91,99,101. Sin embargo, hay que tener en cuenta los riesgos de la anestesia general en el periodo neonatal 99.
La dermoabrasión consigue resultados similares al curetaje durante los primeros 12 meses de vida. Sin embargo, es una técnica más agresiva, causa mayor hemorragia y sólo permite eliminar una porción más superficial del NMC. Esto es debido a que si se sobrepasa la unión dermoepidérmica puede aparecer cicatrización hipertrófica en el 15 % de los casos, sobre todo en los NMC dorsales 76.
También se ha intentado la exéresis de la epidermis y la dermis superficial mediante afeitado, utilizando la misma técnica que para obtener injertos laminares 108. Sin embargo, se han observado cicatrices hipopigmentadas o con pigmentación moteada al realizar esta intervención antes de las 9 semanas de vida 92.
Hay autores que han empleado peeling químico con fenol 109, obteniendo resultados estéticos muy variables. Tiene los inconvenientes de no permitir el estudio histopatológico y el riesgo de toxicidad cardiaca, hepática y renal93.
Se han empleado varios tipos de láser en el tratamiento de NMCG que no eran subsidiarios de exéresis quirúrgica. Los más utilizados fueron el láser de rubí en modo normal (LRMN) 110 y el láser CO278,111, pero son técnicas dolorosas y con resultados cosméticos impredecibles 77,110,111. Actualmente suele emplearse el láser CO2 ultrapulsado 112,113 para eliminar las capas de tejido con más concentración de pigmento, permitiendo posteriormente la actuación de láseres más selectivos 77,100,114,115. En un estudio realizado en 5 NMC se observó que el láser Q-switched rubí eliminaba más eficazmente las células névicas superficiales que el láser Q-switched Nd:YAG 102. También hay autores que combinan el láser Q-switched rubí con el LRMN, observando la eliminación de un mayor número de melanocitos que al utilizar el LRMN de forma aislada 103-105. El láser de erbio:YAG se empleó con éxito para el tratamiento de NMCG 79 y NMC faciales inoperables 116. El láser CO2 también puede utilizarse como complemento al curetaje, para tratar lesiones satélites en las que el plano de disección no está bien definido 80.
Recientemente se ha demostrado que la utilización de autoinjertos obtenidos por cultivo epidérmico tras el tratamiento con láser erbio:YAG o curetaje induce una rápida reepitelización y disminuye el riesgo de cicatrización hipertrófica, la formación de tejido de granulación y la estancia hospitalaria84.
Tratamiento de la melanosis neurocutáneaComo hemos visto antes, en pacientes con NMCG localizados en el eje axial posterior se recomienda realizar RMN en los primeros 6 meses de vida (antes de que el depósito normal de mielina oculte los depósitos de melanina) 117 y controles neurológicos periódicos 83 (fig. 1). La edad óptima para la exéresis quirúrgica de los NMC en niños con MeNC también sigue siendo un tema controvertido: aunque la intervención debería posponerse hasta los 2 años en niños asintomáticos con hallazgos de melanocitosis leptomeníngea en la RMN, es necesario tener en cuenta que la mayoría de los melanomas que se desarrollan sobre NMCG también aparecen a esta edad 58.
El tratamiento de la MeNC sintomática es paliativo, fundamentalmente con agentes anticonvulsivantes. En los casos que cursan con hidrocefalia obstructiva se colocan drenajes de derivación de LCR ventrículo-peritoneales 61. Algunos autores han intentado sin éxito el tratamiento combinado con radioterapia y quimioterapia 118,119.
ConclusionesLas conclusiones de esta revisión bibliográfica se resumen en la tabla 3.
- 1.
El riesgo medio de desarrollar melanoma sobre NMCG es aproximadamente del 2 %.
- 2.
En un 7-8 % de biopsias de melanoma se han encontrado NMC pequeños asociados.
- 3.
El NMC tiene un pico bimodal de incidencia de melanoma: el primero ocurre antes de los 5 años de edad y corresponde a los que aparecen sobre NMCG; el segundo va desde la pubertad a la edad adulta y está en relación con los que aparecen sobre NMC pequeños.
- 4.
Sólo el 11,8 % de los casos de melanoma en la infancia se asocian a un NMC previo; de estos, el 3,52 % se asociaban a NMCG y el 5,8 % a NMC medianos o pequeños (relación 5:3).
- 5.
El tratamiento quirúrgico de los NMCG es un tema controvertido, y debe ser individualizado en función de la sospecha clínica de melanoma y de las consecuencias estéticas y funcionales.
- 6.
Actualmente se considera que el riesgo de malignización de los NMC pequeños durante el periodo prepuberal es bajo, por lo que se recomienda vigilancia periódica durante la infancia y exéresis profiláctica en la pubertad.
- 7.
Los tratamientos que sólo eliminan el componente superficial de los NMCG (curetaje, dermoabrasión y láser) consiguen buenos resultados estéticos, aunque existe controversia acerca su influencia en el desarrollo de melanoma.
- 8.
En pacientes con NMCG localizados en el eje axial posterior se recomienda realizar RMN en los primeros 6 meses de vida y controles neurológicos periódicos para descartar MeNC.
Preguntas frecuentes sobre los nevus melanocíticos
| NMC pequeño y mediano | NMCG | |
| ¿Cuál es el riesgo de desarrollar melanoma? | Desconocido, pero se han encontrado datos de NMC en el 7-8 % de biopsias de melanoma | 2 % |
| ¿Dónde se inicia el melanoma? | En la unión dermoepidérmica | En la unión dermoepidérmica. ¿Excepcionalmente en la dermis? |
| ¿A qué edad aparece el melanoma? | Durante/tras la pubertad | Antes de la pubertad |
| ¿Quiénes tienen más riesgo de MeNC? | ≥ 3 NMC | Localización axial |
| ¿Cuáles son las opciones terapéuticas? | Seguimiento | Seguimiento |
| Autoexamen | Autoexamen | |
| Exéresis profiláctica (postpuberal) | Exéresis profiláctica (precoz) | |
| ¿Cuáles son las técnicas disponibles? | Cirugía (simple o en varios tiempos, con injertos o expansores tisulares) | Cirugía (simple o en varios tiempos, con injertos o expansores tisulares) ¿curetaje en periodo neonatal? |
| ¿Cómo se puede diagnosticar precozmente el melanoma? | Examen clínico | Examen clínico |
| Dermatoscopia | Palpación | |
| Seguimiento fotográfico | Seguimiento fotográfico |
Modificada de Marghoob et al 117,141. MeNC: melanosis neurocutánea; NMC: nevus melanocítico congénito; NMCG: nevus melanocítico congénito gigante.
A los doctores Félix Contreras Rubio, Jesús Cuevas Santos y Víctor G. Prieto, por sus correcciones y comentarios a este trabajo.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.