En las últimas décadas está aumentando la incidencia de melanoma maligno (MM) y el diagnóstico precoz sigue siendo esencial para conseguir su curación. Nuestro objetivo fue analizar los MM cutáneos diagnosticados durante 15 años en un hospital terciario para comprobar si existe una tendencia favorable hacia un diagnóstico cada vez más precoz e intentar identificar grupos de población con MM de peor pronóstico.
Material y métodosAnálisis retrospectivo de los melanomas cutáneos primarios analizados en el Departamento de Anatomía Patológica del Hospital La Paz entre 1990 y 2004.
ResultadosSe diagnosticaron en total 526 melanomas. El espesor medio de Breslow fue de 2,63 mm (desviación estándar [DE] 4,84) y la mediana de 0,98 mm (0-65 mm); el tamaño medio (diámetro mayor) fue de 16,59 mm (DE 12,11); el tipo histológico más frecuente fue el melanoma de extensión superficial y la localización más habitual el tronco. Los melanomas detectados en varones tendieron a ser más grandes y de mayor espesor (p=0,05) que los de las mujeres. Los mayores de 60 años consultaron con tumores significativamente más gruesos y de mayor diámetro que los pacientes más jóvenes. A lo largo de estos años, ha aumentado progresivamente el número de MM, pero han disminuido el Breslow medio y el tamaño.
ConclusionesEl diagnóstico del melanoma en nuestro medio es cada vez más precoz, pero los varones y los mayores de 60 años en ocasiones aún consultan con tumores localmente avanzados.
The incidence of malignant melanoma has increased over recent decades. Early diagnosis continues to be essential for effective treatment. Our objective was to analyze cutaneous malignant melanomas diagnosed over a 15-year period in a tertiary hospital for trends towards earlier diagnosis and to identify subgroups with poorer prognosis.
Material and methodsRetrospective analysis of primary cutaneous melanomas analyzed in the pathology department of Hospital La Paz, Madrid, Spain, between 1990 and 2004.
ResultsIn total, 526 melanomas were diagnosed. The mean (SD) Breslow thickness was 2.63 (4.84) mm and the median thickness was 0.98 mm (range, 0-65 mm). The mean size (widest point) was 16.59 (12.11) mm. The most common histological type was surface-spreading melanoma and the most common site was the trunk. Melanomas detected in men were generally larger and thicker than in women (P=0.05). Individuals aged over 60 years consulted for significantly thicker and larger tumors than younger individuals. The incidence of malignant melanomas has increased steadily over the years whereas the mean Breslow thickness and size have decreased.
ConclusionsDiagnosis of melanoma in Spain is made increasingly earlier, although locally advanced tumors are still sometimes seen in men and in individuals aged over 60 years.
La incidencia y mortalidad del melanoma maligno cutáneo (MM) han aumentado en las últimas décadas en todo el mundo, convirtiéndose en uno de los tumores que con más frecuencia es responsable de la muerte por cáncer en pacientes jóvenes 1–3. Aunque el MM solo supone del 1,5 al 7 % del total de tumores malignos de piel, causa el 65 % de las muertes por este motivo, cifra que alcanza el 80–90 % en los individuos de menos de 65 años 4. El aumento de la mortalidad por MM ha sido menor que el aumento en la incidencia debido a su diagnóstico cada vez más precoz, por lo que la supervivencia a los 5 años está mejorando progresivamente 2,5–7.
El espesor del melanoma primario en el momento de su extirpación se correlaciona directamente con la supervivencia 8. Cuando se diagnostican metástasis viscerales el pronóstico es ciertamente infausto y apenas ha variado en los últimos años, pues no se han logrado avances relevantes en el tratamiento del melanoma diseminado. Esta altísima letalidad y resistencia a los tratamientos del MM en estadios avanzados convierten a la prevención primaria y al diagnóstico precoz en las principales herramientas en la lucha contra esta neoplasia 9,10.
El objetivo del presente trabajo ha sido conocer las características clínicas y patológicas básicas de los melanomas cutáneos primarios extirpados en el Hospital Universitario La Paz o en cualquiera de los centros de su área de influencia (área sanitaria V de la Comunidad Autónoma de Madrid) entre 1990 y 2004. La evolución de estas características a lo largo del tiempo permitirá saber si existe una tendencia hacia el diagnóstico cada vez más precoz de MM en dicha área y si la comparación de los MM por sexos y grupos de edad podría identificar grupos de población con MM de peor pronóstico.
Material y métodosSe incluyeron todos los melanomas primarios cutáneos extirpados en cualquiera de los centros del área sanitaria V de la Comunidad Autónoma de Madrid, y remitidos para su estudio histopatológico al Departamento de Anatomía Patológica del Hospital Universitario La Paz entre el 1 de enero de 1990 y el 31 de diciembre de 2004. No se incluyeron pacientes cuyo tumor hubiese sido extirpado y estudiado histológicamente en otro centro, aunque su seguimiento posterior se hubiera llevado a cabo en el Hospital La Paz. Se excluyeron de este estudio los MM primarios situados a nivel ocular (excepto los ubicados en la piel del párpado), los MM de semimucosas o mucosas y los MM de partes blandas. Sí se incluyeron los MM del aparato ungueal.
Los MM incluidos en este trabajo se identificaron a partir de la base de datos informatizada del Departamento de Anatomía Patológica. Los datos clínicos y patológicos de los mismos se obtuvieron de la información contenida en la historia clínica de cada paciente, así como en el volante de solicitud del estudio histopatológico y de su informe definitivo. No se han revisado histológicamente los MM para este trabajo. La revisión de historias clínicas y la recogida de datos se llevó a cabo por la misma persona en todos los casos (DAS).
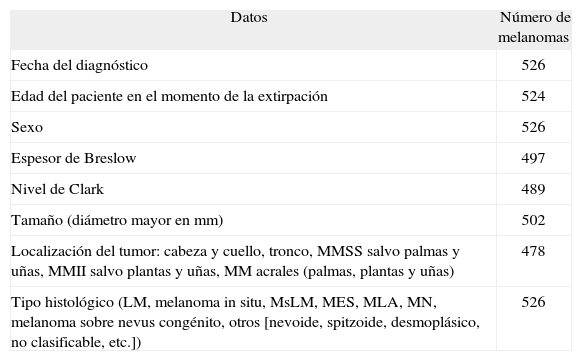
Los datos clínicos recogidos sobre cada MM para el presente trabajo fueron el sexo, la edad del paciente, la fecha en el momento del diagnóstico, la localización anatómica en la que asentaba el tumor y el tamaño de la lesión en milímetros medidos en su longitud mayor. No todos los datos pudieron conseguirse en todos los MM; en la tabla 1 puede verse el número de casos en los que cada variable estaba disponible. El tamaño de los MM se incluyó por ser un indicador indirecto de la precocidad diagnóstica y, sobre todo, de la mayor o menor dificultad para la sospecha en cada caso.
Datos clínicos y patológicos recogidos en cada melanoma maligno y número de casos en los que cada variable estaba disponible
| Datos | Número de melanomas |
| Fecha del diagnóstico | 526 |
| Edad del paciente en el momento de la extirpación | 524 |
| Sexo | 526 |
| Espesor de Breslow | 497 |
| Nivel de Clark | 489 |
| Tamaño (diámetro mayor en mm) | 502 |
| Localización del tumor: cabeza y cuello, tronco, MMSS salvo palmas y uñas, MMII salvo plantas y uñas, MM acrales (palmas, plantas y uñas) | 478 |
| Tipo histológico (LM, melanoma in situ, MsLM, MES, MLA, MN, melanoma sobre nevus congénito, otros [nevoide, spitzoide, desmoplásico, no clasificable, etc.]) | 526 |
LM: lentigo maligno; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; MM: melanomas; MMII: miembros inferiores; MMSS: miembros superiores; MN: melanoma nodular; MsLM: melanoma sobre lentigo maligno.
Los datos histológicos analizados fueron el espesor de Breslow, el nivel de invasión de Clark y el tipo histológico de MM. El espesor de Breslow es el principal factor pronóstico en MM y está relacionado con la precocidad del diagnóstico; en 29 casos no se pudo conseguir este dato, por extirpaciones incorrectas o por realizarse tan solo una biopsia incisional diagnóstica en pacientes con melanomas metastásicos o tumores inoperables. No se ha considerado la presencia de ulceración histológica porque este aspecto no se incluyó en la clasificación AJCC (The American Joint Committee on Cancer) hasta el año 2001 8, y en muchos de los informes histopatológicos de los melanomas de este trabajo dicho dato no figuraba, al ser emitidos en años previos a esa fecha.
Del conjunto de MM in situ (nivel I de Clark), se han individualizado y considerado como grupo aparte las lesiones diagnosticadas como lentigo maligno (LM) debido a las peculiaridades clínicas y epidemiológicas de este subtipo.
Los datos recogidos se han analizado de forma global y también comparándolos por sexos y grupos de edad. Además, se han estudiado las diferencias en los sucesivos quinquenios (periodo 1: 1990–1994; periodo 2: 1995–1999; periodo 3: 2000–2004).
Análisis estadísticoSe ha llevado a cabo con el programa SAS (versión 9.1) y se ha considerado como nivel de significación estadística p < 0,05.
Para comprobar la existencia de relación entre variables cualitativas se ha usado la prueba de la Chi cuadrado; en los análisis en los que esta prueba resultó significativa, se aplicó posteriormente un análisis de correspondencias simples para determinar qué modalidades de las variables estaban relacionadas entre sí. Para determinar si existían diferencias con respecto a las variables cuantitativas se ha utilizado el análisis de la varianza (ANOVA), así como las pruebas estadísticas no paramétricas de la mediana, de Mann–Whitney, de Wilcoxon y de Kruskal-Wallis; para saber entre qué grupos existían diferencias se han realizado las pruebas múltiples de Duncan.
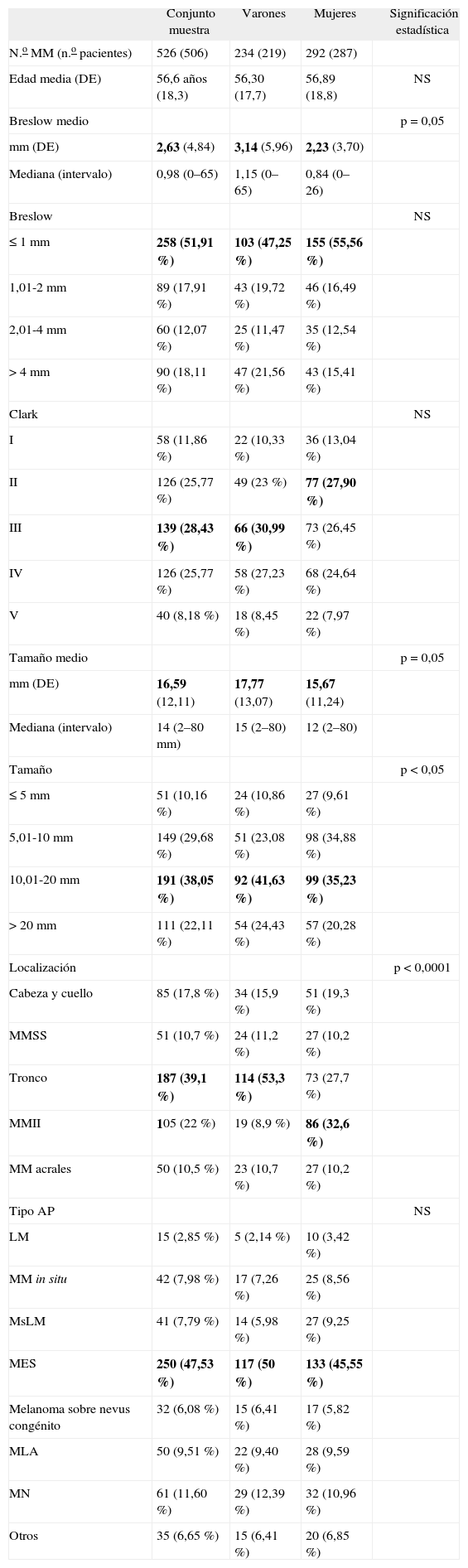
ResultadosCaracterísticas globales de los melanomas y comparación por sexosEl conjunto de la muestra incluye 526 melanomas en 506 pacientes. En la tabla 2 se presentan los datos clínicos y patológicos completos. Los datos más relevantes son expuestos a continuación.
Características globales de la muestra en conjunto y comparación por sexos
| Conjunto muestra | Varones | Mujeres | Significación estadística | |
| N.o MM (n.o pacientes) | 526 (506) | 234 (219) | 292 (287) | |
| Edad media (DE) | 56,6 años (18,3) | 56,30 (17,7) | 56,89 (18,8) | NS |
| Breslow medio | p = 0,05 | |||
| mm (DE) | 2,63 (4,84) | 3,14 (5,96) | 2,23 (3,70) | |
| Mediana (intervalo) | 0,98 (0–65) | 1,15 (0–65) | 0,84 (0–26) | |
| Breslow | NS | |||
| ≤ 1 mm | 258 (51,91 %) | 103 (47,25 %) | 155 (55,56 %) | |
| 1,01-2 mm | 89 (17,91 %) | 43 (19,72 %) | 46 (16,49 %) | |
| 2,01-4 mm | 60 (12,07 %) | 25 (11,47 %) | 35 (12,54 %) | |
| > 4 mm | 90 (18,11 %) | 47 (21,56 %) | 43 (15,41 %) | |
| Clark | NS | |||
| I | 58 (11,86 %) | 22 (10,33 %) | 36 (13,04 %) | |
| II | 126 (25,77 %) | 49 (23 %) | 77 (27,90 %) | |
| III | 139 (28,43 %) | 66 (30,99 %) | 73 (26,45 %) | |
| IV | 126 (25,77 %) | 58 (27,23 %) | 68 (24,64 %) | |
| V | 40 (8,18 %) | 18 (8,45 %) | 22 (7,97 %) | |
| Tamaño medio | p = 0,05 | |||
| mm (DE) | 16,59 (12,11) | 17,77 (13,07) | 15,67 (11,24) | |
| Mediana (intervalo) | 14 (2–80 mm) | 15 (2–80) | 12 (2–80) | |
| Tamaño | p < 0,05 | |||
| ≤ 5 mm | 51 (10,16 %) | 24 (10,86 %) | 27 (9,61 %) | |
| 5,01-10 mm | 149 (29,68 %) | 51 (23,08 %) | 98 (34,88 %) | |
| 10,01-20 mm | 191 (38,05 %) | 92 (41,63 %) | 99 (35,23 %) | |
| > 20 mm | 111 (22,11 %) | 54 (24,43 %) | 57 (20,28 %) | |
| Localización | p < 0,0001 | |||
| Cabeza y cuello | 85 (17,8 %) | 34 (15,9 %) | 51 (19,3 %) | |
| MMSS | 51 (10,7 %) | 24 (11,2 %) | 27 (10,2 %) | |
| Tronco | 187 (39,1 %) | 114 (53,3 %) | 73 (27,7 %) | |
| MMII | 105 (22 %) | 19 (8,9 %) | 86 (32,6 %) | |
| MM acrales | 50 (10,5 %) | 23 (10,7 %) | 27 (10,2 %) | |
| Tipo AP | NS | |||
| LM | 15 (2,85 %) | 5 (2,14 %) | 10 (3,42 %) | |
| MM in situ | 42 (7,98 %) | 17 (7,26 %) | 25 (8,56 %) | |
| MsLM | 41 (7,79 %) | 14 (5,98 %) | 27 (9,25 %) | |
| MES | 250 (47,53 %) | 117 (50 %) | 133 (45,55 %) | |
| Melanoma sobre nevus congénito | 32 (6,08 %) | 15 (6,41 %) | 17 (5,82 %) | |
| MLA | 50 (9,51 %) | 22 (9,40 %) | 28 (9,59 %) | |
| MN | 61 (11,60 %) | 29 (12,39 %) | 32 (10,96 %) | |
| Otros | 35 (6,65 %) | 15 (6,41 %) | 20 (6,85 %) |
DE: desviación estándar; LM: lentigo maligno; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; MM: melanomas; MMII: miembros inferiores; MMSS: miembros superiores; MN: melanoma nodular; MsLM: melanoma sobre lentigo maligno; NS: no significativo. En negrita aparecen los valores más frecuentes en cada análisis.
De los 526 MM, el 44,5 % fue en varones y el 55,5 % en mujeres, con una edad media de 56,6 años (desviación estándar [DE] 18,3) y sin diferencias entre ambos sexos. La mediana de la edad fue 56,8 años; el paciente más joven tenía 14,6 años y el de más edad 96,5.
El espesor medio de Breslow en conjunto fue de 2,63 mm (DE 4,84) y la mediana de 0,98 (intervalo 0–65 mm). El tamaño medio global fue de 16,59 mm (DE 12,11) y la mediana de 14 mm (2–80 mm). Los MM diagnosticados en varones tendieron a ser más profundos (Breslow medio 3,14 mm) y de mayor tamaño (media 17,77 mm) que los de las mujeres (2,23 mm y 15,67 mm, respectivamente), aunque estas diferencias no alcanzaron la significación estadística (p = 0,05).
Las localizaciones por orden decreciente en frecuencia global fueron el tronco, los miembros inferiores (MMII) y la cabeza y el cuello. Se encontraron diferencias significativas por sexos, de forma que en los varones hubo un claro predominio en el tronco, mientras que las mujeres tuvieron mayor frecuencia de MM en los MMII, seguidos del tronco y la cabeza (Chi cuadrado, análisis de correspondencias simples). El tipo histológico más frecuente en estos 15 años fue el melanoma de extensión superficial (MES), sin que hubiera diferencias entre sexos.
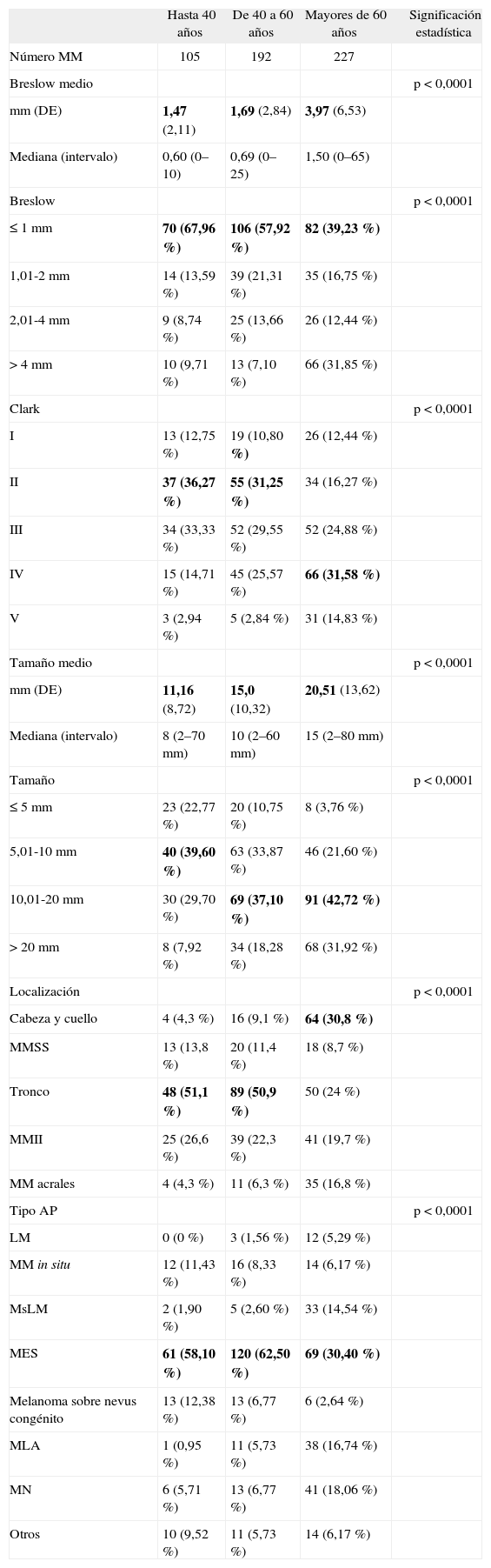
Características de los melanomas en los distintos grupos de edadEn la tabla 3 se detallan los datos de los MM según la edad a la que se diagnosticaron, con claras diferencias en todas las características clínico-patológicas entre los pacientes mayores y menores de 60 años.
Características de los melanomas por intervalos de edad (n = 524)
| Hasta 40 años | De 40 a 60 años | Mayores de 60 años | Significación estadística | |
| Número MM | 105 | 192 | 227 | |
| Breslow medio | p < 0,0001 | |||
| mm (DE) | 1,47 (2,11) | 1,69 (2,84) | 3,97 (6,53) | |
| Mediana (intervalo) | 0,60 (0–10) | 0,69 (0–25) | 1,50 (0–65) | |
| Breslow | p < 0,0001 | |||
| ≤ 1 mm | 70 (67,96 %) | 106 (57,92 %) | 82 (39,23 %) | |
| 1,01-2 mm | 14 (13,59 %) | 39 (21,31 %) | 35 (16,75 %) | |
| 2,01-4 mm | 9 (8,74 %) | 25 (13,66 %) | 26 (12,44 %) | |
| > 4 mm | 10 (9,71 %) | 13 (7,10 %) | 66 (31,85 %) | |
| Clark | p < 0,0001 | |||
| I | 13 (12,75 %) | 19 (10,80 %) | 26 (12,44 %) | |
| II | 37 (36,27 %) | 55 (31,25 %) | 34 (16,27 %) | |
| III | 34 (33,33 %) | 52 (29,55 %) | 52 (24,88 %) | |
| IV | 15 (14,71 %) | 45 (25,57 %) | 66 (31,58 %) | |
| V | 3 (2,94 %) | 5 (2,84 %) | 31 (14,83 %) | |
| Tamaño medio | p < 0,0001 | |||
| mm (DE) | 11,16 (8,72) | 15,0 (10,32) | 20,51 (13,62) | |
| Mediana (intervalo) | 8 (2–70 mm) | 10 (2–60 mm) | 15 (2–80 mm) | |
| Tamaño | p < 0,0001 | |||
| ≤ 5 mm | 23 (22,77 %) | 20 (10,75 %) | 8 (3,76 %) | |
| 5,01-10 mm | 40 (39,60 %) | 63 (33,87 %) | 46 (21,60 %) | |
| 10,01-20 mm | 30 (29,70 %) | 69 (37,10 %) | 91 (42,72 %) | |
| > 20 mm | 8 (7,92 %) | 34 (18,28 %) | 68 (31,92 %) | |
| Localización | p < 0,0001 | |||
| Cabeza y cuello | 4 (4,3 %) | 16 (9,1 %) | 64 (30,8 %) | |
| MMSS | 13 (13,8 %) | 20 (11,4 %) | 18 (8,7 %) | |
| Tronco | 48 (51,1 %) | 89 (50,9 %) | 50 (24 %) | |
| MMII | 25 (26,6 %) | 39 (22,3 %) | 41 (19,7 %) | |
| MM acrales | 4 (4,3 %) | 11 (6,3 %) | 35 (16,8 %) | |
| Tipo AP | p < 0,0001 | |||
| LM | 0 (0 %) | 3 (1,56 %) | 12 (5,29 %) | |
| MM in situ | 12 (11,43 %) | 16 (8,33 %) | 14 (6,17 %) | |
| MsLM | 2 (1,90 %) | 5 (2,60 %) | 33 (14,54 %) | |
| MES | 61 (58,10 %) | 120 (62,50 %) | 69 (30,40 %) | |
| Melanoma sobre nevus congénito | 13 (12,38 %) | 13 (6,77 %) | 6 (2,64 %) | |
| MLA | 1 (0,95 %) | 11 (5,73 %) | 38 (16,74 %) | |
| MN | 6 (5,71 %) | 13 (6,77 %) | 41 (18,06 %) | |
| Otros | 10 (9,52 %) | 11 (5,73 %) | 14 (6,17 %) |
DE: desviación estándar; LM: lentigo maligno; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; MM: melanomas; MMII: miembros inferiores; MMSS: miembros superiores; MN: melanoma nodular; MsLM: melanoma sobre lentigo maligno. En negrita aparecen los valores más frecuentes en cada análisis.
Los MM detectados en los pacientes mayores de 60 años fueron significativamente más gruesos y de mayor tamaño que los de pacientes menores de esa edad (ANOVA, prueba de Duncan).
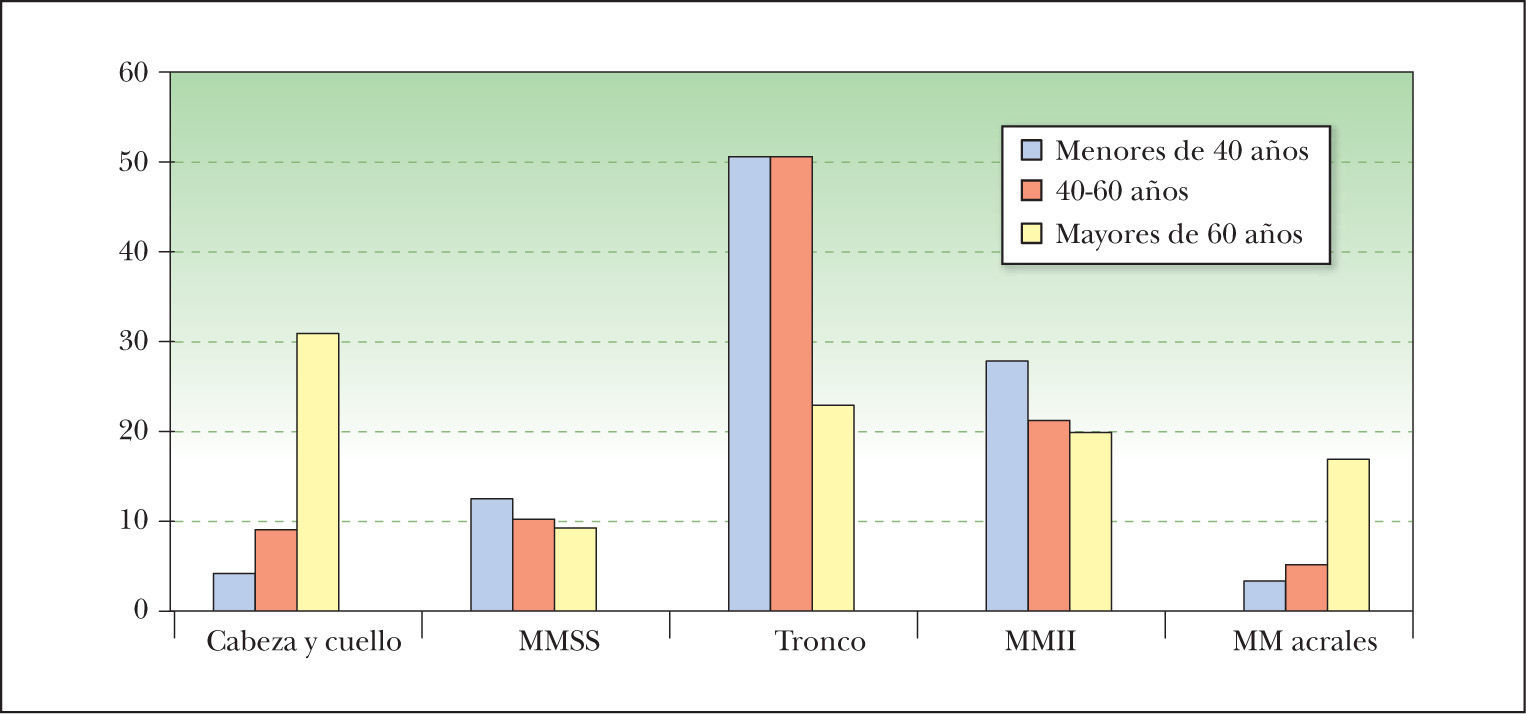
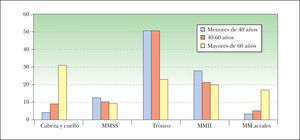
Las localizaciones más frecuentes hasta los 60 años fueron el tronco y los MMII, mientras que después de esa edad el predominio por unas zonas concretas no fue tan acusado, siendo la localización más frecuente la cabeza y el cuello; asimismo, destacó en mayores de 60 años la localización acral, que fue infrecuente en otros grupos de edad y aquí supuso el 16,8 % de todos los melanomas (fig. 1) (Chi cuadrado, análisis de correspondencias simples).
En cuanto a los tipos histológicos, en mayores de 60 años hubo mayor proporción de LM, melanomas sobre lentigo maligno (MsLM), melanomas nodulares (MN) y melanomas lentiginosos acrales (MLA) que en los pacientes jóvenes (Chi cuadrado, análisis de correspondencias simples), aunque en todas las edades el tipo más frecuente fue el MES.
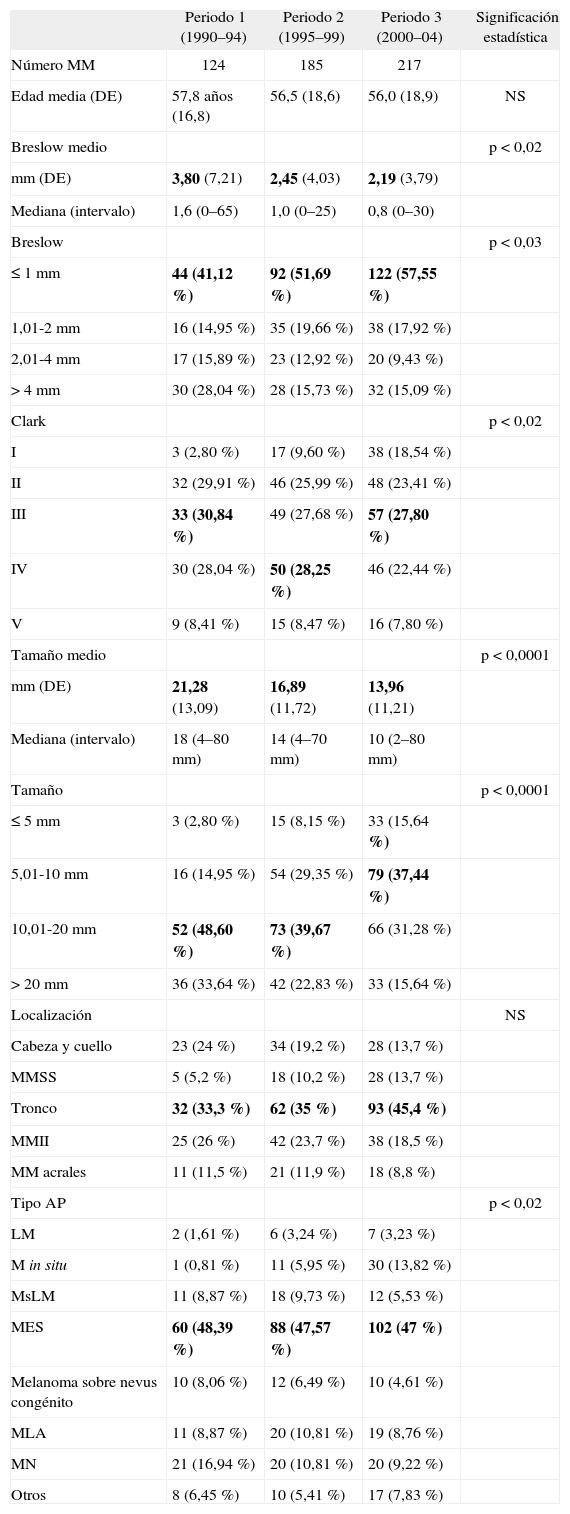
Características de los melanomas según el periodo temporal de extirpación y cambios con el paso del tiempoEn la tabla 4 se detallan todos los datos recogidos en este análisis, cuyos resultados más relevantes son los que desarrollamos a continuación.
Características de los melanomas en los sucesivos periodos
| Periodo 1 (1990–94) | Periodo 2 (1995–99) | Periodo 3 (2000–04) | Significación estadística | |
| Número MM | 124 | 185 | 217 | |
| Edad media (DE) | 57,8 años (16,8) | 56,5 (18,6) | 56,0 (18,9) | NS |
| Breslow medio | p < 0,02 | |||
| mm (DE) | 3,80 (7,21) | 2,45 (4,03) | 2,19 (3,79) | |
| Mediana (intervalo) | 1,6 (0–65) | 1,0 (0–25) | 0,8 (0–30) | |
| Breslow | p < 0,03 | |||
| ≤ 1 mm | 44 (41,12 %) | 92 (51,69 %) | 122 (57,55 %) | |
| 1,01-2 mm | 16 (14,95 %) | 35 (19,66 %) | 38 (17,92 %) | |
| 2,01-4 mm | 17 (15,89 %) | 23 (12,92 %) | 20 (9,43 %) | |
| > 4 mm | 30 (28,04 %) | 28 (15,73 %) | 32 (15,09 %) | |
| Clark | p < 0,02 | |||
| I | 3 (2,80 %) | 17 (9,60 %) | 38 (18,54 %) | |
| II | 32 (29,91 %) | 46 (25,99 %) | 48 (23,41 %) | |
| III | 33 (30,84 %) | 49 (27,68 %) | 57 (27,80 %) | |
| IV | 30 (28,04 %) | 50 (28,25 %) | 46 (22,44 %) | |
| V | 9 (8,41 %) | 15 (8,47 %) | 16 (7,80 %) | |
| Tamaño medio | p < 0,0001 | |||
| mm (DE) | 21,28 (13,09) | 16,89 (11,72) | 13,96 (11,21) | |
| Mediana (intervalo) | 18 (4–80 mm) | 14 (4–70 mm) | 10 (2–80 mm) | |
| Tamaño | p < 0,0001 | |||
| ≤ 5 mm | 3 (2,80 %) | 15 (8,15 %) | 33 (15,64 %) | |
| 5,01-10 mm | 16 (14,95 %) | 54 (29,35 %) | 79 (37,44 %) | |
| 10,01-20 mm | 52 (48,60 %) | 73 (39,67 %) | 66 (31,28 %) | |
| > 20 mm | 36 (33,64 %) | 42 (22,83 %) | 33 (15,64 %) | |
| Localización | NS | |||
| Cabeza y cuello | 23 (24 %) | 34 (19,2 %) | 28 (13,7 %) | |
| MMSS | 5 (5,2 %) | 18 (10,2 %) | 28 (13,7 %) | |
| Tronco | 32 (33,3 %) | 62 (35 %) | 93 (45,4 %) | |
| MMII | 25 (26 %) | 42 (23,7 %) | 38 (18,5 %) | |
| MM acrales | 11 (11,5 %) | 21 (11,9 %) | 18 (8,8 %) | |
| Tipo AP | p < 0,02 | |||
| LM | 2 (1,61 %) | 6 (3,24 %) | 7 (3,23 %) | |
| M in situ | 1 (0,81 %) | 11 (5,95 %) | 30 (13,82 %) | |
| MsLM | 11 (8,87 %) | 18 (9,73 %) | 12 (5,53 %) | |
| MES | 60 (48,39 %) | 88 (47,57 %) | 102 (47 %) | |
| Melanoma sobre nevus congénito | 10 (8,06 %) | 12 (6,49 %) | 10 (4,61 %) | |
| MLA | 11 (8,87 %) | 20 (10,81 %) | 19 (8,76 %) | |
| MN | 21 (16,94 %) | 20 (10,81 %) | 20 (9,22 %) | |
| Otros | 8 (6,45 %) | 10 (5,41 %) | 17 (7,83 %) |
DE: desviación estándar; LM: lentigo maligno; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; MM: melanomas; MMII: miembros inferiores; MMSS: miembros superiores; MN: melanoma nodular; MsLM: melanoma sobre lentigo maligno; NS: no significativo. En negrita aparecen los valores más frecuentes en cada análisis.
El número total de MM en cada quinquenio aumentó desde 124 en el primero hasta 217 en el tercero. No hubo diferencias en la edad de diagnóstico.
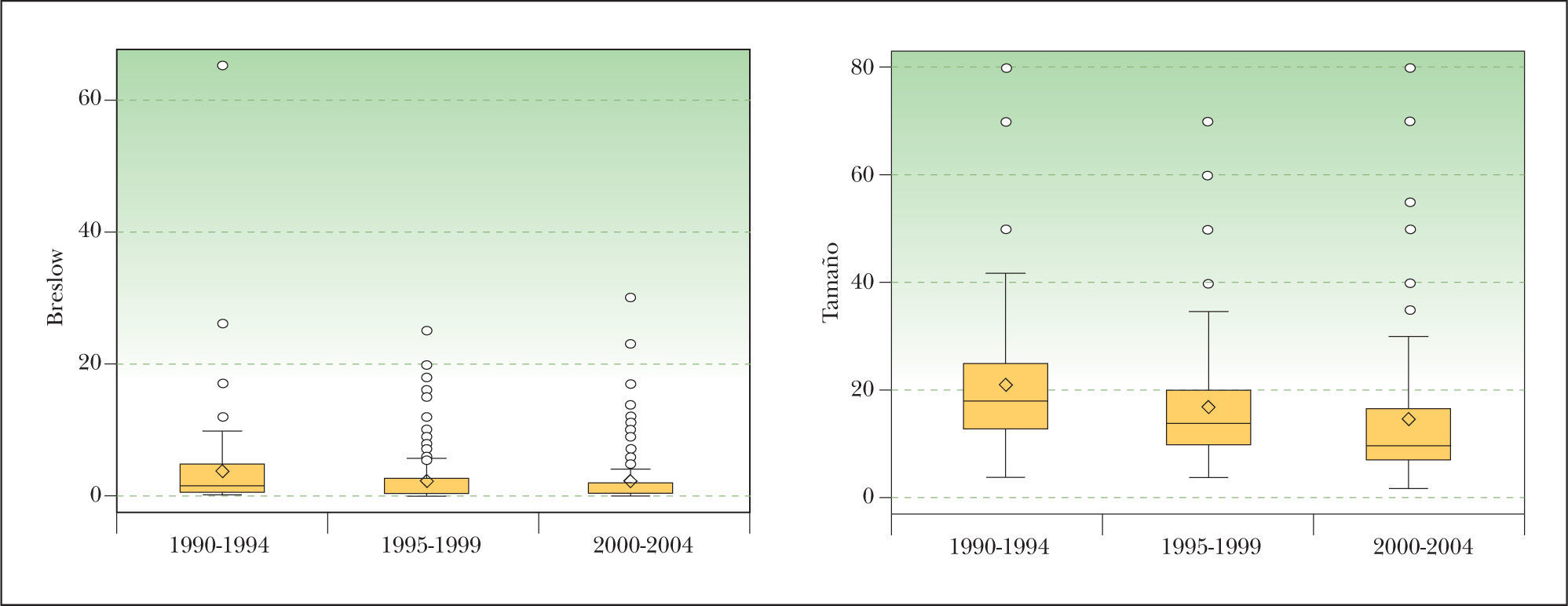
Paralelamente al aumento en el número de casos, fue disminuyendo el espesor medio (con diferencias estadísticamente significativas entre el primer periodo y los otros dos, en los cuales se mantuvo la tendencia descendente, pero con diferencias menos acusadas; ANOVA, prueba de Duncan) y el tamaño de los MM (diferencias significativas entre los tres periodos; ANOVA, prueba de Duncan) en el momento del diagnóstico (fig. 2). El aumento del número de MM en estos años fue a expensas de MM de menos de 1 mm de Breslow. Sin embargo, aunque el porcentaje de MM de más de 4 mm fue disminuyendo progresivamente, apenas hubo cambios en el número absoluto.
A lo largo de los 15 años incluidos en este trabajo, los melanomas se extirparon siendo cada vez más finos y más pequeños en superficie. En el espesor de Breslow hubo diferencias significativas entre el primer quinquenio y los dos siguientes; en el tamaño las diferencias fueron entre los tres periodos (ANOVA, prueba de Duncan).
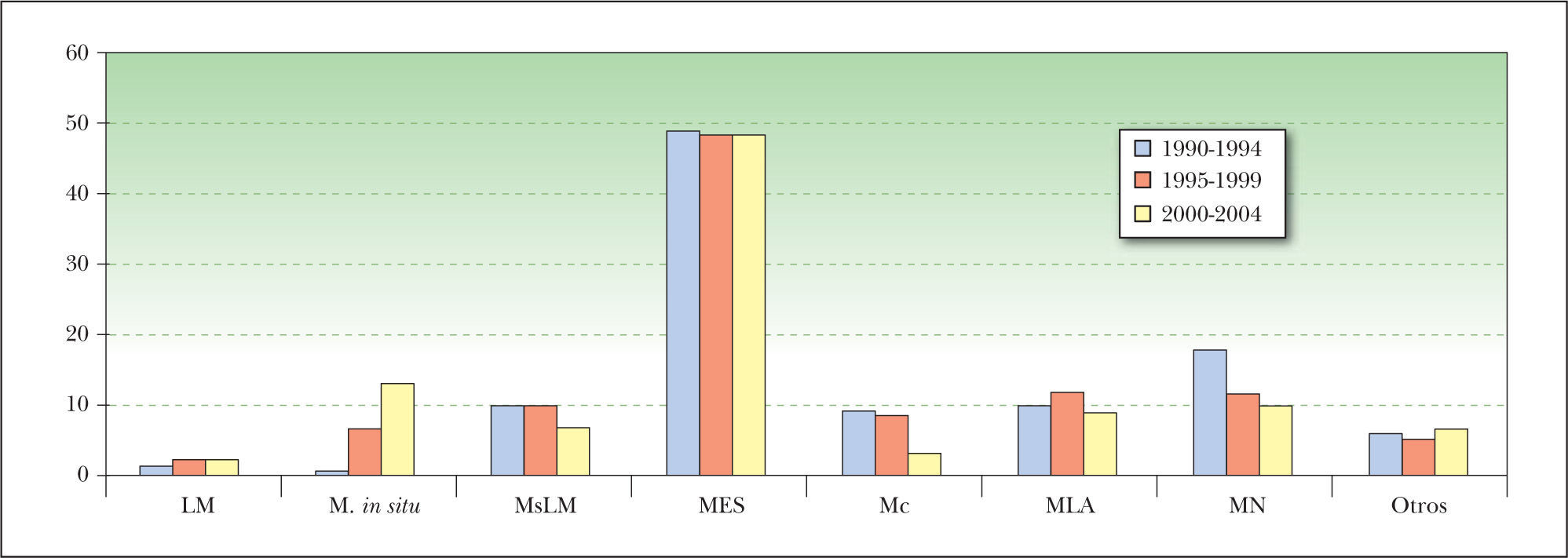
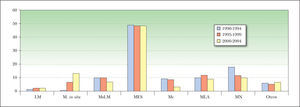
En la distribución por localizaciones no hubo cambios con el tiempo, mientras que en los tipos histológicos hubo un aumento de los MM in situ y disminuyeron porcentualmente los MN (Chi cuadrado, análisis de correspondencias simples) (fig. 3), aunque estos últimos se mantuvieron estables en número absoluto.
Evolución de los tipos histológicos de melanoma con el tiempo (en porcentaje sobre el total del periodo). Progresivamente fueron aumentando los melanomas in situ y disminuyendo los nodulares (Chi cuadrado, análisis de correspondencias simples). LM: lentigo maligno; M: melanoma; Mc: melanoma sobre nevus congénito; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; M: melanoma; MN: melanoma nodular; MsLM: melanoma sobre lentigo maligno.
Las características epidemiológicas generales de los MM incluidos en el presente estudio son similares a las descritas en otras series recientes españolas en cuanto a la edad media, la distribución por sexos, las localizaciones más frecuentes y los tipos histológicos 11–14. El único de estos parámetros en el que se producen diferencias entre unas series y otras es la localización, con algunos trabajos en los que encuentran más tumores en los MMII 15–17. También es similar el espesor medio de Breslow al encontrado en los trabajos que incluyen este dato 11–13,16, sin embargo, en nuestra serie, el porcentaje de MM con más de 4 mm de profundidad es algo mayor que en algunos de ellos 11,13,14. Esta diferencia puede atribuirse a que el área V de Madrid cubre una población rural importante y relativamente alejada de los centros de especialidades, existiendo factores socioculturales propios de este grupo de población que podrían influir negativamente en la precocidad con la que se solicita atención médica.
En nuestra muestra hemos encontrado que las mujeres tienden a tener melanomas más pequeños y con menor espesor de Breslow, localizados en los MMII, mientras que los varones, en general, consultan con MM más avanzados, fundamentalmente en el tronco. Estas diferencias en el espesor se repiten en trabajos realizados en España 13,16 y fuera de ella 18, y en general se acepta que es debido a un diagnóstico más precoz en las mujeres. Nuestros resultados son concordantes con esta teoría, ya que las mujeres tienden a tener tumores de menor diámetro en el momento del diagnóstico, sin que las diferencias en el tamaño puedan justificarse por diferencias en los tipos histológicos.
En la comparación por grupos de edad, el resultado más destacado es que los pacientes mayores de 60 años tienen melanomas más gruesos y de mayor tamaño que los menores de esa edad, dato que se repite en trabajos realizados dentro y fuera de nuestro país 12,13,18–20. Además, los pacientes de edad avanzada tienen un porcentaje mayor de MM de tipos histológicos distintos del MES y en localizaciones diferentes a los más jóvenes, con mayor frecuencia de tumores en cabeza y cuello y en las zonas acrales. Otras series españolas encuentran el mismo perfil en las localizaciones 12,13,15, aunque en otros países no hay tantos tumores en la cabeza 1. Esto podría explicarse por una mayor proporción de LM y MsLM en España, en relación con la importante exposición solar crónica de una parte de la población, tanto por motivos geográficos como ocupacionales.
Evaluación de los cambios con el tiempoHemos podido comprobar que han aumentado los melanomas diagnosticados en el Hospital La Paz de Madrid y su área de influencia en los sucesivos quinquenios. Según datos proporcionados por el Gabinete de Comunicación del Hospital La Paz, la población oficial del área V de Madrid en 1990 era de 550.242 personas, aumentando hasta 787.962 en 2004 (aumento del 43 % respecto a la población inicial). El número de MM incluidos en este trabajo en cada quinquenio aumentó en estos 15 años un 75 % (de 124 en el primer periodo a 217 en el tercero).
Somos conscientes de que las revisiones de casos de centros individuales no permiten extraer conclusiones sobre la evolución de la incidencia poblacional, por la gran influencia en los mismos que pueden tener circunstancias ajenas a la epidemiología del MM. Por ejemplo, en nuestro caso no hemos contabilizado los MM del área V de Madrid detectados y extirpados en consultas u hospitales ajenos al Hospital La Paz, y sabemos que una parte de la población, de un poder adquisitivo acomodado, podría haber utilizado la medicina privada para este fin. Sin embargo, en España no hay un registro nacional que permita conocer la incidencia anual global de MM, por lo que las estimaciones sobre su aumento solo pueden realizarse desde series limitadas a uno o varios centros. El registro que reúne el mayor número de MM es el creado en 1997 por la Academia Española de Dermatología y Venereología 21, que recoge casos de toda España y proporciona una información epidemiológica de indudable valor, pero del que tampoco se pueden extraer datos exactos de incidencia pues solo incluye los casos voluntariamente comunicados por algunos dermatólogos.
Progresivamente han ido disminuyendo el espesor y el tamaño de los MM detectados en el Hospital La Paz y su área de influencia, tendencia que, junto con el aumento del número de casos, ya comenzó a finales de los años ochenta 22. Esta misma comparación entre melanomas de un mismo centro en los distintos periodos se ha llevado a cabo en otros hospitales españoles 13–15,17,23,24, comprobando en casi todos ellos cómo con el tiempo ha aumentado el número de melanomas diagnosticados, aunque, afortunadamente, también han ido disminuyendo los espesores tumorales, los niveles de invasión y la proporción de MN.
Desde nuestro punto de vista, la tendencia general al diagnóstico cada vez más precoz del melanoma está influida por varios factores, principalmente por una mayor información de la población general y una mejor formación de los médicos que intervienen en el diagnóstico y tratamiento de esta neoplasia, junto con la ayuda de algunos avances técnicos. En las últimas décadas, el seguimiento de pacientes de alto riesgo con controles fotográficos y la exploración con dermatoscopia se han ido implantando en distintos centros de todo el mundo, con el objetivo de facilitar la sospecha precoz de melanoma. Se han realizado múltiples trabajos evaluando la utilidad de ambas técnicas y los datos disponibles hasta la fecha sugieren que con ellas se pueden identificar algunos MM que pasarían desapercibidos con las exploraciones convencionales, al objetivar la inestabilidad de lesiones nuevas o preexistentes mediante fotografías 25,26, o al añadir criterios dermatoscópicos sospechosos de melanoma a la atipia clínica 27,28. En 1995 comenzó a funcionar una Consulta especializada en Lesiones Pigmentadas (CLP) en el Hospital La Paz, que ha utilizado ambas técnicas en su práctica habitual, pero en el presente trabajo no hemos analizado el peso específico de la CLP en la disminución del Breslow y el tamaño de los melanomas en cada periodo.
En la misma línea que en otros trabajos 14,19,20,29,30, hemos encontrado una disminución relativa de los tumores mayores de 4 mm de profundidad y de los MN, pero con un número absoluto estable en los distintos periodos. Parece que con las medidas dirigidas a conseguir un diagnóstico más precoz se detectan más MM finos, pero no desciende el número de melanomas gruesos ni el de los nodulares, responsables de la mayor parte del gasto sanitario y la mortalidad por melanoma 31. En este sentido, puede parecer que los esfuerzos realizados carecen de utilidad, aunque quizá sin ellos podrían haber aumentado ambos capítulos (mortalidad y gasto) por un mayor número de melanomas profundos en el momento del diagnóstico.
Desgraciadamente, el espesor de Breslow no siempre se correlaciona con la demora en consultar. Hay tumores especialmente agresivos que llaman la atención del paciente y, a pesar de que este consulta rápidamente, se extirpan alcanzando una profundidad considerable, y hay otros detectados de forma casual que posiblemente también serían finos aunque se extirpasen un tiempo después. En la población no informada, la demora sí se relaciona con el Breslow, pero entre los pacientes que saben lo que es un melanoma, la profundidad se relacionaría más con la agresividad tumoral 32,33.
En resumen, ante el aumento del número de MM y la falta de grandes avances en el tratamiento en estadios avanzados, la prevención primaria y el diagnóstico precoz son las mejores estrategias para disminuir la mortalidad por melanoma. La combinación de una mejor información de la población, el mejor acceso a las consultas médicas y la mejor formación de los facultativos implicados en el diagnóstico de MM está consiguiendo que este sea cada vez más precoz. Del análisis por sexos y por grupos de edad se deduce que los mensajes sobre el melanoma y su diagnóstico precoz no llegan bien a los varones ni a los mayores de cierta edad, que en ocasiones siguen consultando con tumores localmente avanzados. El hecho de que se mantengan constantes las cifras de MM mayores de 4 mm de profundidad y de MN sugiere que hay un grupo de MM biológicamente muy agresivos cuya epidemiología difiere de la de los MM habitualmente más finos, y cuya incidencia no parece modificarse por las medidas encaminadas a un diagnóstico precoz realizadas hasta ahora.
AgradecimientosAl Dr. F. Contreras Rubio, Jefe del Departamento de Anatomía Patológica del Hospital La Paz durante los años incluidos en este trabajo, por facilitarnos el acceso a la información necesaria para la realización del mismo y, sobre todo, por su generoso apoyo y calidad científica y docente.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.