El vitíligo es una patología cutánea que se manifiesta en forma de manchas hipocrómicas y acrómicas. Se caracteriza por la pérdida de melanocitos y se ha hipotetizado que un mecanismo autoinmune podría estar estrechamente relacionado con este fenómeno de despigmentación. El melanoma es una neoplasia maligna derivada de los melanocitos, que es letal si no se trata oportunamente. La leucodermia es un fenómeno de despigmentación cutánea, que ocasionalmente se puede asociar a melanoma. Tanto en los pacientes con vitíligo como con melanoma se ha observado una respuesta inmune contra antígenos de las células melanocíticas, ya sea para la destrucción de los melanocitos normales como de las células tumorales. A través de diversos estudios en humanos y modelos animales se ha observado que, tanto la inmunidad humoral como la celular tienen un papel inmunorregulador en la citotoxicidad contra el tumor o contra las células melanocíticas. El estudio de los factores asociados a los mecanismos de inmunopatogenicidad antitumoral, así como a la autoinmunidad es, en potencia, una vía alternativa para el diagnóstico y tratamiento de patologías como el vitíligo y el melanoma maligno.
Vitiligo is a skin condition characterized by white, hypopigmented macules. Melanocyte loss is a feature of the disease, and it has been hypothesized that an autoimmune mechanism could be responsible for the depigmentation. Melanoma is a malignancy that develops in melanocytes; if not detected and treated early, it is often deadly. Leukoderma, a condition characterized by depigmentation of the skin, is sometimes associated with malignant melanoma. An immune response against melanocyte antigens leading to destruction of either melanoma cells or melanocytes has been observed in both vitiligo and melanoma. Studies in animal models and humans have shown that humoral and cell-mediated immune responses are involved in modulating cytotoxic activity against tumor cells and normal melanocytes. The study of factors associated with anti-tumor immunopathogenic mechanisms —autoimmunity for example— may provide us with tools for the diagnosis and treatment of diseases such as vitiligo and malignant melanoma.
El vitíligo es un trastorno caracterizado por máculas hipocrómicas y acrómicas, bien delimitadas, que carecen de melanocitos identificables. Es una dermatosis habitualmente adquirida, aunque se han descrito casos congénitos y familiares1. El impacto más importante de esta enfermedad es sobre el estatus psicológico del paciente. Se estima que la prevalencia a nivel mundial es del 0,5%2. La incidencia es de aproximadamente el 1-2% en la población general. El cuadro clínico del vitíligo consiste en la presencia de máculas hipo y acrómicas, de forma redondeada u oval, con márgenes regulares. En ocasiones puede presentar un patrón de color tricrómico (coloración canela en forma de franja entre la mácula acrómica y la piel sana), o cuatricrómico (hiperpigmentación macular perifolicular o marginal en casos de vitíligo repigmentante). Otra forma clínica es el vitíligo inflamatorio, el cual posee un límite eritematoso sobreelevado semejante al de la pitiriasis versicolor. Los patrones de distribución de las lesiones de vitíligo van desde el vitíligo focal (lesión aislada), segmentario (lesiones maculares unilaterales, que generalmente abarcan un dermatoma), generalizado (forma más común, máculas diseminadas de tamaños variables, usualmente de distribución simétrica y con cierta predilección por superficies extensoras) y universal (forma severa que afecta más del 80% de la superficie corporal).
Para la síntesis de la melanina, pigmento que provee de color a los ojos, la piel y sus anexos, se requieren algunas proteínas localizadas en los melanosomas3. Tales moléculas se denominan proteínas melanosomales y se clasifican en 2 grupos:
- 1.
Tirosinasa, proteína 1 relacionada con la tirosinasa (codificada por el gen TYRP-1) y proteína 2 relacionada con la tirosinasa (codificada por el gen TYRP-2), las cuales catalizan los pasos bioquímicos de la biosíntesis de la melanina.
- 2.
MART-1, Pmel17, Rab7 y Rab27, proteínas que tienen el papel de retener las estructuras melanosomales y/o transportar las proteínas melanogénicas o los pigmentos de melanina.
Todas estas proteínas tienen importancia desde el punto de vista fisiopatogénico, diagnóstico y terapéutico en un gran porcentaje de trastornos pigmentarios (vitíligo, piebaldismo, nevos melanocíticos y melanomas, entre otros).
Hasta la fecha se han propuesto diferentes teorías que explican la posible fisiopatogénesis del vitíligo, siendo la más frecuentemente aceptada la inmunológica. Por un lado se ha comprobado que el vitíligo puede asociarse a otras enfermedades autoinmunes, especialmente a tiroiditis autoinmune. Por otro lado en estos pacientes se han encontrado anticuerpos dirigidos contra antígenos de los melanocitos, tales como tirosinasa, TYRP-1 y TYRP-2. Además, existen estudios que revelan que la inmunidad celular también influye en el desarrollo del vitíligo. Se han encontrado infiltrados de linfocitos T, de tipo CD8, reactivos contra antígenos propios de los melanocitos, como Melan-A/MART-1, tirosinasa y gp-1001.
El tratamiento del vitíligo depende de la extensión y de la presencia de comorbilidades relacionadas; la terapia se basa en agentes inmunosupresores tópicos (corticosteroides e inhibidores de calcineurina), fototerapia para inducir repigmentación, y en casos de despigmentación extensa se indica la despigmentación de la piel normal mediante monobenciléter de hidroquinona1.
El melanoma es una neoplasia mucocutánea u ocular fatal, que puede ser esporádico o familiar, asociado a diversas alteraciones genéticas. Otros factores predisponentes son la exposición solar intensa asociada a quemaduras solares y poseer un fototipo claro (Fitzpatrick I-II, principalmente); aunque los pacientes con fototipos oscuros también pueden presentar esta neoplasia. Representa aproximadamente el 5% de todos los cánceres en el sexo masculino y el 4% en el femenino4. Se ha reportado que, en caucásicos, el incremento en la incidencia del melanoma cutáneo es de 3-7% cada año5.
Las manifestaciones clínicas del melanoma cutáneo se han descrito ampliamente en textos de dermatología y oncología, por lo que no se tratarán profundamente en el presente escrito; sin embargo, es importante mencionar que son lesiones usualmente maculares o nodulares, de bordes irregulares, generalmente hiperpigmentadas con variedades de colores, que van desde el color café claro, azul, grisáceo e incluso con zonas de hipopigmentación (zonas de regresión). Entre 15 y 36% de los pacientes con melanoma en etapas tempranas (i y ii) presentan alguna forma de recurrencia o metástasis (regionales y a distancia) durante su evolución clínica4. Entre los factores pronósticos aceptados en la clasificación de la American Joint Committee on Cancer (AJCC) en 2009 se encuentran: el espesor tumoral, el nivel de invasión (solo para melanomas T1), la tasa mitótica por mm2, la ulceración, la presencia de metástasis satélites, ganglionares y pulmonares, los niveles elevados de DHL6 y la respuesta linfoide antitumoral, específicamente hablando de los linfocitos que infiltran el tumor, cuya densidad del infiltrado es directamente proporcional a la mejoría en el pronóstico4, por lo cual la función de este infiltrado es generar una respuesta inmune innata antimelanoma, aunque desafortunadamente en muchos casos insuficiente como para erradicar totalmente la neoplasia3. Otros factores pronósticos que también han sido considerados son: la edad, el sexo, la localización anatómica del tumor y la afectación de ganglios linfáticos regionales4.
El melanoma es una neoplasia altamente inmunogénica, en otras palabras, que estimula el sistema inmune para generar una respuesta humoral (mediada por anticuerpos) y fundamentalmente celular (mediada por linfocitos citotóxicos) frente a antígenos citoplásmicos, así como de membrana de las células de melanoma3. Los antígenos asociados a melanoma se pueden clasificar de manera general en 2 clases:
- 1.
Antígenos de cáncer/testículo. Están altamente expresados en tejidos normales durante el desarrollo, pero en adultos la expresión se limita a los testículos y a la placenta. Se expresa en algunos tipos de cáncer. En este grupo se encuentran la familia de antígeno de melanoma (MAGE), la familia del antígeno B (BAGE), la familia del antígeno G (GAGE) y New York-esófago (NY-ESO-1).
- 2.
Antígenos de diferenciación. Son antígenos que expresan tanto las células tumorales como sus contrapartes normales, pero no otros tipos celulares. A su vez este grupo de antígenos se subdivide en: a) proteínas de membrana del melanosoma, donde se incluyen tirosinasa, tyrosinase related protein (TYRP-1), TYRP-2, Pmel17 (también conocida como gp100) y melanoma-antigen recognized by T cells (MART-1); y b) gangliósidos (GD): se presentan ampliamente en las células de melanoma. Se piensa que el papel de los gangliósidos es el de adhesión célula-célula y célula-matriz y en fijación a factores de crecimiento, principalmente apuntando su papel hacia el proceso invasivo del tumor. En este grupo se incluyen GD3, GD2, GM2, GM3 y O-acetil GD3.
La terapia del melanoma depende del estadio clínico. En estadios precoces el tratamiento fundamental es quirúrgico. El interferón alfa (IFNα) se ha utilizado principalmente como tratamiento adyuvante en los pacientes con melanoma, libres de enfermedad tras un tratamiento quirúrgico adecuado, pero con riesgo intermedio o alto de recaída. Para estadios avanzados (melanoma diseminado o con enfermedad locorregional irresecable) se ha utilizado la quimioterapia, la radioterapia y la quimioinmunoterapia con agentes como la interleucina 2 (IL-2), que potencia la citotoxicidad de células T y NK específicas de antígeno in vitro7, en combinación con agentes quimioterapéuticos, con índices de respuesta que, aunque son menores al 20% de pacientes8, son alentadores. En la actualidad existen además nuevos tratamientos contra dianas terapéuticas, dirigidas contra moléculas como KIT9 o BRAF10. Otro agente que forma parte de esta generación —la llamada target therapy— es el anticuerpo monoclonal denominado ipilimumab (anti-CTLA4)11. Por otra parte, se han hecho esfuerzos para el desarrollo de esquemas de inmunoterapia con células dendríticas, ya sea solas o potenciadas con moléculas como la glucoproteína gp10012, o métodos como la transferencia de linfocitos13, lo cual muestra el gran interés en este campo de la investigación.
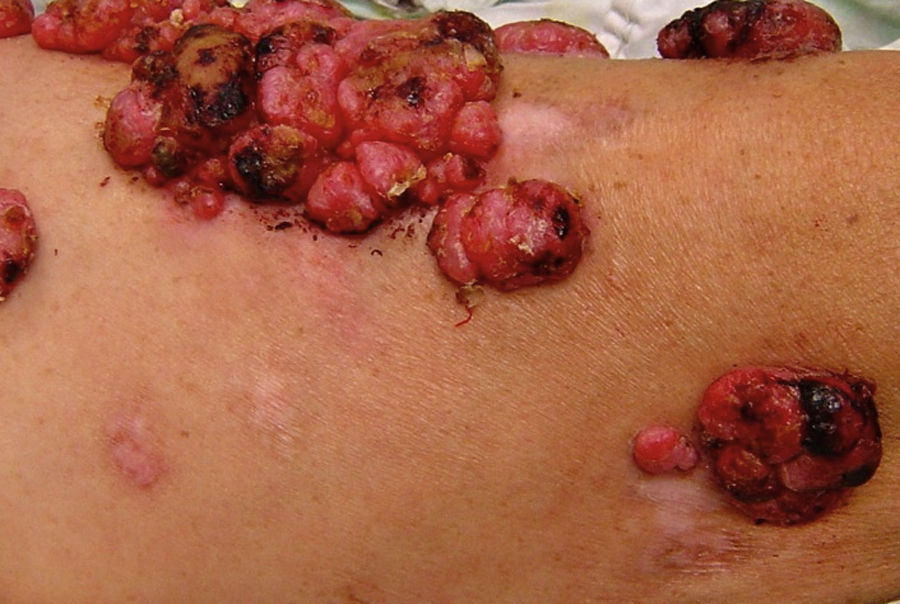
Leucodermia asociada a melanomaEn ciertas circunstancias se puede desarrollar vitíligo (leucodermia) en pacientes con melanoma maligno, principalmente en etapas avanzadas14. La relación entre el melanoma y la leucodermia es un tópico controvertido y fascinante. Cerca del 3% de los pacientes con melanoma pueden presentar este fenómeno de despigmentación vitiligoide asociada a melanoma15. La hipopigmentación (leucodermia) en asociación con lesiones melanocíticas benignas y malignas se ha comunicado frecuentemente con diferentes formas clínicas que incluyen: lesiones de regresión adyacentes a melanomas primarios o sus metástasis (fig. 1)15–17, el nevo con halo (Sutton) alrededor de nevos melanocíticos preexistentes, o lesiones vitiligoides en sitios distantes del melanoma, ya sean aisladas o asociadas a hallazgos oculares del síndrome de Vogt-Koyanagi-Harada2.
Leucodermia asociada a melanoma. Se observan múltiples máculas rosadas, además de placas hipocrómicas, algunas de aspecto cicatrizal, adyacentes a tumores de aspecto angiomatoso (metástasis de melanoma) en la cara anterior del muslo izquierdo. Este paciente ha sido previamente reportado por Salas-Alanís et al.17.
Durante el curso del melanoma, y usualmente en el contexto de etapas avanzadas (metástasis) y sus terapias (principalmente a base de inmunoterapia con IL-2 o INFα2b), puede aparecer leucodermia a distancia18,19. Se ha observado mayor supervivencia en pacientes que desarrollan leucodermia en asociación a melanoma en etapas avanzadas que en pacientes con melanoma que no la desarrollan14, sugiriendo que es un reflejo de la presencia de una actividad antitumoral en el paciente. Este fenómeno asociado a melanoma se puede presentar con una frecuencia de entre 1,4 y 20%2. Desafortunadamente, como se mencionó previamente, la eficacia de esta respuesta antitumoral no es lo suficientemente alta como para aumentar la posibilidad de la erradicación completa del melanoma.
Clínicamente la leucodermia asociada a melanoma tiene similitudes con el vitíligo. Se estima que en la población con melanoma la prevalencia de vitíligo es del 3-6%14. En una serie de 15 pacientes con melanoma e hipopigmentación se encontró que la leucodermia estaba directamente asociada al melanoma en 12 casos (80%). Se observó que la hipopigmentación apareció en promedio 4,8 años después del diagnóstico inicial de melanoma, y que la edad de aparición fue a los 56,4±10,8 años, en comparación con la edad de un grupo de pacientes con vitíligo no asociado a melanoma (promedio de 27,6±16,5 años)20. No existe una diferencia de frecuencia de tal asociación entre sexos. En esta serie de casos se encontró que el 75% de los pacientes con leucodermia asociada a melanoma tenía una distribución bilateral y simétrica semejante a la del vitíligo diseminado, mientras que solo el 25% de la población estudiada tenía una distribución focal o unilateral asimétrica de la hipopigmentación; ningún paciente con la asociación presentó distribución acrofacial de la despigmentación20. La evolución de la leucodermia asociada a melanoma no es tan rápida y progresiva como lo es usualmente la despigmentación en el vitíligo. No existe diferencia histológica ni inmunohistoquímica entre ambas formas de despigmentación. Entre los datos que diferencian la leucodermia asociada a melanoma y el vitíligo se encuentran: ausencia de historia familiar de vitíligo, decoloración parcial y distribución «parcheada» extensa. No existe una evidencia lo suficientemente sólida como para concluir que los pacientes con melanoma tienen más riesgo de desarrollar vitíligo o viceversa21. Por tanto, debido a la baja frecuencia del fenómeno, una vez que se haya hecho el diagnóstico de melanoma cutáneo, mucoso u ocular, no se requiere un seguimiento o vigilancia muy intensa respecto al desarrollo de leucodermia. Es suficiente una exploración física adecuada para valorar la presencia o ausencia de lesiones hipopigmentadas.
La asociación entre leucodermia y melanoma es probablemente consecuencia de una respuesta inmune dual contra antígenos presentes tanto en melanocitos como en células de melanoma2,14, donde el efecto inmunológico primario buscado sería el rechazo tumoral, sin embargo con un efecto secundario simultáneo de autoinmunidad caracterizado en forma de máculas hipopigmentadas (leucodermia)8.
Papel de la inmunidad humoral en la leucodermia asociada a melanomaLos anticuerpos mayoritariamente involucrados en estos efectos autoinmunitarios (e incluso antitumorales) van dirigidos a los antígenos de diferenciación melanocítica (tirosinasa, TYRP1, TYRP2 y Pmel17). Por ejemplo, Merimsky et al. encontraron niveles significativamente altos de anticuerpos antitirosinasa en el suero de pacientes con vitíligo, comparado con pacientes con melanoma metastásico, leucodermia asociada a melanoma y controles normales; además observaron una inhibición in vitro de la proliferación de células de melanoma y una disminución en la incidencia y el número de metástasis en modelos animales tratados con IgG de pacientes con vitíligo22. Los anticuerpos IgG anti-TYRP2 se han encontrado a títulos elevados en una población de pacientes con vitíligo, fenómeno semejante a lo observado en pacientes con melanoma y despigmentación inducida por inmunoterapia3. En una población de pacientes con vitíligo también se pudieron detectar anticuerpos dirigidos contra el antígeno Pmel17 por medio de radioinmunoensayo23. Por el contrario, no se han encontrado autoanticuerpos en pacientes con vitíligo3. Una evidencia más de que existe un papel importante de la inmunidad humoral y de la leucodermia asociadas a melanoma es el hallazgo de que el anticuerpo monoclonal de ratón TA99 (IgG2a), dirigido contra la proteína TYRP1/gp75, está relacionado con una hipopigmentación en modelos de ratón con melanoma (línea B16)8.
A pesar de que la despigmentación se puede considerar como un inconveniente de tipo cosmético, es interesante destacar que el umbral inmunológico de la despigmentación ha mostrado ser significativamente mayor que el requerido para el rechazo tumoral. Esto quiere decir que es mucho más fácil el acceso de anticuerpos a tumores sólidos debido a su vascularización que el acceso a los melanocitos, los cuales se localizan en la membrana basal de la epidermis y epitelios foliculares3.
En el estudio realizado por Boasberg et al. sobre un grupo de 49 pacientes con melanoma metastásico que fueron tratados inicialmente con bioquimioterapia concurrente (dacarbazina, cisplatino, vinblastina, IL-2 e IFNα2b) y posteriormente con bioterapia de mantenimiento a base de IL-2 y factor estimulante de colonias de granulocitos y monocitos (GM-CSF), los investigadores observaron que 21 pacientes (43%) desarrollaron lesiones vitiligoides. Este subgrupo de pacientes tuvo una supervivencia de cerca de 18,2 meses comparada con 8,5 meses que tuvieron los pacientes que no desarrollaron leucodermia24. Se encontraron títulos elevados de IgG anti-TYRP2 en el grupo de pacientes con leucoderma (6 de 21 pacientes; 29%) comparado con los pacientes sin despigmentación (4 de 28 pacientes; 14%). No hubo diferencia estadísticamente significativa en los títulos de anticuerpos anti-gp100 entre ambos subgrupos de pacientes.
Papel de la inmunidad celular en la leucodermia asociada a melanomaComo se mencionó previamente, las lesiones de vitíligo presentan un infiltrado inflamatorio compuesto por macrófagos, células dendríticas y linfocitos T, principalmente de la subpoblación CD8+25, aunque también se observan células CD4+. En sangre periférica de pacientes con vitíligo progresivo, así como de pacientes con melanoma (después del desarrollo de despigmentación concurrente) se han detectado células T CD8+ reactivas contra MART-1. En una población similar se encontró que más del 15% de las células T en sangre periférica eran reactivas contra el epítopo 209-217 del antígeno gp100. Estos 2 antígenos son considerados los más inmunogénicos del melanocito. Por otro lado, las células T que infiltran tumores de melanoma son muy reactivas contra estas 2 proteínas3.
Ramírez-Montagut et al. encontraron que en el 50% de una población de pacientes con melanoma se detectan células T específicas contra la proteína Melan-A/MART-1 sin que exista una correlación con un mejor pronóstico8. En otro estudio26 se demostró la presencia de células CD8+ específicas de melanocitos en sangre periférica en pacientes con melanoma, así como en pacientes con vitíligo. Específicamente eran reactivas contra tirosinasa y Melan-A/MART1 en estos grupos de pacientes, la mayoría de los cuales expresaban el HLA-A*020126. La especificidad de epítopos contra los que se dirigen las células CD8+ hacen suponer que las células responsables de la reducción tumoral lo son también de la despigmentación.
En un modelo de ratón transgénico que desarrolla melanomas se observó que casi la mitad de estos animales (45 de 88) tuvieron leucodermia permanente. En el seguimiento a 6 meses de edad de estos modelos, se observó que los animales con leucodermia asociada a melanoma presentaron significativamente menos tumores faciales y dorsales que los animales de la misma edad que no habían desarrollado leucodermia. En este estudio se demostró además que la proporción de linfocitos en sangre periférica específicos para melanoma era significativamente mayor en el subgrupo de ratones con leucodermia asociada a melanoma (1 de cada 680 linfocitos), que el de ratones sin leucodermia (1 de cada 1.000 linfocitos); estos linfocitos fueron principalmente CD8+, que inducen además la secreción de IL-12 e IFN-γ, citocinas que poseen propiedades antitumorales27. La infiltración de células inmunes le confiere un cierto grado de protección a este modelo, ya que 140 días después de la introducción de células singénicas Melan-ret se observó que el 25% de los ratones transgénicos con vitíligo estaba aún protegido contra melanoma, mientras que ningún ratón libre de leucodermia estaba protegido. La reactividad antitumoral está mediada por células T CD8+ específicas para TYRP2 y gp100. Estos mismos autores han demostrado la inducción natural de inmunidad celular mediada por células T CD8+ en humanos durante el curso de progresión de melanoma y desarrollo de leucodermia27.
Entra en controversia si la presencia de células T CD8+ son causa o consecuencia de la leucodermia, como lo muestra el estudio de Byrne et al., en el cual se demuestra que la destrucción autoinmune de los melanocitos es necesaria para una adecuada y duradera respuesta inmunológica antitumoral en un modelo en ratones28.
El papel de la IL-2 es crucial en el desarrollo de respuestas inmunes celulares antitumorales, ya que se ha observado que induce, además del reclutamiento de células T citotóxicas y NK, la supresión de células T reguladoras CD4+CD25hi-FoxP3+ (Tregs, que son las primeras células supresoras de linfocitos T específicos de antígeno) en pacientes con melanoma metastásico que responden favorablemente a la citocina. Por lo tanto, IL-2 incrementa la función citotóxica de las células CD8+ responsables tanto de regresión tumoral como de autoinmunidad7.
PerspectivasLos modelos animales como el cerdo Sinclair son muy valiosos para el entendimiento de la patogenia de estas entidades asociadas, ya que esta especie nace con melanomas congénitos que presentan regresión espontánea a las semanas de edad, y de forma concomitante presentan la aparición de máculas hipopigmentadas generalizadas. Se ha observado un incremento en los títulos de anticuerpos dirigidos a las células pigmentarias cuando se presenta el fenómeno de leucodermia2.
La línea celular de melanoma B16 se ha usado en modelos de ratón para continuar con el desarrollo de investigaciones de la respuesta humoral contra antígenos de diferenciación de melanocito, e incluso se ha observado que la inmunización pasiva con anticuerpos contra TYRP-1/gp75 resulta en el rechazo de melanoma singénico y disminución de las metástasis pulmonares en modelos animales de melanoma metástasico8.
Lengagne et al.27 establecieron un modelo experimental en ratones transgénicos, MT/ret con la línea B6. Este modelo desarrolla lesiones de melanoma a temprana edad (el 65% de los ratones en un período de 10 meses) y, posteriormente, lesiones de aspecto vitiligoide. Estos autores suponen haber promovido el desarrollo de melanoma al agregar cinc al agua de los ratones.
El antígeno 4 asociado a linfocitos T citotóxicos (CTLA-4) se encarga de la regulación negativa de los linfocitos T citotóxicos activados. El bloqueo de esta molécula por medio de un anticuerpo específico contra CTLA-4ha sido probado tanto en modelos animales como en humanos con respuestas favorables. Cabe mencionar que la respuesta clínica a dicho tratamiento se asocia a manifestaciones de autoinmunidad —entre las que se encuentra la leucodermia— sugiriendo que CTLA-4 es importante en el mantenimiento de la tolerancia periférica a autoantígenos29. Esta y otras moléculas seguirán siendo estudiadas con el fin de obtener una terapia antitumoral efectiva y con toxicidad limitada, para la mejoría en la calidad de vida de pacientes afectados por esta neoplasia maligna tan agresiva.
Debido a las características inmunogénicas del melanoma, sigue siendo un reto el desarrollo de vacunas antitumorales. De hecho, se ha desarrollado una vacuna que contiene 6 péptidos asociados a melanoma, los cuales derivan de las proteínas MAGE, MART-1/Melan A, gp100 y tirosinasa. Cabe mencionar que entre las toxicidades asociadas a la inmunización se incluyen fatiga, cefalea, mialgias, artralgias y náuseas, entre otras. Otro tipo de toxicidades que se presentaron eran de tipo autoinmune, entre las que se encontraban elevaciones en el factor reumatoide (10%), leucodermia asociada a la terapia (10%) y elevaciones en anticuerpos antinucleares30.
Las características de la respuesta inmune inductora y efectora presente en lesiones de leucodermia asociada a melanoma, así como la destrucción selectiva de células pigmentarias que ocurre en el vitíligo son los puntos en los que se enfoca la investigación de melanoma. En teoría, no sería sorprendente diseñar una transferencia de inmunoglobulinas de pacientes con vitíligo y administrarlo a pacientes con melanoma. Inclusive, una autotransferencia podría despertar una respuesta inmune antitumoral, debido a la inducción de una reactividad cruzada3. Incluso es posible hipotetizar que el suero de pacientes con vitíligo generalizado o universal podría tener un efecto antimelanoma más potente que el de pacientes con vitíligo focal o segmentario, por lo que es un área de oportunidad en el campo de la investigación de la inmunooncología.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se ha realizado experimientos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.