Teenagers’ Quality of Life (T-QoL) es un cuestionario de calidad de vida específico para adolescentes con enfermedades cutáneas. Hasta el momento, no existe ningún método validado para este fin en español, por lo que presentamos la traducción, adaptación cultural y validación del T-QoL al español.
MétodoSe diseñó un estudio prospectivo con 133 pacientes (entre 12-19 años), atendidos en el Servicio de Dermatología del Hospital Universitario de Toledo, España (septiembre 2019-mayo 2020). Para la traducción y adaptación cultural se utilizaron las guías de la Sociedad Internacional de Farmacoeconomía e Investigación de Resultados (ISPOR). Se evaluó la validez convergente con el Índice de Calidad de Vida en Dermatología (DLQI), el Índice de Calidad de Vida en Dermatología Infantil (CDLQI) y con una Pregunta Global (GQ) sobre la gravedad de la enfermedad autoevaluada. También se analizó la consistencia interna y la fiabilidad de la herramienta T-QoL, y se confirmó su estructura con un análisis factorial.
ResultadosLas puntuaciones globales de T-QoL se correlacionaron significativamente con el DLQI y el CDLQI (r = 0,75) y con la GQ (r = 0,63). El análisis factorial mostró un ajuste óptimo para el modelo bifactorial y un ajuste adecuado para el modelo de tres factores correlacionado. Los indicadores de fiabilidad fueron altos (α de Cronbach = 0,89; índice Lambda 6 de Guttman (G6) = 0,91; Omega ω = 0,91) y el test-retest mostró una alta estabilidad (coeficiente de correlación intraclase [ICC] = 0,85). Los resultados fueron consistentes con los encontrados por los autores de la prueba original.
ConclusionesLa versión española del T-QoL es un cuestionario válido y fiable para evaluar la QoL de adolescentes hispanohablantes con enfermedades cutáneas.
Teenagers’ Quality of Life (T-QoL) is an age-specific measure to assess QoL of teenagers suffering from different skin diseases. A validated Spanish language version is lacking. We present the translation, cultural adaptation and validation of the T-QoL into Spanish.
MethodsA prospective study with 133 patients (between 12 and 19 years old), attended at the dermatology department of Toledo University Hospital, Spain (September 2019–May 2020), was carried out for the validation study. The International Society for Pharmacoeconomics and Outcomes Research (ISPOR) guidelines were used for the translation and cultural adaptation. We evaluated the convergent validity with the Dermatology Life Quality Index (DLQI), the Children's Dermatology Life Quality Index (CDLQI) and with a Global Question (GQ) on self-assessed disease severity. We also analysed internal consistency and reliability of the T-QoL tool and confirmed its structure with a factor analysis.
ResultsGlobal T-QoL scores significantly correlated with the DLQI and the CDLQI (r = 0.75) and with the GQ (r = 0.63). The confirmatory factor analysis showed optimal fit for the bi-factor model and an adequate fit for the correlated three-factor model. Reliability indicators were high (Cronbach's α = 0.89; Guttman's Lambda 6 index = 0.91; Omega ω = 0.91) and test–retest showed a high stability (ICC = 0.85). The results were consistent with those found by the authors of the original test.
ConclusionOur Spanish version of the T-QoL tool is valid and reliable to assess QoL of Spanish-speaking adolescents with skin diseases.
El impacto psicológico en los pacientes que padecen enfermedades visibles de la piel (EVP) incluyen la depresión, la ansiedad y la baja autoestima1,2. Cuando las EVP no se abordana una edad temprana, pueden producir un deterioro significativo a nivel emocional, social o productivo3.
La adolescencia es una etapa vital con características propias como la maduración física, la imagen corporal, las relaciones con los compañeros, la sexualidad y la autonomía. Estas situaciones deben ser consideradas para poder comprender la calidad de vida relacionada con la salud (CVRS) de los adolescentes4. Son muchos los estudios que han evaluado el impacto de las EVP en la adolescencia, demostrando que condicionan un impacto negativo en el desarrollo psicológico5–8. Sin embargo, en la mayoría de estos estudios se han utilizado cuestionarios no validado9–12.
En la actualidad, existen tres cuestionarios genéricos disponibles en español para evaluar la calidad de vida (QoL) en personas con enfermedades de la piel: el «Dermatology Life Quality Index» (DLQI)13, el «Skindex-29»14, y el «Children's Dermatology Life Quality Index» (CDLQI)15. Ninguno de estos cuestionarios profundiza en cuestiones específicas de los adolescentes. Para abordar esto, Basra et al. desarrollaron y validaron la Calidad de Vida de los Adolescentes (T-QoL©)16.
Hasta la fecha no hay estudios publicados que evalúen la equivalencia cultural y lingüística del T-QoL para su uso en otras poblaciones adolescentes. Nuestro objetivo fue traducir, adaptar culturalmente y validar psicométricamente la herramienta del T-QoL al español.
MétodosParticipantesSe realizó un estudio prospectivo con adolescentes que acudieron al Servicio de Dermatología del Hospital Universitario de Toledo entre septiembre de 2019 y mayo de 2020. El muestreo se realizó de manera no consecutiva y no probabilística. El tamaño de la muestra estimado fue de cinco pacientes por ítem, pero no de menos de 100 pacientes en total17.
Los criterios de inclusión fueron: pacientes de 12 a 19 años que padecieran una enfermedad de la piel, que entendieran y supieran leer en español y que dieran su consentimiento informado por escrito. Los criterios de exclusión incluyeron pacientes con comorbilidades significativas que podrían afectar la CdV. Toda la información personal se mantuvo confidencial.
InstrumentosEl T-QoL consta de 18 ítems puntuados mediante una escala ordinal de 0 a 2: Nunca, Ocasionalmente o Siempre. La puntuación se puede informar como una puntuación total, con un mínimo de 0 y un máximo de 36, o como las puntuaciones de los tres dominios o subescalas: Autoimagen (ítems 1–8), Bienestar físico y aspiraciones futuras (ítems 9 –12), e Impacto psicológico y relaciones (ítems 13–18). Las puntuaciones más altas denotan un mayor deterioro de la QoL.
Como cuestionarios comparadores se utilizaron las versiones validadas en español del DLQI18, diseñado para adultos mayores de 16 años, y del CDLQI19, diseñado para niños entre cuatro y 16 años. Ambos cuestionarios constan de 10 ítems puntuados de 0 a 3, lo que da una puntuación máxima de 30.
También se utilizó una pregunta de gravedad global (GG) acerca de la gravedad de la enfermedad autoevaluada en una escala de 0 a 10 de menor a mayor gravedad.
ProcedimientoLa adaptación del T-QoL al español se realizó en dos fases: 1) traducción y adaptación cultural, 2) validación.
Para la primera etapa se utilizaron las guías elaboradas por el «Task Force for Translation and Cultural Adaptation» de la «International Society for Pharmacoeconomics and Outcomes Research» (ISPOR)20.
Análisis de los datosLas diferencias entre las puntuaciones de los cuestionarios, la pregunta de GG, los grupos de edad y el género se estudiaron mediante la prueba de suma de rangos de Wilcoxon (prueba U de Mann-Whitney) y el índice d de Cohen. La normalidad univariante se probó con la prueba de Kolmogorov-Smirnov21 y la normalidad multivariante con la prueba de Mardia22.
La validez convergente se evaluó mediante la correlación de rangos de Spearman entre el T-QoL, el DLQI, el CDLQI y el GQ. Presumimos que las correlaciones de validez convergente entre el T-QoL, el DLQI y el CDLQI serían de moderadas a altas y de moderadas a bajas con el GQ. Los tamaños del efecto se interpretaron como muy bajos (r ≤ 0,3), bajos (r = 0,3–0,49), moderados (r = 0,5–0,7) y altos (r = 0,71–0,9) y muy altos (r > 0,9)23.
La dimensionalidad de las puntuaciones de las pruebas se estudió mediante el análisis en paralelo. Realizamos un análisis factorial confirmatorio (AFC) en un modelo correlacionado de tres factores y en un modelo bifactorial con tres factores de grupo. También se analizaron las magnitudes de la saturación factorial y la varianza del ítem explicada por cada modelo (R2).
Se utilizaron el α de Cronbach y el Omega ω para evaluar la consistencia interna de las pruebas. Las puntuaciones entre 0,7 y 0,9 se consideraron adecuadas, y por encima de 0,9 podían indicar redundancia de los ítems24–26. También analizamos la matriz de correlación de Spearman entre ítems, la correlación ítem-resto corregida de la prueba, la correlación media entre ítems y la Lambda 6 de Guttman (G6)27. Los ítems se consideraron heterogéneos en valores de G6 < 0,7, consistentes cerca de 0,8 o redundantes > 0,928.
La fiabilidad del test-retest se estimó para las tres subescalas y la puntuación total utilizando el coeficiente de correlación intraclase (ICC). Las puntuaciones del ICC < 0,6 se consideraron insuficientes, entre 0,60 y 0,74 buenas y > 0,75 excelentes28. La hipótesis de estabilidad temporal de las pruebas fue encontrar resultados similares entre los participantes que repetían el cuestionario.
ResultadosPrimera fase: traducción y adaptación culturalDespués de revisar las traducciones inversas se propuso cambiar ciertas expresiones cuyo significado tenía diferentes matices en función del idioma (tabla 1). La versión en español del T-QoL se probó en un grupo piloto de ocho participantes con enfermedades de la piel. Todos los participantes contestaron el cuestionario con una viabilidad del 100% y un tiempo de respuesta menor a 3 min. En la pregunta 1 se incluyó un sinónimo del término «cohibido» para una mejor comprensión. La versión en español del T-QoL se publicó en el sitio web de la Universidad de Cardiff en octubre de 2019 (ver Material complementario): https://www.cardiff.ac.uk/medicine/resources/quality-of-life-questionnaires/teenagers-quality-of-life29.
Cambios adoptados en el proceso de traducción
| Parte del cuestionario | Versión original | Traducción directa | Versión final |
|---|---|---|---|
| Párrafo explicativo | …el impacto que su enfermedad de la piel tiene en su calidad de vida en este momento | … el impacto que su enfermedad de la piel tiene en su calidad de vida actualmente | …cuánto afecta tu problema de la piel a tu calidad de vida en este momento |
| Todas las preguntas | Condición de la piel | Enfermedad de la piel | Problema de la piel |
| Pregunta 1 | ¿La condición de tu piel te hace sentir cohibido? | ¿Eres consciente de tu enfermedad de la piel? | ¿Te sientes cohibido por tu problema de la piel? |
| Pregunta 3 | ¿La condición de tu piel te hace sentir que te ves diferente? | ¿Tu enfermedad de la piel te hace sentir diferente? | ¿Sientes que te ves diferente debido a tu problema de la piel? |
| Pregunta 13 | ¿Tu condición de la piel te hace sentir molesto? | ¿Tu enfermedad de la piel te hace sentir disgustado? | ¿Te pones de mal humor por tu problema de la piel? |
| Pregunta 16 | ¿Recibes comentarios hostiles de otras personas sobre tu piel? | ¿Recibes comentarios despectivos de otras personas sobre tu piel? | ¿Recibes comentarios desagradables sobre tu piel? |
La edad media ± DE de los 133 pacientes fue de 16,1 ± 1,9 años; 60,2% de los pacientes tenían > 16 años y 51,1% eran mujeres. Los diagnósticos incluyeron acné (65,4%), dermatosis eccematosa incluida la psoriasis (10,5%), hiperhidrosis (5,3%), nevus (3,8%), pitiriasis versicolor (3,0%) y otros (12,0%). Una comparación descriptiva de las puntuaciones medias del T-QoL en los dos momentos en que se administró no demostró diferencias significativas (T0: 8,3 ± 6,1; T1: 9,2 ± 6,6; p = 0,4). Estos hallazgos fueron congruentes con el GQ.
No se observaron diferencias estadísticas entre los niños adolescentes menores (12-15,9 años) y los adolescentes mayores (16-19 años) en ninguno de los momentos en los que contestaron el cuestionario (T0: T-QoLadolescentesmenores 7,2 ± 5,2; T-QoLadolescentesmayores 9,1 ± 6,5; p = 0,14; T1: T-QoLadolescentesmenores 9,4 ± 6,6; T-QoLadolescentesmayores 9,4 ± 6,6; p = 0,8). Solo en el dominio 3 las puntuaciones fueron superiores entre los mayores de 16 años (p < 0,05, d = −0,362). La puntuación media del T-QoL fue significativamente mayor en mujeres que en hombres a nivel global (T-QoLmujeres 10,3 ± 6,4; T-QoLhombres 6,3 ± 5,0; p < 0,001; d = −0,693), en los dominios 1 y 3, y en los dos momentos en que se administró la prueba. También encontramos diferencias de género en las evaluaciones del GQ, del CDLQI y del DLQI (GQmujeres 4,9 ± 2,6, GQhombres 3,7 ± 2,6, p < 0,05, d = −0,475; CDLQI/DLQImujeres 4,0 ± 3,6, CDLQI/DLQIvarones 2,7 ± 3,0, p < 0,05, d = −0,385).
La distribución de las puntuaciones de los ítems también se reflejó en las puntuaciones medias del dominio con el dominio 1: la autoimagen tuvo la media (EM) más alta (5,2; rango 0-16) seguido del dominio 3: impacto psicosocial y relaciones (2,1, rango 0-12) y dominio 2: Bienestar físico y aspiraciones futuras (1,2, rango 0–8).
Validez convergenteLa prueba de Kolmogorov-Smirnov fue significativa para la puntuación total del T-QoL (D = 0,12875; p < 0,001), el DLQI/CLQI (D = 0,209; p < 0,001) y GQ (D = 0,107; p = 0,020). Por lo tanto, no se puede asegurar la normalidad de ninguna de las puntuaciones totales.
Las correlaciones de las puntuaciones totales del T-QoL con el DLQI y el CLQI fueron r = 0,75 y r = 0,63 con el GQ, lo que sugiere que los resultados generales parecen converger moderadamente entre las diferentes herramientas de medición.
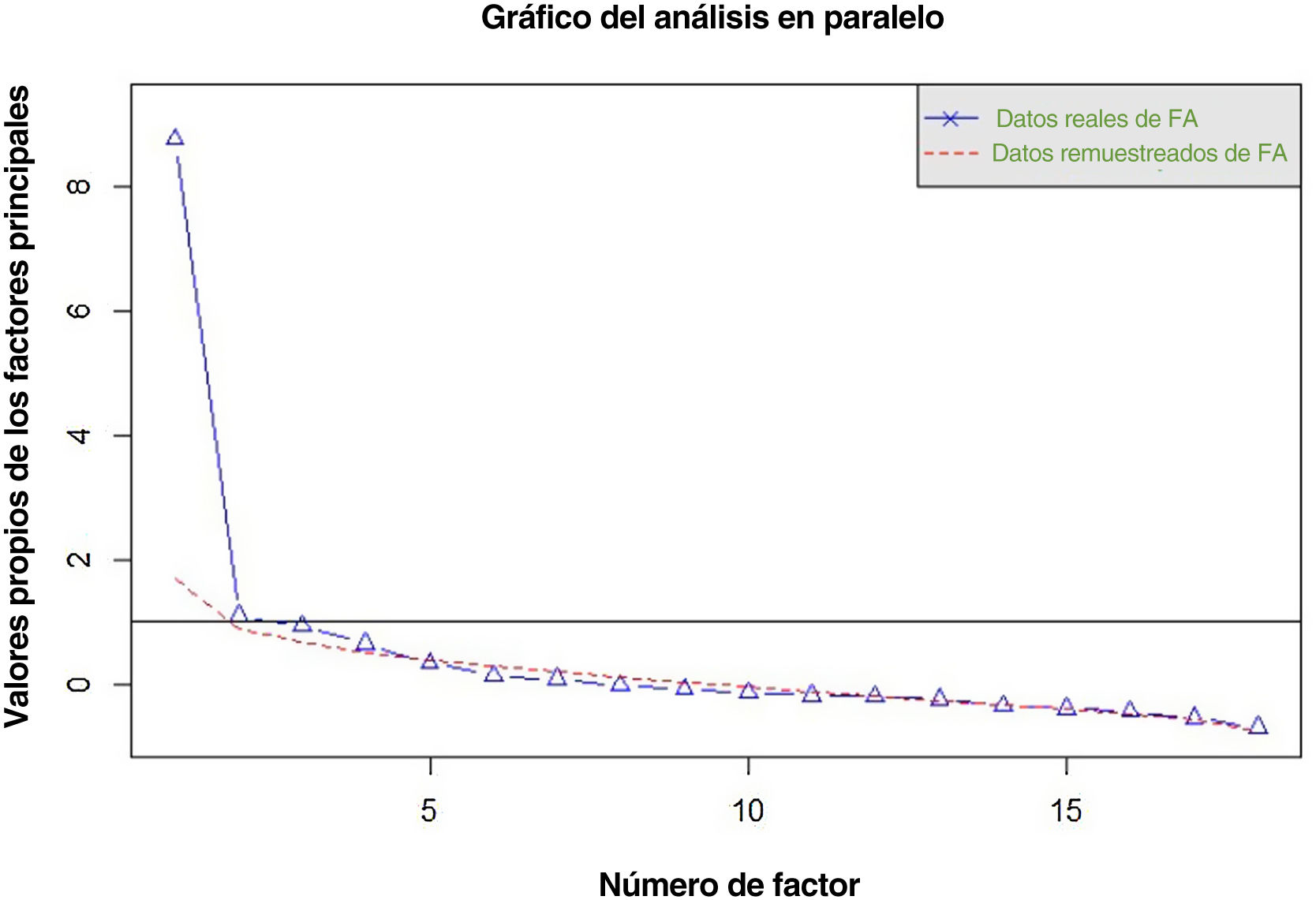
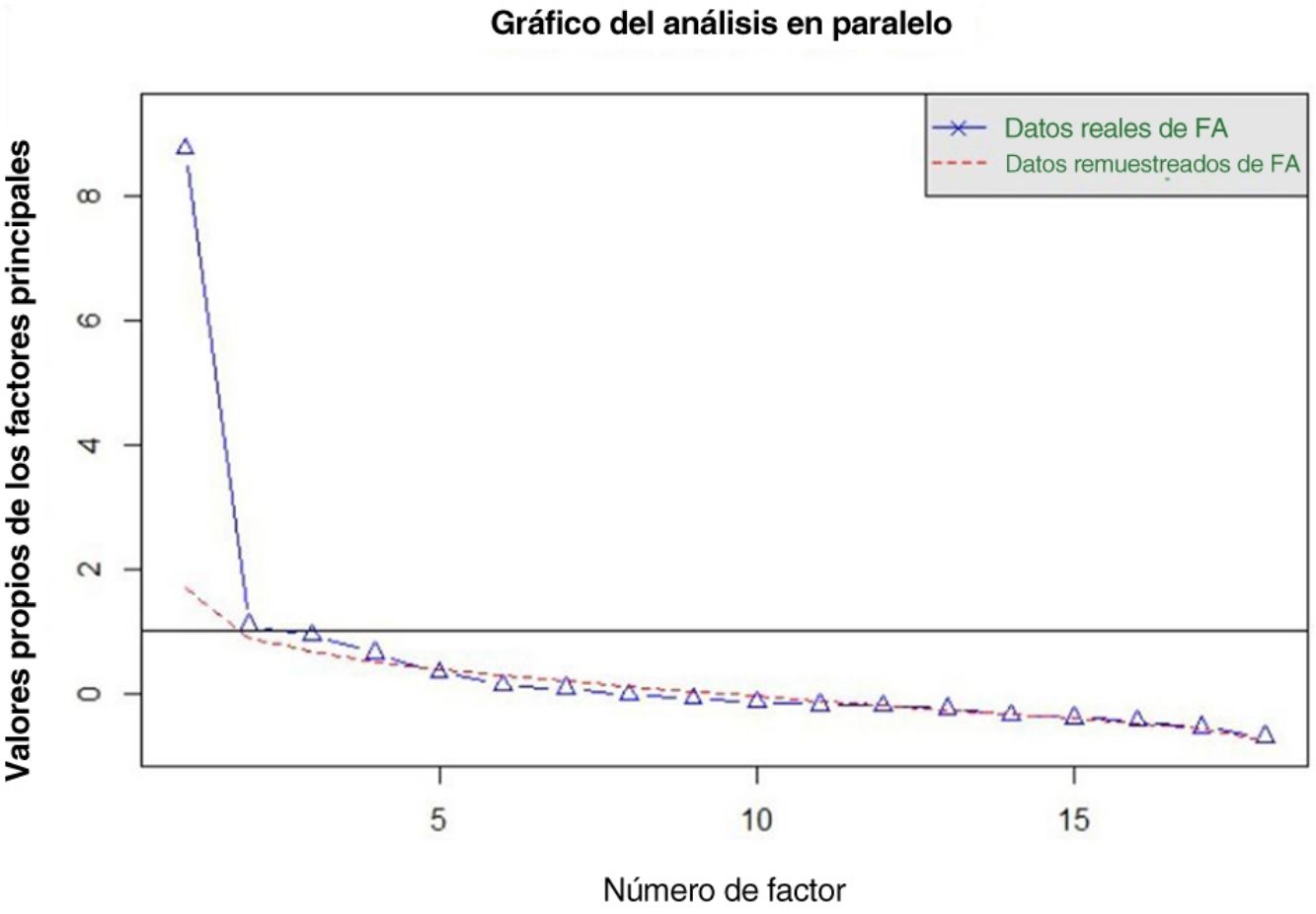
Validez de constructoEstudio de dimensionalidadEl análisis en paralelo realizado recomienda la extracción de cuatro factores cuyos autovalores empíricos fueran superiores a la media de los simulados y su percentil 95 (fig. 1). El primer factor parece ser dominante, mientras que los otros tres contienen valores propios secundarios que explican menos la varianza que el primer factor.
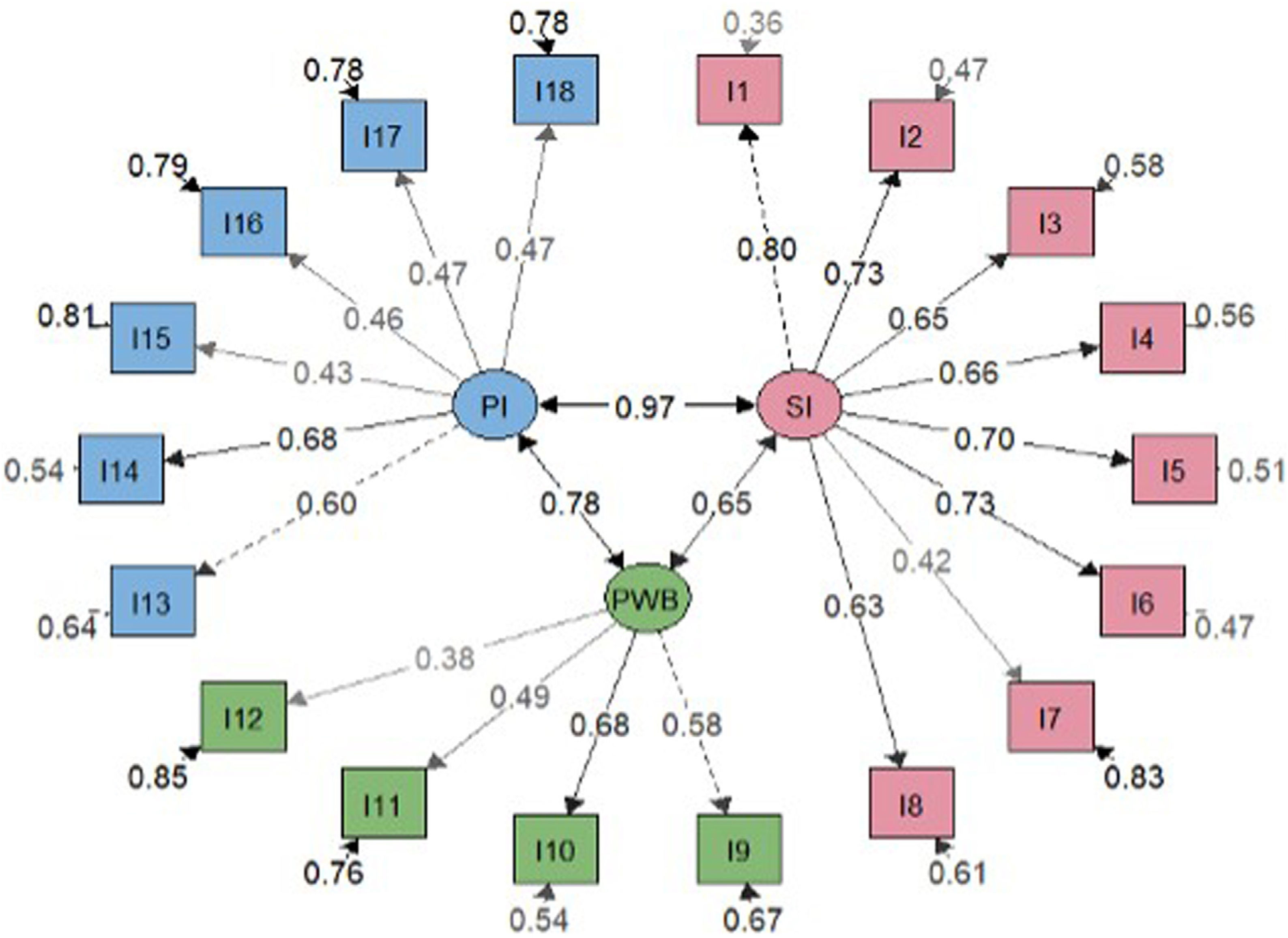
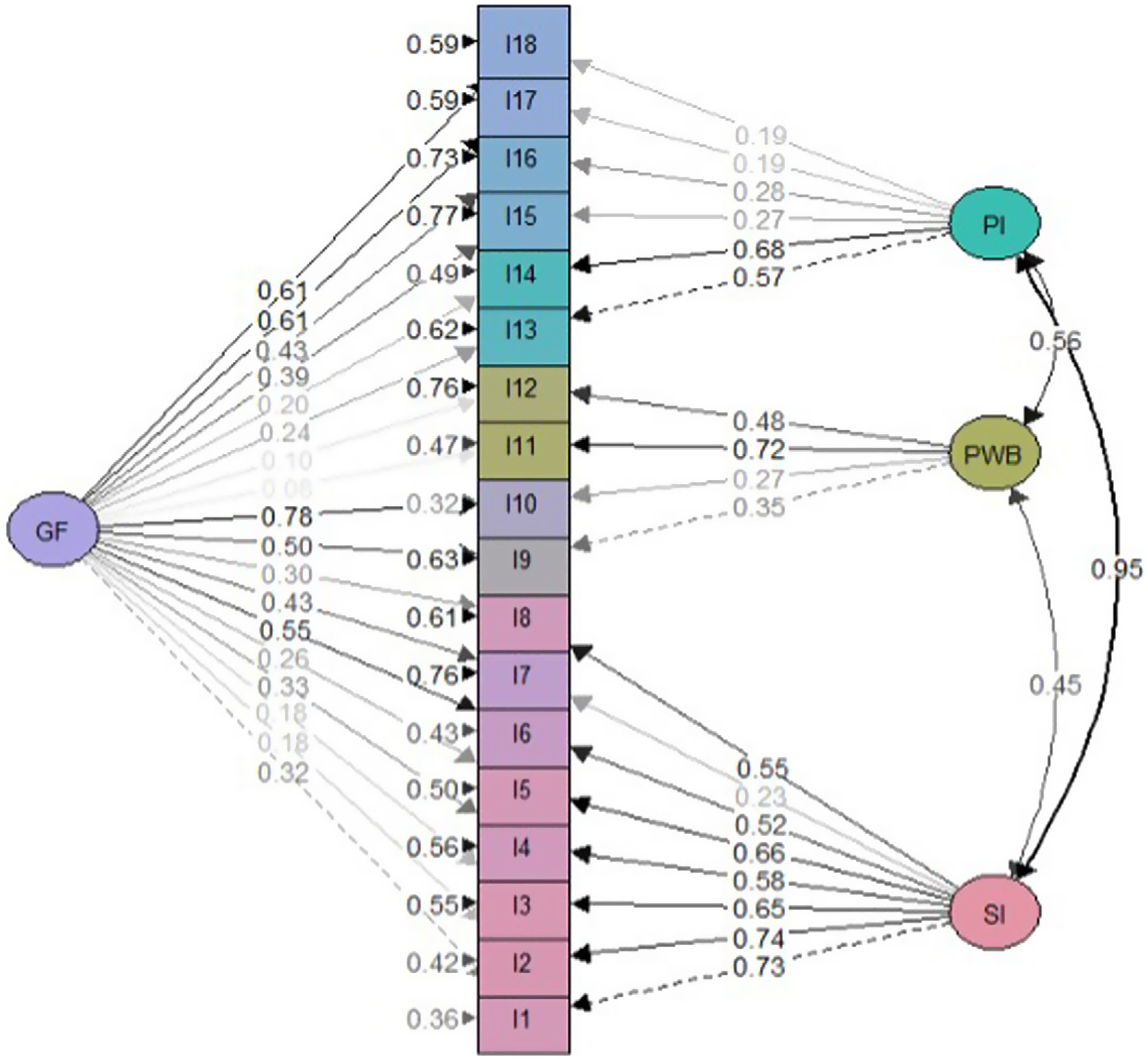
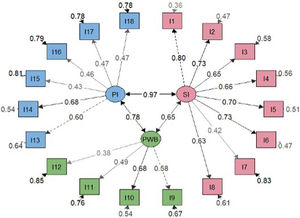
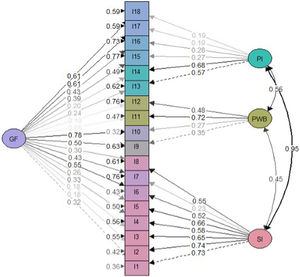
Análisis factorialLos resultados estadísticos del modelo general ajustado sugirieron un mejor ajuste para el modelo bifactorial que para el modelo de tres factores correlacionados (tabla 2). Se obtuvieron saturaciones menos significativas en el modelo bifactorial en comparación con el modelo factorial general (figs. 2 y 3). No obstante, las cargas factoriales en el modelo bifactorial no alcanzaron valores inferiores a 0,20 excepto los ítems 17 y 18 para el factor del tercer grupo y los ítems 2, 3, 11 y 12 para el factor general. Todas las saturaciones y varianzas de error fueron positivas en ambos modelos. El único ítem que no saturó significativamente en ninguno de los dos modelos fue el ítem 12. Los resultados de R2 muestran que el modelo bifactorial explicó más varianza para cada ítem incluyendo un factor general. Los ítems del dominio 1 (excepto el ítem 7) y los ítems 13, 14 fueron los ítems mejor explicados en ambos modelos. Por lo demás, los ítems 7, 12, 15 y 16 tuvieron el valor de R2 más bajo (<0,30) en los tres modelos.
Comparación de modelos
| Modelo | X2 | Df | CFI | TLI | RMSEA | SRMRu | SRMRu/R2 |
|---|---|---|---|---|---|---|---|
| Modelo de 3 factores correlacionados | 323,38** | 132 | 0,979 | 0,975 | 0,020 | 0,069 | 0,108 |
| Modelo bifactor de 3 factores de grupo | 218,23** | 114 | 0,991 | 0,987 | 0,014 | 0,043 | 0,067 |
CFA: análisis factorial confirmatorio; CFI: índice de ajuste comparativo; TLI: índice de Tucker-Lewis; Df: grados de libertad; RMSEA: error cuadrático medio de aproximación; SRMRu: media residual cuadrática estandarizada no sesgada.
Un modelo se ajusta satisfactoriamente si: CFI > 0,95, RMSEA < 0,05 y SRMRu < 0,08.
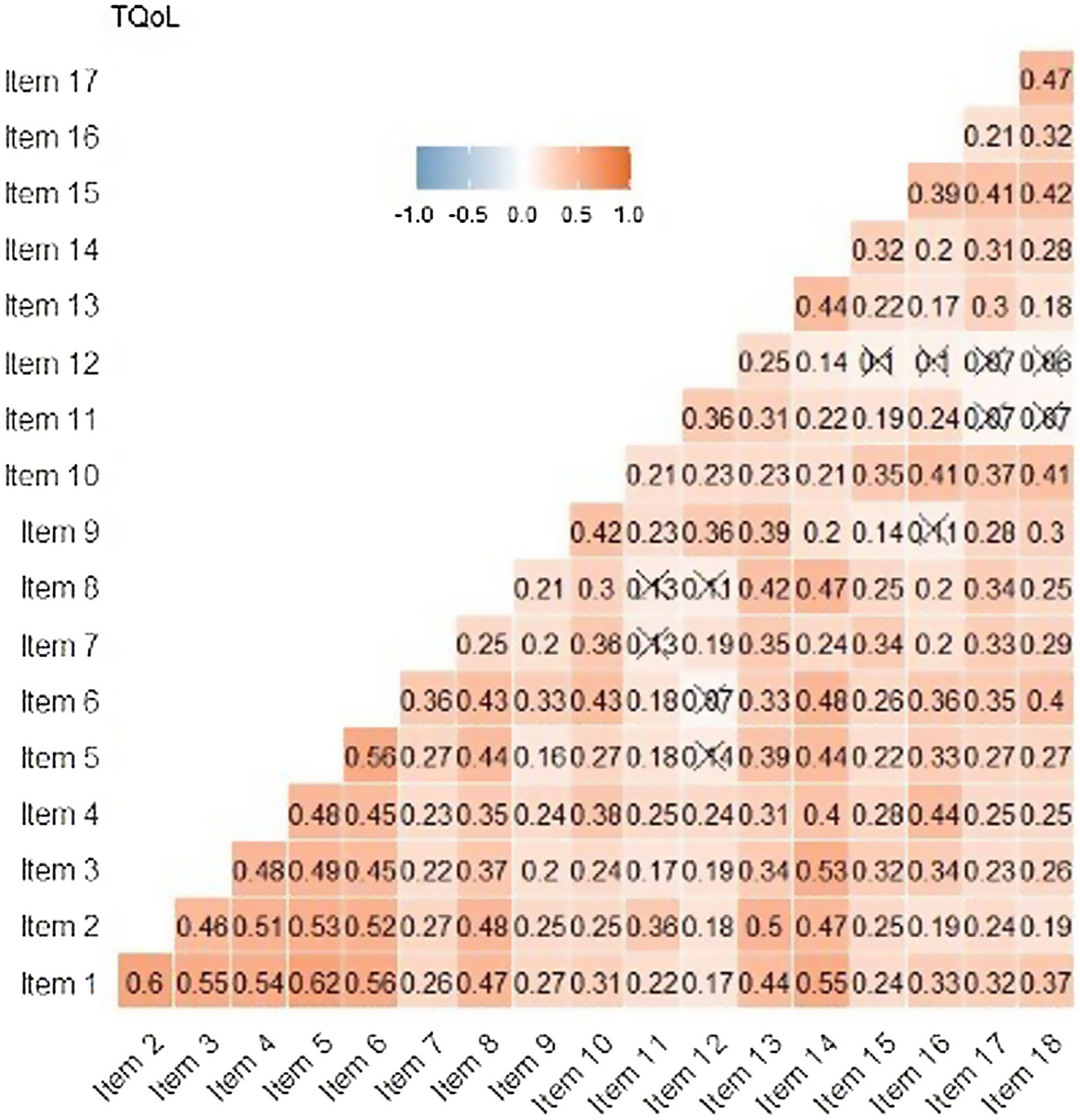
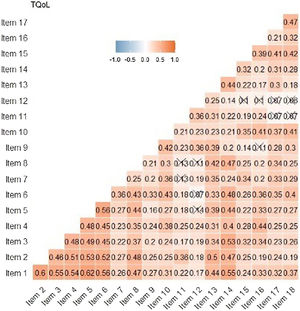
Los indicadores de fiabilidad mostraron valores elevados como: α = 0,89 de Cronbach, G6 = 0,91 y Omega ω = 0,91. Estos resultados muestran que los ítems parecen estar estrechamente relacionados entre sí. En la matriz de correlación de Spearman entre ítems, las preguntas 1 a 6 se correlacionan mucho entre sí (coeficiente de correlación > 0,3). Los ítems 11 y 12 tienen correlaciones menos significativas con otros ítems (fig. 4). En la correlación ítem-resto de la prueba, el ítem 12 es el único con correlación < 0,30, siendo el menos correlacionado con el resto de la prueba.
Para el test-retest, 47 pacientes (35% de 133) completaron el segundo conjunto de cuestionarios después de una media de 12,8 días. El ICC fue más alto para la puntuación media total del T-QoL = 0,85 (IC 95% = 0,77–0,91), seguido del dominio 1 = 0,81 (IC 95% = 0,71–0,88), dominio 3 = 0,80 (IC 95% = 0,69–0,87) y dominio 2 = 0,75 (IC 95% = 0,62–0,84).
DiscusiónPara la traducción del T-QoL se han seguido las recomendaciones de consenso de la guías ISPOR20. El término que tuvo mayores dificultades de compresión fue «cohibido» Para aclararlo se decidió añadir un sinónimo, igual que se hizo en la versión en español del DLQI y del CDLQI19, resultando la pregunta de la siguiente forma: «¿Te sientes cohibido/a o cortado/a por tu problema de la piel?».
Desde los primeros análisis descriptivos, no se observaron diferencias significativas en las puntuaciones del T-QoL cuando se repitió una semana después. Estos resultados son un buen indicador de la fiabilidad desde una perspectiva descriptiva. La comparación con el DLQI, el CDLQI y el GQ tampoco mostró diferencias significativas, lo que es un indicador preliminar de buena validez convergente.
El comportamiento similar de la prueba entre los niños mayores y los adolescentes más jóvenes es una buena aproximación de la confiabilidad para ambos grupos de edad. Solo se observaron diferencias en el dominio 3, en el que las puntuaciones fueron mayores en los participantes con más de 16 años. Una posible explicación es que el dominio 3, relacionado con el impacto psicológico y las relaciones, es más relevante para los adolescentes mayores. Las mujeres generalmente obtuvieron puntuaciones más altos que los hombres en el T-QoL y en las pruebas de comparación, lo que sugiere que el T-QoL es fiable en el análisis por género. Tanto en la muestra española como en la inglesa16, las mujeres parecen mostrar un mayor interés en cuestiones relacionadas con la imagen (ámbito 1) y las relaciones (ámbito 3). Sin embargo, las preguntas sobre el bienestar físico y las aspiraciones futuras parecen tener un interés similar para ambos géneros.
La distribución de las puntuaciones de los ítems también fue consistente con los resultados de Basra et al.16. Para ambos, el dominio 1 obtuvo las puntuaciones más altas, seguido del dominio 3 y el dominio 2. Otras similitudes con la versión original fueron el acné, la dermatosis eccematosa y la psoriasis, siendo estas las tres condiciones más frecuentemente incluidas.
En la evaluación de la validez convergente, observamos una alta correlación (r = 0,75) entre el T-QoL y las herramientas del DLQI y el CDLQI. Resultados similares se observaron en la versión original, donde los resultados del T-QoL fueron equivalentes con las herramientas del CDLQI (r = 0,75) y del DLQI (r = 0,74). También encontramos una correlación moderada con la evaluación del GQ, que es mayor que en la versión original (r = 0,5).
Los resultados del CFA respaldan que se puede calcular una puntuación total a pesar de la multidimensionalidad del T-QoL. Cabe señalar que los autores originales extrajeron tres factores a partir de los autovalores fundados mediante la regla de Kaiser, no recomendado según Ruiz et al.30 y en este estudio se han extraído cuatro factores mediante la técnica de análisis paralelo.
A pesar de que el modelo bifactorial obtuvo un ajuste más positivo que el modelo de tres factores correlacionado, hay que analizar estos resultados con cautela, teniendo en consideración lo que hay descrito en la literatura respecto a los modelos bifactoriales, especialmente cuando el tamaño de la muestra no es muy grande. Sin embargo, a diferencia de la versión original, en esta ocasión no se encontró que las saturaciones del factor general fueran siempre mayores que las de los factores grupales. Esto no parece ser una indicación de sobreestimación de las saturaciones en el factor general al absorber la varianza del factor de grupo31,32, aunque las implicaciones de no tener cargas cruzadas específicas deben ser objeto de atención en estudios futuros.
Para la fiabilidad de la consistencia interna, los valores de α de Cronbach de la versión española del T-QoL fueron iguales a la versión original (α de Cronbach = 0,89 para la puntuación total de la escala). También se estudiaron estimadores adicionales con niveles excelentes (ω = 0,91, G6 = 0,91). Los valores elevados son en ocasiones síntoma de redundancia o baja especificidad24–26; sin embargo, no podemos asegurar que los resultados de los índices de consistencia interna indiquen unidimensionalidad. El valor de ICC para la puntuación media total del T-QoL fue ligeramente inferior a los resultados de la versión original (0,85 vs. 0,91), pero > 0,75 demuestra una excelente estabilidad de la medida.
Tanto la correlación inter-ítem como ítem-resto de la prueba, el ítem 12 (relativo al sueño) fue el menos correlacionado. En el análisis factorial el mismo ítem fue el único que no saturó significativamente en ninguno de los tres modelos, cuya revisión parece más que recomendable.
El valor de este estudio va más allá de la metodología seguida y los resultados obtenidos en el proceso de validación. Se ha intentado ampliar el número de indicadores de pruebas de fiabilidad y validez y destacar algunas recomendaciones de la literatura de los modelos bifactoriales de CFA, por lo que futuras investigaciones seguirán cuestionando las decisiones metodológicas para validar la estructura factorial de esta prueba. En la práctica clínica habitual, la versión española del T-QoL mejorará la relación médico-paciente, ya que aborda los aspectos emocionales de las condiciones del paciente33. Las respuestas al cuestionario también aportan información valiosa para facilitar el manejo multimodal y la colaboración de dermatólogos con psicólogos y psiquiatras, cuando sea necesario34.
La carencia de otras versiones validadas del T-QoL hace que nuestra adaptación permita extender el uso de este cuestionario a otros países, fomentando el desarrollo de estudios multicéntricos internacionales. No obstante, creemos que sería recomendable realizar un estudio piloto de la herramienta para asegurar su validez en un contexto cultural diferente al español antes de su aplicación a gran escala.
También creemos que este cuestionario puede ser de interés para futuros análisis de coste-utilidad, tan relevantes en el campo de la dermatología35.
Limitaciones del estudioNo se registró el número total de pacientes que acudieron a la consulta de dermatología, ni el número de adolescentes que se negaron a participar durante el reclutamiento. La validación puede verse obstaculizada por el sesgo de respuesta, común a la mayoría de los estudios basados en cuestionarios, aunque se probó positivamente la consistencia y la concordancia con otros instrumentos ampliamente utilizados.
En el test-retest hubo una disminución del tamaño de la muestra, de 133 a 47 (−35%). Sin embargo, los autores decidieron continuar con el análisis, ya que las condiciones de atención médica cambiaron drásticamente durante el periodo de confinamiento (marzo-junio de 2020) de la pandemia de COVID-19. Esta disminución también ocurrió en la validación de la versión original: de 203 a 61 (−30%)16.
Como conclusión, hemos traducido, adaptado y validado con éxito la versión en español del T-QoL. Se trata de la primera versión en un idioma distinto del inglés.
Su implementación en países de habla hispana permitirá ampliar los horizontes de investigación y mejorar el conocimiento de las enfermedades de la piel en los adolescentes, contribuyendo así a mejorar de su calidad de vida.
FinanciaciónEste trabajo no ha recibido financiación externa.
Conflicto de interesesEl Dr. González-Cantero se ha desempeñado como consultor de Abbie, Janssen, Novartis, Almirall, Celgene y Leo Pharma recibiendo subvenciones/otros pagos, fuera del trabajo presentado.
Nos gustaría agradecer a todos los participantes, así como a los colegas del Departamento de Dermatología del Hospital Universitario de Toledo por ayudarnos a reclutar participantes para nuestro estudio. Además, queremos agradecer al Dr. Andrew Finlay, Dr. Agustín Buendía-Eisman, Omar Alonso-Naranjo y Francisco Estupiñan-Romero por revisar nuestro manuscrito.