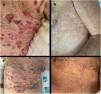
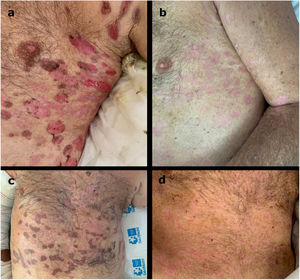
La administración de dosis bajas de rituximab es un protocolo utilizado en diversas enfermedades autoinmunes, que ha demostrado también su eficacia y seguridad para el pénfigo vulgar.
ObjetivosDeterminar si rituximab a dosis bajas es efectivo para el penfigoide ampolloso (PA).
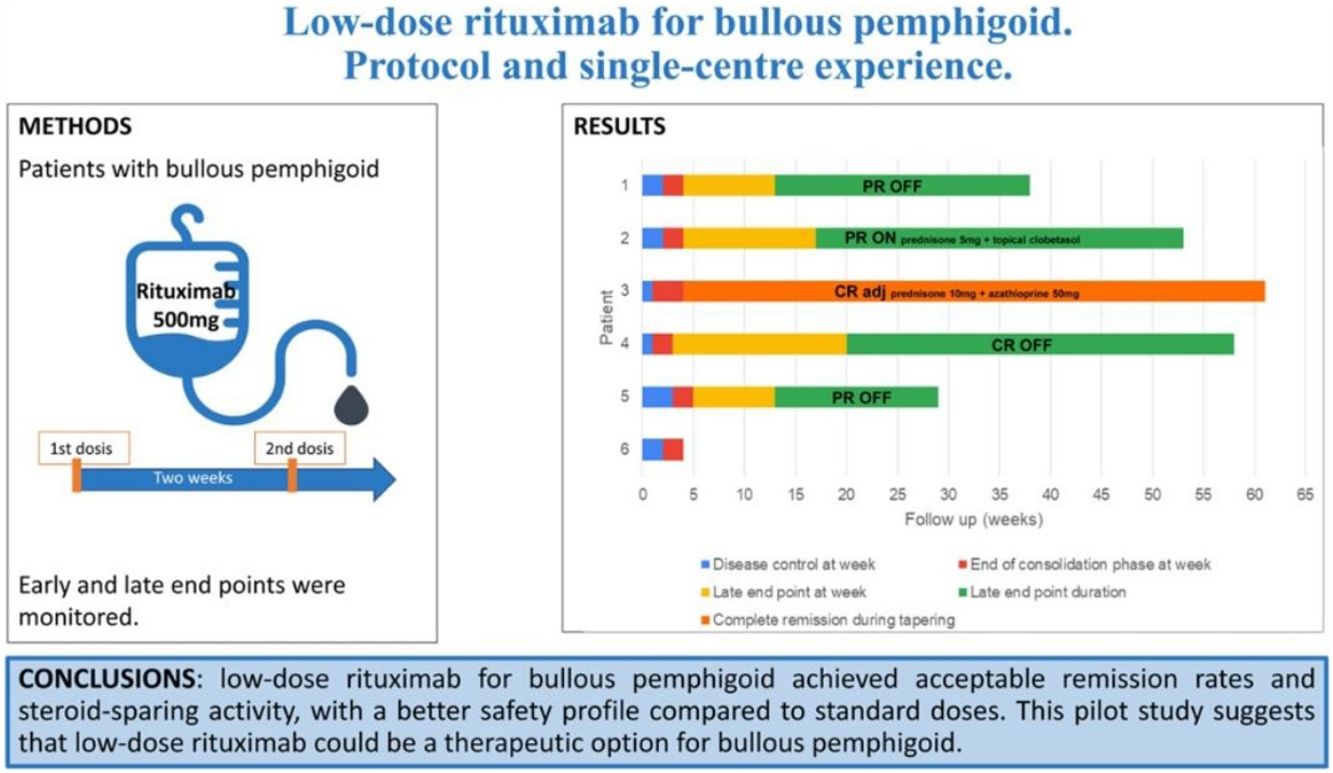
MétodosSe trató a los pacientes con PA con un ciclo único de dos infusiones de rituximab de 500 mg con un intervalo de dos semanas. Se monitorizaron los puntos temprano y final tardío.
ResultadosSe incluyeron en el estudio seis pacientes, cinco varones y una mujer, con una edad media de 78,6 años (rango: 65.89) e historia media de PA de 6,7 meses (rango: 2-16). Se observó una respuesta rápida y acusada tras un ciclo único de tratamiento, con un tiempo medio hasta el control de la enfermedad y el final de la fase de consolidación de 1,9 (rango: 1-3) y cuatro semanas (rango: 3-5), respectivamente. Cuatro pacientes lograron un punto final tardío a una media de 15,75 semanas (rango: 13-20). Tres de ellos lograron una remisión parcial sin terapia (dos pacientes) o con terapia mínima (un paciente), logrando uno de ellos la remisión completa sin terapia. A un paciente se le realizó un seguimiento de seis semanas tras la administración de rituximab. El paciente restante sufrió una recaída transcurridas cuatro semanas del tratamiento de rituximab, permaneciendo en remisión completa con terapia mínima. Un paciente manifestó gingivoestomatitis herpética relacionada con rituximab.
ConclusionesLa administración de dosis bajas de rituximab para PA logró tasas de remisión aceptables y reducción de esteroides, con un mejor perfil de seguridad y un menor coste, en comparación con las dosis estándar. Este estudio piloto sugiere que la administración de bajas dosis de rituximab podría ser una opción terapéutica para el PA.
Low-dose rituximab is a protocol used in several autoimmune diseases, that has also shown to be effective and safe in pemphigus vulgaris.
ObjectivesTo study whether low-dose rituximab is also effective for bullous pemphigoid.
MethodsPatients with BP were treated with a single cycle of two infusions of rituximab 500 mg at an interval of 2 weeks. Early and late end points were monitored.
ResultsSix patients, five males and a female, with a mean age of 78.6 years (range 65–89) and a mean history of BP of 6.7 months (range 2–16) were included. A rapid and marked response was observed after a single cycle of treatment, with a mean time to disease control and to end of consolidation phase of 1.9 (range 1–3), and 4 weeks (range 3–5), respectively. Four patients achieved a late end point at a mean of 15.75 weeks (range 13–20). Three of them achieved partial remission with no therapy (two patients) or with minimal therapy (one patient), and one of them achieved complete remission with no therapy. One patient has 6 weeks of clinical follow-up after rituximab administration. The remaining patient relapsed 4 weeks after the rituximab treatment, and remains in complete remission with more than minimal therapy. One patient had a herpetic gingivostomatitis related to rituximab.
ConclusionsLow-dose rituximab for BP achieved acceptable remission rates and steroid-sparing activity, with a better safety profile and a lower cost, compared to standard doses. This pilot study suggests that low-dose rituximab could be a therapeutic option for BP.
El penfigoide ampolloso (PA) es la enfermedad ampollosa autoinmune más frecuente1. La morbilidad y mortalidad de los pacientes con PA está incrementada, principalmente a causa de la edad avanzada y los trastornos subyacentes, aunque también debido a los efectos adversos de las terapias inmunosupresoras utilizadas para esta situación1,2. Los corticosteroides tópicos y orales son el tratamiento de base para el PA1. La segunda línea de tratamiento incluye diversas terapias no validadas tales como tetraciclinas, azatioprina, micofenolato, metotrexato, clorambucil o dapsona1,2. El difícil equilibrio entre el beneficio y el riesgo conduce a la búsqueda constante de terapias más seguras y nuevas.
Rituximab ha sido utilizado para el tratamiento de las enfermedades ampollosas autoinmunes. Las dosis estándar aprobadas para linfomas (375 mg/m2 a la semana durante cuatro semanas) y artritis reumatoide (AR) (dos infusiones de 1.000 mg que se repiten transcurridas dos semanas) son los protocolos más utilizados, habiendo sido efectivos para el pénfigo vulgar (PV)3,4, PA2,5,6 y otras enfermedades ampollosas autoinmunes7. También se ha utilizado para el PV un protocolo de rituximab a bajas dosis, dos infusiones de 500 mg, que ha reflejado un buen perfil de seguridad y una buena respuesta terapéutica3,4. Por ello, nuestra hipótesis es que esta baja dosis podría resultar efectiva también para el PA. Describimos nuestra experiencia en el tratamiento del PA con bajas dosis de rituximab.
MétodosPacientesEsta serie de casos retrospectiva y unicéntrica incluyó a pacientes con PA tratados con bajas dosis de rituximab en el Hospital Universitario Ramón y Cajal (Madrid, España) entre septiembre de 2019 y abril de 2020. El diagnóstico de PA fue establecido mediante criterios clínicos, histológicos e inmunológicos, de acuerdo con las guías clínicas europeas1. Todos los pacientes presentaron fracaso en el control inicial tras el tratamiento con terapias convencionales durante un mínimo de cuatro semanas, según lo definido por el International Pemphigoid Committee8. El tratamiento con rituximab a dosis bajas fue autorizado por nuestra institución como uso compasivo.
Estudio previo al tratamientoEl estudio previo al tratamiento incluyó analítica completa, placa de tórax, prueba de Mantoux, así como diversas pruebas microbiológicas para descartar infecciones virales incluyendo virus de la hepatitis B, virus de la hepatitis C y VIH.
Protocolo de tratamientoLos pacientes fueron premedicados con 125 mg de metilprednisolona, 5 mg de dexclorfeniramina, y 1 g de paracetamol por vía intravenosa el día de la infusión y el día posterior a la misma. Se administró un ciclo único de dos infusiones de 500 mg de rituximab con un intervalo de 14 días. Se supervisaron los efectos vitales y adversos inmediatos durante la infusión y el día posterior.
Seguimiento y criterios de valoraciónLa frecuencia de las visitas de seguimiento y los exámenes de laboratorio se establecieron considerando la situación individual de los pacientes. Los objetivos y las medidas del resultado se definieron de acuerdo con el International Pemphigoid Committee8, como (a) «Control de la enfermedad»: tiempo en el que dejan de formarse nuevas lesiones o prurito y empiezan a sanarse las lesiones establecidas; (b) «Final de la fase de consolidación»: tiempo en el cual no se han desarrollado lesiones o prurito durante un mínimo de dos semanas, habiendo remitido la mayoría (aproximadamente el 80%) de las lesiones establecidas; (c) «Remisión completa durante la reducción progresiva»: ausencia de lesiones no transitorias mientras el paciente recibe una terapia superior a la mínima; (d) «Remisión completa»: ausencia de lesiones nuevas o establecidas o prurito durante al menos dos meses, mientras el paciente no sigue terapia para PA (CR OFF) o recibe terapia mínima (CR ON); (e) «Remisión parcial»: presencia de nuevas lesiones transitorias que se resuelven en el plazo de una semana durante al menos dos meses, mientras no se sigue terapia para PA (PR OFF) o sigue terapia mínima (PR ON). La «terapia mínima» se define como menor o igual a 0,1 mg/kg/día (o su equivalente) dosis de prednisona o 20 g/semana de propionato de clobetasol y/o terapia adyuvante mínima (metotrexato 5 mg/semana; azatioprina 0,7 mg/kg/día; micofenolato de mofetilo 500 mg/día; o dapsona 50 mg/día).
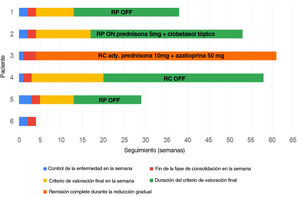
ResultadosSe incluyó a cinco varones y una mujer, con una edad media de 78,6 años (rango 65–89), con índice de comorbilidad de Charlson medio de 5,6 (rango 3–9). La historia media de PA anterior al tratamiento de rituximab fue de 6,7 meses (rango 2–16), asociándose a enfermedad de Alzheimer en dos pacientes e ingesta de inhibidores de dipeptidil peptidasa-4 (DPP-4) en un paciente. Antes del tratamiento con rituximab, todos los pacientes habían recibido terapia convencional sistémica incluyendo prednisona (seis pacientes), doxiciclina (cuatro pacientes) o azatioprina (tres pacientes), además de pomada de propionato de clobetasol 0,05% (seis pacientes). El seguimiento medio de los pacientes fue de 52 semanas (rango 6–77). La tabla 1 y la fig. 1 muestran las características y criterios de valoración de los pacientes, respectivamente.
Características demográficas, clínicas y resultados de los pacientes con penfigoide ampolloso tratados con baja dosis de rituximab
| Paciente | Sexo/edad (años) | Historia de la enfermedad (meses) | Condiciones asociadas | Terapias previas | Episodios adversos de rituximab | Control de la enfermedad en la semana | Criterio de valoración final (en la semana) | Terapia mínima | Recidiva en la semana | Seguimiento (semanas) |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | V/82 | 7 | Ingesta de Gliptina | AZA (50 mg), PRED (30 mg), CLOB | – | 2 | RP OFF (13) | – | – | 54 |
| 2 | V/65 | 16 | – | AZA (75 mg/día), DOXY (100 mg/día), PRED (20 mg/día), CLOB | Gingivoestomatitis herpética | 2 | RP ON (17) | PRED 5 mg + CLOB | – | 69 |
| 3 | V/81 | 2.5 | – | PRED (30 mg/día), DOXY (100 mg/día) | – | 1 | – | – | 4 | 77 |
| 4 | V/89 | 6 | Alzheimer (GDS = 4) | PRED (20 mg/día), DOXY (100 mg/día), CLOB | – | 1 | RC OFF (20) | – | – | 74 |
| 5 | V/77 | 2 | Alzheimer (GDS = 6) | PRED (30 mg/día), CLOB | – | 3 | RP OFF (19) | – | 32 | |
| 6 | M/77 | 6 | – | PRED (20 mg/día),CLOB | – | 2 | – | CLOB | – | 6 |
AZA: azatioprina; CLOB: pomada de propionato de clobetasol al 0,05%; RC OFF: remisión completa sin terapia alguna; DOXY: doxiciclina; GDS: escala de deterioro global; PRED: prednisona; RP OFF: remisión parcial sin terapia alguna; RP ON: remisión parcial con terapia mínima.
Fases de la enfermedad y criterios de valoración tras el tratamiento con rituximab. Cada barra representa un paciente, y su longitud muestra la duración del seguimiento. Tras un único ciclo de baja dosis de rituximab (en la semana 0), se reflejan el tiempo hasta el control de la enfermedad (azul), el tiempo hasta el final de la consolidación (rojo), el tiempo hasta el criterio de valoración final (amarillo) y su duración (verde).
RC ady.: remisión completa con terapia superior a la mínima adyuvante (también denominada «remisión completa durante la reducción gradual»); RC OFF: remisión completa sin terapia alguna; RC ON: remisión completa con terapia mínima; RP OFF: remisión parcial sin terapia alguna; RP ON: remisión parcial con terapia mínima.
Observamos una respuesta rápida y acusada tras las dos infusiones de rituximab (probablemente influyó también la premedicación con metilprednisolona) (fig. 2). El tiempo medio hasta el control de la enfermedad fue de 1,9 semanas (rango 1–3), y el tiempo medio hasta el final de la fase de consolidación fue de cuatro semanas (rango 3–5).
Criterios de valoración finalesTras un único ciclo de dosis baja de rituximab, cuatro pacientes (80%) lograron un criterio de valoración final a una media de 15,75 semanas (rango 13–20), que se mantuvo en el momento de redactar este artículo, durante una media de 28,75 semanas (rango 16–38). Tres pacientes lograron una remisión parcial: dos sin necesidad de medicación alguna (PR OFF), y uno con terapia mínima (PR ON) (prednisona 5 mg más pomada de propionato de clobetasol al 0,05%, y únicamente pomada de propionato de clobetasol al 0,05%, respectivamente). Un paciente logró la remisión completa sin terapia alguna (CR OFF). Un paciente fue seguido durante seis semanas.
El paciente restante logró controlar la enfermedad transcurrida una semana, aunque recayó tras cuatro semanas de tratamiento con rituximab. Sin embargo, sigue en remisión completa durante la reducción de tratamiento gradual, con terapia superior a la adyuvante mínima (RC ady.) (prednisona 10 mg/día y azatioprina 50 mg/día).
Efectos adversosUn paciente presentó erosiones y vesículas orales dos meses tras el tratamiento con rituximab. Se le diagnosticó gingivoestomatitis herpética (confirmada mediante PCR), resolviéndose con valaciclovir oral. Otro paciente, con mano en garra secundaria a ictus, desarrolló úlcera por presión que requirió la amputación de un dedo transcurridos 1,5 meses del tratamiento con rituximab, aunque el vínculo directo con el fármaco es improbable. No se produjeron más episodios adversos graves durante el seguimiento.
DiscusiónRituximab es un anticuerpo monoclonal quimérico humanizado dirigido contra el antígeno de CD-20 de los linfocitos B, con diversas indicaciones aprobadas y fuera de ficha técnica. Ha sido recientemente autorizado por la Food and Drug Administration (FDA) de E.E. U.U. en 2018, y la European Medicines Agency (EMA) en 2019 como tratamiento para el PV. Desde entonces se ha incrementado el número de artículos que plantean el tratamiento del PA con rituximab a dosis estándar (tabla 2)2,5,6. El protocolo para el linfoma se utiliza con mayor frecuencia que el protocolo para la AR, aunque un estudio no encontró diferencia entre ambos en términos de eficacia6. A dichas dosis estándar, la remisión completa osciló entre 352 y 85%5 de los pacientes, y la remisión parcial entre 155 y 40%.2 Dichos estudios reportaron episodios adversos graves, principalmente infecciosos, e incluso casos de muerte. En general, los datos sugieren que rituximab a dosis estándar es efectivo para el PA, y también útil como terapia ahorradora de esteroides e inmunosupresores, aunque puede tener efectos adversos graves2,5,6. Además, un estudio recientemente publicado ha reflejado que la mortalidad en los pacientes con PA tratados con rituximab es menor que en aquellos que reciben tratamiento estándar9.
Comparación de resultados entre el tratamiento del PA con dosis baja de rituximab (estudio actual) y dosis estándar
| Estudio actual, n = 5 | Polansky et al., 2019; n = 20 | Kremer et al., 2018; n = 62 | Tovanabutra et al., 2019; n = 21 | |
|---|---|---|---|---|
| Dosis de RTX | 2 dosis de 500 mg (dosis baja de RTX) | 1: Linfoma19: AR | 33: Linfoma27: AR2: otros | 14: Linfoma7: AR |
| Remisión completa, n (%) | 2 (40%)- RC OFF: 1 (20%)- RC ady.: 1 (20%) | 7 (35%)- RC OFF: 2 (10%)- RC ON: 4 (20%)- RC ady.: 1 (5%) | 52 (85%)a- RC OFF u ON: 40 (65%)- CR ady.: 12 (20%) | 12 (57%)- RC OFF: 2 (9,5%)- RC ON: 10 (47,6%) |
| Remisión parcial, n (%) | 3 (60%)- RP OFF: 2 (40%)- RP ON: 1 (20%) | 8 (40%)- RP OFF: 1 (5%)- RP ON: 3 (15%)- RP ady.: 4 (20%) | 9 (15%)No especificado | 4 (19%)- RP OFF: 1 (4,7%)- RP ON: 3 (14,3%) |
| Tiempo hasta la remisión, media (rango); meses | 3,67 (3–4,7) | 5,6 (1,9–13,9) | – | – |
| Recidiva, n (%) | 1 (20%) | 2 (13,3%) | 15 (24,5%) | 16 (76,2%) |
| Tiempo desde RTX a recidiva, media (rango); meses | 1 | 11,8 (10,9–12,6) (desde la primera dosis de RTX) | 10.2 (1–24) (desde la última dosis de RTX) | – |
| Periodo de seguimiento, media (rango); meses | 11,2 (6,8–14,2) | 16,9 (4,4–41,6) | 33 (3–108) | 44,5 (3,7–101,5) |
| Efectos adversos | 1 paciente (20%),Leve | 23 episodios- 15 hospitalizaciones- 0 muertes | 13 pacientes (24%)- 2 muertes | 4 pacientes (19%)-1 muerte |
RC ady.: remisión completa con terapia superior a la mínima adyuvante; RC OFF: remisión completa sin terapia alguna; RC ON: remisión completa con terapia mínima; RP ady.: remisión parcial con terapia superior a la mínima adyuvante; RP OFF: remisión parcial sin terapia alguna; RP ON: remisión parcial con terapia mínima. Protocolo para linfoma (375 mg/m2 semanalmente durante 4 semanas); AR: Protocolo para artritis reumatoide (dos infusiones de 1.000 mg, repetido en 2 semanas); RTX: rituximab.
Este estudio clasificó como RC OFF a los pacientes que no siguieron terapia alguna o fueron tratados con prednisona, a una dosis máxima de 10 mg. Como el último grupo se define mejor como RC ON, este grupo se denomina RC OFF u ON en la tabla. Este estudio clasificó también como RC ON a los pacientes con más de 10 mg de prednisona y/u otras terapias sistémicas. Este grupo se denomina RC ady. en la tabla.
Se ha demostrado que la baja dosis de rituximab es efectiva en varias enfermedades autoinmunes, tales como miastenia grave, artritis reumatoide o trombocitopenia inmune10. En dermatología, el rituximab a dosis bajas se ha utilizado principalmente en el PV, con datos satisfactorios en cuanto a efectividad y seguridad3,4. En un metaanálisis realizado por Wang et al. no se encontró diferencia entre las dosis estándar y las dosis bajas en términos de tiempo hasta el control de la enfermedad, tasa de remisión completa y tasa de recidiva en los pacientes con PV11.
En nuestro estudio presentamos seis pacientes con PA tratados con rituximab a dosis bajas (dos infusiones de 500 mg), que supone 39% de la dosis utilizada en hematología y 50% de la utilizada en reumatología, con un perfil aceptable de efectividad y seguridad. La administración conjunta de dosis altas de metilprednisolona ha producido probablemente este rápido efecto beneficioso, según lo observado en otras enferedades12, aunque el buen control a largo plazo de la enfermedad se deriva del uso de rituximab. Solo un paciente de nuestra serie experimentó un episodio adverso leve, en comparación con diversos episodios adversos graves con las dosis estándar2,5,6. La RC (incluyendo ausencia de terapia, terapia mínima y terapia superior a la mínima) se logró en 40% de los pacientes (en comparación con 352–85%5 con dosis estándar), y la RP en 60% de los pacientes (en comparación con 155–40%2 con dosis estándar) (tabla 2). Solo un paciente experimentó recidiva y tuvo que continuar con terapia inmunosupresora, lo cual respalda que la dosis baja de rituximab es útil también para evitar la terapia de esteroides e inmunosupresores, reduciendo la morbilidad y los episodios adversos en los pacientes de PA con edad avanzada.
Subrayamos que se trata de pacientes dependientes, con alta comorbilidad y polimedicación, lo cual supone una baja adherencia al tratamiento de primera línea (corticosteroides tópicos de alta potencia). El objetivo de este tratamiento es mejorar la calidad de vida de los pacientes, reduciendo su necesidad de cuidados, sin incrementar los efectos secundarios.
Nuestro estudio tuvo diversas limitaciones, incluyendo su naturaleza retrospectiva, el pequeño tamaño de la muestra y el corto periodo de seguimiento, que no permite apreciar los efectos a largo plazo. Sin embargo, se trata de la primera serie de PA tratada con baja dosis de rituximab, lo cual será de utilidad para futuros estudios prospectivos.
En conclusión, el tratamiento del PA con dosis bajas de rituximab logró unas tasas aceptables de remisión y una actividad ahorradora de esteroides, con un mejor perfil de seguridad, en comparación con las dosis estándar. Aunque son necesarios estudios futuros, este trabajo piloto sugiere que rituximab a dosis baja podría ser una opción terapéutica para el PA.
FinanciaciónEste estudio no ha recibido ninguna subvención específica de entidades financieras de los sectores público, comercial, o sin ánimo de lucro.