INTRODUCCION
Los avances en la fisiopatología de las enfermedades inflamatorias y autoinmunes ha potenciado el conocimiento del papel de las células T y de las citocinas derivadas de células T en la generación de inflamación tisular. Aunque el posible origen inmunológico de la psoriasis sigue todavía en discusión, lo que sí es indudable es que los fenómenos inmunológicos desempeñan un papel relevante. La infiltración por linfocitos, la secreción de diversas citocinas y quimiocinas, etc., son elementos importantes en la fisiopatología de la enfermedad. Esto ha llevado a diseñar estrategias de interferencia en estos procesos que pueden llevar a dar una solución a la psoriasis.
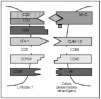
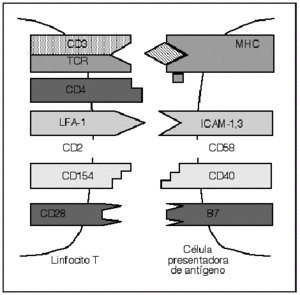
Desde un punto de vista teórico, el mecanismo de interferencia más directo sería la utilización de anticuerpos monoclonales (acm) que actúen directamente sobre dianas de las células efectoras o sobre los mecanismos de reconocimiento celular (fig. 1). En este aspecto no sólo el linfocito, sino tanto las células presentadoras de antígeno como los queratinocitos, pueden desempeñar un papel en la inmunopatogénesis de la psoriasis, ampliando el número de objetivos a los que pueden ser dirigidos los tratamientos. Además se pueden utilizar como dianas las citocinas que las células utilizan en su actividad inflamatoria o efectora.
Fig. 1.--Interacción entre el linfocito T y la célula presentadora de antígeno.
El primer acm usado terapéuticamente en humanos fue el OKT3 (anti-CD3). Sin embargo, aunque eficaz, su uso estaba asociado a graves e incluso mortales efectos secundarios debidos a síntomas de la enfermedad del suero y del síndrome de liberación de citocinas. Además, debido a que provocaba una profunda inmunosupresión, se produjo un aumento de infecciones y a largo plazo el desarrollo de enfermedades linfoproliferativas1. Asimismo, tanto este acm como la mayor parte de los primeros acm ensayados eran usados directamente tras ser generados en ratones, por lo que los pacientes desarrollaban anticuerpos contra inmunoglobulinas de ratón que a veces influían en el efecto del anticuerpo1.
Esto llevó a la realización de cambios en las tecnologías de preparación de acm (anticuerpos quiméricos, humanizados y humanos) y a la búsqueda de moléculas no inmunoglobulinas que tuvieran una alta afinidad por receptores celulares y pudieran interferir en su actividad.
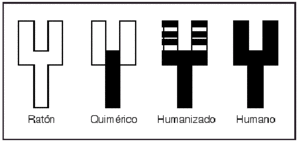
Brevemente explicaremos estas nuevas tecnologías (fig. 2). Los anticuerpos quiméricos son anticuerpos en los que la parte variable de la inmunoglobulina de ratón se une a una región constante de inmunoglobulina humana. Esto reduce la inmunogenicidad de los anticuerpos.
Fig. 2.--Anticuerpos monoclonales del ratón al humano.
Los anticuerpos humanizados también se consiguen mediante ingeniería genética. En este caso sólo las regiones determinantes del reconocimiento antigénico de las regiones variables del anticuerpo de ratón se combinan con la estructura de la región variable humana. Estos anticuerpos deben ser más «humanos» que los anticuerpos quiméricos y quizá menos inmunogénicos.
Por último se pueden conseguir anticuerpos humanos mediante tres técnicas: donantes inmunizados, de librerías de fagos y de ratones transgénicos que sólo sintetizan inmunoglobulinas humanas.
Otras alternativas para interferir en los mecanismos de reconocimiento o activación celular son:
-- Los ligandos: se usan ligandos de receptores celulares para bloquear el receptor o receptores solubles de citocinas para captar la citocina e impedir que llegue a su receptor natural. En muchas ocasiones el ligando se une a un cuerpo de inmunoglobulina que facilita que la sustancia permanezca más tiempo en el torrente sanguíneo sin ser eliminada por los mecanismos de detoxificación y que no sea reconocida como inmunógeno.
-- Los inmunoconjugados: se obtienen de fusionar, bien por una reacción química, bien mediante ingeniería genética, un acm o un ligando con una toxina (botulínica, colérica) capaz de destruir la célula diana.
Revisaremos las diversas estrategias utilizadas y los resultados obtenidos con relación al tratamiento de la psoriasis. Muchos de los anticuerpos están en desarrollo y sometidos a estudios clínicos, por lo que los resultados todavía no son públicos y sólo se dispone de la información que publicita la compañía farmacéutica. Siempre que ha sido posible hemos reflejado la dosificación, vía de administración, resultados con relación al PASI, los efectos secundarios clínicos y analíticos.
ANTI-CD2
CD2 es un antígeno de superficie de los linfocitos T que media la adhesión a las células presentadoras de antígeno, donde su ligando es CD58 (LFA-3).
Amevive® (alefacept, LFA3TIP) es la fusión de LFA-3, ligando de CD2, con una IgG1 humana, por lo que no es un acm. Con esta molécula se han desarrollado diversos ensayos clínicos y se han tratado un número alto de pacientes (al menos 600 al completar los estudios de fase II). En uno de los estudios en fase II, multicéntrico, doble ciego, se incluyeron 229 pacientes tratados con tres dosis distintas de LFA3TIP intravenosos semanales durante 12 semanas frente a placebo2. El tratamiento fue bien tolerado, sin observarse efectos secundarios importantes y con mejoría significativa de la psoriasis. Se produjo una disminución en linfocitos CD4 a expensas de los CD4+ CD45RO+ (células T de memoria y efectoras) y sólo un paciente desarrolló anticuerpos contra el LFA3TIP sin relevancia clínica. Se ha finalizado un estudio de fase III, multicéntrico, multinacional, doble ciego, comparando dosis de 10 y 15 mg de alefacept con placebo, administrado intramuscularmente una vez por semana durante 12 semanas, con un seguimiento posterior de 12 semanas más. Se incluyeron 507 pacientes y se obtuvo mejoría significativa en los pacientes tratados, sobre todo con la dosis de 15 mg. Se alcanzó una reducción del 75% del PASI en un 33% y de más del 50% en un 57%, con mínimos efectos secundarios (no hubo signos o síntomas de inmunosupresión) y una reducción significativa de CD4. Llamativamente, los pacientes que lograron una reducción del PASI mayor del 75% mantenían una reducción del mismo superior al 50% después de 7 meses tras el tratamiento. No se observó ni efecto rebote ni reactivación de la psoriasis. El 6 de agosto de 2001 se entregó la documentación a las agencias americana y europea de medicamentos pa-ra su aprobación y comercialización. Se espera que pueda iniciarse su comercialización en la segunda mitad del año 2002 (informe de la compañía).
Siplizumab (MEDI-507) es un anticuerpo humanizado anti-CD2 derivado del anticuerpo murino BTI-322. Se han realizado ensayos clínicos abiertos de fase 1 con dosis única intravenosa en 14 pacientes, de fase I/II con dosis intravenosa semanal durante 8 semanas en 26 pacientes y de fase I/II con diversas dosis subcutáneas semanales durante 12 semanas en 39 pacientes. Globalmente más del 70% de pacientes tuvieron una reducción del PASI superior al 25%. En el grupo de dosis más alta un 39% de pacientes presentó una reducción del 75% y un 55% más del 50%. Se han iniciado dos ensayos clínicos de fase II en abril de 2001 con pacientes de Europa (que se había completado en septiembre con 121 pacientes) y EE.UU. (donde se espera incluir 400 pacientes). En estos ensayos se utilizan inyecciones subcutáneas semanales durante 12 semanas (informe de la compañía).
ANTI-CD3
CD3 es un antígeno presente en todos los linfocitos T que forma un complejo con el receptor de células T (TCR). La activación de las células T depende de la interacción del complejo TCR/CD3 con su ligando.
Como hemos indicado previamente el acm anti-CD3 IgG2a Orthoclone® OKT3 obtenido en ratones fue utilizado en pacientes con trasplante renal, hepático o cardíaco con graves efectos secundarios e incluso mortales3: fiebre, distrés respiratorio, síndrome de liberación de citocinas y aumento en la incidencia de infecciones y de enfermedades linfoproliferativas, estos últimos probablemente debidos a su gran efecto inmunosupresor1. Debido a estos problemas se han desarrollado otros acm que reconocen otros epítopos en CD3 y se han ensayado sobre todo en pacientes sometidos a trasplantes. Se ha publicado un único paciente tratado con OKT3 debido a una esclerosis múltiple y que además padecía psoriasis4. Durante el tratamiento se observó una mejoría rápida (10 días) de su enfermedad.
Nuvion® es un acm IgG2 humanizado HuM291 anti-CD3 (SMART anti-CD3) en el que se han realizado modificaciones para evitar el síndrome de liberación de citocinas, con el que recientemente se han iniciado estudios en fase I/II (informe de la compañía).
ANTI-CD4
CD4 es una molécula importante en la regulación de la inmunidad. Participa en el reconocimiento de los antígenos de histocompatibilidad de clase II. En la mayor parte de los infiltrados inflamatorios dérmicos se encuentra una preponderancia de linfocitos CD4, por lo que bloquear la activación de estas células parece un camino para disminuir la reacción inflamatoria5.
La publicación en 1991 de una observación aislada del efecto de un acm anti-CD4 en un paciente con psoriasis6 desencadenó la publicación de otros casos tratados con anti-CD47,8. Desde entonces se han tratado al menos medio centenar de pacientes con estos acm.
El tratamiento con acm anti-CD4 se había empleado previamente en trasplante y en enfermedades autoinmunes como la artritis reumatoide, así como en tratamientos contra el virus de la inmunodeficiencia humana9. Se han utilizado diversos acm con distintas especificidades. Presenta pocos efectos secundarios y se han observado anticuerpos neutralizantes en una baja proporción de pacientes.
Las series publicadas han demostrado cierta eficacia en el tratamiento de la psoriasis. Así, la primera serie publicada fue con el acm BB14/BF15, una IgG1 murina de líquido ascítico que fue utilizado en tres pacientes durante 8 días10. Los pacientes sufrieron fiebre, escalofríos y en un caso cefalea y dolor abdominal, sugestivos de una enfermedad del suero. El PASI mejoró en los tres con un máximo a los 20-30 días y rebrote al cabo de 1 mes. No se evidenciaron alteraciones humorales significativas, ni siquiera una disminución del número de linfocitos CD4+, aunque todos generaron anticuerpos contra el acm. Posteriormente este grupo trató 2 pacientes más observando una buena respuesta tras dos dosis intravenosas separadas 24 h11, aunque los pacientes siguieron sufriendo de náuseas, vómitos y escalofríos y un rebrote al mes del tratamiento.
El acm quimérico M-T413 (IgG1 humana) se ha utilizado en un paciente con psoriasis pustuloso durante 1 semana con buena respuesta7. Se objetivó una linfopenia con disminución en el número de linfocitos CD4.
Con el acm murino YNB46.1.8, humanizado con IgG1, se realizó tratamiento intravenoso en diversas dosis y pautas en cinco pacientes12. Un paciente mejoró mucho (75% de reducción del PASI) y cuatro parcialmente (reducción del 20%-40%). De los tres pacientes con artropatía psoriásica, dos notaron una mejoría articular que duró de 1 a 3 meses. En la primera dosis todos los pacientes sufrieron de fiebre, escalofríos y en algunos casos hipotensión y dolor torácico que no ocurrió con las siguientes dosis y que se interpretaron como una liberación de citocinas en respuesta al acm. Se produjo una disminución del número de CD4 (30%-70%) que se recuperó lentamente y no se observó la producción de anticuerpos contra el acm. Globalmente se produjo una mejoría transitoria que fue algo más prolongada en la afectación articular.
Otro abordaje, usando un acm murino OKT4A humanizado con IgG4 se aplicó sobre seis pacientes13. Se obtuvo una reducción del 46% a las 4 semanas, que permaneció similar durante 6 meses en cuatro pacientes. Un paciente no respondió al tratamiento y el otro sufrió un rebrote de sus lesiones. No se objetivaron efectos secundarios, excepto prurito en dos pacientes, ni cambios analíticos, permaneciendo estables el número de CD4 y sin aparición de anticuerpos contra el acm. A partir de este trabajo se inició un estudio doble ciego con 75 ó 225 mg/día intravenosos los días 1, 3 y 5 controlado con placebo14. Los que no respondieron se incluyeron en un estudio abierto en el que se usó la dosis de 225 mg/día. Tras el primer ciclo sólo se obtuvo una reducción significativa en el PASI en el grupo de dosis alta, aunque no fue diferente del placebo. Los pacientes que se incluyeron en el estudio abierto tuvieron una reducción del PASI significativa respecto al placebo. Se produjeron diversos efectos secundarios durante la infusión (prurito, urticaria, sensación de calor) y algunas infecciones cutáneas. No se produjeron alteraciones analíticas ni anticuerpos contra el acm.
Humax-T4® es un acm humano contra CD4 del que está en desarrollo un estudio en fase II desde enero de 2001. Recientemente han informado de una reducción del 30% del PASI, estadísticamente significativa, en los pacientes tratados. El fármaco fue seguro y bien tolerado (informe de la compañía).
ANTI-CD6
La glucoproteína CD6 es una molécula accesoria que media la activación y proliferación de células T. Algunos anti-CD6 han sido usados en tratamiento de enfermedad injerto contra huésped y en linfoma de células T. Hay un caso publicado de tratamiento intravenoso con un acm IgG2 murino anti-CD6 junto con una formulación tópica del mismo acm. La paciente mejoró de sus lesiones15.
ANTI-CD11a
LFA-1 es un heterodímero de CD11a y CD18 que se expresa en todos los linfocitos.
LFA-1 es el ligando de ICAM-1 y funciona como molécula coestimuladora para la activación de los linfocitos.
Xanelim® (efalizumab, hu1124) es un acm humanizado del acm murino anti-CD11a MHM24. Se han tratado 31 pacientes en un estudio abierto16 con diversas dosis intravenosas únicas. Se observó un aumento de eficacia con mayor dosis, así hubo dos respuestas parciales entre los ocho pacientes tratados con dosis menores a 0,3 mg/kg, tres parciales y cinco completas en los quince tratados con dosis medias y una parcial y cuatro completas en los cinco tratados con más de 1,0 mg/kg. En pacientes tratados con dosis menores a 0,6 mg/kg los efectos secundarios fueron mínimos, pero en el grupo con dosis mayores sufrieron cefaleas y escalofríos (56%), rebrote de psoriasis, fiebre (40%), infecciones y náuseas (27%) en las 24 h tras la infusión. No se objetivó una disminución en los linfocitos T o B. En estudio en fase I/II abierto con 61 pacientes con dosis inicial subcutánea de 0,7 mg/kg, seguido de once inyecciones subcutáneas semanales en dosis de 1 a 4 mg/kg se observó una mejoría del 50% o más del PASI en un 75% de los pacientes y una mejoría del 75% o más en un 31%. Se comprobó que la dosificación subcutánea tenía características farmacocinéticas y farmacodinámicas similares a la formulación intravenosa, manteniéndose niveles adecuados del fármaco durante el tratamiento. El tratamiento fue bien tolerado, observándose cefaleas, síntomas gripales y síntomas de psoriasis. No se observó ningún efecto grave (informe de la compañía). En un estudio de retratamiento con dosis subcutáneas de 50 pacientes tratados previamente con dosis intravenosas o subcutáneas se observaron índices de respuesta similares o mayores al primer tratamiento en un 80% de los tratados (informe de la compañía). Recientemente se han publicado los resultados de un ensayo en fase II con 145 pacientes, multicéntrico, doble ciego, con dosis de 0,1 y 0,3 mg/kg comparado con placebo, en administración intravenosa semanal durante 8 semanas17. Se observó una disminución del PASI estadísticamente significativa sólo en el grupo tratado con 0,3 mg/kg. Se detectaron efectos secundarios en forma de vómitos, fiebre, escalofríos y cefaleas con la primera infusión en un 56% de los pacientes. Se produjo mayor frecuencia de rebrote de psoriasis comparado con el placebo. Analíticamente se observó un aumento de linfocitos circulantes y presencia de anticuerpos contra el monoclonal, sin significado clínico. En febrero de 2001 se ha iniciado un estudio de fase III cuya fase de inclusión de pacientes ha terminado. Aunque la compañía esperaba poder presentar la documentación a la Food and Drugs Administration (FDA) para su aprobación a primeros de 2002, alteraciones en su sistema de producción retrasará su presentación hasta el verano (informe de la compañía).
ANTI-CD25 (IL-2R)
CD25 (p55 alfa o subunidad Tac) es la subunidad α del receptor de interleucina-2 (IL-2), que se expresa en gran cantidad en los linfocitos T activados.
Simulect® (basiliximab) es un acm quimérico murino-humano contra CD25 aprobado para su uso en la prevención del rechazo de injertos. Ha sido publicada su utilización en un caso resistente a tratamiento en el que se combinó el tratamiento de ciclosporina (3 mg/kg) y fluoxetina (20 mg/día) con dos bolos de basiliximab de 20 mg intravenosos en los días 5 y 2118. Aunque se produjo una gran mejoría (PASI de 51 a 4) rebrotó a las 9 semanas del fin del tratamiento a pesar de continuar con ciclosporina en dosis de 3 mg/kg. Los mismos autores informan de tres casos más tratados en otros centros del Reino Unido con efectos dispares: un paciente con psoriasis eritrodérmica pustulosa que respondió bien y dos pacientes con psoriasis recalcitrante con mala respuesta. Un grupo alemán ha tratado dos pacientes19, uno con dos dosis de 20 mg/día intravenosos separados 21 días que no respondió y el otro tratado con 40 mg/día en tres dosis separadas 21 días que tuvo una reducción del 84% en el PASI. No se observaron efectos secundarios.
Zenapax® (daclizumab) es un acm humanizado IgG1 del acm murino 2A3 anti-CD25, que ha sido usado y está aprobado por la FDA para el trasplante renal. Se realizó un estudio abierto con 19 pacientes20 mediante infusión intravenosa de 2 mg/kg el día 0 y de 1 mg/kg en las semanas 2, 4, 8 y 12. Cuatro pacientes empeoraron, tres no se modificaron y doce mejoraron significativamente, a pesar de que en todos los pacientes se demostró un bloqueo intenso de CD25 por el acm. No se observaron efectos secundarios graves ni modificaciones analíticas. Se ha completado el reclutamiento de 126 pacientes para un ensayo clínico en fase II con este anticuerpo en pacientes con psoriasis. El estudio evalúa la eficacia y seguridad de daclizumab para mantener la remisión de la enfermedad conseguida tras tratamiento con ciclosporina. Se espera tener resultados para marzo de 2002 (informe de la compañía).
Se ha diseñado otro tipo de ataque contra el receptor de IL-2 mediante la inmunotoxina DAB389IL-2. Esta molécula se forma por ingeniería genética, fusionando el gen de la toxina de la difteria al de la IL-2. De esta manera se produce una IL-2 capaz de destruir aquellas células que expresen el receptor para IL-2. Se ha probado en un grupo de diez pacientes, obteniéndose cuatro respuestas completas y cuatro moderadas1,21. Se constató una disminución en el número de linfocitos T CD8+. Posteriormente se trataron 24 pacientes en los que un 50% tuvo una mejoría del 50% en el PASI22. Tras ello se inició un estudio multicéntrico, doble ciego, randomizado, a dosis de 5, 10 ó 15 μg/kg controlado con placebo en el que se incluyeron 41 pacientes23. El tratamiento intravenoso se realizó 3 días seguidos de cada semana durante 4 semanas. Aunque mejoraron más pacientes en el grupo tratado que en el placebo, las diferencias no fueron estadísticamente significativas. Un 34% de los pacientes dejó el tratamiento debido a los efectos secundarios: hasta un 75% de los pacientes tratados sufrió fiebre y escalofríos, más de un 50% astenia y cefaleas y más de un 30% mialgias, prurito, náuseas y exantemas. Analíticamente sólo se observó un aumento de transaminasas; sin embargo, hasta un 50% de los tratados desarrolló anticuerpos contra DAB389IL-2. Recientemente se ha publicado un estudio en 35 pacientes con dosis de 0,5, 1 y 5 μg/kg día, 3 días seguidos cada 2 semanas durante 8 semanas24. Sólo la dosis de 5 μg/kg fue efectiva, consiguiendo una reducción superior al 50% del PASI en 7 de 15 pacientes, pero 3 de los 15 abandonó el tratamiento debido a los efectos secundarios.
ANTI-CD80 Y CD86 (B7)
La familia de moléculas B7 (CD80 [B7-1] y CD86 [B7-2]) de las células presentadoras de antígeno regulan la activación de los linfocitos T enviando señales independientes de antígeno activadoras a través de CD28 o inhibidoras a través de CD152 (CTLA-4).
IDEC-114 es un acm Primatized® anti-B7-1 (CD80) del que se inició un estudio clínico de fase II en enero de 2001 (informe de la compañía). En los estudios de fase I/II se trataron 35 pacientes con cuatro infusiones de dosis variables. Un 40% alcanzaron una disminución de al menos el 50% en el PASI en algún momento del estudio. Además, los pacientes continuaron mejorando más allá del final del período de tratamiento alcanzando la mayor mejoría en el último día de seguimiento. Los efectos secundarios fueron leves (resfriados, escalofríos y cansancio) (informe de la compañía).
CTLA4Ig es una proteína de fusión entre la zona extracelular de CD152 y una IgG1, que se une a B7-1 (CD80) y B7-2 (CD86), expresado en las células presentadoras de antígeno. Se ha publicado un ensayo de fase I, abierto, en el que se trataron 43 pacientes con dosis intravenosa de 0,5 hasta 50 mg/kg los días 1, 3, 16 y 2925,26. Un 46% de los pacientes presentó una mejoría superior al 50% en el PASI, que fue mayor a mayor dosis, con mínimos efectos secundarios.
ANTI-CD154
CD154 es el ligando de CD40 en los linfocitos T y participa en las interacciones entre linfocitos T, B y células presentadoras de antígeno.
IDEC-131 es un acm humanizado anti-CD154 con el que se han iniciado estudios en fase II en enero de 2001 (informe de la compañía).
ANTI-ICAM-3
ICAM-3 es una molécula de adhesión que se expresa en células de la línea hematopoyética (monocitos, linfocitos y células dendríticas). Su ligando es LFA-1.
Se realizaron ensayos de fase I y I/II con un anticuerpo anti-ICAM-3 en los años 1998 y 1999 que no han tenido continuación (informe de la compañía).
ANTI-IL-8
La IL-8 es una quimiocina que desempeña un papel central en los procesos inflamatorios y que se encuentra elevada en la psoriasis.
Se han realizado ensayos clínicos de fase I usando ABX-IL8, un acm humano anti-IL-827. En ellos se han tratado 45 pacientes y se ha observado una mejoría relacionada con la dosis. Un 58% de los pacientes que recibieron 1 y 3 mg/kg intravenosos, una vez cada 3 semanas en cuatro ocasiones, alcanzaron más de un 25% de mejoría y un 21% de los pacientes alcanzó una mejoría de más del 50% en el PASI, frente a ningún paciente que mejoró más del 25% con placebo (informe de la compañía). Un ensayo de fase IIa en 94 pacientes con dosis de 3 y 6 mg/kg administrados de forma intravenosa cada 3 semanas en cinco infusiones ha confirmado su seguridad y efectividad. No se observó la formación de anticuerpos contra ABX-IL8 ni se observaron reacciones relacionadas con la infusión. La administración de dosis hasta 6 mg/kg fueron seguras y bien toleradas. No se observaron diferencias estadísticamente significativas entre la dosis de 3 y 6 mg/kg y los pacientes que tuvieron mejorías superiores al 75% del PASI mantuvieron esa respuesta hasta la semana 36. El análisis retrospectivo de los datos mostró que el efecto era mayor en los pacientes con PASI más severo (informe de la compañía). A partir de estos resultados se ha iniciado un estudio de fase IIb en febrero de 2001 con este anticuerpo en dosis de 100 y 300 mg intravenosos que hacen dosis totales entre 1 y 3 mg/kg (informe de la compañía).
ANTI-TNF-α
El factor de necrosis tumoral alfa (TNF-α) es una citocina implicada en múltiples procesos celulares. En la psoriasis su concentración está aumentada y se considera que está implicada en la síntesis de citocinas como la IL-8 o en el cúmulo de células inflamatorias.
Remicade® (infliximab) es un acm IgG1 quimérico murino-humano que ha sido aprobado para su uso en artritis reumatoide y la enfermedad de Crohn28. Se ha publicado un caso de una paciente cuya psoriasis mejoró al recibir tratamiento intravenoso con infliximab a 5 mg/kg para su enfermedad inflamatoria intestinal29. Existe publicado un estudio piloto abierto con nueve pacientes con artritis psoriásica, tratados con infliximab a dosis intravenosa de 5 mg/kg en las semanas 0, 2 y 6. En los ocho pacientes con lesiones cutáneas se observó una mejoría significativa del PASI. No se observaron efectos secundarios graves en ningún paciente30. Se ha publicado un ensayo de fase II, doblemente ciego, en 33 pacientes, comparando placebo con dosis de 5 y 10 mg/kg intravenosas en las semanas 0, 2 y 631. Los resultados han sido muy llamativos, con mejorías del PASI superiores al 75% en un 82% y 73%, respectivamente, de los pacientes tratados, sin observarse ningún efecto secundario importante. Es probable que se desarrolle un estudio fase III.
Enbrel® (etanercept) no es un monoclonal, es un agente bloqueador de TNF-α, obtenido mediante la fusión de IgG1 y el receptor de 75 kD de TFN-α. Su uso está aprobado en artritis reumatoide. Se han publicado algunos ensayos clínicos en psoriasis. Así, en un ensayo randomizado, doble ciego, en 60 pacientes con artritis psoriásica, se les añadió a su tratamiento (metotrexato, prednisona o antiinflamatorios no esteroideos) bien placebo o 25 mg de etanercept subcutáneo dos veces por semana durante 12 semanas32. De los 38 pacientes con psoriasis cutáneo un 26% de los tratados con etanercept tuvieron una disminución del 75% en el PASI frente a ninguno del placebo, con buena tolerancia y sin efectos secundarios. Posteriormente se ha desarrollado un ensayo en fase III con 205 pacientes, y tras los buenos resultados obtenidos, la compañía espera que se apruebe la indicación para el tratamiento de la artritis psoriásica a primeros del año 2002. En este grupo de pacientes, 128 tenían además psoriasis cutánea y un 23% logró una mejoría superior al 75% comparado con un 3% de los tratados con placebo. Por otra parte se ha usado en un estudio clínico con 112 pacientes con psoriasis sólo cutánea, logrando mejorías superiores al 75% en un 30% de los pacientes. Además, cuando 105 pacientes fueron tratados durante 6 meses, un 50% logró mejorías superiores al 75% y un 20% superiores al 90% (informe de la compañía).
ANTI-IFN-γ
El interferón gamma (IFN-γ) está implicado en la patogenia de la psoriasis.
El anticuerpo monoclonal SMART antigamma interferón está siendo ensayado en un estudio de fase I (informe de la compañía).
ANTI-C5
El factor 5 del complemento ha sido implicado en algunos procesos autoinmunes. Su activación y rotura genera los factores C5a, que es un potente factor quimiotáctico, y C5b, que es la molécula iniciadora de la formación del complejo de ataque de membrana.
El acm IgG humanizado inhibidor del factor 5 del complemento (5G1.1) ha sido utilizado en ensayos de fase I y I/II en lupus eritematoso sistémico y artritis reumatoide y se encuentra en fase Ib en el tratamiento de la psoriasis (informe de la compañía).
¿QUÉ HAY MAS ADELANTE?
El problema es seleccionar el acm que va a funcionar en el tratamiento. Se ha comprobado que los bioensayos o incluso los resultados obtenidos en modelos animales no son extrapolables al hombre, y acm que parecían funcionar mejor a priori in vitro o en ratones no lo demostraron después3,33. Además se ha comprobado que los efectos secundarios son distintos en animales, incluidos chimpancés, que en hombres, o que en enfermedades diferentes también son distintos. En este aspecto, el acm BB14/BF15 producía efectos secundarios graves en pacientes con dermatitis atópica y leves en pacientes con psoriasis11.
Después de todo esto parece claro que el único ambiente real para evaluar la eficiencia, efectos secundarios, vida media o producción de anticuerpos bloqueadores es el hombre y, además, con la limitación de una enfermedad determinada3. Además esto mismo se aplica a anticuerpos que actúen sobre la misma molécula o incluso sobre el mismo epítopo como hemos visto con los distintos acm anti-CD4 usados7,10,12,13.
En otras enfermedades como el trasplante o la enfermedad injerto contra huésped se han asociado estos acm con inmunosupresores como la ciclosporina o con otros acm para aumentar la eficacia y evitar efectos secundarios como la generación de anticuerpos bloqueadores. Ésta puede ser una línea de trabajo futura para el tratamiento de la psoriasis3.
Otro aspecto en desarrollo es la generación de inmunoconjugados o inmunotoxinas (bien acm conjugados con toxinas o simplemente de ligandos unidos a toxinas como el ejemplo del DAB389IL-2). Esta línea de trabajo tiene problemas que solucionar, como la posible ineficacia de los tóxicos para destruir las células diana, la inestabilidad de la unión del acm a la toxina (en uniones realizadas mediante modificaciones químicas en vez de por ingeniería genética), el aclaramiento rápido por el sistema mononuclear fagocítico, la inaccesibilidad a los espacios extravasculares, el desarrollo de anticuerpos contra las toxinas o por lo que su desarrollo no es muy dinámico actualmente.
De todas formas los tratamientos con acm o moléculas de biotecnología en la psoriasis parecen una realidad cercana. La realización de ensayos en fase III finalizados o en finalización con Xanelim® (efalizumab, anti-CD11a) o Amevive® (alefacept, anti-CD2) o la posibilidad de nuevas indicaciones para los ya aprobados Remicade® (infliximab, anti-TNF-α), Enbrel® (etanercept, anti-TNF-α) y Zenapax® (daclizumab, anti-CD25) van a modificar en los próximos años nuestra forma de tratar la enfermedad: infusiones intravenosas o inyecciones intramusculares o subcutáneas habitualmente de forma semanal. Sólo el precio y la duda de posibles efectos secundarios que aparezcan a largo plazo (como la activación de tuberculosis en pacientes tratados con Remicade® [infliximab]) puede ensombrecer el uso de estos tratamientos que, sobre todo, ofrecen un mínimo de efectos secundarios a corto plazo y una pauta de tratamiento muy cómoda en muchos casos.
NOTA FINAL
El Comité Consultor de Fármacos Dermatológicos de la FDA ha recomendado la aprobación de Amevive® para el tratamiento de la psoriasis. Se espera una respuesta de la FDA para agosto. Los resultados con efalizumab acaban de ser publicados (Gottlieb AB, Krueger JG, Wittkowski K, Dedrik R, Walicke PA, Garovoy M. Psoriasis as a model for T-cell-mediated disease: immunobiologic and clinical effects of treatment with multiple doses of efalizumab, an anti-CD11a antibody. Arch Dermatol 2002;138:591-600) aunque su desarrollo tiene más retrasos debido a que el nuevo sistema de producción presenta problemas, por lo que no se presentará la documentación hasta finales de 2002. El desarrollo de daclizumab en psoriasis ha sido suspendido ante la incapacidad de mantener la remisión de la psoriasis tratada con ciclosporina. Los resultados en fase II con HuMax-T4 son poco interesantes (un 28% tiene una mejoría superior al 25% del PASI). Los estudios en fase IIb con Abx-IL8 no han demostrado eficacia en la psoriasis, por lo que su desarrollo también ha sido suspendido. Infliximab ha demostrado una mejoría del PASI superior al 75% en un 80% de los pacientes tratados en la semana 10 en un ensayo en fase II con 33 pacientes. Etanercept ha sido aprobado por la FDA para el tratamiento de la artritis psoriásica y un ensayo fase II en psoriasis ha demostrado mejorías del PASI superiores al 75% en un 56% de los pacientes tratados durante 6 meses.