Se han identificado microARN (miARN) circulantes implicados en la regulación postranscripcional de genes del metabolismo de lípidos (miARN-33) y de la función vascular y angiogénesis (miARN-126). El objetivo de este estudio exploratorio ha sido evaluar los niveles plasmáticos de miARN-33 y miARN-126 en pacientes con psoriasis en placas y su relación con parámetros clínicos.
Material y métodosSe estudiaron once pacientes con psoriasis en placas (PASI [mediana] [25-75% percentil] 13 [9-14] y BSA 12 [11-15]) y un grupo pareado en edad y sexo de 11 controles sanos. Se analizaron factores de riesgo cardiovascular y la ateromatosis carotídea subclínica. Los miARN plasmáticos se evaluaron mediante la reacción en cadena de la polimerasa cuantitativa a tiempo real (qRT-PCR).
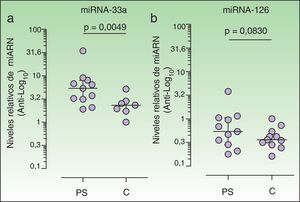
ResultadosLa media del grosor de la íntima carotídea (GIM) estaba aumentada en pacientes (0,57mm [0,54-0,61], n=11) respecto a controles (0,50mm [0,48-0,54], datos disponibles n=9) (test Mann-Whitney, p=0,0055). La expresión de miARN-33 en pacientes (5,34 [3,12–7,96], n=11) estaba significativamente aumentada respecto a controles (2,33 [1,71-2,84], n=7; solo se pudo detectar en 7 de 11) (test de Wilcoxon signed Rank, p=0,0049). No se observaron diferencias en los niveles de miARN-126 entre pacientes y controles. En pacientes se observó una correlación positiva entre miARN-33 e insulina (r=0,7289, p=0,0109, n=11); y una correlación negativa entre miARN-126 y GIM (r=–0,6181, p=0,0426, n=11).
ConclusiónLos pacientes con psoriasis presentaban niveles plasmáticos aumentados de miARN-33 (metabolismo de lípidos y glucosa), que se correlacionaban con los niveles de insulina. La valoración de miARN-33 circulante puede contribuir al conocimiento de las alteraciones inflamatorias sistémicas en psoriasis.
Circulating microRNAs (miRNA) are involved in the posttranscriptional regulation of genes associated with lipid metabolism (miRNA-33) and vascular function and angiogenesis (miRNA-126). The objective of this exploratory study was to measure plasma levels of miRNA-33 and miRNA-126 in patients with plaque psoriasis and evaluate their association with clinical parameters.
Material and methodsWe studied 11 patients with plaque psoriasis. The median Psoriasis Area Severity Index (PASI) was 13 (interquartile range [IQR], 9-14) and body surface area involvement was 12 (IQR, 11-15). Eleven healthy controls matched for age and sex were also included. We analyzed cardiovascular risk factors and subclinical carotid atheromatosis. Plasma miRNAs were evaluated using quantitative real-time polymerase chain reaction.
ResultsCarotid intima-media thickness was greater in patients (0.57mm; IQR, 0.54-0.61; n=11) than in controls (0.50mm; IQR, 0.48-0.54; data available for 9 controls) (P=.0055, Mann-Whitney). Expression of miRNA-33 in patients (5.34; IQR, 3.12-7.96; n=11) was significantly higher than in controls (2.33; IQR, 1.71-2.84; only detected in 7 of 11 controls) (P=.0049, Wilcoxon signed rank). No differences in miRNA-126 levels were observed between patients and controls. In patients (n=11), we observed a positive correlation between miRNA-33 and insulin levels (r=0.7289, P=.0109) and a negative correlation between miRNA-126 and carotid intima-media thickness (r=–0.6181, P=.0426).
ConclusionIn psoriasis patients plasma levels of lipid and glucose metabolism-related miRNA-33 are increased and correlated with insulin. The study of circulating miRNA-33 in psoriasis may provide new insights about the associated systemic inflammatory abnormalities.
En la patogenia de la psoriasis, enfermedad inflamatoria crónica de la piel y de las articulaciones, intervienen factores genéticos, ambientales e inmunológicos1,2. En las lesiones psoriásicas se han descrito alteraciones en la expresión génica de aproximadamente más de un millar de genes3,4. Recientemente se ha descrito la participación clave de moléculas pequeñas de ARN (20-25 nucleótidos), denominadas microARN (miARN o miR)5, en el control de la expresión génica de proteínas implicadas en el proceso inflamatorio de la piel afectada por psoriasis. Así se han identificado miARN implicados en la regulación de la diferenciación de los queratinocitos6 y de la función de las células T en psoriasis7.
Los miARN están conservados evolutivamente (miRBase, http://www.mirbase.org), y se unen a secuencias complementarias en las regiones 3¿ no traducidas de los mARN dianas, dando lugar a la inhibición de la traducción o a la degradación del mARN8. El resultado de la unión del miARN-mARN diana va a contribuir a la reducción de la cantidad de proteína producida8. Los miARN pueden tener como dianas múltiples mARN y actuar como reguladores de la expresión génica en la homeostasis de numerosos procesos celulares. Los miARN son una de las más abundantes e importantes clases de moléculas reguladoras génicas y constituyen un nuevo nivel de dicha regulación9. Estudios recientes han demostrado la presencia de miARN en la circulación sanguínea10. El origen celular de los miARN circulantes no está totalmente establecido; se postula que provengan en parte de células de la circulación sanguínea11. Alteraciones en los niveles de miARN en plasma se han descrito asociados a cambios fisiológicos y alteraciones patológicas12, lo que ha llevado a un aumento en el interés por su estudio como posibles biomarcadores10 y/o dianas terapéuticas13. Alteraciones en la expresión de miARN se han descrito en enfermedades inflamatorias autoinmunes crónicas14–16. En pacientes con psoriasis se ha descrito recientemente que los niveles de miARN circulantes están alterados y que la inhibición del factor de necrosis tumoral mediante el tratamiento con etanercept disminuye el nivel de expresión de miARN relacionados con inflamación y autoinmunidad17.
Recientemente se han identificado miARN circulantes implicados en la regulación postranscripcional de genes del metabolismo de lípidos18, entre ellos miARN-33, que está implicado en la regulación postranscripcional de genes del metabolismo del colesterol18,19. Además miARN-33 tiene como dianas otros genes implicados en el transporte de esteroles y el metabolismo de lipoproteínas de alta densidad (HDL), así como genes implicados en la oxidación de ácidos grasos y en el metabolismo de la glucosa18. El silenciamiento in vivo de miARN-33dio lugar a un aumento de los niveles de HDL y promovió el transporte reverso de colesterol18. Hay un gran interés en el estudio del papel de miARN-33 como posible diana de nuevas estrategias terapéuticas en el tratamiento de la aterosclerosis y de otras enfermedades metabólicas18. También se han identificado miARN circulantes en enfermedades cardiovasculares20, entre ellos miARN-126, que se ha demostrado que está implicado en la regulación postranscripcional de genes que desempeñan un papel en la función vascular y angiogénesis21.
Hay evidencia científica que indica que los enfermos con psoriasis presentan aumentos en la incidencia de factores de riesgo cardiovascular, síndrome metabólico, obesidad, dislipidemia, diabetes e hipertensión22,23. Asimismo, se han descrito similitudes importantes en los mecanismos inflamatorios presentes en aterosclerosis y psoriasis24. Por ello el objetivo de este estudio exploratorio ha sido evaluar los niveles plasmáticos de miARN-33 y miARN-126 en pacientes con psoriasis en placas y su relación con parámetros clínicos.
Materiales y métodoPacientes y controlesSe han estudiado 11 pacientes adultos con diagnóstico clínico de psoriasis en placas procedentes de la consulta de dermatología del hospital. Todos ellos fueron incluidos de forma consecutiva y firmaron un consentimiento informado. Siete pacientes no habían recibido ningún tratamiento sistémico previamente, y otros 4 llevaban al menos de 4 a 6 semanas sin tratamiento sistémico. El periodo de tiempo en el que se realizó la recogida las muestras y las pruebas fue de febrero a mayo de 2012. En ese periodo de tiempo se tomaron como controles un grupo pareado en edad y sexo de 11 voluntarios sanos y se hicieron las pruebas correspondientes. Los criterios de exclusión para pacientes y controles fueron la presencia de linfomas cutáneos u otros cánceres y la presencia de una enfermedad cardiovascular establecida (infarto o ictus cerebral).
Parámetros clínicos y de laboratorioLa gravedad de la psoriasis se determinó mediante los índices Psoriasis Area Severity Index (PASI) y Body Surface Area (BSA). En pacientes y controles se midió el peso, la talla y el perímetro abdominal y se calculó el índice de masa corporal a partir de estos datos (IMC, kg/m2; IMC>25, sobrepeso). La tensión arterial sistólica (TAS) y diastólica (TAD) se tomaron tras 10min de descanso y en 2 ocasiones más, obteniéndose los valores medios. De igual modo en pacientes y controles se midieron los niveles séricos de colesterol-HDL (C-HDL), colesterol-LDL (C-LDL), triglicéridos (TG), glucosa, insulina, velocidad de sedimentación globular (VSG), proteína C reactiva (PCR) y fibrinógeno. La prevalencia de síndrome metabólico fue calculada siguiendo los criterios de la ATP-III25. Se consideró que tenían síndrome metabólico si presentaban 3 o más de los siguientes criterios: circunferencia abdominal>102cm en hombres y>88cm en mujeres; velocidad de sedimentación globular (VSG)>10mm/h; hipertrigliceridemia>150mg/dl; C-HDL<40mg/dl en hombres y<50mg/dl en mujeres; presión arterial>130/85mmHg o glucosa en ayunas>110mg/dl.
Muestras de sangre y plasmaLa recogida de muestras de sangre se llevó a cabo siguiendo los procedimientos estándar (tubos K2-EDTA, sistema Vacutainer BD; BD Diagnostics, Franklin Lakes, NJ, EE. UU.) en el laboratorio de análisis del hospital. El plasma se aisló mediante centrifugación en gradiente de Ficoll, según el procedimiento descrito2. Las alícuotas del plasma se guardaron a –80°C hasta la realización de los análisis.
Extracción de microARN y reacción en cadena de la polimerasa cuantitativa a tiempo real (qRT-PCR)El ARN total se aisló de 200μl de plasma de pacientes (n=11) y de controles (n=11) suplementado con 3,5μl de 1,6×108 copias/μl de Control miRNeasy Serum/Plasma Spike-In (Qiagen, catálogo n.° 219.610), usando el kit de Qiagen miRNeasy Mini Kit (catálogo n.° 21.704) y siguiendo las instrucciones del fabricante. La calidad del ARN total se analizó mediante el sistema Experion Automated Electrophoresis Sation (Bio-Rad) y la cantidad se midió por NanoDrop (Termo Fisher). La síntesis de cADN se realizó a partir de 1μg de ARN total usando miScript II Reverse Transcription Kit (Qiagen) siguiendo las condiciones recomendadas por el fabricante. Las qRT-PCR se realizaron en un termociclador CFX96 (Bio-Rad); cada 10μl de mezcla de reacción de PCR contenía: 1X QuantiTec SYBR Green PCR Master Mix; 1X miScript Universal Primer, 1X cebador específico de miARN y 10ng de cADN. Se utilizaron cebadores miARN-específicos de Qiagen (Homo sapiens miRNA-33a; n.° catálogo: MS00003304; y Homo sapiens miRNA 126-1; n.° catálogo: MS00003430). Se utilizó el siguiente programa de PCR: 15min de incubación a 95°C para la activación de la Taq ADN polimerasa de «arranque caliente» (hot start), seguido de 40 ciclos de 15seg (s) a 94°C, 30s a 55°C y 30s a 70°C. La fluorescencia emitida por el SyBrGreen se midió al final del paso extensión de cada ciclo. La especificidad de amplificación por PCR se comprobó mediante la realización de una curva de desnaturalización del amplicón una vez finalizada la PCR. Para ello se efectuó un calentamiento desde 55°C a 90°C, incrementando la temperatura 0,5°C cada 10s. Las cuantificaciones se realizaron a partir de 3 reacciones de PCR por cada muestra de paciente y de cada control. El ciclo umbral (Ct) se calculó por el programa informático del equipo de la PCR cuantitativa en tiempo real, y fue el ciclo en el que comenzaba a detectarse el amplicón de forma exponencial. Los resultados obtenidos se normalizaron internamente a los niveles del miRNeasy Serum/Plasma Spike In Control Ce-miR-39_1 (cebador de Qiagen, n.° catálogo: MS00019789). Los niveles relativos de transcrito en cada muestra se calcularon usando el método de 2-ΔΔCt26.
UltrasonografíaEn los pacientes (n=11) y los controles (n=9) se realizaron ultrasonografías doppler-color (Acuson Antares, Siemens, Berlín, Alemania), utilizando un transductor de 10-5MHz, con programa de troncos supraaórticos (TSA), registrándose la presencia de placas de ateroma, de acuerdo con la metodología previamente descrita2,23. Se consideró la presencia de placa de ateroma si la media del grosor de la íntima carotídea (GIM) (mm)>1,5cm.
EstadísticaLos resultados se presentan mediante la mediana y el 25-75% percentil, salvo indicaciones específicas. Los niveles de expresión relativos de miARN en el plasma de los pacientes con respecto a los controles se analizaron utilizando el test no paramétrico Wilcoxon Signed Rank, comparando la mediana del grupo de los pacientes con respecto a la mediana del correspondiente grupo control. En los casos indicados, para analizar las diferencias entre pacientes y controles se utilizó la prueba U de Mann-Whitney. Para el análisis de variables cualitativas se utilizó el test de Fischer. Para calcular las correlaciones se utilizó el test de Spearman. Se consideraron diferencias estadísticamente significativas los valores de p<0,05 (GraphPad Prism v.5.01; GraphPad Software, Inc., CA, EE. UU.).
ÉticaEl protocolo del estudio fue aprobado por las comisiones de investigación y los comités de ética del hospital y del instituto de investigación.
ResultadosDatos clínicosLa distribución por género en el grupo de casos y controles fue similar, 5 hombres y 6 mujeres, con una mediana de edad algo superior en el grupo de pacientes con psoriasis pero sin diferencias estadísticamente significativas (tabla 1).Todos los participantes eran caucasianos. En los pacientes las medianas de los índices de actividad de la enfermedad PASI y BSA eran>10 (tabla 1). La mediana de la duración de la enfermedad fue de 5 años.
Datos clínicos
| Pacientes con psoriasis (Ps)(n=11) | Controles(C) (n=11) | p*(Ps vs. C) | |
| Mujeresa/hombresa | 6 (55)/5 (45) | 6 (55)/5 (45) | |
| Edad (años)b | 34 (25-42) | 28 (26-42) | 0,6924 |
| Duración enfermedad (años)b | 5 (1-18) | -- | -- |
| PASIb | 13 (9-14) | -- | -- |
| BSA (MAX)b | 12 (11-15) | -- | -- |
| Media del grosor de la íntima carotídea (GIM) (mm)b | 0,57 (0,54-0,61) | 0,50 (0,48-0,54)c | 0,0055 |
| VSGb (mm/h) | 8 (6-11) | 5 (5-7) | 0,0743 |
| PCRb (mg/dl) | 2,1 (0,17-2,5) | 0,21 (0,05-1,78) | 0,1579 |
| Índice de masa corporalb (IMC) (kg/m2) | 28,33 (23,8-31,8) | 24,53 (20,49-26,72)d | 0,0620 |
| Circunferencia abdominalb (cm) | Hombres88 (80,3-109,5) | Hombres92 (92-98) | 0,5556 |
| Mujeres99,8 (84,3-108,9) | Mujeres81,5 (76-94,3) | 0,0777 | |
| Concentración sérica de triglicéridosb (mg/dl) | 80 (54-112) | 106 (77-150) | 0,2643 |
| Colesterol-HDL (C-HDL)b (mg/dl) | Hombres49 (41,5-72,25) | Hombres51 (41-63,5) | 1 |
| Mujeres57 (46,8-114,5) | Mujeres74 (66-83,5) | 0,4848 | |
| C-LDLb(mg/dl) | 133 (67-160) | 127 (114-154) | 0,7676 |
| Glucosab (mg/dl) | 84 (78-103) | 80 (62-88) | 0,1577 |
| Insulinab (microU/ml) | 7,3 (7-13,2) | 8,2 (7,1-10,2) | 0,8954 |
| Tensión arterial sistólicab (mm Hg) | 120 (107-126) | 123 (114-131)d | 0,3783 |
| Tensión arterial diastólicab(mm Hg) | 73 (66-82) | 73 (70-86,3)d | 0,4579 |
| Fibrinógenob (mg/dl) | 389 (375-456) | 304 (243-345)c | 0,0055 |
La mediana del GIM estaba aumentada en los pacientes (0,57mm [0,54- 0,61]) respecto a controles (0,50mm [0,48-0,54]) (p=0,0055). Uno de los pacientes presentaba placas de ateroma carotídeas.
No se observaron diferencias significativas entre pacientes y controles en los niveles de C-HDL, C-LDL y de TG, glucosa e insulina (tabla 1). Uno de los pacientes presentaba síndrome metabólico de acuerdo con los criterios de la ATP-III25. Se observaron correlaciones positivas entre niveles de TG y niveles plasmáticos de glucosa (r=0,7900; p=0,0038, n=11), de insulina (r=0,8018; p=0,0030, n=11) y fibrinógeno, (r=0,6651; p=0,0255, n=11). Los niveles de C-LDL se correlacionaron con la duración de la enfermedad (r=0,8219; p=0,0019, n=11). Por otro lado, se correlacionaron de forma inversa los niveles de C-HDL y el PASI (r=–0,6391; p=0,0343, n=11), el IMC (r=–0,6273; p=0,0388, n=11) y la TAS (r=–0,6651; P=0,0255, n=11). En lo referente a los parámetros de obesidad no se observaron diferencias en los valores de IMC, de VSG, ni circunferencia abdominal entre los pacientes y los controles (tabla 1). En los pacientes se observó una correlación entre el IMC con los valores de circunferencia abdominal (r=0,9091; p=0,0001), la glucosa (r=0,6895; p=0,0189) y la insulina (r=0,7973; p=0,0033). Asimismo, los pacientes presentaron cifras más elevadas del marcador inflamatorio y proteína de coagulación fibrinógeno que los controles (tabla 1).
Aumento de los niveles plasmáticos de microARN-33 en pacientes con psoriasisSe observó un aumento significativo de los niveles de expresión relativa del miARN-33 en plasma de pacientes con psoriasis (5,34 [3,12-7,96]) con respecto a los controles (2,33 [1,71–2,84], test Wilcoxon Signed Rank, p=0,0049). Los niveles de expresión de miARN-33 en el plasma en 3 de los controles fueron bajos, de forma que solo se pudo cuantificar correctamente miARN-33 en el plasma de 7 de los 11 controles estudiados (fig. 1[a]). En el grupo de pacientes se observó una correlación positiva entre los niveles plasmáticos de miARN-33 y de insulina (r=0,7289, p=0,0109), no presente en los controles (r=0,1071, p=0,8397, n=7). No se ha encontrado ninguna correlación entre la expresión en plasma de miARN-33 y parámetros clínicos como el peso o el IMC ni en pacientes ni en controles. Adicionalmente, se calculó el índice de resistencia insulínica mediante homeostasis model assessment ([HOMA]=[insulina×glucosa]/22,5) (HOMAIR); expresando la insulina en μU/ml y la glucosa en mmol/L, no observándose diferencias entre los casos y los controles. (HOMAIR en pacientes, (1,5 [1,3-3,4], y en controles (1,5 [1,2-2,02]; test Mann Whitney, p=0,4307) Sin embargo, se ha observado que en el grupo de los pacientes existe una correlación positiva entre los niveles de expresión en plasma de miARN-33 y el HOMAIR (r=0,6545; p=0,0289), no presente en los controles (r=–0,2143; p=0,6445).
Los niveles de expresión en plasma de miARN-33a y miARN-126 en cada muestra se calcularon mediante el método de 2-ΔΔCt26(Material y métodos). Los resultados se presentan mediante la mediana y el 25-75% percentil, y en escala logarítmica en base 10; en el eje vertical se indican los valores anti-logarítmicos. Para el análisis de los resultados se utilizó el test Wilcoxon Signed Rank y se comparó la mediana del grupo de los pacientes (n=11) con respecto a la mediana del grupo control (n=11). En el panel (a) la expresión de miARN-33 en el plasma de los controles fue más baja; se cuantificó miARN-33 en el plasma de 7 de los 11 controles estudiados (Resultados). Para el análisis se utilizó el software Graph-Pad Prism versión 5.01.
Por el contrario, no se observaron aumentos significativos en los niveles de expresión relativa de miARN-126 en el plasma de los pacientes (0,5384 [0,2839-1,052]) respecto a los controles (0,361 [0,2806-0,5371]) (p=0,0830).
Además se observó una correlación negativa entre los niveles de miARN-126 circulantes y los valores de GIM en los pacientes (r=–0,6181; p=0,0426), no presente en los controles (r=–0,3333; p=0,3807).
Por último, en el grupo de pacientes con psoriasis no se observaron correlaciones significativas entre los niveles de expresión en plasma de miARN-33 y de miARN-126 y otros parámetros clínicos analizados.
DiscusiónEl resultado original de este estudio es la observación de que los niveles plasmáticos de miARN-33, implicado en la regulación postranscripcional de genes del metabolismo del colesterol y de la glucosa18,19, están aumentados en pacientes con psoriasis en placas respecto a los controles, y además se correlacionan positivamente con sus niveles de insulina y con el índice HOMAIR.
Actualmente hay un interés creciente en el estudio de los miARN circulantes por su posible papel como biomarcadores10. Los miARN circulantes pueden tener una función clave, aún por esclarecer, en la comunicación intercelular27. La familia de miARN-33a y b están codificados en los intrones de los genes que codifican para un factor de transcripción que se une al elemento regulador del esterol (Sterol-regulatory element-binding protein-2 [SREBP-2])18,19. Se ha descrito que los miARN-33 tienen un papel importante en la represión postranscripcional de los transportadores de colesterol A1 (ATP-binding cassette transporters A1 [ABCA1])18, dando lugar a alteraciones en la regulación del flujo del colesterol en macrófagos. Por otro lado, la manipulación de los niveles de los miARN-33 puede dar lugar a alteraciones de los niveles circulantes de C-HDL19. Resultados similares se han descrito en ratones deficientes en miARN-33, sugiriendo que el bloqueo de este miARN podría contribuir a la prevención de la aterosclerosis28. Los miARN son moléculas reguladoras génicas que pueden tener como dianas múltiples mARN y regular numerosos procesos celulares. Así, se ha descrito que en situaciones de hiperinsulinemia aumentos en la expresión de factores de transcripción SREBP y de miARN-33 pueden contribuir a los niveles plasmáticos elevados de TG y disminuidos de C-HDL, criterios incluidos en la definición del síndrome metabólico18. Otras dianas descritas de los miARN-33 son genes implicados en la oxidación de ácidos grasos y en el metabolismo de la glucosa18. Entre otros, Sirtuina 6 (Sirt6), histona deacetilasa dependiente de NAD, implicadas en vías moleculares del envejecimiento, inflamación y cáncer, y de IRS2, el sustrato 2 para el receptor de insulina18. Se ha descrito que entre los genes diana de los miARN-33 también se encuentran genes implicados en el ciclo celular, proliferación celular e inflamación18. Además, en pacientes con cáncer de vejiga los niveles de expresión de miARN-33 se ha descrito que se correlacionan inversamente con el estado de la enfermedad29, contándose entre sus dianas descritas las vías de señalización para el factor de crecimiento tumoral-beta, TGF-beta29.
Por otro lado el miARN-126 se encuentra entre los denominados angiomiRs, miARN que se han identificado como reguladores clave en el desarrollo vascular y la angiogénesis30. Se ha descrito que pueden ser detectados en plasma, suero y macropartículas circulantes30. Así, se ha descrito que pacientes con enfermedad coronaria arterial o con diabetes presentaban una reducción en los niveles de miARN-126 circulantes comparados con controles sanos20. Recientemente se ha descrito que el tratamiento con etanercept disminuye el nivel de expresión de miARN-126 en el suero de pacientes con psoriasis17. Sin embargo, en nuestro estudio no observamos diferencias significativas en sus niveles en los pacientes con psoriasis respecto a los controles, aunque sí hay una correlación inversa entre miARN-126 y GIM. En el grupo de pacientes con psoriasis estudiado solo uno presentaba placas de ateroma y reunía los criterios de síndrome metabólico.
Nuestro estudio ha obtenido resultados significativos que sugieren la existencia de funciones biológicas de interés para miARN-33 en psoriasis. No obstante, su principal limitación es el número pequeño de la muestra.
En conclusión, el estudio de la expresión de miARN circulantes, como miARN-33, en el plasma de pacientes con psoriasis puede contribuir a un mejor conocimiento de los mecanismos implicados en las alteraciones inflamatorias sistémicas de dichos pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónFondo Social Europeo (European Commission-European Regional Development Fund [ERDF/FEDER]); CSIC-PI 200820I216 (MZ); Junta de Andalucía (JA), Consejerías Innovación-Ciencia-Empresa y Educación-Ciencia (CVI 226 y PC08-CTS-04046) (JS y MZ); ME-MICINN (SAF-2008-03685) (JS y MZ); SAF-2011-27261 (JS); JAE-Doc CSIC-FEDER (Contrato Postdoctoral; SGR); JA-Consejería de Igualdad, Salud y Políticas Sociales-HCUSC.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.