El herpes genital es una infección crónica que se caracteriza por una reactivación periódica, con capacidad tanto de producir una enfermedad sintomática en el huésped como de excreción viral asintomática. Hoy en día constituye la primera causa de ulceración genital y representa un importante problema de salud pública, con considerables repercusiones clínicas, psicológicas y económicas.
Se revisan y actualizan las distintas opciones y pautas terapéuticas disponibles en la actualidad, basadas fundamentalmente en el empleo por vía sistémica de los fármacos antivirales aciclovir, valaciclovir y famciclovir. Por otro lado, se pone especial énfasis en la prevención y el manejo de esta infección en situaciones particulares, como en embarazadas, en niños, o en pacientes inmunodeprimidos.
Genital herpes is a chronic infection characterized by periodic reactivation. It can produce symptomatic disease in the host although asymptomatic viral excretion can also occur. It is currently the main cause of genital ulceration and an important public health problem that has substantial clinical, psychological, and economic repercussions.
This review analyzes the currently available therapeutic options and regimens, which are based mainly on systemic use of antiviral agents such as aciclovir, valacyclovir, and famciclovir. In addition, special emphasis is placed on the prevention and management of this infection in specific situations, such as pregnant, pediatric, and immunocompromised patients.
El herpes genital es una de las enfermedades de transmisión sexual con mayor distribución en la población mundial y representa la primera causa de ulceración genital.
Hoy en día constituye un importante problema de salud pública, con considerables repercusiones físicas, psíquicas y económicas, que además aumenta el riesgo de transmisión y de contagio del virus de la inmunodeficiencia humana (VIH)1.
En la actualidad, aproximadamente el 90 % de los herpes genitales es imputable al virus herpes simple (VHS)-2, mientras que el 10 % restante está producido por el VHS-1. Se estima que la seroprevalencia del VHS-2 en los países desarrollados está en torno a un 15–25 %2,3, y la del VHS-1 estaría sobre un 65 %. En España los estudios más recientes muestran que la prevalencia del VHS-2 está por debajo de la de los países de nuestro entorno, con un 3,5 %4.
El ser humano es el único reservorio de la infección por VHS2. El VHS-2 se transmite por vía sexual, tanto a partir de lesiones cutáneo-mucosas como a través de secreciones contaminadas sin clínica aparente, mientras que el VHS-1 lo hace habitualmente por vía orogenital. Más de la mitad de los pacientes infectados por el VHS-2 experimenta episodios de excreción asintomática del virus, por lo que este mecanismo constituye la forma de transmisión más importante, y se observa hasta en un 70 % de los casos5. La transmisión del VHS-2 de un hombre a una mujer es mucho más frecuente que viceversa2. La primoinfección genital por ambos virus se aprecia más frecuentemente en adultos jóvenes y suele ser asintomática. La infección genital por el VHS-1 se caracteriza por una excreción viral asintomática, una frecuencia de transmisión y una frecuencia derecurrencias menores que las provocadas por el VHS-21. El hecho de que la mayoría de las transmisiones sean secundarias a episodios de excreción viral asintomática y que las primoinfecciones también suelan ser asintomáticas, provoca que la mayoría de los pacientes seropositivos para el VHS-2 desconozcan que están infectados.
Fármacos antiviralesActualmente existen tres fármacos antivirales aprobados para su empleo en el herpes genital: el aciclovir, el valaciclovir y el famciclovir6,7.
Los antivíricos orales penetran en las células infectadas actuando como análogos de los nucleósidos y se unen a la timidín cinasa viral, resultando en su fosforilación. Posteriormente, los antivirales son fosforilados de nuevo por enzimas celulares y compiten con los nucleósidos para unirse a la ADN polimerasa viral, provocando una inactivación de la enzima y una reducción de la replicación viral.
El aciclovir es un análogo acíclico de la guanosina que inhibe la enzima ADN polimerasa viral actuando como un inhibidor competitivo de la guanosina trifosfato8. Tras la ingesta oral se fosforila inicialmente por la timidín cinasa viral y luego por las cinasas celulares a aciclovir trifosfato, que se une a la ADN polimerasa viral, inhibiéndola y actuando como un finalizador de la cadena de ADN.
Los efectos secundarios del aciclovir son raros e incluyen cefaleas, náuseas, diarreas y toxicidad renal, por lo que en pacientes con insuficiencia renal hay que reajustar las dosis. Excepcionalmente también se han descrito manifestaciones neuropsiquiátricas como desorientación, temblores, delirio o alteraciones del habla6.
La principal limitación del aciclovir es su baja biodisponibilidad (15–20 %), por lo que es necesario administrarlo en dosis frecuentes a lo largo del día (generalmente repartido en 5 tomas).
El valaciclovir es un profármaco del aciclovir con mucha mayor biodisponibilidad por vía oral (65 %), que consigue unos niveles en sangre comparables a los del aciclovir intravenoso9,10. Los efectos adversos son similares a los del aciclovir.
El famciclovir es un profármaco que tiene como metabolito activo el penciclovir, que es un análogo acíclico de la guanosina. Sufre un proceso de fosforilación similar al aciclovir y también inhibe la ADN polimerasa viral, bloqueando la síntesis y la replicación viral. El penciclovir trifosfato posee una vida media intracelular mucho más prolongada que el aciclovir trifosfato, ya que persiste de 10 a 20 horas en las células infectadas por el virus11. El famciclovir tiene también una biodisponibilidad mayor que el aciclovir y el valaciclovir (77 %), y una tolerancia y efectos adversos similares al aciclovir. En vista de la historia natural de las infecciones por el VHS, de la elevada biodisponibilidad del famciclovir y de su prolongada vida media, este fármaco instaurado de forma precoz puede resultar de gran ayuda en el manejo de las recurrencias de infecciones por el VHS.
Aunque de forma rara, se han descrito reacciones alérgicas al aciclovir, valaciclovir y famciclovir.
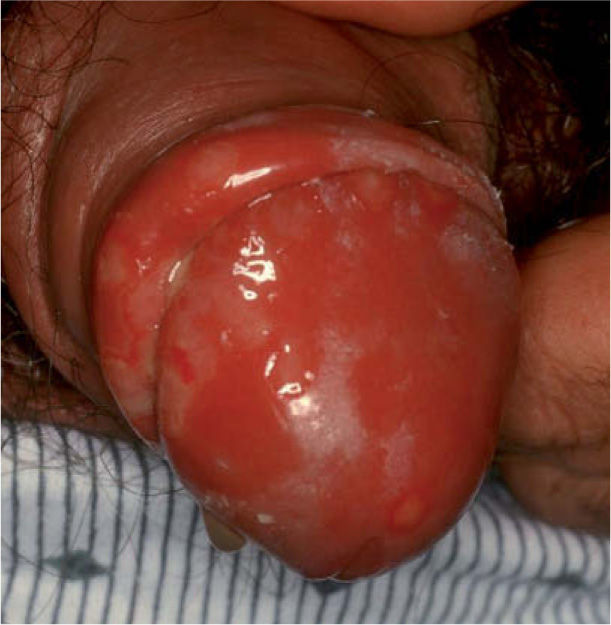
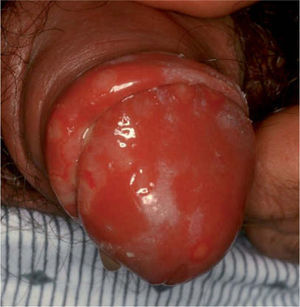
Tratamiento de la primoinfecciónLa primoinfección por herpes genital es con frecuencia asintomática. El herpes genital primario sintomático se presenta por lo general una semana después del contacto con el virus, aunque puede aparecer entre 2 días y 3 semanas después del contagio. Entre 12 y 24 horas antes de la aparición de las lesiones cutáneo-mucosas aparecen pródromos a modo de hipoestesias o disestesias (prurito, quemazón, dolor, etc.). Al no existir inmunidad previa, las manifestaciones clínicas iniciales habituales consisten en la aparición de pápulas y vesículas, que evolucionan de forma rápida a erosiones y úlceras en gran número, con contornos policíclicos, y generalmente rodeadas por un halo eritematoso y asociadas con intenso dolor (fig. 1). Las lesiones genitales se acompañan habitualmente de linfadenopatías inguinales dolorosas, y en ocasiones de clínica sistémica como fiebre y mialgias. La primoinfección herpética sintomática es más frecuente en el sexo femenino, y las manifestaciones clínicas suelen ser más graves que en los varones. Sin tratamiento las lesiones suelen curar espontáneamente en menos de 4 semanas. El riesgo de contagio se prolonga hasta la curación completa de las lesiones.
El uso de fármacos antivirales es beneficioso en la mayoría de los pacientes que presentan síntomas de infección herpética. Con ellos se consigue una curación más rápida de las lesiones y se atenúan los síntomas, pero desafortunadamente no se consigue erradicar el virus latente y, por tanto, las recidivas, aunque sí disminuyen en tiempo e intensidad.
En el tratamiento de la primoinfección se pueden utilizar el aciclovir, el valaciclovir y el famciclovir por vía oral.
La duración recomendada es de 7 a 10 días, aunque en cualquiera de los casos las terapias con antivirales deben prolongarse hasta que las úlceras estén completamente cicatrizadas. Las pautas recomendadas para el tratamiento de la infección genital primaria por el VHS se encuentran resumidas en la tabla 112.
Pautas recomendadas en la primoinfección herpética genital
| Aciclovir |
| 200mg vía oral 5 veces al día durante 7-10 días |
| 400mg vía oral 3 veces al día durante 7-10 días |
| Valaciclovir |
| 1g vía oral 2 veces al día durante 7-10 días |
| Famciclovir |
| 250mg vía oral 3 veces al día durante 7-10 días |
Adaptada de Centers for Disease Control and Prevention12.
Normalmente se trata de una infección benigna y autolimitada, pero en las primoinfecciones pueden surgir complicaciones de diversa índole, fundamentalmente debidas a la diseminación hematógena del virus, entre las que destacan las neurológicas, las psíquicas, la afectación cutánea generalizada, e incluso en algunos casos la afectación visceral (hepatitis, artritis, neumonitis, etc.). La complicación neurológica más frecuente es la meningitis aséptica, aunque también pueden desarrollarse síndrome de GuillainBarré, encefalitis, radiculomielopatía lumbosacra y mielitis transversa.
En caso de que surjan complicaciones se recomienda el tratamiento endovenoso con aciclovir en dosis de 5–10mg/kg de peso cada 8 horas, generalmente entre 7 y 10 días. Si se experimenta una rápida mejoría clínica se puede pasar a administrar el tratamiento de la vía endovenosa a la vía oral hasta la resolución completa de las manifestaciones12.
Tratamiento de las recurrenciasUna vez que se ha producido la infección primaria, el virus permanece en un estado latente en los ganglios sensitivos sacros. Las recurrencias del herpes genital se producen por una reactivación de esta infección latente, que se ve favorecida por factores como la fiebre, el estrés o la menstruación (herpes catamenial). De este modo, el virus migra desde las células gliales de los ganglios dorsales a través de las fibras nerviosas sensitivas a la región genital.
Las recurrencias clínicas se presentan en torno a un 50 % de los pacientes portadores de anticuerpos anti-VHS, generalmente a partir de los 4 meses del brote inicial, y son mucho más frecuentes en los pacientes con herpes genital por el VHS-2 que por el VHS-1. La posibilidad de recurrencia es mayor en el varón, si bien los episodios son más dolorosos en la mujer.
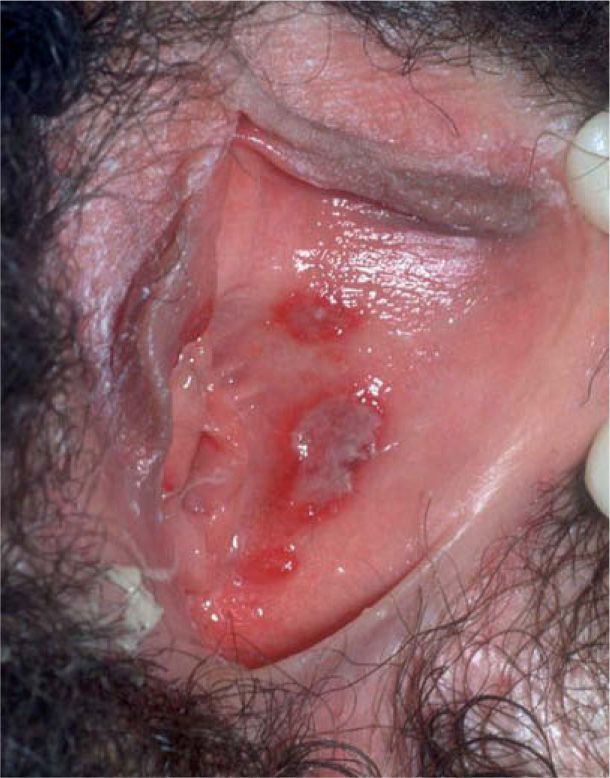
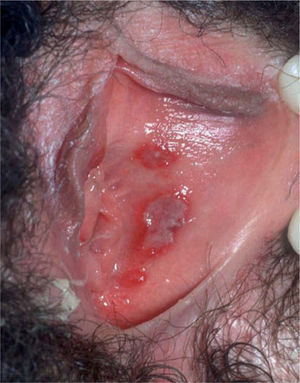
Las manifestaciones clínicas de las recidivas son menos intensas que las que aparecen en el curso de una primoinfección (fig. 2) y la duración es menor, y en ocasiones pueden ser distintas al cuadro vesículo-ulcerativo clásico, con manifestaciones clínicas inespecíficas como irritación, edema, costras o agrietamiento13.
Si bien hasta la fecha no hay una cura definitiva para la infección por el VHS, existen fundamentalmente dos estrategias terapéuticas para el manejo de las recidivas del herpes genital: tratar los brotes cuando ocurren (terapia episódica), o intentar prevenir futuros brotes (terapia supresora).
La terapia episódica se pone en práctica cuando se presentan los síntomas de un brote. Con el tratamiento de las recidivas se administra un fármaco antivírico por vía oral durante varios días, generalmente de 3 a 5, y se pretende acortar la duración del episodio e intentar aliviar los síntomas de la infección, aunque no altera la frecuencia de las recurrencias. El tratamiento ha de instaurarse, a ser posible, en el momento en que se manifiestan los pródromos o en el mismo día de aparición de las lesiones. No tiene efectos sobre los episodios subclínicos y no ha demostrado reducir el riesgo de transmisión. La terapia episódica es apropiada para personas con recidivas infrecuentes o leves, que no quieren tomar medicación a diario, que no están preocupadas por la frecuencia de las recidivas, o que no son sexualmente activas14.
Por otro lado, si lo que se pretende es disminuir el número de recurrencias o reducir el riesgo de transmisión del herpes genital a parejas sexuales, lo recomendable es emplear la terapia supresora15-17. Con esta estrategia terapéutica se administra un fármaco antiviral de forma diaria conla finalidad de evitar la reactivación del virus. Está recomendada en pacientes con más de 6 episodios al año, pudiendo reducirlos hasta en un 70–80 %18,19.
También se puede emplear la terapia supresora de forma intermitente, administrando el fármaco antivírico durante un tiempo limitado para reducir la probabilidad de aparición de un brote en algún periodo determinado de la vida del paciente, como en el momento del parto.
La terapia supresora es apropiada para pacientes con múltiples recidivas o recidivas graves, para pacientes que muestran mucha inquietud ante posibles recurrencias, o para pacientes preocupados por la posibilidad de transmitir la infección a parejas sexuales. Las pautas recomendadas están mencionadas en la tabla 212.
Pautas recomendadas en el tratamiento supresor del herpes genital
| Aciclovir |
| 400mg vía oral 2 veces al día |
| Valaciclovir |
| 500mg vía oral 1 vez al día |
| 1g vía oral 1 vez al día |
| Famciclovir |
| 250mg vía oral 2 veces al día |
Adaptada de Centers for Disease Control and Prevention12.
La decisión de emplear el tratamiento episódico o supresor para el manejo de las recurrencias del herpes genital requiere un consenso entre el paciente y el médico.
Como consideraciones conviene destacar que la replicación del virus es más activa en las primeras 24 horas tras la aparición de las lesiones, cuando la mayoría se encuentra en fase de vesícula. Por tanto, el mejor momento para obtener un beneficio clínico de los agentes antivirales se sitúa en el breve y precoz periodo de tiempo en el que la replicación vírica predomina sobre la respuesta inmune del huésped, que también se desarrolla rápidamente. Por este motivo, la terapia antiviral debe instaurarse de forma muy precoz si se pretende obtener un máximo beneficio de la misma, y la estrategia más adecuada consistiría en instruir al paciente para que disponga de medicación y pueda así autoadministrársela lo antes posible tras empezar a notar los síntomas prodrómicos14,20,21.
En cuanto a las diversas opciones terapéuticas usadas como tratamiento episódico, el aciclovir está aprobado durante 5 días, aunque también ha demostrado ser efectiva una pauta de tan sólo 2 días17. El aciclovir es efectivo, pero su baja biodisponibilidad requiere dosis muy frecuentes. El valaciclovir tiene una mayor biodisponibilidad que el aciclovir y se ha aprobado para el tratamiento episódico en pautas de 3 días. La alta biodisponibilidad de famciclovir (77 %), unida al rápido inicio de la replicación viral, permite que este fármaco sea muy eficaz en el tratamiento de los brotes de herpes genital. Asimismo, su farmacocinética posibilita una fácil administración y el tratamiento se puede cumplimentar de un modo mucho más sencillo que conotros antivirales11,20,22.
Varios ensayos clínicos recientes han demostrado que regímenes de altas dosis de terapia antiviral con famciclovir, administrado tan sólo un día, también han sido efectivos tanto para el tratamiento episódico de los brotes de herpes genital (famciclovir 1g dos veces al día), como de los de herpes labial (famciclovir 1.500mg una sola vez al día)21.
La pauta del famciclovir un solo día parece inhibir la replicación viral lo suficiente como para reducir de forma significativa tanto los síntomas como el daño tisular característicos de un brote completo, previniendo la progresión a una recurrencia completa en algunos casos. Esta forma de administración tiene la gran ventaja de que tan sólo debe administrarse durante un solo día, a diferencia de las pautas convencionales de tratamiento episódico, que duran de 3 a 5 días, por lo que el grado de cumplimentación de la misma y la satisfacción del paciente mejoran, y pueden permitir un mejor manejo global de las recurrencias de herpes genital.
Aunque no hay estudios que confronten la terapia de un solo día con famciclovir con otros antivirales, los pacientes que han recibido este tratamiento experimentaron efectos similares a los observados con las terapias tradicionales más prolongadas14,23-29.
Finalmente, en términos de comparación entre la terapia supresora con valaciclovir y la episódica con valaciclovir, la supresora ha demostrado tener un mayor impacto en medidas como frecuencia de recurrencias y quemazón. De todas formas, tanto una como otra mejoraron considerablemente la calidad de vida de pacientes con herpes genital recurrente, por lo que ambas estrategias son beneficiosas en pacientes con herpes recidivante30.
Asimismo, el valaciclovir parece ser algo mejor que el famciclovir en el tratamiento supresor del herpes genital y para reducir la excreción del virus17. Las pautas recomendadas para el tratamiento episódico del herpes genital se hallan descritas en la tabla 312.
Pautas recomendadas en el tratamiento episódico del herpes genital
| Aciclovir |
| 400mg vía oral 3 veces al día durante 5 días |
| 800mg vía oral 2 veces al día durante 5 días |
| 800mg vía oral 3 veces al día durante 2 días |
| Valaciclovir |
| 500mg vía oral 2 veces al día durante 3 días |
| 1g vía oral 1 vez al día durante 5 días |
| Famciclovir |
| 125mg vía oral 2 veces al día durante 5 días |
| 1g vía oral 2 veces al día durante 1 día |
Adaptada deCenters for Disease Control and Prevention12.
Aproximadamente un 2 % de las mujeres que están infectadas por el VHS-2 entra en contacto con el virus durante el embarazo31. El 90 % de estas mujeres están infradiagnosticadas porque son asintomáticas o tienen síntomas sutiles que se confunden con otras patologías. Para poderlas diagnosticar en estos casos se requiere realizar técnicas de laboratorio como cultivos, reacción en cadena de la polimerasa (PCR) o serologías específicas32,33.
El riesgo de transmisión al neonato por una madre infectada es muy alto (30–50 %) si las madres adquieren el herpes cerca del momento del nacimiento. Por el contrario, el riesgo es mucho menor (< 1 %) entre las mujeres con antecedentes de herpes recurrente o que se infectan durante el primer trimestre del embarazo12,34. A pesar de ello, dado que es mucho más frecuente que la madre sufra una recidiva de un herpes y no una primoinfección durante el embarazo, la proporción de infecciones por herpes genital en neonatos es mucho mayor como consecuencia de un herpes recidivante en la madre.
La transmisión del VHS al neonato puede ocurrir tanto cuando hay episodios sintomáticos maternos como en casos de excreción asintomática del virus35,36. En mujeres seropositivas para el VHS-2 la prevalencia de excreción asintomática durante el parto medida por cultivos de VHS varía del 0,35 al 1,4 %37, aunque medida por PCR (detectando ADN del VHS) puede llegar a un 10 %38. La probabilidad de adquirir un herpes genital durante el embarazo es idéntica en los tres trimestres del mismo36.
La seguridad del aciclovir, valaciclovir y famciclovir en mujeres embarazadas no ha sido plenamente establecida hasta la fecha. Los datos disponibles en mujeres a las que se ha administrado aciclovir en el primer trimestre de la gestación sugieren que no existe un incremento en el riesgo de padecer malformaciones fetales comparado con la población general, por lo que este fármaco ofrece ciertas garantías en el embarazo. La experiencia con valaciclovir y famciclovir es mucho más limitada12,39.
En mujeres embarazadas la terapia antiviral se usa fundamentalmente en dos circunstancias. Una es para tratar una enfermedad grave o diseminada, o una primoinfección. La otra, para evitar una recurrencia al final del embarazo y prevenir un herpes neonatal. El aciclovir se puede administrar por vía oral a las mujeres embarazadas que tienen un primer episodio de herpes genital o si padecen una recurrencia moderada o importante, o por vía endovenosa en casos muy graves. Por otro lado, el tratamiento con aciclovir al final del embarazo reduce la frecuencia de cesáreas en las mujeres que tienen un herpes genital recidivante, disminuyendo la probabilidad de una recurrencia en el momento del parto34. En la primoinfección o primer episodio genital no primario se recomienda emplear aciclovir oral 400mg 3 veces al día durante 10 días, o aciclovir endovenoso 5mg/kg 3 veces al día durante 10 días si se trata de casos muy graves. Asimismo, en esta circunstancia también se recomienda realizar un tratamiento supresor al final del embarazo usando aciclovir 400mg 3 veces al día desde la semana 36 hasta el parto12,38,40,41.
Aunque clásicamente la terapia supresora durante el embarazo se ha realizado con aciclovir, ya que es el fármaco más estudiado de todos los antivirales, en los últimos años han aparecido varios estudios que han usado valaciclovir oral 500mg 2 veces al día a partir de la semana 36 de gestación. Este fármaco también ha demostrado reducir significativamente la excreción del VHS y las recurrencias que requieren cesáreas42,43.
Aunque en caso de recurrencias leves al comienzo del embarazo existe controversia sobre si deberían tratarse o no, la mayoría de los autores coinciden en que las recurrencias deben tratarse. La pauta más empleada es aciclovir 200mg 5 veces al día durante 5 días, salvo en casos graves en los que el tratamiento debería ser por vía endovenosa. La terapia supresora en mujeres diagnosticadas de herpes genital está indicada desde la semana 36 para prevenir una recurrencia en el momento del parto. Aunque el contagio también es posible si se produce una excreción asintomática en el momento del parto, no hay evidencia que apoye el empleo de antivirales en mujeres con serologías positivas para el VHS sin historia de herpes genital12.
En la actualidad la cesárea se reserva para los casos en los que existen lesiones en los genitales de la madre en el momento del parto, o en ausencia de lesiones genitales herpéticas si se ha producido una primoinfección o un primer episodio genital no primario en el mes previo al parto. A pesar de ello, la cesárea no reduce por completo el riesgo de transmisión del herpes al neonato. En algunas series, entre un 13 y un 33 % de los recién nacidos con infección por el VHS el parto se produjo por cesárea34,44. En cualquier caso, si la madre tiene lesiones herpéticas o antecedentes de herpes genital, deben realizarse cultivos faríngeos y oculares y un minucioso examen clínico al recién nacido. El tratamiento del recién nacido se debe instaurar de forma precoz y por vía endovenosa en todo aquel con herpes neonatal o con factores de riesgo evidentes. Las pautas recomendadas son aciclovir 20mg/kg peso por vía endovenosa cada 8 horas durante 21 días para la enfermedad diseminada o con afectación de sistema nervioso central, o durante 14 días para la enfermedad limitada a la piel y mucosas12,45.
No se recomienda la realización semanal de cultivos en la mujer embarazada en la que se ha confirmado un herpes genital, ya que éstos no predicen el riesgo de adquisición del VHS por el recién nacido al no prevenir una excreción asintomática en el momento del parto. Sin embargo, la supresión con antivirales durante el embarazo reduce la posibilidad tanto de tener lesiones clínicas en el momento del parto como la excreción subclínica, y por tanto también reduce el número de cesáreas32,46,47. La monitorización fetal invasiva puede aumentar el riesgo de herpes neonatal, y debería usarse tan sólo en mujeres seropositivas para el VHS-2 en indicaciones obstétricas muy bien definidas48.
La prevención de la transmisión materno-fetal del VHS debe fundamentarse en prevenir la infección materna al final del embarazo y en evitar el contacto del neonato con las lesiones herpéticas en el momento del nacimiento49.
La realización de serologías permite detectar mujeres con riesgo. Una mujer seronegativa para el VHS tiene riesgo de adquirir la infección si su pareja es seropositiva para el VHS-2 o el VHS-15.
Varios estudios han demostrado que entre las mujeres seronegativas para el VHS-2 cuya pareja es seropositiva para el VHS-2, el riesgo de adquirir una infección por el VHS-2 durante el embarazo oscila entre un 20 y un 30 %34,50. Como sucede en el resto de la población no embarazada que se infecta por el VHS, la mayoría de las seroconversiones son asintomáticas o pasan inadvertidas36. Por el contrario, este riesgo se reduce considerablemente si la mujer es seropositiva para el VHS-1 aunque la pareja sea seropositiva para el VHS-2 (se reduce a un 5–10 %)5,36.
Las mujeres susceptibles de adquirir un herpes genital deben evitar coitos no protegidos o realizar abstinencia sexual durante el tercer trimestre. Las embarazadas seropositivas para el VHS-2 deben ser examinadas de forma cautelosa al final del embarazo en búsqueda de lesiones genitales e interrogadas acerca de pródromos en el momento del parto. Si esto se produce debe realizarse una cesárea12,51,52.
Por último, en parejas sexuales discordantes (mujer seronegativa y varón seropositivo para el VHS-2), la terapia supresora con valaciclovir 500mg/día ha demostrado ser efectiva al reducir la transmisión del VHS durante el embarazo15.
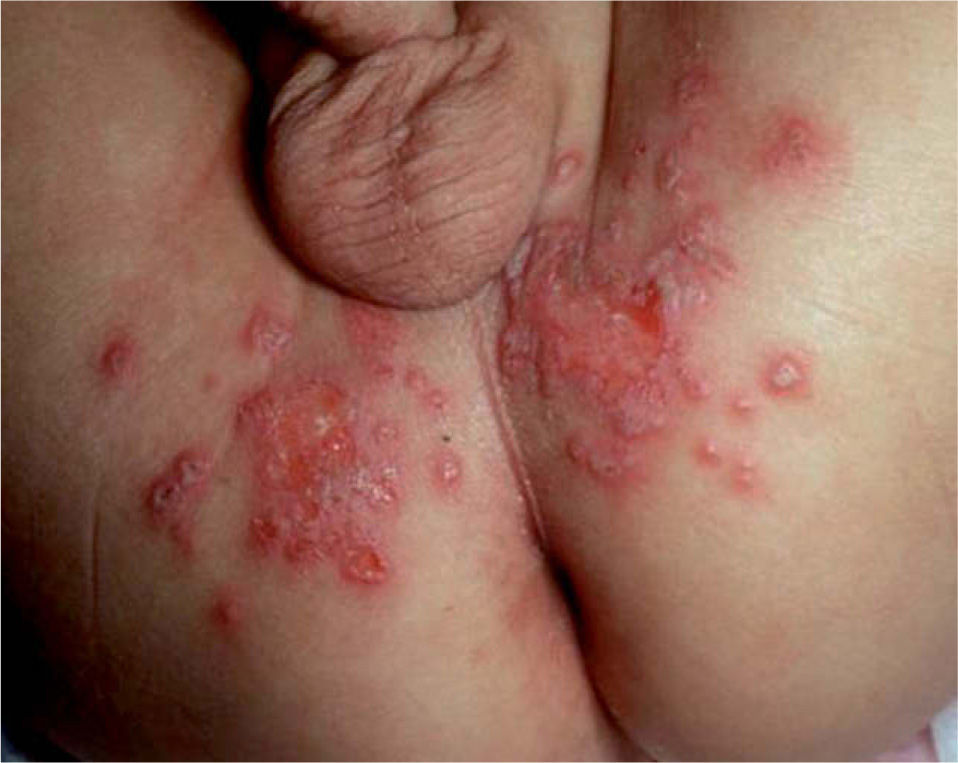
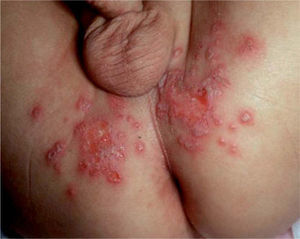
Herpes genital en niñosEl herpes genital es una enfermedad rara en niños y se asocia principalmente a infección por el VHS-1. Los portadores asintomáticos también se encuentran frecuentemente implicados en la transmisión del virus. En la infancia, la transmisión genital del VHS se produce generalmente por autoinoculación o a través de personas infectadas por el VHS-153-55 (fig. 3). Es importante que los padres con antecedentes de infección por el VHS-1, especialmente si se localiza en los labios o en las manos, conozcan que pueden contagiar un herpes genital a sus hijos si les besan o tocan con lesiones activas, y que también pueden transmitirlo en casos de excreción viral asintomática.
Al igual que sucede en los adultos, lo habitual es que la infección sea asintomática. La edad más habitual en la que el herpes genital se presenta en niños es entre los 2 y 4 años. Al tratarse la mayoría de los casos de una infección por el VHS-1 las recurrencias son poco frecuentes.
En niños y adolescentes es especialmente importante tipificar el tipo de VHS que ha provocado la infección mediante exámenes serológicos y cultivos. Indudablemente, se debe valorar la posibilidad de un abuso sexual, y en estos casos es necesaria la evaluación del niño por un médico forense. Los abusos sexuales son más frecuentes en los niños con edades comprendidas entre los 6 y 12 años53-55.
En el tratamiento del herpes genital en niños pueden emplearse los mismos fármacos que en los adultos. Las dosis que se emplean en niños mayores de 2 años son similares a las de los adultos, mientras que en los menores de 2 años se reduce la dosis a la mitad; 2,5ml de aciclovir en suspensión oral equivalen a 200mg.
Herpes genital en pacientes inmunodeprimidosLas infecciones por herpes simple afectan preferentemente a pacientes con neutropenia o con una disfunción o deficiencia de linfocitos T. En pacientes inmunocompetentes la duración del proceso es de aproximadamente unos 7–10 días, mientras que cuando ocurren alteraciones de la inmunidad el cuadro clínico puede variar de forma considerable, de forma que la frecuencia y la gravedad de las infecciones por el VHS son proporcionales al grado de inmunosupresión, y en pacientes con infección por el VIH al número de CD456.
Un elevado porcentaje de personas infectadas por el VIH tipo 1 (VIH-1) están también infectadas por el VHS-2, con rangos que oscilan entre un 50 a un 90 %, en función de las diferentes partes del mundo1,57,58. De hecho, el herpes genital es la enfermedad de transmisión sexual más frecuente en pacientes VIH positivos59. La presencia de inflamación y ulceración de la mucosa facilita la transmisión del VIH a sus parejas sexuales y, además, la infección aguda por el VHS o la reactivación de una infección pasada estimulan la replicación del VIH, aumentando la carga viral en el plasma y favoreciendo la progresión de la enfermedad60.
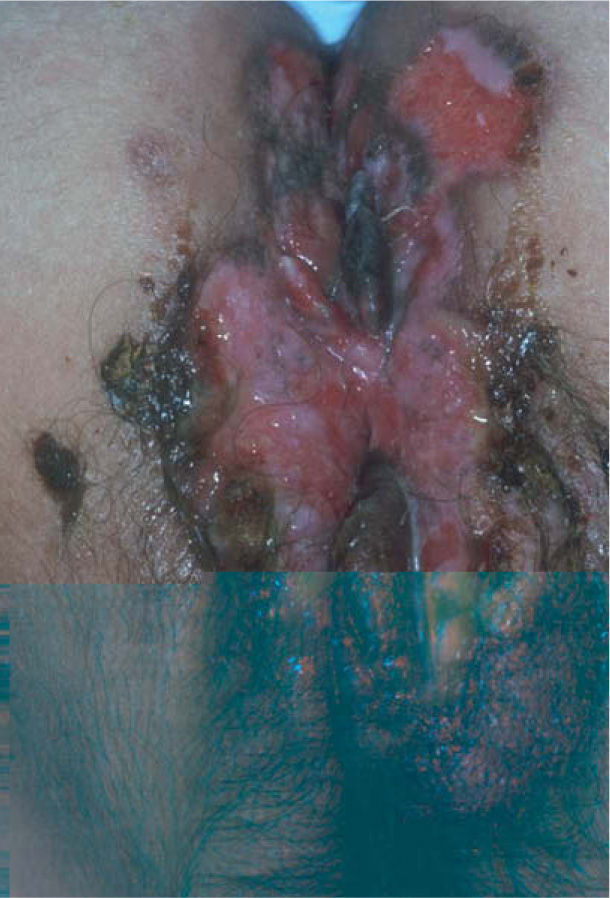
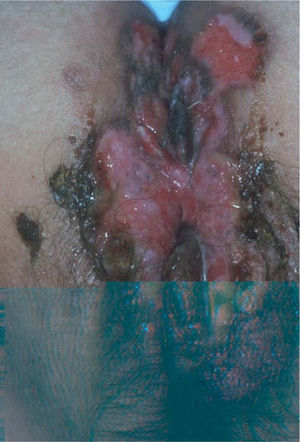
El herpes genital en personas con infección por el VIH se asocia con una infección más grave y con lesiones más crónicas, al igual que con un incremento en la excreción asintomática. Las úlceras genitales en pacientes inmunodeprimidos pueden ser muy numerosas, alcanzar tamaños enormes y asociarse con intenso dolor y mucha afectación adenopática (fig. 4). También son frecuentes las formas de presentación tan atípicas como lesiones hiperqueratósicas o similares a condilomas acuminados, o incluso a carcinomas epidermoides. La inmunosupresión inducida por el VIH, especialmente cuando el recuento de CD4 es inferior a 100 células/mm3, ejerce un papel importante en la reactivación del herpes genital y también es responsable de estas formas de presentación poco habituales y de que las lesiones tengan un curso más crónico61,62. Por otro lado, se ha descrito un incremento en la incidencia de herpes genital tras la introducción de la terapia antirretroviral para el VIH. Este hecho representaría una manifestación frecuente del síndrome inflamatorio de reconstitución inmune en pacientes infectados por el VIH63.
Las recurrencias de las úlceras genitales en pacientes VIH positivos son de tres a cinco veces más frecuentes que en pacientes inmunocompetentes64. Los análogos de los nucleósidos reducen la frecuencia y la gravedad de las recurrencias del VHS-2, y también disminuyen los niveles del VIH-1 en la sangre y el tracto genital. Son fármacos seguros y bien tolerados en pacientes con infección por el VIH-1. Debido a estos beneficios, a todos los pacientes con infección por el VIH deberían realizárseles serologías para el VHS-257. La principal diferencia terapéutica en los pacientes inmunodeprimidos es que generalmente se ha de prolongar el tiempo de administración de los fármacos para conseguir curar las lesiones. En infecciones complicadas o si hay diseminación hematógena el tratamiento debe ser por vía endovenosa y en un medio hospitalario, con aciclovir en dosis de 10mg/kg de peso cada 8 horas durante 10 días.
En pacientes inmunodeprimidos es frecuente el desarrollo de resistencias a estos fármacos antivirales, sobre todo si han sido tratados con ellos en multitud de ocasiones. Se detecta en aproximadamente un 5–25 %6 de los individuos con infección por el VIH y herpes genital, y es más frecuente en los pacientes que reciben un tratamiento episódico65. En la mayoría de los casos, la resistencia se debe a la selección de cepas de timidín cinasa viral defectuosas, enzima que es necesaria para activar el aciclovir por fosforilación. A pesar de ello, estas cepas suelen ser sensibles a foscarnet y cidofovir debido a que esos fármacos actúan sobre la ADN polimerasa del virus65.
Por tanto, en lesiones herpéticas que no curan es importante el aislamiento del virus para conocer la sensibilidad de éste y poder instaurar un tratamiento adecuado. Generalmente, cuando se produce una resistencia a aciclovir también se da para valaciclovir y famciclovir. La alternativa en estos casos es el forcarnet, que se administra por vía intravenosa en dosis de 40mg/kg de peso cada 8 horas hasta la resolución del cuadro. Hay que tener en cuenta que es un fármaco nefrotóxico y que también se han descrito resistencias a foscarnet en pacientes VIH positivos.
El cidofovir es otro fármaco antiviral que se está utilizando tanto intravenoso como tópico en infecciones herpéticas que no responden a los antivirales convencionales66.
En caso de infecciones localizadas se pueden utilizar las pautas habituales durante 10 días. Si tras 10 días no se resuelven las manifestaciones clínicas, se puede iniciar tratamiento con aciclovir por vía endovenosa, y en caso de que esta medida tampoco se muestre eficaz habría que plantearse una resistencia al aciclovir y se debería utilizar un fármaco alternativo como el foscarnet.
Debido a que las lesiones en el paciente inmunodeprimido revisten una mayor extensión y profundidad, es frecuente la sobreinfección por bacterias y hongos y, por eso, se deben tratar con antibioterapia o fármacos antifúngicos adecuados.
Las pautas recomendadas en el tratamiento de las recurrencias en pacientes VIH positivos se encuentran descritas en la tabla 412.
Pautas recomendadas en el tratamiento de las recurrencias en pacientes VIH+
| Tratamiento supresor | |
| Aciclovir: | 400-800mg vía oral 2 ó 3 veces al día |
| Valaciclovir: | 500mg vía oral 2 veces al día |
| Famciclovir: | 500mg vía oral 2 veces al día |
| Tratamiento episódico | |
| Aciclovir: | 400mg vía oral 3 veces al día durante 5-10 días |
| Valaciclovir: | 1g vía oral 2 veces al día durante 5-10 días |
| Famciclovir: | 500mg vía oral 2 veces al día durante 5-10 días |
Adaptada de Centers for Disease Control and Prevention12.
En pacientes sometidos a trasplante de algún órgano, la infección por el VHS-1 y el VHS-2 es la única que característicamente aumenta su incidencia en las primeras semanas tras la intervención67. Por este motivo, en individuos que van a ser sometidos a un trasplante de cualquier órgano se debe realizar profilaxis preoperatoria con aciclovir, consiguiendo reducir de forma significativa la infección o reactivación no sólo de los virus HS-1 y HS-2, sino también de otros virus herpes como el citomegalovirus68,69. Se recomienda realizar la profilaxis con aciclovir intravenoso o valaciclovir oral (500mg/12 horas) en pacientes seropositivos que se someten a un trasplante.
El tratamiento de la proctitis herpética se realiza con aciclovir en dosis altas y la pauta recomendada es de 400mg por vía oral 5 veces al día, de 7 a 10 días.
Consejos para reducir la transmisiónEl adiestramiento de las personas con herpes genital en el conocimiento de algunos aspectos importantes de la enfermedad puede reducir el riesgo de transmisión. Los pilares fundamentales de estos consejos deben basarse en la información de su situación por parte de los pacientes, tanto a las parejas previas como a las sucesivas, en la abstinencia sexual durante los brotes, en el empleo de métodos de barrera y en ofrecer la posibilidad de realizar una terapia supresora.
Los pacientes y sus parejas deben conocer que la transmisión sexual del VHS puede ocurrir durante periodos asintomáticos, y que la excreción asintomática del virus es mucho más frecuente durante los 12 meses posteriores al contagio. Debe recomendarse la realización de serologías a las parejas asintomáticas de individuos infectados para ver si tienen riesgo de contagio. Evidentemente, hay que evitar mantener relaciones sexuales cuando existan síntomas evocadores de la infección, incluidos los pródromos. En cuanto a los condones de látex, cuando se usan de forma consistente y correcta pueden reducir el riesgo de transmisión del herpes genital, aunque no protegen al 100 % y deberían usarse también entre los brotes.
Por otro lado, debe explicarse el riesgo de infección neonatal a todas las personas infectadas, incluidos los hombres. Las mujeres embarazadas que no estén infectadas por el VHS-2 deberían evitar mantener relaciones sexuales durante el tercer trimestre con parejas con antecedentes de herpes genital. De forma similar, las mujeres embarazadas que no estén infectadas por el VHS-1 también deberían evitar la exposición de sus genitales al VHS-1, fundamentalmente no siendo receptoras de sexo oral durante el tercer trimestre con una pareja con herpes labial36.
Por último, los pacientes tienen que saber que el riesgo de transmisión sexual del VHS-2 puede reducirse por el uso diario de antivirales por parte de la persona infectada15.
Tratamiento tópico del herpes genitalLos tratamientos tópicos tan sólo ocupan un lugar muy limitado dentro del arsenal terapéutico del que se dispone para tratar el herpes genital. Aunque el tratamiento tópico con aciclovir se empleó inicialmente en el herpes genital recurrente, se ha demostrado que es ineficaz, por lo que aunque está aprobado como tratamiento del herpes genital, no se recomienda su uso70.
El uso de fomentos puede producir una mejoría de las lesiones exudativas y el empleo tópico de antibióticos o antifúngicos resulta de gran ayuda para evitar y tratar las sobreinfecciones, sobre todo en caso de lesiones extensas o profundas.
En pacientes con herpes recurrente y resistencias al aciclovir, especialmente en inmunodeprimidos, se han empleado diversos tratamientos tópicos. Existen casos de herpes genital refractario al aciclovir en pacientes con sida que se han tratado con éxito con imiquimod71-73, aunque no parece que este fármaco altere la historia natural del herpes genital, según han demostrado algunos ensayos clínicos74.
También hay casos de resistencia al aciclovir y al valaciclovir oral en pacientes con sida y herpes genital grave en los que tras la aplicación de foscarnet al 2,4 % en crema 2 veces al día durante 20 minutos, las lesiones se resolvieron en menos de 2 meses. En algunos ensayos se ha empleado también el foscarnet en crema al 1 %, 5 veces al día, con buena respuesta pero con algunos efectos adversos como irritación, cefalea o fiebre75.
También hay casos de pacientes VIH positivos con herpes genital resistente al aciclovir y al valaciclovir en los que lesiones hipertróficas similares a condilomas desaparecieron en menos de 2 meses usando cidofovir al 1 % en crema 2 veces al día, y con foscarnet en solución al 50 %, aplicado también 2 veces al día durante 1 mes71. El foscarnet en solución parece que se trata de un tratamiento bien tolerado y con menos efectos adversos que la formulación en crema. Estos fármacos tienen el problema de que su vida media es muy corta, aunque si es necesario se puede aumentar el número de aplicaciones71,72.
Hay varias descripciones en la literatura en las que tras emplear este tipo de tratamientos tópicos, especialmente el foscarnet, se consiguió que desaparecieran las resistencias del VHS-2 al aciclovir y al valaciclovir, por lo que los tratamientos tópicos constituirían una importante ayuda en el manejo de inmunodeprimidos con resistencias a antivirales76-78.
Como anécdota, la povidona yodada también ha resultado de utilidad en el tratamiento de algunos casos de herpes genital79.
En los últimos años se están realizando experimentos con animales de laboratorio empleando ARN de interferencia para prevenir la infección de la mucosa vaginal de ratonas. Este hecho ha abierto la posibilidad de investigación para el desarrollo de microbicidas tópicos con ARN de interferencia que sean capaces de bloquear al virus en el momento que entren en el cuerpo80,81.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.