INTRODUCCION
Las leishmaniasis son un grupo de enfermedades originadas por la infección producida por protozoos del género Leishmania, que parasitan las células del sistema reticuloendotelial.
Los parásitos son transmitidos por la picadura de las hembras de mosquitos de los géneros Phlebotomus y Lutzomya, de los cuales unas 30 especies son vectores demostrados. El reservorio lo constituyen generalmente mamíferos salvajes o domésticos, aunque también puede ser una infección antroponótica.
Su capacidad infectiva se manifiesta de forma variada en la sintomatología, dando lugar a formas viscerales (kala-azar), mucocutáneas y cutáneas.
EPIDEMIOLOGIA
La infección por Leishmania constituye un problema de extraordinaria envergadura desde el punto de vista de la salud pública, ya que afecta a la población de 88 países de zonas intertropicales y templadas, de los cuales sólo en 40 es de declaración obligatoria, por lo que de los aproximadamente 2 millones de casos nuevos estimados por año, sólo 600.000 se declaran oficialmente. La prevalencia está en torno a los 12 millones de enfermos y la población en riesgo es de más de 350 millones de personas1.
De los casos nuevos, una cuarta parte corresponden a formas viscerales. En el 90 % en la India, Nepal, Bangladesh, Brasil y Sudán. De las formas cutáneas, el 90 % ocurren en Afganistán, Arabia Saudí, Irán, Siria, Brasil y Perú, y las mucocutáneas se concentran en el 90 % en Bolivia, Brasil y Perú.
La leishmaniasis en España
En nuestro país, tanto la leishmaniasis cutánea como la visceral están producidas por L. infantum y han sido enfermedades de declaración obligatoria (EDO, rúbrica núm. 085) desde febrero de 1982 hasta el 1 de julio de 1996; a partir de entonces, son enfermedades de notificación regional y sólo se registran en las comunidades autónomas donde se considere oportuno. Por ello no se dispone de una información fiable, aunque la declaración obligatoria previa tampoco reflejaba la realidad por existir una subdeclaración evidente.
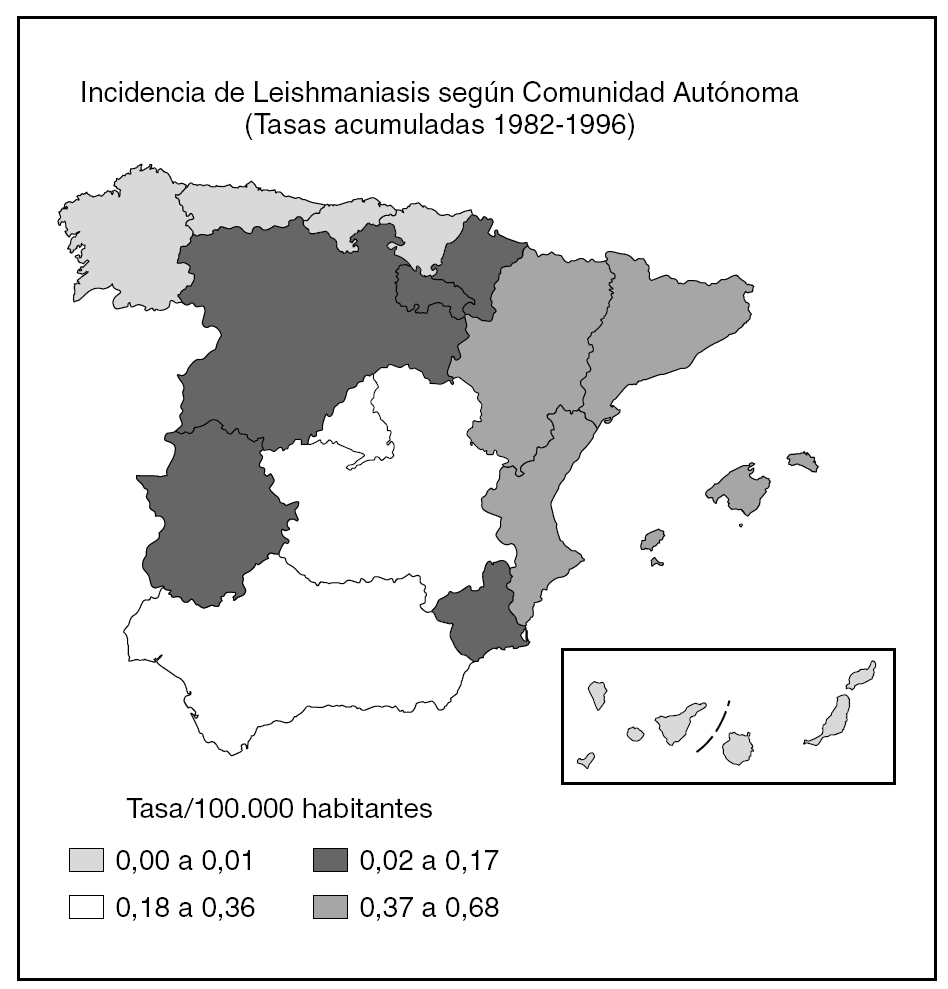
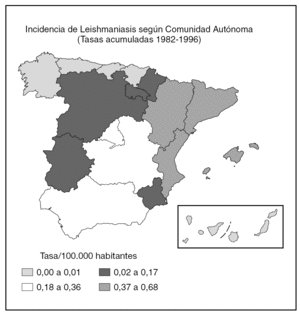
De acuerdo con los datos oficiales EDO, las comunidades autónomas más afectadas serían Aragón, Baleares, Cataluña y Valencia y, en un segundo grupo, Andalucía, Castilla-La Mancha y Madrid (fig. 1). Por otra parte, en esta declaración no se diferencia entre leishmaniasis cutánea y kala-azar, por lo que es muy difícil establecer una estimación. Para Alvar, una estimación realista sería de unos 200 casos nuevos viscerales y 100 cutáneos2.
Fig. 1.--Incidencia de Leishmaniasis en España.
De las publicaciones españolas al respecto, señalaremos el trabajo de Albero Blanes et al3 que recogen 141 casos durante 4 años, en Alcoy; Coscojuela et al4 43 casos en 10 años, en Aragón; Alcalde Alonso et al5 39 pacientes en 6 años, en Granada, Daudén et al6, 31 pacientes en 9 años, en Madrid; y Sesma y Barricarte7, 15 casos cutáneos y 18 viscerales en 21 años, en Navarra.
En nuestra consulta, tras una revisión publicada en el año 20008, seguimos intentando recopilar información retrospectiva y actual sobre nuestros pacientes de leishmaniasis. Sobre una población aproximada de 380.000 habitantes, se recogieron, entre 1992 y febrero de 2004, 131 pacientes con lesiones cutáneas o mucosas en los que se confirmó el parásito, de los cuales 125 eran inmunocompetentes, 3 casos de coinfección con virus de la inmunodeficiencia humana (VIH), y otros 3 casos de leishmaniasis de inoculación laríngea, en pacientes inmunocompetentes, atendidos en los servicios de otorrinolaringología (ORL) y medicina interna de nuestro hospital. Si a ello se añaden los casos que sin demostración del parásito presentaban una historia clínica y unas lesiones cutáneas muy sospechosas de botón de Oriente, curados con antimoniales intralesionales, los casos atendidos en otras consultas del área, y un número indeterminado de pacientes que no llegan a las consultas dermatológicas por la regresión espontánea de las lesiones, es muy verosímil que la cifra de pacientes en este periodo pueda incrementarse como mínimo en un 20-25 %. Ello, unido a lo comunicado en las series españolas citadas, hace pensar que la incidencia de la leishmaniasis cutánea en España exceda ampliamente las previsiones de Alvar, que pueden ser mucho más ajustadas en lo que respecta al kala-azar.
HISTORIA
Se conocen referencias de la enfermedad en el papiro de Ebers (hacia 1600 a.C.). La evolución del conocimiento de la leishmaniasis desde el punto de vista histórico se resume en la tabla 1.
ETIOLOGIA
Como se ha dicho en la introducción, el agente causal de las leishmaniasis es un protozoo del género Leishmania pero, como en toda zoonosis, la interacción agente-vector-reservorio es absolutamente determinante para el desencadenamiento de la enfermedad, su transmisión y su mantenimiento como tal en el medio ambiente. Por ello, parece preferible hablar de «complejo etiológico», entendiendo por tal cada uno de esos elementos con sus interrelaciones.
EL PARASITO
Leishmania, descrita en 1903 por Leishman y Donovan en la India y simultáneamente por Wright en un niño armenio, es un protozoo flagelado perteneciente a la clase Zoomastigophora, orden Kinetoplastida y familia Trypanosomatidae (tabla 2). El género Leishmania (Ross, 1903) incluye más de dos docenas de especies, la mayoría de las cuales parasita al ser humano. De todas ellas, L. donovani (L. archibaldi en el este de África) y L. infantum (L. chagasi en el Nuevo Mundo), tienen un tropismo preferentemente visceral y el resto cutáneo o mucocutáneo. No obstante, algunas de estas especies viscerotrópicas pueden dar lugar a afectación exclusivamente cutánea, como es el caso de L. infantum, agente de la leishmaniasis cutánea en España y en el resto de la cuenca mediterránea occidental y L. chagasi, molecularmente idéntica a L. infantum, también es responsable de formas cutáneas en el Nuevo Mundo. Igualmente se han descrito casos de afectación visceral por L. tropica en zonas endémicas y en veteranos de la guerra del Golfo.
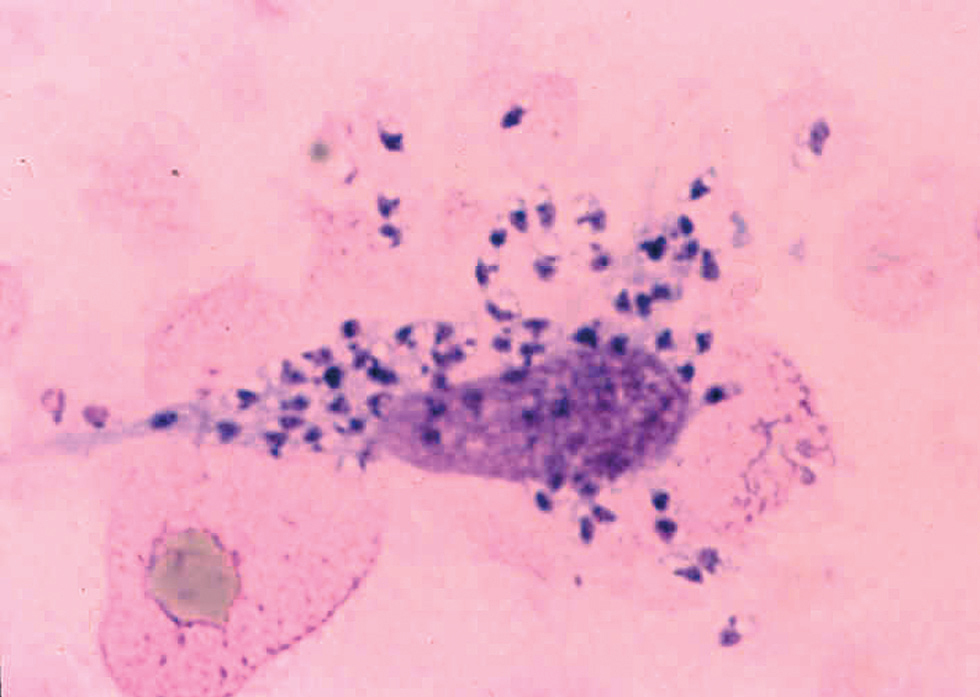
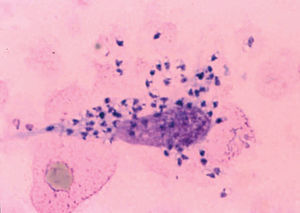
Morfológicamente las leishmanias se presentan bajo una forma intracelular, amastigote, que se encuentra dentro del sistema reticuloendotelial del mamífero huésped, así como en frotis y biopsias (fig. 2) y una forma flagelada, promastigote, en el interior del intestino del vector y en los medios de cultivo.
Fig. 2.--Frotis en el que pueden apreciarse claramente los amastigotes, dentro y fuera de un macrófago.
Los amastigotes se presentan como cuerpos redondeados u ovalados (cuerpos de Leishman-Donovan) de 2-6 mm de diámetro, en los que se identifican un núcleo, un quinetoplasto puntiforme y un flagelo interno, este último sólo visible al microscopio electrónico17,18. La tinción con Giemsa de los frotis obtenidos de las lesiones cutáneas revela un citoplasma azul claro, mientras que el núcleo y quinetoplasto se tiñen de púrpura.
Los promastigotes son alargados, de alrededor de 20 por 2-3 mm, con un núcleo central, un flagelo externo, anterior, rodeado de membrana plasmática, de longitud similar al cuerpo del parásito y un quinetoplasto, ubicado en el extremo anterior, en la proximidad del origen del flagelo17-19.
Desde el punto de vista de su biología molecular y genética, debe señalarse que las leishmanias tienen dos genomas, nuclear y quinetoplástido, este último equivalente al genoma mitocondrial de los mamíferos19,20. El cariotipo de Leishmania es de 34-36 cromosomas, y su tamaño para L. infantum es de 35,5 Mb (Wincker et al, 1996, citado por Alvar) y de 33,6 Mb para L. major (proyecto para estudio del genoma de Leishmania del Centro Sanger).
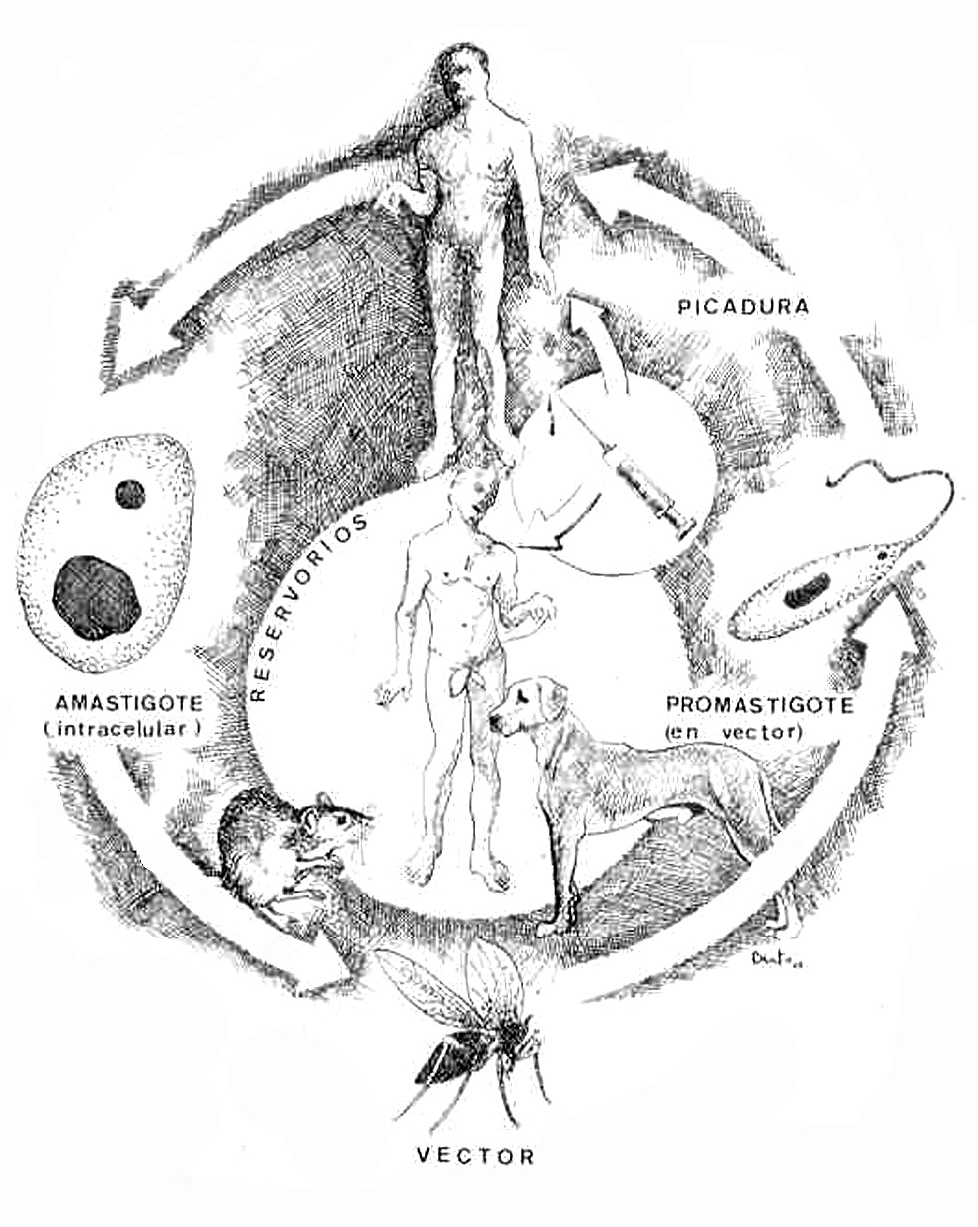
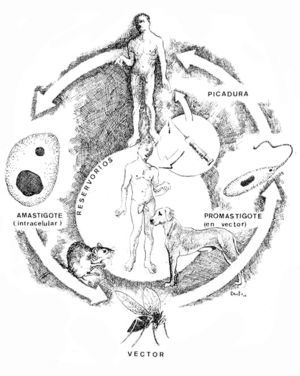
Ciclo vital (fig. 3)
Fig. 3.--Ciclo biológico de Leishmania en su fase de amastigote en el ser humano y el reservorio, representado por un roedor, un perro doméstico y el propio ser humano, y de promastigote en el tubo digestivo del vector. Se introduce el nuevo ciclo antroponótico descrito por Alvar, de transmisión inicial a través de agujas en adictos a drogas por vía intravenosa. Ilustración de Eduardo Sánchez-Beato182.
Para alimentarse, la hembra del insecto vector pica al mamífero reservorio. De este modo, los amastigotes de los tejidos infectados o de la sangre pasan al tracto digestivo del mosquito y en el intestino medio, fundamentalmente, se transforman en promastigotes en 24-36 h tras la picadura, e inician una rápida multiplicación.
Dentro del tubo digestivo del vector, las características del promastigote van cambiando desde la fase de nectomona, sujeto a las microvellosidades del tubo digestivo, a la de promastigote infectivo o metacíclico, libre en hipofaringe, pasando por una fase intermedia de haptomona. Este proceso se conoce como metaciclogénesis y dura aproximadamente 10 días21.
Los promastigotes metacíclicos rellenan la faringe y probóscide del mosquito y permanecen allí hasta una nueva picadura, momento en el que serán inoculados a un nuevo huésped. Existe un alto nivel de especificidad entre vector y especie de Leishmania, ligado a la estructura de membrana del parásito y características genéticas del insecto, de modo que una especie de flebótomo sólo es susceptible a una o algunas especies de Leishmania y viceversa22.
Con cada picadura entran en la dermis entre 10 y 200 promastigotes metacíclicos, algunos de los cuales, probablemente, son destruidos por los leucocitos polinucleares y eosinófilos, mientras que otros se adhieren a los receptores de superficie de los macrófagos y son fagocitados.
Una vez dentro del macrófago, se transforman nuevamente en amastigotes, que vivirán en los fagolisosomas, o vacuolas parasitóforas del macrófago. En estas estructuras, los amastigotes sobreviven y se multiplican por división binaria, hasta que el macrófago queda repleto de amastigotes, momento en el que se rompe y los parásitos pasan al espacio extracelular, donde serán nuevamente captados por otros macrófagos19,23.
Un factor fundamental asociado a la virulencia es el tropismo de la especie, que hace que las especies viscerotropas L. donovani (L. archibaldi), L. infantum (L. chagasi) alcancen rápidamente cualquier área del sistema reticuloendotelial, mientras que las especies dermotropas como L. tropica o L. major, queden acantonadas preferentemente en piel23.
La situación de inmunocompetencia del sujeto infectado también es determinante del alcance de la infección. A este respecto hay que señalar que especies como L. aethiopica o L. major causantes de leishmaniasis cutánea localizada, dan lugar a formas difusas en inmunodeprimidos. Así mismo, las variantes enzimáticas dermotrópicas de L. infantum de la cuenca mediterránea producen leishmaniasis visceral en los inmunodeprimidos, en especial en los infectados por el VIH.
Identificación de las leishmanias (tabla 3)
No existen criterios morfológicos que permitan distinguir las diferentes especies de Leishmania, ni a la observación microscópica convencional de los tejidos parasitados o de los cultivos, ni mediante el estudio de microscopia electrónica, si bien las diferencias que se observan con el microscopio electrónico de transmisión y barrido sugieren diferencias en lo que ocurre a nivel molecular y bioquímico en el momento de la fijación (Blum, 1996).
Por ello, se han propuesto múltiples criterios de identificación, unos extrínsecos, como la sintomatología, distribución geográfica y comportamiento en vectores o animales de laboratorio, y otros intrínsecos que analizan el fenotipo o el genoma del parásito.
Dentro de los criterios extrínsecos, Lainson y Shaw24 utilizaron el desarrollo de Leishmania en el tubo digestivo del vector para diferenciar las secciones (subgéneros) Suprapylaria (Leishmania) y Peripylaria (Viannia). Las primeras se desarrollarían en el segmento de tubo digestivo anterior al píloro y las segundas en píloro y por detrás del mismo. Así mismo, el vicerotropismo y dermotropismo siguen teniendo vigencia como criterios extrínsecos.
Como criterios intrínsecos, se incluyen las dos técnicas bioquímicas de caracterización fenotípica más utilizadas: la caracterización de isoenzimas y los anticuerpos monoclonales.
La caracterización de isoenzimas se realiza mediante el estudio de la movilidad electroforética de estas enzimas en cultivos de promastigotes de diferentes estirpes de Leishmania. Ello permite la caracterización de éstas, según sus perfiles enzimáticos, en grupos taxonómicos electroforéticamente homogéneos llamados zimodemos. Es la técnica de referencia en la actualidad para la identificación de leishmanias a niveles específicos e intraespecíficos25,26.
El uso de anticuerpos monoclonales contra antígenos específicos de género o de especie de Leishmania permite identificar amastigotes en frotis y biopsias, o promastigotes en cultivos27,28.
Sin embargo, el desarrollo de la biología molecular ha permitido la puesta en marcha de numerosas técnicas de identificación molecular, que permiten la identificación del genoma, de mayor sensibilidad y especificidad que las técnicas extrínsecas. Con este propósito se utiliza el aislamiento de fragmentos específicos de ADN mediante enzimas de restricción (RFLP), hibridación con sondas de ADN genómico y el ADNk del quinetoplasto y la reacción en cadena de la polimerasa (PCR) con sus variantes RAPD (random amplified polimorphic DNA) y PCR-RFLP, que identifica y diferencia estirpes genéticamente próximas19. La Leishmania Genoma Network (Red para del estudio del genoma de la Leishmania) agrupa a varios centros actualmente ocupados en secuenciar el genoma del protozoo.
Clasificación
La clasificación del género Leishmania, establecida por Ross en 1903, comenzó en 1916 y ha seguido los pasos basados en los diferentes criterios de identificación antes mencionados. Hasta 1961, las diferentes clasificaciones siguen el sistema de Linneo basándose en características biogeográficas y clínicas y, posteriormente, se van añadiendo aspectos de comportamiento del parásito en vectores, cultivos y animales de experimentación. Las técnicas de identificación de características bioquímicas, en particular las isoenzimas, dieron paso a clasificaciones filogenéticas en las que los caracteres biológicos se ordenan de acuerdo con la evolución, para conseguir diseñar un árbol filogenético (cladograma, dendrograma), en el que se muestra la sucesión de ancestros y descendientes.
El uso actual de técnicas moleculares, en particular la secuenciación genómica de Leishmania, permite completar y precisar las clasificaciones actualmente vigentes.
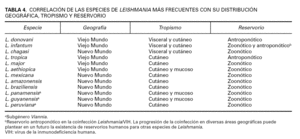
Desde el punto de vista práctico, se adoptará la clasificación que muestra la tabla 4 en la que se correlaciona la especie con el tropismo y patología habitual que produce, referida a las especies más frecuentes de Leishmania.
EL VECTOR
Los vectores de las leishmaniasis son mosquitos del orden Dipterae, familia Psychodidae, subfamilia Phlebotominae y géneros Phlebotomus (12 subgéneros), en el Viejo Mundo y Lutzomya (25 subgéneros), en el Nuevo Mundo. La identificación de los flebotominos como vectores fue llevada a cabo, por primera vez, por Adler y Theodor en 1925.
Excepcionalmente se ha comunicado la transmisión accidental por aplastamiento de mosquitos infectados contra la piel, mecánica por la mosca Stomoxys calcitrans29 (contaminada al alimentarse en úlceras infectadas por Leishmania y posarse posteriormente en heridas no infectadas en seres humanos), sexual, por transfusión de sangre y congénita. La transmisión por agujas infectadas en drogadictos es un mecanismo relativamente reciente y de gran trascendencia en la coinfección Leishmania/VIH, que ha dado lugar al establecimiento de un nuevo ciclo antroponótico artificial, señalado por Alvar16.
El mosquito se distribuye preferentemente en las zonas intertropicales y templadas, aunque alcanza los 50° N de latitud en el suroeste de Canadá y los 40° S. No se ha localizado en Nueva Zelanda e islas del Pacífico, ni en la Antártida. En cuanto a la altura, su distribución va del nivel del mar hasta 3.300 m sobre el mismo30,31.
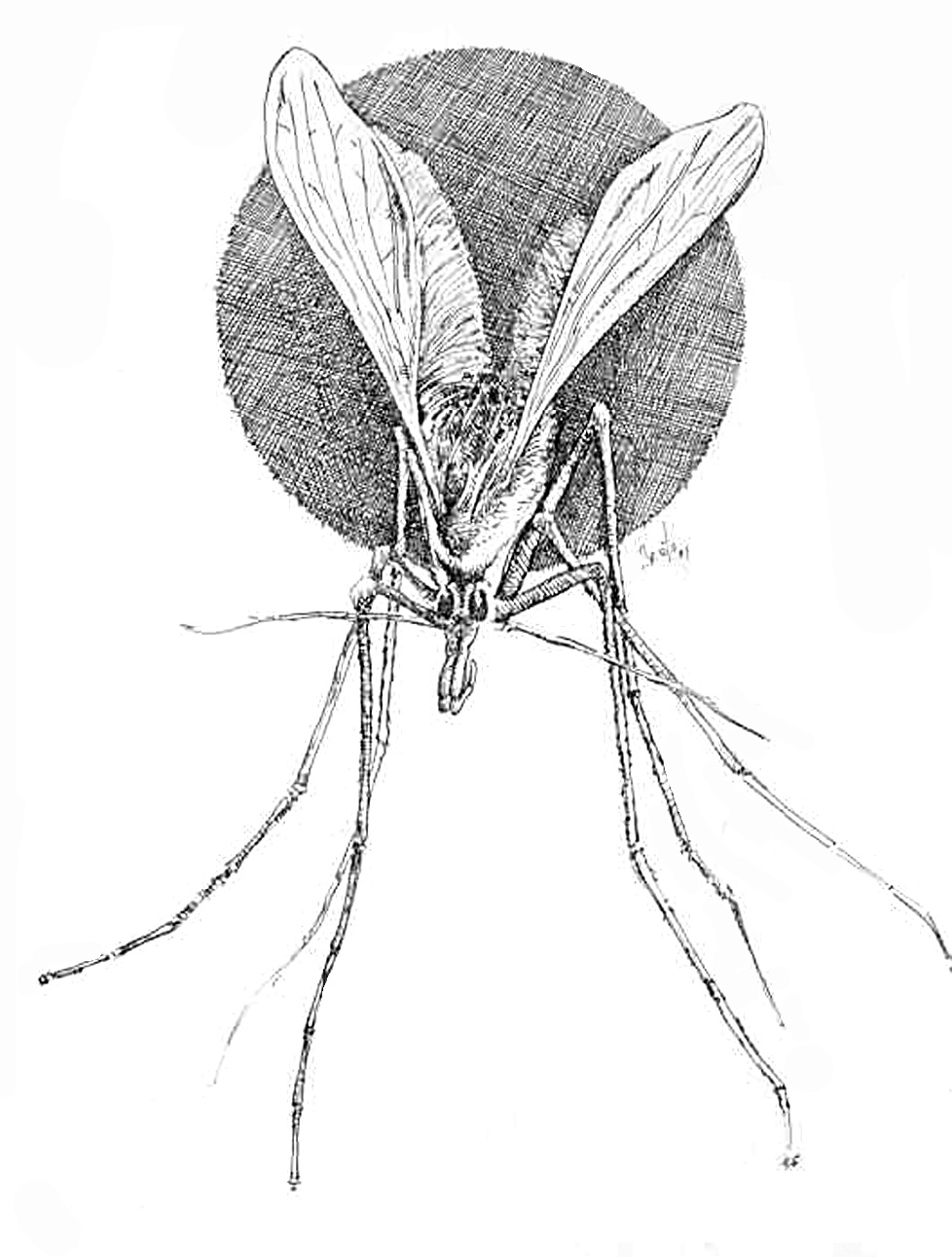
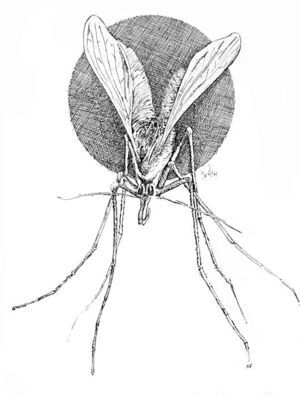
Los flebótomos son pequeños insectos de color variable de blanquecinos a casi negros, de unos 3 mm de longitud, cuerpo y alas pilosos y, cuando se posan, éstas quedan en una posición de V sobre el cuerpo, de modo que parecen minúsculas polillas (fig. 4). Experimentan metamorfosis completa: huevo, cuatro estadios de larva, uno de pupa y forma adulta. Hacen las puestas en zonas arenosas, húmedas, oscuras o poco iluminadas, con temperatura constante y ricas en material orgánico, que permita la alimentación de las larvas al eclosionar. En la provincia de Toledo, la mayor parte de los pacientes con leishmaniasis cutánea viven en poblaciones próximas a ríos o zonas relativamente húmedas, o las frecuentan, lo que sugiere una mayor densidad de flebótomos en esas áreas, por la mayor facilidad de reproducción32.
Fig. 4.--Phlebotomus spp. (Dibujo de Eduardo Sánchez-Beato182.)
Un dato importante de su anatomía, como la de otros insectos hematófagos, es la existencia de dos glándulas salivales saculares, localizadas en el tórax, que vierten su secreción a través de conductos salivales que forman un canal a lo largo de la hipofaringe. En el momento de la picadura, como veremos más adelante, los parásitos son inyectados en la dermis del huésped junto con la saliva del mosquito, lo cual tiene una gran trascendencia en la facilitación de la infección.
Son insectos de actividad crepuscular o nocturna, aunque algunas especies pueden picar durante el día, y, aparentemente, no se desplazan lejos de su entorno habitual. Son preferentemente exofágicas, es decir, pican con más frecuencia en el exterior de las edificaciones, aunque la mayor parte de las especies son endofágicas y exofágicas y alguna, como P. papatasi, suele picar más en interiores. Por otra parte, la mayor parte de flebótomos son fototrópicos, por lo que penetran en las viviendas iluminadas por la noche y actúan endofágicamente. El vuelo es corto y silencioso y estudios en túnel de viento sugieren que su máxima velocidad es algo menos de 1 m/s33. Durante las horas de inactividad se refugian en casas, bodegas, establos, agujeros de las paredes, basureros, madrigueras o nidos de los mamíferos reservorio, vegetación, etc.
Ambos sexos suelen alimentarse de fuentes vegetales de azúcar, como la savia, pero mientras que los machos son exclusivamente fitófagos, las hembras necesitan alimentarse también con sangre, nutrición proteica imprescindible para la producción de huevos. Por este motivo sólo las hembras son hematófagas y los machos no pican30,31,34.
Según el índice-catálogo de Zooparásitos Ibéricos (Cordero et al 1994), en España hay 12 especies de flebótomos, pertenecientes a los géneros Phlebotomus y Sergentomyia, de los cuales los vectores principales de L. infantum son P. perniciosus y P. ariasi (tabla 5).
EL RESERVORIO
Fundamentalmente, las leishmanias parasitan mamíferos salvajes o domésticos (perro); es una zoonosis. En zonas de endemia, la transmisión puede ser también antroponótica, es decir, de humano a humano (L. tropica), a través del vector, o a través de jeringas infectadas en la coinfección Leishmania/VIH (L. infantum)16.
Según la Organización Mundial de la Salud (OMS) (Comité de Expertos, 1990)35, pueden distinguirse tres clases de huéspedes animales: primarios, secundarios e incidentales. Los huéspedes primarios de Leishmania son el refugio habitual del parásito y mantienen la enfermedad en su entorno, como reservorio estable, por lo que tienen el papel más importante en la perpetuación de la enfermedad en los humanos u otros animales. Además, su adaptación al parásito hace que, en el animal, la infección curse con benignidad, o sin enfermedad aparente. El huésped secundario es el portador de los parásitos al entorno humano, facilitando de este modo la transmisión, y ocupa el segundo escalón en importancia en el mantenimiento de la epidemiología de la enfermedad, mientras que los huéspedes incidentales tienen escasa relevancia en el mantenimiento o transmisión de la enfermedad.
Entre parásito, vector y reservorio, se establece un conjunto de relaciones complejas que permiten que sea un sistema automantenido. Una especie determinada de Leishmania puede parasitar a huéspedes de diferentes grupos filogenéticos; por ejemplo, L. major puede infectar a primates, perros y roedores e, inversamente, un huésped concreto puede ser parasitado por distintas especies de Leishmania, como es el caso de la infección humana por L. donovani, L. infantum, L. tropica y otras, o en el caso del perro doméstico por L. infantum y L. donovani.
El aislamiento de las leishmanias en las lesiones cutáneas o en las vísceras del huésped es parte imprescindible de su imputación como posible reservorio36. Por otra parte, la correcta identificación taxonómica, así como el conocimiento de la biología, comportamiento, ecología y distribución de los reservorios es fundamental para abordar el control epidemiológico y erradicación de la infección37.
En la península Ibérica, el perro es el reservorio principal de L. infantum. La susceptibilidad de los perros a la infección es variable según las razas y, parece ser que los animales más seleccionados son más susceptibles, mientras que los mestizos de zonas endémicas y algunas razas como los podencos ibicencos han desarrollado cierto grado de resistencia. El perro infectado puede permanecer asintomático, aunque altamente infectivo, o bien desarrollar la enfermedad, aumentado su capacidad de infectar a los flebótomos que se alimentan de él38. El zorro también está parasitado en una alta proporción por L. infantum y su mayor proximidad al entorno humano podría ser un factor de acercamiento del ciclo rural al peridoméstico. También se ha confirmado la parasitación de la rata negra, gallinas, équidos y gatos, pero sólo como huéspedes accidentales y, por lo tanto, sin valor epidemiológico.
PATOGENIA
Desde un punto de vista esquemático, se consideran tres fases en los mecanismos fisiopatológicos que configuran el desarrollo de la enfermedad: los eventos iniciales desde la picadura hasta que se produce la respuesta inmunitaria, la respuesta inmunitaria innata y adaptativa y la diseminación de la enfermedad. No obstante, estos sucesos se imbrican muy pronto y esta división es artificial y sólo pretende facilitar su comprensión (tabla 6).
La picadura y el inicio de la infección
Hay dos factores relevantes en la eficiencia de la transmisión del parásito en relación con la picadura: el número de picaduras infligidas al huésped y la composición de la saliva del vector.
La frecuencia de las picaduras varía de una especie de flebótomo a otra y mientras unas se alimentan una sola vez para cada oviposición, otras se alimentan varias veces en días diferentes. Además, la hembras infectadas tienden a «probar» varias veces cuando pican, posiblemente por las alteraciones producidas por los parásitos, que llenan la faringe y trompa del insecto, en la válvula cardial de éste, dificultando así su normal alimentación, lo que le obliga a prodigar el número de picaduras39,40.
En segundo lugar, la saliva del mosquito no sólo es capaz de provocar reacciones de hipersensibilidad retardada local en algunas personas, sino que tiene una serie de componentes proteicos con un papel determinante de interferencia en los mecanismos de defensa del huésped, como antiagregantes plaquetarios, vasodilatadores, inmunosupresores, difusores y potenciadores de la infectividad del parásito41. Entre estos factores están la apirasa, el maxidilán42, la adenosina y su precursor 5'AMP43, hialuronidasa y desintegrinas.
Una vez en la dermis, una parte de los promastigotes son eliminados en el espacio extracelular y otros son fagocitados por los macrófagos dentro de los cuales se multiplicarán. La supervivencia de las leishmanias en medios hostiles tan diferentes como el intestino del vector y los macrófagos es posible gracias al desarrollo de mecanismos capaces no sólo de neutralizar la formación de factores microbicidas, sino de progresar en medios tan extremos44.
La fagocitosis de los promastigotes está mediada por los receptores de superficie de los macrófagos y, de todos ellos, la fracción 3 del complemento parece tener un papel predominante. Los ligandos de Leishmania para esta unión han sido adscritos a los glucoconjugados de su superficie como la Zn-proteinasa (gp63) y los lipofosfoglucanos44,45. Así mismo, se piensa que éstos y otras ectoenzimas y moléculas de superficie desempeñan algún papel en la supervivencia de las leishmanias dentro de los lisosomas y su replicación.
Otro mecanismo potenciador de la infectividad estudiado en P. papatassi, es la inhibición de la producción de óxido nítrico (NO) por el macrófago activado, factor fundamental de defensa del mismo; su inhibición por parte de las leishmanias es totalmente determinante de la supervivencia de éstas46,47.
Recientemente se ha puesto de manifiesto la capacidad de los amastigotes de inducir una intensa producción de interleucina 10 (IL-10) por parte de los macrófagos, haciéndolos refractarios al influjo de interferón gamma (IFN-γ) para su activación y disminuyendo su producción de IL-12 y factor de necrosis tumoral alfa (TNF-α), e impidiendo la lisis del parásito48.
Un factor importante que posiblemente se correlacione con la agresividad de las lesiones cutáneas es la variable actividad de las enzimas del metabolismo energético (hexoquinasa, glucosa-6-fosfato deshidrogenasa, lactato deshidrogenasa [LDH]) en diferentes especies de Leishmania. L. tropica tiene una actividad enzimática mucho menor que L. major y las lesiones producidas por esta última son de mayor intensidad y agresividad que las que ocasiona L. tropica.
En resumen, en el inicio de la infección se aúnan una serie de factores dependientes del vector (picaduras múltiples, sustancias de la saliva facilitadoras de la infección) y del parásito (mecanismos activos de invasión y mecanismos de elusión o neutralización de la primera línea de defensas del huésped), que van a concluir en el éxito inicial de la infección48-50.
No por ello va a progresar necesariamente la enfermedad, sino que la infección puede permanecer latente y asintomática, o involucionar posteriormente y concluir con la cicatrización de las lesiones.
Para que la enfermedad se desarrolle es necesaria una respuesta inmunitaria inadecuada a una serie de determinantes patógenos del parásito. Estas moléculas son epitopos inmunológicamente activos capaces de reorientar la respuesta inmunitaria del huésped no sólo hacia un final improductivo, sino al arranque de alteraciones inmunopatológicas que se traducen en síntomas clínicos.
Progresión de la infección y la respuesta inmunitaria
En primera instancia, el huésped despliega su capacidad defensiva mediante la respuesta inflamatoria local y sistémica (respuesta de fase aguda) y la interacción de moléculas y células en lo que llamamos respuesta inmunitaria, al tiempo que el parásito explotará al máximo sus posibilidades de infectividad, patogenicidad y virulencia para contrarrestar dichas defensas, eludiéndolas o anulándolas.
La inmunidad celular es fundamental en la defensa contra las leishmanias y está específicamente ligada a la función de los linfocitos T CD4+ colaboradores, mientras que la inmunidad humoral tiene un papel escaso50.
La activación de los linfocitos T precisa de la función de las células presentadoras de antígeno (fundamentalmente las células de Langerhans) y de la interacción de los ligandos del linfocito con otros receptores de dichas células merced a moléculas coestimuladoras (citocinas y moléculas de adhesión) que actúan sinérgicamente. En este punto tienen un papel fundamental los componentes de la respuesta inmunitaria innata (complemento, células natural killer [NK] y macrófagos entre otros).
La determinación genética de la susceptibilidad o resistencia del huésped a la infección se ha demostrado en modelos experimentales murinos y existen datos a favor de que lo mismo ocurra en seres humanos, aunque aún no se han identificado determinantes genéticos en nuestra especie51,52.
Pero además, la respuesta del huésped también puede verse influida por factores externos, positiva o negativamente. La adquisición de inmunidad frente a Leishmania en personas que no han experimentado infección clínicamente aparente y que viven en zonas endémicas ilustra el aspecto positivo, mientras que la concurrencia de enfermedades o medicaciones inmunosupresoras conlleva una precipitación o agravamiento de la enfermedad, en algunos casos de forma devastadora, como en la coinfección Leishmania/VIH.
El conocimiento de la respuesta inmunitaria en la infección por Leishmania se ha desarrollado fundamentalmente a partir de modelos experimentales, en particular ratones, que permiten conocer el desarrollo de dos subpoblaciones de linfocitos T colaboradores, Th1 y Th2. La identificación de estas subpoblaciones está basada en el diferente perfil de producción de citocinas que se desencadena ante la estimulación antigénica53,54.
Los Th1 segregan IFN-γ, IL-2 y TNF-β y están asociados a funciones de la inmunidad celular, como la activación de macrófagos y la hipersensibilidad retardada. Los Th2 producen IL-4, IL-5, IL-9, IL-10 e IL-13 y se relacionan con la inmunidad humoral, en especial las respuestas mediadas por inmunoglobulina E (IgE)55-58.
De acuerdo con lo anterior, en términos generales, las estirpes de ratones capaces de generar una respuesta Th1 presentan resistencia a la infección por Leishmania, mientras que las que desarrollen una respuesta Th2 sucumbirán a ella. No obstante, la susceptibilidad o resistencia es un asunto de suma complejidad en el que influyen otros muchos factores y las investigaciones actuales en modelo experimental están encontrando permanentemente nuevos datos y algunas respuestas paradójicas59-64.
El conjunto esencial de acontecimientos que ocurre cuando un ratón es infectado por Leishmania y su respuesta inmunitaria es adecuada, se muestra en la tabla 6.
Además de las subpoblaciones Th1 y Th2 existen datos sugerentes de la existencia de otras subpoblaciones CD4+ que intervendrían en la respuesta inmunitaria55, así como los linfocitos T supresores, CD8+65,66, las células NK, una pequeña subpoblación gamma delta T67 y los linfocitos CD1868. En el modelo murino, todas estas células pueden tener un papel protector frente a Leishmania, pero de menor rango que el de los CD4+, que es determinante.
En la infección humana, se encuentran perfiles de citocinas mixtos, Th1 y Th2 y el predominio de Th1 y/o linfocitos T CD8+ se asocian con la resolución. Ello sugiere que, en los seres humanos, lo que determina la progresión o no de la enfermedad es el balance entre linfocinas que activan o suprimen la actividad macrofágica.
Diseminación de la enfermedad
El primer paso de diseminación se lleva a cabo por las células de Langerhans de la epidermis y otras subpoblaciones de leucocitos dendríticos cutáneos, que emigran a dermis, entre las 24-96 h de la inoculación en los modelos experimentales, donde fagocitan a los promastigotes y posteriormente se dirigen, por los vasos linfáticos aferentes, hacia los ganglios linfáticos. Además de su función fagocítica y al igual que otros macrófagos, los leucocitos dendríticos tienen una función fundamental de presentadoras de antígeno y consecuente activación linfocitaria. En la infección tardía los macrófagos localizados en los ganglios también expresan antígenos y contienen amastigotes23,71-74.
La diseminación hematógena, más asociada a la leishmaniasis visceral, también se ha demostrado en la leishmaniasis cutánea y es vehiculada por los macrófagos y monocitos sanguíneos. La existencia de lesiones metastáticas localizadas fuera de la ruta de drenaje linfático apoyan la diseminación por vía hemática23.
Los traumatismos preceden ocasionalmente la aparición de lesiones específicas de leishmaniasis74,75. Ello sugiere la existencia de un mecanismo inflamatorio inespecífico, con el desarrollo de lesiones secundarias en el lugar de la agresión. Experimentalmente se ha comprobado que los estímulos negativos desencadenarían la producción por los queratinocitos de IL-1 y TNF-α los cuales inducirían la expresión de moléculas de adhesión intercelulares, extravasación de leucocitos y su acumulación en el lugar de la inflamación23,76,77.
Probablemente en la infección humana ocurra algo parecido y el traumatismo propicie el influjo de los monocitos infectados y macrófagos mononucleares, reactivándose la infección. Alternativamente, los parásitos quiescentes, presentes en la piel normal de los sujetos infectados, serían captados por los macrófagos, en respuesta a los mediadores de la inflamación, y transportados a los ganglios linfáticos, donde se desencadenaría la respuesta inmunitaria y, finalmente, la patogenia23,77.
MANIFESTACIONES CLINICAS
Las manifestaciones clínicas de las leishmaniasis son extraordinariamente variadas y dependen de la interacción de factores del parásito como son el tropismo de la especie y su capacidad infectiva, patogenicidad y virulencia, de factores dependientes del vector, como el número de picaduras o la composición de su saliva, y de la situación inmunitaria y susceptibilidad genética del huésped.
Este polimorfismo clínico se agrupa en cuatro formas diferentes: leishmaniasis visceral o kala-azar (fiebre negra), la forma más grave, con mortalidad del 100 % si no se trata; leishmaniasis mucocutánea o espundia, que produce extensas lesiones destructivas de la mucosa nasal, oral y faringe dando lugar a terribles desfiguraciones; leishmaniasis cutánea de la que nos ocuparemos más detenidamente y coinfección Leishmania/VIH, a la que aludiremos posteriormente por su importancia en la actualidad y en nuestro medio.
LEISHMANIASIS CUTANEA
Sinonimia
Botón de Oriente, úlcera de Oriente, botón de Biskra, botón de Alepo, forúnculo de Jericó, forúnculo de Delhi, salek («año corto», en Irán), al okht («la hermanita», en Arabia Saudí), úlcera de chiclero en América central y del sur, etc. Entre nosotros, el término botón de Oriente (Villemin, 1854) ha desplazado al resto.
Incubación
En el lugar de la picadura aparece una pápula eritematosa, inespecífica, similar a cualquier picadura de mosquito, que se resuelve de forma espontánea, o, tras un periodo variable, entre una semana y 3 meses de promedio, da lugar a una lesión específica de leishmaniasis cutánea. La duración de la incubación depende de diversos factores, como la especie de Leishmania y la cantidad de parásitos inoculados; también parece ser más corta en los visitantes a un área endémica que en los residentes en la misma78,79.
Leishmaniasis cutánea aguda
Es la forma más habitual y comprende aquellos casos de menos de un año de evolución si se trata de infecciones zoonóticas y de 2 años si son antroponóticas. Está causada con más frecuencia por L. tropica, L. major, L. infantum (en la cuenca mediterránea occidental fundamentalmente) y L. aethiopica, en el Viejo Mundo y L. mexicana y L. braziliensis en el Nuevo Mundo. La localización preferente es la cara y, en general, áreas descubiertas, por la natural accesibilidad a la picadura.
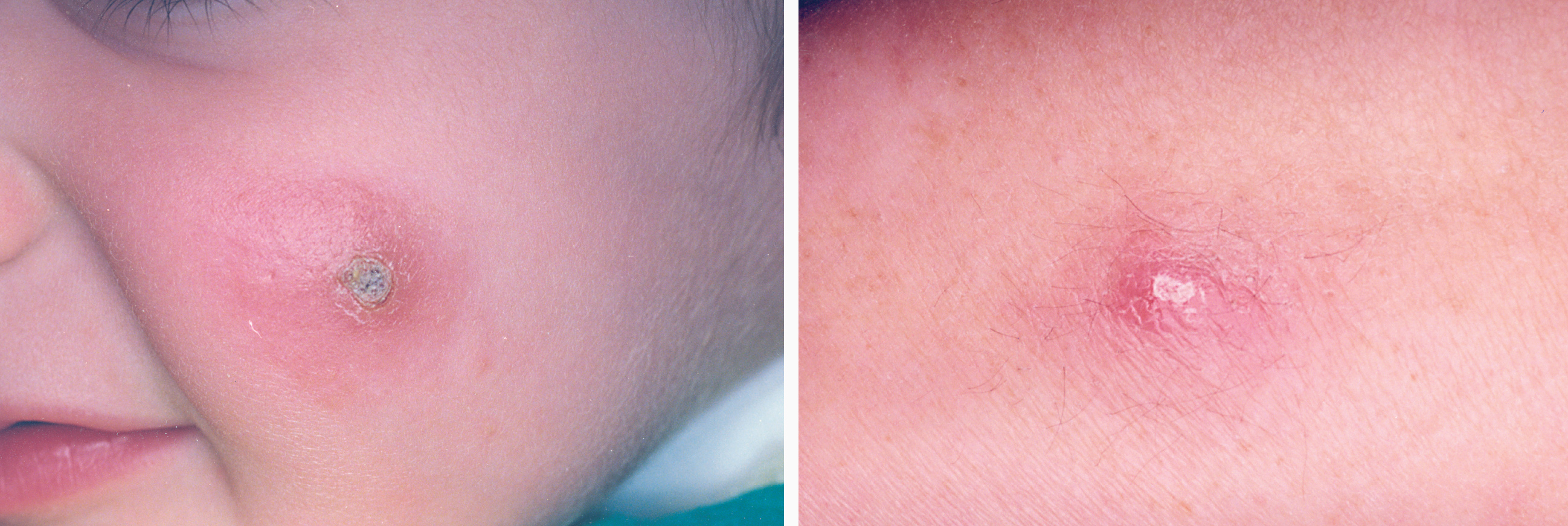
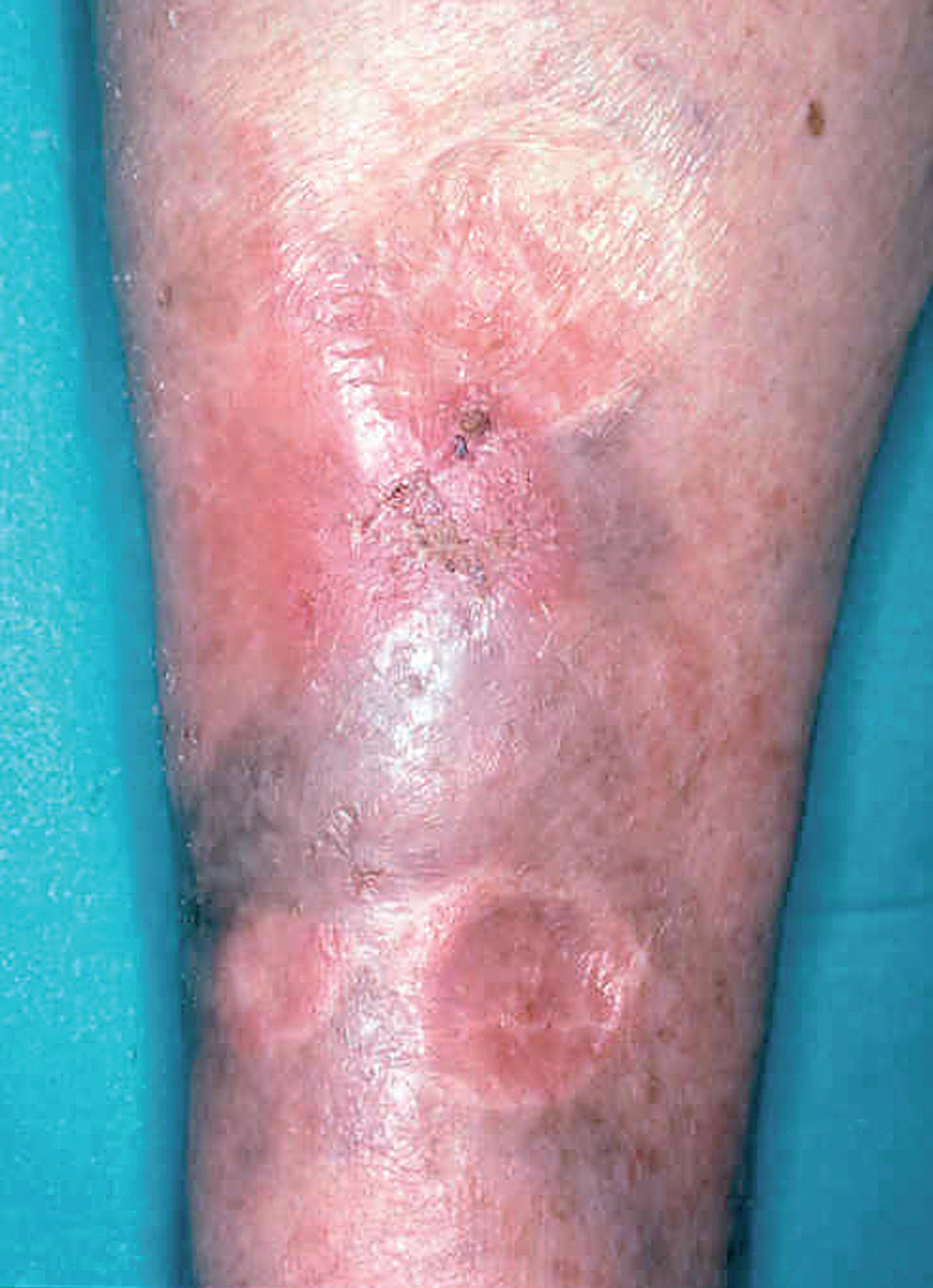
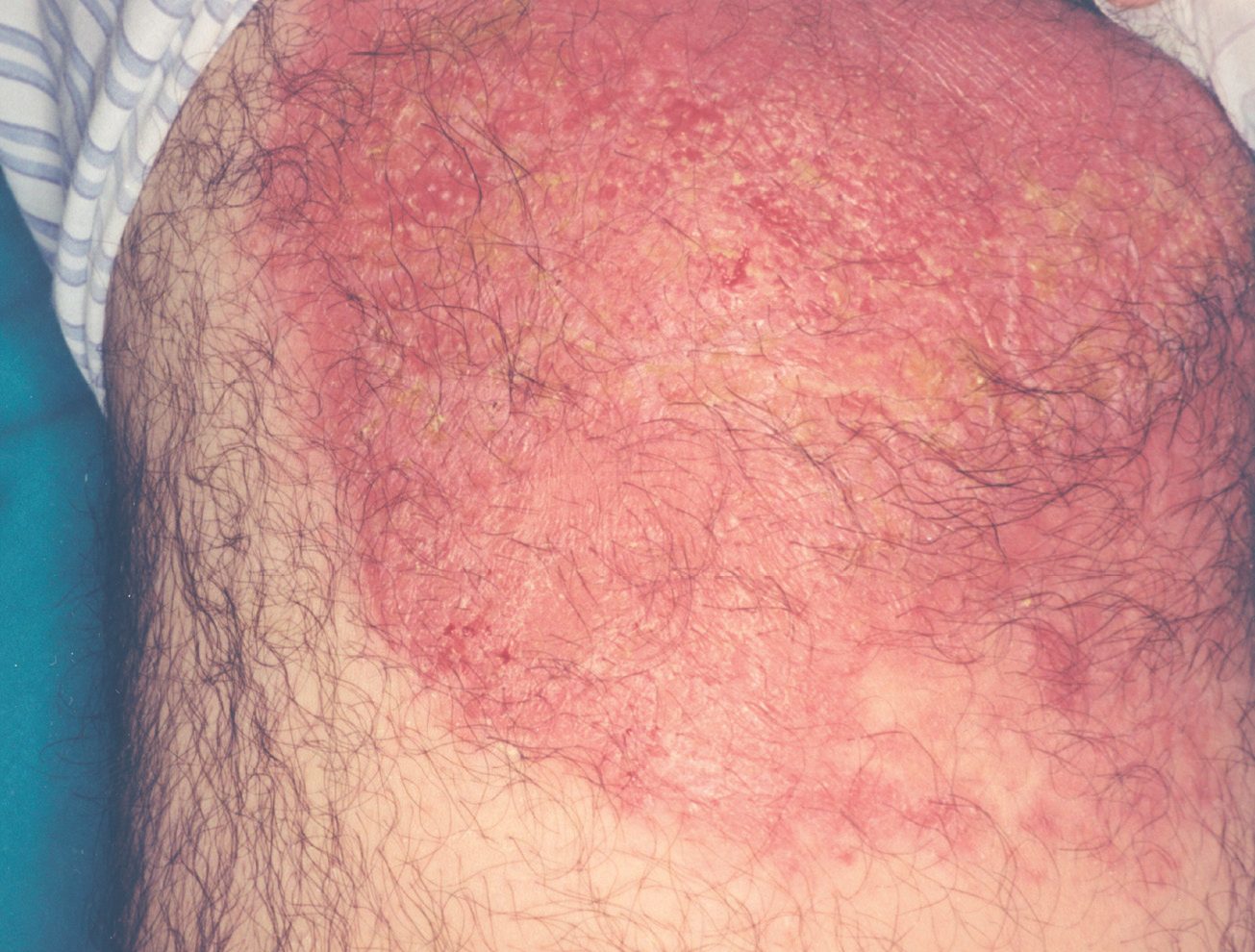
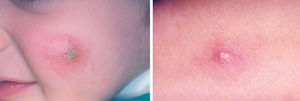
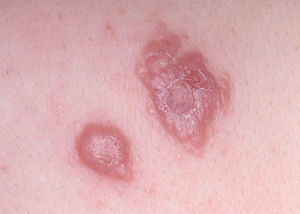
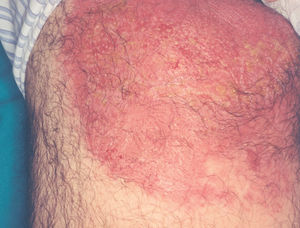
La lesión ya establecida de leishmaniasis, inicialmente papulosa, redondeada u ovalada, asintomática o levemente pruriginosa, puede ser única o múltiple y de localización preferente en cara o áreas de piel descubiertas (figs. 5 y 6). Paulatinamente va tomando un tono rojizo más oscuro, al tiempo que se infiltra y aumenta de tamaño. La superficie se cubre ocasionalmente de escamas furfuráceas y, en 1-3 meses se va transformando en una lesión nodular, o una placa infiltrada en profundidad, en cuyo centro comienza a brotar un exudado seropurulento cuya desecación da lugar a una costra firmemente adherida (fig. 7). En algunos casos, al desprender la costra, se aprecian en su cara profunda una serie de espigones córneos, similares a los de las lesiones hiperqueratósicas de lupus eritematoso discoide (fig. 8), y bajo ella aparece una úlcera de bordes más o menos elevados y fondo irregular cubierto por un exudado seropurulento. En esta fase, la lesión puede tener una dimensión variable, entre 2 y 8 cm incluso más, la piel que la recubre tiene un tono rojo vinoso-violáceo, aspecto ligeramente arrugado, como tafilete, y con frecuencia está rodeada de una zona edematosa e indurada. Puede haber satelitosis por linfangitis nodular y adenopatías, en especial en la leishmaniasis cutánea del Nuevo Mundo23,70,79-82.
Figs. 5 y 6.--Botón de Oriente, en sus primeras fases evolutivas.
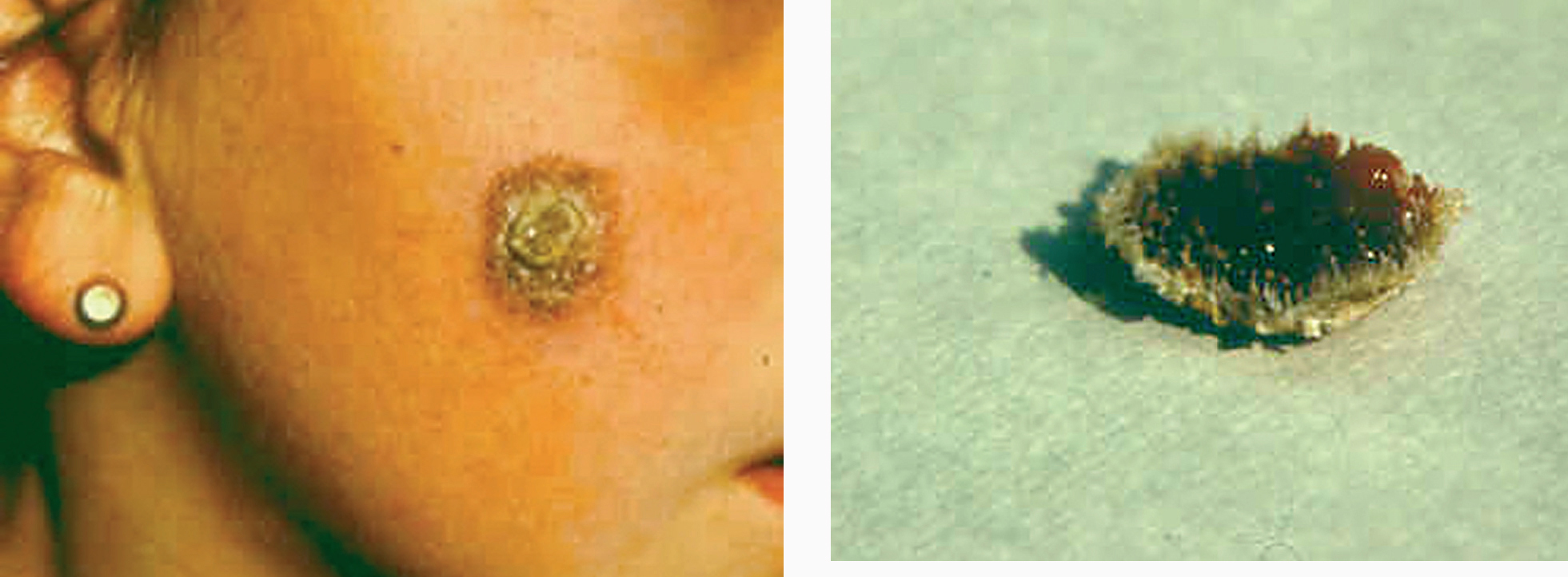
Figs. 7 y 8.--Forma hiperqueratósica. Pueden apreciarse los «espigones córneos» en la base de la costra, tras su desprendimiento182.
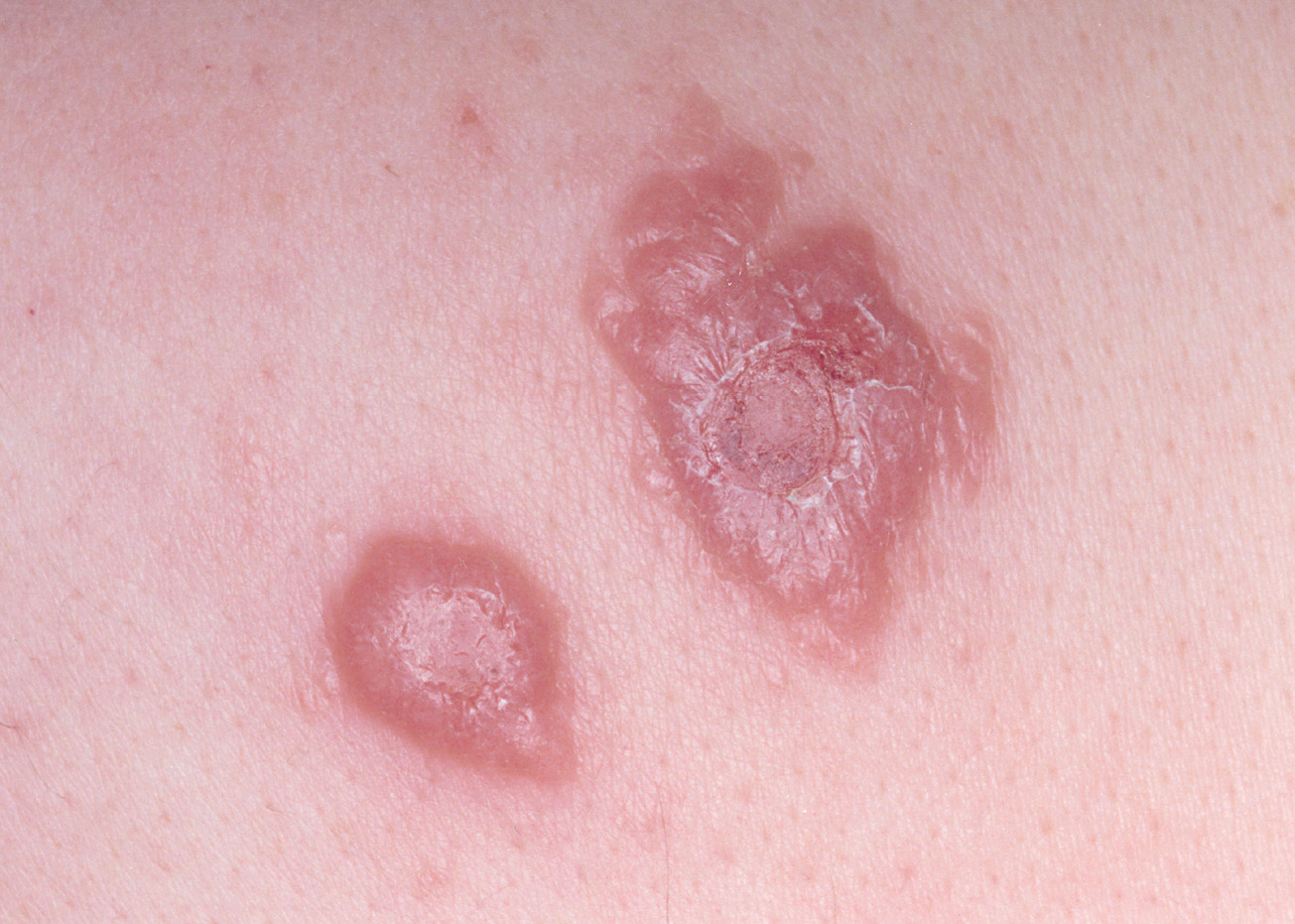
En nuestra experiencia, algunas lesiones no llegan a ulcerarse en varios meses de evolución (fig. 9), y aunque no hemos esperado a la autoinvolución, por haberlas tratado, ello coincide con las observaciones de otros autores como Dowlati83.
Fig. 9.--Lesiones de varios meses de evolución, en las que no se ha producido ulceración182.
En esta situación de madurez, la lesión puede permanecer durante varias semanas e incluso meses; después, la secreción cesa y comienza la regresión y reparación de la lesión a partir del centro, hacia el exterior, en un tiempo variable, y concluyendo con la formación de una cicatriz lisa o rugosa, deprimida, hiper o hipocrómica y habitualmente inestética. En la infección producida por L. ethiopica el curso es más lento y la autorresolución puede prolongarse hasta 5 años. Por el contrario, las lesiones cutáneas producidas por L. infantum son más leves y habitualmente de menor duración.
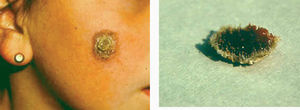
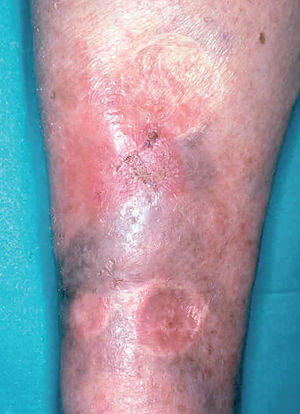
Las formas clínicas son extraordinariamente variadas (hacia 1940 ya se habían descrito más de 20). La lesión puede ser única o múltiple84-86 (fig. 9) adoptar la típica forma nodular ulcerocostrosa o formas alargadas siguiendo las arrugas o los pliegues cutáneos, formas eczematiformes, en placa87, hiperqueratósicas, verrugosas y papilomatosas (Fergusson y Richard), zosteriformes, erisipeloides, esporotricoides, o presentarse como una macroqueilia88 (fig. 10); existen formas que simulan una conectivopatía (lupus eritematoso, dermatomiositis)89-91 o un lupus tuberculoso (formas lupoides)92-94. Los autores franceses como Degos y De Graciansky, entre otros, incluyen una forma en nappe (mantel) que probablemente se corresponde con la forma erisipeloide. Así mismo se han descrito formas fagedénicas (fig. 11) y tumorales95,96, de las cuales la forma clásica era la llamada «úlcera conglomerada de Castaigne», o manifestarse como un cuerno cutáneo. El diagnóstico diferencial es tan variado como la sintomatología y debe plantearse individualmente de acuerdo con la localización y el aspecto de la lesión78,79 (fig. 12).
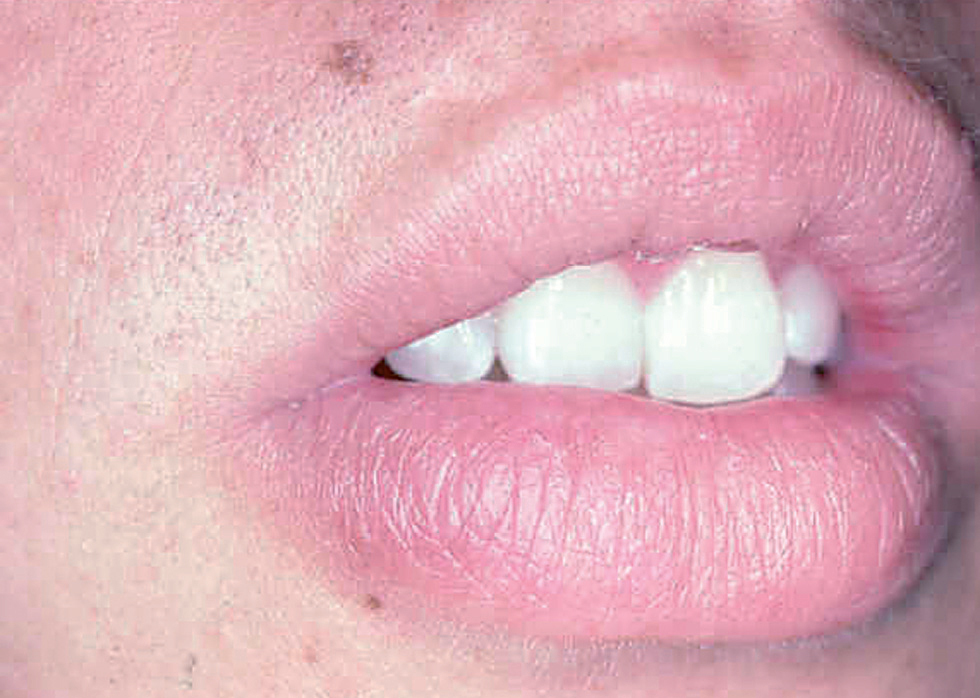
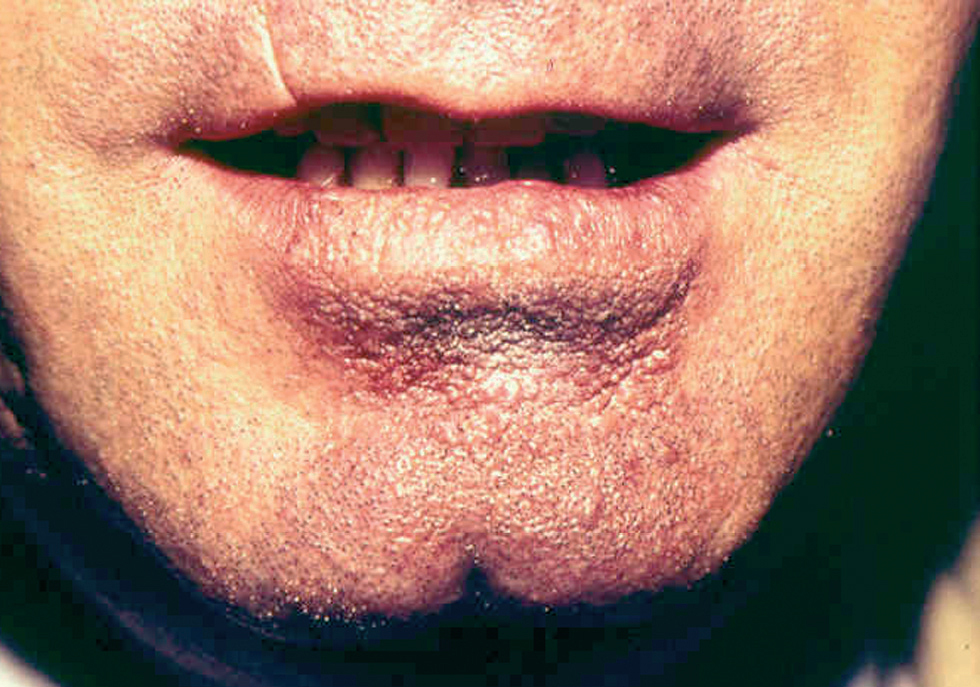
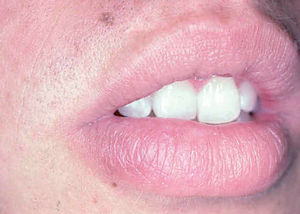
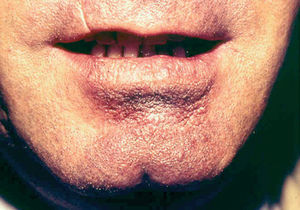
Fig. 10.--Presentación como macroquelia por picadura en el labio inferior.
Fig. 11.--Forma fagedénica con tendencia a ulceración y cicatrización progresiva por los bordes182.
Fig. 12.--Placa inguinocrural de 5 años de evolución que simula una dermatofitosis.
Leishmaniasis cutánea de inoculación mucosa
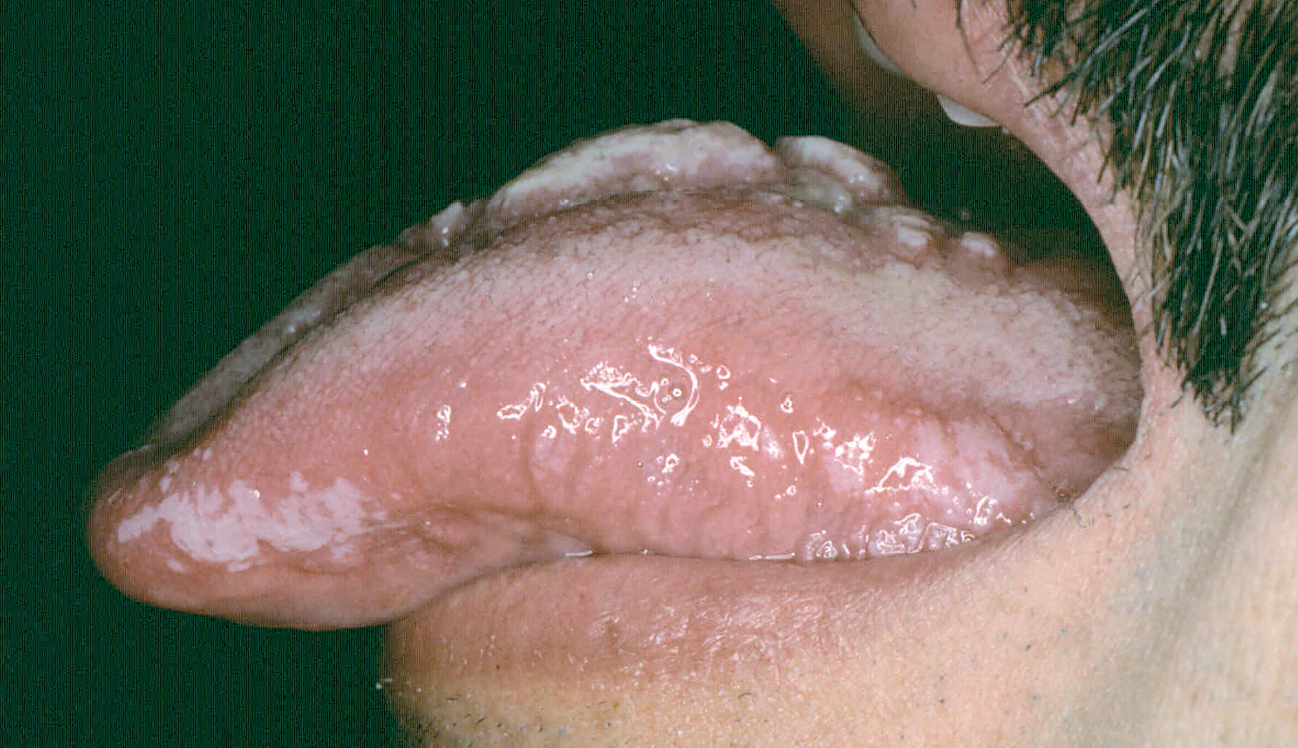
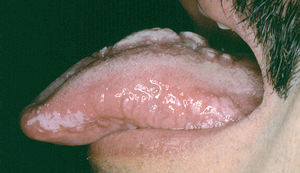
Ocasionalmente, la picadura se produce en las mucosas expuestas, nasal, labio (fig. 13), lengua (fig. 14) o laringe por inhalación del mosquito, dando lugar a una lesión que progresa con sintomatología variable, según la localización. Puede simular un furúnculo de la ventana nasal, un angioedema de labio o una queilitis granulomatosa88, o manifestarse como ronquera apareciendo en la laringoscopia como un pólipo de cuerda vocal, una leucoqueratosis o una masa de aspecto epiteliomatoso.
Fig. 13.--Placa de larga evolución, iniciada en picadura en labio inferior.
Fig. 14.--Paciente con sida en cuya lengua puede apreciarse la coexistencia de una lesión de leishmaniasis en dorso lingual, con una leucoplasia vellosa en margen lingual.
Se trata de una forma comunicada desde hace mucho tiempo en la literatura97,98, pero que no se ha individualizado como tal y creemos que debe hacerse, por lo que proponemos la denominación de «botón de Oriente de inoculación mucosa», o, «leishmaniasis cutánea de inoculación mucosa», para diferenciarla de las formas cutáneas que invaden de forma secundaria la mucosa o las formas cutaneomucosas, completamente diferentes en su evolución y pronóstico y que no se ven en nuestro medio, salvo casos importados.
Leishmaniasis cutánea crónica
Incluye los casos que exceden en duración a las formas agudas. Las lesiones suelen más polimorfas (grandes placas induradas de borde papuloso, eczematiformes, verrugosas, de aspecto queloideo, etc.) y a la dificultad clínica del diagnóstico se suma una menor sensibilidad del examen microscópico de frotis, de los cultivos y de la histopatología, debido a la escasez de amastigotes en las lesiones. La respuesta al tratamiento es habitualmente peor que en las formas agudas23,78,82.
Una forma clínica peculiar es la leishmaniasis lupoide, Leishmania recidiva cutis o Leishmania recidivans78,83-85, así llamada porque sobre una lesión ya cicatrizada aparecen nuevas lesiones papulosas simulando un lupus vulgar. Algunas de estas nuevas lesiones pueden evolucionar hacia la ulceración y otras involucionar de forma espontánea. El mecanismo de reactivación de las lesiones podría ser una reinfección o la reactivación de una infección latente, con un periodo de 1 a 15 años tras la cicatrización de la lesión aguda.
Suele estar asociada con L. tropica en el Viejo Mundo y con L. braziliensis en el Nuevo Mundo, donde es mucho más infrecuente23,70,99,100, aunque también puede producirse en la infección por L. infantum101. Debe diferenciarse de las formas agudas de tipo lupoide.
Leishmaniasis cutánea difusa o diseminada
Producida por L. aethiopica en el Viejo Mundo y L. mexicana complex en el Nuevo Mundo23,70,78, se inicia con una pápula o nódulo que se disemina inicialmente en la vecindad y luego a distancia con la aparición de numerosos nódulos, en cara y resto del tegumento, de modo similar a la lepra. En cara da lugar a facies leonina, como la lepra lepromatosa102,103. Las lesiones suelen ser asintomáticas y sin tendencia a la ulceración. Esta forma tiene mala respuesta al tratamiento y tiende a recidivar, aunque no hay afectación visceral.
La disminución de la reacción inflamatoria se debe a la falta de una respuesta de la inmunidad celular específica para Leishmania, lo que parece más determinante en el desarrollo y progresión del cuadro que la participación de zimodemos peculiares de las especies implicadas70,102,103.
Leishmaniasis dérmica tras kala-azar
Está producida por L. donovani y aparece como secuela en los pacientes de leishmaniasis visceral aparentemente curados, alrededor de un año después del tratamiento. Es más frecuente en la India, donde se presenta en el 20 % de estos pacientes, mientras que en África la proporción es de un 5 %102,104.
El cuadro consiste en la aparición de una erupción constituida por máculas, pápulas o nódulos, con escasa tendencia a la ulceración, en cara, tronco y extremidades. En la India es frecuente la presentación como máculas y placas hipopigmentadas asintomáticas.
COINFECCION LEISHMANIA/VIH
La asociación de la infección del VIH con la infección por Leishmania constituye una nueva enfermedad, extraordinariamente grave y de frecuencia creciente. Descrita por primera vez en España en 198515, se ha constituido como una amenaza real, en particular en el sudoeste de Europa.
De los 1.700 casos de coinfección comunicados a la Organización Mundial de la Salud (OMS), procedentes de 33 países, hasta 1998, 1.440 fueron de la zona: España (835), Italia (229), Francia (259) y Portugal (117). La mayoría eran varones, jóvenes (20-40 años) y adictos a drogas por vía parenteral. En América la mayor parte de los casos procedían de Brasil105,106.
En relación con las infecciones por Leishmania en inmunocompetentes, la coinfección presenta una serie de características diferenciales 15,105,107:
1. La picadura por el vector infectado en inmunocompetentes no supone necesariamente el desarrollo de la enfermedad, mientras que en inmunodeprimidos (por infección VIH u otras causas), existe un alto riesgo de desarrollo de leishmaniasis visceral, de forma rápida y grave.
2. El sida y la leishmaniasis visceral se insertan en un círculo vicioso de refuerzo mutuo. El sida incrementa el riesgo de leishmaniasis visceral entre 100 y 1.000 veces en áreas endémicas. Las dos enfermedades producen una disminución sinérgica de la respuesta inmunitaria, al destruir las mismas células.
3. El uso de agujas intravenosas en adictos a drogas permite la transmisión directa de persona a persona, lo que constituye un nuevo patrón de transmisión de la enfermedad en el que un nuevo ciclo antroponótico artificial se añade al ciclo zoonótico convencional. Además, el colectivo de pacientes coinfectados se constituye en un nuevo reservorio no existente previamente15,16.
4. El diagnóstico de la coinfección presenta dificultades específicas, debidas fundamentalmente a la destrucción de las mismas células y consiguientemente de la respuesta inmunitaria por ambos agentes infecciosos: sintomatología inusual, en la que no siempre están presentes los signos y síntomas habituales107-111 (fig. 14), falsas negatividades serológicas en el 42,6 % de los pacientes coinfectados, enfermedades asociadas como toxoplasmosis y tuberculosis y dificultad de diagnóstico parasitológico. La punción medular es la técnica más sensible y segura para la búsqueda de amastigotes y, si no es posible realizarla, se deben buscar parásitos en sangre periférica. También se han utilizado punciones hepáticas y esplénicas.
5. El tratamiento presenta así mismo serias dificultades, por disminución de la eficacia de los medicamentos, recidivas por resistencias al tratamiento (más del 50 % comparado con el 10 % en inmunocompetentes) y acumulación de efectos secundarios.
La educación sanitaria, en particular a los colectivos de riesgo, adictos a drogas fundamentalmente y declaración de los nuevos casos son factores importantes en la prevención, que deben estar imbricados en los esfuerzos de colectividades y organizaciones implicados en el tema.
Desde 1994, una red de vigilancia epidemiológica auspiciada y supervisada por la OMS105 viene reuniendo datos inicialmente en 13 países. Esta red se ha hecho extensiva a 28 instituciones y continúa creciendo y estableciendo laboratorios de referencia y hospitales, con una infraestructura capaz de diagnosticar y tratar a los pacientes coinfectados.
Los centros de seguimiento siguen protocolos proporcionados por la OMS y el UNAIDS (programa de las Naciones Unidas sobre el sida) para llegar a conclusiones homogéneas.
DIAGNOSTICO
El diagnóstico habitual de la leishmaniasis cutánea se fundamenta en tres pilares:
1. La sintomatología.
2. Los exámenes microscópicos: investigación de los parásitos en frotis de exudados, punción-aspiración con aguja fina112,113 y estudio de biopsias cutáneas.
3. Comportamiento de la respuesta inmunitario celular: test de Montenegro.
Otras técnicas de diagnóstico a las que se aludirá posteriormente, o tienen escaso interés como la serología o, por su complicación y coste económico hacen que sean reservadas para casos especiales o para su aplicación en investigación.
Clínica
Como ya se ha comentado más extensamente, el polimorfismo clínico es extraordinario, lo que obliga a plantear diagnósticos diferenciales a veces complejos. No obstante, en las zonas endémicas, particularmente, puede existir, en las formas típicas, una certeza diagnóstica muy razonable, a pesar de lo cual suele ser recomendable hacer una confirmación con uno o más de los otros métodos78,79.
Diagnóstico parasitológico
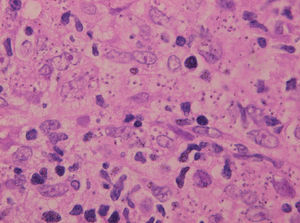
Es el procedimiento más sencillo y útil, cuando es positivo. Consiste en el examen microscópico de frotis de exudado de la lesión o de la extensión tras punción-aspiración con aguja fina de la misma, para comprobar la existencia de amastigotes (fig. 2). La tinción con Giemsa del frotis permite observar los amastigotes dentro o fuera de los macrófagos como cuerpos redondeados u ovales, de color azul claro, con un núcleo y un quinetoplasto puntiforme, ambos de color púrpura, en el interior de su citoplasma78,112.
Histopatología
Existe una correlación entre la presentación clínica, a su vez mediatizada por la inmunidad celular del paciente y los hallazgos histológicos: la existencia de gran número de amastigotes y muchos histiocitos sin otras células inflamatorias indica una mala respuesta inmunitaria, un número moderado o escaso de amastigotes suele asociarse a necrosis o formación de granulomas y es sintomático de una inmunidad celular adecuada.
Leishmaniasis cutánea aguda
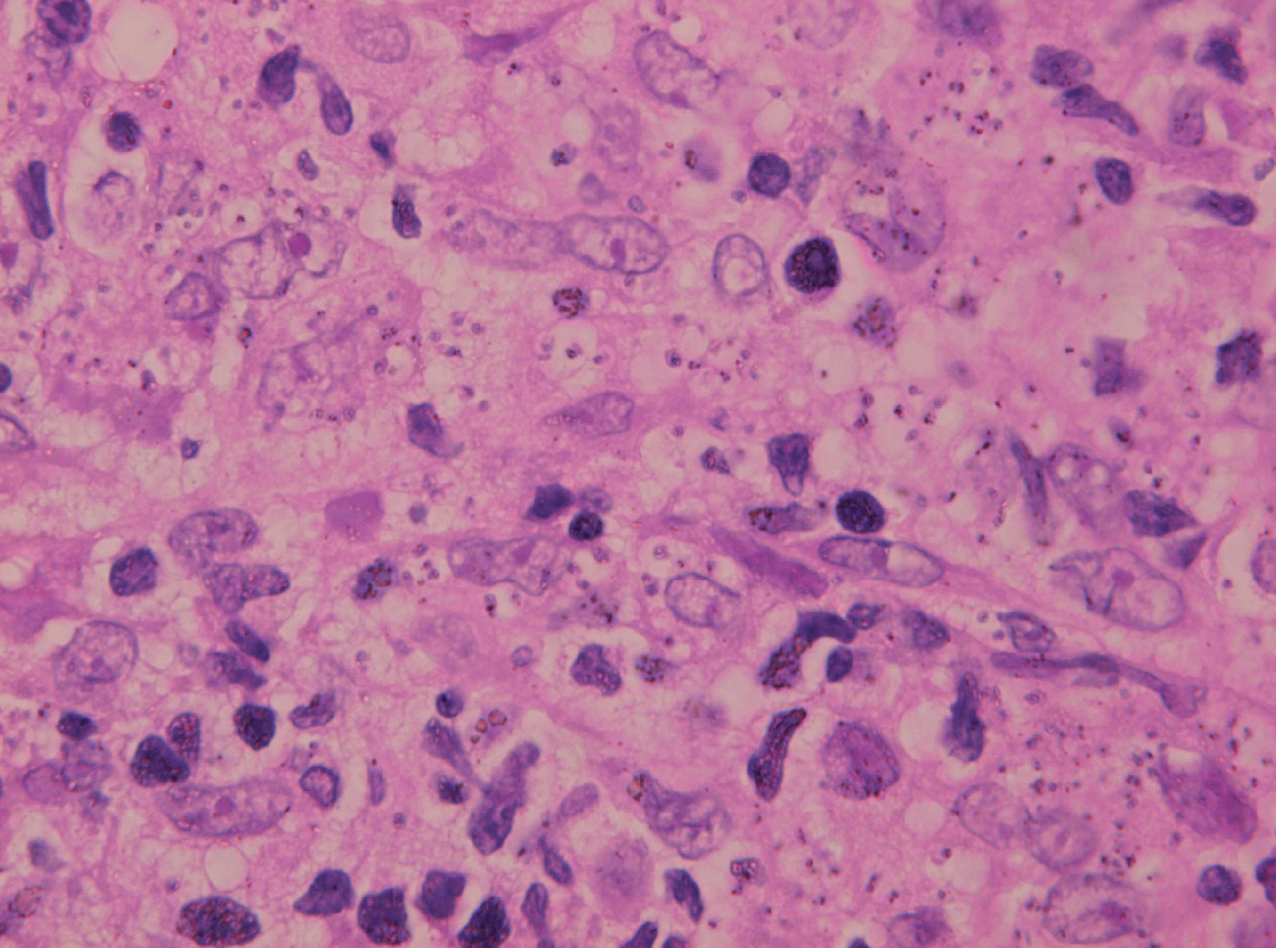
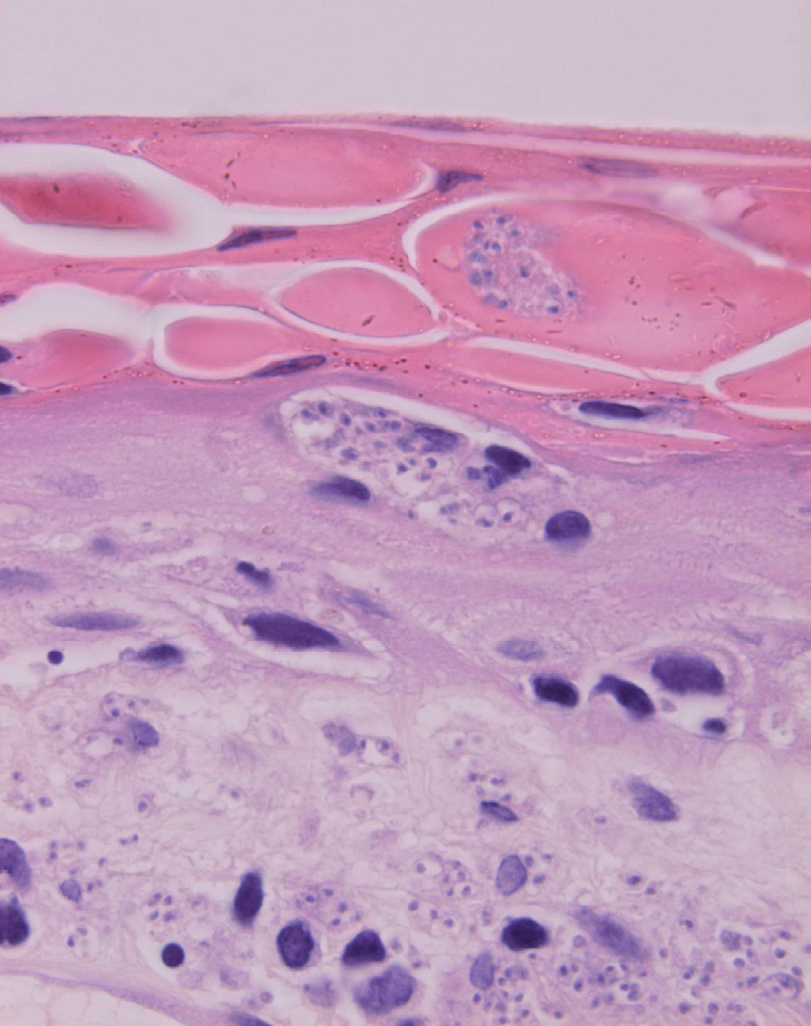
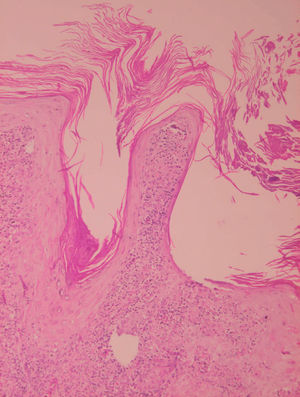
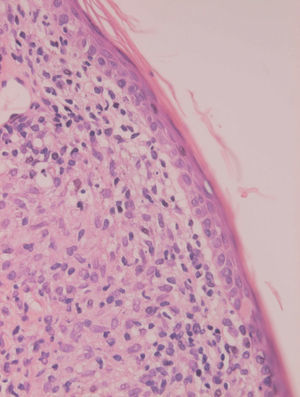
Inicialmente hay un infiltrado dérmico denso y difuso compuesto fundamentalmente por histiocitos, linfocitos y células plasmáticas con «cuerpos de Russel» eosinofílicos, que indican producción de inmunoglobulinas. También se encuentran neutrófilos y eosinófilos, generalmente escasos. Los amastigotes pueden verse en el interior de los macrófagos y también en el espacio extracelular (fig. 15). La ulceración es frecuente y en ocasiones pueden verse focos de necrosis dérmica. Conforme avanza la lesión, se van formando granulomas epitelioides inicialmente en la dermis superior, que pueden ocupar toda la dermis. Pueden verse células gigantes de tipo Langhans y el número de células plasmáticas aumenta, mientras que el número de amastigotes disminuye y su presencia sólo se puede apreciar en la mitad de los casos de evolución tardía de la leishmaniasis cutánea aguda (figs. 16 y 17).
Fig. 15.--Aspecto del infiltrado, con numerosas leishmanias en el citoplasma de los histiocitos.
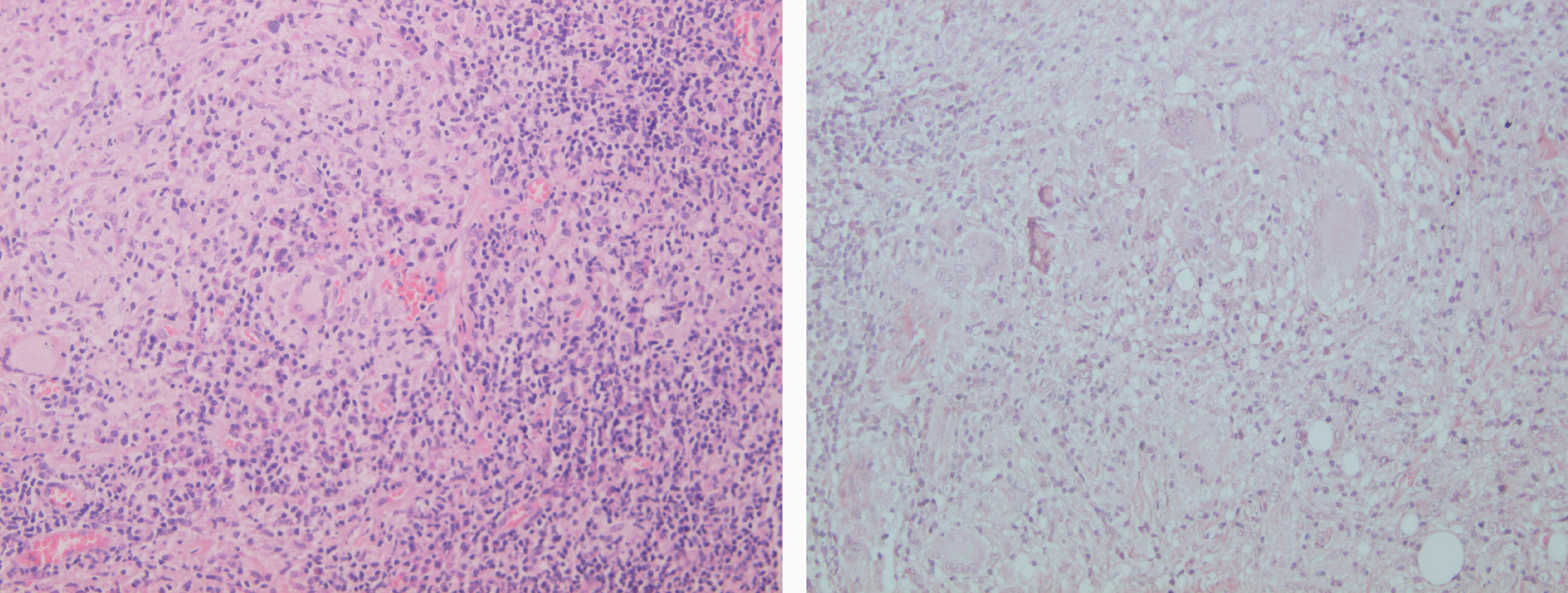
Figs. 16 y 17.--Formación de granulomas epitelioides con presencia de células gigantes.
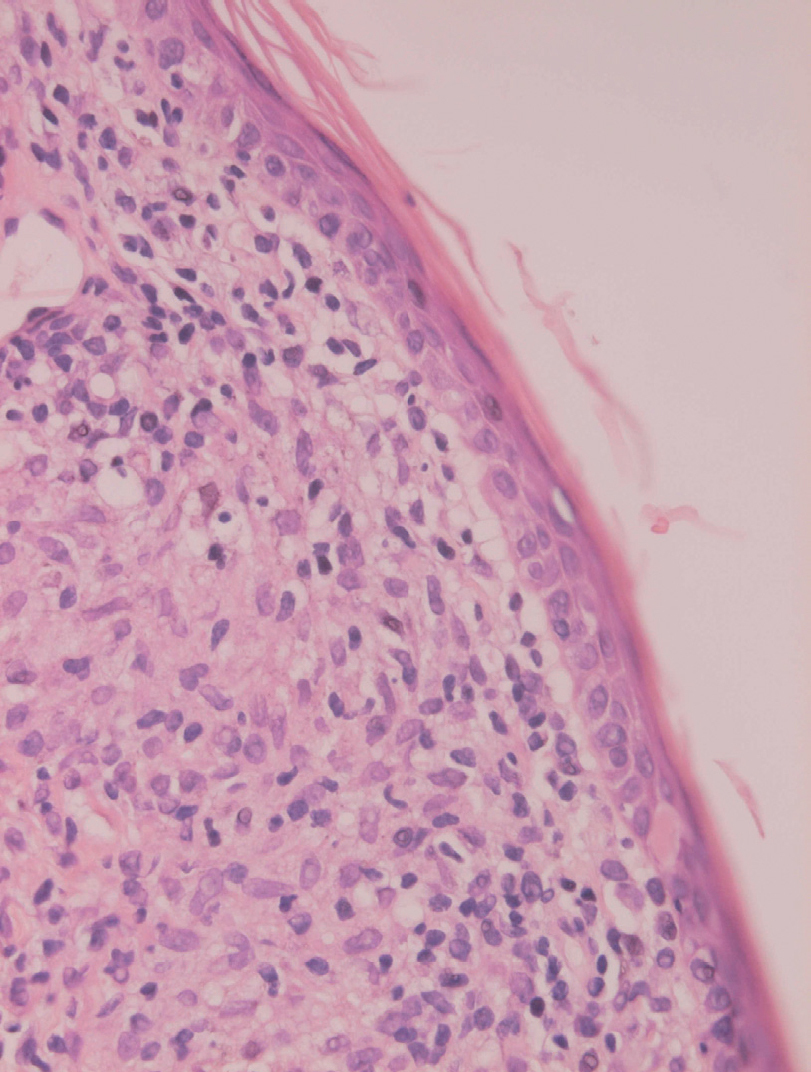
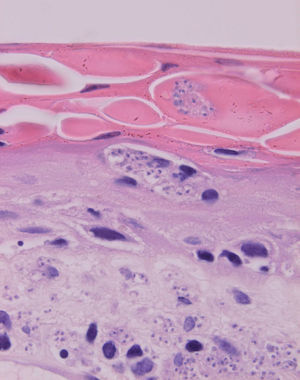
La epidermis suele presentar hiperqueratosis y acantosis (fig. 18), a veces con hiperplasia pseudoepiteliomatosa, aunque ocasionalmente aparezca paraqueratosis y atrofia. La hiperqueratosis folicular con formación de espigones córneos no es infrecuente y también puede producirse degeneración hidrópica de la capa basal (fig. 19). Infrecuentemente pueden verse microabscesos intraepidérmicos de neutrófilos, o amastigotes en el interior de los queratinocitos102,114-117 (fig. 20).
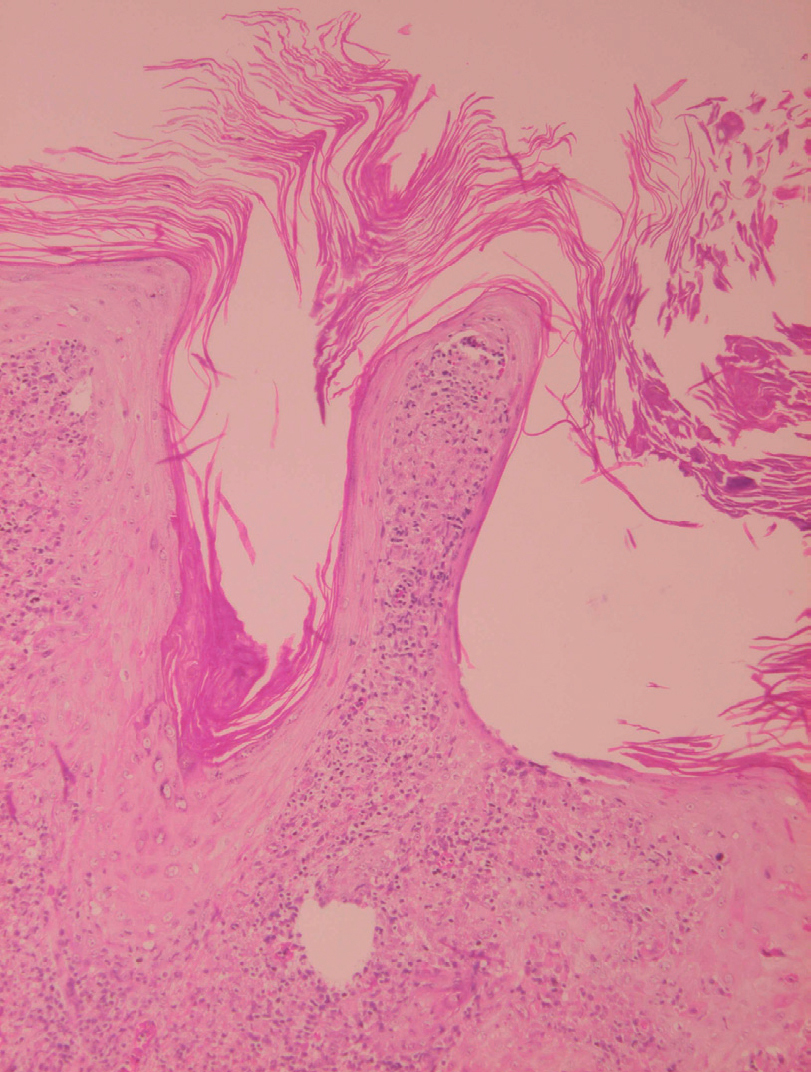
Fig. 18.--Hiperqueratosis con formación de tapones córneos.
Fig. 19.--Atrofia epidérmica y licuefacción de la capa basal.
Fig. 20.--Acumulaciones de amastigotes intraepidérmicos.
Leishmaniasis cutánea crónica
Las formas comunes no presentan grandes diferencias con los estadios tardíos de la leishmaniasis cutánea aguda. El componente granulomatoso se hace más predominante y hay más células plasmáticas, mientras que los amastigotes son más difíciles de encontrar. En cambio, el diagnóstico histológico de la leishmaniasis recidivans presenta serias dificultades, porque el cuadro histológico que ofrece es el de una granulomatosis epitelioide, no necrosante. La dermis está ocupada en todo su grosor por un denso infiltrado difuso o nodular compuesto por granulomas epitelioides bien organizados, rodeados por linfocitos y con la presencia ocasional de eosinófilos y células plasmáticas. El infiltrado puede estar junto a la epidermis, en cuyo caso puede aparecer hiperplasia pseudoepiteliomatosa, o dejar una banda de dermis respetada, zona Grenz, con una epidermis normal. En algún caso puede tener lugar una reacción liquenoide con atrofia epidérmica, hiperqueratosis folicular y degeneración hidrópica focal de la capa basal, acompañada de pérdida de pigmento de los melanófagos dérmicos. La atrofia y pérdida de folículos pilosebáceos es frecuente y hay una pérdida de fibras elásticas que se corresponde con el aspecto cicatricial de las lesiones en la sintomatología. Habitualmente no hay presencia de amastigotes en las lesiones102,115-120.
La histopatología de la leishmaniasis cutánea difusa es similar a la de la lepra lepromatosa, como lo es la sintomatología. La dermis está ocupada por un infiltrado de macrófagos vacuolados, dispuestos en un patrón difuso y sin formación de granulomas. Los amastigotes están presentes en gran número dentro y fuera de las células. Los linfocitos, células plasmáticas y células gigantes son escasos. La epidermis puede estar atrófica, ulcerada o hiperplásica115,121.
En la leishmaniasis dérmica tras kala-azar, suele haber atrofia epidérmica con hiperqueratosis folicular y, en dermis, el cuadro es similar al de la leishmaniasis lupoide. Cuando se observan parásitos, éstos son escasos104,115.
CoinfecciónLeishmania/VIH
En las lesiones cutáneas y mucosas puede verse un intenso infiltrado histiocitario que ocupa toda la dermis superior, con escasa presencia linfocitaria. Los amastigotes están presentes en gran número en el interior de los macrófagos y en el espacio extracelular, así en las células secretoras de las glándulas sudoríparas ecrinas y en el acrosiringio115,122-124.
La inmunohistoquímica es una técnica complementaria a la histopatología cuyo interés radica en la correlación de las situaciones clínica e inmunológica del paciente en estudio, por lo que no tiene utilidad práctica en la leishmaniasis cutánea no complicada. La inmunopatología muestra básicamente los rasgos de un respuesta inmunitaria celular con abundancia de linfocitos T con fenotipo activado que expresan receptores de IL-2 (CD25+), transferrina (CD71+) o moléculas de clase II del complejo mayor de histocompatibilidad en su superficie. En las lesiones localizadas el número de linfocitos T facilitadores (CD4+) y supresores (CD8+) es similar. La mayor parte de los linfocitos T tienen el receptor a/b, aunque un 20-30 % llevan el receptor g/d; estas últimas disminuyen en número conforme se cronifica la enfermedad54,70,102,115,125-127.
Prueba de Montenegro o de la leishmanina
Descrita por este autor en 1926128 consiste en la inyección intradérmica de una suspensión preparada con amastigotes muertos con fenol y se utiliza para valorar la respuesta inmunitaria celular. A las 48 y 72 h se hace la lectura de la reacción inflamatoria.
La positividad indica una infección activa o pasada. Es positivo en leishmaniasis cutánea localizada y en leishmaniasis mucocutánea, y negativa en la leishmaniasis cutánea localizada muy reciente, leishmaniasis diseminada y leishmaniasis tras kala-azar. En zonas endémicas la mitad de los sujetos a los que se practicó la prueba, sin signos de enfermedad presente ni pasada eran positivos, lo que sugiere una infección subclínica78,114,129,130.
No es una prueba específica de especie, por lo que la suspensión preparada con amastigotes de una especie de Leishmania es útil para valorar la reactividad de pacientes infectados con otra especie.
Otros procedimientos diagnósticos
Otros procedimientos diagnósticos se utilizan de modo más restringido con fines de investigación o para casos más concretos en la práctica clínica:
1. La inoculación intradérmica o subcutánea de aspirados de tejido sospechoso en hámsters y otros animales de laboratorio puede ser también un procedimiento útil, capaz de detectar la infección incluso pocos días después de producirse (Rab, 1994).
2. Una prueba útil, aunque es compleja y económicamente costosa, cuando los métodos rutinarios fallan o en niños pequeños con lesiones faciales, es el estudio in vitro de la proliferación de linfocitos T en presencia de antígenos de Leishmania, que consiste en poner en contacto una muestra de sangre periférica (una punción en un dedo es suficiente) y se cultiva en presencia de un extracto de amastigotes. Tras 6 días de incubación se evalúa la proliferación linfocitaria T y el perfil de citocinas78,114,130.
3. El cultivo en medio Novy-McNeal-Nicolle (NNN) o en el medio de Schneider para insectos, en presencia de suero de ternera, puede tener interés en situaciones clínicas determinadas o para investigación, pero no es útil para el diagnóstico habitual por el retraso que conlleva.
4. La serología (inmunofluorescencia, aglutinación directa y enzimoinmunoabsorción ligada a enzimas [ELISA]) no tiene interés en las formas cutáneas por falta de sensibilidad y especificidad.
5. La identificación de especies de Leishmania puede tener utilidad clínica en casos especiales, por ejemplo, en viajeros infectados en zonas endémicas. De las técnicas de identificación, el análisis isoenzimático es poco útil clínicamente por su complejidad. El uso de anticuerpos monoclonales dirigidos contra antígenos de género o especie específicos de Leishmania, permite la identificación en frotis, cultivos, o biopsias, pero debido a su coste se restringe, en principio, a la investigación78, aunque se están investigando nuevos anticuerpos que permitan obviar dicho inconveniente127. Más útil para la clínica es la PCR, de mayor sensibilidad que la microscopia convencional en la detección de parásitos, en particular cuando éstos son escasos, como ocurre en las lesiones antiguas. Esta técnica permite además la identificación de especie utilizando cebadores o primers basados en el ADN del quinetoplasto. A pesar de su indudable utilidad, todavía es una técnica costosa, por lo que su aplicación sigue estando restringida78,131-133.
PREVENCION Y TRATAMIENTO
Ya se ha comentado anteriormente que la prevalencia de la infección por Leishmania está claramente subestimada. Además, existen factores en el mundo actual que, sin duda, están contribuyendo a su progresión. El incremento de los viajes a zonas de endemia por motivos turísticos o laborales, el transporte de mercancías propio del comercio internacional, la emigración de zonas en donde el reservorio es humano a otras de mayor desarrollo en donde no existe la enfermedad o la transmisión es zoonótica, o de zonas no afectadas a zonas endémicas, los grandes movimientos de masas por guerras, la deforestación y el desarrollo agrícola, la reducción o eliminación de las campañas de fumigación de insecticidas contra el paludismo, urbanización incontrolada, precariedad de medios y condiciones sanitarias en áreas intensamente subdesarrolladas, la irrupción del sida y otros factores están provocando un incremento de la transmisión y diseminación de la enfermedad106,132-138.
En líneas generales, las actuaciones preventivas deben ir dirigidas en cuatro direcciones:
1.Información. Conocimiento adecuado de la distribución geográfica y características de la infección en cada zona, recogida de datos, refuerzo de las medidas destinadas a consolidar la declaración de los casos y educación sanitaria de la población general y formación específica del personal sanitario y auxiliar implicados en los programas de control.
2.Control de los vectores. El uso de insecticidas con acción residual en las casas, árboles y refugios de los mosquitos, mosquiteras, visillos y cortinas impregnadas con piretroides y collares insecticidas para perros, han sido algunas de las medidas utilizadas con distinto éxito según las zonas. Un mejor conocimiento de la biología del vector y la ubicación de sus puestas y sus larvas contribuirá a una mayor eficacia en este terreno30,136,138.
Las actuales técnicas de transferencia genética prometen una línea de actuación extraordinariamente interesante y ecológicamente «limpia»: la creación de mosquitos transgénicos en los que se introdujeran genes capaces de hacer resistente a la infección al propio vector e indujeran la destrucción del parásito en su tubo digestivo. El desplazamiento de la naturaleza de artrópodos transmisores por otros inocuos, probablemente supondrá una revolución en el control, no sólo de la leishmaniasis, sino de la malaria, dengue, fiebre amarilla y otras numerosas enfermedades parasitarias y virales transmitidas por este mecanismo.
3.Control de los reservorios. En nuestro medio debe llevarse a cabo el sacrificio de perros domésticos infectados, o su tratamiento cuando las fuertes implicaciones afectivas con los propietarios dificulten lo primero. En cualquier caso, los perros vagabundos infectados deben ser capturados y sacrificados36-38,136.
4.Medidas preventivas en humanos. Vacunas y diagnóstico precoz. Aún no existe una vacuna definitiva para las leishmaniasis. Se siguen realizando estudios en tres líneas diferentes, utilizando promastigotes muertos con diferentes adyuvantes, manipulando genéticamente al parásito e inoculando de forma directa ADN en células musculares de ratón69,70,136,139-150. No obstante, las características de prevalencia y benignidad de la leishmaniasis cutánea entre nosotros no indican el empleo de vacunas, aunque sí debe enfatizarse el diagnóstico y tratamiento precoces, para limitar la morbilidad de la enfermedad.
TRATAMIENTO (tabla 7)
Tratamiento tópico
La paromomicina es un aminoglucósido obtenido de Streptomyces rimosus, y se ha utilizado diversas formulaciones tópicas, particularmente la propuesta por El-On151,152: sulfato de paromomicina, 15 %; metilcloruro de benzetonio, 12 %; vaselina filante, c.s.H.p.s.a.
La pauta general de aplicación es de 2 veces al día entre 10 y 15 días. Aparte de la paromomicina, el metilcloruro de benzetonio tiene actividad contra la Leishmania, por sí mismo.
Existe un preparado comercial con esta formulación en Israel y otro en Irán, con excipiente diferente.
Otros aminoglucósidos con cierta actividad antileishmania son la gentamicina y kanamicina, pero de escasa utilidad clínica, al igual que la rifampicina.
El imiquimod es una imidazoquinolina, comercialmente disponible en crema al 5 % (Aldara, 3M Pharmaceuticals), cuya acción inmunomoduladora dio pie a su empleo en el tratamiento de los condilomas genitales causados por papilomavirus humano. Induce la expresión de INF-α, TNF-α y diversas interleucinas. Su principal diana son los monocitos/macrófagos. El imiquimod activa los macrófagos induciendo la producción de NO, lo que conlleva la destrucción intracelular de los amastigotes de Leishmania in vitro. Su aplicación tanto en ratones como en humanos está ofreciendo resultados prometedores153-156.
La anfotericina B liposomal en formulaciones tópicas con etanol se ha mostrado eficaz en ratones.
La miltefosina, una alquilfosfocolina utilizada como antineoplásico oral, ha demostrado eficacia tópicamente en ratones, pero, de momento, no parece tener éxito en humanos.
Se han ensayado otros tratamientos tópicos con imidazólicos, que han revelado mayor acción del clotrimazol que del miconazol, pero no parecen tener un papel de interés en el tratamiento tópico de la leishmaniasis cutánea.
Tratamiento intralesional
El empleo de antimoniales intralesionales con buenos resultados se remonta a la década de 194012,13,156-162.
En nuestra experiencia es el tratamiento de elección para las formas típicas de botón de Oriente uni o paucilesional, salvo que su localización167 o extensión168 no posibiliten la terapia intralesional. Se ha utilizado el antimoniato de meglumina (Glucantime®) y nos ha dado excelentes resultados con pautas variables de infiltración, de dos veces en semana a quincenal e incluso mensual y en dosis variables dependientes del tamaño de la lesión, entre 0,2 y 1 ml por lesión, reparándose sin cicatriz visible, o con cicatrices poco aparentes en general8,163. También se ha utilizado el estibogluconato de sodio (Pentostán®) con resultados similares164. Ambos son antimoniales pentavalentes que se transforman en trivalentes en el interior del macrófago para poder ejercer su acción, mediante el bloqueo del metabolismo energético del parásito.
Lo reducido de la dosis, con minimización de la toxicidad sistémica y disminución del coste, comodidad de aplicación, rapidez de respuesta y buen resultado estético avalan esta forma de tratamiento para las formas cutáneas del Viejo Mundo, aunque son necesarios más estudios controlados con placebo para validar en grandes series su eficacia. No existen datos disponibles sobre su eficacia en el Nuevo Mundo165.
Cirugía y terapéutica física
La cirugía no tiene lugar en el tratamiento de la leishmaniasis cutánea, con la excepción de la biopsia-extirpación en lesiones pequeñas que no hayan podido diagnosticarse por frotis. El legrado por sí solo no es curativo.
La termoterapia mediante agua a 39-41 °C en bañera circulante, la radiación infrarroja y el uso de ultrasonidos para producir hipotermia local, se han utilizado con éxito aparente, pero hasta el momento no existen datos de estudios controlados y de evolución a largo plazo169-171.
La crioterapia con nieve carbónica166 ha dejado paso a la aplicación de óxido nitroso (NO2) y posteriormente de nitrógeno líquido con buenos resultados, en algunos estudios no controlados. En una serie de 600 pacientes de Arabia Saudí, tratados con NO2, la tasa de curación fue sólo del 30 %. Por otra parte, la crioterapia produce con frecuencia hipopigmentación persistente en estos casos.
Sharquie et al172 han utilizado recientemente electroterapia mediante electroestimulación directa de las lesiones, con buenos resultados.
Tratamiento sistémico
Antimoniales pentavalentes
Es la medicación de primera elección cuando está indicado el tratamiento sistémico165,174. Se utilizan el antimoniato de meglumina y estibogluconato de sodio, ya citados a propósito de la terapia intralesional. Las pautas de empleo están entre los 10-20 mg/kg/día, por vía intramuscular o intravenosa (en este caso diluido en 50 ml de suero glucosado, a perfundir durante 10 min), durante 10-20 días, dependiendo de la gravedad y extensión de las lesiones. Entre los efectos secundarios son frecuentes las reacciones de hipersensibilidad con erupciones cutáneas, náuseas y vómitos, cefaleas, dolor abdominal, fiebre, mialgias y artralgias. Otros más graves son las alteraciones electrocardiográficas, elevación de las transaminasas, pancreatitis y neuropatía periférica.
En las formas cutáneas habituales en España no suele ser preciso el empleo de terapia sistémica, aunque algunas formas clínicas pueden requerirlo167,168.
Pentamidina
Además de la actividad antileishmania, es eficaz frente a los tripanosomas africanos (Trypanosoma gambiense y T. rhodesiense) y Pneumocystis jiroveci (antes carinii). Es un fármaco de segunda línea que se ha utilizado sobre todo en el Nuevo Mundo, en dosis de 2-3 mg/kg en días alternos, de 4 a 7 inyecciones de tratamiento total. Entre los efectos secundarios comunes están el dolor en el lugar de la inyección, cefaleas, mialgias y náuseas. La falta de estudios controlados y comparativos mantienen a este medicamento como una opción secundaria.
Anfotericina B
Es un antibiótico poliénico macrocíclico derivado de Streptomyces nodosus, y se encuentra así mismo en segunda línea de la terapéutica sistémica antileishmania. Su alta toxicidad se ha venido a paliar por el desarrollo de formas liposomiales. En las formas cutáneas, no complicadas de botón de Oriente, creemos que no tiene lugar por la sencillez y coste de las otras alternativas, en especial el antimoniato de meglumina intralesional.
Aminosidina y paromomicina
Además de lo comentado referente al tratamiento tópico, su empleo como agente terapéutico único no es útil en la leishmaniasis cutánea.
Otros medicamentos
Entre las diversas opciones alternativas a los antimoniales y la pentamidina, se han ensayado medicamentos de uso oral como el alopurinol125,131, pirazolopirimidina que inhibe la xantinooxidasa, interfiriendo así con el metabolismo de los ácidos nucleicos del huésped e impidiendo la liberación de purinas. Las leishmanias son incapaces de sintetizar las purinas por sí mismas y necesitan las del huésped, por lo que la acción del alopurinol impide la síntesis de ácidos nucleicos del parásito. Sin embargo, en los ensayos clínicos, hasta el momento, se ha revelado de escasa utilidad como medicamento único en la leishmaniasis cutánea; los azoles, ketoconazol e itraconazol actuarían inhibiendo la síntesis de ergosterol en la membrana del parásito, pero tampoco han mostrado eficacia relevante frente a Leishmania.
Así mismo se han utilizado la rifampicina y el metronidazol166 sin resultados de interés. Se ha ensayado también la dapsona con resultados contradictorios en dos estudios, realizados en India y Colombia175,176.
La inmunoterapia con IFN-γ combinado con antimoniales por vía parenteral o solo, en infiltración intralesional, también se ha utilizado, pero su elevado coste y efectos secundarios en el primer caso y su eficacia, muy inferior a la de los antimoniales intralesionales, en el segundo, no parecen confirmar su utilidad, aunque son precisas futuras investigaciones en el terreno de las citocinas para valorar con mayor precisión su posible papel terapéutico.
El Comité de Quimioterapia Integrada del Programa para la investigación de enfermedades tropicales (TDR), de la OMS ha establecido entre sus prioridades la investigación y desarrollo de tratamientos orales para la leishmaniasis cutánea. Entre los medicamentos, actualmente en fase de estudio, que se han mostrado eficaces, están las quinoleínas, chimanina B y 2-n-propilquinoleína, derivadas de una planta medicinal boliviana, Galipea longiflora, de la familia de las Rutáceas, y la 8-aminoquinoleína, lepidina (WR6026)165,177. Así mismo, las chalconas, flavonoides oxigenados de la raíz de la regaliz china se han mostrado leishmanicidas in vitro e in vivo173.
Otros numerosos compuestos, como la argentilactona178 o los inhibidores de la tripanotion reductasa179, se están estudiando como potenciales antiprotozoarios y, desde hace algunos años, se ha intensificado la investigación etnomédica en busca de remedios de la medicina tradicional180,181.