INTRODUCCIÓN
La especial incidencia y problemática de la infección por el Papillomavirus humano (VPH) en inmunodeprimidos ya era señalada en pacientes tras quimioterapia o radioterapia y en series de trasplantados en los años ochenta1. Con el desarrollo de la pandemia de la infección por el virus de la inmunodeficiencia humana (VIH) en los noventa, este hecho adquirió su actual importancia epidemiológica, incluso con situaciones inmunológicas relativamente preservadas (CD4 > 500/mm3), lo que indujo la sospecha de que, además del déficit inmunitario y de compartir la vía de transmisión sexual, otros factores de riesgo influirían en la alta prevalencia de coinfección por ambos virus2. El curso clínico de las lesiones por VPH, de mayor desarrollo, agresividad3 y dificultad terapéutica en estos enfermos, parece estar mediado por otros determinantes. Entre ellos se ha estudiado, por una parte, la interrelación entre el gen tat-1 (proteína reguladora del VIH) y la proteína E2 del VPH, que favorece la expresión de otros genes tempranos del VPH4. Por otra parte, los cambios en la inmunidad regional de mucosas, con descenso local de linfocitos CD4, células de Langerhans y alteración en el patrón de citocinas, también favorecen la transcripción de determinados VPH5.
En el campo de la enfermedad por VIH el estudio de la infección por VPH se ha centrado mayoritariamente en la localización genital en mujeres. En ellas se detectó, primero por citología, un aumento de «lesiones escamosas intraepiteliales» (SIL o CIN según criterios histológicos) precursoras de carcinoma cervical invasivo. Con los métodos de genética molecular actuales pronto se relacionó este hecho con el hallazgo de una elevada frecuencia de infecciones persistentes por VPH en lavados cervicovaginales de estas enfermas6, 7. Secundariamente también se ha demostrado una mayor prevalencia de infección por VPH y lesiones precursoras de carcinoma escamoso a nivel anal (AIN, neoplasia intraepitelial anal) en pacientes homo/bisexuales, particularmente en infectados por el VIH8.
Fuera de estos dos terrenos hemos querido valorar la utilidad de estas técnicas moleculares para la detección de infección por VPH y su tipado en una consulta puramente dermatológica.
MATERIAL Y MÉTODOS
Estudiamos 61 pacientes consecutivos que acudieron con lesiones sugestivas de infección por VPH a nuestra Unidad VIH de la consulta de Dermatología del Hospital 12 de Octubre de Madrid. Recogimos en el momento de la toma de muestras datos generales (sexo, edad, etc.) de los pacientes, datos sobre su situación VIH (conducta de riesgo, antigüedad del diagnóstico, estadio actual, cifra de CD4 en los últimos dos meses) y datos sobre sus lesiones por VPH (diagnóstico clínico/histológico, localización, evolución y tratamientos previos). No utilizamos como variable en el estudio la carga vírica de VIH por no disponer de ella de rutina en nuestro hospital en el momento de inclusión de los primeros pacientes (1995).
De esta población tomamos una muestra de 120 tomas (de una a tres por paciente), en un único momento evolutivo (salvo en dos pacientes), que clasificamos en función de dos criterios: a) localización: definida como «mucosa» (semimucosas y piel adyacente) o «no mucosa» (si afectaba a otras localizaciones cutáneas), y b) diagnóstico dermatológico clínico/histológico9. En muchos casos realizamos además toma de la zona anogenital clínicamente libre de lesiones.
Para detección de VPH elegimos, por su sensibilidad10, 11, una técnica de amplificación, mediante reacción en cadena de la polimerasa (PCR)12, 13, seguida de un método de tipado con enzimas de restricción, que fueron realizadas en el servicio de Microbiología del Hospital Clínico de Madrid.
La toma de muestras elegida por sencillez y rentabilidad diagnóstica fue el raspado con torunda de algodón estéril humedecida con suero8, 11, 14 que, como ya se ha mencionado, también realizamos en zonas de semimucosa anal o genital (surco balano-prepucial, vestíbulo vulvar) «sin lesión». Las muestras se conservaron a 20° C hasta su procesamiento. Para la extracción del ADN digerimos con una solución de proteinasa K y Tween 20 durante tres horas a 55° C y después se realizó la amplificación mediante PCR. Utilizamos unos iniciadores generales (My09 y My11), que amplifican una región común de los VPH (región L1 open reading frame [ORF]), que es una zona conservada de aproximadamente 450 pares de bases (pb). En todas las muestras se utilizó un control interno de amplificación para poder distinguir los negativos de las reacciones inhibidas. También se utilizaron controles externos tanto positivos como negativos por cada ronda de amplificación14. Los productos de la amplificación se detectaron mediante electroforesis en gel de agarosa teñida con bromuro de etidio15. Como marcadores de peso molecular se utilizaron M VIII y OX 174 digerido con HaeIII.
El tipado se llevó a cabo mediante digestión con enzimas de restricción Rsa1 y 2 (PVHfast PharmaGen®), que producen cortes en la secuencia del ADN y posteriormente se interpretó el patrón de bandas por electroforesis. Cada tipo de virus presenta un patrón de restricción distinto. En la mayoría de casos dispusimos de un segundo método de tipado mediante hibridación con sondas tipo específicas para los VPH mucosos a priori más relevantes, los VPH tipos 6, 11, 16, 18 y 3314.
Consideramos muestra negativa a aquélla en la que sólo aparecía la banda del control interno de amplificación, y una muestra positiva cuando además aparecía la banda de 450 pb correspondiente a los VPH. En las muestras positivas se procedió al tipado de las mismas informando del tipo concreto, de tipados mixtos o múltiples y se consideraron como «no tipables» cuando no existía un patrón de bandas específico de tipo. Una muestra es considerada inhibida cuando no aparece la banda de 450 pb propia de los VPH ni la banda del control interno de amplificación; en estos casos realizamos diluciones de la muestra y/o purificación del ADN extraído antes de considerar este resultado como definitivo.
Dentro de los VPH detectables definimos para el análisis como de «alto riesgo» oncogénico a los VPH 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 6810, 16.
El estudio estadístico se realizó con una prueba de asociación para variables cualitativas por medio del criterio del Chi cuadrado, distribución χ2 de Pearson y prueba exacta de Fisher, mediante el programa informático epi.info.
RESULTADOS
Las características de los 61 pacientes de la muestra se corresponden con bastante fidelidad con la población general que atendemos en nuestra unidad: 52 de ellos (85%) son hombres, con una edad media de 30,5 años (rango: 22 a 47 años); conductas de riesgo para VIH: 38 casos (62%) son adictos a drogas por vía parenteral (ADVP), 16 pacientes (26%) son hombres homo/bisexuales y en 14 casos (23%) se plantea la transmisión heterosexual como la vía de contagio, sobre todo en mujeres (en 5 de ellas 9 como única vía); estadio VIH: todos los posibles, predominando el C3 (45% de pacientes), con cifra media de CD4 en el momento de la toma de 278/mm3 (rango: 1 a 1.235/mm3). Los tratamientos previos para el VPH son variados (desde cidofovir tópico hasta cirugía amplia), únicos en 25 y combinados en 10 pacientes, predominando la crioterapia y el podofilino.
Las 120 muestras correspondían:
1. Por su localización: a 98 muestras «mucosas» (de las cuales 49 eran de zona genital externa, 47 de zona anal y 2 de mucosa oral), y a 22 muestras «no mucosas».
2. Por diagnósticos: 54 a condilomas acuminados (CA), 32 a tomas «sin lesión» (SL), 16 a papulosis bowenoides (PB), 9 a verrugas planas, 5 a verrugas vulgares, 3 a carcinomas verrucosos y 1 a papiloma.
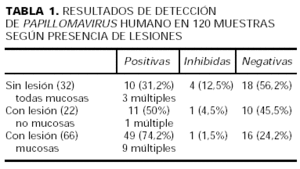
Los resultados de detección por pacientes demostraban alguna muestra positiva en 46 (76%) de los mismos, todas negativas en 13 (21%) e inhibidas en 2 (3%). Los resultados de detección en las 120 muestras según localización, presencia y/o diagnósticos de las lesiones están recogidos en las tablas 1 y 2.
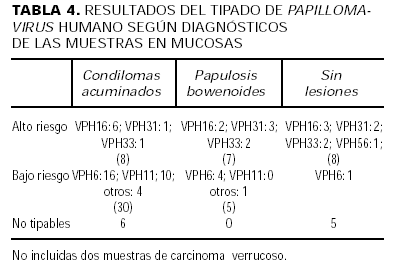
Los distintos tipos obtenidos en nuestras muestras son los siguientes: VPH 6 (en 21 tomas), no tipable (18 tomas), VPH 11 (12 tomas), VPH 16 (11 tomas), VPH 31 (6 tomas), VPH 33 (5 tomas), VPH 42 (2 tomas) y luego, con una toma por cada tipo, los VPH 30, 44, 56, 61, 34, 52, 8/9, 4 y 27. Los resultados más destacados del tipado según localización y/o diagnósticos principales están recogidos en las tablas 3 y 4.
DISCUSIÓN
Aunque el rastreo de VPH ya se ha realizado en consultas de enfermedades de transmisión sexual (ETS)17, no existe una base bibliográfica dermatológica referida a pacientes infectados por el VIH, y la mayoría de trabajos sobre estos pacientes provienen de otras especialidades (como ginecología, gastroenterología o laboratorios de medicina interna); se refieren por ello a poblaciones y localizaciones de tomas de muestras muy distintas a las de nuestro medio o parcelares, con términos citológicos (como SIL) e histológicos (como CIN, AIN o PIN, referidos a neoplasias intraepiteliales a nivel cervical, anal o de pene), poco familiares para los dermatólogos8, 18-21. En otras mucosas, cuestiones como el posible significado de detecciones persistentes de VPH a lo largo del tiempo o tras tratamientos previos se infieren siempre de lo observado a nivel cervical22, 23.
La característica fundamental de nuestra población infectada por VIH es el predominio de hombres ADVP, en los que también vemos una elevada incidencia de lesiones por VPH genitales (condilomas y papulosis bowenoides) e incluso anales, negando en muchos casos contactos homosexuales previos. Estas muestras mucosas son el centro de nuestro estudio, repartidas casi por igual entre ambas localizaciones (49 genitales y 47 anales). De hecho, no encontramos diferencias de resultados apreciables en relación con conductas de riesgo, como tampoco las observamos para las otras variables que no mencionamos en esta discusión. Voltz et al en Cedex estudiaron también la tipificación virológica en una consulta dermatológica, reuniendo 19 enfermos infectados por VIH con histología de lesiones por VPH, que estudiaron mediante hibridación in situ24. Su muestra de pacientes infectados por VIH era más semejante a la norteamericana, con solamente un 16% de pacientes ADVP. Su método de detección genómica (hibridación in situ) es bastante menos sensible que la amplificación12, 13, preferible para estudios de cribaje10, 11; estos autores encontraron un predominio de tipos de alto riesgo en el 71% de las lesiones.
Los resultados de nuestro estudio demuestran ya una rentabilidad de esta técnica incruenta si los referimos a los pacientes, con positividad en alguna de sus muestras en 46 pacientes (76%), mientras que se encuentran todas negativas en 13 (21%) e inhibidas en 2 (3%) de los mismos, si bien 9 de estos 15 últimos pacientes (con muestras negativas e inhibidas) disponían de tomas únicas.
Más datos se obtienen refiriendo los resultados a las 120 tomas obtenidas de ellos. Y así, según la localización y presencia de lesiones (tabla 1), vemos que:
1. De las 22 muestras «no mucosas», todas ellas con lesiones aparentes, hay 11 (50%) positivas, 10 (45,5%) negativas y 1 inhibida. Encontramos, pues, un alto porcentaje de «falsos negativos» cuando esta técnica se utiliza sobre lesiones puramente cutáneas. Destacamos que de las 10 tomas negativas, 6 proceden de verrugas (planas o vulgares) localizadas en dorso de manos o dedos.
2.Sin embargo, de las 66 muestras «mucosas» con lesión, 49 (74%) son positivas (significación esta- dística frente a las muestras sin lesión, p < 0,0005), 16 son negativas y 1 resulta inhibida. El porcentaje de positividad si consideramos sólo las lesiones genitales corresponde a un 69%, pero referido a lesiones anales alcanza un 81%, por lo que esta localización parece especialmente apropiada para esta técnica de detección25.
3.En las 32 muestras (SL), todas ellas de mucosa anogenital, también encontramos un porcen-taje no despreciable de positividad: del 31% (10 tomas frente a 18 negativas y 4 inhibidas). Este porcentaje es bastante más elevado que el 9%-10% que se baraja como cifra media de positividad en población sana de referencia, al menos a nivel cervical26, y plantea la cuestión de una posible tasa especialmente significativa de portadores en inmunodeprimidos. Con respecto a las muestras inhibidas hay que destacar que, de las 5 muestras mucosas inhibidas (con/sin lesión), 4 de ellas corresponden a tomas anales, localización en la que modificamos la técnica tras iniciar el estudio porque se precisaban purificaciones repetidas del ADN.
En cuanto a los resultados de las muestras referidos al diagnóstico de las lesiones, cuando éstas estaban presentes (tabla 2) vemos cómo el principal responsable del alto número de positividades en lesiones mucosas es el CA, con 41 positivas de 54 CA (76%) frente a 9 positivas de 16 PB (56%) (CA > PB > SL). Este orden de positividades concuerda con los hallazgos en pacientes no infectados por VIH17.
Refiriéndonos ya a los resultados de tipificación, se detectaron 84 tipos de VPH en las 120 muestras. En las muestras no mucosas (tabla 3) hay 7 «no tipables» y otros 5 tipos con poca correspondencia clínica: Detectamos un VPH 8/9 (propio de la epidermodisplasia verruciforme) en una verruga vulgar y un VPH 27 (propio de verrugas intermedias de Jablonska) en un papiloma plantar; además encontramos tipos mucosos (VPH 34 y 52) asociados con lesiones cutáneas, hallazgo que algunos autores quieren relacionar con situaciones de inmunosupresión27, 28.
Centrándonos en las 72 tipificaciones en muestras mucosas, encontramos un predominio de los de bajo grado de riesgo oncogénico sobre los de alto grado, aunque en 19 de 52 pacientes (36,5%) con alguna muestra mucosa se detecta al menos un tipo de alto riesgo. Así, el VPH 6 (bajo grado) es el más prevalente (29%), seguido del VPH 11 (17%, también de bajo grado), los «no tipables» (15%), el VPH 16 (15%) y los VPH 31 y 33 (que juntos suponen otro 15%). El resto de VPH justifican sólo un 8% restante. No hemos encontrado ningún VPH 18. En nuestro medio y con las mismas técnicas, la rareza del VPH 18 parece habitual en nuestra población, mientras que el predominio del VPH 6 lo hemos encontrado en poblaciones de riesgo (clínica de ETS), pero no así en muestras cervicales de una población control de mujeres embarazadas (en principio sanas)14. Sin embargo, los datos de nuestra serie están en desacuerdo con los 19 casos de Voltz24 y con otras casuísticas norteamericanas que utilizan también PCR en distintas poblaciones infectadas por VIH, donde los de alto grado, sobre todo el VPH 16 y 18, predominan sobre el VPH 6 en localizaciones cervicales y anales11, 25, 29, 30.
La detección de genotipos múltiples sólo aparece en una de las muestras no mucosas, mientras que 12 (20%) de las 59 muestras mucosas positivas presentan genotipos múltiples (tabla 1). En 11 de esas 12 muestras mucosas con genotipos múltiples está implicado, además, al menos un tipo de alto riesgo, y 3 de ellas son tomas de mucosas SL. La bibliografía muestra que las infecciones múltiples son en pacientes negativos para el VIH, menos frecuentes a nivel genital17 y anal29, 31, y que en la población infectada por VIH parecen asociarse a lesiones displásicas y a peores situaciones inmunológicas11. En nuestra serie los genotipos múltiples aparecen proporcionalmente algo más en PB que en CA (tabla 2), y todos en sujetos con cifras de CD 4 < 220/mm3.
Agrupar tipados de alto y bajo riesgo nos ha permitido observar algunas tendencias con respecto a otras variables:
1.Así, con respecto a la localización (tabla 3), vemos que ambos grupos están bastante regularmente repartidos entre las localizaciones mucosas principales (anal y genital), pero los positivos «no tipables» son más raros en zona genital que en anal o en no mucosa.
2.Con respecto a los diagnósticos mayoritarios en mucosas (tabla 4), vemos cómo los de bajo grado se asocian significativamente con un diagnóstico de condiloma (p < 0,05) frente al de PB, donde, por ejemplo, no encontramos ningún VPH 11; también observamos cómo nuestros «no tipables» son raros en lesiones de PB, además de en localización genital. En dos muestras correspondientes a carcinoma verrucoso encontramos VPH 11 de bajo riesgo. El mecanismo oncogénico de estas neoplasias, según describen Majewski y Jablonska27, no está ligado a las oncoproteínas E6/E7 de los VPH de alto riesgo, y así parece que gran parte de las neoplasias anogenitales que vemos los dermatólogos en pacientes de riesgo sean de este tipo histológico, con gran capacidad destructiva local, y esto a pesar de que predominen los tipos VPH de bajo riesgo oncogénico en dichos tumores32.
Otro punto importante ha sido relacionar los tipados de muestras mucosas con la situación inmunológica del paciente en el momento de la toma. En las principales series de muestras cervicales y anales de pacientes infectados por VIH se aprecia una tendencia con mayor inmunodepresión hacia detecciones de supuesta mayor agresividad, expresada como mayor número de positividades, de carga VPH infectante y de genotipos múltiples y/o de alto grado oncogénico10, 11, 25, 29, 30, 33. Nosotros, incluyendo un número significativo de muestras genitales masculinas (a diferencia de estas series), no observamos en la nuestra un mayor número de detecciones positivas con inmunodeficiencias más marcadas, pero sí la asociación con genotipos múltiples y sobre todo con tipados de alto riesgo, hallazgos similares a los que refiere Arany en condilomas de pene, que los relaciona con una activación transcripcional34. Poniendo un punto de corte en los 150 linfocitos CD4/mm3, hemos observado 14 (61%) de 23 tipados de alto riesgo en mucosas por debajo de esta cifra, mientras que 29 (76%) de los 38 tipados de bajo riesgo se encuentran por encima de la misma (p < 0,005). Y este dato parece especialmente relevante cuando consideramos algunos tipos concretos de alto riesgo como son los VPH 31 ó 33: de 11 tipados globales con uno de estos dos tipos, 8 (73%) los encontramos en pacientes con CD4 < 120/mm3. Desconocemos el significado de estos hallazgos, que habrá que confirmar con series más amplias. La influencia de la terapia antirretroviral de gran eficaca (TARGA) en las cifras de linfocitos CD4 con la que algunos autores de prestigio vaticinaban un aumento de neoplasias por VPH oncogénicos (en el seno de una inmunodeficiencia prolongada)35 en realidad ya ha demostrado también aquí su utilidad, alterando el curso de la enfermedad por VPH en pacientes infectados por el VIH, reduciendo la progresión y aumentando la regresión (al menos en base a criterios citológicos cervicales), según se ha publicado recientemente en un estudio prospectivo con 2.059 mujeres infectadas por el VIH pertenecientes al WIHS norteamericano (Interagencia de la mujer para estudio del VIH)10.
El hallazgo más significativo de nuestro estudio es la altísima prevalencia de tipados de alto riesgo en muestras anogenitales de zonas sin lesión (tabla 4). De las 10 muestras sin lesión que fueron positivas, en 7 (70%) hay al menos un tipo de alto riesgo. Además sólo dos de estas muestras presentan concordancia de tipos con la otra localización anogenital del mismo paciente donde sí hay presencia de lesión. Así, por ejemplo, mientras en la toma correspondiente a un CA anal de un paciente homosexual detectamos un VPH 6, la toma de pene SL del mismo paciente resulta inicialmente inhibida y, tras diluciones posteriores, muestra un VPH 16; o la toma correspondiente a vulva SL de una paciente sometida un año antes a una conización cervical por un CIN es negativa, pero la toma anal SL de la misma paciente muestra un VPH 56 y un «no tipable». Esta discrepancia de tipos en distintas mucosas junto a un mayor número de detecciones a nivel anal (sin llegar a ser significativo en nuestra serie) son hallazgos señalados recientemente por Palefsky en mujeres con afectación cervical por VPH11. Aunque no se conozca la trascendencia clínico-evolutiva de estos hechos en mucosas sin lesiones clínicas25, los datos aportados en estudios junto a rastreos citológicos no parecen tranquilizadores36.
Como previamente se valoró en cérvix, actualmente se ha estudiado la relación coste-eficacia a otro nivel, y distintos autores proponen las modernas técnicas de amplificación genómica, junto a métodos de valoración citológica, como parte de un cribaje de detección de la infección anal por VPH en poblaciones de riesgo oncológico especial, como es la población infectada por el VIH20, 24, 37. Frente a instrumentos más especializados, como anoscopios de alta resolución20, 37, y basándonos en el rendimiento obtenido de sencillos raspados mucosos38, los dermatólogos clínicos gozamos de una accesibilidad única para el cribaje de lesiones anogenitales por VPH, si disponemos de procedimientos sensibles de detección genómica de rutina. Los dermatólogos que trabajamos con pacientes infectados por VIH nos enfrentamos a diario al problema de «la verruga anogenital y la displasia», con pocas referencias evolutivas y, desde hace 6 años, al menos con posibilidades de controlar esta lesión por VPH fuera de un marco inmunológico tan caótico como era invariablemente el previo. El despistaje y tipado de lesiones, e incluso de mucosas sanas, nos aportaría datos al problema clínico individual y una base inestimable para valorar cursos evolutivos o definir situaciones de más riesgo en nuestra población seropositiva para el VIH, como ya ha sucedido en otras especialidades19, 39.
CONCLUSIÓN
Queremos destacar de este trabajo:
1.La alta rentabilidad de la técnica empleada en mucosas, sobre todo en lesiones anales, y su sencillez para el clínico.
2.Los siguientes hallazgos en nuestra población de estudio, referidos a muestras mucosas: a)elevada presencia de VPH en localizaciones SL, con frecuencia de alto grado de riesgo oncogénico; b) coinfecciones frecuentes por varios tipos de VPH concurrentes; c) predominio de VPH tipo 6 y ausencia de VPH tipo 18, y d) tipos de alto riesgo oncogénico más frecuentes en peores situaciones inmunológicas.
3.Proponemos el despistaje y tipado de VPH en tomas por raspado anogenital, factibles para el dermatólogo, como parte de un cribaje de posibles poblaciones de riesgo para la infección por VPH, entre ellos los pacientes seropositivos para VIH.