El carcinoma epidermoide (CE) es el segundo cáncer cutáneo más frecuente, y representa aproximadamente el 20% del total del cáncer cutáneo no melanoma (CCNM), con una incidencia creciente1,2. La tasa de incidencia global en nuestro medio se ha estimado en 38,16/100.000 personas/año3. Aunque la mayoría de CE evolucionan satisfactoriamente tras la extirpación quirúrgica, existe un subgrupo de lesiones de alto riesgo, con alta probabilidad de recurrencia, metástasis y muerte relacionada con la enfermedad1,3. Teniendo en cuenta el envejecimiento progresivo de la población y el consiguiente incremento en la incidencia del CCNM y, especialmente, de los carcinomas queratinocíticos, las estrategias encaminadas al diagnóstico precoz de lesiones malignas y que nos permitan diferenciarlas de sus precursores, se hacen cada vez más importantes.
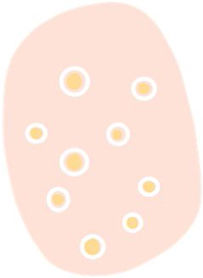
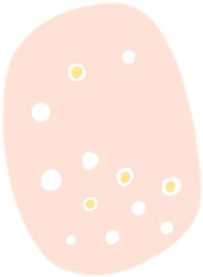
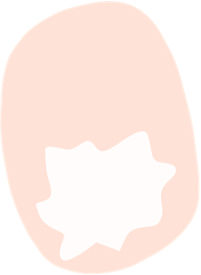
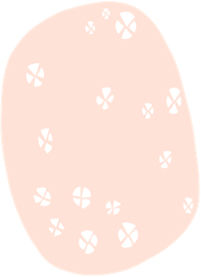
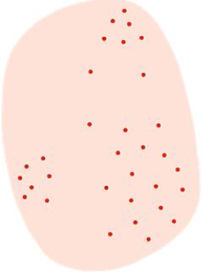
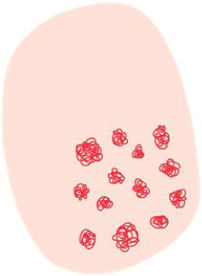
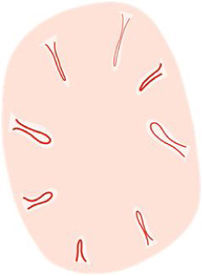
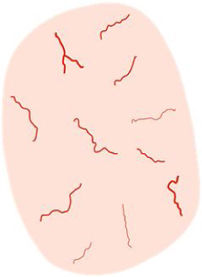
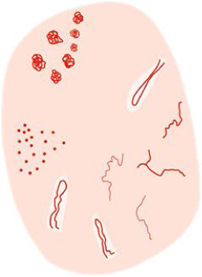
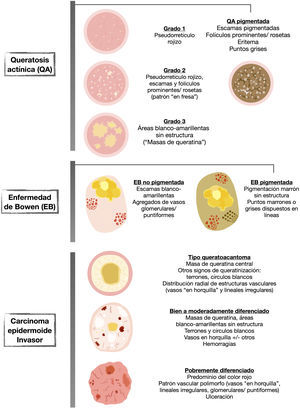
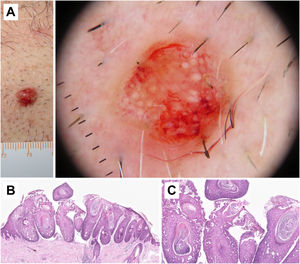
La dermatoscopia es una técnica no invasiva que hoy en día forma parte esencial del diagnóstico clínico en dermatología. En manos experimentadas, ha demostrado mejorar la precisión diagnóstica en lesiones cutáneas pigmentadas y no pigmentadas. En concreto, la dermatoscopia aumenta la sensibilidad en el diagóstico del CE4, habiéndose descrito patrones asociados a los diferentes tipos de lesiones y estadios de progresión, lo que facilita la diferenciación entre queratosis actínica (QA), enfermedad de Bowen (EB) y CE invasivo (CEi)5,6 (fig. 1). Así mismo, la QA pigmentada (QAp) puede suponer un reto diagnóstico por su solapamiento clínico con el léntigo maligno (LM), escenario en el que la dermatoscopia también ha demostrado su papel5. La presente revisión trata de ser una síntesis de la literatura con un enfoque práctico y que aborde de una forma global el espectro de neoplasias queratinocíticas y sus precursores desde una perspectiva dermatoscópica, tratando al mismo tiempo de unificar en castellano la gran heterogeneidad terminológica existente7 (tabla 1).
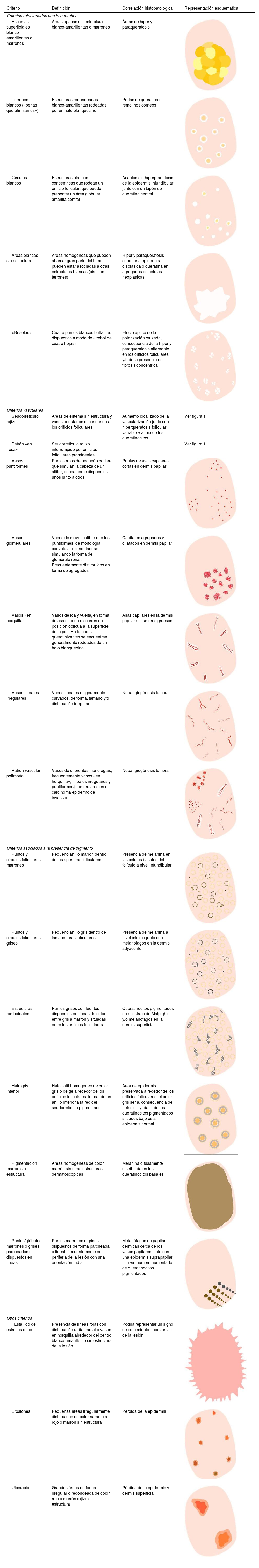
Glosario de los principales términos dermatoscópicos descritos en la literatura en el espectro queratosis actínica, enfermedad de Bowen y carcinoma epidermoide invasivo, así como su definición, representación esquemática y correlación histopatológica
| Criterio | Definición | Correlación histopatológica | Representación esquemática |
|---|---|---|---|
| Criterios relacionados con la queratina | |||
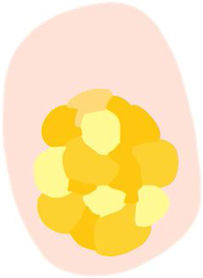
| Escamas superficiales blanco-amarillentas o marrones | Áreas opacas sin estructura blanco-amarillentas o marrones | Áreas de hiper y paraqueratosis | |
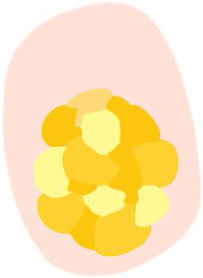
| Terrones blancos («perlas queratinizantes») | Estructuras redondeadas blanco-amarillentas rodeadas por un halo blanquecino | Perlas de queratina o remolinos córneos | |
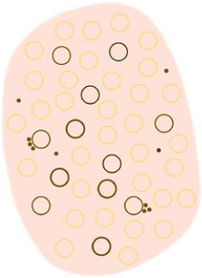
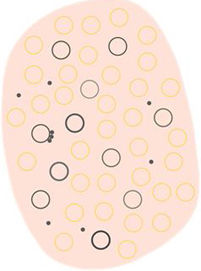
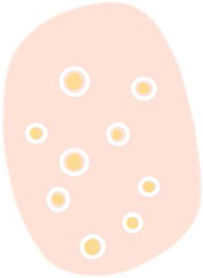
| Círculos blancos | Estructuras blancas concéntricas que rodean un orificio folicular, que puede presentar un área globular amarilla central | Acantosis e hipergranulosis de la epidermis infundibular junto con un tapón de queratina central | |
| Áreas blancas sin estructura | Áreas homogéneas que pueden abarcar gran parte del tumor, pueden estar asociadas a otras estructuras blancas (círculos, terrones) | Hiper y paraqueratosis sobre una epidermis displásica o queratina en agregados de células neoplásicas | |
| «Rosetas» | Cuatro puntos blancos brillantes dispuestos a modo de «trebol de cuatro hojas» | Efecto óptico de la polarización cruzada, consecuencia de la hiper y paraqueratosis alternante en los orificios foliculares y/o de la presencia de fibrosis concéntrica | |
| Criterios vasculares | |||
| Seudorretículo rojizo | Áreas de eritema sin estructura y vasos ondulados circundando a los orificios foliculares | Aumento localizado de la vascularización junto con hiperqueratosis folicular variable y atipia de los queratinocitos | Ver figura 1 |
| Patrón «en fresa» | Seudorretículo rojizo interrumpido por orificios foliculares prominentes | Ver figura 1 | |
| Vasos puntiformes | Puntos rojos de pequeño calibre que simulan la cabeza de un alfiler, densamente dispuestos unos junto a otros | Puntas de asas capilares cortas en dermis papilar | |
| Vasos glomerulares | Vasos de mayor calibre que los puntiformes, de morfología convoluta o «enrollados», simulando la forma del glomérulo renal. Frecuentemente distirbuídos en forma de agregados | Capilares agrupados y dilatados en dermis papilar | |
| Vasos «en horquilla» | Vasos de ida y vuelta, en forma de asa cuando discurren en posición oblicua a la superficie de la piel. En tumores queratinizantes se encuentran generalmente rodeados de un halo blanquecino | Asas capilares en la dermis papilar en tumores gruesos | |
| Vasos lineales irregulares | Vasos lineales o ligeramente curvados, de forma, tamaño y/o distribución irregular | Neoangiogénesis tumoral | |
| Patrón vascular polimorfo | Vasos de diferentes morfologías, frecuentemente vasos «en horquilla», lineales irregulares y puntiformes/glomerulares en el carcinoma epidermoide invasivo | Neoangiogénesis tumoral | |
| Criterios asociados a la presencia de pigmento | |||
| Puntos y círculos foliculares marrones | Pequeño anillo marrón dentro de las aperturas foliculares | Presencia de melanina en las células basales del folículo a nivel infundibular | |
| Puntos y círculos foliculares grises | Pequeño anillo gris dentro de las aperturas foliculares | Presencia de melanina a nivel ístmico junto con melanófagos en la dermis adyacente | |
| Estructuras romboidales | Puntos grises confluentes dispuestos en líneas de color entre gris a marrón y situadas entre los orificios foliculares | Queratinocitos pigmentados en el estrato de Malpighio y/o melanófagos en la dermis superficial | |
| Halo gris interior | Halo sutil homogéneo de color gris o beige alrededor de los orificios foliculares, formando un anillo interior a la red del seudorretículo pigmentado | Área de epidermis preservada alrededor de los orificios foliculares, el color gris sería. consecuencia del «efecto Tyndall» de los queratinocitos pigmentados situados bajo esta epidermis normal | |
| Pigmentación marrón sin estructura | Áreas homogéneas de color marrón sin otras estructuras dermatoscópicas | Melanina difusamente distribuida en los queratinocitos basales | |
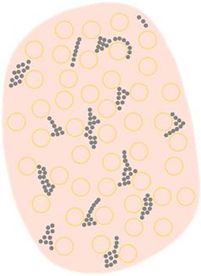
| Puntos/glóbulos marrones o grises parcheados o dispuestos en líneas | Puntos marrones o grises dispuestos de forma parcheada o lineal, frecuentemente en periferia de la lesión con una orientación radial | Melanófagos en papilas dérmicas cerca de los vasos papilares junto con una epidermis suprapapilar fina y/o número aumentado de queratinocitos pigmentados | |
| Otros criterios | |||
| «Estallido de estrellas rojo» | Presencia de líneas rojas con distribución radial radial o vasos en horquilla alrededor del centro blanco-amarillento sin estructura de la lesión | Podría representar un signo de crecimiento «horizontal» de la lesión | |
| Erosiones | Pequeñas áreas irregularmente distribuidas de color naranja a rojo o marrón sin estructura | Pérdida de la epidermis | |
| Ulceración | Grandes áreas de forma irregular o redondeada de color rojo o marrón rojizo sin estructura | Pérdida de la epidermis y dermis superficial | |
Excluiremos de esta revisión el CE del aparato ungueal, que por sus peculiaridades y criterios dermatoscópicos específicos, quizás merezca ser abordado en un trabajo independiente.
Dermatoscopia de la queratosis actínicaQueratosis actínicas no pigmentadasAspectos clave- •
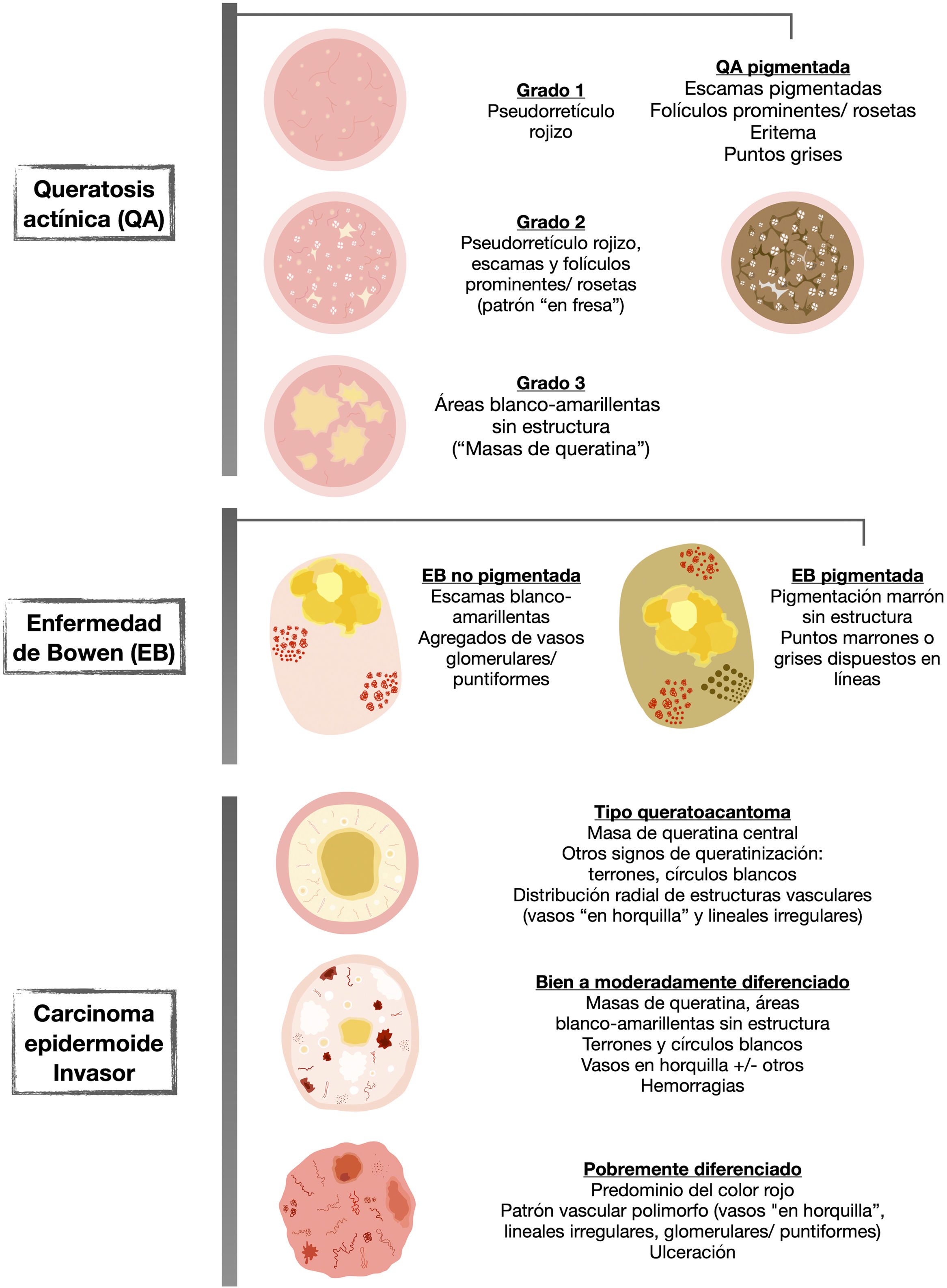
La QA no pigmentada se caracteriza frecuentemente por el denominado «patrón en fresa», caracterizado por un seudorretículo rojizo interrumpido por folículos prominentes. Estos pueden observarse en forma de «rosetas» con dermatoscopia de luz polarizada (fig. 2).
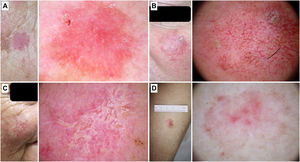
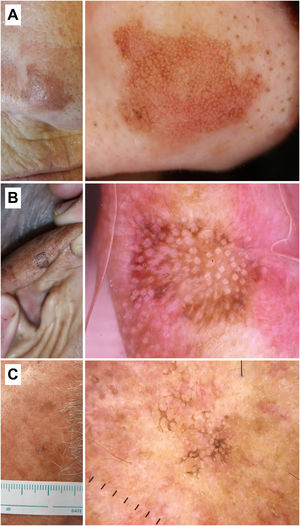
Figura 2.Queratosis actínicas no pigmentadas. A) Queratosis actínica grado 1 en la cara de una mujer de 81 años. En la dermatoscopia se aprecian un seudorretículo rojizo y una descamación discreta. B) Queratosis actínica grado 2 facial en un varón de 72 años. Patrón dermatoscópico «en fresa», con folículos prominentes/«rosetas», vasos ondulados perifoliculares y queratina. C) Queratosis actínica grado 3 en la cara de una mujer de 80 años. Con dermatoscopia se aprecian masas de queratina en forma de áreas blanco-amarillentas sin estructura. D) Queratosis actínica bowenoide en la pierna de una mujer de 80 años. En la dermatoscopia se observan múltiples vasos puntiformes/glomerulares.
(0,51MB).
En un primer trabajo, Zalaudek et al. evaluaron 41 QA no pigmentadas faciales e identificaron 4 estructuras dermatoscópicas fundamentales: un seudorretículo rojizo (95%), escamas superficiales (85%), vasos finos, lineales u ondulados de distribución perifolicular (81%) y folículos prominentes (66%) y/o rodeados de un halo blanco («folículos en diana») (100%). La combinación de estas estructuras conforma el denominado metafóricamente «patrón en fresa»8,9. El mismo grupo observó posteriormente dicho patrón en un 67% de lesiones en su serie, estando asociado de forma significativa al diagnóstico de QA frente a EB/CE/queratoacantoma (KA) (p<0,001)10.
Cuellar et al. describieron las estructuras denominadas «rosetas» (4 puntos blancos brillantes a modo de «trebol de cuatro hojas») en QA, únicamente visibles con luz polarizada11 (fig. 2). Sin embargo, estas estructuras se han descrito con posterioridad en un amplio abanico de neoplasias e incluso en piel fotodañada no lesional, por lo que no se consideran específicas12. Lozano-Masdemont et al. propusieron posteriormente que el denominado «patrón en rosetas», presente en el 35,8% de lesiones en su serie y caracterizado por presentar esta estructura como característica predominante, sí podría ser específico13.
Desde un punto de vista práctico y en función del grado clínico en la clasificación de Olsen, observaremos estas estructuras en mayor o menor frecuencia, pudiendo clasificar las QA en 3 estadios clínico/dermatoscópicos5 (fig. 2):
- -
QA grado 1: lesiones palpables, escasamente visibles, que con dermatoscopia se caracterizan por un seudorretículo rojizo y una descamación discreta.
- -
QA grado 2: lesiones visibles, fácilmente palpables y moderadamente queratósicas. Con dermatoscopia, se caracterizan por un fondo rojizo, sobre el que asientan folículos prominentes o «rosetas». Este estadio se corresponde al patrón «en fresa» descrito anteriormente5.
- -
QA grado 3: lesiones gruesas, con una hiperqueratosis marcada y bien delimitadas, que dermatoscópicamente muestran de forma predominante masas de queratina compacta en forma de áreas blanco/amarillentas sin estructura5,14.
Por localizaciones, cabe señalar que las QA no pigmentadas extrafaciales pueden presentar ciertas diferencias dermatoscópicas y, en este sentido, Reinehr et al. observaron como las escamas blanquecinas (97,3%) y el eritema (57,4%) fueron las estructuras más frecuentes en su estudio. Las diferencias anatómicas de la piel extrafacial (fundamentalmente la menor densidad de estructuras anexiales) condiciona que las estructuras asociadas al folículo y el propio seudorretículo rojizo sean menos frecuentes15.
La validez de la dermatoscopia para el diagnóstico de las QA fue refrendada por Huerta-Brogueras et al. en un estudio prospectivo con 178 lesiones clínicamente sugestivas de QA, encontrándo una sensibilidad y especificidad del 98,7 y 95%, respectivamente, con una concordancia de κ=0,917 entre dicha técnica y la histopatología16. Más aún, la dermatoscopia parece ser útil también en la monitorización postratamiento con crioterapia, tratamientos tópicos o TFD17,18.
Queratosis actínicas pigmentadasAspectos clave- •
Las QAp y el LM presentan un gran solapamiento dermatoscópico, fundamentalmente en base a criterios relacionados con el pigmento como los puntos grises, estructuras romboidales o pigmentación perifolicular asimétrica.
- •
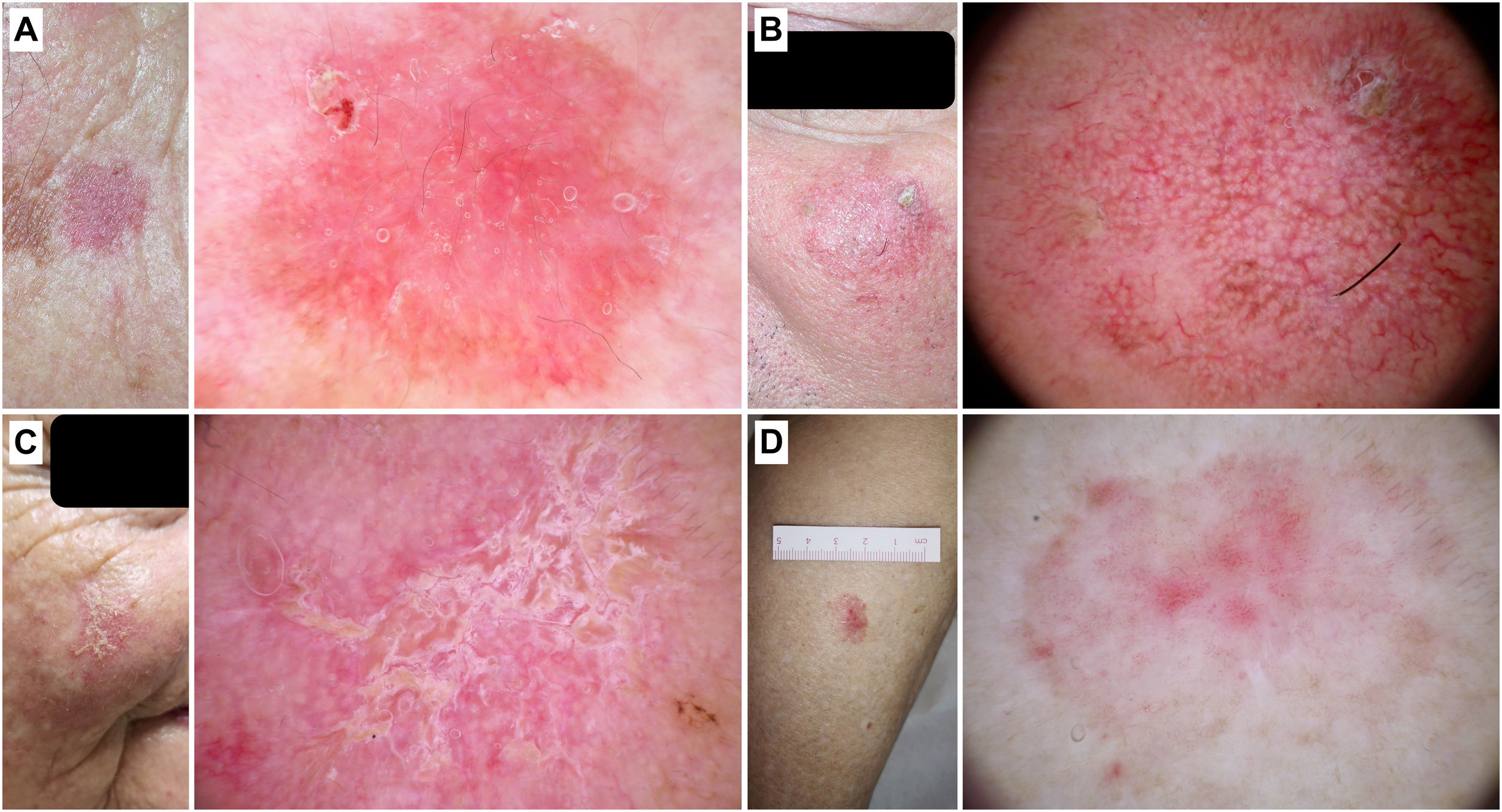
Hallazgos adicionales como los folículos prominentes/«rosetas», la presencia de escamas, el eritema o un halo gris interior a nivel folicular favorecen el diagnóstico de QAp (fig. 3).
Figura 3.Queratosis actínicas pigmentadas. A) Queratosis actínica pigmentada en la pirámide nasal de una mujer de 70 años. En la dermatoscopia se aprecia un patrón anular/granular, eritema y folículos prominentes. B) Queratosis actínica pigmentada en el hélix de un varón de 85 años. Con dermatoscopia se observa un área marrón sin estructura, eritema y múltiples «rosetas». C) Queratosis actínica pigmentada en la sien de un varón de 56 años. En el examen dermatoscópico pueden verse escamas pigmentadas y folículos prominentes/«rosetas».
(0,58MB).
El diagnóstico de las QAp puede suponer un desafío debido a su similitud clínica y dermatoscópica con el LM19–22. En este sentido, Akay et al. analizaron 99 lesiones pigmentadas faciales (67 de ellas QAp) y observaron como estas últimas pueden presentar criterios dermatoscópicos como puntos grises (70%), un patrón anular/granular (39%), estructuras romboidales (36%) o una pigmentación perifolicular asimétrica (25%)23. En el estudio de Moscarella et al. con 17 QAp faciales y extrafaciales, destacaron como estructuras más frecuentes los puntos grises (76,5%), áreas marrones sin estructura (58,8%) y el seudorretículo pigmentado (35,3%), así como la presencia de círculos blancos en un 11,7%. En la misma línea de similitud con el LM, estos autores observaron un patrón anular/granular y pigmentación perifolicular asimétrica en un 23,5 y 11,7% de los casos, respectivamente20, mientras que Kelati et al. detectaron un patrón anular/granular y estructuras romboidales en el 19,4 y 82,8% de 232 QAp22. Sin embargo, existen ciertos criterios dermatoscópicos que pueden ayudarnos en este difícil diagnóstico diferencial. Lallas et al. analizaron 70 LM y 56 QAp y encontraron que la presencia de círculos blancos/folículos prominentes (OR: 13,5; p=0,006), escamas (OR: 7,7; p=0,001) y eritema (OR: 3,6; p=0,009) se correlacionaban con el diagnóstico de QAp. Al contrario, las estructuras romboidales, la pigmentación intensa y los folículos no prominentes, fueron predictores de LM24. Un reciente trabajo que incluyó 53 QAp ha corroborado que el eritema (35,8%), las escamas (77,4%) y los folículos prominentes (52,8%) pueden ser la clave para poder identificar estas lesiones, al mismo tiempo que pueden observarse estructuras compartidas con el LM como puntos (22,6%) y círculos marrones (43,4%), puntos (45,4%) y círculos grises (26,4%) y áreas de pigmentación sin estructura (30,2%)25. Por último, la presencia de un «halo gris interior» a nivel folicular fue descrita por Nascimento et al. como un predictor de QAp frente a LM, observando este signo dermatoscópico en 91,4% de QAp frente al 23,8% de LM (p<0,01), con una excelente concordancia interobservador (κ=0,846)26.
Otras variantesLas QA bowenoides presentan vasos glomerulares distribuidos regularmente27,28 (fig. 2), mientras que las QA liquenoides pueden presentar un patrón anular/granular grisáceo por la presencia de melanofagia5. Por último, recientemente se ha descrito el denominado como «signo del iceberg» en QA con una coloración azulada en su superficie. La presencia de este signo se ha relacionado con el uso de determinados champús violetas y el consiguiente depósito de un material basófilo amorfo a nivel de la capa córnea29.
Dermatoscopia del carcinoma epidermoide in situ (enfermedad de Bowen)Enfermedad de Bowen no pigmentadaAspectos clave- •
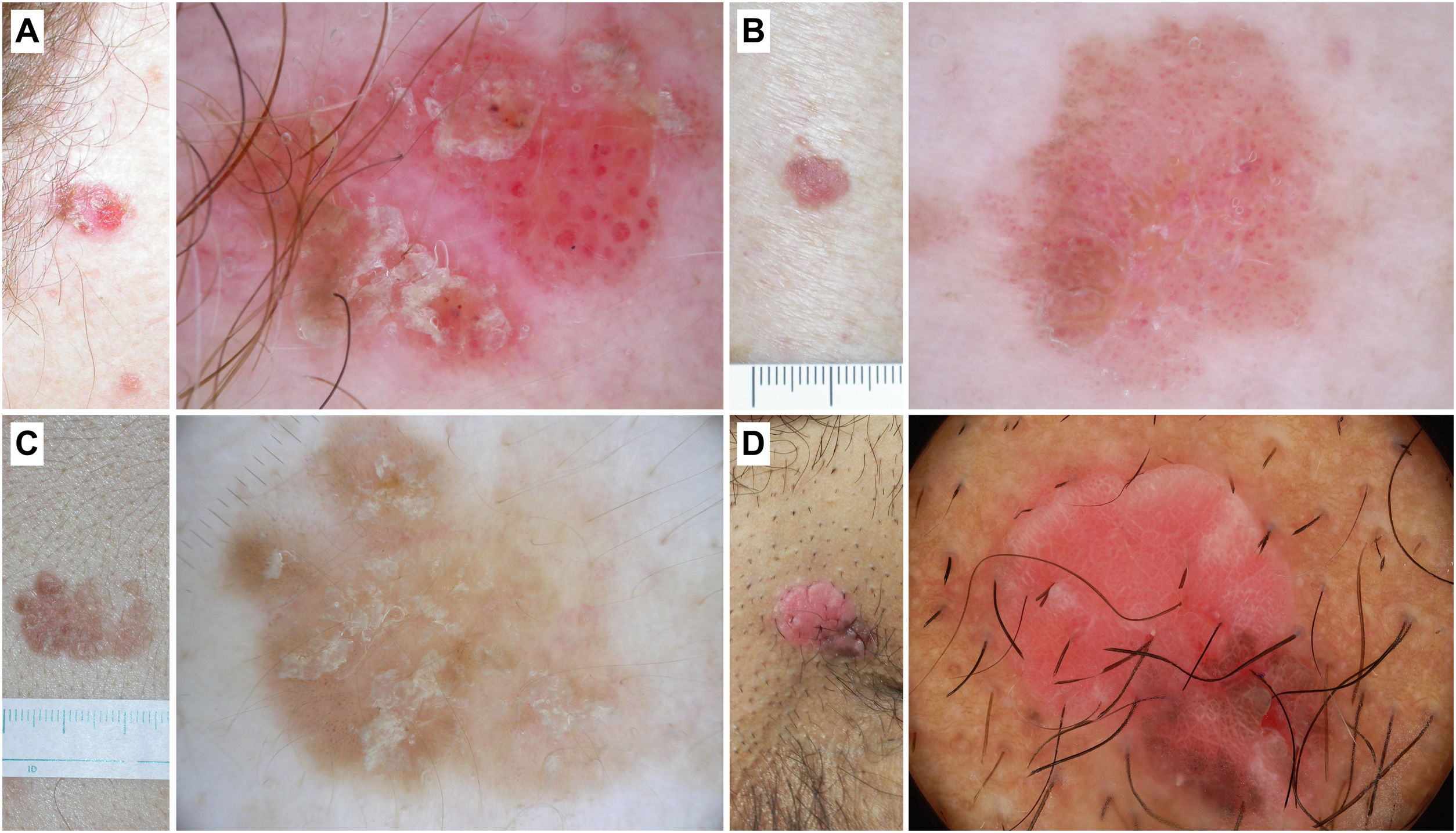
La EB no pigmentada se caracteriza por la presencia de agregados de vasos glomerulares o puntiformes junto con escamas blanco/amarillentas (fig. 4).
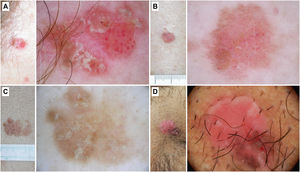
Figura 4.Enfermedad de Bowen. A) Enfermedad de Bowen no pigmentada en la sien de una mujer de 79 años. Patrón dermatoscópico compuesto por escamas blanco-amarillentas y agregados de vasos glomerulares. B) Enfermedad de Bowen no pigmentada en la espalda de un varón de 55 años. En la dermatoscopia se observa una descamación discreta y vasos glomerulares y puntiformes. C) Enfermedad de Bowen pigmentada en la espalda de un varón de 31 años. Con dermatoscopia puede apreciarse una pigmentación marrón sin estructura, agregados de vasos glomerulares y puntos marrones y grises dispuestos en líneas. D) Enfermedad de Bowen genital en el pubis de un varón de 59 años. En la dermatoscopia se puede observar un área de pigmentación marrón sin estructura, puntos marrones dispuestos en líneas, vasos puntiformes y líneas blancas brillantes.
(0,51MB).
En el estudio inicial publicado por Zalaudek et al., en el que analizaron 21 EB, observaron que las estructuras dermatoscópicas más frecuentes fueron los vasos glomerulares (90%) y las escamas blanco/amarillentas (90%)30. Estos datos fueron corroborados por el mismo grupo, observando estos criterios en un 43,3 y un 83,1% de un total de 71 EB, con diferencias significativas frente a la QA. Los autores describieron también la presencia de un patrón en «estallido de estrellas rojo» en el 28,2% de EB. En base al modelo de progresión QA-EB-CE hipotetizaron que este criterio podría representar un primer paso en dicha progresión10. En esta línea, Pan et al., desarrollaron un estudio observacional retrospectivo con 50 casos de EB, 150 CBC y 100 casos de psoriasis y concluyeron que la combinación de vasos glomerulares agregados e hiperqueratosis alcanzaba una probabilidad diagnóstica del 98% para EB31. Cabe mencionar que la morfología de los vasos puede estar condicionada por los aumentos que utilicemos. Así, con los dermatoscopios de mano habituales podremos observar agregados de vasos puntiformes32. En un trabajo reciente llevado a cabo por Papagergiou et al., obsevaron como los vasos puntiformes y glomerulares fueron los principales predictores de EB frente a CBC. Sin embargo, también observaron como pueden detectarse vasos puntiformes o glomerulares en CBC localizados en las extremidades inferiores, debido probablemente al éstasis venoso (25 y 19,3% en dicho estudio, respectivamente)33. Al margen de estos hallazgos fundamentales, otros criterios dermatoscópicos descritos son las hemorragias, hipopigmentación focal, vasos lineales irregulares o vasos «en horquilla» entre otros34–36. Asímismo, también cabe señalar como la dermatoscopia parece ser útil en el control postratamiento con imiquimod. Mun et al., en una pequeña serie de pacientes, observaron como la persistencia de vasos glomerulares tras el tratamiento podría sugerir la presencia de tumor residual34.
Enfermedad de Bowen pigmentadaAspectos clave- •
La EB pigmentada se caracteriza por los criterios presentes en la forma no pigmentada y por la presencia de áreas de pigmentación marrón sin estructura y puntos marrones o grises dispuestos en líneas (fig. 4).
En un primer estudio llevado a cabo por el grupo de Zalaudek, analizaron 10 EB pigmentados y observaron glóbulos marrones en una distribución parcheada (90%), así como áreas grises o marrones sin estructura (80%)30. Posteriormente, Cameron et al. publicaron un estudio retrospectivo con 52 EB pigmentadas, observando en el 21,2% puntos marrones o grises con un patrón de distribución en líneas. En un 48,1% de los casos, sin embargo, predominaba un patrón de pigmentación sin estructura, mientras que en un 34,6% observaron una combinación de pigmentación sin estructura y puntos. La mayoría de casos presentaron un patrón vascular monomorfo (82,9%), predominando los vasos glomerulares (44,2%), con una distribución lineal de los vasos en el 11,5%37. Otros estudios han corroborado estos hallazgos en porcentajes variables, fundamentalmente la presencia de vasos glomerulares (50-100%), los puntos/glóbulos pigmentados (30-80%), o las áreas de pigmentación sin estructura (70-78%)34,36,38.
Mientras que estos hallazgos han demostrado ser reproducibles en el área genital38 (fig. 4), un estudio centrado en 79 lesiones de cabeza y cuello, concluyó que en esta localización los patrones dermatoscópicos difieren de lo previamente publicado y son equiparables a las QAp en base a una menor presencia de vasos glomerulares (7,6%) y puntos dispuestos en líneas (13,9%), a la observación de estructuras como círculos pigmentados (48,1%) y blancos (17,7%), estructuras romboidales (41,8%) y áreas de pigmentación sin estructura (86,1%), así como a un predominio de vasos lineales irregulares (29,2%)39 (fig. 5). Otros criterios dermatoscópicos descritos de forma menos consistente son, entre otros, las proyecciones, el retículo pigmentado, las áreas hipopigmentadas o la ulceración30,34,36,39.
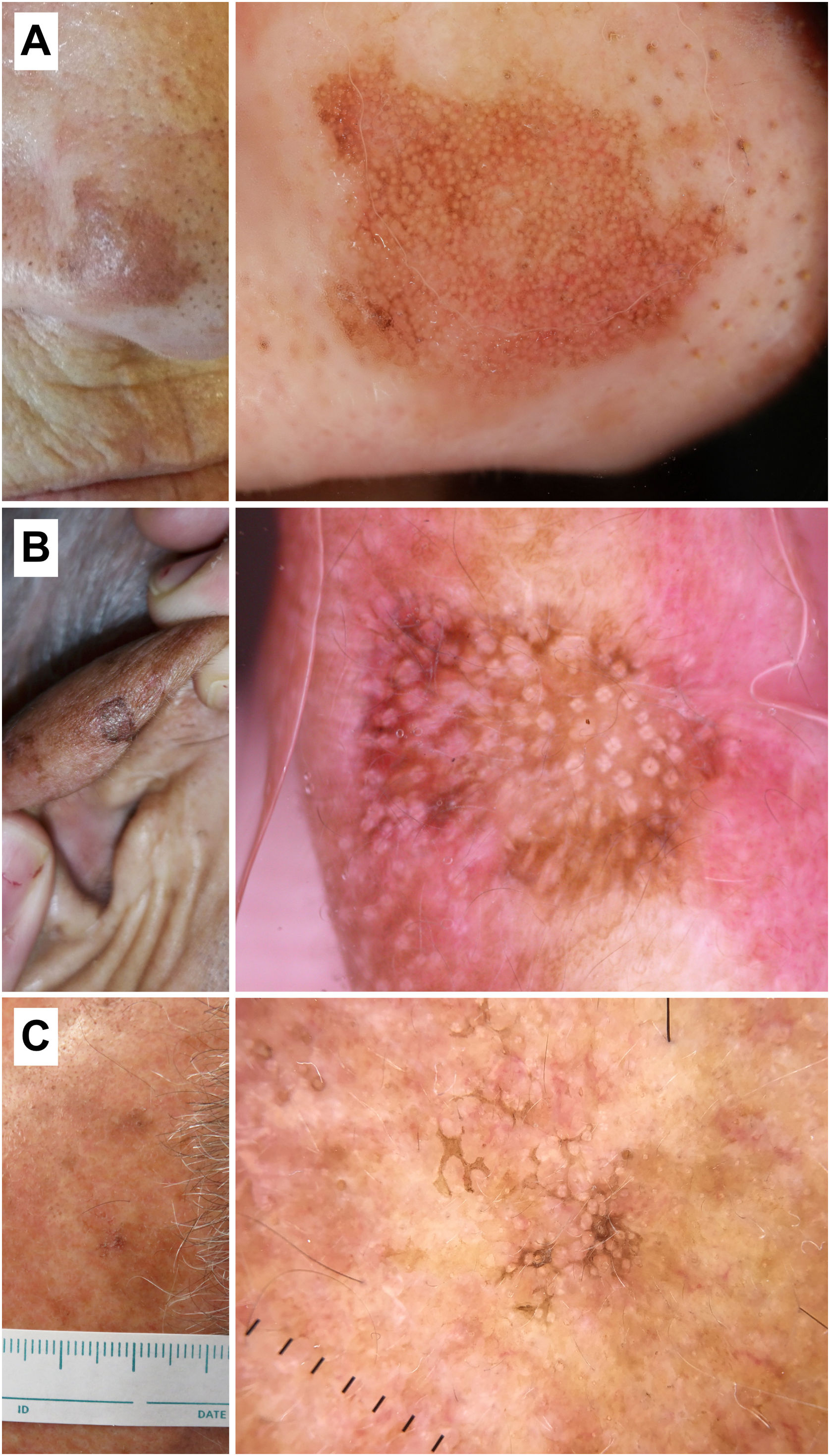
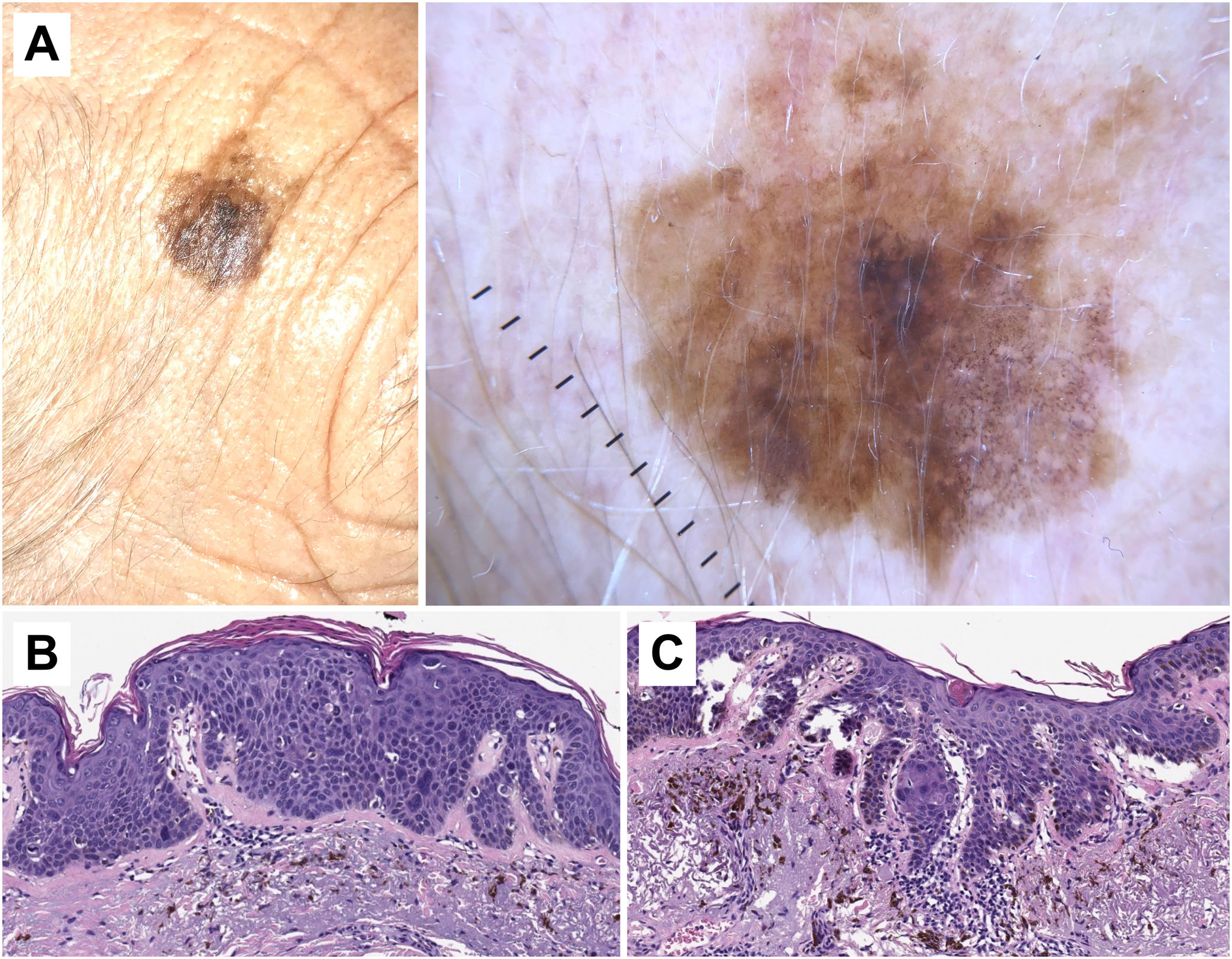
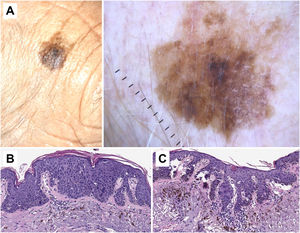
Correlación histopatológica en queratosis actínica pigmentada con áreas de carcinoma epidermoide in situ. A) Lesión pigmentada atípica en la sien de una mujer de 75 años. Imagen dermatoscópica, en la que se observan áreas de pigmentación marrón homogénea, círculos marrones, gránulos azul-gris y puntos grises dispuestos en líneas en el polo inferior de la misma. En este caso los hallazgos dermatoscópicos no permiten un diagnóstico fiable y el estudio histológico resulta imprescindible. B) Imagen histopatológica de un área de carcinoma epidermoide in situ (enfermedad de Bowen) con melanófagos en dermis superficial (hematoxilina eosina, ×10). C) Área de queratosis actínica proliferativa con queratinocitos pigmentados y melanófagos en la dermis superficial (hematoxilina eosina, ×10).
- •
En el CEi podemos identificar criterios dermatoscópicos asociados a queratinización (terrones y círculos blancos, áreas blancas sin estructura), criterios vasculares (vasos lineales irregulares, puntiformes/ glomerulares y «en horquilla») y otros criterios (ulceración, hemorragias).
- •
En los CE bien a moderadamente diferenciados predominarán los criterios asociados a queratinización, mientras que en los pobremente diferenciados predominará un patrón vascular polimorfo (fig. 6).
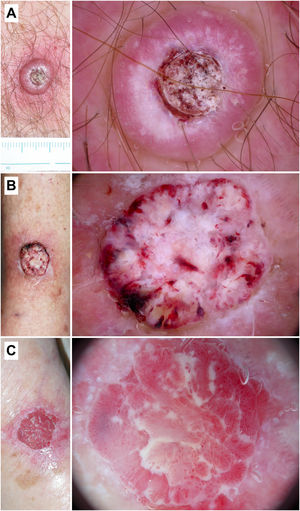
Figura 6.Queratoacantoma y carcinoma epidermoide invasivo. A) Queratoacantoma en el tórax de un varón de 54 años. En la dermatoscopia se observa una masa de queratina central, terrones y círculos blancos, áreas blancas sin estructura y vasos «en horquilla» con una distribución radial. B) Carcinoma epidermoide bien diferenciado en la pierna de una mujer de 88 años. Con dermatoscopia se aprecian áreas blanco-amarillentas sin estructura, terrones y círculos blancos, un patrón vascular polimorfo y hemorragias. C) Carcinoma epidermoide pobremente diferenciado en el brazo de una mujer de 89 años. En la dermatoscopia puede verse un predominio del color rojo y de un patrón vascular francamente atípico, con apenas criterios asociados a queratinización.
(0,73MB). - •
En el diagnóstico diferencial con las QA, la presencia de vasos puntiformes/glomerulares, «estallido de estrellas rojo», vasos «en horquilla», áreas blancas sin estructura y círculos blancos perifoliculares deben plantear la realización de una biopsia cutánea para descartar un CEi.
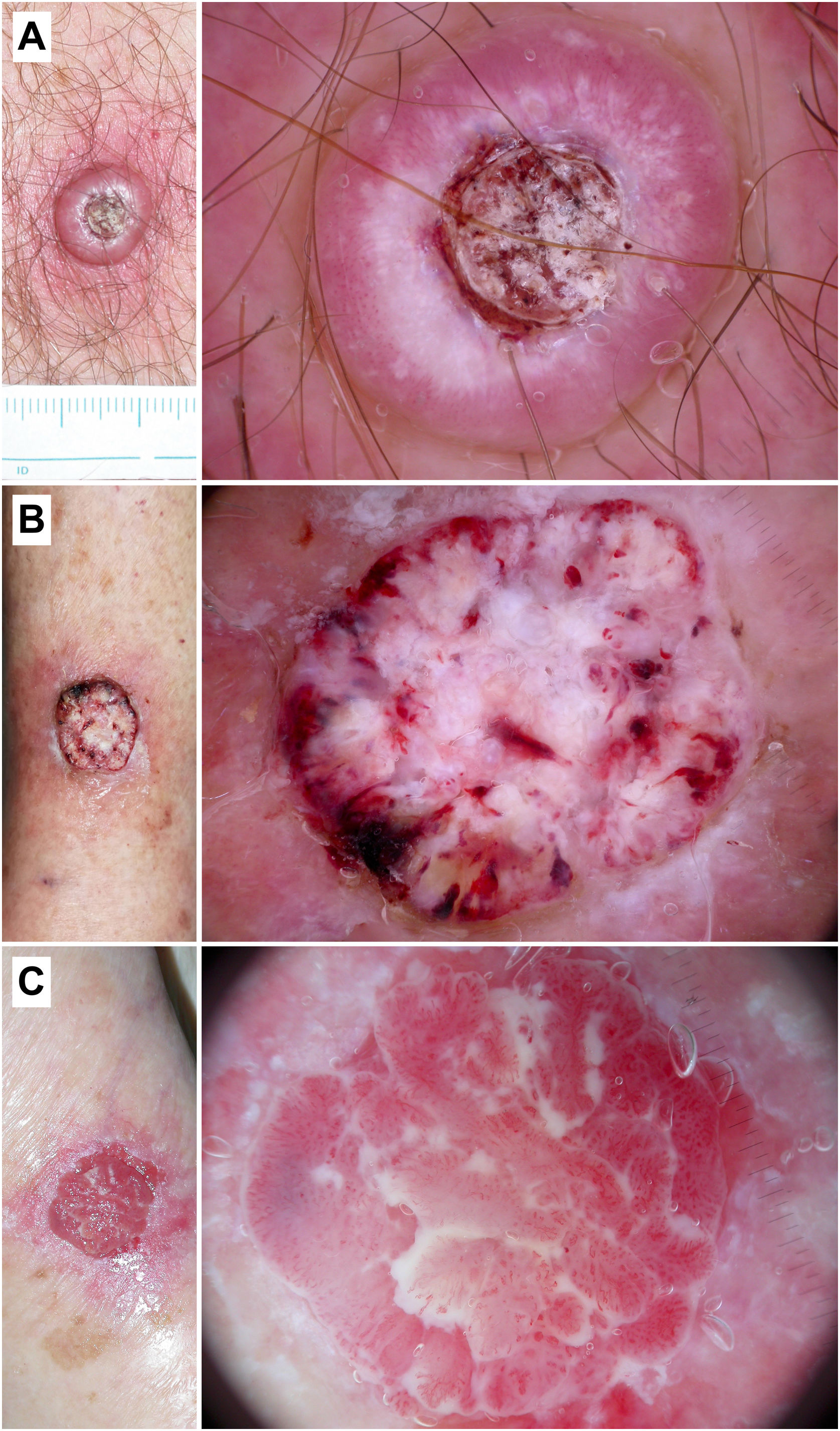
En el estudio de Zalaudek et al., en el que incluyeron 78 CEi y 24 KA, observaron como los vasos «en horquilla» (38,5%), vasos lineales irregulares (17,9%), los folículos en diana (41%), las áreas blancas sin estructura (42,3%), la queratina central (39,4%) y la ulceración (17,9%), estaban significativamente asociados con el diagnóstico de CEi (p<0,001), con frecuencias comparables en el grupo de KA excepto para los vasos lineales irregulares, más frecuentes en estos últimos10. Por otra parte, Jaimes et al. acuñaron el término «perlas queratinizantes» tras analizar 15 KA/CE bien diferenciados y observar como todas las lesiones presentaban estructuras redondeadas blanco/amarillanteas rodeadas por un halo blanquecino40 (fig. 7). Estas estructuras también han sido denominadas terrones blancos y estaban presentes en el 25,6 y 16,7% de KA y CE en el estudio de Rosendahl et al., respectivamente. De este trabajo, diseñado en forma de estudio retro- y prospectivo con 43 KA/60 CEi y 29 KA/32 CEi/145 otras lesiones, respectivamente, cabe mencionar como conclusiones: 1) la queratina central fue más frecuente en el KA (51,2%) vs. CEi (30,0%) (p=0,03); 2) la presencia de queratina fue más frecuente en el grupo de KA/CEi que en el de otras lesiones (78,7 vs. 30,3%; p<0,001), con una sensibilidad y un valor predictivo positivo (VPP) del 79 y 92% frente al grupo del CBC, respectivamente; 3) las áreas blancas sin estructura (39,3 vs.18,6%; p=0,02) y los círculos blancos (44,3 vs. 13,1%; p<0,001) fueron más frecuentes en el grupo de KA/CEi, con una especificidad de los últimos del 87% frente al resto de lesiones; y 4) en el modelo multivariante, la queratina, las hemorragias y los círculos blancos, fueron los únicos predictores independientes del diagnóstico de KA/CEi, alcanzando estos últimos el odds ratio más elevado (6,1; IC 95%: 2,4-13,3; p<0,001)41. En este contexto, debemos tener en cuenta que el CEi y el KA pueden presentar un patrón dermatoscópico solapable y que el examen histopatológico será obligado en la gran mayoría de los casos42.
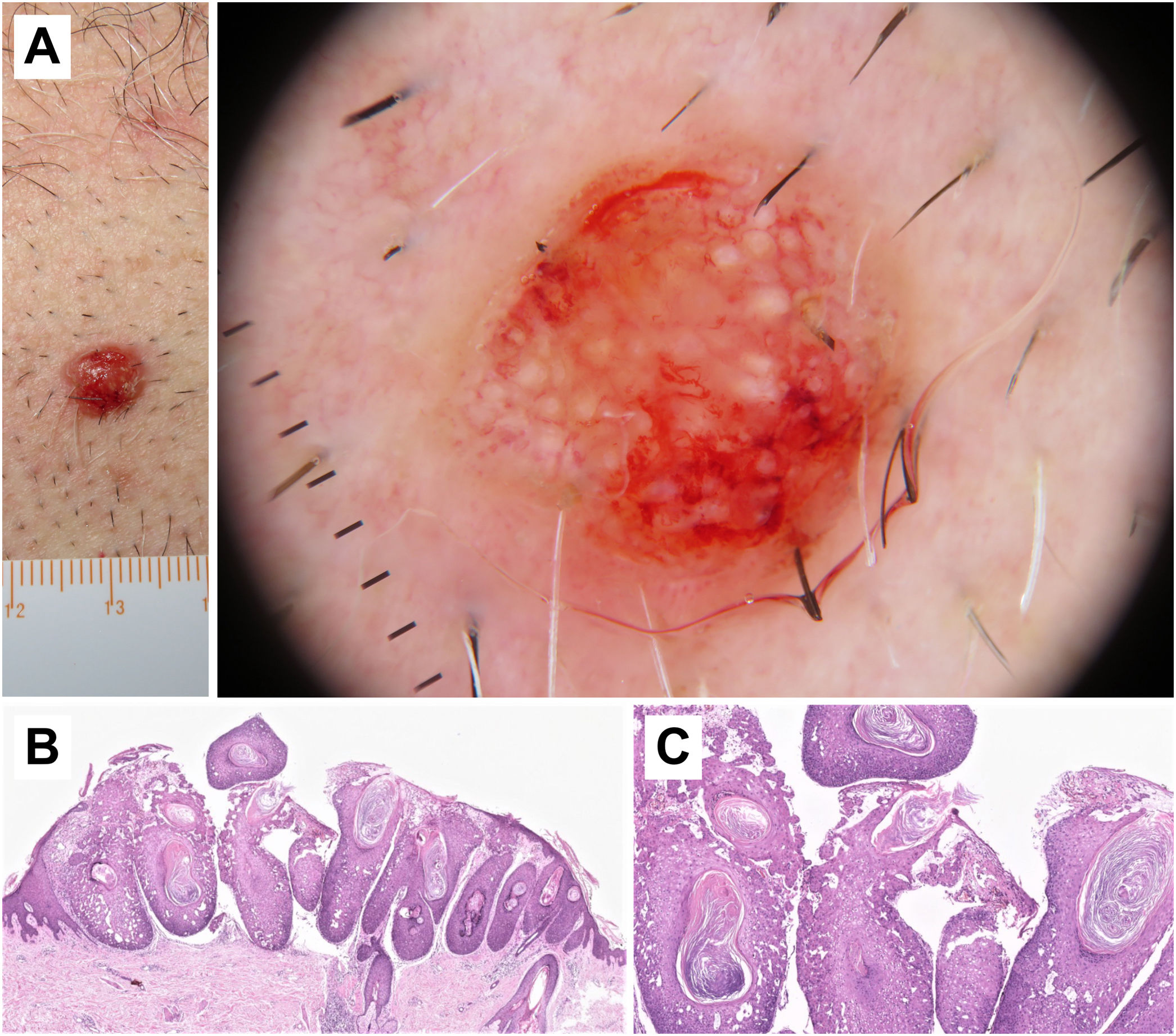
Correlación histopatológica en un carcinoma epidermoide microinfiltrante. A) Pápula eritematosa en el tórax de un varón de 46 años. B) Imagen dermatoscópica, en la que se pueden observar terrones blancos y un patrón vascular polimorfo con vasos lineales irregulares, «en horquilla» y glomerulares. C) Imagen histopatológica, en la que se observa una proliferación epitelial con acantosis y nidos bulbosos, que muestran fenómenos de acantolisis y queratinización central (hematoxilina eosina, ×2). D) Imagen a mayor aumento, en la que se aprecian en detalle las células tumorales y las áreas de queratinización («perlas córneas»), correspondientes a la imagen de terrones blancos en dermatoscopia (hematoxilina eosina, ×5).
En función del grado de diferenciación del tumor, podremos observar diferentes patrones dermatoscópicos43,44. En síntesis, aquellos CEi de bien a moderadamente diferenciados, presentarán con mayor frecuencia vasos «en horquilla», áreas blancas o amarillentas sin estructura, terrones y círculos blancos. Específicamente, el KA se ha asociado a la presencia de una masa de queratina central rodeada de vasos en horquilla o lineales irregulares con una distribución radial10,28. Al contrario, en los tumores pobremente diferenciados predominarán un patrón vascular polimorfo/atípico y la ulceración5. Lallas et al. encontraron que el predominio del color rojo se asociaba con una probabilidad 13 veces mayor de ser un CEi pobremente diferenciado44. Un patrón similar en el que predomina la vascularización atípica se ha descrito en tumores combinados CE/carcinoma de Merkel45.
Con respecto a localizaciones, destacar que el CE labial comparte en gran medida las características dermatoscópicas del CE cutáneo46. Benati et al. publicaron una serie de 22 CE labiales, en los que las estructuras más relevantes fueron las escamas (100%), halos blancos perivasculares (86%), áreas blancas sin estructura (91%) y círculos blancos (59%), así como un patrón vascular polimorfo (68%)47. En un reciente estudio retrospectivo multicéntrico con 177 lesiones labiales (107 de ellas CE), Lallas et al. observaron que la presencia de terrones blancos y la ulceración fueron predictores del diagnóstico de CE frente a los controles (OR: 6,38 y 4,11, respectivamente)48.
En relación al diagnóstico diferencial con otras lesiones, cobra especial importancia la detección precoz del CEi y su diferenciación de las QA, escenario habitual en el seguimiento de pacientes con daño actínico. El «estallido de estrellas rojo» descrito en el trabajo de Zalaudek et al. se observó en el 29,5% de CEi en dicho estudio, no encontrándose diferencias significativas en la frecuencia respecto a la EB/CE in situ. En cualquier caso, este patrón dermatoscópico debe tenerse en cuenta a la hora de plantear realizar una biopsia cutánea en el contexto de un paciente con daño actínico10. Papageorgiou et al. recogieron 50 CEi incipientes y 45 QA con confirmación histopatológica, encontrando que la presencia de vasos puntiformes/glomerulares (OR: 3,83), vasos «en horquilla» (OR: 12,12) y las áreas blancas sin estructura (OR: 3,58), fueron los principales predictores para el diagnóstico de CE en el análisis multivariante. El modelo univariante sugirió así mismo que la ulceración, los halos blancos perivasculares y los círculos blancos podrían ser así mismo predictores de CE, por lo que deben ser tenidos en cuenta49. El CEi puede presentar también un solapamiento importante con lesiones benignas frecuentes, como las queratosis seborreicas (QS), fundamentalmente en el caso de CE bien diferenciados50. En un trabajo llevado a cabo por el mismo grupo, se analizaron 104 CE y 61 QS irritadas y observaron como la presencia de vasos puntiformes (OR: 10,4), vasos lineales ramificados (OR: 5,3), las áreas blancas sin estructura (OR: 6,78), los círculos blancos, (OR: 23,45) o una distribución irregular (OR: 2,55) o periférica (2,8) de las estructuras vasculares, fueron predictores del diagnóstico de CE frente al de QS irritada51.
ConclusionesLos pacientes con daño actínico/ campo de cancerización presentan por lo general decenas de lesiones cutáneas de diferente comportamiento biológico. En este contexto, un diagnóstico diferencial preciso que nos permita seleccionar aquellas lesiones malignas candidatas a cirugía y nos posibilite identificar con seguridad lesiones «premalignas» accesibles a otros tratamientos, debe ser lo deseable. En base a la evidencia disponible, la dermatoscopia puede ser clave en este cometido y, por ello, una adecuada formación más allá de las neoplasias melanocíticas y que integre el espectro de los carcinomas queratinocíticos es fundamental.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
A la Dra. Mar García, del Servicio de Anatomía Patológica del Hospital Clínico Universitario «Lozano Blesa» de Zaragoza, por su inestimable colaboración con las imágenes de correlación histopatológica.