La electroquimioterapia (EQT) es una técnica terapéutica indicada en tumores cutáneos y subcutáneos no resecables quirúrgicamente. La EQT se fundamenta en la acción sinérgica de un fármaco antineoplásico junto con la electroporación de las membranas celulares para aumentar su citotoxicidad. El objetivo del presente estudio es objetivar la eficacia clínica, así como el perfil de seguridad de la EQT como tratamiento en pacientes con recidivas o metástasis cutáneas locorregionales de melanoma no abordables quirúrgicamente.
Material y métodosEntre enero de 2007 y diciembre de 2012 se incluyeron 31 pacientes. Todos los tratamientos se realizaron siguiendo las guías de consenso European Standard Operating Procedures of Electrochemotherapy (ESOPE). La respuesta se calculó por paciente, obteniendo la media del conjunto de las lesiones.
ResultadosEn el 49% de los casos se demostró una respuesta parcial y en el 23% se obtuvo una respuesta completa. Diecisiete pacientes mantuvieron la respuesta al año de seguimiento. En el 28% existió progresión de la enfermedad. Las complicaciones locales inmediatas (dolor, edema, eritema) fueron leves, y se resolvieron en las primeras 48h en la mayoría de los casos. Ocho pacientes presentaron complicaciones locales posteriores, como ulceración y sobreinfección, secundarias a la necrosis de las lesiones y fueron controladas con tratamientos tópicos.
ConclusionesLa EQT presenta un excelente perfil de eficacia, eficiencia y seguridad, siendo de gran utilidad en el control de la enfermedad locorregional avanzada en el melanoma en lesiones no resecables quirúrgicamente.
Electrochemotherapy is indicated for the treatment of unresectable cutaneous and subcutaneous tumors. The technique involves the synergistic use of electroporation of cell membranes to increase the cytotoxicity of anticancer drugs delivered to the tumor cells. The aim of this study was to analyze the clinical effectiveness and safety of electrochemotherapy in the treatment of unresectable locoregional recurrent or metastatic melanomas.
Material and methodsWe studied 31 patients treated between January 2007 and December 2012. The European Standard Operating Procedures of Electrochemotherapy (ESOPE) were applied in all cases. Treatment response was analyzed as overall patient response (mean response based on results for all lesions treated in a given patient).
ResultsResponse was classified as partial in 49% of patients and complete in 23%. At 1 year, the level of response achieved had been maintained in 17 patients. Disease progression was observed in 28% of the series. Immediate local complications (pain, swelling, erythema) were mild and resolved within 48hours in most cases. Eight patients developed subsequent local complications, such as ulcers and secondary infections associated with necrosis of the lesions. These complications were brought under control with topical treatments.
ConclusionsElectrochemotherapy is a very effective, safe, and efficient treatment for advanced locoregional disease in patients with unresectable melanoma lesions.
La electroquimioterapia (EQT) es una novedosa opción terapéutica indicada en tumores cutáneos y subcutáneos no resecables quirúrgicamente, en los que por su localización o extensión ha fracasado el tratamiento inicial o no existen otras opciones de tratamiento1. Está fundamentada en la acción combinada de la electroporación de membranas celulares, junto con la administración de fármacos antineoplásicos para el tratamiento y control locorregional de tumores sólidos. Desde su introducción a principios de los años 80, la electroporación ha sido utilizada tanto in vitro como in vivo para facilitar la entrada de sustancias hidrosolubles como nucleótidos, péptidos y fármacos en el interior de las células2. La electroporación es el fenómeno físico-químico mediante el cual la membrana celular es sometida a un campo eléctrico de alta intensidad y muy corta duración, lo que genera canales o poros transmembrana que permiten la introducción de moléculas hidrosolubles al citosol celular, no permeables en condiciones normales3. Así, mediante esta permeabilización transitoria y reversible de la membrana celular, se alcanza una mayor concentración intracelular de fármacos como el cisplatino o la bleomicina, aumentando su citotoxicidad por 100 y por 1.000, respectivamente4.
La estandarización del procedimiento de la EQT se realizó con el proyecto European Standard Operating Procedures of Electrochemotherapy (ESOPE) publicado en 20065, donde se estudiaron la eficacia, la toxicidad, la dosis y el mecanismo de administración. Este trabajo, realizado en 4 centros de cáncer de Europa en pacientes con metástasis cutáneas de diversas etiologías, demostró una respuesta positiva de control local del tumor en el 88% de casos tratados con EQT con bleomicina intravenosa, en comparación con el 73% con bleomicina intratumoral y el 75% con cisplatino intratumoral.
Los objetivos de este estudio fueron objetivar la respuesta al mes y al año, así como las posibles complicaciones derivadas de la EQT como terapia locorregional en pacientes con recidivas o metástasis cutáneas de melanoma no abordables quirúrgicamente.
Material y métodosSe diseña un estudio observacional en forma de serie de casos, en la que se recogieron datos tanto prospectivamente como retrospectivamente, entre enero de 2007 y diciembre de 2012 en el Servicio de Dermatología del Hospital Clínic, Universidad de Barcelona. Se incluyeron en el estudio aquellos pacientes con recidivas o metástasis cutáneas de melanoma no tributarios de cirugía o sin alternativa de tratamiento tras fracaso de terapias previas. Debido a la situación crítica de estos pacientes, no se presentaron criterios de exclusión estrictos, a excepción de alergia a la bleomicina o derivados. No se excluyeron aquellos pacientes que habían recibido terapias locales o sistémicas previas. Todos los tratamientos se realizaron siguiendo las guías de consenso ESOPE5.
Se usó el equipo Cliniporator® (IGEA®, Italia). Los electrodos utilizados para el tratamiento de las lesiones cutáneas o subcutáneas constan de 6 agujas de longitud variable (entre 1 y 3cm). Dichas agujas se disponen formando un pentágono periférico con la sexta aguja en su centro geométrico. La intensidad y amplitud de los pulsos eléctricos se mantuvieron superiores a 400V/cm2 y a 1A, respectivamente. La duración de estos pulsos fue de 100ms. La amplitud, frecuencia y duración de los pulsos se dirige automáticamente por la consola del equipo comercializado que controla la fuente de potencia según los estándares europeos (ESOPE). En cada aplicación se producen 8 pulsos eléctricos con las características antes descritas y una frecuencia de 5.000Hz.
Los pulsos eléctricos fueron iniciados una vez transcurridos 8min después de la inyección intravenosa de bleomicina, tal y como se estandarizó en los criterios ESOPE6. La dosis de bleomicina administrada fue de 15.000IU/m2. La EQT fue aplicada bajo anestesia general. Todos los pacientes firmaron el correspondiente consentimiento informado.
Se realizó iconografía de las lesiones antes y después de cada curso de tratamiento. En cada paciente se recogieron los siguientes datos: localización, estadificación de la enfermedad, características histológicas del tumor primario, presencia o no de enfermedad a distancia (ganglionar o metástasis en órganos internos), tratamientos previos, número de cursos de EQT y el intervalo entre ellos, dosis de bleomicina, número de pulsos por sesión y efectos secundarios. En aquellos casos necesarios se aplicó un nuevo curso a las 4-6 semanas del anterior. La respuesta al tratamiento fue valorada a las 4 semanas del último ciclo y al año del tratamiento, definiéndose como: a) progresión clínica (aumento del tamaño tumoral >25%); b) estabilización de la enfermedad locorregional-respuesta parcial (aumento del tamaño<25% o reducción<50%); y c) respuesta completa (reducción >50%). Sin embargo, en nuestro estudio establecimos una media del resultado de todas las lesiones de un mismo paciente, con el objetivo de instaurar un resultado global, en lugar de realizarlo por cada una de las lesiones, tal y como se ha realizado en otros estudios (en pacientes con un elevado número de lesiones comunicar los resultados por lesión puede resultar confuso).
Las nuevas lesiones que aparecieron posteriormente en regiones no tratadas fueron consideradas nueva enfermedad y no recidiva de lesiones ya tratadas, por lo que no se incluyeron en los parámetros de respuesta local.
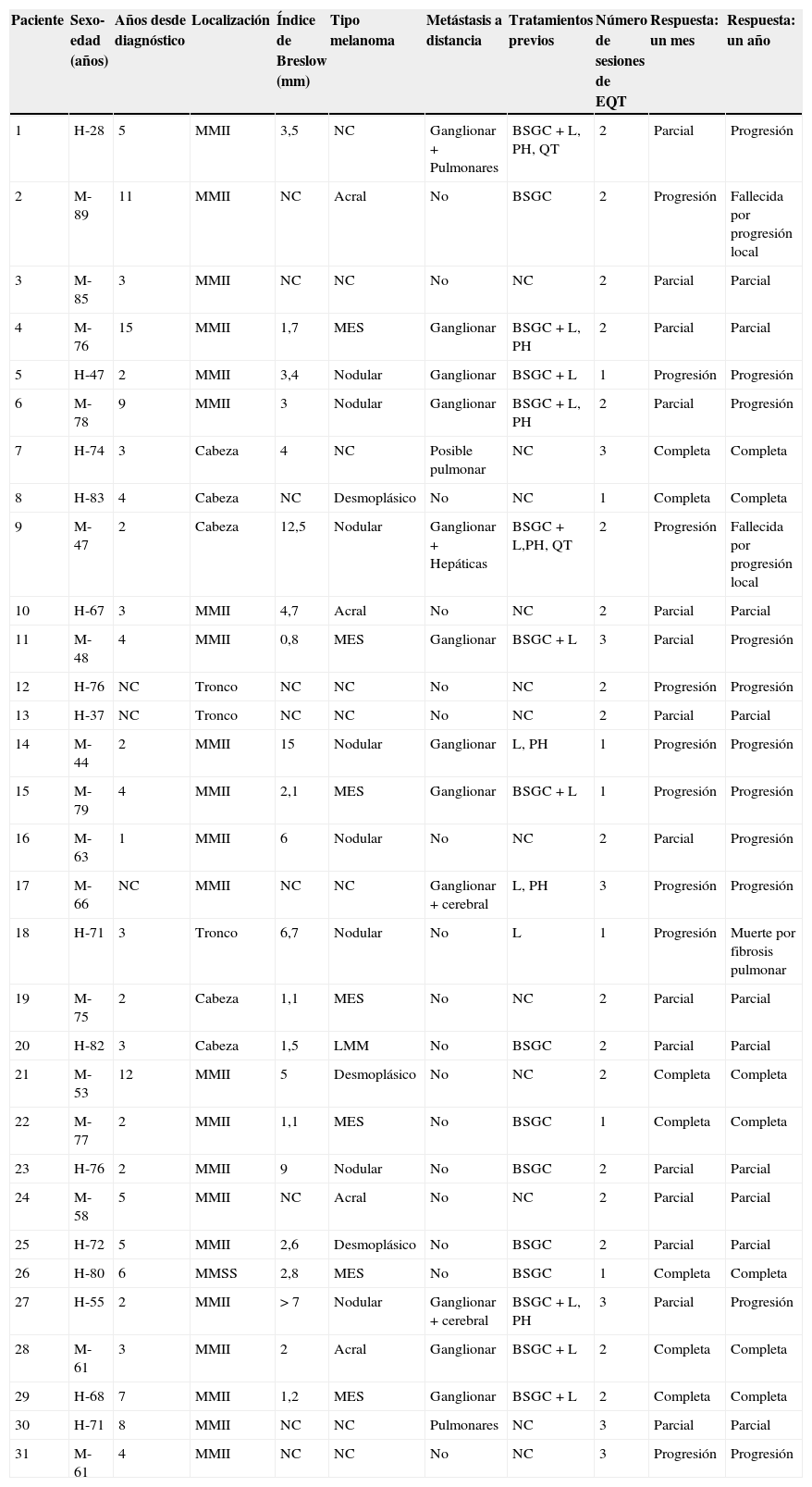
ResultadosSe incluyeron en el estudio 31 pacientes; 16 mujeres y 15 hombres (tabla 1). Ningún paciente fue excluido. La media de edad fue de 66 años (rango desde 28 hasta 89 años). El índice de Breslow medio del tumor primario fue de 4,39mm (0,8-15mm). Por frecuencia se observó que el melanoma primario se dividía en los siguientes tipos: nodular (8 casos), extensión superficial (7 casos), acral (4 casos), desmoplásico (3 casos) y lentigo maligno (un caso). El tipo no pudo ser confirmado en 8 pacientes referidos de otros centros. El tumor primario se localizó en los miembros inferiores en un 68% de los casos. Otras localizaciones incluyeron la cabeza y cuello (19%), tronco (10%) y miembros superiores (3%).
Características basales y de respuesta en 31 pacientes con metástasis cutáneas de melanoma tratados con electroquimioterapia
| Paciente | Sexo-edad (años) | Años desde diagnóstico | Localización | Índice de Breslow (mm) | Tipo melanoma | Metástasis a distancia | Tratamientos previos | Número de sesiones de EQT | Respuesta: un mes | Respuesta: un año |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H-28 | 5 | MMII | 3,5 | NC | Ganglionar+Pulmonares | BSGC+L, PH, QT | 2 | Parcial | Progresión |
| 2 | M-89 | 11 | MMII | NC | Acral | No | BSGC | 2 | Progresión | Fallecida por progresión local |
| 3 | M-85 | 3 | MMII | NC | NC | No | NC | 2 | Parcial | Parcial |
| 4 | M-76 | 15 | MMII | 1,7 | MES | Ganglionar | BSGC+L, PH | 2 | Parcial | Parcial |
| 5 | H-47 | 2 | MMII | 3,4 | Nodular | Ganglionar | BSGC+L | 1 | Progresión | Progresión |
| 6 | M-78 | 9 | MMII | 3 | Nodular | Ganglionar | BSGC+L, PH | 2 | Parcial | Progresión |
| 7 | H-74 | 3 | Cabeza | 4 | NC | Posible pulmonar | NC | 3 | Completa | Completa |
| 8 | H-83 | 4 | Cabeza | NC | Desmoplásico | No | NC | 1 | Completa | Completa |
| 9 | M-47 | 2 | Cabeza | 12,5 | Nodular | Ganglionar+Hepáticas | BSGC+L,PH, QT | 2 | Progresión | Fallecida por progresión local |
| 10 | H-67 | 3 | MMII | 4,7 | Acral | No | NC | 2 | Parcial | Parcial |
| 11 | M-48 | 4 | MMII | 0,8 | MES | Ganglionar | BSGC+L | 3 | Parcial | Progresión |
| 12 | H-76 | NC | Tronco | NC | NC | No | NC | 2 | Progresión | Progresión |
| 13 | H-37 | NC | Tronco | NC | NC | No | NC | 2 | Parcial | Parcial |
| 14 | M-44 | 2 | MMII | 15 | Nodular | Ganglionar | L, PH | 1 | Progresión | Progresión |
| 15 | M-79 | 4 | MMII | 2,1 | MES | Ganglionar | BSGC+L | 1 | Progresión | Progresión |
| 16 | M-63 | 1 | MMII | 6 | Nodular | No | NC | 2 | Parcial | Progresión |
| 17 | M-66 | NC | MMII | NC | NC | Ganglionar+cerebral | L, PH | 3 | Progresión | Progresión |
| 18 | H-71 | 3 | Tronco | 6,7 | Nodular | No | L | 1 | Progresión | Muerte por fibrosis pulmonar |
| 19 | M-75 | 2 | Cabeza | 1,1 | MES | No | NC | 2 | Parcial | Parcial |
| 20 | H-82 | 3 | Cabeza | 1,5 | LMM | No | BSGC | 2 | Parcial | Parcial |
| 21 | M-53 | 12 | MMII | 5 | Desmoplásico | No | NC | 2 | Completa | Completa |
| 22 | M-77 | 2 | MMII | 1,1 | MES | No | BSGC | 1 | Completa | Completa |
| 23 | H-76 | 2 | MMII | 9 | Nodular | No | BSGC | 2 | Parcial | Parcial |
| 24 | M-58 | 5 | MMII | NC | Acral | No | NC | 2 | Parcial | Parcial |
| 25 | H-72 | 5 | MMII | 2,6 | Desmoplásico | No | BSGC | 2 | Parcial | Parcial |
| 26 | H-80 | 6 | MMSS | 2,8 | MES | No | BSGC | 1 | Completa | Completa |
| 27 | H-55 | 2 | MMII | >7 | Nodular | Ganglionar+cerebral | BSGC+L, PH | 3 | Parcial | Progresión |
| 28 | M-61 | 3 | MMII | 2 | Acral | Ganglionar | BSGC+L | 2 | Completa | Completa |
| 29 | H-68 | 7 | MMII | 1,2 | MES | Ganglionar | BSGC+L | 2 | Completa | Completa |
| 30 | H-71 | 8 | MMII | NC | NC | Pulmonares | NC | 3 | Parcial | Parcial |
| 31 | M-61 | 4 | MMII | NC | NC | No | NC | 3 | Progresión | Progresión |
BSGC: biopsia selectiva de ganglio centinela; H: hombre; L: linfadenectomía; LMM: lentigo maligno melanoma; M: mujer; MES: melanoma de extensión superficial; mm: milímetros; MMII: miembros inferiores; MMSS: miembros superiores; NC: no conocido; PH: perfusión hipertérmica; QT: quimioterapia.
Se realizaron un total de 57 sesiones de EQT. Todos los pacientes realizaron una sesión, mientras que 18 de ellos realizaron 2 sesiones, y solamente 6 pacientes recibieron 3 cursos. La administración de pulsos por lesión se realizó en función de su tamaño: 2 pulsos cuando la lesión era menor de 5mm de diámetro y de 3 a 5 pulsos en aquellas lesiones de mayor tamaño. Cinco pacientes presentaron antes o durante el estudio metástasis de órganos internos sólidos. Los tratamientos documentados previamente a la EQT fueron:a) biopsia selectiva de ganglio centinela (BSGC): 16 casos (10 de ellos asociados a linfadenectomía posterior);b) linfadenectomía: 13 casos (3 de ellos sin BSGC previa);c) perfusión hipertérmica de miembro aislado: 7 casos; y d) quimioterapia sistémica: 2 casos.
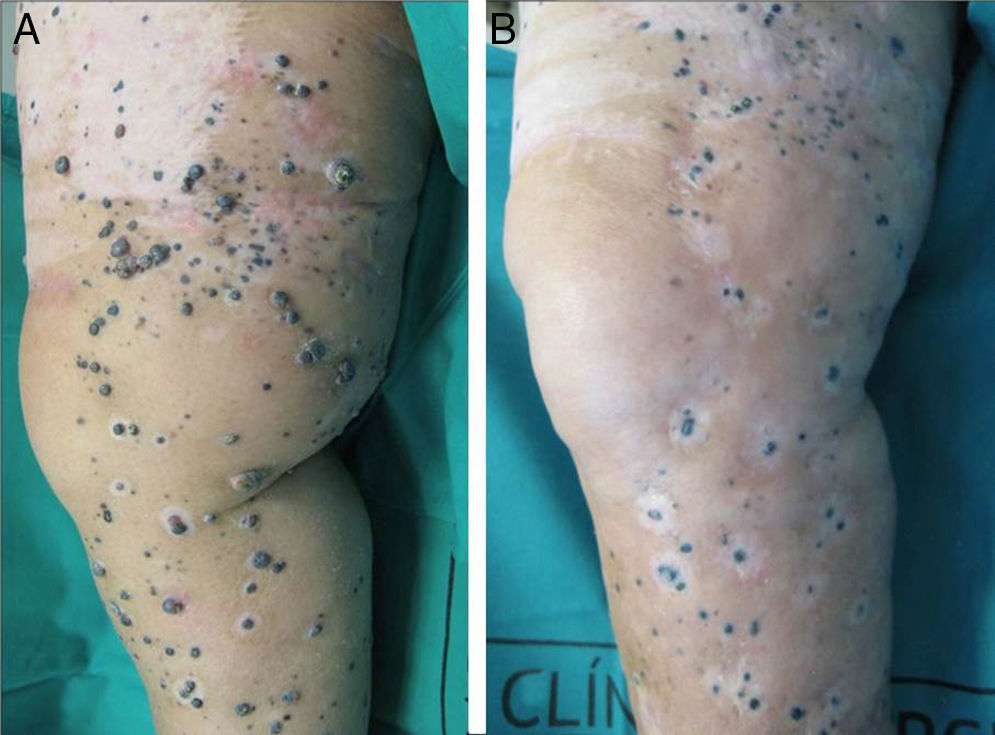
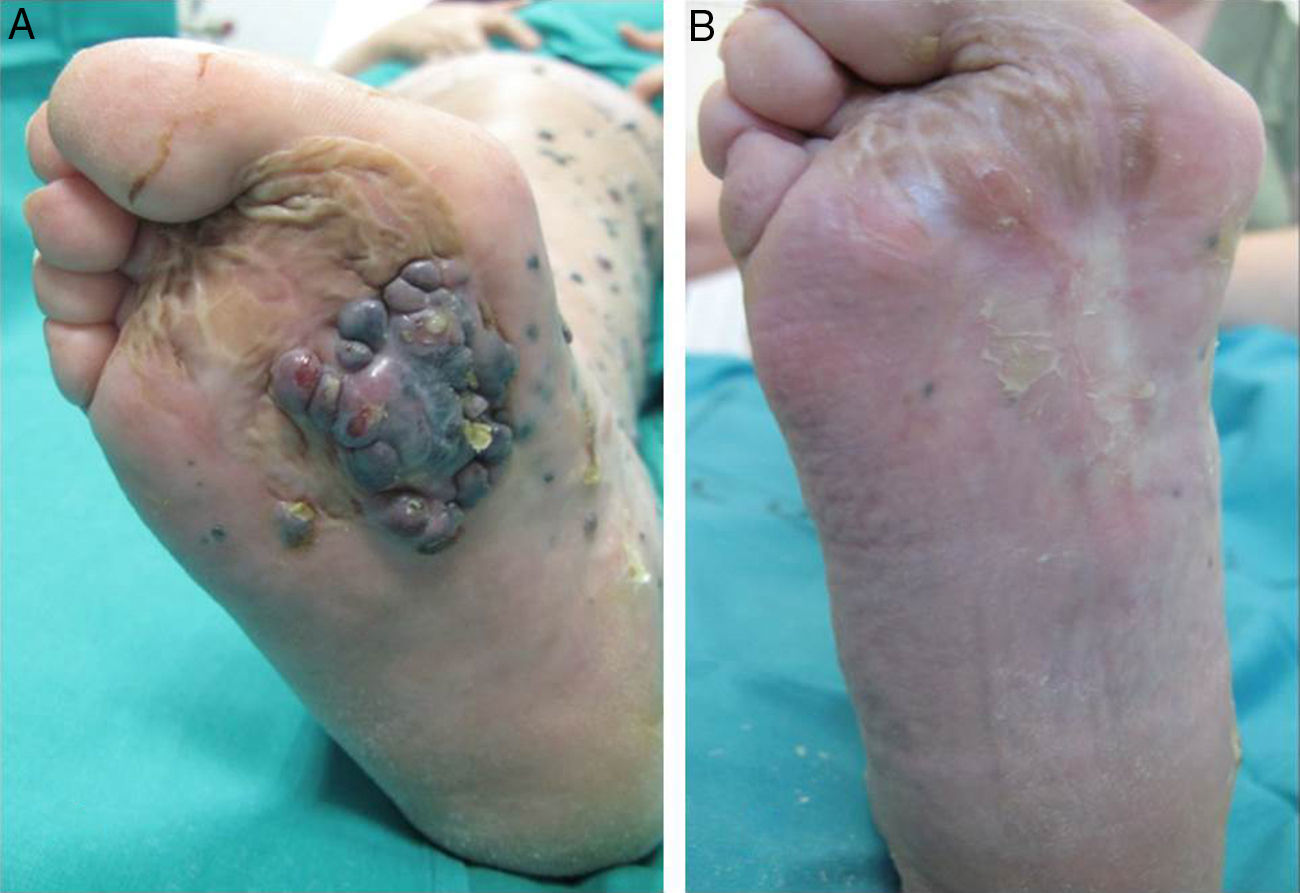
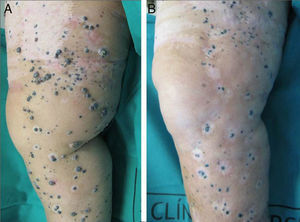
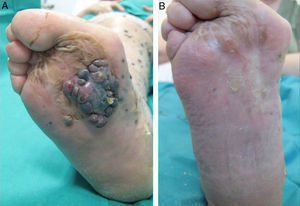
El 72% (22 casos) de los pacientes obtuvieron una respuesta positiva con mejoría o estabilización de las lesiones durante al menos 12 meses de seguimiento (figs. 1 y 2). Mientras que 15 de los 22 pacientes (49%) demostraron una estabilización clínica de la enfermedad, en los 7 restantes (23%) se obtuvo una respuesta clínica completa de las lesiones tratadas. En el 28% existió progresión de la enfermedad después del ciclo de EQT. Cinco de los 15 pacientes con respuesta parcial padecieron progresión de la enfermedad entre los 8 y los 12 meses después del tratamiento.
La mayoría de pacientes toleraron bien el tratamiento sin importantes complicaciones. Los efectos secundarios sistémicos más frecuentes fueron las náuseas y los vómitos, que se controlaron bien con tratamiento médico. Las complicaciones locales inmediatas fueron leves, aparecieron en todos los pacientes y se resolvieron en las primeras 48h en la mayoría de casos. Entre ellas destacaron el dolor, el edema, el eritema y la exudación. Ocho pacientes presentaron complicaciones locales posteriores, como ulceración y sobreinfección, secundarias a la necrosis de las lesiones y fueron controladas con tratamientos tópicos. Un paciente falleció en los primeros 7 días de seguimiento por insuficiencia respiratoria progresiva, sin demostrarse su relación con la EQT.
DiscusiónLas metástasis en tránsito de melanoma son aquellas que aparecen a lo largo del trayecto cutáneo entre el lugar del tumor primario y el grupo linfático regional. Se han documentado en un 5% de casos sin enfermedad nodal y hasta en un 20% de los pacientes con metástasis linfáticas7. El manejo de las recurrencias cutáneas múltiples es un reto terapéutico que afecta hasta al 80% de pacientes que presentan recidivas de melanoma en los primeros 5 años de seguimiento8. A pesar de que la resección quirúrgica es el tratamiento de elección, el gran número de lesiones o su localización las hacen inabordables en muchos casos. La evolución de la enfermedad locorregional avanzada empeora substancialmente la calidad de vida en estos pacientes debido a la tórpida evolución de las lesiones, que causan dolor e impotencia funcional en la región afectada. Además, las lesiones aumentan en número y de tamaño, se ulceran, sangran y pueden sobreinfectarse, por lo que necesitan tratamientos paliativos. Sin embargo, desafortunadamente no existe consenso sobre el manejo de estos casos, ya que las opciones terapéuticas son limitadas, muy costosas y con resultados variables, siendo así el pronóstico pobre, con datos de supervivencia a los 5 años que varían del 12% al 37% de los casos9. Existen diferentes opciones para su tratamiento con resultados variables: imiquimod10, EQT, quimioterapia sistémica11, radioterapia12, IL-2 intralesional13, interferón-α14, intratumoral bacilo de Calmette-Guérin15 y perfusión hipertérmica de miembro aislado16,17.
La EQT es una novedosa opción terapéutica para tumores cutáneos y subcutáneos de diferentes etiologías que no son operables y en los que han fracasado tratamientos previos. Se ha publicado su utilidad en el melanoma18,19, el sarcoma de Kaposi20, el carcinoma basocelular21 y el carcinoma espidermoide1. Recientemente se ha publicado una serie de 3 casos con linfoma B de la zona marginal primario cutáneo que respondieron a este tratamiento22. Asimismo, se han documentado respuestas positivas en metástasis cutáneas y subcutáneas de cáncer gástrico23, mama24 y carcinoma escamoso de cabeza y cuello. En este momento se está investigando con electrodos de mayor longitud y otros sistemas la aplicabilidad de la EQT en órganos más profundos como metástasis óseas, sarcomas de partes blandas25 y metástasis hepáticas de cáncer colorrectal26.
En las metástasis cutáneas de melanoma se han documentado tasas de respuesta globales muy altas. Se han objetivado respuestas parciales del 39% y completas del 23% de las metástasis (61% de respuesta global)27. Otros estudios demuestran hasta un 58% de respuesta completa y un 35% de respuesta parcial (93% de respuesta global)28. En nuestro estudio se observó un 49% de respuesta parcial, un 23% de respuesta completa (72% de respuesta global) y en un 28% existió progresión de la enfermedad. Algunos autores han observado mejor respuesta en nódulos menores de 2cm29. Hasta el momento la EQT solo se contempla con uso paliativo en el melanoma debido a que no modifica la evolución de las metástasis en órganos internos ni ha demostrado aumento de la supervivencia30. Sin embargo, Caracò et al.31 han documentado que el 21,7% de los pacientes alcanzaron respuestas completas de larga duración (hasta los 27,5 meses), por lo que su uso locorregional, además de controlar la enfermedad y evitar complicaciones a corto término, podría tener un papel relevante también a medio plazo. Además, los mínimos efectos secundarios asociados a la EQT permite el retratamiento de las lesiones hasta alcanzar una respuesta mayor28. Nuestra serie también documenta que los resultados positivos se mantienen, por lo menos un año en la mayoría de casos.
Los efectos secundarios suelen ser leves y transitorios. En nuestra experiencia la aparición de complicaciones inmediatas como eritema, edema y dolor es constante y se resuelve en los primeros días después del procedimiento. Las náuseas y los vómitos requirieron una atención especial debido al malestar que crea en el paciente. Algunas series han comunicado mioclonías30. Efectos secundarios o complicaciones tardías son raramente reportados en la literatura. Por ello, es interesante destacar que 8 de los pacientes que hemos estudiado presentaron complicaciones locales posteriores, como ulceración y sobreinfección, secundarias a la necrosis de las lesiones y que fueron controladas con tratamientos tópicos. Por otra parte, es conocido que la bleomicina induce una amplia variedad de disfunciones respiratorias y pulmonares, entre ellas la fibrosis pulmonar32. A pesar de que en la EQT las dosis de bleomicina administradas sistémicamente son relativamente bajas (puesto que se compensa con una concentración intratumoral de citostáticos muy elevada gracias a la electroporación), por lo que su toxicidad sistémica es baja, un paciente del estudio falleció a causa del deterioro de la fibrosis pulmonar de base que padecía. Por tanto, sugerimos el uso de cisplatino en pacientes que presenten alteraciones pulmonares de base.
Debido a su alta tasa de respuesta, su menor morbilidad y su menor coste la EQT se está posicionando como primera opción en el tratamiento de las metástasis locorregionales de melanoma de extremidades, en detrimento de la perfusión hipertérmica de miembro aislado33. Además, posee una capacidad hemostática reduciendo el flujo sanguíneo que, además de tener un efecto anti-tumoral, permite controlar inmediatamente la hemorragia de los tumores cutáneos avanzados34, una complicación frecuente que empeora considerablemente la calidad de vida de estos pacientes. Por este motivo, algunos investigadores han usado con éxito la EQT para detener el sangrado en metástasis de melanoma refractarias35.
En conclusión, la EQT representa una opción paliativa, pero de gran utilidad en el control del melanoma recidivante o con múltiples metástasis cutáneas no resecables quirúrgicamente, en los que por su localización o extensión ha fracasado el tratamiento inicial o no existen otras opciones de tratamiento. Sin embargo, puede representar en un futuro próximo la terapia de elección en la enfermedad locorregional avanzada debido a su excelente perfil de eficacia, eficiencia y seguridad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.