La esclerosis tuberosa (ET) es un trastorno neurocutáneo de herencia autosómica dominante causado por mutaciones en el gen supresor tumoral, TSC1 (cromosoma 9q34) o TSC2 (cromosoma 16p13.3), que codifican para las proteínas hamartina y tuberina, respectivamente. Dichas proteínas son responsables de formar un complejo que inhibe la molécula diana de la rapamicina en mamíferos (mTOR), fundamental en la regulación del ciclo celular. El resultado es una proliferación celular descontrolada, caracterizándose por la aparición de hamartomas en múltiples órganos, incluyendo la piel, el riñón y el sistema nervioso central1,2. Rapamicina (sirolimus) es un fármaco inmunosupresor que actúa mediante la inhibición de mTOR. Se ha utilizado clásicamente por vía oral para evitar el rechazo en el trasplante renal, dadas sus propiedades antineoplásicas al inhibir la neoangiogénesis y la proliferación de células tumorales, y se ha comprobado su eficacia en la disminución del número y tamaño de los tumores en los pacientes diagnosticados de ET. Recientemente se ha publicado la utilidad de rapamicina tópica para el tratamiento de angiofibromas faciales3–7 y en la reducción de máculas hipomelanóticas8 en pacientes con ET.
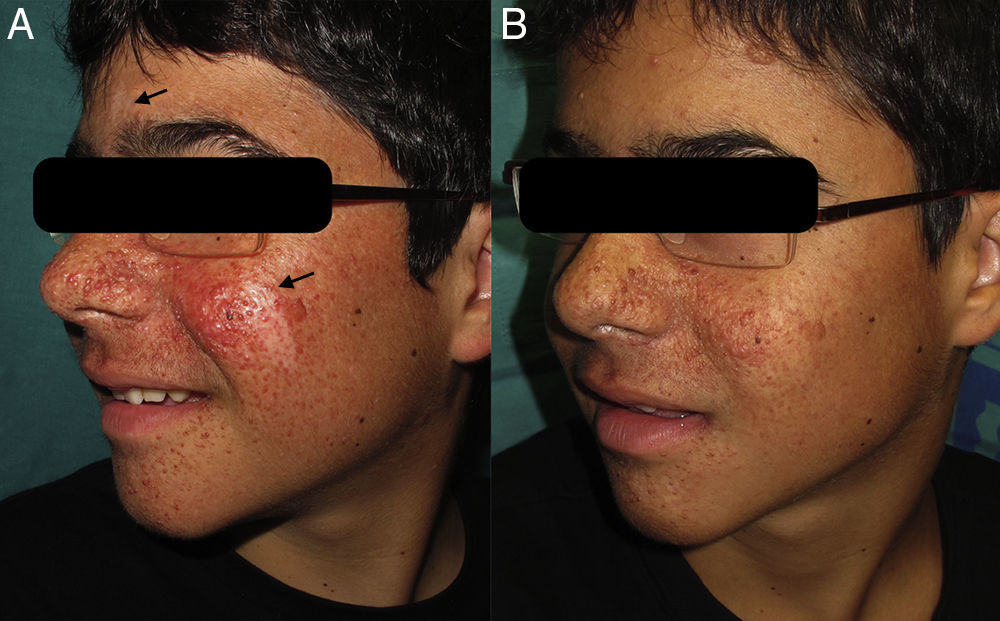
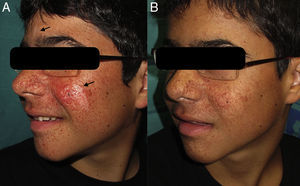
Presentamos el caso de un paciente, varón de 13 años de edad, diagnosticado clínicamente de ET a los 4 meses por presentar un cuadro con varias manifestaciones características de la enfermedad: epilepsia, múltiples máculas hipomelanóticas y angiofibromas faciales. El estudio genético confirmó la presencia de ET esporádica, debido a una mutación c5043C>G en el exón 38 del gen TSC2, que modifica la secuencia de la proteína p.N1681K. La resonancia magnética nuclear cerebral demostró la presencia de múltiples tuberosidades corticales y subcorticales, así como la presencia de múltiples hamartomas intraventriculares y subependimarios. El paciente presentaba astrocitomas retinianos bilaterales, y la ecografía abdominal reveló la presencia de múltiples angiomiolipomas de localización hepática y renal, asintomáticos en el momento de la evaluación. Las manifestaciones cutáneas consistían en angiofibromas faciales de aparición progresiva, múltiples máculas hipomelanóticas, un fibroma periungueal y una placa chagrín en la espalda.
Con el objetivo de mejorar el aspecto facial y disminuir el número de angiofibromas se obtuvo consentimiento informado y se comenzó a aplicar pomada de rapamicina al 0,2% formulada en la farmacia del hospital, sin coste para el paciente. La posología utilizada fue la de una aplicación diaria, 5 días por semana, durante 12 meses.
La pomada se aplicó únicamente en la cara. No se consideró su utilización en las máculas del tronco y las extremidades debido al elevado precio del preparado.
A las 2 semanas de iniciar el tratamiento se empezó a observar una disminución del número de los angiofibromas faciales, objetivándose su máximo efecto a las 12 semanas. Destacamos también la notable mejoría de las máculas hipomelanóticas de la cara, donde la respuesta fue similar en el área glabelar y en la mejilla izquierda del paciente (fig. 1).
El tratamiento fue bien tolerado, sin aparición de efectos adversos locales o sistémicos, con niveles plasmáticos de rapamicina en un rango inferior a 0,3ng/ml. Se decidió mantener la estrategia terapéutica durante un año para evitar la aparición de nuevos angiofibromas.
Los angiofibromas faciales son un rasgo característico de la ET, que a pesar de ser tumoraciones benignas tienen una importante repercusión psicológica en estos pacientes.
Nuestro caso demuestra que la formulación de rapamicina tópica al 0,2% es efectiva y segura para el tratamiento de los angiofibromas faciales, así como para las máculas hipomelanóticas. El precio y la ausencia de indicación aprobada para el uso tópico de la rapamicina son factores limitantes de este agente terapéutico. Este caso es el tercero descrito en la literatura en el que se ha observado una franca mejoría, hasta casi la desaparición completa, de las máculas hipomelanóticas. El fundamento que justifica la utilidad de la rapamicina en las máculas hipomelanóticas podría ser que aumenta la transcripción de microphtalmia transcription factor (MITF) implicado en la expresión génica melanogénica y en la inducción de la melanización de células en el melanoma9.
En conclusión, nuestro caso viene a apoyar la utilidad de rapamicina tópica en el tratamiento de las máculas hipomelanóticas de pacientes con ET. Sin embargo son necesarios más casos tratados con rapamicina tópica para establecer su seguridad, así como la pauta terapéutica y eficacia a largo plazo.