Vismodegib es el primer inhibidor selectivo de la vía de señalización Hedgehog que ha sido aprobado por la Food and Drug Administration (FDA) en EE. UU. para el tratamiento del carcinoma basocelular localmente avanzado y metastásico (Erivedge, Genentech, enero de 2012). Este fármaco se une e inactiva específicamente el receptor de transmembrana-7 Smoothened (SMO), frenando la activación de la familia de factores de transcripción del oncogén asociado a glioma (GLI), suprimiendo la proliferación y el crecimiento tumoral. Los estudios publicados hasta la fecha evalúan la eficacia de vismodegib basándose en criterios clínicos y radiológicos, pero disponemos de escasa información respecto a las bases moleculares que justifican la eficacia clínica probada del fármaco. Esta revisión intenta proporcionar datos actuales respecto a la vía de señalización Hedgehog, datos sobre los ensayos clínicos realizados con vismodegib en el tratamiento del carcinoma basocelular y su uso en otro tipo de tumores.
In January 2012, vismodegib (Erivedge, manufactured by Genentech) became the first selective inhibitor of the Hedgehog signaling pathway to be approved by the US Food and Drug Administration for the treatment of locally advanced and metastatic basal cell carcinoma. The drug selectively binds to Smoothened, a 7-helix transmembrane receptor, thereby inhibiting activation of transcription factors of the glioma-associated oncogene family and suppressing tumor proliferation and growth. Studies published to date have assessed the efficacy of vismodegib according to clinical and radiologic outcomes but little information is available on the molecular mechanisms underpinning the proven clinical efficacy of the drug. This review will cover recent data on the Hedgehog signaling pathway and data from clinical trials with vismodegib in the treatment of basal cell carcinoma, and will consider its use in other types of tumor.
El carcinoma basocelular (CBC) es el tumor cutáneo más frecuente con una incidencia anual estimada del 0,1 al 0,5%1. Constituye el 80% de los cánceres cutáneos no melanoma.
Existen múltiples alternativas terapéuticas según el tipo, localización del tumor y las características del paciente, que incluyen la electrocoagulación, legrado, crioterapia, imiquimod tópico, terapia fotodinámica, cirugía y radioterapia. En algunos casos, sin embargo, el CBC se muestra especialmente agresivo y puede dar lugar a metástasis2. Hasta ahora las recomendaciones terapéuticas para los tumores irresecables, metastásicos o no accesibles a radioterapia consistían en la administración de quimioterapia basada en el uso de platino, 5-fluoracilo, vincristina, etopóxido, bleomicina, metotrexato, ciclofosfamida y doxorrubicina, solos o en combinación o, si esto no fuera posible por la existencia de comorbilidades asociadas o efectos adversos, la aplicación de tratamiento paliativo y de soporte. Aunque Pfeiffer et al. publicaron que el cisplatino era el agente quimioterápico más efectivo, otros autores han encontrado opciones terapéuticas igual o más efectivas como es la combinación de vincristina, bleomicina y prednisolona3.
En un futuro próximo estos casos localmente avanzados, no tributarios a tratamiento quirúrgico ni a radioterapia, podrán ser controlados con vismodegib, un inhibidor de la vía de señalización Hedgehog (Hh).
Vía de señalización HedgehogLos primeros artículos relacionados con la vía Hh aparecen con la identificación del receptor Patched (PTCH) durante el estudio embriogénico de la mosca de la fruta Drosophila melanogaster4. La vía Hh aparece como crucial para el normal desarrollo embrionario de la Drosophila, determinando la polaridad segmentaria y su estructura morfológica normal.
Binns et al. publicaron varios años antes una epidemia de ciclopia en ovejas, que consistía en el desarrollo de defectos congénitos caracterizados por la ausencia de estructuras faciales de la línea media y prosencéfalo no divisible (holoprosencefalia)5. La etiología de esta malformación residía en la ingestión de la planta liliácea llamada Veratrum californicum durante la gestación, que contiene un esteroide alcaloide llamado ciclopamina6,7. Años después se demostró el papel directo de la ciclopamina como inhibidor de la vía de Hh al bloquear directamente uno de los componentes de esta vía llamado Smoothened (SMO)8. Sin embargo, aunque fue un agente muy importante para el estudio en modelos preclínicos de la vía de señalización Hh, su escasa biodisponibilidad por vía oral y su sensibilidad ácida ha obligado al desarrollo de otros derivados sintéticos y semisintéticos con potencial de administración por vía oral9.
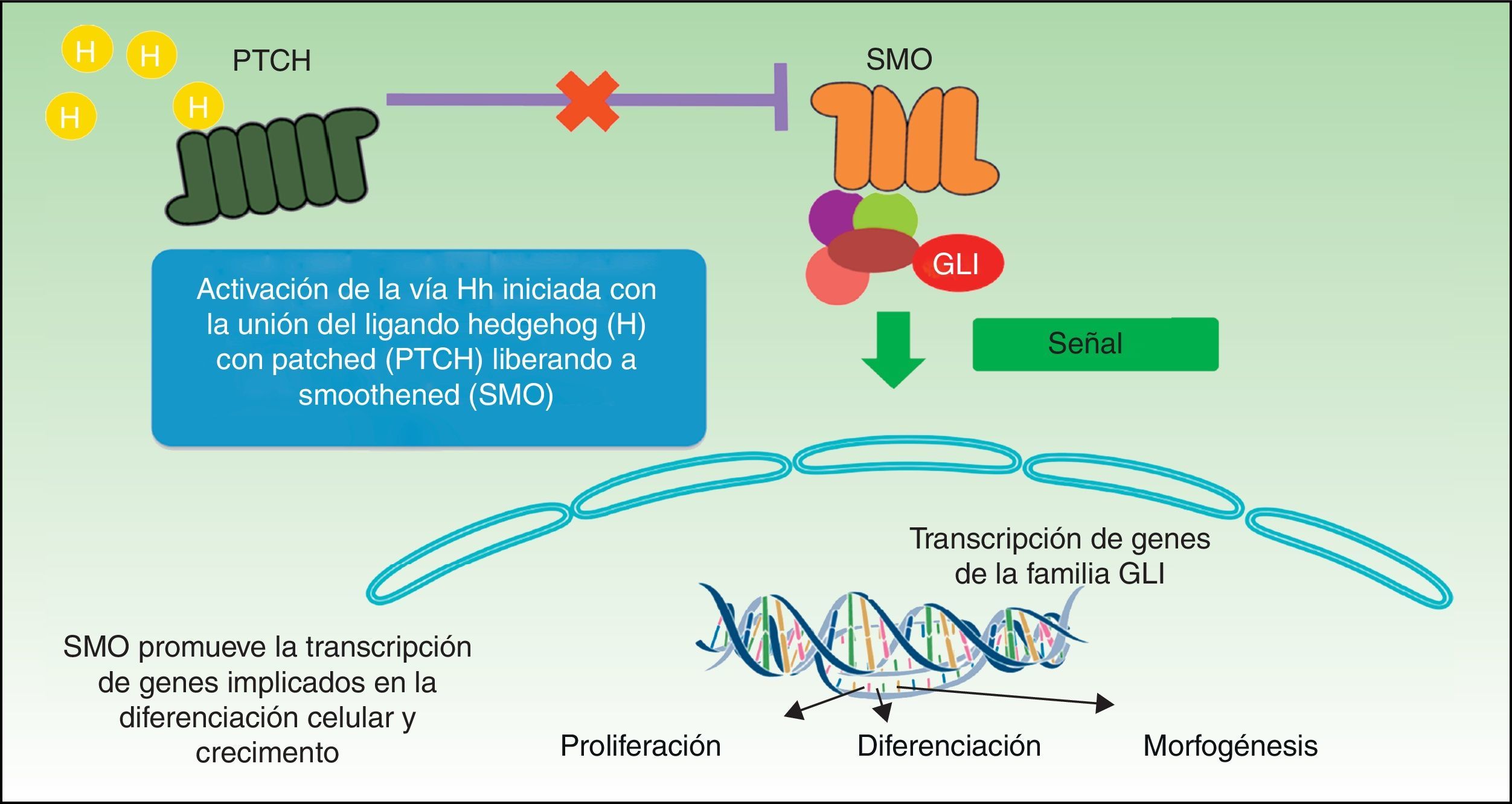
La vía de señalización Hh desempeña un papel crucial en la organogénesis durante la embriogénesis en múltiples especies, pero durante la edad adulta solo está activa en el folículo piloso y las células madre, donde ejerce un papel mayor en el mantenimiento de la homeostasis tisular y la reparación celular10. El mecanismo del procesamiento, secreción y señalización de las proteínas de la vía Hh se ha conservado más o menos en la escala filogenética, aunque con algunas diferencias. La Drosophila tiene un único gen Hh, mientras que los vertebrados tienen 3 ligandos Hh homólogos: Sonic (Sh), Desert (Dh) e Indian (Ih), de los cuales el mejor conocido es el primero. Dh está implicado en el desarrollo de las células germinales masculinas e Ih es un importante regulador en el crecimiento óseo y el desarrollo de cartílago11. Sh desarrolla otras múltiples actividades como establecer la simetría izquierda-derecha, desarrollo del SNC, desarrollo del ojo y los músculos. El sistema de recepción de estas proteínas está constituido por un receptor proteico transmembrana Patched 1(PTCH1) y una proteína transmembrana SMO; esta última pertenece a la familia de receptor ligado a la proteína G y actúa como un transductor de señal obligatorio en la vía Hh (fig. 1). En ausencia de ligando, el receptor PTCH1 reprime la actividad de SMO; si se une el ligando la represión de SMO desaparece y subsecuentemente esto resulta en la modulación y activación de los factores de transcripción GLI que se traslocan al núcleo y se induce la transcripción de genes como GLI112, marcador principal de la vía de señalización Hh. La activación de SMO requiere de 2 etapas para su activación en presencia de Hh: la fosforilación de su porción C-terminal por parte de la proteína cinasa dependiente de AMPc (PKA), caseína cinasa 1 (CK1), caseína cinasa 2 (CK2) y el receptor de cinasa 2 asociado a proteína G (GRK2), y su traslocación posterior a la membrana celular mediante vesículas citoplasmáticas. En ausencia de Hh existen múltiples fosfatasas que mantienen niveles bajos de fosforilación de SMO.
Dentro de la vía Hh existen 2 modos de señalización, la vía canónica y la vía no canónica. En la vía canónica Hh regula la activación de miembros de familia de factores de transcripción GLI. La vía no canónica es aquella que se activa de forma independiente a las proteínas GLI, y a su vez se subdivide en 2 vías de señalización, las que no requieren SMO (tipo 1) y las que más allá de SMO no precisan GLI (tipo 2). En la vía canónica de señalización de Hh, en ausencia de ligando, PTCH impide la activación y translocación a membrana de SMO, mientras que la unión de Hh al receptor PTCH resulta en la internalización del complejo ligando-receptor y la activación por fosforilación y translocación de SMO. En vertebrados la señalización tiene lugar en los cilios primarios regulando el procesamiento y activación de la proteína GLI. Los cilios primarios son cilios no móviles que presentan la mayoría de las células de los vertebrados, constituidos por una protrusión de la membrana en la zona apical de células polarizadas. PTCH1 se encuentra en cantidades abundantes en los cilios primarios en ausencia de Hh y se elimina de estos en presencia de Hh13. El papel fundamental de la vía canónica de Hh es la inducción de la proliferación celular a través de la inducción de genes que codifican la ciclina D1 y N-Myc14. En la vía no canónica de tipo 1 PTCH1 actúa regulando la supervivencia celular, de modo que la sobreexpresión de PTCH1 induce apoptosis, tal como se ha visto en múltiples ensayos in vitro y ex vivo15. En vertebrados los 3 ligandos de Hh tienen efecto antiapoptótico en células en cultivo, efecto que no es bloqueado por los antagonistas de SMO. En esta vía de señalización se produce la regulación del ciclo celular a través de la modulación de la localización subcelular de la ciclina B1. La unión de Sh a PTCH impide la interacción de PTCH con ciclina B1, dando lugar a un incremento de la proliferación celular y supervivencia celular13. En la vía de señalización canónica tipo 2, dependiente de SMO, SMO regula la actina del citoesqueleto a través de GTPasas, induciendo procesos de migración, tubulogénesis, formación de espinas dendríticas y axones en las neuronas13.
Como hemos comentado anteriormente, la vía Hh queda inactivada durante la vida adulta y solo permanece funcional en células madre, piel y folículo piloso. Estudios in vitro e in vivo han demostrado cómo la reactivación aberrante de la vía Hh activaría genes que promueven la proliferación celular, dando lugar a varios tipos de tumores como meduloblastoma, rabdomiosarcoma, melanoma, cáncer de páncreas, mama, pulmón, hígado, estómago y CBC16,17. La inhibición por tanto de los factores de transcripción GLI se ha propuesto como un arma terapéutica emergente y prometedora para varios tipos de tumores.
Los mecanismos a través de los cuales se puede producir un incremento en la activación de la vía Hh son básicamente 2. Por un lado, se produce un aumento en la expresión de proteínas ligando Hh, que de forma directa da lugar al un aumento en la señalización. Por otro lado, las alteraciones genéticas en PTCH1 y SMO que den lugar a receptores constitutivamente activados implicarán también un aumento en la transducción de señal a través de esta vía.
Alteraciones moleculares en el carcinoma basocelularLa vía de señalización Hh está constitucionalmente activada en el CBC18,19. Se han hallado mutaciones en las proteínas reguladoras de la vía Hh de modo independiente a la presencia de ligando Hh, mientras que en otros tumores humanos como el cáncer de ovario o el cáncer colorrectal la carcinogénesis es activada por un aumento de la expresión del ligando Hh en las células tumorales, que a su vez actúan sobre células del estroma a través de mecanismos de señalización paracrinos. La identificación de mutaciones en el gen PTCH1 en el CBC se obtuvo a partir del estudio de pacientes con síndrome del nevus basocelular (SNB) o síndrome de Gorlin, enfermedad hereditaria en la que los pacientes presentan múltiples CBC y alteraciones del desarrollo. Las mutaciones en PTCH1 se han identificado en la mayoría de exones del gen en pacientes con síndrome del SNB y CBC esporádicos. En el estudio realizado por Aszterbaum et al.20 se exponen los resultados del análisis de 23 exones en 86 muestras de ADN de pacientes con síndrome del SNB, 26 CBC esporádicos y 7 CBC asociados a SNB. En este estudio, de los 26 CBC esporádicos analizados, 11 casos presentaron pérdida de heterozigosidad en uno o más de los marcadores de polimorfimos que fueron examinados. Esta observación sugiere la actuación de PTCH1 como un gen supresor de tumores clásico, que requiere mutación en los 2 alelos para activar la tumorogénesis.
En el caso de los CBC adquiridos estas mutaciones en ambos alelos se producen por insultos posnatales, como la radiación UV, RX, carcinogénesis química o alteraciones genéticas al azar. En cambio, en los pacientes con SNB existe una susceptibilidad mayor para la tumorogénesis, ya que una de las mutaciones se hereda en la línea germinal y solo requieren una mutación adquirida en el otro alelo para que se produzca la pérdida de heterozigosidad. En cuanto a las mutaciones en PTCH se detectaron mutaciones en 3 tumores, cada uno en un exón diferente del gen. En un caso la mutación resulta en una sustitución de aminoácidos, en otro la aparición de un codón de parada y en el tercero una pérdida de pauta de lectura. Estas mutaciones no son las característicamente asociadas a la exposición solar e inducidas por UV.
En el caso de los pacientes con SNB se identificaron mutaciones en 8 exones en 13 de los 86 pacientes. Las mutaciones halladas con más frecuencia eran mutaciones con pérdida de pauta de lectura, dando lugar a productos génicos con terminación prematura.
Mutaciones en SmoothenedSegún el modelo propuesto de inhibición de SMO por PTCH en presencia de Sh, SMO solo puede estar en forma activa en ausencia de Sh. En cambio, la presencia de mutaciones somáticas sin sentido, activadoras, en el gen SMO ha sido identificada en pacientes con CBC esporádico dando lugar a la actuación de SMO como oncogén. Con el fin de comprobar el potencial oncogénico de SMO, Xie et al. constataron que la sobreexpresión de SMO mutada en la epidermis de ratones transgénicos da lugar a la formación de alteraciones epidérmicas similares a la del CBC, con un fenotipo similar al que se obtiene en ratones transgénicos que sobreexpresan Sh salvaje19,21.
Mutaciones en el gen p53Además de las mutaciones en PTCH, las mutaciones en p53 son frecuentes en el CBC. En un estudio realizado por Ling et al.22 se estudiaron muestras microdisecadas de tumores y piel sana adyacente con el fin de realizar un análisis por PCR y secuenciación en el que se halló una pérdida alélica del locus patched en 6/8 CBC esporádicos y 17/19 tumores hereditarios, mientras que las mutaciones en p53 se encontraron en todos los casos esporádicos y solo en 7/20 hereditarios. Las mutaciones detectadas en p53 en los casos de CBC hereditario incluyó deleciones de nucleótidos aislados y atípicas sustituciones de doble base comparadas con el patrón de mutaciones sin sentido inducidas por la luz ultravioleta en los casos esporádicos. La elevada frecuencia de ambas mutaciones y su coexistencia sugiere que las alteraciones genéticas en los genes patched y p53 son importantes en el desarrollo del CBC.
Patrón de expresión molecular en el carcinoma basocelularEn el análisis del perfil de expresión genética de CBC realizado por Bonifas et al.23, en comparación con la piel normal, los CBC expresan niveles elevados de ARNm de PTCH1, GLI1, HIP, WNT2B y WNT5a, niveles bajos de ARNm de c-Myc, c-fos y WNT4. Estas alteraciones sugieren que las mutaciones en la vía Hh desempeñan un papel fundamental en la carcinogénesis del CBC. A nivel cuantitativo los ARNm de PTCH1, GLI1 y HIP parecen ser los más elevados en este tipo de tumor. El gen HIP codifica para una proteína con capacidad para unirse a Sh con avidez similar a PTCH1, de modo que niveles elevados de su ARNm en los CBC indican que la función de esta proteína puede ser clave en la vía de señalización Hh en humanos.
Ensayos clínicos con vismodegibVismodegib (GDC-0449) es el primer fármaco aprobado por la Food and Drug Administration (FDA) desde enero del 2012 para el tratamiento del CBC localmente avanzado no tributario de cirugía o radioterapia y para CBC metastásico (Erivedge, Genentech, enero de 2012). Es una molécula que pertenece a la familia de la 2-arilpiridina e inhibe la vía Hh al bloquear la activación de SMO3.
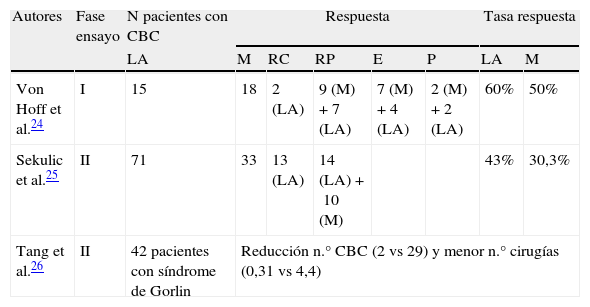
Hasta el momento se ha publicado un ensayo clínico fase i y 2 ensayos fase ii sobre el uso de vismodegib en pacientes con CBC avanzado y/o metastásico (tabla 1).
Resumen de los ensayos clínicos desarrollados con vismodegib
| Autores | Fase ensayo | N pacientes con CBC | Respuesta | Tasa respuesta | |||||
| LA | M | RC | RP | E | P | LA | M | ||
| Von Hoff et al.24 | I | 15 | 18 | 2 (LA) | 9 (M)+7 (LA) | 7 (M)+4 (LA) | 2 (M)+2 (LA) | 60% | 50% |
| Sekulic et al.25 | II | 71 | 33 | 13 (LA) | 14 (LA)+10 (M) | 43% | 30,3% | ||
| Tang et al.26 | II | 42 pacientes con síndrome de Gorlin | Reducción n.° CBC (2 vs 29) y menor n.° cirugías (0,31 vs 4,4) | ||||||
CBC: carcinoma basocelular; E: enfermedad estable; LA: localmente avanzado; M: metastásico; P: progresión tumoral; RC: respuesta completa; RP: respuesta parcial.
Von Hoff et al.24 llevaron a cabo un ensayo clínico fase I en 2 estadios que evaluaba la seguridad y tolerabilidad de vismodegib en 68 pacientes, 33 de los cuales tenían CBC avanzado (n=15) y metastásico (n=18). En el primer estadio, que pretendía estudiar la dosis máxima tolerada, se evaluaron 20 pacientes con 3 dosis diferentes, recibiendo el fármaco en el día 1, seguido de un período de lavado de 6 días y continuando con la administración diaria de la misma dosis a partir del día 8; 7 pacientes recibieron 150mg/día, 9 pacientes 270mg/día y 4 pacientes 540mg/día, sin observarse efectos tóxicos limitantes de dosis. Tres de los 20 pacientes tenían CBC y cada uno recibió las 3 dosis diferentes de vismodegib (150, 270 y 540mg). En el estadio 2 se pretendía obtener información adicional acerca de farmacocinética, farmacodinámica y seguridad y se añadieron 48 pacientes, 30 de los cuales tenían CBC: 16 pacientes recibieron 150mg/d y 14 pacientes 270mg/d. El seguimiento se realizó cada 4 semanas mediante exploración física, electrocardiograma, bioquímica y hematología. Para aquellos pacientes con enfermedad radiológicamente mensurable (sobre todo en CBC metastásico), la evaluación tumoral se llevó a cabo mediante los criterios de evaluación de respuesta para tumores sólidos (RECIST) (versión 1.0). Para los tumores no radiológicamente mensurables el seguimiento se realizó mediante exploración física, de manera que se consideró una respuesta completa como la desaparición del tumor palpable o visible, y una respuesta parcial como la reducción de más del 50% del diámetro tumoral palpable o visible. De los 18 pacientes con CBC metastásico 9 obtuvieron respuesta parcial, 7 pacientes permanecieron con enfermedad estable y 2 pacientes presentaron progresión tumoral. La tasa global de respuesta entre los pacientes con CBC metastásico fue del 50%. De los 15 pacientes con CBC localmente avanzado 2 tuvieron respuesta completa, 7 respuesta parcial, 4 enfermedad estable y 2 pacientes presentaron progresión tumoral. La tasa global de respuesta en este grupo de pacientes fue del 60%. Los efectos adversos más frecuentemente observados fueron calambres musculares, disgeusia, anorexia y pérdida de peso, todos ellos de grado 2-3. La dosis establecida como adecuada fue de 150mg/d, ya que no se observaron incrementos plasmáticos de dosis de forma paralela y proporcional al aumento de dosis administrada por vía oral. Vismodegib se metaboliza mínimamente y >98% del fármaco se elimina por vía biliar sin modificar (el 82% se recoge en heces y el 4,4% en orina). Resultados de estudios in vitro sugieren que este fármaco actúa como inhibidor de los citocromos CYP2C8, CYP2C9, CYP2C19 y el BRCP (proteína de resistencia del cáncer de mama). Los efectos adversos pueden incementarse si se administra de forma concomitante con fármacos que inhiben la glucoproteína-p, como claritromicina, eritromicina o azitromicina. La vida media estimada de vismodegib es de 12 días tras una única dosis y de 4 días tras la administración diaria continua.
Ensayos clínicos fase iiSekulic et al.25 llevaron a cabo el ensayo clínico fase ii que condujo a la aprobación para su comercialización por parte de la FDA. Recogieron 104 pacientes con CBC metastásico (n=33) y CBC localmente avanzado (n=71), de los cuales 8 fueron excluidos del ensayo debido a que el patólogo no identificó la presencia de CBC en la biopsia inicial. Todos los pacientes recibieron vismodegib a dosis de 150mg/d hasta que se observara progresión tumoral o aparición de toxicidad farmacológica severa. El principal indicador de eficacia fue la tasa de respuesta, de manera que para los pacientes con CBC metastásico se utilizaron las guías RECIST (versión 1.07) y para los pacientes con CBC localmente avanzado la respuesta se definió como un descenso de ≥30% en el tamaño tumoral o la completa desaparición del mismo. Se definió enfermedad progresiva como un incremento ≥20% del tamaño tumoral visible o mensurable radiológicamente, aparición de nueva ulceración o nuevas lesiones. Para los pacientes con múltiples lesiones se utilizó la suma de los diámetros mayores para determinar la respuesta y progresión. En el grupo de CBC metastásico (n=33) se obtuvieron 10 respuestas parciales (30,3%) y ninguna respuesta completa. La duración media de una respuesta objetiva en este grupo de pacientes fue de 7,6 meses. En el grupo de CBC localmente avanzado (n=63) se obtuvieron 13 respuestas completas (20,6%) y 14 respuestas parciales (22,2%), con una tasa de respuesta global en este grupo de pacientes del 43%. La duración media de la respuesta fue de 7,6 meses. Además, en 34 de los 63 pacientes (54%) no se observó CBC residual en biopsias posteriores. Los efectos adversos más frecuentemente observados fueron calambres musculares, pérdida de peso, fatiga y disminución del apetito, todos ellos de grado 2 y 3. Los efectos adversos más graves se observaron en 7 pacientes (uno con CBC metastásico y 6 con CBC localmente avanzado): 3 muertes de causa desconocida, infarto de miocardio, enfermedad meníngea y accidente cerebrovascular. La relación entre las muertes y el fármaco se desconoce por el momento. A nivel molecular registraron y confirmaron el aumento de expresión de los genes que codifican el factor GLI1 y el receptor 2 homólogo de patched (PTCH2) en biopsias cutáneas tumorales previas al tratamiento con vismodegib, comparado con biopsias cutáneas de piel sana de otros sujetos.
El otro ensayo clínico fase ii fue desarrollado por Tang et al.26; se trataba de un ensayo aleatorizado, doble ciego y controlado con placebo que pretendía investigar la eficacia de vismodegib en pacientes con síndrome de Gorlin. Recogieron 42 pacientes afectos de este síndrome y fueron aleatorizados, con una ratio 2:1, a recibir vismodegib oral a dosis de 150mg/d (n=26) o placebo (n=15) por un período de 18 meses. El principal indicador de eficacia fue la tasa comparativa de aparición de nuevos CBC que serían tributarios de cirugía (aquellos con un diámetro ≥3mm en la nariz o en el área periorbitaria, ≥5mm en cualquier parte de la cara o ≥9mm en el tronco y los muslos). El indicador secundario de eficacia fue la reducción en la tasa de aparición de pequeños CBC (≤5mm) en el tercio superior de la espalda, reducción del tamaño de CBC tributarios de cirugía, duración del efecto contra el CBC tras la discontinuación del fármaco y cambios en la expresión del gen Hh en los CBC. El seguimiento clínico se realizó mensualmente durante los primeros 9 meses y trimestralmente durante los 9 meses restantes. Únicamente 38 pacientes completaron el régimen de visitas los 3 primeros meses. Además se realizaron estudios moleculares para evaluar el grado de inhibición de la vía Hh mediante el análisis de los niveles de ARNm que codifica el GLI1 en biopsias cutáneas, realizadas en el momento inicial y al mes de haber iniciado vismodegib. Los resultados obtenidos fueron una reducción en la aparición de nuevos CBC tributarios de cirugía en el grupo de vismodegib comparado con placebo (2 vs 29 nuevos CBC por año, p<0,001). Vismodegib también redujo el tamaño de los tumores existentes, expresado como el porcentaje de cambio en la suma de los diámetros mayores (–65 vs –11%, p=0,003). Los pacientes del grupo de vismodegib se sometieron a menor cantidad de cirugías comparado con el grupo placebo (media de cirugías por pacientes 0,31 vs 4,4 con placebo, p<0,001). Prácticamente todos los tumores respondieron a vismodegib, obteniendo una remisión clínica casi completa en algunos pacientes. Respecto al estudio de las biopsias cutáneas y estudios moleculares, entre los pacientes que recibieron vismodegib durante más de 3 meses el 46% de las biopsias reveló la presencia de tumor residual, y entre aquellas lesiones que clínicamente parecían resueltas la presencia de tumor residual se objetivó únicamente en el 17% de las mismas. A nivel molecular el efecto de vismodegib también se asoció con un descenso de señalización Hh, con una disminución de hasta el 90% de la expresión del ARNm GLI1 en biopsias realizadas al mes de tratamiento, una reducción en la proliferación tumoral, evaluada mediante la expresión de Ki67, pero sin observar cambios en la apoptosis celular, evaluada mediante la medición de caspasa 3. Los efectos adversos más frecuentemente relaccionados con el tratamiento con vismodegib fueron disgeusia, calambres musculares, alopecia y pérdida de peso, todos ellos grado 1-3. No se observaron efectos adversos graves. Tras 8 meses de tratamiento 7 de los 26 pacientes (27%) que recibieron el fármaco discontinuaron la terapia debido a los efectos adversos, con resolución de los mismos entre uno y 3 meses después.
Vismodegib en situaciones especialesVismodegib y gestaciónVismodegib es considerado como categoría D por la FDA. En estudios con ratas se observó teratogenicidad con la administración del 20% de la dosis diaria recomendada para humanos que incluía la aparición de anomalías craneofaciales, perineo abierto y fusiones digitales27.
Vismodegib en población pediátricaNo se ha evaluado la eficacia y seguridad de vismodegib en población pediátrica humana. En estudios animales se observaron diversas anomalías con dosis entre un 20-40% de la dosis diaria recomendada en adultos, con aparición de cierre epifisario temprano y anomalías en el desarrollo de la dentición27.
Vismodegib en población geriátricaHasta la fecha no disponemos de un número suficiente de pacientes ≥65 años incluidos en los ensayos clínicos para determinar las diferencias respecto a farmacocinética, seguridad o eficacia en la población geriátrica. Debido a que la mayoría de los CBC metastásicos y/o localmente avanzados ocurren en pacientes mayores, deberían realizarse más estudios en fase poscomercialización para evaluar estos datos28.
Mecanismos de resistencia a vismodegibEl tema de la resistencia adquirida a fármacos es especialmente prevalente en el contexto de los inhibidores de las cinasas. La reciente introducción en la clínica de vismodegib como inhibidor de la vía de señalización Hh ha proporcionado la aparición del primer registro de resistencia al grupo de terapias dirigidas contra el receptor SMO y, por extensión, ha favorecido la consideración del fenómeno de resistencia adquirida a fármacos dirigidos contra moléculas relacionadas con el receptor acoplado a proteína G29. Concretamente, Rudin et al. publicaron el primer caso de meduloblastoma tratado con vismodegib con buena respuesta inicial, pero con pérdida de eficacia a los 3 meses. Se trataba de un paciente varón de 26 años con un meduloblastoma metastásico en el que se inició tratamiento con vismodegib a dosis de 150mg/d con una rápida y notable regresión tumoral inicial; el análisis molecular del tumor primario y de las metástasis previo al tratamiento revelaron la existencia de una mutación en PTCH1(PTCH1-W844C), así como una sobrerregulación de diferentes genes implicados en la vía Hh, confirmando la premisa de que la enfermedad estaba inducida por una hiperactivación de esta vía de señalización30. Posteriormente Yauch et al. intentaron dilucidar la naturaleza del mecanismo de resistencia al fármaco en este paciente, de manera que recogieron una biopsia de una lesión tumoral e identificaron, mediante secuenciación genética, una mutación sin sentido heterocigota G-C en la posición 1497 de SMO, que predice el cambio de aminoácido en el codón 473 de ácido aspártico (Asp) por histidina (His) (D473H). Esta mutación no se detectó en biopsias pretratamiento, aunque es posible que estuviera presente en una frecuencia inferior a niveles detectables31. Por su parte, Dijkgraaf et al., basándose en estudios in vitro, publicaron una nueva mutación en SMO mediante la inducción de mutaciones en regiones de SMO importantes para la interacción con vismodegib. La mayoría de las 21 nuevas mutaciones que mostraban deficiencia para la unión a vismodegib eran inactivas con respecto a la señalización, o no se expresaban en la superficie celular. Sin embargo, la mutación SMO-E518A sí que mostró una actividad importante y demostró una resistencia parcial frente a la presencia de 1μmol/l de vismodegib32. Una manera de aproximarnos a la resistencia generada por mutaciones específicas es el desarrollo de inhibidores de segunda generación que conserven actividad en presencia de mutaciones. Esta estrategia se ha utilizado con éxito en el caso de resistencia a fármacos dirigidos contra el receptor de factor de crecimiento epidérmico (EGFR), por ejemplo nilotinib, un inhibidor de segunda generación que mostró actividad clínica en pacientes con leucemia mieloide crónica resistentes a imatinib33. Una alternativa válida podría ser el uso de antagonistas de la vía de señalización Hh con un mecanismo de acción diferente a vismodegib. Por ejemplo, se ha descubierto recientemente que itraconazol inhibe la vía Hh mediante un mecanismo diferente de la ciclopamina y que actualmente se encuentra pendiente de determinar34. Por otro lado, el uso de antagonistas de la vía Hh más allá de SMO, como GANT61, que bloquea la función GLI, podría considerarse como una estrategia en el contexto de resistencia frente a vismodegib35.
Uso de vismodegib en otros tumoresAlteración en la vía de señalización Hedgehog en otros tumoresUna vía de señalización Hh aberrante puede desencadenar la iniciación, proliferación y propagación de diferentes tipos de cáncer mediante la activación de una vía ligando-dependiente o ligando-independiente. En la vía ligando-independiente las alteraciones genéticas en los diferentes componentes de la vía Hh, como las mutaciones pérdida de función en PTCH, SUFU o aumento de función en SMO y mutaciones sin sentido en GLI1 y GLI3, favorecen las propiedades de supervivencia y crecimiento de la célula tumoral, como se observa en el caso del CBC y meduloblastoma. La vía ligando-dependiente puede ser autocrina si el ligando Hh producido por la célula tumoral actúa sobre las células vecinas para estimular su propagación y supervivencia, o paracrina donde el ligando Hh secretado por el epitelio estimula el estroma subyacente para continuar la proliferación y transformación maligna. La señalización autocrina se ha observado en casos de cáncer de pulmón, cancér pancreático y de próstata, mientras que la vía paracrina se ha aislado en casos de cáncer de ovario y colorrectal36. Además, la transición tumorogénica se ve influenciada por el estadio del proceso neoplásico en el cual interviene la variante de señalización Hh. Por ejemplo, en los casos de CBC y meduloblastoma la alteración en la vía Hh es importante para la iniciación de la formación tumoral y el mantenimiento de la misma; en casos de cáncer de colon y pancreático la alteración Hh es importante para el mantenimiento tumoral, pero no para la formación tumoral; en otros casos como cáncer de mama, de ovario, de próstata o pulmonar se sabe que esta vía está implicada, pero su papel todavía no se ha definido37.Concretamente en los casos de cáncer de páncreas, de ovario, de colon y en la leucemia se están llevando a cabo diversos ensayos clínicos para valorar la eficacia de vismodegib solo o en combinación con otros regímenes quimioterápicos.
ConclusiónEn la última década ha habido importantes avances en la comprensión de las funciones y mecanismos de acción de las proteínas Hh en el desarrollo del cáncer. Aunque no todos los mecanismos de la vía de señalización Hh se han estudiado completamente, es evidente que una vía Hh aberrante favorece el crecimiento del tumor y su proliferación, aumentando también su agresividad y la frecuencia de metástasis. La inhibición de la vía de Hh es, por lo tanto, un nuevo enfoque prometedor y selectivo para el tratamiento de determinadas neoplasias malignas avanzadas, como el CBC y el meduloblastoma, entre otras. Los ensayos clínicos iniciales llevados a cabo con el antagonista SMO vía oral GDC-0449 muestran una buena eficacia y la seguridad en el CBC y el meduloblastoma. Estos estudios preliminares han sentado las bases para el uso de estos inhibidores en otros tipos de cáncer, de los cuales disponemos de algún ensayo clínico publicado en la literatura con resultados prometedores; sin embargo se necesita más experiencia para poder valorar realmente su eficacia a largo plazo, el tiempo de administración y la posible aparición de nuevos efectos adversos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.