La ecografía cutánea de alta frecuencia (ECAF) es una técnica diagnóstica relativamente reciente, y aún en vías de investigación, que ha demostrado ser un procedimiento no invasivo útil aplicable a diferentes ámbitos de la dermatología1,2. Esta se basa en el principio físico de la emisión de pulsos ultrasónicos de alta frecuencia (>10Mhz) emitidos desde un transductor sobre la piel y registrados posteriormente a su regreso (fenómeno de eco) en la unidad de procesamiento. Estos datos se pueden representar en la pantalla de diferentes modos (A, B, C, etc.). En concreto, en modo B (uno de los más usados en ecografía cutánea), la unidad de procesamiento transforma las señales eléctricas en puntos de mayor o menor intensidad lumínica en la pantalla. Las imágenes en este modo representan un corte transversal o longitudinal según la orientación de la sonda respecto a la estructura estudiada1. Un punto a destacar es que a mayores frecuencias usadas, menor será la penetración de los ultrasonidos en el tejido, pero mayor la resolución (es decir, la capacidad de discriminar entre los ecos de 2 estructuras adyacentes)1,2. Así, a frecuencias de 20Mhz la profundidad máxima alcanzada en la piel se encuentra entre los 8 y 10mm, a 50Mhz se alcanzan aproximadamente unos 4mm de profundidad, y a 100 Mhz en torno a 1,5mm3. Muchos de los modernos ecógrafos disponen también de sondas doppler combinadas que van a permitir detectar y medir la velocidad y distribución del flujo sanguíneo en las diferentes estructuras de la piel1. Aunque 20Mhz es la frecuencia mínima recomendada por la mayoría de autores para el estudio de estructuras cutáneas, muchos de los estudios publicados sobre la materia usan sondas de 15Mhz e incluso menores con buenos resultados de correlación2–4.
Desde las primeras publicaciones sobre ecografía cutánea a finales de los años 705 el campo abarcado por esta técnica es cada vez mayor, como lo demuestra el incremento de estudios en los últimos años englobando un abanico cada vez más amplio de enfermedades. Así, la ECAF ha demostrado utilidad tanto en el campo de dermatosis inflamatorias (para valorar la extensión de infecciones, la actividad de enfermedades reumatológicas, la valoración de respuesta a tratamientos en psoriasis, etc.) como de afecciones ungueales (tumores subungueales, onicopatía psoriásica), incluso en el campo de la estética (valoración de rellenos subcutáneos, punciones guiadas, estudio del envejecimiento cutáneo, etc.) y como no, en el campo de la enfermedad tumoral1, tema en el que se centrará este artículo.
Numerosos han sido ya los estudios realizados sobre la utilidad de la ECAF en el cáncer cutáneo. Dejaremos a un lado los realizados sobre ecografía en melanoma, donde la mayoría han ido enfocados al estudio de la concordancia entre las mediciones de profundidad mediante ecografía y los valores de índice de Breslow obtenidos mediante la histología6, y nos centraremos en el estudio del cáncer cutáneo no melanoma (CCNM), y en concreto en el carcinoma basocelular (CBC), campo en el que la ECAF presenta prometedores hallazgos.
Antes de entrar de lleno en el campo de la ecografía y el CBC es importante recordar la situación actual y plantear algunas cuestiones previas. Como ya es de sobra conocido, el CBC es el subtipo más frecuente de CCNM, representando el 80-90% del total7,8. Su elevada incidencia lo convierte en un importante problema de salud pública, para algunos autores de características epidémicas, que origina una importante demanda asistencial y, en consecuencia, elevados costes sanitarios9. El manejo terapéutico de estos tumores se basa fundamentalmente en la aplicación de terapias invasivas (cirugía de Mohs, cirugía convencional) o terapias no invasivas (destacando la terapia fotodinámica [TFD], imiquimod y crioterapia)7,8. La indicación de una u otra técnica va a depender fundamentalmente del subtipo histológico (agresivo vs no agresivo) con el que nos encontremos tras realizar la biopsia incisional (fundamentalmente punch) y de otras características como la localización, comorbilidades, disponibilidad de medios, preferencias del paciente, etc.7,8. Las técnicas invasivas son actualmente de primera elección en la gran mayoría de casos, pues son las que han demostrado menores tasas de recurrencias al permitir asegurar los márgenes libres7,8,10. Sin embargo, el aumento de incidencia de este tipo de cáncer en poblaciones cada vez más jóvenes incrementa la demanda de tratamientos menos invasivos y con mejores resultados estéticos, lugar en el que las técnicas no invasivas desempeñan el papel más importante10.
La primera cuestión a plantear es con qué grado de certeza estamos clasificando bien los subtipos histológicos en nuestra práctica diaria, punto fundamental antes de planificar el tratamiento más adecuado. Así, se puede dar el caso de catalogar un tumor agresivo como no agresivo, con las conocidas consecuencias que se derivan de ello (mal manejo terapéutico, recurrencias, incremento del gasto sanitario, etc.). Mucho se ha publicado ya en la literatura al respecto, existiendo trabajos muy interesantes donde se estudian y comparan tasas de concordancia diagnóstica entre resultados obtenidos por biopsia incisional y los obtenidos mediante biopsia escisional10–14. En diversos artículos se refieren tasas de concordancia de entre el 50 y el 89% según las series11 y propugnan una incorrecta clasificación histológica en uno de cada 3 CBC11 y en uno de cada 6 para aquellos CBC con histología agresiva10. Otras series encuentran que hasta un 21% de subtipos agresivos (diagnosticados tras la biopsia escisional) habían sido catalogados como superficiales en el estudio de la biopsia inicial13. El motivo achacado a esta discordancia es que la biopsia permite únicamente el análisis de una mínima porción del tejido tumoral, por lo que la información que aporta puede resultar insuficiente y equívoca11. Las tasas empeoran lógicamente a mayor tamaño tumoral (puesto que la parte proporcional analizada por la biopsia es menor) y en tumores de componente mixto, donde existe riesgo de analizar exclusivamente el componente superficial pasando por alto la parte agresiva del mismo. Así, aunque su concordancia con la biopsia escisional se puede considerar relativamente buena en CBC de un solo tipo histológico, esta baja considerablemente en casos mixtos (del 83 al 37%, respectivamente)11. De hecho, se estima que en torno al 40% (del 18% hasta más del 50% según las series) de los CBC que nos encontramos en nuestras consultas diarias son en realidad tumores de componente mixto10.
La biopsia incisional posee por tanto carencias para diferenciar formas agresivas y no agresivas12. En la práctica clínica la infraestimación de variantes agresivas conlleva una errónea orientación terapéutica en la mayor parte de los casos, que a largo plazo se traduce, como ya se ha mencionado antes, en recurrencias tumorales, con el consecuente coste económico para el sistema sanitario y coste emocional para el paciente10. Hoy en día muchos autores consideran esta mala clasificación como una de las principales causas que explicarían las recurrencias en terapias no invasivas, como el imiquimod tópico o la TFD y, de hecho, se han publicado estudios donde el porcentaje de recurrencias halladas tras el tratamiento de CBC primarios con TFD coinciden con las tasas de mala clasificación histológica mediante la biopsia punch11. Es más, la utilización de estos tratamientos no invasivos (cuya indicación aprobada es exclusivamente para subtipos de CBC no agresivos) ha aumentado considerablemente en los últimos 10 años, por lo que el diagnóstico certero pretratamiento se vuelve aún más importante11.
Y es aquí donde la ECAF puede ejercer un papel fundamental ayudando al clínico para conseguir que la diferenciación de subtipos sea más certera, y aunque no ha sido aún establecida como método diagnóstico fuera del campo de la investigación, con respecto a los CBC la ecografía ha demostrado tener una potencialidad nada despreciable tanto para la medición tumoral (y su posterior aplicación al diseño de la resección quirúrgica más adecuada) como para su posible papel diagnóstico15.
La mayoría de los estudios publicados en este campo se basan en el estudio de localización tumoral, tamaño y establecimiento de márgenes quirúrgicos, comparando los resultados ecográficos obtenidos con los resultados histológicos tras la posterior biopsia escisional de la lesión16–23.
Las tasas de concordancia de la ECAF en cuanto al tamaño tumoral comparando con la histología están en general por encima del 73%, llegando hasta el 98% dependiendo de las series15–23. Existen publicaciones con peores resultados19,24, pero son en aquellas series que incluyen además carcinomas de células escamosas, que son a su vez más difíciles de valorar con ECAF (ya que presentan frecuentemente ulceración e hiperqueratosis que van a generar artefactos ecográficos que dificultan su estudio). Las tasas publicadas de márgenes libres de CBC intervenidos quirúrgicamente previa delimitación de márgenes por ECAF llegan hasta el 95% (si bien las mejores tasas obtenidas han sido estudiando CBC en condiciones favorables: subtipos no agresivos, en localizaciones fácilmente accesibles y de bajo riesgo)17.
Por otro lado, en general la ECAF tiende a sobreestimar la extensión tumoral respecto a la medición histológica, sobre todo en superficie (largo por ancho), y la explicación que se ha dado a este hecho ha sido el encogimiento ex-vivo de la pieza a analizar en los procesos de preparación histológica17,24,25. Si se compara la medición de la ECAF con la medición clínica pre-exéresis los resultados publicados son contradictorios, aunque hay trabajos recientes que apuntan a una superioridad de la ECAF respecto a la clínica16,17,24 y esto es razonable, ya que con la ecografía podrían detectarse prolongaciones tumorales más profundas no manifestadas clínicamente. Además, la ECAF podría permitir visualizar el cartílago subyacente en algunas localizaciones de riesgo como son el cartílago nasal y auricular, permitiendo obtener información de su afectación y, por ende, evitarse resecciones incompletas16. También se ha destacado su utilidad en la detección de lesiones subclínicas que de otro modo hubieran pasado desapercibidas16.
Una de las limitaciones más importantes de la técnica a la hora de delimitar el tamaño y sobre todo los márgenes tumorales la origina la sonda del ecógrafo, pues estas sondas son de considerable tamaño, lo que nos va a hacer difícil el acceso a determinadas localizaciones como son los surcos y pliegues nasales, pabellones auriculares o párpados, que son, a su vez, asiento frecuente de CBC de alto riesgo. Del mismo modo, en lesiones muy asimétricas o con prolongaciones muy irregulares existen grandes dificultades para determinar con exactitud su localización exacta en la piel del paciente, punto clave en la planificación de la cirugía, más aún si la cirugía a desarrollar es microcirugía de Mohs. Por tanto se podría postular, como opinan diversos autores, que aunque no va a sustituir a la histología, sí es una herramienta útil a tener en cuenta en la estimación del tamaño tumoral, el establecimiento del plan quirúrgico y la estratificación de pacientes de alto riesgo16.
Menos se ha publicado sobre la utilidad de la ECAF en el intento de describir patrones ecográficos diferenciadores de subtipos, campo en el que las dificultades han sido mayores. Wortsman et al.26, en un estudio retrospectivo de 4.338 lesiones dermatológicas analizadas por ECAF (que incluían 75 tumores malignos, en su mayoría CBC), concluyeron que esta permite el correcto diagnóstico dermatológico en un 97%, con una sensibilidad del 99% y una especificidad del 100%.
En la misma línea Bobadilla et al.16 realizaron un estudio prospectivo de 25 pacientes con 29 CBC usando una sonda de 15Mhz. Compararon los datos obtenidos por ecografía (tanto referidos al tamaño tumoral como al diagnóstico presuntivo) con los resultados histológicos obtenidos por biopsia escisional posterior. La ecografía fue capaz de detectar todos los casos con una correlación del 90% en el establecimiento del tamaño tumoral y todos se extirparon con márgenes libres tras la cirugía. Según sus resultados el 92% de los CBC eran nodulares, en los cuales encontraron un patrón ecográfico oval, hipoecoico, heterogéneo de tumor sólido, con bordes irregulares, localizado en el límite dermoepidérmico (que coincide con otros patrones descritos)27. Encontraron además un 4% de subtipos morfeiformes y un 4% quísticos, sin encontrar diferencias ecográficas respecto al patrón descrito anteriormente. Sin embargo, otros autores17 que también obtuvieron los mismos hallazgos ecográficos anteriormente descritos respecto a los CBC nodulares, sí encontraron además patrones ecográficos diferenciadores de otros subtipos histológicos. Así, en el caso del subtipo superficial el patrón encontrado fue similar al nodular, pero con forma más aplanada y no oval; en el caso del morfeiforme observaron un aumento de la ecogenicidad alrededor de la masa tumoral principal hipoecoica, que los autores achacan a un aumento de fibrosis que caracteriza a este tipo de tumores, y en el caso del subtipo infiltrativo describieron bandas hipoecoicas que parten de la masa hipoecoica principal y que penetran la dermis subyacente. Concluyen que la ECAF puede ser un método de despistaje sensible, que puede identificar patrones de crecimiento agresivo cuando la apariencia clínica no está clara, y puede ser útil en la planificación de cirugía en áreas de alto riesgo, optimizando el tratamiento y disminuyendo la morbilidad asociada, y a estas mismas conclusiones llegan otros autores28. No obstante, no hay que olvidar las formas agresivas (infiltrativas, morfeiformes) que simulan formas no agresivas (superficiales y nodulares) y que podrían condicionar confusión diagnóstica mediante ecografía. En estos casos el análisis histológico sigue desempeñando el papel más importante.
Se han realizado además estudios mediante análisis doppler de CBC, describiéndose un aumento de vascularización arterial dentro y en la periferia del tumor, con un predominio de vasos en profundidad16.
Otro hallazgo diagnóstico descrito por varios autores16,18,28 ha sido la presencia de puntos hiperecoicos intralesionales, estudiados en mayor profundidad por Uhara et al.29. Estos autores estudiaron retrospectivamente 85 casos (29 CBC y 56 melanomas) haciendo una correlación histológica de las lesiones buscando calcificaciones, quistes y acumulación de células apoptoicas, y sostienen que los puntos hiperecoicos múltiples y grandes mal definidos parecen ser característicos del CBC, y que corresponderían a numerosos y grandes focos de calcificación. Concluyen además que podrían ser útiles para diferenciar el CBC del melanoma, y que por tanto la ECAF podría ser una herramienta útil no invasiva en el diagnóstico del CBC.
Siguiendo todas estas líneas de investigación realizamos recientemente en nuestro servicio un estudio preliminar sobre la utilidad de la ECAF para la diferenciación de patrones agresivos de no agresivos de CBC, obteniendo resultados alentadores. Mediante un ecógrafo de 20MHz (DermascanC®) estudiamos varios casos de CBC clínicamente recurrentes tras recibir tratamiento con TFD (figs. 1 y 2) y los resultados obtenidos apuntan a una posible superioridad de la ECAF respecto a la biopsia incisional para detectar patrones infiltrativos en tumores de componente mixto donde la parte infiltrativa del tumor no fue recogida por la biopsia incisional mediante punch.
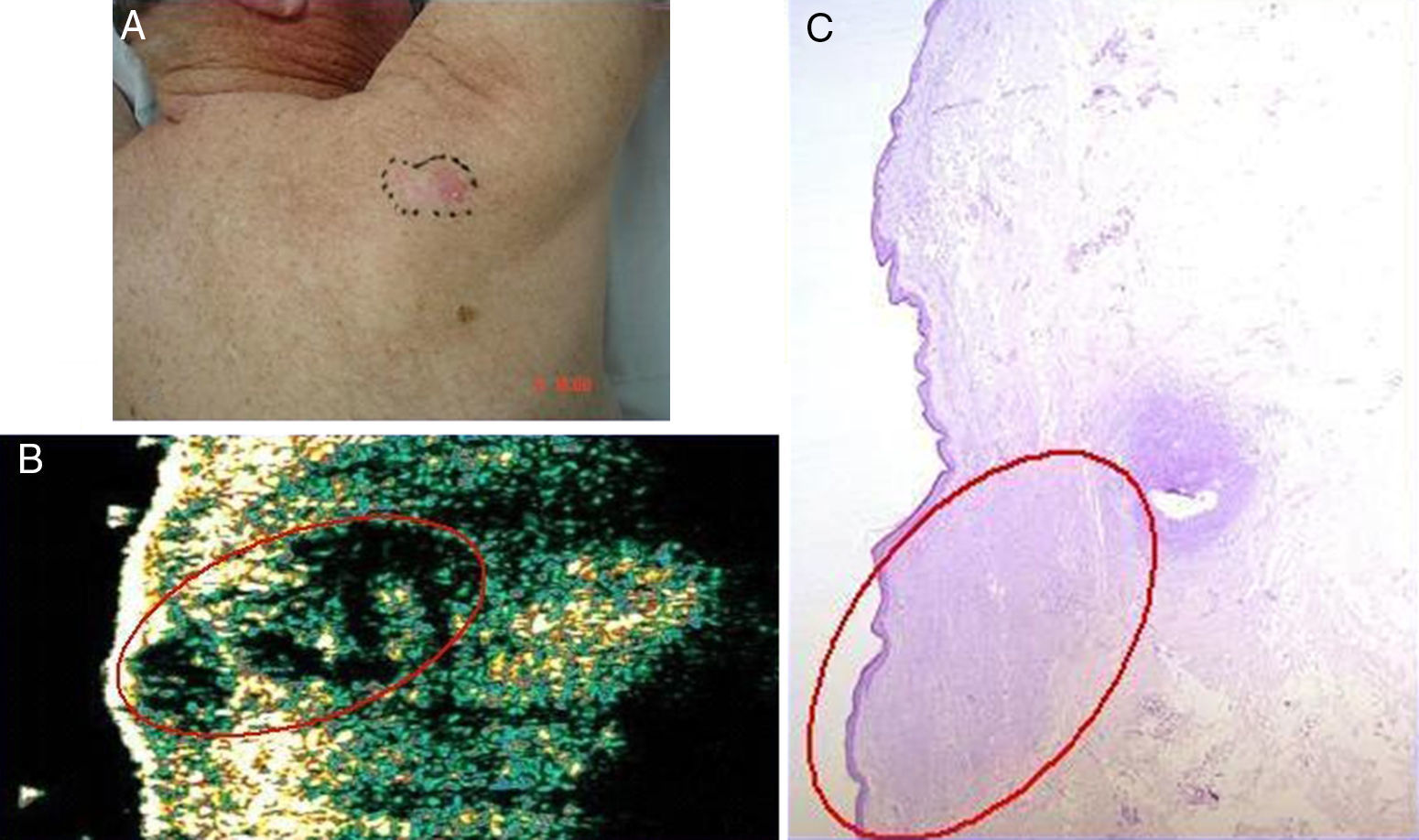
Varón de 71 años con carcinoma basocelular dorsal. A. Imagen clínica de la lesión. B. Imagen ecográfica (20Mhz) de la lesión donde se observa una estructura hipoecoica más o menos redondeada, mal definida subepidérmica de la que parte una prolongación hipoecoica alargada y mal definida que penetra en la dermis subyacente y que sugiere infiltración. C. Imagen histológica de la lesión con H-E ×50. Destacado en rojo se observa el marcado componente infiltrativo de la lesión.
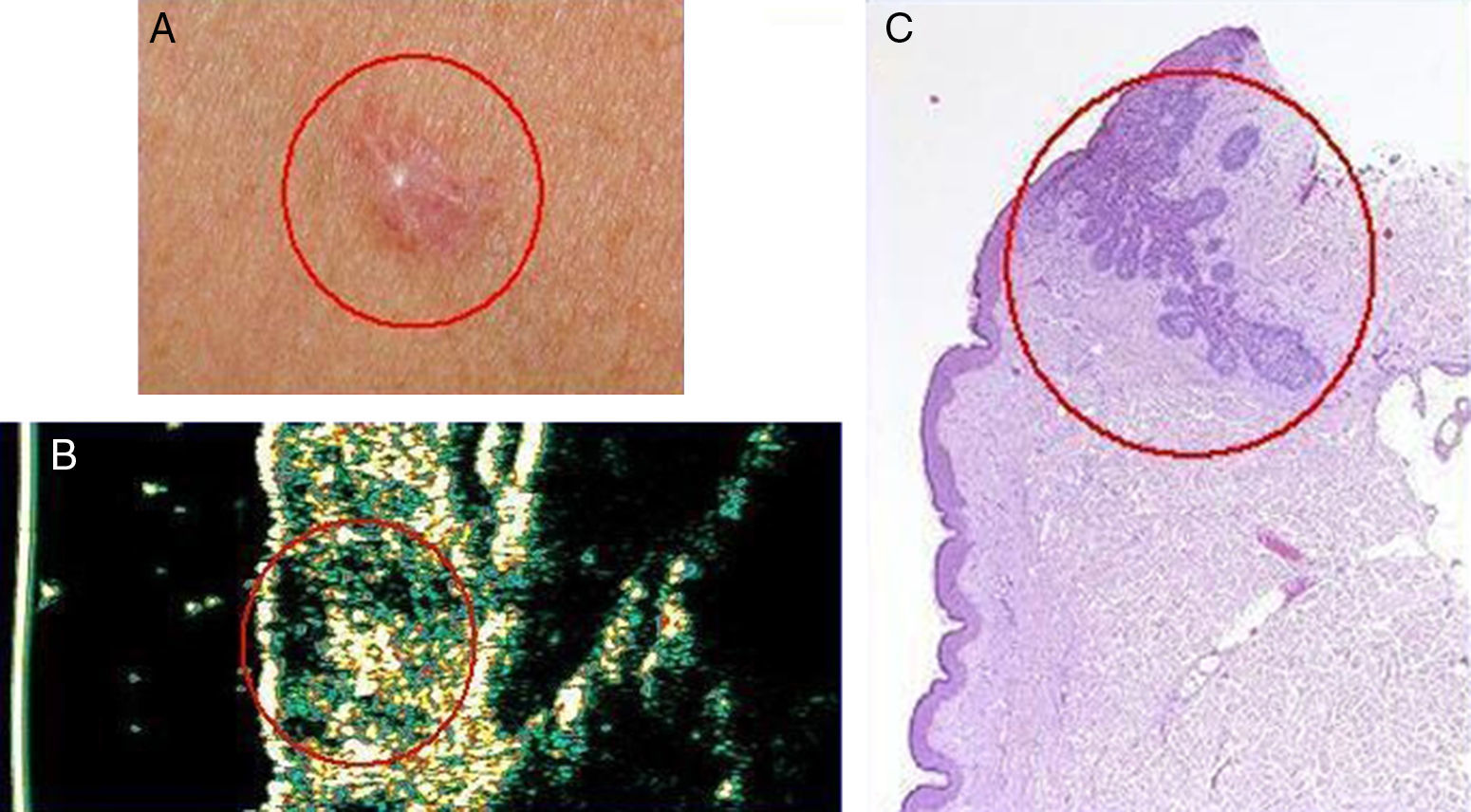
Mujer de 50 años con carcinoma basocelular pectoral. A. Imagen clínica de la lesión. B. Imagen ecográfica (20Mhz) de la lesión donde se observa una estructura hipoecoica subepidérmica mal definida y aplanada. Obsérvese que subyacente a la misma se puede apreciar otra formación hipoecoica irregular y mal definida sugerente de infiltración. C. Imagen histológica de la lesión con H-E ×50 donde se observa destacado en rojo el componente infiltrativo del carcinoma basocelular.
Finalmente habría que destacar otras limitaciones de la técnica no comentadas anteriormente, como son que las valoraciones pueden ser difíciles en proximidades de cicatrices o zonas de curetaje/biopsia, la imposibilidad de detectar agregados tumorales más pequeños que la resolución del ecógrafo, la imposibilidad de diferenciar procesos inflamatorios adyacentes a la lesión y que pueden dar lugar a una sobreestimación del tamaño de la misma, la dificultad de diferenciar subtipos superficiales de CBC en pieles con gran elastosis, la imposibilidad de determinar los márgenes de la lesión si hay afectación del límite dermo-hipodérmico, y que es una técnica operador dependiente (necesidad de cierta experiencia, con una curva de aprendizaje, etc.). No hay que olvidar además el precio considerable que tienen en la actualidad los ecógrafos de alta frecuencia y que puede constituir un inconveniente en cuanto a su adquisición en algunos casos.
Así, podemos concluir que a día de hoy la histología puede haber encontrado un valioso aliado y que, aunque queda mucho trabajo por hacer con la ECAF (desarrollo de sondas más pequeñas, reducción del tamaño del ecógrafo que le otorgue mayor funcionalidad, desarrollo de técnicas de digitalización y mejora de resolución, más estudios sobre la materia con series de casos aún más amplias), y pese a las limitaciones actuales de la técnica, es indudable que nos encontramos ante una técnica con un gran valor potencial para la valoración del CBC y otras lesiones tumorales y no tumorales. En nuestra opinión, al igual que sucedió con la dermatoscopia hace algunos años, en un relativo corto o medio espacio de tiempo en muchos hospitales se dispondrá de un ecógrafo para uso del dermatólogo en su práctica habitual.