No existen estudios sobre el uso de polimorfismos en psoriasis para predecir la respuesta a brodalumab.
ObjetivosAnalizar la relación de 180 polimorfismos con una respuesta óptima a brodalumab en práctica clínica real.
MétodosSe incluyeron pacientes con psoriasis en placas tratados con brodalumab durante al menos 24semanas. Se genotiparon 180 polimorfismos de genes relacionados con la inmunopatogenia de la psoriasis. La respuesta óptima (PASI absoluto ≤1) al tratamiento se evaluó a los 6 y 12meses. En el análisis multivariante se incluyeron los polimorfismos con False Discovery Rate ≤0,25.
ResultadosEl estudio incluyó 119 pacientes; el 68% y el 62% alcanzaron un PASI ≤1 a los 6 y a los 12meses, respectivamente. Se identificaron como factores de riesgo para no lograr un PASI ≤1: el uso previo de biológicos y fármacos antirreumáticos modificadores de la enfermedad, el diagnóstico de artritis psoriásica y el peso. El análisis de asociación a los 12meses reveló que los polimorfismos rs495337 (SPATA), rs6311 (HTR2A) y rs4085613 (LCE3D) se asocian con alcanzar un PASI ≤1 independientemente del uso previo de biológicos, artritis psoriásica o el peso. Los genotipos CT-TT para rs6311 y GT para rs4085613 fueron identificados como factores de riesgo para alcanzar PASI ≤1, mientras que AG-AA para rs495337 aumentaron la probabilidad de lograr respuesta óptima. Ningún polimorfismo se asoció con la respuesta a los 6meses.
ConclusionesEste estudio identificó variaciones genéticas que podrían predecir la respuesta a brodalumab, permitiendo optimizar su uso en el tratamiento de la psoriasis.
Numerous studies have investigated the association that exists between genetic variants and the efficacy profile of biologic therapies for the management of psoriasis. However, as far as we know, data on this association for brodalumab are lacking in the currently available scientific literature.
ObjectivesTo analyze the association of 180 polymorphisms with an optimal response to brodalumab in real-world clinical practice.
MethodsA total of 119 patients with plaque psoriasis on a 24-regimen of brodalumab recruited from 11 Spanish hospitals were genotyped for 180 polymorphisms. Optimal response was evaluated as absolute (PASI)≤1 at 6 and 12months. Polymorphisms with false discovery rates <0.25 were included in a multiple regression model.
ResultsA total of 68% and 62% of patients achieved PASI≤1 at 6 and 12months, respectively. Patient weight, history of biological therapy, disease-modifying anti-rheumatic drugs, and psoriatic arthritis were identified as risk factors for failing to achieve PASI≤1. At 12months, polymorphisms rs495337 (SPATA2), rs6311 (HTR2A), and rs4085613 (LCE3D) were associated with achieving a PASI≤1 regardless of previous use of biologics and DMARDs, psoriatic arthritis, or weight. The genotypes CT-TT for rs6311 (HTR2A) and GT for rs4085613 (LCE3D) were identified as risk factors for lack of optimal response at 12months, while genotypes AG-AA for rs495337 (SPATA2) increase the probability of response. No polymorphism was associated to brodalumab response at 6months.
ConclusionsThis study identified genetic variations associated with the ability to achieve an optimal response to brodalumab, providing potential insights into its efficacy profile for treating plaque psoriasis.
La psoriasis es una enfermedad multifactorial en la que influyen la predisposición genética, los cambios epigenéticos y los desencadenantes ambientales. El desarrollo de lesiones de psoriasis es el resultado de la interacción de estos factores1. La interleucina (IL)-17 es un mediador clave en este proceso que promueve la inflamación y el daño tisular. Aunque la producción de IL-17 se atribuyó inicialmente a las célulasT helper (Th) 17 dependientes de IL-23, cada vez hay más pruebas de que las células inmunitarias innatas son una fuente de IL-17 independientemente de la IL-232.
La aprobación de terapias biológicas dirigidas al eje IL-23/IL-17 ha proporcionado tratamientos con un perfil de eficacia favorable en un número considerable de pacientes con psoriasis3. Entre estas terapias novedosas destaca el brodalumab, un anticuerpo monoclonal humanizado. Al unirse a la subunidadA del receptor de la IL-17 (IL-17RA), el brodalumab inhibe la actividad de múltiples citocinas proinflamatorias de la familia de la IL-17, además de la IL-17A. Brodalumab está indicado para la psoriasis de moderada a grave en adultos susceptibles de recibir tratamiento sistémico. Los ensayos clínicos con este fármaco han demostrado resultados de seguridad y eficacia muy favorables que conducen a un rápido control de la enfermedad4. Sin embargo, los índices de eficacia en la práctica clínica real pueden variar5, lo que subraya la importancia de identificar marcadores predictivos de la respuesta al tratamiento. Los marcadores genéticos, en particular los polimorfismos de nucleótido único (SNP), son candidatos prometedores6.
Numerosos estudios, centrados en los bloqueantes del factor de necrosis antitumoral (TNF) y el anticuerpo monoclonal anti-IL-17 ustekinumab, han estudiado la asociación de las variaciones genéticas y la eficacia de las terapias biológicas en el tratamiento de la psoriasis7,8. Recientemente, nuestro grupo de trabajó identificó la asociación de ciertas variantes con el perfil de eficacia de secukinumab9. Sin embargo, esta asociación queda por explorar en el caso del brodalumab.
Se estudió la asociación de 180 polimorfismos en genes relevantes para la psoriasis con la respuesta a brodalumab a los 12 meses en práctica clínica real. El estudio se centró en la asociación con pacientes con respuesta óptima (superrespondedores) definidos en este manuscrito como aquellos con puntuaciones absolutas del índice de área y gravedad de la psoriasis (PASI)≤1.
MétodosSujetosRealizamos este estudio retrospectivo-prospectivo en 11 centros dermatológicos de España. El estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Universitario de La Princesa (Madrid, España). Se incluyeron 119 pacientes adultos con psoriasis crónica en placas de moderada a grave que habían recibido tratamiento previo con brodalumab en práctica clínica durante, al menos, 24semanas. Los pacientes se reclutaron entre septiembre de 2020 y septiembre de 2022 y siguieron la posología y el régimen terapéutico recomendados en el recomendados en la ficha técnica del producto del producto (210mg por vía subcutánea en las semanas0, 1 y 2, seguidos de dosis cada 2semanas). Se recogieron datos clínicos, la edad, el sexo, el peso, la duración de la enfermedad, los antecedentes médicos de terapias sistémicas convencionales y biológicas, y la presencia de artritis psoriásica (APs). El perfil de eficacia de brodalumab se evaluó a los 6 y 12meses y, posteriormente, se categorizó mediante puntuaciones absolutas PASI≤3, ≤2 y ≤1.
Procesamiento de muestras y genotipadoLa extracción de ADN se realizó utilizando 1ml de sangre periférica con el sistema MagNA Pure LC 2.0 (Roche, Suiza) y se cuantificó utilizando un espectrofotómetro NanoDrop® ND-1000 (Wilmington, EE.UU.). Se diseñó una micromatriz personalizada que contenía 180 polimorfismos en genes relevantes para la psoriasis, basándose en una extensa revisión bibliográfica (Tabla suplementaria 1)9. El genotipado se realizó utilizando un instrumento de qPCR QuantStudio 12K Flex con un bloque térmico OpenArray (Applied Biosystems, Thermofisher, EE.UU.).
EstadísticasSe excluyeron del análisis de asociación los polimorfismos con >5% de de errores en el genotipado y los individuos con >5% de datos perdidos. La regresión logística univariable evaluó la asociación de variables sociodemográficas y clínicas (la edad, el sexo, la APs, la duración de la enfermedad y la puntuación PASI basal) con la eficacia del tratamiento. La asociación entre cada polimorfismo y la respuesta clínica se ajustó para las covariables identificadas como significativas en el análisis univariable utilizando el Criterio de Información de Akaike (AIC) para la selección del modelo y el paquete SNPassoc R para fines analíticos. El método Last Observation Carried Forward se empleó en el análisis estadístico para imputar los datos que faltaban de los pacientes que abandonaron, principalmente debido a una eficacia insuficiente.
Para el modelo de regresión logística multivariable a los 12meses se seleccionaron las variantes con una tasa de falsos descubrimientos (FDR) <0,25. Para la construcción del modelo se utilizó el método de selección paso a paso hacia atrás. Se utilizó el análisis de la curva ROC (receiver operating characteristic) para evaluar la capacidad de los modelos para distinguir entre respondedores y no respondedores en función del PASI absoluto. El análisis estadístico se realizó con RStudio versión 2023.09.0+463.
ResultadosDatos sociodemográficos basales y perfil de eficaciaSe analizó una cohorte de 119 pacientes (52% hombres con una edad media de 51,1±13años y un peso medio de 84,5±20,4kg). Entre ellos, el 22% no habían recibido tratamiento con agentes biológicos y el 24% tenían un diagnóstico confirmado de APs. Las características clínicas y sociodemográficas de los pacientes se muestran en la tabla 1. No se notificaron acontecimientos adversos graves.
Características fenotípicas de los pacientes (datos basales)
| Característica | n=119 |
|---|---|
| Varones, n (%) | 62 (52) |
| Edad, media±DE | 51,1±13 |
| Peso (kg), media±DE | 84,5±20,4 |
| Artritis psoriásica, n (%), sí | 29 (24) |
| Duración de la enfermedad (años), media±DE | 19,6±14,5 |
| PASI inicial | 11,03±6,4 |
| Sin tratamiento previo con cFARME, n (%), sí | 36 (30,2) |
| Terapia biológica (%), sí | |
| 0 | 26 (22) |
| 1 | 52 (44) |
| 2 | 16 (13) |
| ≥ 3 | 25 (21) |
APs: artritis psoriásica; cFARME: fármacos antirreumáticos modificadores de la enfermedad convencionales; PASI: índice de área y gravedad de la psoriasis.
Los datos se muestran como media y desviación estándar o número.
A los seis meses de tratamiento, el 87%, el 76% y el 68% de los pacientes alcanzaron PASI≤3, ≤2 y ≤1, respectivamente. Estas respuestas favorables se mantuvieron a los 12meses; el 87% de los pacientes mantuvieron PASI≤3; el 77%, PASI≤2, y el 62%, PASI≤1.
Estudio de asociaciónPara el análisis de asociación se excluyó a un total de 5 pacientes debido a fallos en el genotipado. En el análisis univariante, el uso previo de fármacos antirreumáticos modificadores de la enfermedad (FARME), el uso previo de terapias biológicas, la APs y el peso del paciente mostraron una asociación significativa con la respuesta óptima a brodalumab (PASI≤1, superrespondedores) (p<0,5). No se encontró ninguna asociación entre el sexo, la edad, la duración de la enfermedad o el PASI basal y la respuesta al tratamiento.
A los 6 meses, varios polimorfismos mostraron una asociación significativa (p<0,05) tras ajustarse por peso, el uso de FARME, el tratamiento biológico previo y la APs. Sin embargo, ninguno de ellos alcanzó el punto de corte para correcciones múltiples (FDR<0,25).
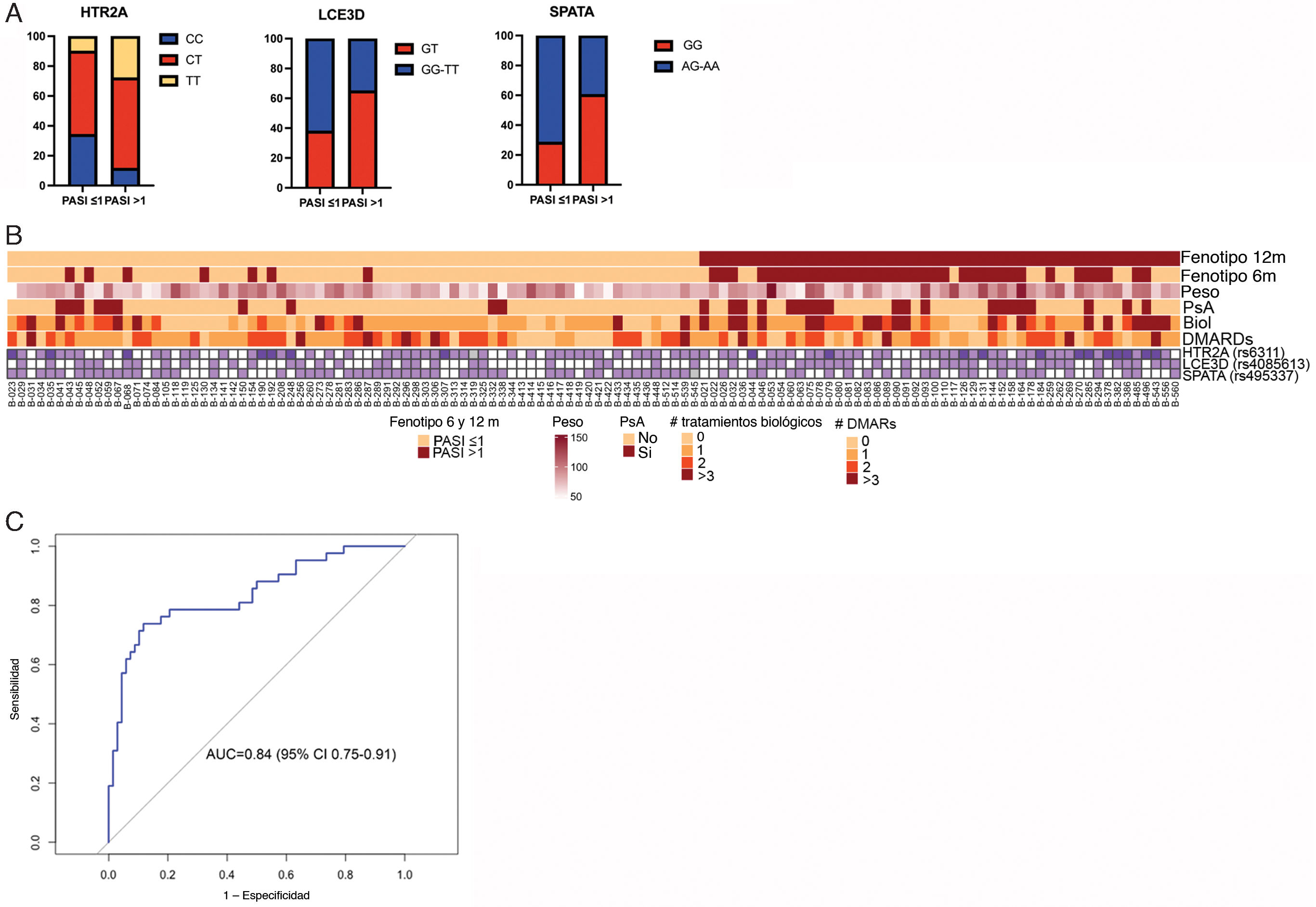
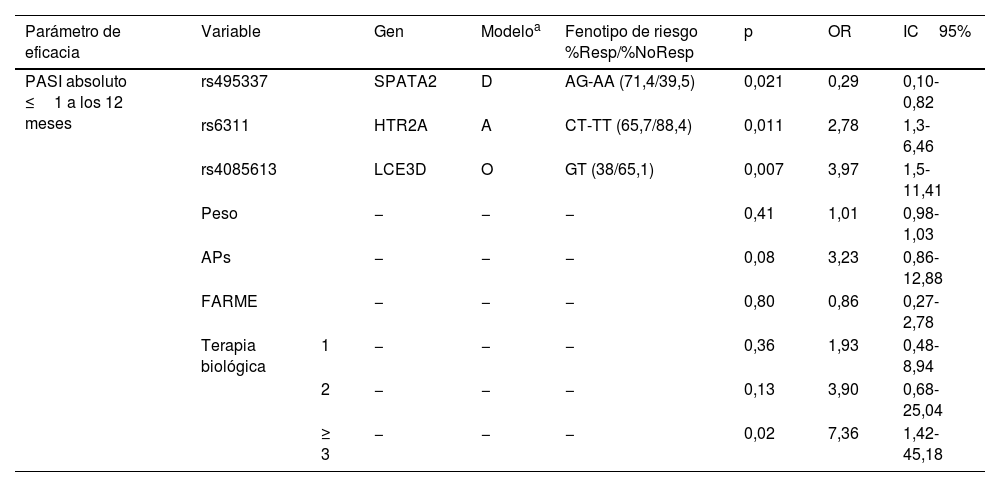
El análisis de 12 meses de tratamiento reveló que los polimorfismos rs495337 (SPATA2), rs6311 (HTR2A) y rs4085613 (LCE3D) se asociaron con un PASI≤1 absoluto, independientemente de los antecedentes médicos de uso de agentes biológicos y FARME, APs o del peso. Los genotipos CT-TT para rs6311 (HTR2A) y GT para rs4085613 (LCE3D) se identificaron como factores de riesgo de no alcanzar un PASI≤1 absoluto a los 12meses, mientras que los genotipos AG-AA para rs495337 (SPATA2) fueron protectores (tabla 2 y fig. 1A, B). El análisis de la curva ROC reveló que el modelo que incluía la combinación de polimorfismos para SPATA2, HTR2A y LCE3D, junto con el peso, el tratamiento biológico y con los FARME previos, y la presencia de APs, un área bajo la curva de 0,83 (intervalo de confianza [IC] del 95%: 0,75-0,91), con unos índices de sensibilidad y especificidad de 0,69 y 0,91, respectivamente, para discriminar entre respondedores y no respondedores (fig. 1C).
Modelo de regresión logística multivariable para PASI≤1 a los 12meses
| Parámetro de eficacia | Variable | Gen | Modeloa | Fenotipo de riesgo %Resp/%NoResp | p | OR | IC95% | |
|---|---|---|---|---|---|---|---|---|
| PASI absoluto ≤1 a los 12 meses | rs495337 | SPATA2 | D | AG-AA (71,4/39,5) | 0,021 | 0,29 | 0,10-0,82 | |
| rs6311 | HTR2A | A | CT-TT (65,7/88,4) | 0,011 | 2,78 | 1,3-6,46 | ||
| rs4085613 | LCE3D | O | GT (38/65,1) | 0,007 | 3,97 | 1,5-11,41 | ||
| Peso | − | − | − | 0,41 | 1,01 | 0,98-1,03 | ||
| APs | − | − | − | 0,08 | 3,23 | 0,86-12,88 | ||
| FARME | − | − | − | 0,80 | 0,86 | 0,27-2,78 | ||
| Terapia biológica | 1 | − | − | − | 0,36 | 1,93 | 0,48-8,94 | |
| 2 | − | − | − | 0,13 | 3,90 | 0,68-25,04 | ||
| ≥ 3 | − | − | − | 0,02 | 7,36 | 1,42-45,18 | ||
APs: artritis psoriásica; FARME: fármacos antirreumáticos modificadores de la enfermedad; IC: intervalo de confianza; NoResp: no respondedores; OR: odds ratio; PASI: índice de área y gravedad de la psoriasis; Resp: respondedores.
Los polimorfismos en HTR2A, LCE3D y SPATA se asocian con una respuesta óptima (PASI≤1) a brodalumab a los 12meses. A)Genotipos de HTR2A, LCE3D y SPATA ATG5 en pacientes que alcanzaron o no un PASI≤1 absoluto a los 12meses (se muestran los porcentajes de pacientes con el genotipo indicado). B)Datos individuales de pacientes correspondientes a polimorfismos en los genes HTR2A, LCE3D y SPATA, peso, APs, antecedentes de biológicos y FARME. Se muestra la presencia del alelo de riesgo para cada polimorfismo. Las barras superiores indican el fenotipo de los pacientes a los 12 y 6meses; pacientes respondedores y no respondedores considerando el PASI≤1 absoluto como parámetro de eficacia. C)Curva receiver operating characteristic (ROC) para la predicción de alcanzar un PASI≤1 absoluto a los 12meses en función de los polimorfismos HTR2A, LCE3D y SPATA, el peso, la APs, los antecedentes de biológicos y los antecedentes de FARME.
Aunque el brodalumab fue aprobado por la Agencia Europea del Medicamento (EMA) para el tratamiento de la psoriasis en placas en 2017, hacen falta estudios exhaustivos que evalúen los polimorfismos como predictores de respuesta al tratamiento4. El presente estudio suple este vacío, ya que ha identificado un conjunto de polimorfismos que se correlacionan con la respuesta al brodalumab. El análisis colectivo de estos polimorfismos podría proporcionar una herramienta valiosa para identificar a los pacientes con probabilidades de alcanzar un PASI≤1 absoluto a los 12meses en práctica clínica10.
El uso del brodalumab está aprobado para el tratamiento de la psoriasis en placas de moderada a grave en Estados Unidos, la Unión Europea, Canadá y algunos países asiáticos. Sin embargo, y a pesar de la eficacia demostrada en APs en los ensayos clínicos de fase II y III y práctica clínica real11,12, su aprobación para esta enfermedad está actualmente restringida a Japón. Curiosamente, en nuestro estudio, la presencia de artritis psoriásica se identificó como factor de riesgo de no alcanzar el PASI≤1 a los 12meses. En relación con el peso corporal y el uso previo de terapia biológica, la evidencia científica respalda una asociación significativa entre estos factores y una menor respuesta al tratamiento biológico, especialmente en pacientes tratados con adalimumab y ustekinumab13.
Además, el riesgo de falta de respuesta aumenta en los pacientes con psoriasis que han experimentado previamente un fracaso terapéutico con >1 terapia biológica previa o múltiples FARME14. Basándonos en estos informes, nuestro estudio ha descrito la asociación del peso y los antecedentes de tratamientos previos con la falta de respuesta al brodalumab en pacientes con diagnóstico de psoriasis en la práctica clínica habitual.
Mediante el análisis de polimorfismos relevantes para la psoriasis construimos un modelo que incluye polimorfismos en los genes HTR2A, LCE3D y SPATA2, ajustados por el peso, los tratamientos biológicos o los FARME previos y presencia de APs capaz de predecir la respuesta óptima al brodalumab (PASI≤1) a los 12meses. Este modelo puede representar una herramienta con buenas capacidades para diferenciar entre los fenotipos respondedores y no respondedores en la práctica clínica habitual.
SPATA2 (gen 2 asociado a la espermatogénesis) se ha identificado recientemente como un factor que contribuye a la señalización del TNF, regulando la actividad de NF-κB y la inducción de la muerte celular15. Además, SPATA2 es un factor de riesgo de psoriasis tanto en poblaciones occidentales como indias16.
Nuestros datos sugieren que el genotipo AG-AA para rs495337 (SPATA2) es protector, es decir, que los individuos que albergan este genotipo pueden tener más probabilidades de alcanzar PASI≤1 a los 12meses.
HTR2A codifica uno de los receptores responsables de la señalización de la serotonina. La serotonina desempeña un papel crucial en la modulación de diversos procesos inmunológicos, como la quimiotaxis, la activación leucocitaria, la proliferación y la secreción de citocinas. En el presente estudio encontramos que existe una asociación entre la presencia del genotipo HTR2A CT-TT y el fracaso en alcanzar una respuesta óptima al brodalumab a los 12meses. Este resultado concuerda con nuestros resultados previos, que muestran una asociación entre los polimorfismos HTR2A y una respuesta inadecuada a los fármacos anti-TNF y ustekinumab17,18.
El clúster del gen de la envoltura cornificada tardía (LCE), en particular el clúster3, es un locus de susceptibilidad para la psoriasis y la APs19, así como para otras enfermedades inflamatorias, como la dermatitis atópica20. Nuestros datos sugieren que albergar el genotipo GT para rs4085613 (LCE3D) podría ser útil para identificar en la práctica clínica a los pacientes con menos probabilidades de alcanzar una respuesta óptima al brodalumab a los 12meses.
En conclusión, este estudio identifica variaciones genéticas asociadas con la respuesta al brodalumab, proporcionando información potencial para la identificación de posibles respondedores óptimos que pueden facilitar la elección de un tratamiento personalizado. Aunque la investigación farmacogenética en enfermedades inmunomediadas está avanzando, la terapia personalizada mediante marcadores genéticos sigue siendo poco frecuente en la práctica clínica. A pesar de limitaciones como el pequeño tamaño de la cohorte, este estudio representa la primera exploración farmacogenética de la respuesta al brodalumab en psoriasis en la práctica clínica. Se justifica la realización de nuevas investigaciones para mejorar nuestra comprensión de los factores determinantes de la respuesta al tratamiento.
FinanciaciónEste estudio fue financiado por el Instituto de Salud CarlosIII (ISCIII) a través de la subvención PI21/01583 a HF y EDT y fue cofinanciado por el European Regional Development. Este estudio, iniciado por el investigador, contó con el apoyo de una subvención de LEO Pharma. LEO Pharma no participó en la planificación, reclutamiento o realización del estudio, ni en el proceso de redacción del manuscrito.
Conflicto de interesesH de la F declaró haber recibido una subvención del Instituto de Salud CarlosIII durante el estudio; EDT declaró haber recibido una subvención de Almirall durante el estudio, y pagos de Janssen-Cilag, Leo-Pharma, Almirall, Novartis, Lilly, UCB, Boehringer-Ingelheim y Bristol-Myers, no relacionados con este trabajo. AST declaró haber recibido pagos de AbbVie, Janssen-Cilag, Leo Pharma, Lilly, Almirall, Amgen, BMS, Novartis y Pfizer, y apoyo no financiero de Janssen-Cilag, Leo Pharma y Novartis, no relacionado con este trabajo. MCOB declaró no tener ningún conflicto de intereses potencial (apoyo a la investigación) con Leo Pharma no relacionado con este trabajo. P de la C declaró haber recibido honorarios por consultoría/ponencia y/o gastos de viaje y/o haber participado en ensayos clínicos patrocinados por AbbVie, Almirall, Amgen, BMS, Boehringer, Celgene, Johnson&Johnson, LEO Pharma, Lilly, MSD, Novartis, Pfizer, Roche, Sanofi y UCB, no relacionados con el trabajo presentado. MLV declaró haber recibido pagos de AbbVie, Almirall, Amgene, Boehringer, Celgene, Janssen, Leo Pharma, Lilly, Kyowa kirin, Novartis y UCB, no relacionados con el trabajo presentado. GR declaró haber recibido pagos y apoyo no financiero de AbbVie, Almirall, Amgen, Celgene, Janssen, Leo Pharma, Lilly, MSD, Novartis, Pfizer, Roche, Sanofi y UCB, no relacionados con el trabajo presentado. FAS ha sido consultor o investigador en ensayos clínicos patrocinados por las siguientes compañías farmacéuticas: Abbott, Alter, Aptatargets, Chemo, Cinfa, FAES, Farmalíder, Ferrer, GlaxoSmithKline, Galenicum, Gilead, Italfarmaco, Janssen-Cilag, Kern, Moderna, MSD, Normon, Novartis, Servier, Silver Pharma, Teva y Zambon, sin relación con este trabajo.
El resto de los autores declararon no tener ningún conflicto de intereses.