Tanto el diagnóstico como el seguimiento en la dermatología dependerán en gran medida de una evaluación visual. Cuando no se puede llegar al diagnóstico, se procede a realizar una biopsia cutánea, un procedimiento invasivo y que con frecuencia los resultados retrasan debido a la demora del transporte, así como al procesamiento de la muestra. Por otro lado, las biopsias pueden destruir las lesiones, lo que imposibilitará realizar un seguimiento clínico de la evolución de la lesión a estudio. La microscopia confocal de reflectancia in vivo (MCR) ofrece una alternativa diagnóstica a la biopsia cutánea. Esta técnica captura en tiempo real imágenes de alta resolución y se utilizará en la evaluación de diversas condiciones dermatológicas. La identificación de características específicas en la MCR podría ayudar a diferenciar dermatosis con una morfología clínica similar. La dermatitis alérgica de contacto (DAC) y la dermatitis irritativa de contacto (DIC) se diagnostican generalmente gracias a pruebas epicutáneas; estas, a su vez, se basarán en un sistema de valoración subjetiva. El uso de la MCR tanto en la detección temprana, como en la clasificación de la intensidad de la DC, ha sido estudiado en múltiples estudios. Existirán algunas características comunes en la MCR de la DAC como de la DIC. Entre estas podemos señalar la disrupción del estrato córneo, la formación de vesículas, la exocitosis, la espongiosis y la paraqueratosis. Las características específicas para la DAC serán la presencia de vasodilatación, el aumento del grosor epidérmico, edema intercelular y acantosis. Las características específicas de la DIC son la presencia de los corneocitos disgregados y queratinocitos en diana. Esta revisión resume la utilidad de la MCR en las condiciones eccematosas de contacto cutáneas y busca incentivar futuras investigaciones, así como incrementar el interés clínico en esta prometedora técnica.
Dermatologic diagnosis and monitoring have been dependent largely on visual grading. A skin biopsy is performed in case of diagnostic uncertainty, but can be traumatic, and results are delayed due to time for specimen transport and processing. Biopsies also destroy specimens, prohibiting lesion evolution monitoring. In vivo reflectance confocal microscopy (RCM) offers a diagnostic alternative to skin biopsy. RCM captures real-time, high-resolution images, and has been piloted for the evaluation of various dermatologic conditions. Identification of unique RCM features may distinguish dermatoses with similar clinical morphologies. Allergic contact dermatitis (ACD) and irritant contact dermatitis (ICD) are diagnosed by patch testing that currently uses a subjective scoring system. RCM has increasingly been studied for early detection and severity grading of CD. Common RCM features shared by ACD and ICD are stratum corneum disruption, vesicle formation, exocytosis, spongiosis, and parakeratosis. Features unique to ACD are vasodilation, increased epidermal thickness, intercellular edema, and acanthosis. Features unique to ICD are detached corneocytes and targetoid keratinocytes. This review summarizes the use of RCM in evaluating contact eccematous conditions and aims to spark future research and interest in this promising tool.
La microscopia confocal de reflectancia in vivo (MCR) es una técnica no invasiva que captura de manera instantánea imágenes de alta resolución de la ultraestructura cutánea en vivo. En 1957, el matemático e informático Marvin Minksy patentó el primer microscopio confocal capaz de capturar imágenes del tejido cerebral1. La MCR se utilizó posteriormente por Rajadhyaksha et al. en 1995 para la visualización de núcleos y de células de piel humana2. Desde finales de los años 90 hasta el 2010, la literatura que se publicó acerca del uso de la MCR en las enfermedades dermatológicas se ha incrementado 20 veces, lo que demuestra el gran potencial de su uso en esta especialidad3.
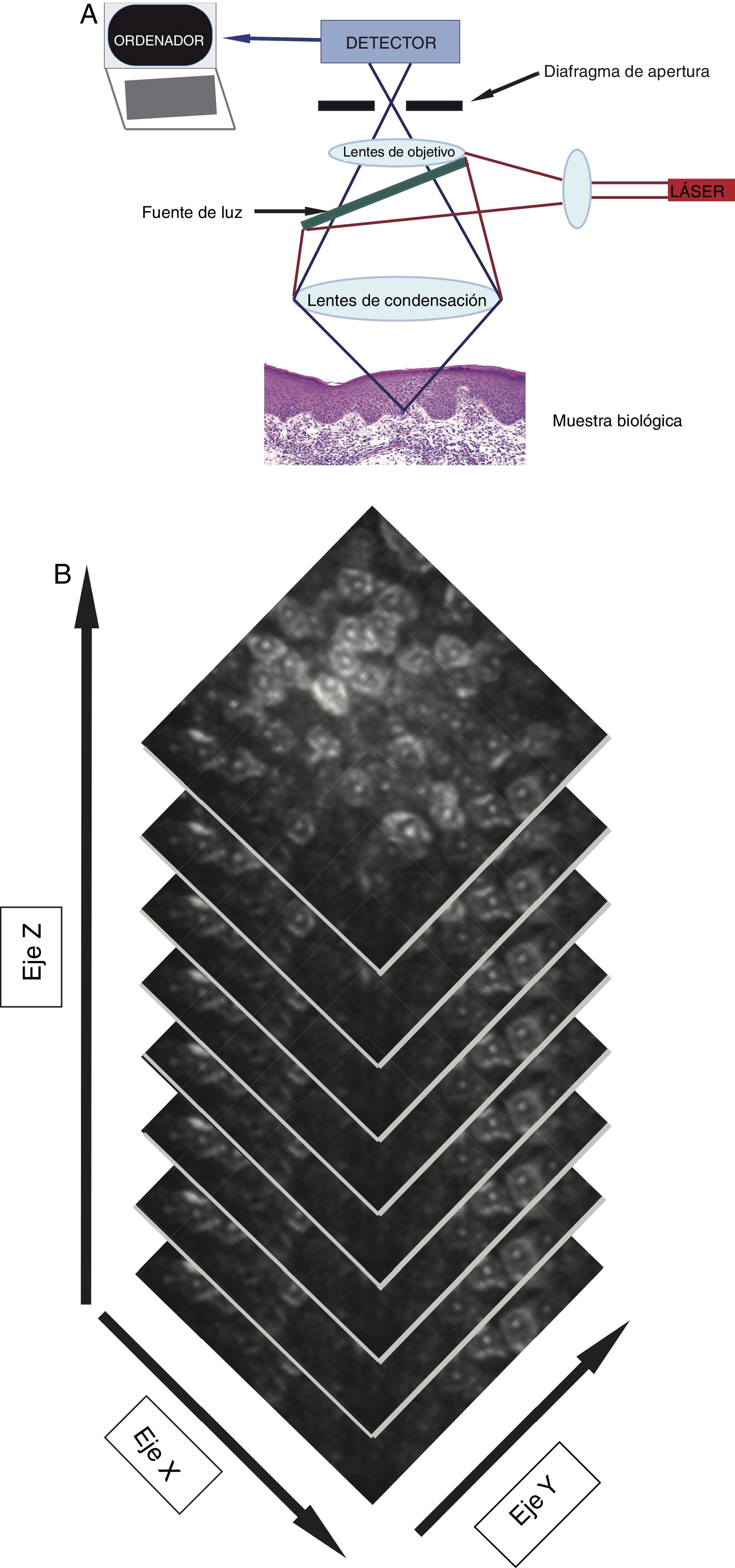
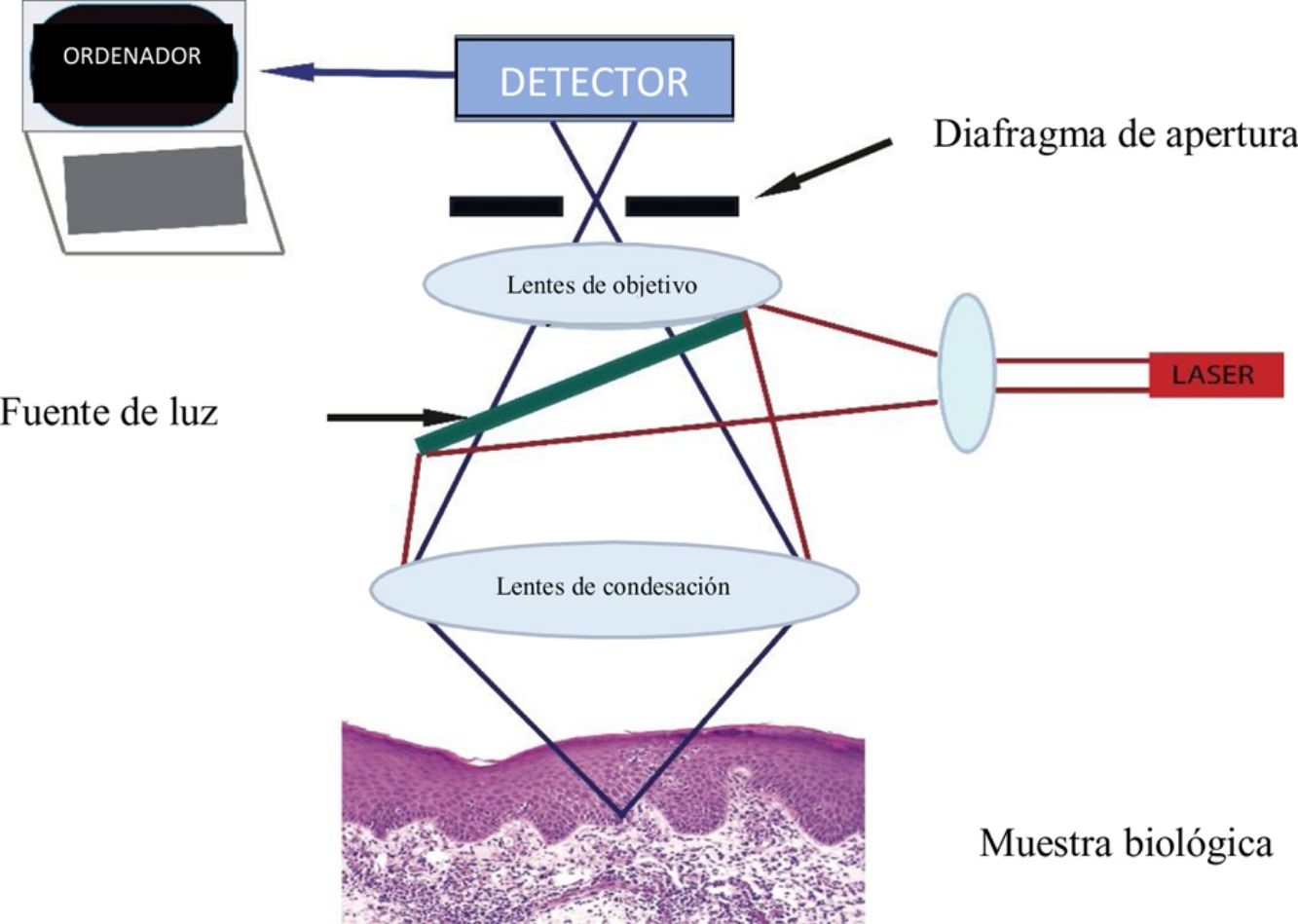
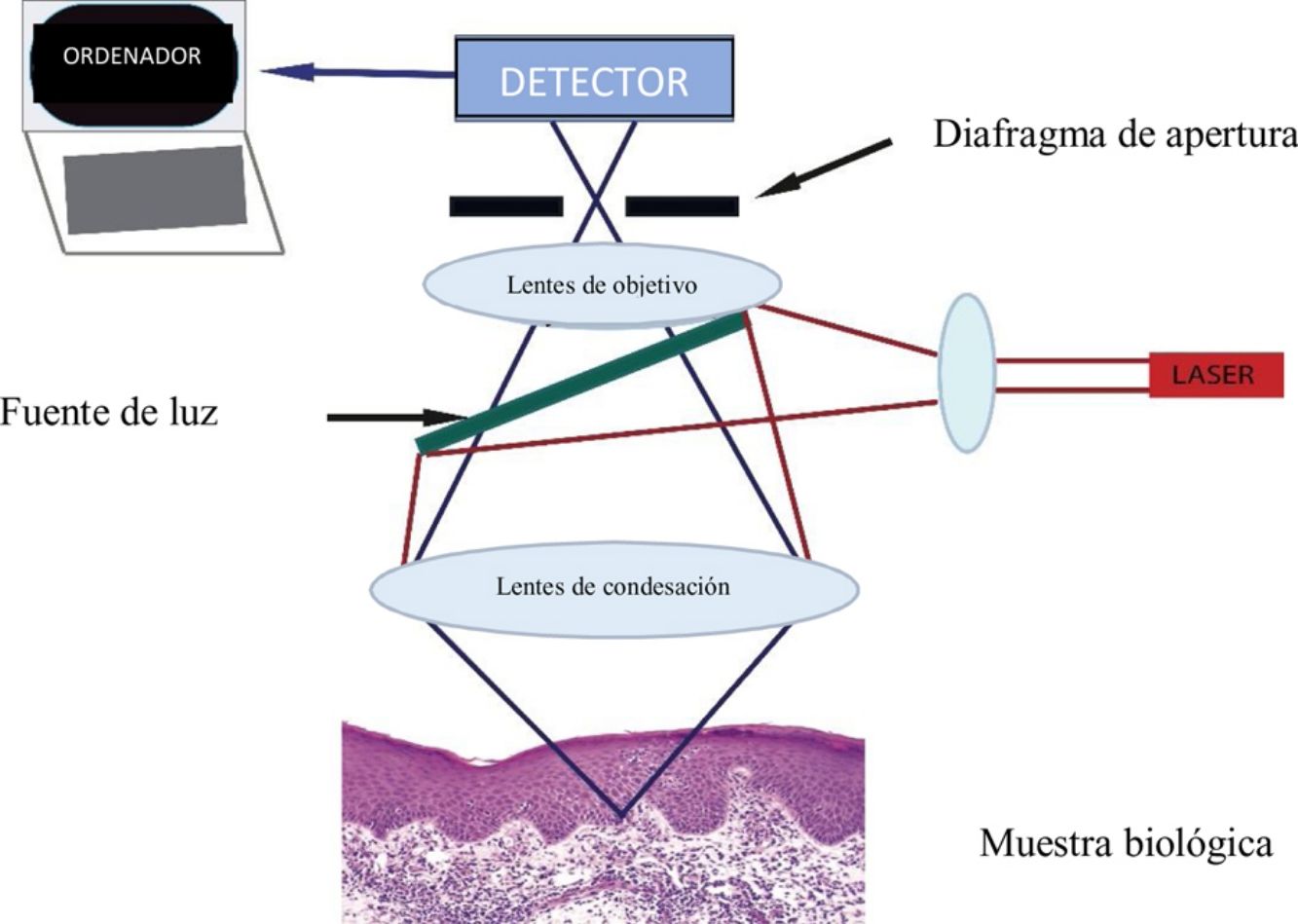
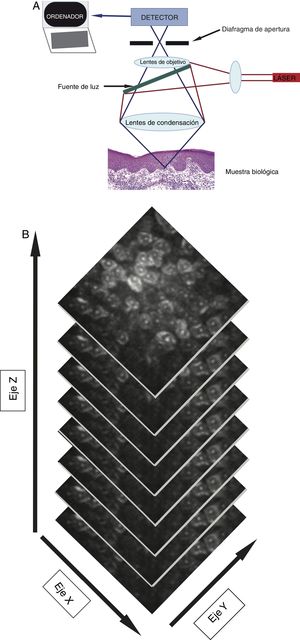
La MCR utiliza un láser de baja potencia (< 30 mW) no ablativo, que captura imágenes en tiempo real ultraestructurales que atraviesen la epidermis llegando hasta la dermis reticular superior (350μm en profundidad)4. El microscopio incluye una fuente de luz láser (láser individual: 830nm, o láser múltiple: 488nm, 658nm, 785nm), elementos para escaneo, telescopio de retransmisión, divisor de haces, diafragma de apertura, lentes de objetivo y un detector (fig. 1A)4,5. Cuando el haz de luz ilumina la piel, las diferencias en la reflectancia generarán en segundos imágenes de las estructuras opacas (no reflectantes) y brillantes (reflectantes)4. Esto se corresponderá con la delimitación que existe entre 2estructuras celulares, las que tendrán diferentes índices de refracción, donde se pueden incluir pero no se limitan únicamente a las membranas, los detritos inflamatorios y los melanosomas4. La luz se reflejará a través de una lente de objetivo. Previamente, un diafragma de apertura filtrará la luz dispersa con la finalidad de crear una imagen de alta resolución similar a la de la histología convencional4,5. Cada imagen recogida será visualizada en un campo visual de 500μm2-8mm2 con una magnificación de 30×. El dispositivo capturará múltiples imágenes en 2dimensiones con una imagen que será almacenada en el plano horizontal (fig. 1B), la cual diferirá del corte vertical de la histopatología estándar5. Los dispositivos de MCR con láser simple son portátiles, lo que hace que su uso sea más fácil. Los dispositivos con láseres múltiples combinarán un microscopio con espectro de luz fluorescente y la MCR. El microscopio con espectro de luz fluorescente incrementará el espectro de longitud de onda, con lo que se identificarán un mayor número de características de la piel sana y patológica. La MCR presenta algunas ventajas en comparación con la dermatoscopia, ya que puede magnificar las estructuras celulares, así como las características específicas a nivel de cada estrato de la piel y, finalmente, recoge fotografías «time-lapse», lo que permitirá la detección de cambios cutáneos de forma dinámica6. Adicionalmente, la detección de cambios subclínicos a través del uso de la MCR permitirá el inicio de un tratamiento oportuno, así como evitar la suspensión de un tratamiento antes de tiempo7. El uso de la MCR, por otro lado, reducirá la necesidad de una implicación exagerada tanto por parte de los pacientes como la del médico8.
A) Un láser de baja intensidad (< 30 mW), no ablativo, incluirá una fuente de luz, elementos para escaneo, telescopio de retransmisión, divisor de haces, diafragma de apertura, lentes de objetivo y un detector que genere imágenes de las estructuras brillantes y oscuras cutáneas. B) Apilamiento representativo de las imágenes, que revelan las características desde la epidermis hasta la dermis reticular superior.
Aproximadamente el 20% de la población de los EE. UU. está afectada por una dermatitis de contacto (DC), representando hasta un 95% de las dermatosis ocupacionales9. La dermatitis alérgica de contacto (DAC) ocurre cuando el contacto con una sustancia específica provocará una reacción de hipersensibilidad retardada de tipo iv, la cual a su vez requerirá un periodo de sensibilización de entre 10-14 días. Una vez ocurrida la reexposición, esta reacción se desarrollará dentro de las siguientes 24-48 h. La DAC se manifestará por prurito, eritema, descamación y la presencia de placas edematosas asociadas a vesículas, las que estarán localizadas en el área de la exposición10. En cuanto a los hallazgos histológicos, en la DAC se observará la formación de vesículas, un infiltrado inflamatorio y espongiosis11-13.
Mientras que en la DAC será necesaria una exposición previa para que haya una reacción cutánea, la dermatitis irritativa de contacto (DIC) puede surgir de una exposición única a un irritante. La DIC se presentará clínicamente con eritema, fisuras y xerosis. Típicamente, estará acompañada por una mayor sensación urente, así como por menor prurito en comparación con la DAC10. A nivel histológico, la DIC causará una disrupción significativa del estrato córneo (EC), paraqueratosis y engrosamiento epidérmico. A pesar de presentar diferencias en la «pato-etiología», la DAC y la DIC tendrán una morfología similar y con frecuencia distinguirlas basándose únicamente en la inspección visual será difícil14.
La prueba del parche (PP) es actualmente la prueba de elección para poder diagnosticar las DC, seguida de la valoración clínica a través del sistema de puntuación del Grupo Internacional de Investigación en Dermatitis de Contacto (tabla 1). Este sistema de puntuación tiene una sensibilidad y una especificidad del 85%, con una tasa de falsos positivos del 15-18%15. La valoración de las reacciones cutáneas estará sujeta a una importante variabilidad inter e intraobservador. Es importante señalar que los mismos criterios serán utilizados para diagnosticar tanto la DAC como la DIC, por lo que no se cuenta con ningún parámetro estandarizado que nos permita diferenciarlas. Por este motivo, existe la imperiosa necesidad de encontrar una forma práctica que de manera más objetiva y consistente nos permita clasificar las DC.
Sistema de puntuación del Grupo Internacional de Investigación en Dermatitis de Contacto
| Símbolo | Morfología | Valoración |
|---|---|---|
| - | No rcn | Rcn negativa |
| ?+ | Ligero eritema únicamente | Rcn dudosa |
| + | Eritema, infiltración, pápulas posibles | Rcn positiva débil |
| ++ | Eritema, infiltración, pápulas, vesículas | Rcn positiva fuerte |
| +++ | Eritema Intenso, infiltrado, vesículas confluyentes | Rcn muy positiva |
| IR | Diversas morfologías, por ejemplo, ampollas, necrosis | Rcn irritativa |
Rcn: reacción.
La MCR se ha utilizado para distinguir condiciones eccematosas con morfologías similares4. La detección de reacciones tempranas utilizando la MCR reducirá la necesidad de realizar consultas posteriores buscando valorar las reacciones de hipersensibilidad retardadas y, a su vez, permitirá implementar un tratamiento más oportuno. En 2015, Hoogedoorn et al. realizaron una revisión sistemática breve acerca del uso de la MCR en las enfermedades inflamatorias de la piel16. Nosotros presentamos una revisión exhaustiva y actualizada, donde resumimos la evidencia actual acerca del uso de la MCR en el diagnóstico y el seguimiento de las condiciones eccematosas de contacto, incluyendo la DAC y la DIC.
Materiales y métodosEn octubre del 2017, 2investigadores realizaron una revisión de la literatura con la finalidad de establecer las características de la DC en la MCR. En las páginas de PubMed y Google Escolar se realizó una búsqueda utilizando los términos «reflectance confocal microscopy» AND «eccematous dermatoses», OR «dermatitis», OR «allergic contact dermatitis», OR «irritant contact dermatitis». Estos parámetros de búsqueda permitieron encontrar un total de 49 artículos. La selección de la literatura se limitó a aquellas publicaciones o traducciones en inglés y a los estudios controlados aleatorizados (ECA). Tres publicaciones se excluyeron ya que trataban básicamente del uso de la microscopia de barrido láser o microscopia confocal de fluorescencia. Los 10 estudios incluidos en la presente revisión son aquellos que hacían referencia al uso de la MCR en ECA, los que han sido resumidos en la tabla 2.
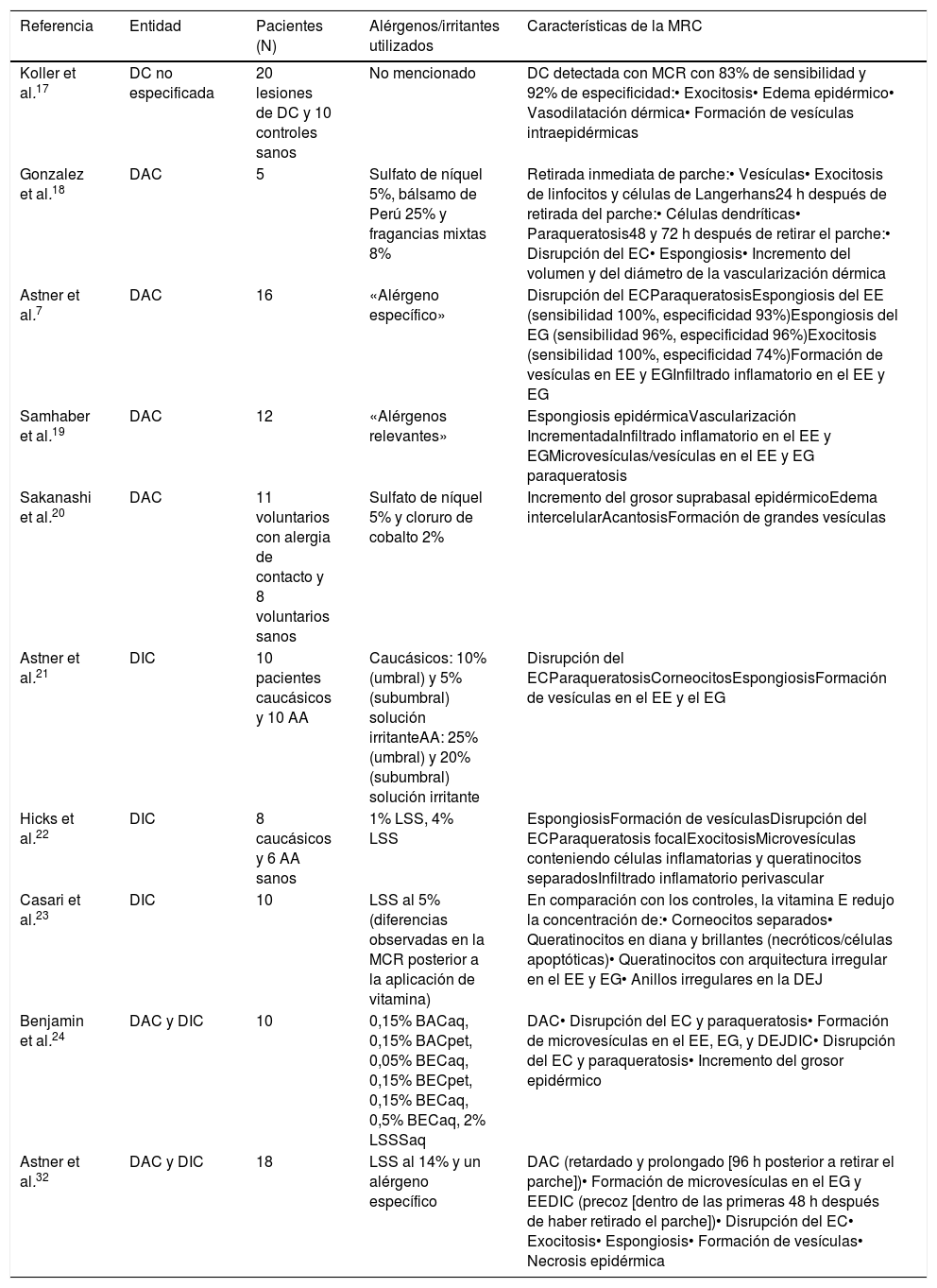
Resumen de los estudios revisados que evaluaban las características de la MCR en la DAC y la DIC
| Referencia | Entidad | Pacientes (N) | Alérgenos/irritantes utilizados | Características de la MRC |
|---|---|---|---|---|
| Koller et al.17 | DC no especificada | 20 lesiones de DC y 10 controles sanos | No mencionado | DC detectada con MCR con 83% de sensibilidad y 92% de especificidad:• Exocitosis• Edema epidérmico• Vasodilatación dérmica• Formación de vesículas intraepidérmicas |
| Gonzalez et al.18 | DAC | 5 | Sulfato de níquel 5%, bálsamo de Perú 25% y fragancias mixtas 8% | Retirada inmediata de parche:• Vesículas• Exocitosis de linfocitos y células de Langerhans24 h después de retirada del parche:• Células dendríticas• Paraqueratosis48 y 72 h después de retirar el parche:• Disrupción del EC• Espongiosis• Incremento del volumen y del diámetro de la vascularización dérmica |
| Astner et al.7 | DAC | 16 | «Alérgeno específico» | Disrupción del ECParaqueratosisEspongiosis del EE (sensibilidad 100%, especificidad 93%)Espongiosis del EG (sensibilidad 96%, especificidad 96%)Exocitosis (sensibilidad 100%, especificidad 74%)Formación de vesículas en EE y EGInfiltrado inflamatorio en el EE y EG |
| Samhaber et al.19 | DAC | 12 | «Alérgenos relevantes» | Espongiosis epidérmicaVascularización IncrementadaInfiltrado inflamatorio en el EE y EGMicrovesículas/vesículas en el EE y EG paraqueratosis |
| Sakanashi et al.20 | DAC | 11 voluntarios con alergia de contacto y 8 voluntarios sanos | Sulfato de níquel 5% y cloruro de cobalto 2% | Incremento del grosor suprabasal epidérmicoEdema intercelularAcantosisFormación de grandes vesículas |
| Astner et al.21 | DIC | 10 pacientes caucásicos y 10 AA | Caucásicos: 10% (umbral) y 5% (subumbral) solución irritanteAA: 25% (umbral) y 20% (subumbral) solución irritante | Disrupción del ECParaqueratosisCorneocitosEspongiosisFormación de vesículas en el EE y el EG |
| Hicks et al.22 | DIC | 8 caucásicos y 6 AA sanos | 1% LSS, 4% LSS | EspongiosisFormación de vesículasDisrupción del ECParaqueratosis focalExocitosisMicrovesículas conteniendo células inflamatorias y queratinocitos separadosInfiltrado inflamatorio perivascular |
| Casari et al.23 | DIC | 10 | LSS al 5% (diferencias observadas en la MCR posterior a la aplicación de vitamina) | En comparación con los controles, la vitamina E redujo la concentración de:• Corneocitos separados• Queratinocitos en diana y brillantes (necróticos/células apoptóticas)• Queratinocitos con arquitectura irregular en el EE y EG• Anillos irregulares en la DEJ |
| Benjamin et al.24 | DAC y DIC | 10 | 0,15% BACaq, 0,15% BACpet, 0,05% BECaq, 0,15% BECpet, 0,15% BECaq, 0,5% BECaq, 2% LSSSaq | DAC• Disrupción del EC y paraqueratosis• Formación de microvesículas en el EE, EG, y DEJDIC• Disrupción del EC y paraqueratosis• Incremento del grosor epidérmico |
| Astner et al.32 | DAC y DIC | 18 | LSS al 14% y un alérgeno específico | DAC (retardado y prolongado [96 h posterior a retirar el parche])• Formación de microvesículas en el EG y EEDIC (precoz [dentro de las primeras 48 h después de haber retirado el parche])• Disrupción del EC• Exocitosis• Espongiosis• Formación de vesículas• Necrosis epidérmica |
DAC: dermatitis alérgica contacto; DC: dermatitis de contacto; DIC: dermatitis irritativa de contacto; EC: estrato córneo; EE: estrato Espinoso; EG: estrato granuloso; LSS: lauril sulfato sódico; MCR: microscopia confocal de reflectancia.
Koller et al. evaluaron la validez de la MCR en el diagnóstico de las DC. Veinte lesiones de DC y 10 controles de tejido sano fueron confirmados histológicamente (n=9) o con PP positiva (n=11) y posteriormente valorados de manera independiente por 3dermatólogos con moderada experiencia en el uso de la MCR. La MCR detectó las DC con una sensibilidad del 83% y una especificidad del 92%, y la piel sana con una sensibilidad del 97% y una especificidad del 99%. Los autores atribuyeron estas diferencias estadísticas a que las DC presentaban características morfológicamente más complejas. Las características de las DC que se observaron en la MCR fueron: exocitosis, edema epidérmico y vasodilatación a nivel dérmico. La formación de vesículas intraepidérmicas a nivel tanto de la epidermis superior como de la unión dermoepidérmica tuvieron una elevada concordancia interobservador. Teniendo en cuenta únicamente estos factores, el software de análisis para clasificación por diagrama de árbol fue capaz de identificar con una exactitud del 82% las lesiones compatibles con DC. Sin embargo, tras analizar las 20 lesiones sospechosas de DC, no quedó del todo claro si estos hallazgos podrían ser extrapolables a la población general17. Los autores no describieron ninguna diferencia entre la DAC y la DIC. Así mismo, estos hallazgos demostraron que la realización de futuros estudios comparando las reacciones de la DAC y la DIC podrían tener un gran potencial17.
Dermatitis alérgica de contactoGonzalez et al. publicaron el primer estudio acerca de la utilización de la MCR en la DAC, en el que se incluyó a 5 pacientes con antecedentes de DAC. En este estudio se buscó determinar si los cambios observados en la histología se podrían observar de forma similar en la MCR. Se colocaron parches con sulfato de níquel al 5%, bálsamo del Perú al 25% y mezcla de fragancias al 8%, tanto a las 24 como a las 48 h. Se realizaron imágenes con MCR de las áreas que presentaron alguna reacción, así como en la piel adyacente; estas imágenes se tomaron inmediatamente después de la exposición, y a las 24, 48, y 72 h después de haber retirado el parche. Para comparar las imágenes de MCR y la histopatología se usaron biopsias cutáneas de 3mm teñidas con hematoxilina-eosina (H-E), tomadas a las 24 h de haber retirado el parche. En las imágenes realizadas inmediatamente después se observaron vesículas de diferentes tamaños, exocitosis de linfocitos y células de Langerhans; no se observó disrupción del EC. A las 24 h el EC seguía estando indemne, pero ya se observaba la presencia de células dendríticas y paraqueratosis. Las características más relevantes se vieron a las 48 como a las 72 h de haber retirado el parche, entre las que se encuentran: la disrupción del EC, la espongiosis, así como el hecho de que a una profundidad de 56μm se objetivaba una vascularización dérmica incrementada en volumen y diámetro (10-22μm) en comparación con la de la piel sana (5-10μm). Las características observadas en la MCR fueron corroboradas en las biopsias con H-E, lo que apoya la teoría de que la MCR podría ser usada como una herramienta diagnóstica complementaria. Dentro de las limitaciones del estudio, los autores mencionaron la variabilidad existente entre las características de los individuos y los alérgenos18, por lo que un mayor número de estudios serían necesarios para llegar a determinar si cada alérgeno podría desencadenar de forma específica una imagen diferente en la MCR.
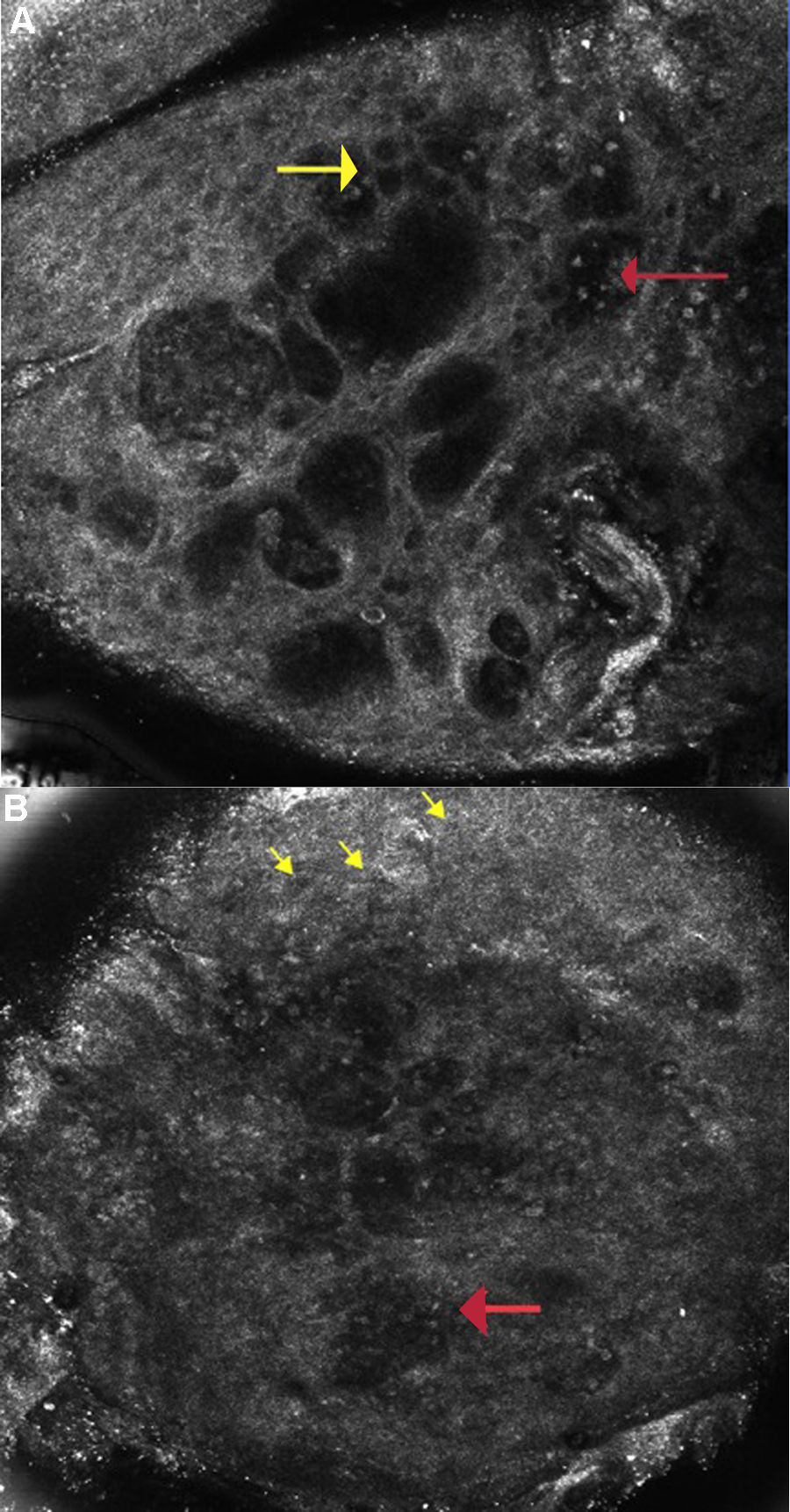
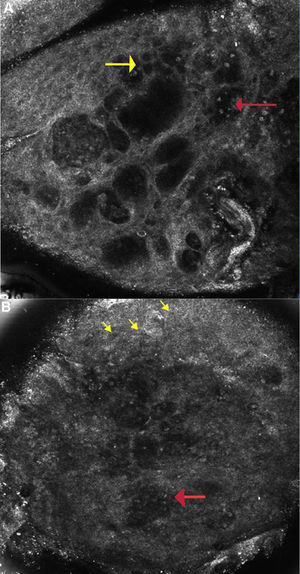
A pesar de que González et al. hicieron una adecuada correlación entre las características de la DAC en la MCR y a nivel histopatológico, la sensibilidad de la MCR para la detección de una DAC sigue siendo una incógnita. Astner et al., con la finalidad de determinar la sensibilidad de la MCR en la DAC, realizaron un estudio piloto en 16 pacientes con antecedentes de alergias cutáneas. Se colocaron parches con alérgenos específicos y controles (que contenían una solución salina taponada con fosfatos), que se retiraron a las 48 h. La evaluación clínica y de las imágenes de la MCR se realizó de manera independiente por 3observadores «ciegos», quienes utilizaron el método de «presence-absence». La valoración clínica se realizó a las 48 y 72 h, y las imágenes de MCR se capturaron a las 72 h después de retirar el parche. Las imágenes de la DAC en la MCR mostraban la presencia de una espongiosis en el estrato espinoso y granuloso, y exocitosis (con una sensibilidad del 100, el 95,8 y el 100%, respectivamente; y una especificidad del 92,6, el 96,3 y el 74,1%, respectivamente). El análisis por regresión logística indicó que el mejor predictor para diagnosticar la DAC fue la presencia de espongiosis en el estrato espinoso, lo que se correlacionó de forma positiva con la formación de vesículas en el estrato granuloso y en el estrato espinoso, presencia de espongiosis en el estrato granuloso e infiltrado inflamatorio a nivel del estrato espinoso y granuloso (fig. 2A). Los cambios a nivel del EC fue la característica menos sensible para diagnosticar la DAC, un hallazgo confirmado en estudios subsecuentes7. En uno de los participantes, la DAC a los alcoholes de lana (lanolina) se detectó por medio de la MCR a las 72 h de haber retirado el parche e incluso cuando la evaluación clínica fue negativa, lo que sugiere que la MCR sería incluso más sensible que la valoración clínica. En 3pacientes que presentaron puntuaciones clínicas con positividad dudosa al ser comparadas con las áreas control, no se evidenciaron cambios en la MCR que fuesen compatibles con la DAC, lo que sugiere que la MCR podría incluso ayudar a identificar lecturas falso positivas7.
A) Dermatitis alérgica de contacto: imagen de microscopia confocal de reflectancia (0,5×0,5mm) a nivel de la capa espinosa (∼ 30 μs de profundidad) mostrando espongiosis y exocitosis (flecha amarilla) y múltiples microvesículas acompañadas de linfocitos y queratinocitos disgregados (flecha roja). B) Dermatitis irritativa de contacto: imagen de microscopia confocal de reflectancia (0,5×0,5mm): muestra disrupción del estrato córneo con presencia de corneocitos disgregados y paraqueratosis temprana (flecha amarilla) y confluencia de microvesículas con infiltración de células inflamatorias (flecha roja).
Samhaber et al. identificaron características específicas de enfermedades vesículo-ampollosas cutáneas en la MCR, incluyendo la DAC. En 12 pacientes con por lo menos una reacción de DAC inequívoca a un alérgeno relevante se tomaron imágenes de MCR en el tercer o cuarto día de al menos 22 lesiones de DAC que tenían una PP positiva. De acuerdo con un artículo reciente, las características más frecuentes en la MCR fueron la presencia de espongiosis epidérmica, un incremento de la vascularización y un infiltrado inflamatorio más prominente a nivel del estrato espinoso y granuloso. En reacciones más intensas, la presencia de microvesículas/vesículas a nivel del estrato espinoso y granuloso se observaron en 17 de los 22 pacientes. Una paraqueratosis se objetivó en 8 lesiones de DAC, la que con frecuencia se asociaba a microvesículas/vesículas múltiples19.
Para determinar la existencia de alguna diferencia entre las reacciones alérgicas cutánea de acuerdo con los diferentes reactantes, Sakanashi et al. realizaron un estudio donde incluyeron a 8 voluntarios sanos y a 11 pacientes con sospecha de alergia de contacto a metales dentales. Los parches usados contenían soluciones acuosas de sulfato de níquel al 5% y cloruro de cobalto al 2%; los mismos se dejaron por 48 h. Se realizó una evaluación clínica, así como imágenes usando la MCR; dichas valoraciones se realizaron al inicio, a los 20 min, un día después y finalmente a 5días después de haber retirado el parche. Antes de la PP, no se objetivó ninguna diferencia en cuanto al grosor suprabasal epidérmico entre los pacientes y los voluntarios sanos. Los pacientes con DAC expuestos al níquel y al cobalto tuvieron un incremento significativo del grosor de la epidermis suprabasal comparados con voluntarios sanos. Así mismo, este signo se observó en todos los momentos de las diversas valoraciones, en comparación con los de la fase inicial. De manera notable, este cambio se pudo apreciar a los 20 min después de haber retirado el parche, lo que sugiere que la MCR puede detectar cambios muy tempranos en la DAC, incluso aquellos que aparecen antes de que los signos clínicos sean visibles. El grupo con una positividad al níquel se caracterizó por presentar un incremento generalizado del edema intercelular, presencia de acantosis y una gran formación de vesículas, lo que sugiere que probablemente existan diferencias específicas entre cada alérgeno. Los autores postularon que el níquel sería capaz de inducir una respuesta más intensa, induciendo una mayor proliferación de queratinocitos y un reclutamiento de células T. Entre las reacciones al cobalto con positividad dudosa (n=3), las imágenes de MCR de 2pacientes mostraban únicamente una disrupción superficial del EC y el tercer paciente únicamente presentó un incremento del grosor suprabasal epidérmico. Los autores afirman que la MCR, como en estos casos, ayudaría a distinguir entre las reacciones de DAC con positividad dudosa y las reacciones con resultado negativo, resaltando el potencial de la MCR para distinguir de forma precisa las reacciones verdaderas de DAC de las dudosas. Además, este estudio sugiere que diversos alérgenos podrían desencadenar diferentes reacciones cutáneas, las que, a su vez, tendrán distintas características en la MCR20.
Dermatitis irritativa de contactoEn 2estudios se intentó determinar la variabilidad de la DIC utilizando la MCR según los tipos de piel clasificados por Fitzpatrick; así mismo se buscó establecer si las reacciones irritativas subclínicas también se podrían detectar a través de la MCR. En un estudio realizado por Astner et al. donde se incluyó a 10 pacientes de raza caucásica sanos (Fitzpatrick II/III) y 10 afroamericanos (AA) sanos (Fitzpatrick V/VI), se realizó la PP utilizando líquido para lavavajillas «Ivory» y agua destilada como control negativo, dejando los parches por 24 h. Los pacientes caucásicos fueron expuestos al 10% del umbral y a un 5% por debajo del umbral de la solución irritante, mientras que los AA fueron expuestos a un 25% del umbral y a un 20% por debajo del umbral de la solución irritante. El umbral se definió como la menor concentración irritante a la cual se detectaba una reacción clínica, mientras que el nivel por debajo del umbral se definió como la mayor concentración irritante a la que la reacción cutánea no era clínicamente apreciable. Los autores reportaron que la mayor concentración necesaria para desencadenar eritema podría deberse tanto a la dificultad en precisar eritema en la piel más pigmentada, como a que la piel en AA sería más resistente a la exposición a irritantes. Las valoraciones con el TEWL e imagenológica (MCR) se realizaron a las 24 h después de haber retirado el parche. Las características de la DIC en la MCR se observaron en ambos grupos de pacientes, tanto en aquellos con concentraciones por encima y por debajo de los umbrales de irritación. Dentro de estas características se incluyeron: una disrupción del EC, paraqueratosis, presencia de corneocitos individualizados, espongiosis y formación de vesículas en el estrato granuloso y en el espinoso (fig. 2B). La MCR detectó características de la DIC incluso cuando la respuesta clínica no era visible o era muy sutil. Esto sugiere que las concentraciones irritativas bajas serían suficientes para desencadenar respuestas cutáneas que sean detectables con la PP en combinación con la MCR. En el análisis de las imágenes de la MCR, los pacientes de raza caucásica experimentaron una disrupción del EC significativamente más intensa, además de espongiosis a nivel epidérmico y paraqueratosis, en comparación con los pacientes AA. Los pacientes de raza caucásica también presentaron un incremento del TEWL «dependiente de la dosis», incluso en ausencia de una reacción clínica visible. Los autores sugirieron que el mayor umbral presentado por los pacientes AA, asociado a una menor TEWL, se atribuiría al mayor número de capas del EC, así como a una mayor cohesividad intercelular, en comparación con la piel de la raza caucásica21.
En un estudio de Hicks et al., donde se incluyó a 8 participantes con fototipos de Fitzpatrick II/III y 6 participantes con fototipos de Fitzpatrick V/VI, se realizó una PP utilizando lauril sulfato de sodio (LSS) al 4% por 6h, así como LSS al 4 y al 1%, y una solución salina taponada con fosfato por 24 h. La valoración clínica, la medición del TEWL y la realización de imágenes con la MCR se realizaron a las 6, 24 y 48 h después de la aplicación inicial. Contrariamente al estudio étnico realizado por Astner et al., en los AA se observó un grosor significativamente menor del EC en comparación con los pacientes caucásicos, pero solo detectable con el LSS al 4% a las 48 h. Esto sugiere que los AA podrían experimentar una mayor erosión irritativa inducida en comparación con los pacientes caucásicos. Por otro lado, contradice los hallazgos previos que señalaban que el EC más pigmentado estaría densamente estratificado y que la piel con mayor grosor sería menos penetrable por el LSS. Adicionalmente, se objetivó que la capa epidérmica suprapapilar en la raza caucásica después de haberse expuesto a LSS al 4% a las 24 y 48h, y a LSS al 1% a las 48 h, tenía un mayor grosor que la de los pacientes AA. Este hecho posiblemente se deba a la mayor intensidad de la espongiosis, así como a la formación de vesículas dentro de la epidermis. Además, explica la mayor gravedad de la reacción clínica evidenciada en los pacientes de raza caucásica. De manera interesante en ambos grupos, las características consideradas como positivas en la MCR fueron identificadas en las áreas expuestas, incluso en aquellos casos en los que las reacciones de DIC no se habían detectado clínicamente. Esto sugiere adicionalmente que la MCR será más sensible que la exploración clínica detectando reacciones de DIC tanto en individuos de piel pigmentada como en los de piel clara22.
La vitamina E es un antioxidante que va a atenuar la irritación, así como estimular los mecanismos reparatorios que siguen a la irritación. Por este motivo, Casari et al. buscaron determinar si es que un antioxidante como este podía tener algún efecto en las reacciones por DIC, así como si esos cambios podrían ser identificados por la MCR. Tres parches que contenían solución de LSS al 5% se colocaron en la cara ventral del antebrazo de 10 sujetos sanos por 24 h. El producto que contenía vitamina E (10% de tocoferoles y 0,3% de tocotrienos) se aplicó en una de las localizaciones antes de colocar el parche con LSS, así como en una de las localizaciones después de colocar el parche con LSS, y no se aplicó en la localización de control. La determinación del TEWL y las imágenes de la MCR se realizaron de forma inmediata, 30 min y 24 h después de haber retirado el parche. Inmediatamente después de haberse retirado el parche, el TEWL se incrementó en las localizaciones de control. A las 48 h, las localizaciones con vitamina E mostraron una TEWL menor que la observada en las localizaciones de control. A las 24 h se observó que había una menor presencia de disgregación de los cornecitos, queratinocitos en diana y anillos irregulares en el área de la vitamina E, en comparación con la de control. Esto sugiere que el efecto protector de la vitamina E en las zonas irritadas podía ser detectable con la MCR. A las 48 h había significativamente menos queratinocitos en diana y anillos irregulares en las localizaciones con vitamina E en comparación con los controles. Los autores no hicieron una correlación de las características objetivadas en la MCR con el sistema de valoración clínica. No obstante, este estudio demostró la utilidad y el potencial de la MCR para la monitorización de lesiones dinámicas, especialmente aquellas que están bajo tratamiento23.
Comparación de la dermatitis alérgica de contacto y la dermatitis irritativa de contactoDebido a las características tanto comunes como específicas de la DAC y la DIC reseñadas en los estudios previos, existe la necesidad de determinar si la MCR podría diferenciar de forma precisa la DAC de la DIC. Componentes del amonio cuaternario (Quats), como son el cloruro de benzalconio (BAC) y cloruro de bencetonio (BEC), son conocidos por provocar reacciones tanto alérgicas como irritativas, lo que dificulta la identificación de la real causa patogénica. Benjamin et al. intentaron distinguir por medio de la MCR las reacciones asociadas a la DAC como a la DIC. Se incluyó a 8sujetos, algunos con PP positiva previa al BAC (n=4), otros con antecedentes de dermatitis de manos postexposición a productos antibacterianos (n=4) y finalmente controles sanos (n=2). La PP que contenía BACaq (0,15% [en vehículo acuoso], BACpet (0,15% [en vehículo vaselinado]), BECaq (0,05%), BECpet (0,15%), BECaq (0,15%), BECaq (0,5%), un control irritativo positivo con LSSaq (2%) y un control negativo con agua desionizada se retiró a las 48 h. La valoración clínica e imagenológica utilizando la MCR se realizó a los 4 y 7 días después de haber retirado el parche. De manera similar a los hallazgos de estudios previos, las características observadas en la MCR de la DAC incluyeron una disrupción del EC, paraqueratosis y formación de microvesículas en el estrato granuloso, el estrato espinoso y la unión dermoepidérmica. Las reacciones clínicamente positivas para la BACaq al 0,15% (n=2) y BECaq al 0,15% (n=1) fueron las que se correlacionaron con las características de la DAC observadas en la MCR. Las reacciones clínicas positivas para BECpet al 0,15% (n=1) se observaron como «cambios sutiles» en la MCR, mientras que las reacciones clínicamente positivas para el BECaq al 0,5% (n=2) se observaron como «posibles» DAC en la MCR. No se evidenciaron reacciones clínicas tras la exposición al BACpet al 0,15% o BECaq al 0,05%24. Entre los 10 pacientes que fueron expuestos al LSSaq al 2%, 7 de los pacientes tuvieron reacciones clínicas positivas, presentando disrupción del EC, paraqueratosis e incremento del grosor epidérmico en el estudio con la MCR. Estos resultados sugieren que, de acuerdo con la MCR los Quats, se podrían considerar más alérgenos que irritantes propiamente dichos24.
Otro estudio realizado por Astner et al. comparó la combinación de los métodos de evaluación técnica (MCR, TEWL y una espectroscopia fluorescente de excitación [EFE]) intentando diferenciar la DAC de la DIC. Dieciocho individuos con antecedentes de DAC fueron parcheados con LSS al 4%, un alérgeno específico, solución salina taponada con fosfatos de control y un control negativo. Los parches se retiraron a las 48 h y los participantes fueron vistos en 3o más oportunidades (a los 2, 3, 4, 9, 14 o 21 días) después de haber retirado el parche. En cada visita 2observadores independientes realizaron una valoración clínica, una evaluación con MCR y TEWL14. La EFE de excitación/emisión de 295/345nm se corresponde con la presencia de proliferación epidérmica25-28 o un incremento de la actividad celular29, donde la banda de excitación a los 270nm se correlacionará con inflamación30. La formación significativa de micro vesículas a nivel del estrato granuloso y espinoso, pero en ausencia de cambios en el EC, se presentó con un pico máximo a las 96 h de retirado el parche, y persistió incluso después del noveno día, lo que indica que las reacciones de la DAC se prolongaran. La EFE no pudo diferenciar entre la DAC y el control, tanto a los 278nm como a los 298nm, por lo que la EFE por sí sola no podría distinguir entre las reacciones asociadas a la DAC o a la ausencia de ellas. No se observó una correlación significativa entre la valoración clínica y la medida de la TEWL o la MCR y la TEWL; sin embargo, no quedó del todo claro si la MCR se podría correlacionar con la evaluación clínica. A pesar de una correspondencia insignificante, un pico en la TEWL, un indicador de disrupción del EC, se retardó al cuarto día después de haber retirado el parche. Esto nos indica que la disrupción del EC ocurriría después en las lesiones de DAC, si comparadas con las reacciones de la DIC. Es posible que los estudios previos no hayan evidenciado la presencia de una disrupción significativa del EC en lesiones de la DAC, ya que las lecturas se realizaban en los primeros 7 días14. Las reacciones de la DIC se detectaron en las primeras 48 h después de retirar el parche, lo que sería anterior a la identificación de las reacciones de la DAC. Las características de la MCR incluían la disrupción del EC, la exocitosis, la espongiosis, la formación de vesículas y la necrosis epidérmica. A diferencia de la DAC, las zonas con DIC presentaron un incremento de la EFE a los 278nm y 298nm, datos que se correspondían con un incremento de la inflamación, la proliferación epidérmica y el incremento de la actividad celular, y que, a su vez, se correlaciona con las características presentes en las reacciones irritativas, como son el incremento de la espongiosis, la paraqueratosis y la hiperqueratosis. Al parecer, la EFE se puede usar en la detección de reacciones de DIC, pero no de DAC. La detección de una reacción precoz y su resolución versus la aparición de una reacción tardía y su resolución se corresponderían a las reacciones de DIC y de DAC en la MCR, respectivamente. La disrupción del EC, identificada en la MCR, y que se asocia a un incremento en el TEWL y en la EFE, fue el cambio estructural precoz clave para determinar la presencia de reacciones irritativas, las que, a su vez, ocurrirán mucho después en las reacciones asociadas a un alérgeno, y así ayudaría a distinguir entre ambas dermatosis14.
ConclusiónLa MCR está emergiendo como una nueva modalidad válida para el diagnóstico de enfermedades malignas cutáneas y dermatosis inflamatorias que en el pasado hubieran necesitado la realización de una biopsia o de la PP. La MCR tiene una sensibilidad y una especificidad comparables con las obtenidas con la PP utilizada en las DC (92% vs. 85% de especificidad y 82% vs. 85% de sensibilidad, respectivamente). Cuando se compara con la histología, la MCR puede identificar la presencia de disrupción del EC, paraqueratosis, espongiosis a nivel del estrato espinoso y granuloso, y exocitosis. En múltiples estudios se ha demostrado que la MCR será efectiva para el diagnóstico de una DIC tanto en pacientes de piel clara como oscura.
Así mismo, otras investigaciones han demostrado que la MCR puede incrementar la capacidad diagnóstica actual de la PP en las DC. La MCR puede detectar reacciones subclínicas de DAC y DIC. Además, podría ayudar a distinguir entre las reacciones de DAC dudosas y las negativas. La MCR es capaz de detectar los cambios patológicos que se producen entre minutos a un día después de realizada la PP. Esta detección precoz de la reacción cambiaría en un futuro la forma en que la PP se realiza. La MCR se podría utilizar en el seguimiento de los cambios dinámicos de la piel, así como durante el tratamiento y su completa resolución. Se ha demostrado que la MCR puede detectar diferencias entre la DAC y la DIC incluso cuando estas son morfológicamente similares, ayudando a distinguir entre estas 2entidades.
Muchos de los equipos de MCR utilizados en los estudios revisados en este artículo eran equipos tradicionales (no portátiles); por lo tanto, están limitados en la realización de imágenes en superficies cutáneas curvas de sujetos en vivo. El movimiento lateral se controlará mediante el uso de un dispositivo fijado tanto a la piel como al equipo, pero sin embargo, la respiración y el mínimo movimiento crearán artefactos de movimiento vertical que podrían afectar la recolección de la imágenes31. En la actualidad, los equipos de microscopia confocal portátiles reducen las limitaciones técnicas de los dispositivos de MCR tradicionales. Futuras generaciones de equipos de MCR podrían solucionar estas limitaciones técnicas. Una limitación adicional de la MCR es el costo, el cual se estima en unos 30.000 USD.
Hasta el momento actual, algunos estudios han identificado cuáles serán las características de la MCR que puedan detectar reacciones subclínicas y que ayuden a diferenciar lesiones morfológicamente similares (tabla 3). Se deberían realizar futuros estudios que busquen diferenciar la forma de presentación de la DAC según los fototipos de Fitzpatrick, de forma similar a lo que se ha hecho con la DIC. Así mismo se requieren estudios que optimicen el protocolo de la toma de imágenes de la MCR, así como determinen los parámetros del láser más adecuados para cada condición, localización anatómica y tipo de piel según la clasificación de Fitzpatrick. Se necesitarán estudios piloto que identifiquen cuáles son las características de la MCR en otras dermatosis inflamatorias y así comparar las características que presentan las diferentes entidades eritemato-descamativas.
Resumen de las características registradas en la MCR en la DAC y en la DIC
| DAC | DIC | |
|---|---|---|
| Disrupción del EC | X | X |
| Espongiosis | X (particularmente del EE) | X |
| Paraqueratosis | X | X |
| Formación de vesículas | X | X (microvesículas) |
| Exocitosis | X | X |
| Infiltrado de células inflamatorias | X | X |
| Vasodilatación | X | |
| Grosor epidérmico | X | |
| Edema intercelular | X | |
| Acantosis | X | |
| Corneocitos separados | X | |
| Queratinocitos en diana | X |
Los autores declaran no tener ningún conflicto de intereses.