La histoplasmosis es una micosis sistémica causada por el hongo dimorfo Histoplasma capsulatum. En pacientes inmunocomprometidos se produce una progresión de la enfermedad pulmonar y la diseminación en la piel y las meninges. Las manifestaciones clínicas aparecen cuando los niveles de linfocitos CD4 son menores a 150 células/μl.
La coccidioidomicosis es una micosis sistémica causada por Coccidioides immitis y Coccidioides posadasii. Se presenta como una forma pulmonar difusa o diseminada, con manifestaciones en el sistema nervioso central, los huesos y la piel, fundamentalmente.
La criptococosis está causada por diferentes especies de Cryptococcus species complex, Cryptococcus neoformans (var. neoformans y var. grubii) y Cryptococcus gattii, que conforman los 5 serotipos identificados: A, B, C, D y AD. Es una infección oportunista común en pacientes con VIH/sida, incluso si están en tratamiento con antirretrovirales.
El estudio histopatológico y el cultivo de cualquier lesión sospechosa son fundamentales para un correcto diagnóstico de estas micosis sistémicas en pacientes infectados por el VIH/sida.
Histoplasmosis is a systemic infection caused by the dimorphic fungus Histoplasma capsulatum. In immunocompromised patients, primary pulmonary infection can spread to the skin and meninges. Clinical manifestations appear in patients with a CD4+ lymphocyte count of less than 150 cells/μL.
Coccidioidomycosis is a systemic mycosis caused by Coccidioides immitis and Coccidioides posadasii. It can present as diffuse pulmonary disease or as a disseminated form primarily affecting the central nervous system, the bones, and the skin.
Cryptococcosis is caused by Cryptococcus neoformans (var. neoformans and var. grubii) and Cryptococcus gattii, which are members of the Cryptococcus species complex and have 5 serotypes: A, B, C, D, and AD. It is a common opportunistic infection in patients with human immunodeficiency virus (HIV)/AIDS, even those receiving antiretroviral therapy.
Histopathologic examination and culture of samples from any suspicious lesions are essential for the correct diagnosis of systemic fungal infections in patients with HIV/AIDS.
Las micosis sistémicas pueden dividirse en las causadas por hongos patógenos sistémicos (Blastomyces dermatitidis, Coccidioides immitis, Histoplasma capsulatum [var. capsulati y duboisii] y Paracoccidioides brasiliensis) y las originadas por un número cada vez mayor de hongos oportunistas, normalmente relacionados con el ambiente. Cada uno de esos hongos es un microorganismo térmicamente dimorfo, que existe en 2 fases, de manera que el paso de la fase natural a la hística se relaciona normalmente con un cambio de temperatura de 25 a 37°C. Con excepción del Coccidioides immitis, que forma esférulas con endosporas, la fase natural de cada uno de esos hongos es un moho, y la hística una levadura1–4.
Todos estos hongos son principalmente microorganismos patógenos pulmonares. La inhalación de conidios hacia el aparato respiratorio es la vía de entrada más probable. Las manifestaciones cutáneas por lo general dependen de la infección diseminada, aunque en algunas ocasiones puede deberse a la implantación traumática de materia contaminada por el hongo. La mayoría de las micosis profundas son características de ciertas regiones de Norteamérica, Sudamérica, Centroamérica y África, aunque actualmente, con el crecimiento de las poblaciones con alteraciones inmunitarias graves —entre las que incluimos el sida—, se han convertido en las infecciones oportunistas más frecuentes en estos pacientes, con sus correspondientes manifestaciones cutáneas. Estas últimas son importantes por 2 razones; por un lado, pueden preceder a otras manifestaciones clínicas, como la pulmonar o la neurológica, lo que ayudaría a una precocidad en la instauración del tratamiento, y por otro, es muy fácil realizar una biopsia cutánea —procedimiento mínimamente invasivo y con gran rentabilidad diagnóstica que permite obtener muestras para el cultivo microbiológico y para el estudio histopatológico—, que es necesaria y en ocasiones imprescindible para llegar a un diagnóstico correcto. Por todo ello, consideramos que este trabajo será de ayuda para nuestros dermatólogos más jóvenes y para todos aquellos interesados en el estudio de las micosis. Nos hemos centrado en 3 patologías: histoplasmosis, coccidioidomicosis y criptococosis porque son las más prevalentes y sobre las que tenemos más información y experiencia.
Hemos realizado una revisión exhaustiva de la bibliografía existente acerca de los datos epidemiológicos, clínicos, diagnósticos y terapéuticos de las micosis sistémicas endémicas, histoplasmosis, coccidioidomicosis y criptococosis en pacientes adultos infectados por el virus de la inmunodeficiencia humana (VIH)/sida, desde la aparición de los primeros casos hasta finales del año 2011. También hemos incluido datos e imágenes procedentes de nuestra propia experiencia.
HistoplasmosisEtiologíaLa histoplasmosis es causada por el hongo dimorfo Histoplasma capsulatum, que tiene 2 variedades patógenas para el hombre: var. duboisii, que predomina en África, y var. capsulatum, que se presenta en América, con 2 focos principales, en Norteamérica y Sudamérica. Sin embargo, la enfermedad tiene una distribución mundial5. El hongo se encuentra en el excremento de murciélagos y de otras aves, y puede persistir en el ambiente por un tiempo prolongado.
Mecanismo de transmisiónLa enfermedad se adquiere por inhalación de la forma micelial y es primariamente pulmonar. En el 95% de los pacientes se resuelve espontáneamente y deja memoria inmunológica6. En la patogénesis posterior a la inhalación de los conidios se produce una neumonitis localizada, seguida de diseminación hematógena a las 2 semanas, y una respuesta inmunitaria celular a las 3 semanas. En los pacientes con sida, al disminuir los niveles de CD4 puede progresar o reactivarse la afección7.
EpidemiologíaDesde 1987 la histoplasmosis fue aceptada como una enfermedad definitoria de sida. Sin embargo, a partir de la introducción de la terapia antirretroviral (TARV), se ha observado un control superior y una disminución en la incidencia de las infecciones fúngicas en general, que en la actualidad representa un 20-25% de lo comunicado en la década de los noventa8–11.
Sintomatología generalLa sintomatología de la histoplasmosis pulmonar aguda incluye fiebre, afectación del estado general, pérdida de peso, tos y dolor torácico. Puede seguir un curso rápido con afección del sistema reticuloendotelial, casi siempre fatal. La afección del sistema nervioso central (SNC) puede ser primaria o acompañar al 5-10% de los casos diseminados, manifestándose como meningitis, encefalitis o síndromes vasculares7,12. El 50% de los pacientes con formas diseminadas tienen compromiso adrenal, pero solo en el 7% se llega a presentar insuficiencia suprarrenal. Puede haber daño ocular, como panoftalmitis y uveítis. Se ha descrito el síndrome de histoplasmosis ocular posterior a uveítis o coroiditis, que en la mayoría de los casos (90%) es unilateral13.
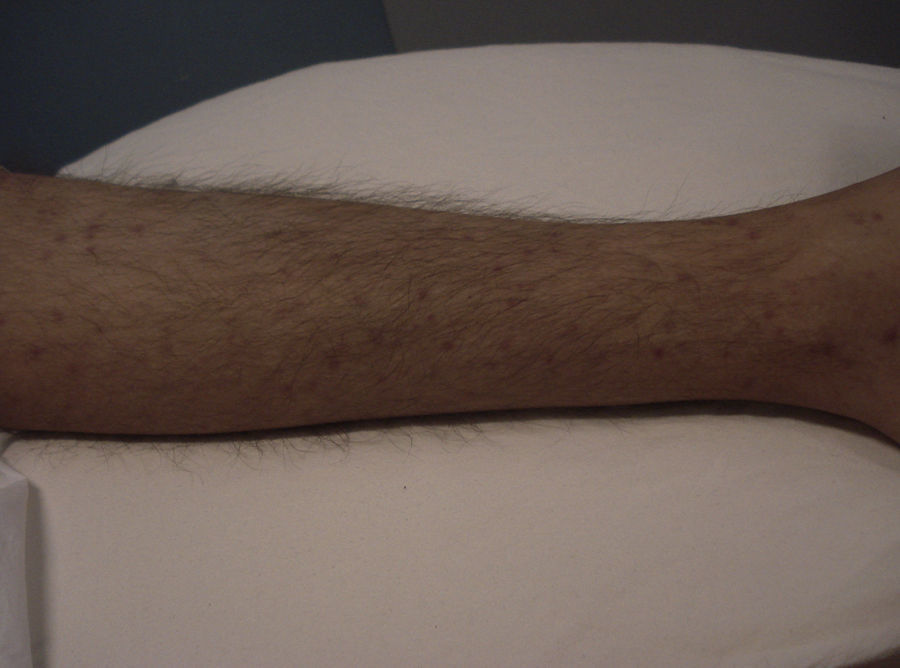
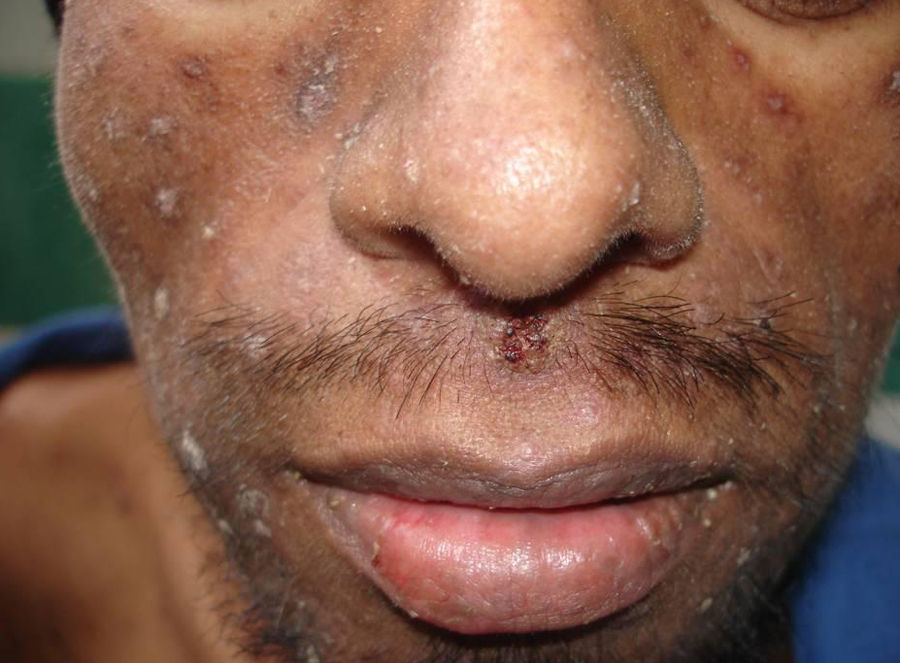
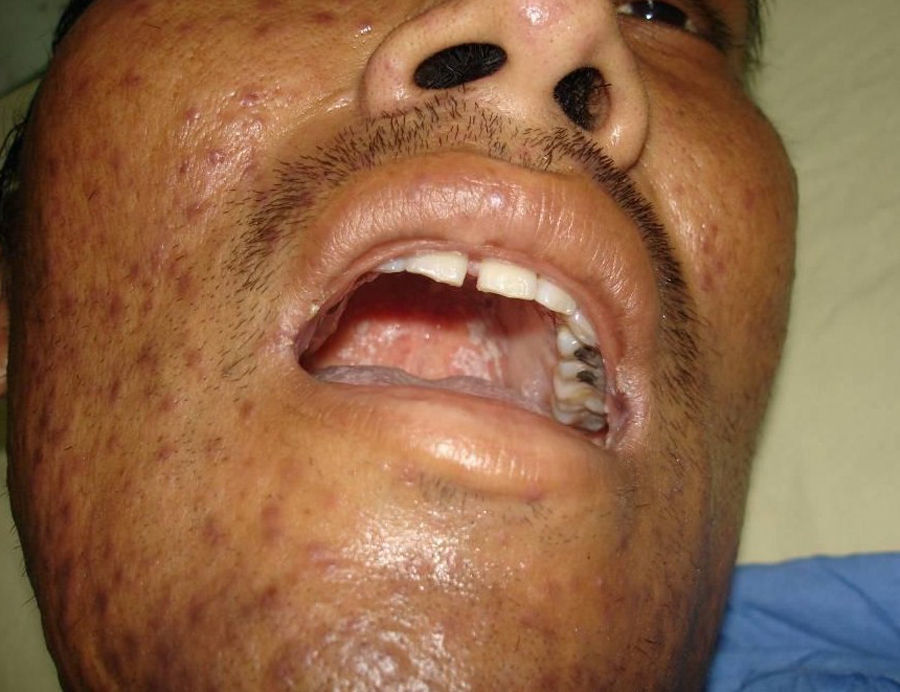
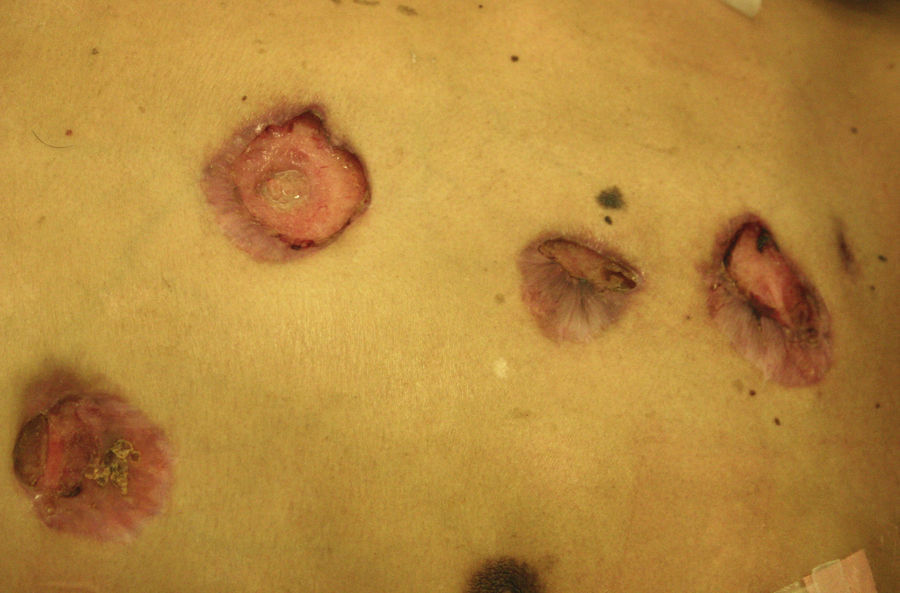
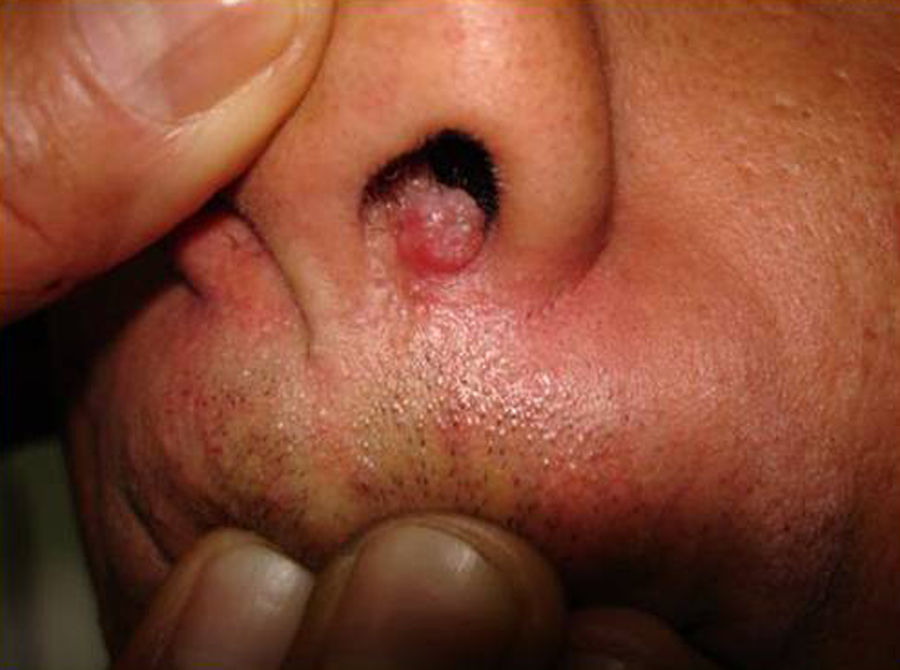
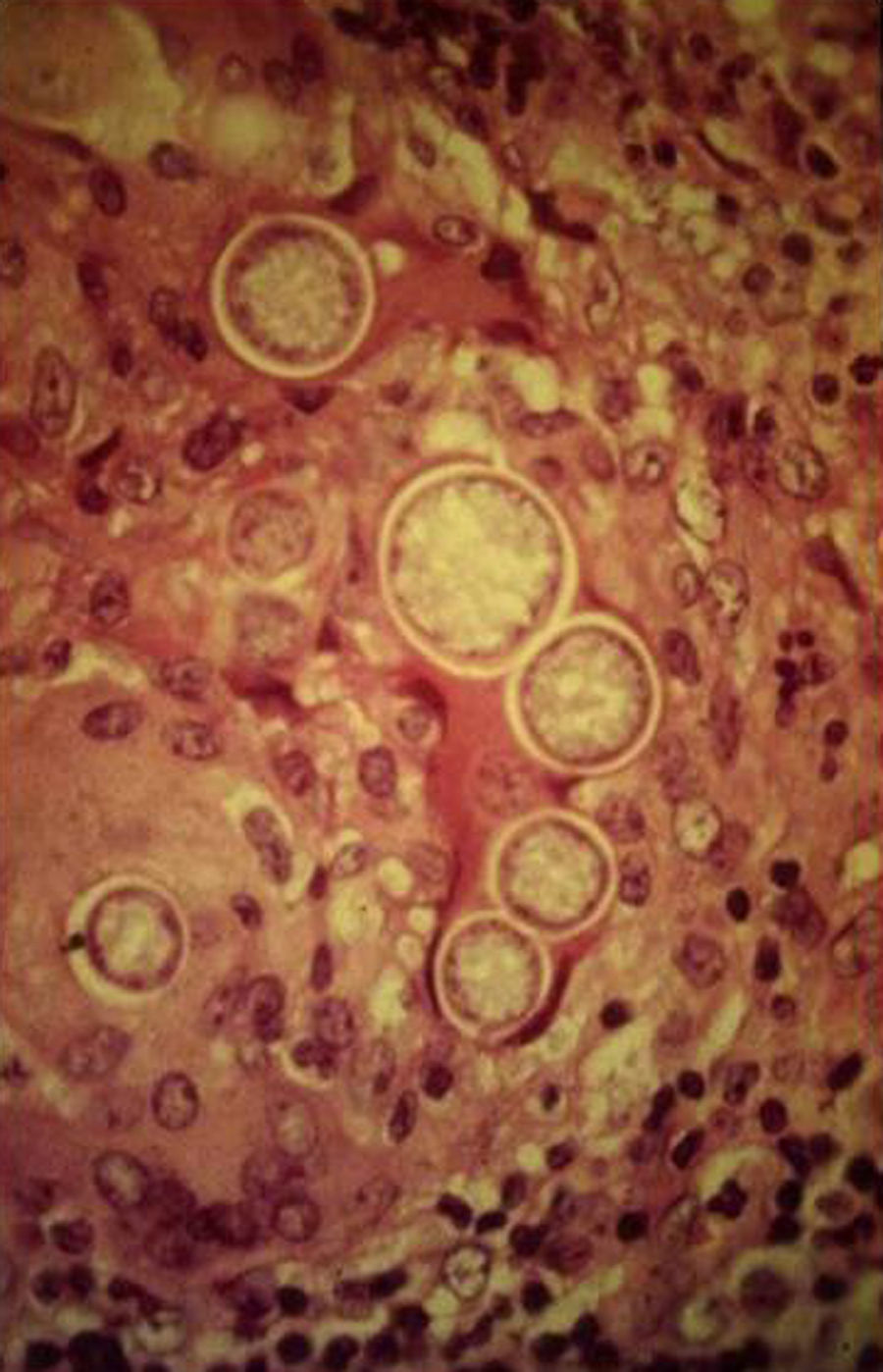
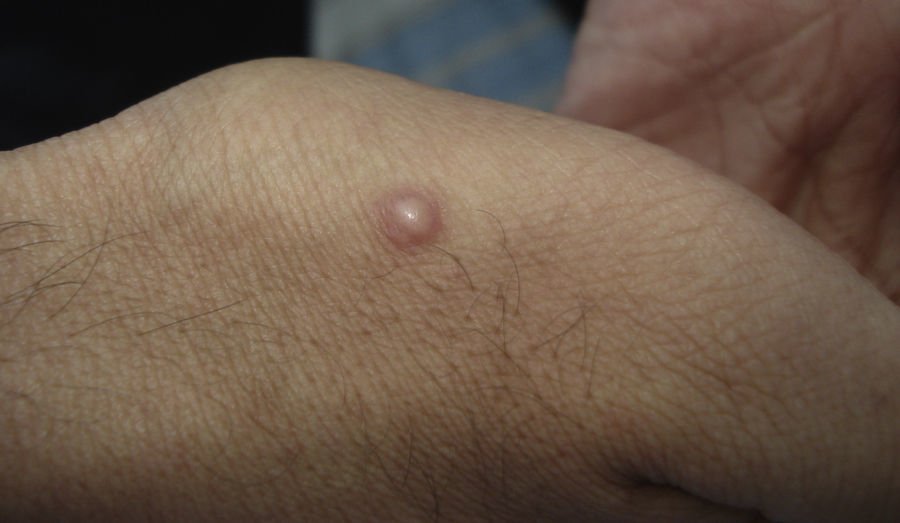
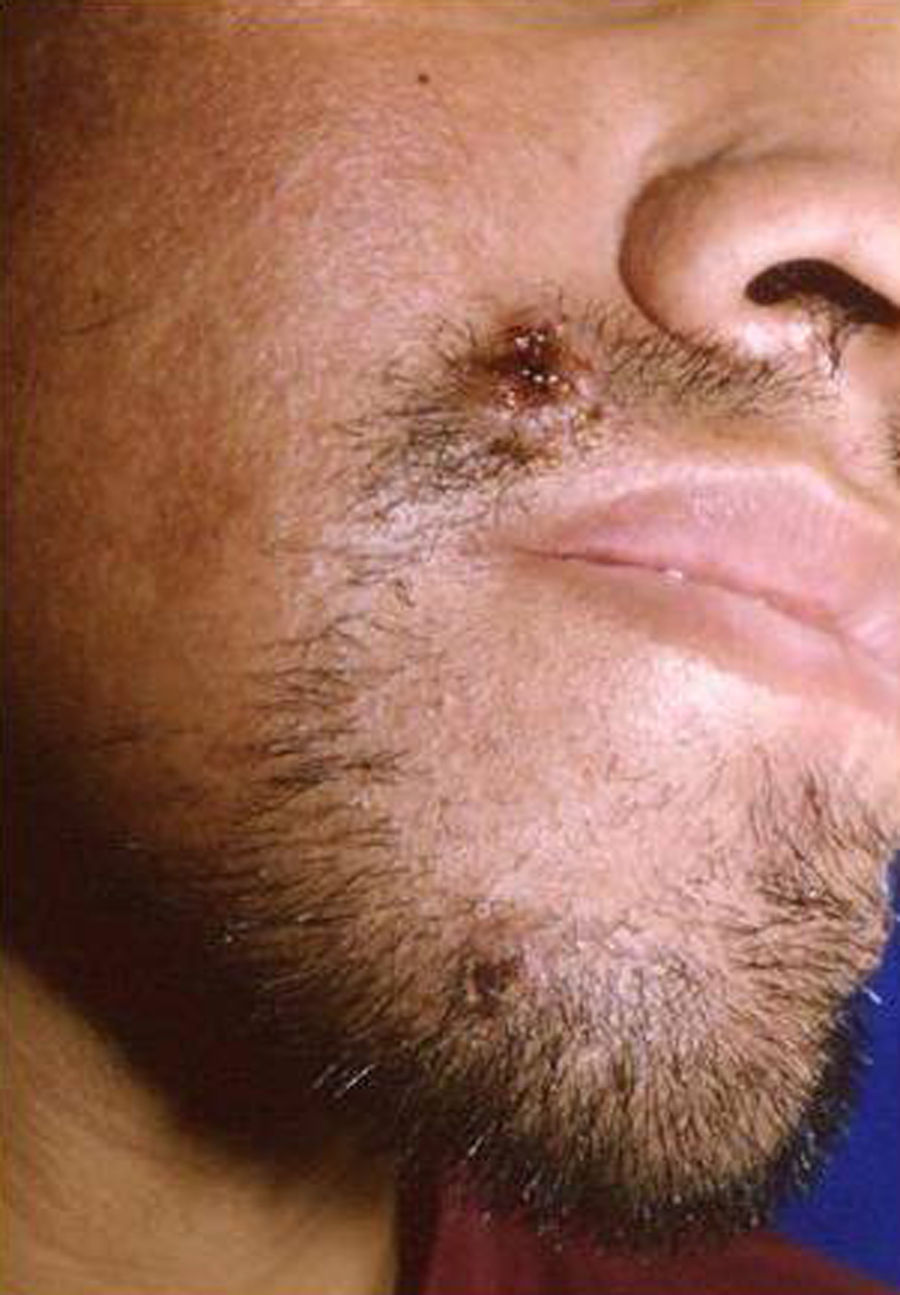
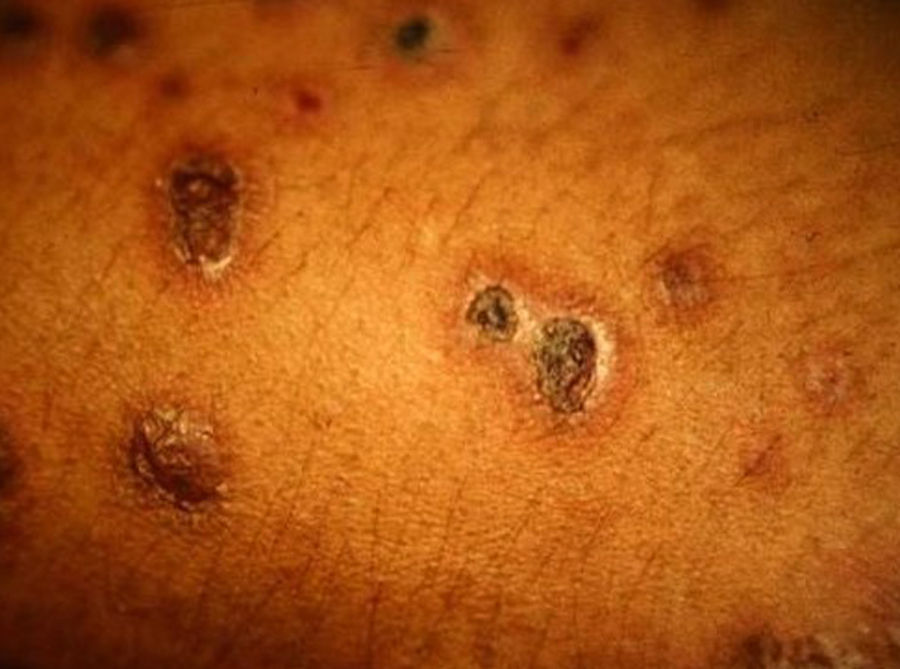
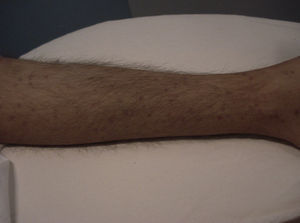
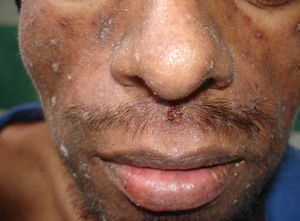
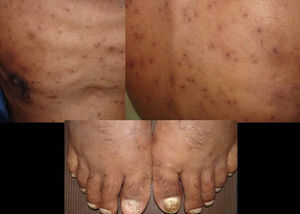
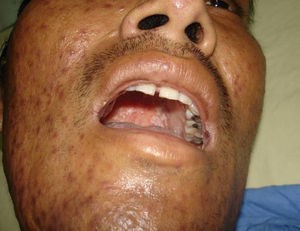
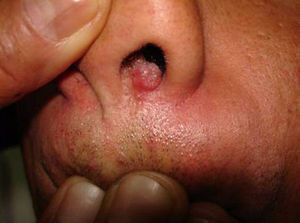
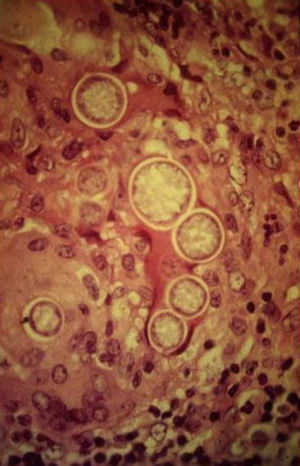
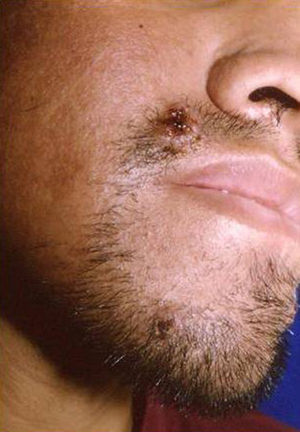
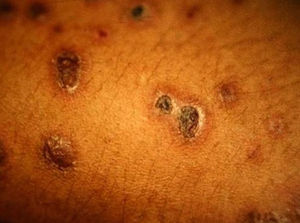
Manifestaciones cutáneasLas lesiones cutáneas primarias son infrecuentes. En el 70-80% de los casos la afección de la piel se presenta en el contexto de histoplasmosis diseminada (figs. 1–3). Se observan sobre todo en adultos y con más frecuencia en Sudamérica; se cree que allí las cepas son más virulentas. No hay lesiones específicas que afecten a la piel. En 2/3 de los pacientes se observa la afectación de las mucosas, sobre todo en el área de la orofaringe (fig. 4). De manera reactiva la histoplasmosis pulmonar puede acompañarse de eritema nudoso o de un eritema polimorfo12.
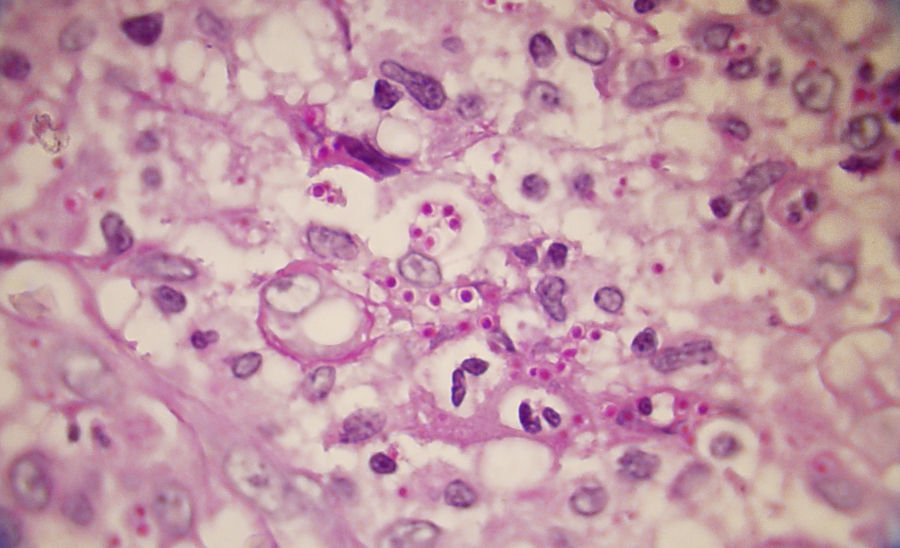
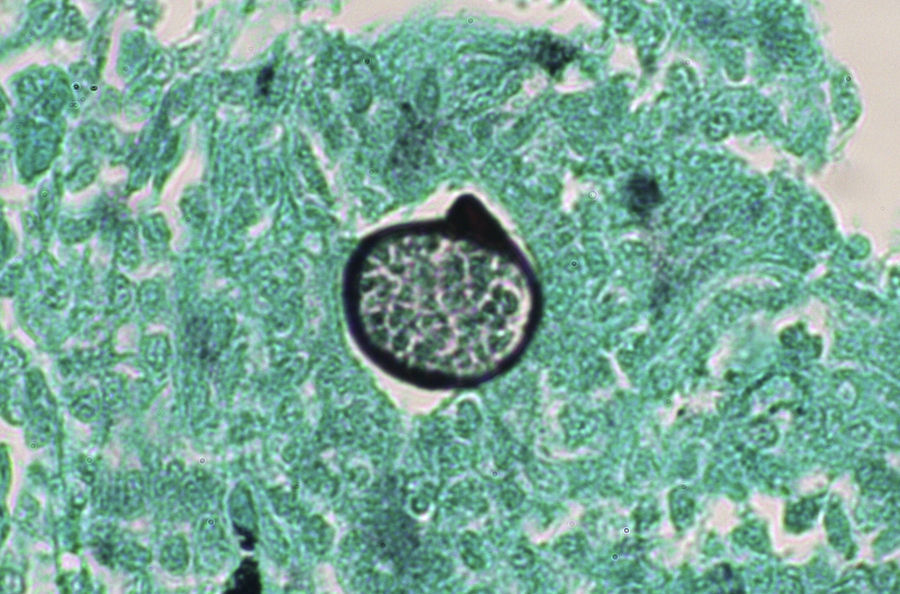
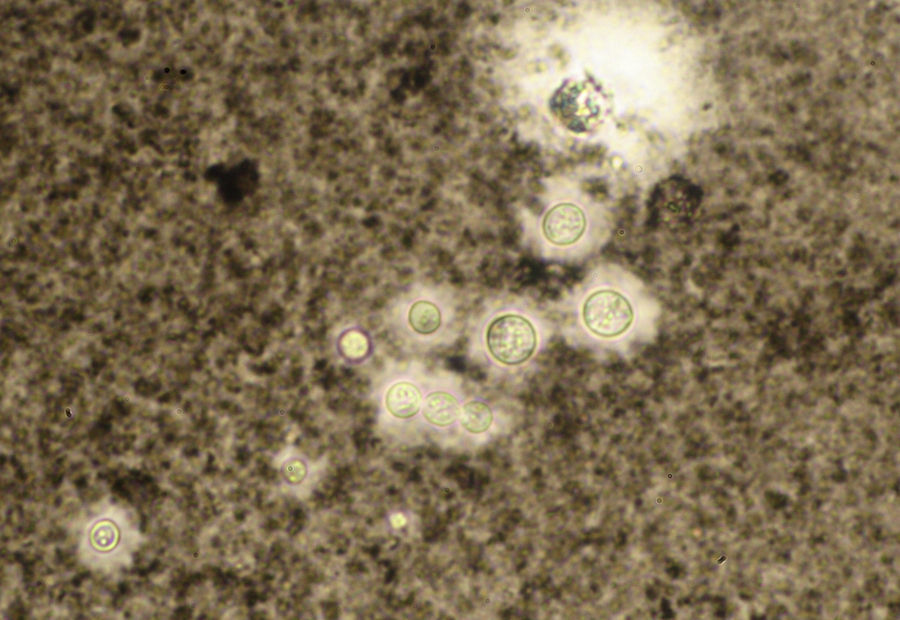
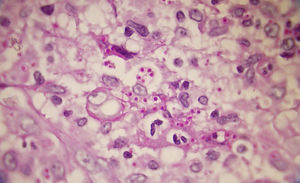
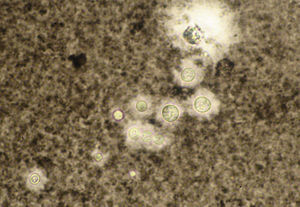
Los estudios de laboratorio que apoyan el diagnóstico de histoplasmosis incluyen la presencia de anemia, leucopenia, trombocitopenia, alteración de las pruebas de función hepática y elevación de LDH y ferritina.A partir de las lesiones, de muestras de médula ósea o de material obtenido por expectoración o broncoscopia, se puede realizar un frotis con tinción de May-Grünwald-Giemsa o PAS, lo que facilita la visualización de las levaduras (fig. 5)14. En los pacientes con sida la intradermorreacción no es de mucha utilidad. Aunque el estudio histopatológico con tinciones de PAS, Giemsa o Gomori-Grocott es de gran ayuda, el cultivo continúa siendo la prueba de oro para el diagnóstico.
En la actualidad existen diferentes técnicas de laboratorio que permiten la identificación de anticuerpos por reacción en cadena de la polimerasa (PCR), inmunodifusión o fijación de complemento. Estas llegan a ser positivas en el 90% de los pacientes con histoplasmosis pulmonar aguda sin inmunosupresión, aunque comúnmente son negativas en los pacientes con sida15.
Finalmente, conviene recordar que la determinación de un antígeno polisacárido en el suero y la orina es una prueba más sensible y rápida, aunque puede tener falsos positivos en pacientes con otras enfermedades micóticas, especialmente blastomicosis15,16.
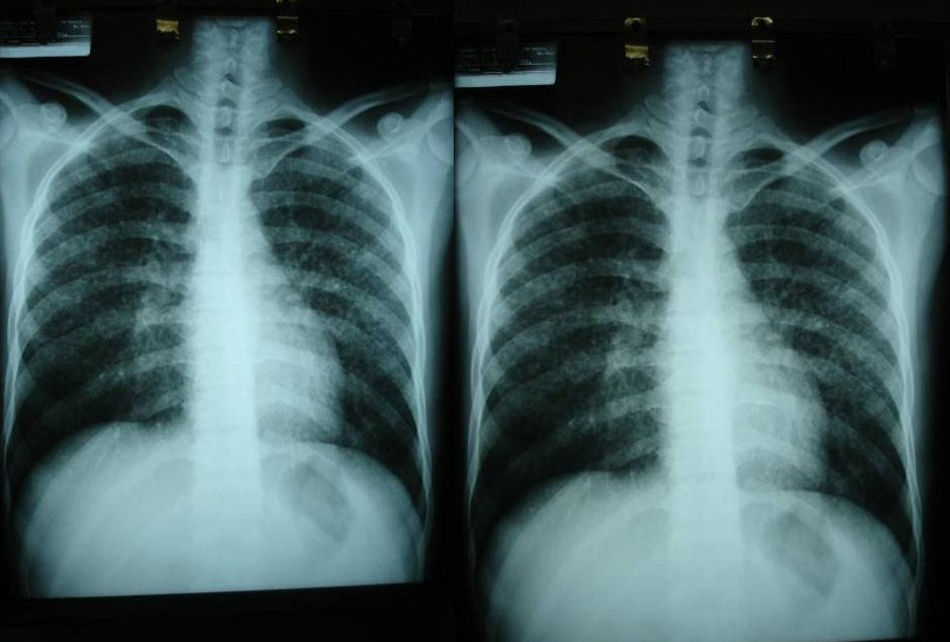
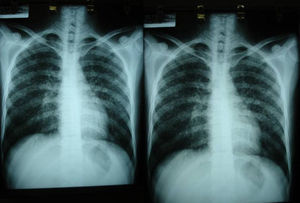
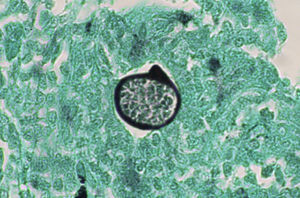
Las pruebas de imagen pueden no ser positivas en los pacientes con histoplasmosis diseminada. Sin embargo, es importante señalar que H. capsulatum se ha aislado de los pulmones de pacientes con sida, por lo que su negatividad no excluye la enfermedad. Se utilizan fundamentalmente para determinar el grado de extensión de la enfermedad (fig. 6).
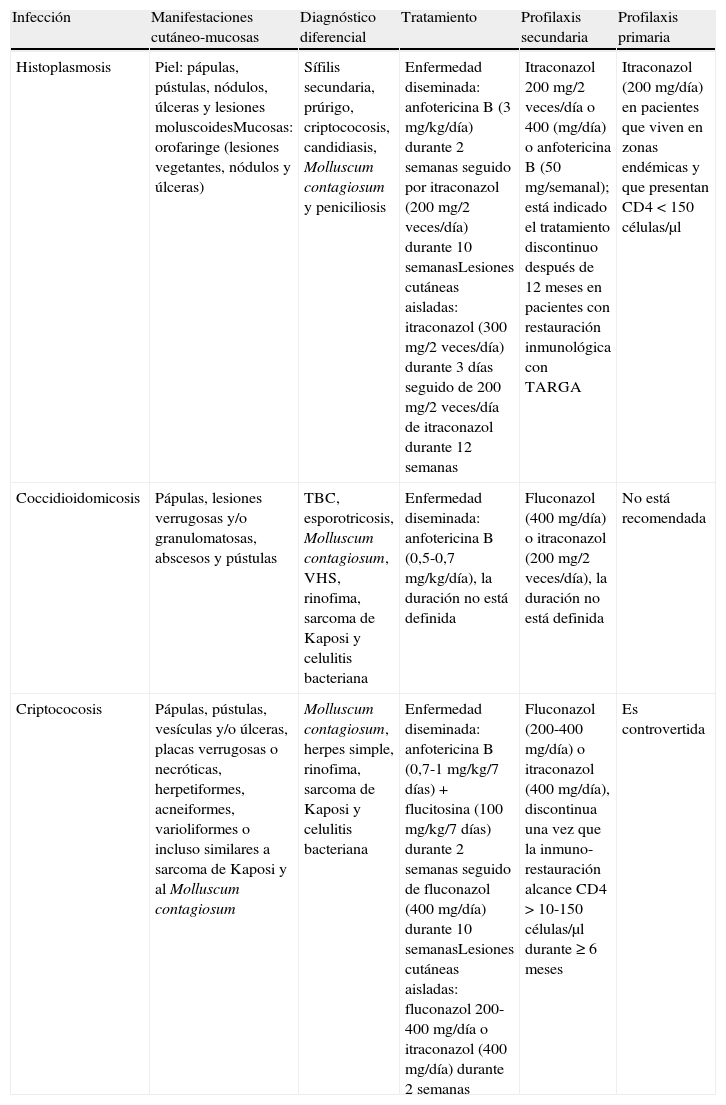
Diagnóstico diferencialEl diagnóstico diferencial incluye la sífilis secundaria y el Molluscum contagiosum, entre otros (tabla 1)16,17.
Tratamiento y profilaxis de las infecciones fúngicas endémicas
| Infección | Manifestaciones cutáneo-mucosas | Diagnóstico diferencial | Tratamiento | Profilaxis secundaria | Profilaxis primaria |
| Histoplasmosis | Piel: pápulas, pústulas, nódulos, úlceras y lesiones moluscoidesMucosas: orofaringe (lesiones vegetantes, nódulos y úlceras) | Sífilis secundaria, prúrigo, criptococosis, candidiasis, Molluscum contagiosum y peniciliosis | Enfermedad diseminada: anfotericina B (3 mg/kg/día) durante 2 semanas seguido por itraconazol (200 mg/2 veces/día) durante 10 semanasLesiones cutáneas aisladas: itraconazol (300 mg/2 veces/día) durante 3 días seguido de 200 mg/2 veces/día de itraconazol durante 12 semanas | Itraconazol 200 mg/2 veces/día o 400 (mg/día) o anfotericina B (50 mg/semanal); está indicado el tratamiento discontinuo después de 12 meses en pacientes con restauración inmunológica con TARGA | Itraconazol (200 mg/día) en pacientes que viven en zonas endémicas y que presentan CD4<150 células/μl |
| Coccidioidomicosis | Pápulas, lesiones verrugosas y/o granulomatosas, abscesos y pústulas | TBC, esporotricosis, Molluscum contagiosum, VHS, rinofima, sarcoma de Kaposi y celulitis bacteriana | Enfermedad diseminada: anfotericina B (0,5-0,7 mg/kg/día), la duración no está definida | Fluconazol (400 mg/día) o itraconazol (200 mg/2 veces/día), la duración no está definida | No está recomendada |
| Criptococosis | Pápulas, pústulas, vesículas y/o úlceras, placas verrugosas o necróticas, herpetiformes, acneiformes, varioliformes o incluso similares a sarcoma de Kaposi y al Molluscum contagiosum | Molluscum contagiosum, herpes simple, rinofima, sarcoma de Kaposi y celulitis bacteriana | Enfermedad diseminada: anfotericina B (0,7-1 mg/kg/7 días) + flucitosina (100 mg/kg/7 días) durante 2 semanas seguido de fluconazol (400 mg/día) durante 10 semanasLesiones cutáneas aisladas: fluconazol 200-400 mg/día o itraconazol (400 mg/día) durante 2 semanas | Fluconazol (200-400 mg/día) o itraconazol (400 mg/día), discontinua una vez que la inmuno-restauración alcance CD4 >10-150 células/μl durante ≥6 meses | Es controvertida |
TARGA: terapia antirretroviral de gran actividad; TBC: tuberculosis; VHS: virus del herpes simple.
Las guías internacionales del tratamiento de la histoplasmosis en casos de sujetos con sida han cambiado a partir de la introducción de la TARV. De hecho, se considera parte fundamental de la prevención y control de las micosis oportunistas en estos pacientes9 (tabla 1).
CoccidioidomicosisEtiologíaCoccidioides spp. es un hongo dimorfo imperfecto; en su modalidad parasitaria constituye una esférula con endosporas y en la forma saprofita es un moho de micelio tabicado que produce conidios tálicos que alternan con células disyuntoras, degeneradas y vacías. La coccidioidomicosis es una micosis sistémica causada por el género Coccidioides, que tiene 2 especies, C. immitis y C. posadasii5.
Mecanismo de transmisiónSe adquiere por inhalación de las artrosporas, que se encuentran en el suelo o en cultivos de laboratorio. Una vez inhaladas se alojan en los alveolos pulmonares y activan la primera línea de defensa, a cargo de polimorfonucleares y macrófagos. Asimismo, se activa el sistema del complemento. Los macrófagos fagocitan los conidios, pero no pueden lisarlos hasta que son activados por los linfocitos Th1. También se activan eosinófilos y mastocitos, que liberan grandes cantidades de inmunoglobulina E. El hongo, además de poseer un elevado potencial biótico (cada esférula puede producir hasta 800 endosporas), cuenta con mecanismos de defensa que lo protegen de la respuesta inmunitaria del huésped, como una metaloproteinasa (MPE1) que degrada una glucoproteína de pared (SOWgp) en la superficie de las endosporas, que interactúa con los anticuerpos y lleva a la opsonización del parásito. De este modo, evita el reconocimiento de esta molécula por el sistema inmunitario, lo que contribuye a la persistencia del microorganismo patógeno en el huésped. C. posadasii produce amoníaco, que favorece la infección, dado que ese metabolito alcaliniza el pH de los tejidos; en experimentos in vivo se ha comprobado que sintetiza melanina5.
No se transmite de una persona a otra porque no se adquiere de las esporas presentes en la expectoración o los exudados, pero existe transmisión perinatal. La infección del aparato genitourinario de la madre provoca afección de la placenta y endometriosis coccidioidal, con aspiración del líquido amniótico infectado y transmisión intraútero o perinatal18–22.
EpidemiologíaLa coccidioidomicosis es la micosis respiratoria más frecuente y grave. Se calcula que se producen de 45.000 a 100.000 casos por año; el 50% de ellos proviene del sur de los Estados Unidos5,23. En las últimas 2 décadas se han encontrado varias zonas endémicas: el noroeste de Brasil, México, Guatemala, Honduras, Venezuela y Argentina24.
Sintomatología generalLos primeros informes de coccidioidomicosis asociados a sida aparecieron unos años después de los casos iniciales del síndrome. La afección es progresiva y puede cursar con insuficiencia respiratoria grave25–27.
La coccidioidomicosis se ha encontrado en casi todos los órganos: ojos, laringe, tiroides, peritoneo, próstata, riñones y útero, así como prótesis y derivaciones peritoneales. La afección ósea es poco frecuente. Los discos vertebrales se afectan rara vez, pero son comunes las masas paraespinales con fístulas. Otros huesos que se afectan son el cráneo, las costillas, la tibia, el fémur, los metacarpianos y los metatarsianos.
La diseminación al SNC es la forma más grave de la infección. Suele presentarse como una meningitis crónica granulomatosa, involucra a las meninges basilares y puede cursar con hidrocefalia28,29.
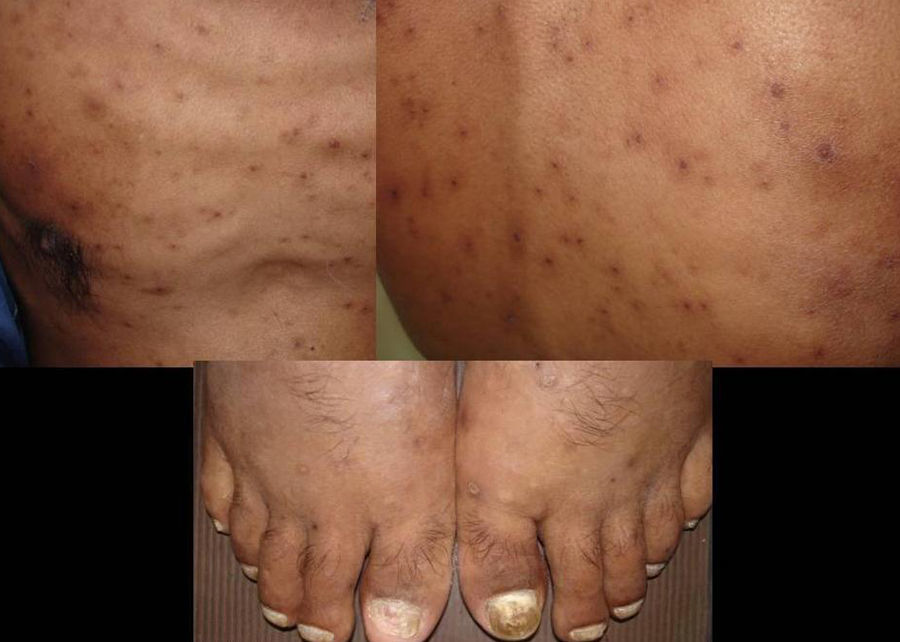
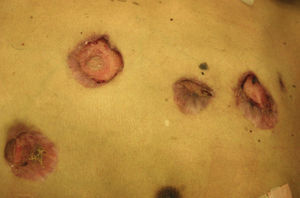
Manifestaciones cutáneasLa piel es el sitio más común de enfermedad diseminada. Las manifestaciones son variadas y suelen confluir en placas (figs. 7 y 8). Las lesiones granulomatosas presentan mínima inflamación. Ante una lesión ulcerada debe considerarse la posibilidad de una fístula30.
Para el diagnóstico se usan intradermorreacciones —se emplea coccidioidina, o esferulina, que es más sensible—, que se hacen positivas desde los 2 días a las 3 semanas de la infección y persisten durante años5. En pacientes con sida son negativas hasta en el 98% de los casos en las primeras 48-72 h26.
Las pruebas serológicas son menos fiables en pacientes con infección por el VIH, aunque son positivas en el 68-74% de los casos. Sin embargo, las pruebas de ELISA y de fijación del complemento tienen una sensibilidad elevada. Las pruebas de precipitación en tubo son muy específicas. La aglutinación de partículas de látex es positiva en el 70% de los casos.
Se pueden emplear, también, técnicas de anticuerpos fluorescentes, anticuerpos monoclonales, enzimoinmunoanálisis, PCR e hibridación in situ.
En laboratorios de alta seguridad se pueden obtener cultivos. En el análisis microscópico se observan hifas delgadas y tabicadas, con artrosporas rectangulares5.
La biopsia de las lesiones de piel y de otros tejidos teñidas con hematoxilina y eosina (fig. 9) con frecuencia demuestran esférulas, que miden de 10 a 80 mμ, con pared retráctil doble y endosporas de 2 a 5 mμ, pero se visualizan mejor con tinciones de PAS y Gomori-Grocott (fig. 10). En la histopatología se identifica una reacción granulomatosa alrededor de las esférulas5.
En el líquido cefalorraquídeo (LCR) el hongo se aísla solo en la mitad de los casos: el diagnóstico se confirma con un resultado positivo de una prueba con anticuerpos IgG26. Los estudios radiográficos no son específicos en estos pacientes5.
Diagnóstico diferencialEl diagnóstico diferencial debe hacerse, en primer lugar, con la tuberculosis en sus diferentes manifestaciones clínicas y, en segundo lugar, con la esporotricosis, entre otros diagnósticos (tabla 1)31.
TratamientoEl tratamiento de las diferentes formas de coccidioidomicosis está en debate. Dada la profunda variabilidad de los resultados y la escasez de estudios controlados, es difícil proponer recomendaciones universales para el tratamiento de cada manifestación clínica en pacientes con VIH, sobre todo respecto a la duración de este (tabla 1). Se ha publicado el uso exitoso de interferón gamma en un caso de coccidioidomicosis diseminada, a una dosis de 50μg/m2, 3 veces por semana29. Los pacientes con pruebas serológicas que son inicialmente negativas pueden tener un retraso en la mejoría y los análisis no se correlacionan forzosamente con la evolución de la enfermedad. La duración de la terapia no se ha definido. Sin embargo, se recomienda que los pacientes sean tratados por lo menos durante un año32,33.
CriptococosisEtiologíaEl género Cryptococcus species complex está compuesto por muchas especies. De ellas, solo C. neoformans (var. neoformans y var. grubii) y C. gattii, que conforman los 5 serotipos identificados —A, B, C, D y AD— afectan al ser humano1. Tienen una pared firme, esférica o elíptica y, de manera característica, presentan una cápsula gruesa que es visible con tinta china en preparaciones en fresco. La cápsula se compone de polisacáridos, principalmente glucoronoxilomanana (90-95%), galactoxilomanana (5-8%) y manoproteínas (<1%)34.
Mecanismo de transmisiónC. neoformans es ubicuo en el medio ambiente cosmopolita y se relaciona con los excrementos de palomas y, en menor medida, el guano de murciélagos, mientras que la especie C. gattii está relacionada con algunos árboles y restringida a zonas tropicales y subtropicales34–38. La penetración se realiza fundamentalmente por la vía respiratoria y más raramente por el aparato gastrointestinal y la piel2. Una vez dentro del huésped la levadura puede variar la composición y el tamaño de la cápsula para aumentar sus posibilidades de resistir o evadir los mecanismos de defensa del huésped, ya que conforman el principal factor de virulencia. Esta le confiere capacidad para evadir la fagocitosis, modificar su fenotipo y, en algunos casos, permite la producción de melanina39.
EpidemiologíaLa criptococosis es una infección oportunista común en pacientes con VIH/sida; de hecho, es la infección fúngica diseminada más frecuente en estos casos. Se ha identificado que el principal factor de riesgo es la disfunción inmunitaria celular, por lo que este grupo de pacientes es muy susceptible, a pesar del tratamiento con TARV40.
Cryptococcus neoformans var. neoformans (serotipo D) y especialmente la var. grubii (serotipo A) son las especies involucradas en la infección de pacientes inmunocomprometidos, incluidos los sujetos con infección por el VIH, cáncer o receptores de trasplantes de órganos5. Por estos motivos, recientemente se ha considerado C. gattii una especie emergente en el noroeste de Norteamérica, que infecta principalmente a pacientes inmunocompetentes.
En Europa C. neoformans es causante del 20% de las infecciones en los pacientes con VIH/sida. En África es la infección inicial en el 20-30% de los pacientes y causa el 20-40% de la mortalidad atribuible al sida. Incluso la criptococosis extrapulmonar se considera una infección que define el sida. Se detecta aproximadamente en el 4,3% de los casos y se presenta con mayor frecuencia en la piel, la próstata y los ojos. La meningitis por criptococo es más habitual en pacientes con recuento CD4<100 células/μl41.
Sintomatología generalLa criptococosis es causa de neumonía en la mayoría de los casos, pero también se informan criptococomas pulmonares y puede diseminarse por vía hematógena (10%) a otros órganos, principalmente al SNC. Es frecuente que cuando se diagnostica ya se encuentre diseminada y además se presenten datos de meningitis hasta en el 60-70% de los pacientes. La meningitis se inicia insidiosamente; hay disminución de la audición, alteración de las funciones mentales superiores, cefalea, fatiga, mareo, irritabilidad y/o alteraciones en la coordinación de movimientos. Otros órganos que pueden estar implicados son el riñón, el hígado y el tracto genitourinario. También puede haber afectación del sistema óseo42.
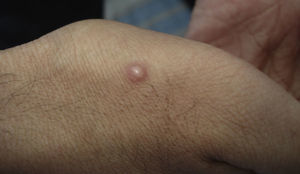
Manifestaciones cutáneasLas lesiones cutáneas se presentan en el 10-15% de los pacientes; pueden ser únicas o múltiples y predominan en el tronco y la cara (figs. 11 y 12). Las formas de presentación clínica son extremadamente variables. Las lesiones cutáneas resultan de la diseminación del C. immitis, desde lesiones pulmonares quiescentes, antiguas, que se reactivan al disminuir la eficacia de los mecanismos de inmunidad específicos, hasta por la propagación a partir de lesiones ganglionares, óseas o articulares subyacentes. Suelen ser múltiples; las primeras se sitúan en la cara y el cuello (cerca de orificios naturales); posteriormente, confluyen en placas y se hacen verrugosas. Los granulomas cutáneos aparecen en la vecindad de los trayectos fistulosos, que tienden a cicatrizar, mientras la lesión progresa por los bordes. Otras veces las lesiones óseas crónicas inducen la afectación secundaria de partes blandas. Las más características se describen en la tabla 143,44.
El criptococo se puede identificar en pruebas sanguíneas, médula ósea, LCR, ojo, tracto respiratorio, piel y mucosas, orina y otros tejidos. Ante cualquier paciente con detección positiva de antígeno de criptococo o hallazgo de levaduras encapsuladas en examen directo, histología o aislamiento de C. neoformans de cualquier sitio corporal, se recomienda que, de manera inmediata, se tomen muestras para examen directo y cultivo de LCR, sangre, orina y títulos séricos para evaluar la gravedad de la infección y optimizar la inducción del tratamiento5,45.
La prueba de tinta china se puede realizar en cualquier fluido corporal. Se observan levaduras de 2-15 mμ, rodeadas cada una por una cápsula mucoide que no se tiñe (fig. 13). Esta prueba es rápida —se realiza en menos de un minuto— y es muy específica, pero es poco sensible, ya que solo en el 50% de los casos es positiva46.
En cortes histológicos se puede teñir la muestra para facilitar la observación del hongo. Las tinciones más útiles son las de PAS, Grocott, Papanicolaou y Gram. También para el diagnóstico de muestras clínicas se puede observar el hongo con un microscopio de fluorescencia y blanco de calcoflúor o microscopia de contraste de fases5.
Por último, debe indicarse que el cultivo puede hacerse de cualquier tejido o fluido corporal. Crecen a una temperatura de 25-37°C y se ven colonias levaduriformes, blancas, amarillentas o café claro. La identificación definitiva de la especie del Cryptococcus se hace con la prueba de utilización de carbohidratos y la producción de pigmento en agar de alpiste negro (Gyzotia abissinica)47.
Diagnóstico diferencialEl diagnóstico diferencial debe incluir el Molluscum contagiosum, el virus del herpes simple (VHS), el rinofima, el sarcoma de Kaposi y la celulitis bacteriana (tabla 1)40–42.
Tratamiento y seguimientoEl tratamiento de elección frente a la infección diseminada es la combinación de anfotericina B y flucitosina por vía intravenosa, lo que permite que se reduzcan las dosis de ambos fármacos, disminuyendo la toxicidad y, por lo tanto, los efectos colaterales. Es importante recordar que la flucitosina aumenta la toxicidad hematológica en pacientes en tratamiento con zidovudina, por lo que se debe controlar la función renal y los niveles de flucitosina de forma constante (tabla 1). Se han postulado 2 factores predictores de mortalidad: el recuento de CD4<50 células/μl y el antecedente de candidiasis oral antes de iniciar las TARV42,43.
Manifestaciones cutáneas del síndrome de reconstitución inmunológicaCon la introducción de la terapia antirretroviral de gran actividad (TARGA) ha disminuido la incidencia de muchas infecciones oportunistas en pacientes infectados por el VIH, pero se han introducido nuevos problemas, como el síndrome inflamatorio de reconstitución inmunitaria (SIRI). Esta es una consecuencia clínica adversa de la restauración de la respuesta inmunológica antígeno-específica inducida por la TARGA, que se traduce en el comienzo clínico de las infecciones subclínicas preexistentes o la manifestación exuberante de enfermedades autoinmunitarias y de neoplasias48–50.
Así, se han publicado casos aislados con manifestaciones cutáneas de histoplasmosis. La mayoría de ellos presentaron lesiones papulosas o costrosas generalizadas (fig. 14) y uno en concreto una lesión nodular en la cara, que se acompañó de fiebre y linfadenitis. La histología de la piel y los nódulos linfáticos mostraron granulomas de células gigantes con necrosis y levaduras. En los cultivos en sangre creció H. capsulatum, que también se aisló de la piel y el pulmón. El tratamiento suele ser la misma terapia antifúngica que para los casos descritos anteriormente51.
La incidencia exacta de SIRI asociado a C. neoformans no se conoce, a pesar de que siempre se encuentra bien en las cohortes de SIRI y como casos aislados. La mayoría de ellos se deben a la reactivación de casos previamente tratados, lo que sugiere que es una respuesta inmunológica a la enfermedad tratada de forma incompleta o una reacción inflamatoria a ciertos antígenos residuales. La mayoría de los casos asociados a SIRI son meningitis, aunque se han comunicado linfadenitis y mediastinitis.
Las manifestaciones cutáneas, aunque poco frecuentes, son morfológicamente grandes masas únicas o múltiples, o úlceras de gran tamaño. En algún caso se requirió la cirugía para extirpar lesiones nodulares y la continuación del TARGA52.
No se han publicado casos con síndrome de reactivación inmunitaria en pacientes con VIH/sida y coccidioidomicosis.
Consecuencias prácticas en nuestro ámbitoLos dermatólogos debemos estar preparados para detectar enfermedades infrecuentes y presentaciones atípicas de las afecciones más comunes, en particular, infecciones de la piel en pacientes con el sistema inmunitario deteriorado, entre los que incluimos los sujetos con VIH/sida. Con la disminución y la disregulación de la inmunidad mediada por células infectadas por el VIH, las personas son susceptibles a innumerables infecciones de la piel. Las lesiones pueden estar menos inflamadas de lo normal o más generalizadas, desfiguradas y destruidas. Las infecciones producidas por más de un organismo también pueden causar lesiones atípicas en pacientes infectados por el VIH53.
La histoplasmosis es una infección oportunista frecuente en pacientes infectados por el VIH que viven en zonas endémicas y tiene una tasa de letalidad de hasta el 80% en algunos informes. En general, en Europa es infrecuente, sobre todo en España, pero no está ausente debido, en gran medida, al número cada vez mayor de emigrantes y visitantes procedentes de países endémicos, como son el este de EE. UU., América Latina, África Subsahariana, Asia Oriental y Oceanía53. Cuando los sujetos con VIH acuden a consulta, en el 95% de ellos la histoplasmosis se presenta en su forma diseminada54. Las lesiones cutáneas surgen por diseminación hematógena y se manifiestan, generalmente, después de que el recuento de células CD4 cae por debajo de 150 células/μl.
Existen diferentes cepas de H. capsulatum, que varían dependiendo de si el paciente presenta o no sida. Reyes-Montes et al. realizaron un estudio en pacientes mexicanos con sida y aislaron los siguientes tipos de cadenas de H. capsulatum: EH-316, EH-317, EH-318, EH-319, EH-323 y EH-325, mientras que EH-46 y EH-53 se aislaron de pacientes que no lo tenían55.
No existe acuerdo en cuanto al sexo. Mientras que algunos autores encuentran que la histoplasmosis afecta a varones y mujeres por igual, en otros estudios se encontró un predominio del sexo masculino. Existe poca información sobre la incidencia de la histoplasmosis entre los diversos grupos y las diferencias relacionadas con la raza. Sin embargo, muchos autores parecen estar de acuerdo en que las características cutáneas de las lesiones pueden diferir entre las razas y la endemia de las diferentes zonas.
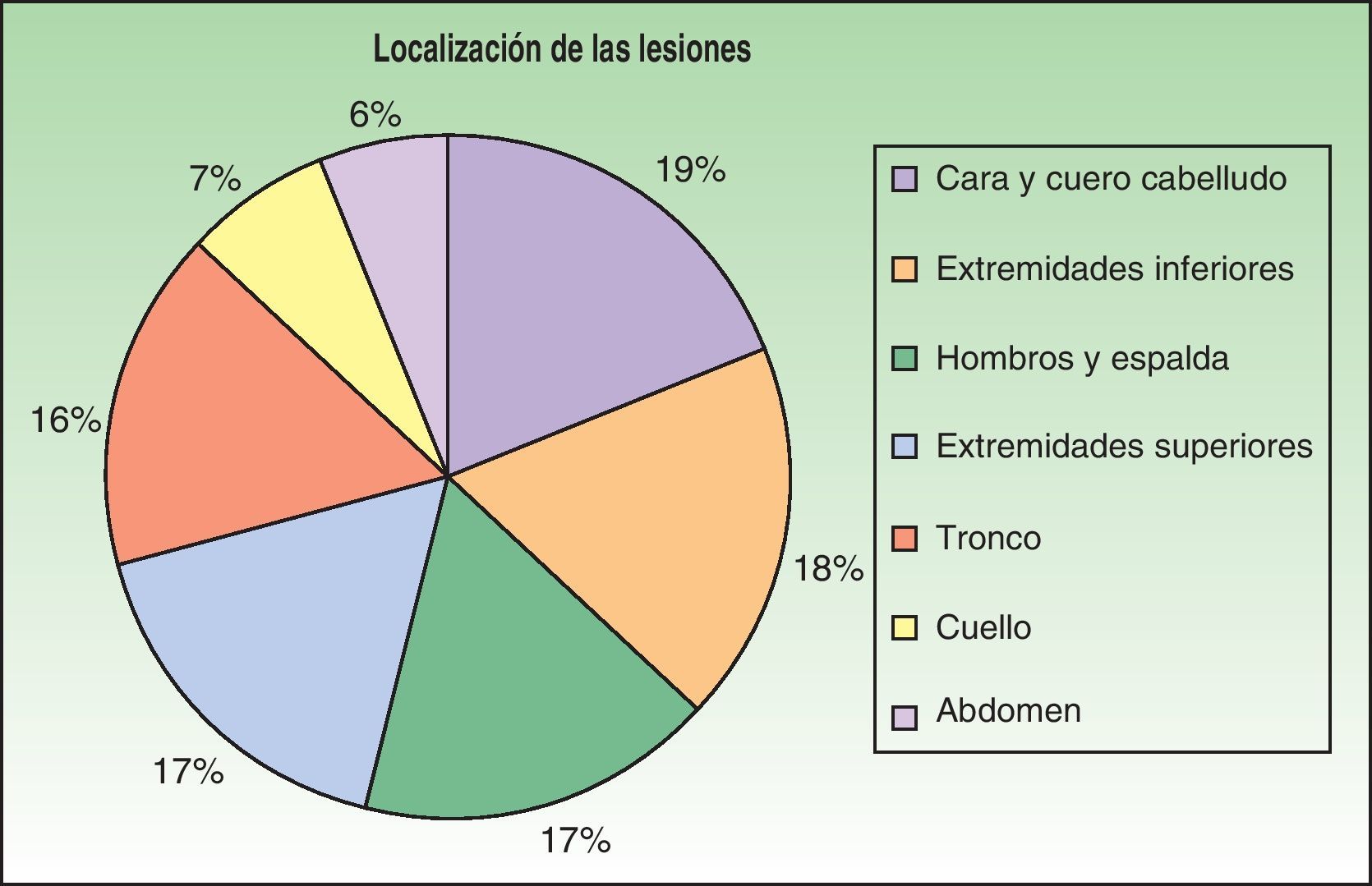
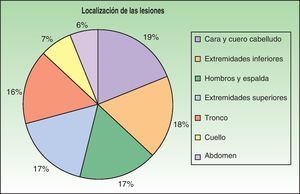
Los primeros casos de histoplasmosis diseminada con repercusión cutánea fueron descritos por Bayes et al.56–59. Posteriormente, otros investigadores añadieron nuevas aportaciones a la literatura60,61. Revisando la bibliografía hemos visto que los lugares de localización más frecuentes de las lesiones, por orden decreciente, fueron la cara y el cuero cabelludo, las extremidades inferiores, los hombros y la espalda, el tronco, el cuello y el abdomen16,17,9,57–62 (fig. 15). Sin embargo, Bonifaz y Chang encontraron lesiones fundamentalmente en la cara y el tronco63. Las lesiones cutáneas aparecen entre el 38-85% de los casos, según sean pacientes de América del Sur o procedentes de África, lo que sugiere diferencias genéticas en las 2 variedades. Se ha indicado que las cepas dermotrópicas de H. capsulatum pueden ser causantes de la alta frecuencia de lesiones cutáneas en los pacientes con sida. H. capsulatum se ha observado en los macrófagos endoneurales y en las células de Schwann en los nervios cutáneos. Se ha considerado que un gran número de estos microorganismos invade la dermis y afecta secundariamente al nervio. Sin embargo, los nervios involucrados no muestran necrosis ni proliferación celular. La presencia de elementos de hongos en los nervios cutáneos puede ser el indicio principal en la enfermedad de recurrencia o diseminación. Las lesiones mucosas pueden ocurrir en el tracto gastrointestinal e incluyen pápulas, nódulos y úlceras.
Bonifaz y Chang encontraron pápulas, nódulos y placas hiperqueratósicas, algunas úlceras y lesiones purpúricas en todos sus pacientes. Esta imagen clínica es común y se ha informado anteriormente en las poblaciones de América Latina12,64. Las muestras tomadas por raspado de estas lesiones permiten confirmar el diagnóstico micológico en casi el 100% de los casos64.
Cabe destacar que la profilaxis primaria (itraconazol, 200mg por día) se administra a pacientes positivos para el VIH con un recuento de CD4<150 células/μl. En pacientes con enfermedad diseminada, a pesar del tratamiento, se ha comunicado una tasa de mortalidad del 43,5%8, mientras que en la revisión europea previamente citada esta es del 15% en la fase inicial del tratamiento y del 57% en la fase de seguimiento65.
La coccidioidomicosis es una micosis sistémica propia del continente americano, tal y como se describe en la epidemiología de esta micosis. La forma diseminada es la más frecuente en los pacientes con sida, en las razas de piel oscura y en los varones. Puede adoptar 3 formas evolutivas: aguda, subaguda o crónica. En estas últimas predominan los síntomas de la enfermedad localizada en la piel, el tejido celular subcutáneo, el sistema osteoarticular, los ganglios linfáticos y el SNC.
La forma primaria pulmonar se manifiesta por neumonía (44%) y puede presentarse afección miliar (19%). Puede cursar con cavitación o coccidioidomas (19%)21,22,66. En aproximadamente el 0,2% de los pacientes con coccidioidomicosis pulmonar primaria las lesiones se difunden de forma predominante a la piel, el SNC y el sistema osteoarticular. La forma diseminada generalmente progresa de una manera aguda, llegando a diversos órganos o sistemas, lo que lleva rápidamente a la muerte cuando el diagnóstico y el tratamiento no son oportunos. En 1972 se describió el primer caso de cocciodioidomicosis diseminada asociado a VIH en España67. Aproximadamente del 10 al 20% de los pacientes positivos para el VIH con enfermedad sistémica tienen lesiones cutáneas. Usualmente es una característica definitoria de sida y un signo de mal pronóstico. La detección temprana de estas puede ayudar a iniciar el TAR y mejora el pronóstico de estos pacientes66.
La gran cantidad de formas clínicas y las posibles complicaciones hacen que sea difícil indicar regímenes de tratamiento específicos para cada situación. Recientemente, se ha demostrado que el voriconazol y el posaconazol pueden usarse en casos refractarios al tratamiento debido a su amplio espectro de acción, pero los resultados no han sido muy satisfactorios68.
Aunque se ha estudiado durante años, no existe una vacuna eficaz contra la coccidioidomicosis. Las vacunas basadas en el ARN total extraído de esférulas han demostrado ser ineficaces. Sin embargo, en estudios recientes la investigación de antígenos recombinantes ha demostrado prometedores resultados experimentales18,42.
El tratamiento quirúrgico con resección de la lesión está indicado en casos de nódulos en el pulmón o en otros sitios cuando los pacientes no responden a la terapia antifúngica. La detección de una masa cerebral o un absceso requiere drenaje o resección quirúrgica. El desbridamiento de las lesiones cutáneas, con la eliminación de material necrótico, es una medida auxiliar importante. Los pacientes deben permanecer en tratamiento ambulatorio, con visitas de seguimiento a los 3 y 6 meses, y luego anualmente, hasta los 12 años32.
La virulencia del género Cryptococcus se asocia a la producción de proteasas y oxidasas, así como a las propiedades antifagocíticas del polisacárido capsular. La explicación más plausible de la infección se basa en el diámetro de las basidiosporas (1,2-1,8μm), el cual les permite acumularse en los alveolos, y en que a una temperatura de 37°C se produce el cambio en las levaduras capsuladas. En la mayoría de los casos la inhalación de Cryptococcus spp. causa una infección pulmonar asintomática y autolimitada, y las levaduras pueden permanecer latentes dentro de este complejo, morir o, en caso de inmunosupresión posterior, reactivarse y causar la enfermedad69. En varios estudios se demostró que el C. neoformans VNI predominó en los pacientes positivos para el VIH, mientras que C. gattii VGII predominó en los pacientes negativos para el VIH (p<0,001). Solo 3 (8,1%) de los 37 casos positivos para el VIH fueron causados por C. gattii VGII, mientras que 5 (23,8%) de los 21 casos negativos para el VIH fueron causados por C. neoformans VNI70–72.
Antes del inicio de la terapia antirretroviral, la criptococosis se convirtió en la gran infección oportunista y la principal causa de fallecimiento en los pacientes infectados por el VIH con CD4<100 células/μl5,43. En nuestro medio, hasta el año 2006, la infección fúngica más frecuente en estos pacientes era la criptococosis73.
La afectación cutánea en la criptococosis ocurre en un 10-20% de los casos, casi siempre de forma secundaria a una infección sistémica, por lo que se considera como un «signo centinela» de enfermedad diseminada. Excepcionalmente, se han descrito infecciones necrotizantes en tejidos blandos (celulitis y fascitis necrotizante) y lesiones que semejan un pioderma gangrenoso y cicatrices queloideas. Cursan con alta mortalidad (80%)74,75.
La criptococosis cutánea primaria es una entidad muy infrecuente, que se ha definido en la literatura científica como la identificación de C. neoformans en la biopsia o el cultivo de piel en ausencia de enfermedad diseminada. El patrón esporotricoide es una presentación extremadamente infrecuente. Los casos revisados corresponden a pacientes inmunodeprimidos, pero en ausencia de infección por el VIH76.
El uso de profilaxis primaria es controvertido. En un metaanálisis la profilaxis primaria con fluconazol o itraconazol en pacientes positivos para el VIH y con CD4<300 células/μl disminuyó la incidencia de criptococosis, pero varió la mortalidad. En los pacientes que se reconstituyen inmunológicamente durante la terapia TARGA el fluconazol o el itraconazol pueden interrumpirse siempre que los linfocitos CD4 permanezcan estables por encima de 100 células/μl durante los últimos 12 meses77,78.
ConclusionesLas micosis sistémicas son principalmente enfermedades pulmonares causadas por hongos patógenos dimórficos. Si el inóculo es grande o el individuo tiene alteraciones inmunológicas es posible la infección primaria, que puede ser aguda, autolimitada o subclínica. La mayoría de las manifestaciones cutáneas representan enfermedad diseminada, y por ello requieren de tratamiento sistémico. Debido a la coincidencia de otras lesiones cutáneas en el curso de estas patologías, en estos pacientes se recomienda realizar una historia clínica exhaustiva y pruebas complementarias de imagen, acompañadas de un estudio histopatológico y cultivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.