La dermatopatología incluye una larga lista de entidades, algunas con una histopatología muy similar. La immunohistoquímica representa una importante herramienta de ayuda en el diagnóstico, diagnóstico diferencial y pronóstico de muchas de las neoplasias cutáneas. La inmunohistoquímica es también la mejor técnica para determinar el origen de un tejido o la diferenciación de las células neoplásicas. En muchos casos la inmunohistoquímica permite un diagnóstico más preciso de los distintos procesos infiltrando la piel. Este artículo revisa el papel de la inmunohistoquímica en el estudio de la diferenciación y el comportamiento biológico de la mayoría de las neoplasias que pueden afectar a la piel. Se revisan las técnicas de inmunoperoxidasa, se discute la utilidad de los anticuerpos utilizados con mayor frecuencia y se presentan una serie de problemas diagnósticos en los que la immunohistoquímica puede resultar muy útil. En cada caso, la finalidad es llegar a un diagnóstico concreto y definitivo. En la primera parte de esta revisión se estudian los anticuerpos que exploran las distintas líneas de diferenciación de las neoplasias cutáneas.
Dermatopathology includes a long list of disorders, some of which have very similar histopathology. Immunohistochemistry is an important auxiliary tool for diagnosis and differential diagnosis, and for predicting the outcome of many skin tumors. It is also the main technique for determining the origin of a tissue or the differentiation of neoplastic cells. In many cases, immunohistochemistry provides a more accurate diagnosis of the different processes that infiltrate the skin. This review examines the role of immunohistochemistry in studying the differentiation and biological behavior of the majority of tumors that can involve the skin. We review the immunoperoxidase techniques, discuss the utility of the most commonly used antibodies, and highlight a number of diagnostic problems in which immunohistochemistry may be very useful. In each case, the goal is to reach a specific and definitive diagnosis. In the first part of this review, we examine the antibodies that determine the different cell-differentiation profiles of skin tumors.
La inmunohistoquímica (IHQ) constituye en la actualidad una herramienta diagnóstica fundamental en dermatopatología. Se trata de un grupo de técnicas de inmunotinción que permiten demostrar una variedad de antígenos presentes en las células o los tejidos utilizando anticuerpos marcados. Estas técnicas se basan en la capacidad de los anticuerpos para unirse específicamente a los correspondientes antígenos, y la reacción se hace visible solo si el anticuerpo está marcado con una sustancia que absorbe o emite luz o produce coloración.
En las técnicas de inmunofluorescencia se utilizan como marcadores compuestos de fluoresceína que bajo luz ultravioleta emiten luz de longitud de onda visible, que depende de la naturaleza del compuesto. La inmunofluorescencia directa se utiliza frecuentemente en el diagnóstico de las enfermedades cutáneas, en donde tiene indicaciones muy precisas, como las enfermedades ampollares, las vasculitis o el diagnóstico de determinadas neoplasias. Pese a ser más sensible que la IHQ, la inmunofluorescencia presenta algunos inconvenientes, como son la pérdida de la fluorescencia con el tiempo, la necesidad de una microscopía con luz especializada y la pobreza del detalle morfológico. Además, para documentar cada caso, es necesario fotografiar la reacción.
En las técnicas de inmunoperoxidasa se utilizan como marcadores enzimas capaces de hacer cambiar de color un sustrato incoloro. Por ejemplo, las enzimas más frecuentemente utilizadas son la peroxidasa y la fosfatasa alcalina, y los sustratos más comunes son la diaminobenzidina (color marrón), el aminoetilcarbazol (color rojo) y el nitroazul de tetrazolio (color azul). Estos marcadores pueden unirse (conjugarse) directamente al anticuerpo primario, o indirectamente mediante otros anticuerpos (secundarios) o sustancias como biotina o proteína A. El espectro de anticuerpos disponibles comercialmente crece día a día, y actualmente es posible encontrar marcadores para una amplia gama de antígenos.
A lo largo de los últimos 20 años la incorporación de la IHQ en el proceso de diagnóstico histopatológico se ha incrementado progresivamente y se ha consolidado como una técnica fundamental en la práctica asistencial. En general, y muy especialmente en patología oncológica, cada vez son más las neoplasias cuyo diagnóstico y clasificación requieren técnicas de IHQ.
De una manera resumida se puede decir que en la actualidad la utilización de técnicas inmunohistoquímicas va dirigida a:
- 1.
Determinar la estirpe o diferenciación de una neoplasia.
- 2.
Precisar el pronóstico de la neoplasia.
- 3.
Diferenciar procesos neoplásicos benignos de malignos.
- 4.
Establecer la arquitectura molecular de un tejido.
- 5.
Detectar agentes infecciosos en las células o tejidos.
En la tabla 1 aparecen clasificados los marcadores inmunohistoquímicos utilizados con mayor frecuencia en dermatopatología, atendiendo al tipo de diferenciación que son capaces de detectar.
Marcadores inmunohistoquímicos utilizados con mayor frecuencia en dermatopatología
| Diferenciación epitelial |
| Citoqueratinas |
| Antígeno epitelial de membrana (EMA) |
| Antígeno carcinoembrionario (CEA) |
| Antígeno de la proteína del líquido de la enfermedad quística (gross cyst disease fluid protein [GCDFP]) |
| Diferenciación mesenquimal |
| Pan-mesenquimal: vimentina |
| Muscular |
| Actina |
| Muscular específica |
| Muscular sarcomérica |
| Alfa de músculo liso |
| Caldesmón |
| Calponina |
| Desmina |
| Miogenina |
| Miosina |
| Endotelial |
| CD31 |
| CD34 |
| WT-1 |
| Podoplanina |
| Lyve-1 |
| Prox-1 |
| VEGFR-3 |
| GLUT-1 |
| FLI-1 |
| ERG |
| Diferenciación neuroectodérmica |
| Proteína S100 |
| HMB45 |
| MelanA |
| Enolasa neuronal específica |
| Neurofilamentos |
| Diferenciación hematopoyética |
| Marcadores de estirpe |
| -Citoqueratinas (AE1/AE3) |
| -CD45 |
| Marcadores de linaje |
| Linaje B |
| CD20 |
| CD79a |
| Linaje T |
| CD45RO |
| CD3 |
| Linaje NK: CD56 |
| Marcadores de clonalidad |
| Restricción de cadenas ligeras kappa o lambda |
| Proliferación monotípica |
| CD4 |
| CD8 |
| Pérdida de antígenos: CD5, CD7 |
| Coexpresión antigénica: CD4+CD8, CD20+CD5, CD20+CD43 |
| Marcadores de translocación |
| Bcl-2 |
| ALK |
| Ciclina D1 |
| Marcadores de activación |
| CD30 |
| EMA |
| Marcadores de proliferación |
| Ki67 |
| Marcadores de origen |
| Bcl-6 |
| CD10 |
| Marcadores sistema inmune accesorio |
| CD1a |
| CD6 |
Las citoqueratinas (CK) constituyen el mayor grupo de filamentos intermedios y son proteínas filamentosas que, junto con otros filamentos, forman el citoesqueleto de las células eucariotas. Algunas de sus funciones son, por tanto, el mantenimiento de la estructura de la célula epitelial, la protección ante traumatismos y la comunicación entre los componentes citoplasmáticos. Se expresan en pares y tienen patrones de expresión de acuerdo con su localización. Se clasifican numéricamente del 1 al 20, según su peso molecular (PM) y su punto isoeléctrico.
Se distinguen 2 grandes grupos de CK: a) CK de epitelios simples (CK7, CK8, CK18, CK19, CK20); y b) CK de epitelios más complejos, como el de la piel (CK5/6, CK10, CK14, CK15). Otro sistema de clasificación distingue entre CK ácidas o tipo i, que generalmente corresponden a CK de bajo PM (CK9-CK20) y CK básicas o tipo ii, que generalmente son CK de alto PM (CK1-CK8). Se han desarrollado anticuerpos monoclonales para las distintas CK con diversa especificidad1 (tabla 2).
Especificidad de las distintas citoqueratinas
| Tipo epitelio | Tipo I | Tipo II | Distribución |
| Epitelio simple | 8 | 18 | Células secretoras y parenquimatosas |
| 7 | 19 | Epitelio ductal y gastrointestinal | |
| 20 | Epitelio gastrointestinal, células de Merkel de la piel, papilas gustativas | ||
| Epitelio escamoso estratificado | 5 | 14 | Células basales de epitelio escamoso y glandular, mioepitelio y mesotelio |
| 15 | Epitelio escamoso | ||
| 8 | 18/19 | Epitelio escamoso estratificado no queratinizado | |
| Células suprabasales | 1 | 10/11 | Epidermis (compartimiento suprabasal) |
| 9 | Epidermis palmas y plantas | ||
| 2e | Epidermis (capas altas) | ||
| 2p | Encías y paladar duro | ||
| 3 | 12 | Epitelio corneal | |
| 4 | 13 | Epitelio escamoso estratificado, no queratinizado de órganos internos | |
| 6 | 16,17 | Epitelio escamoso hiperproliferativoK17 se expresa típicamente en las células basales de los epitelios complejos |
Fuente: Chu PG et al.14
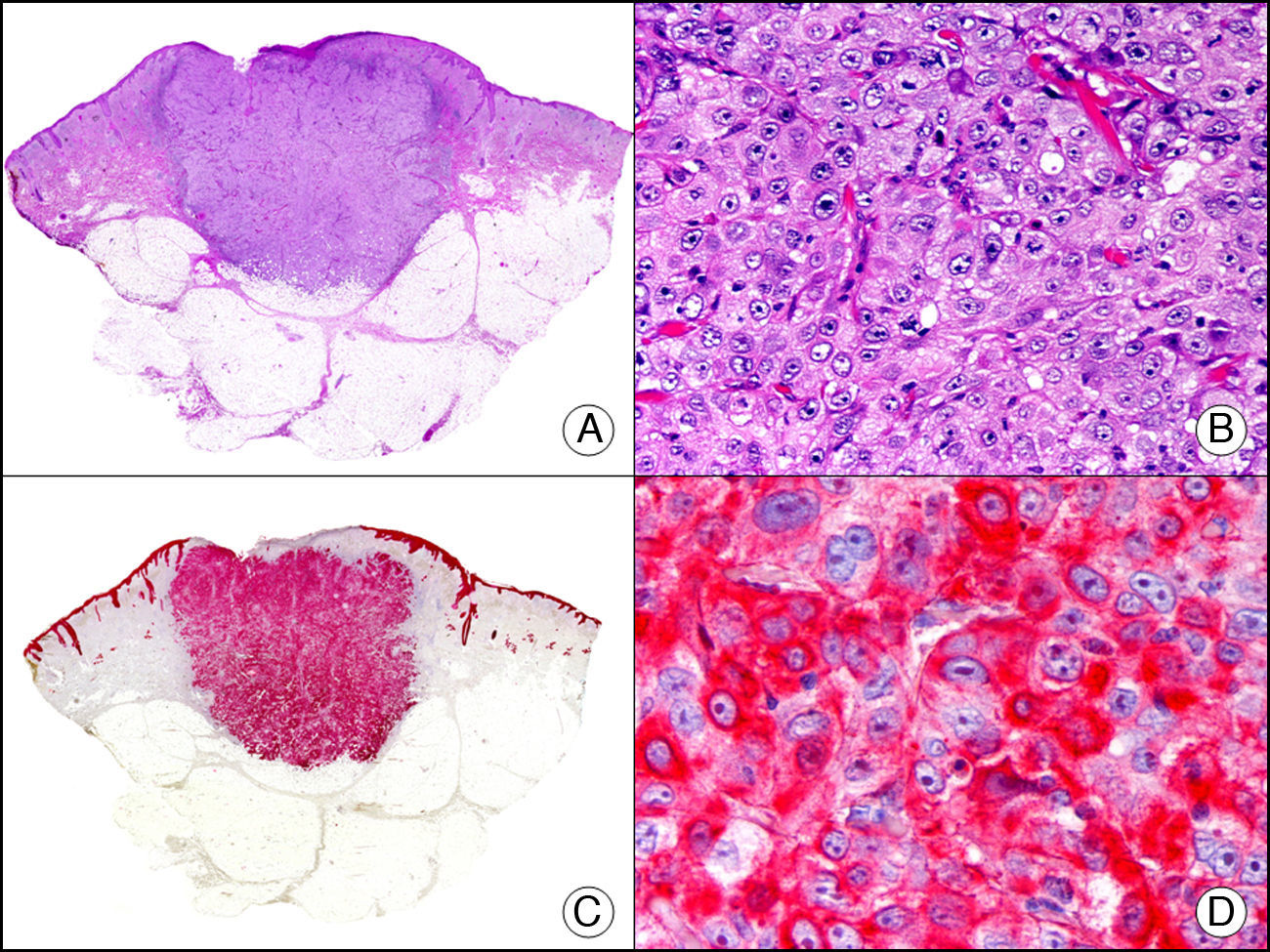
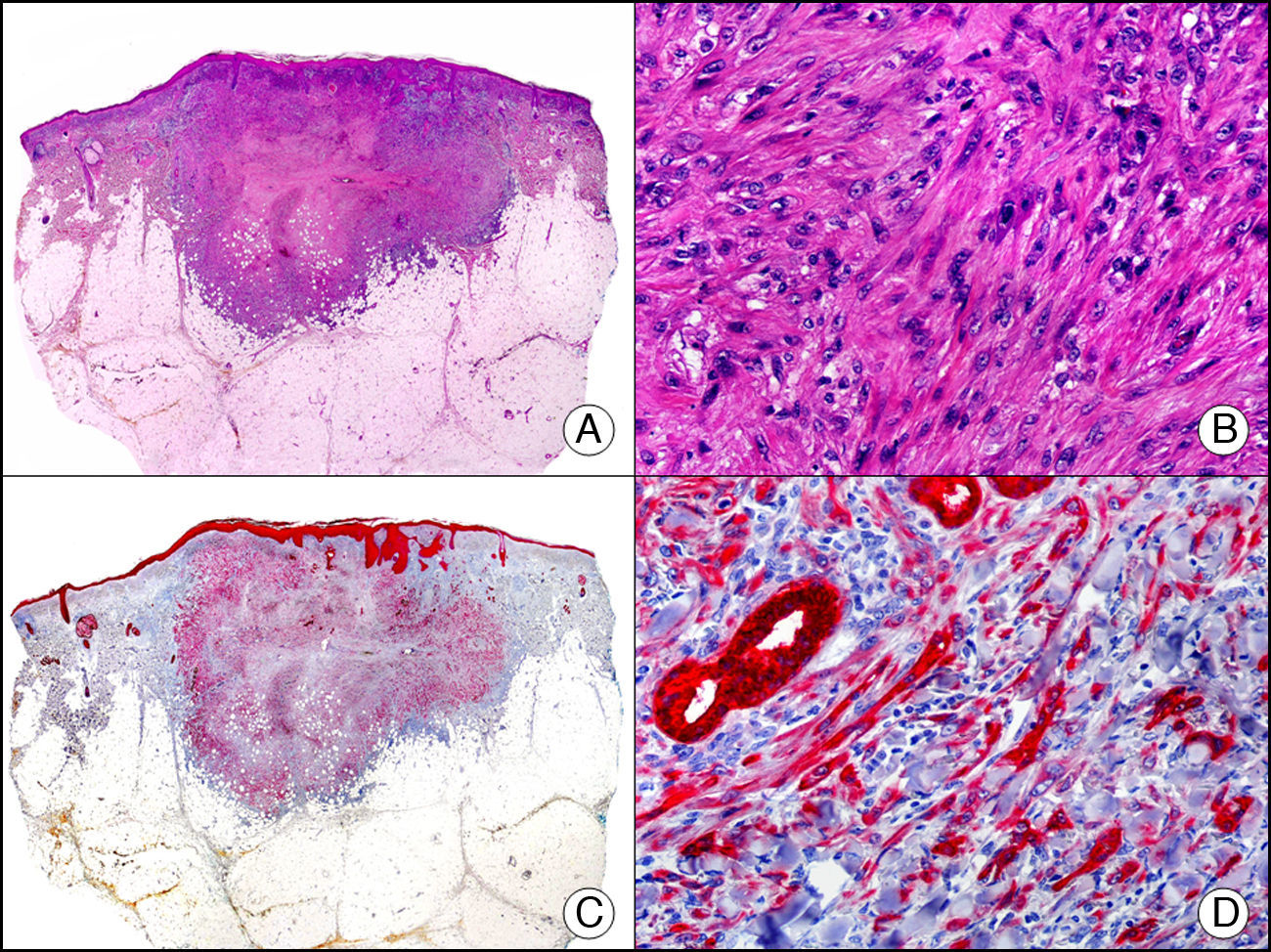
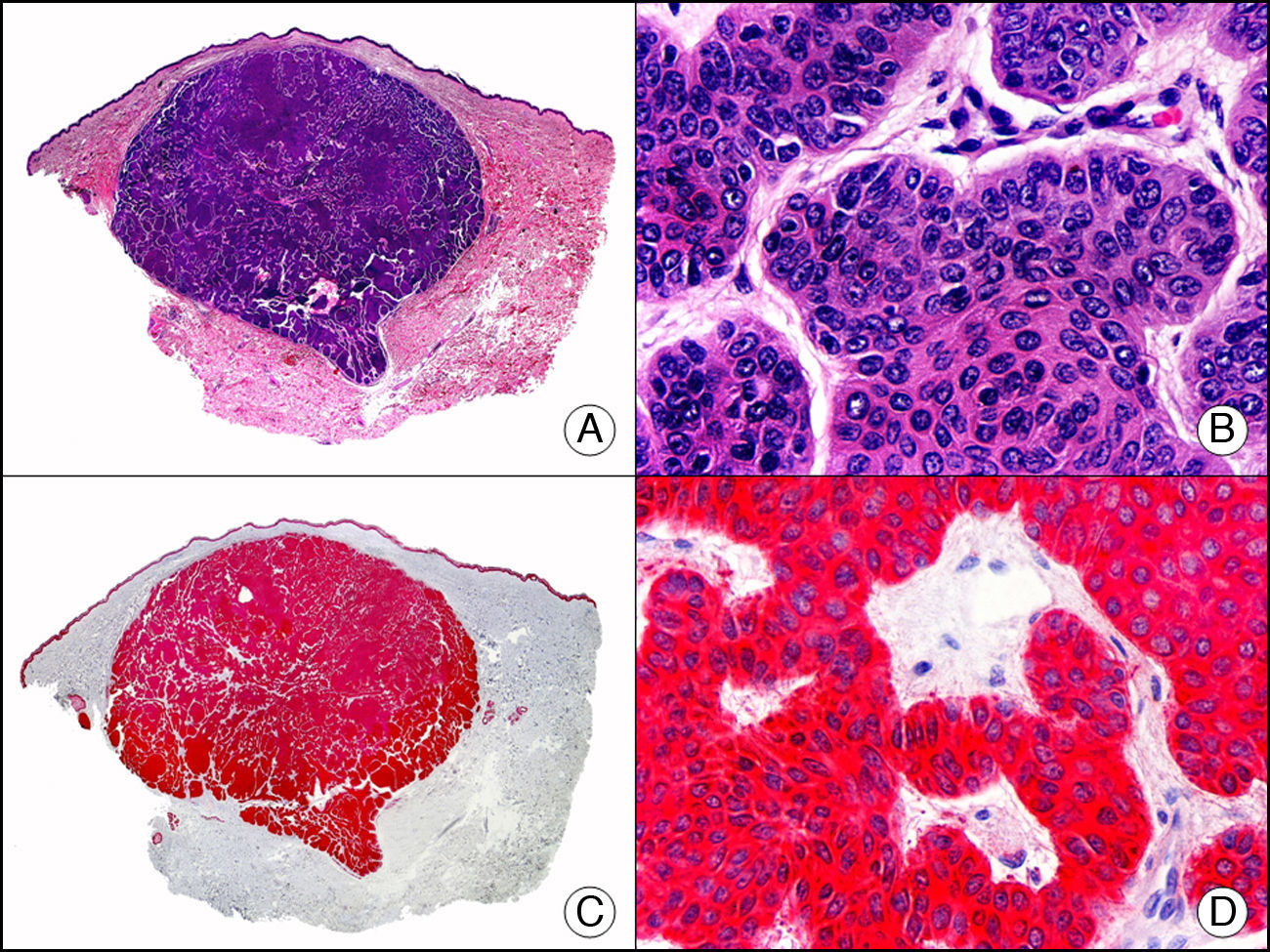
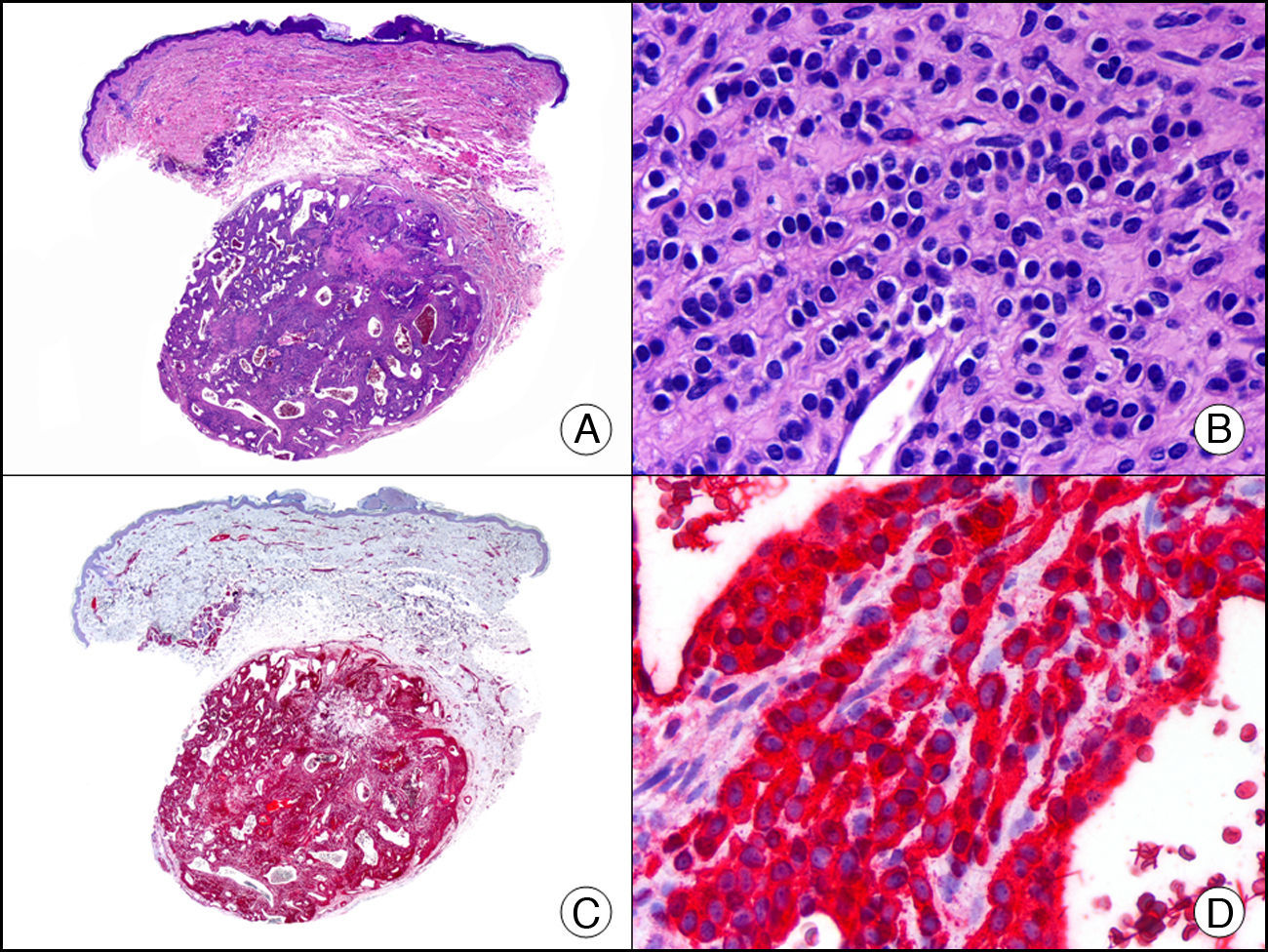
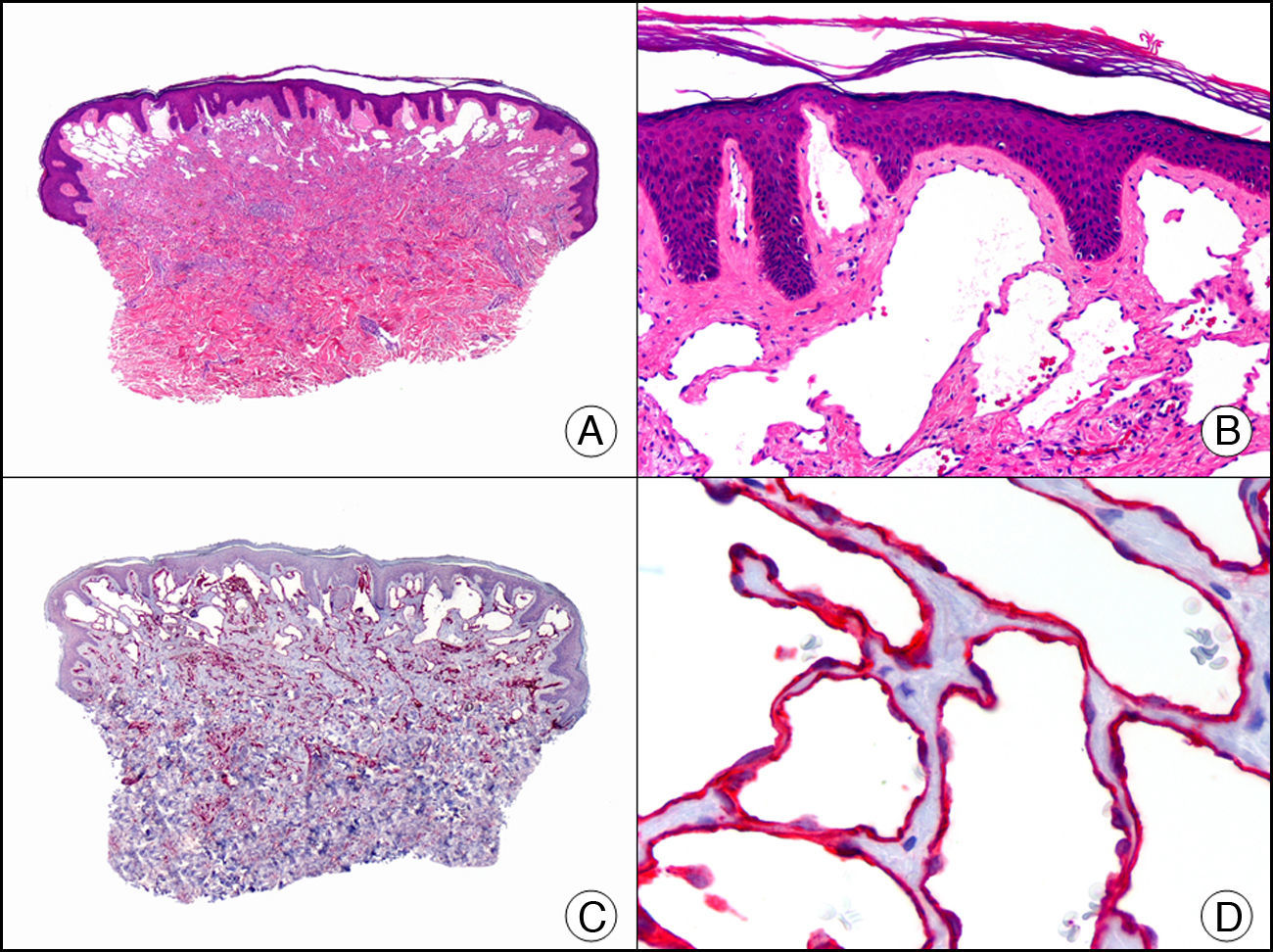
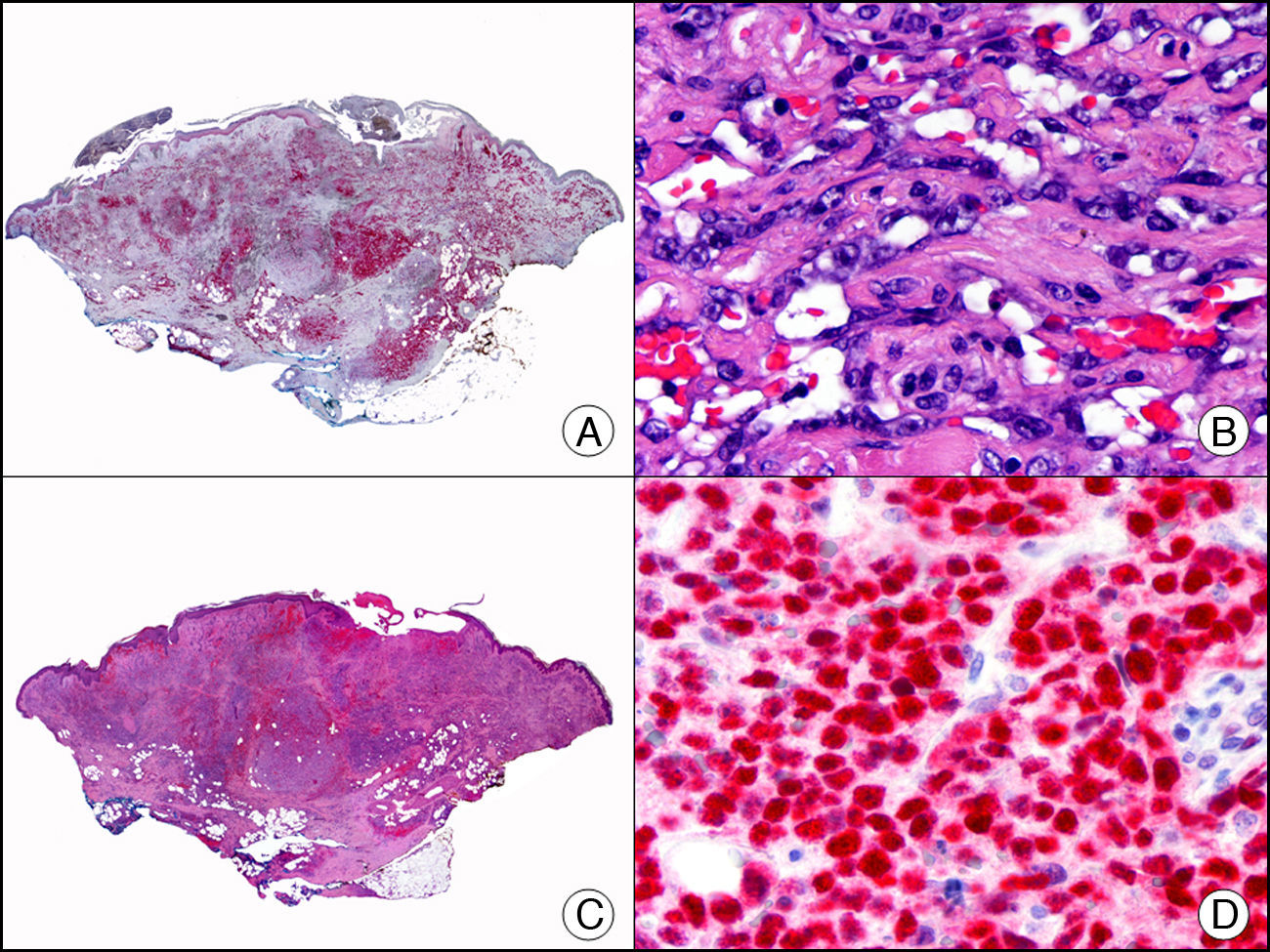
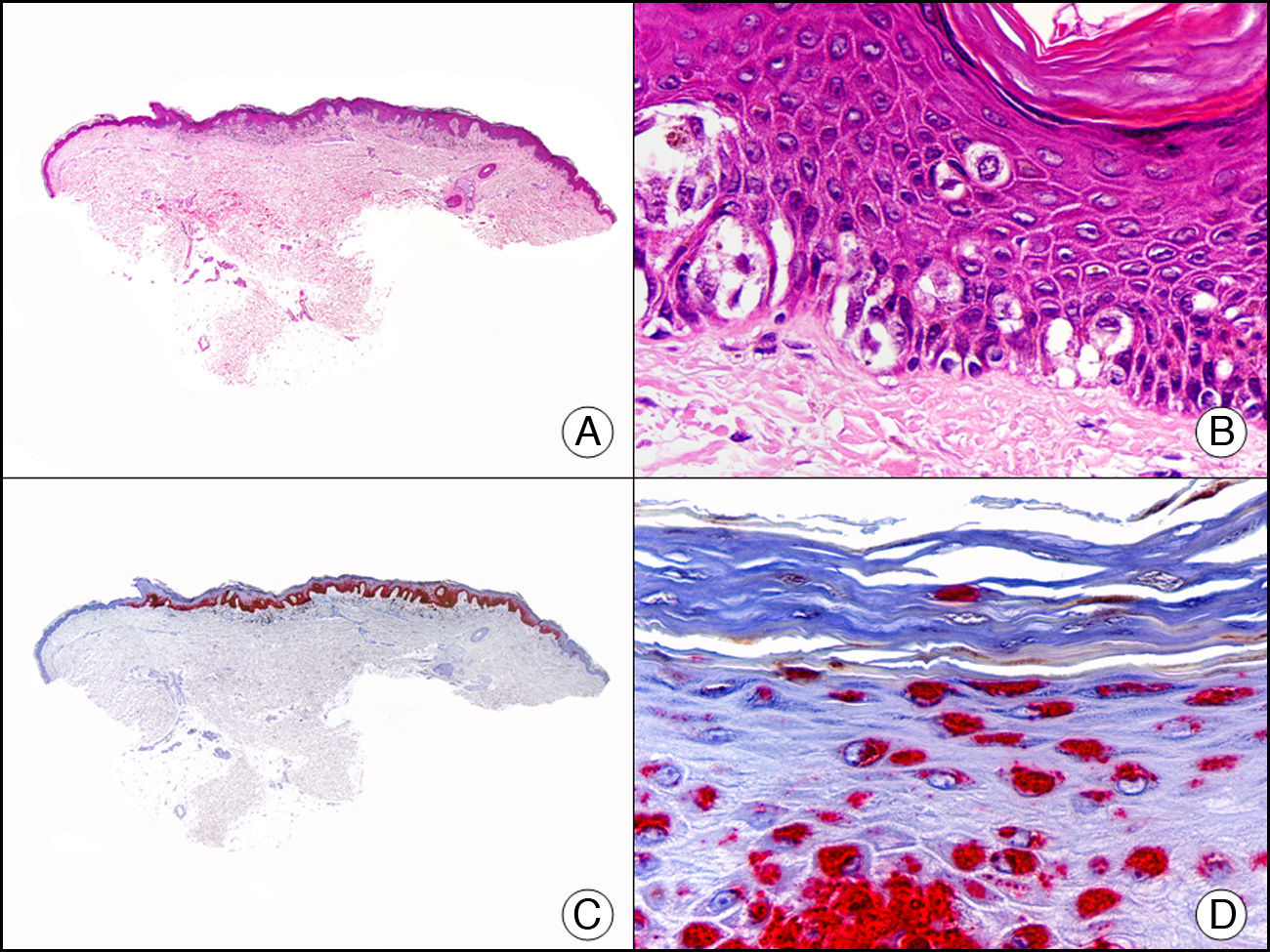
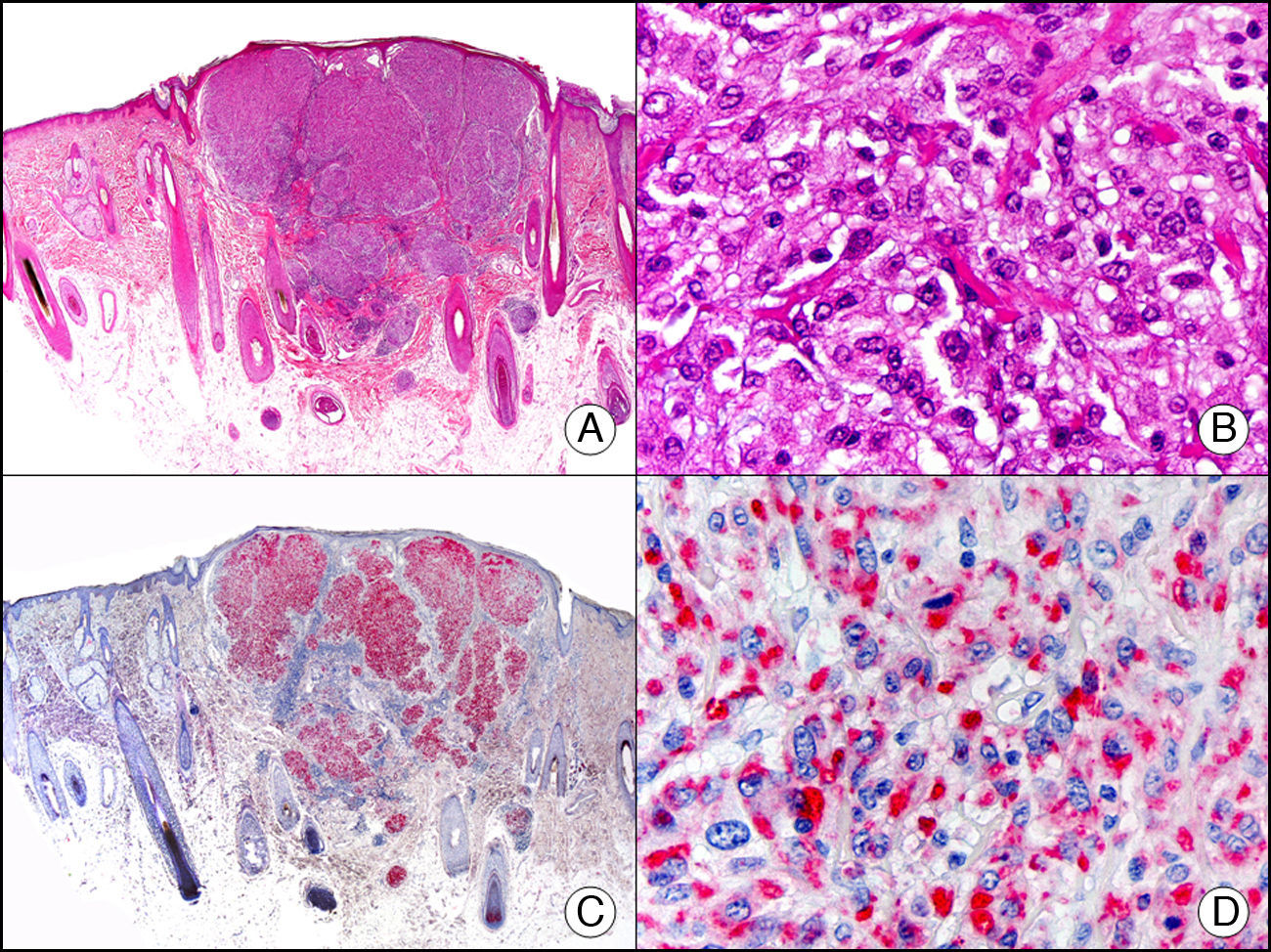
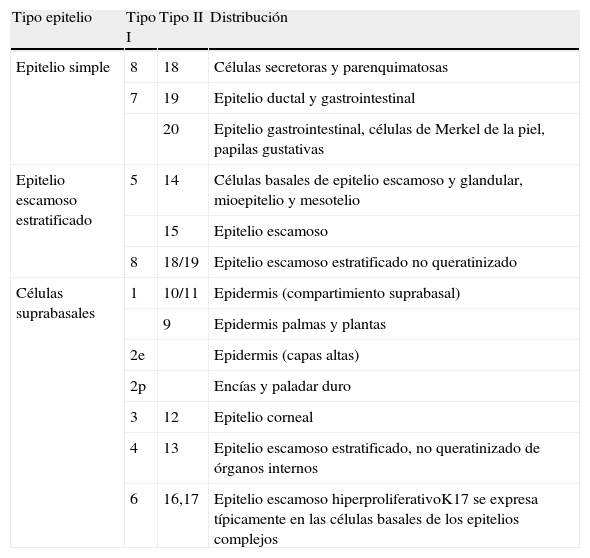
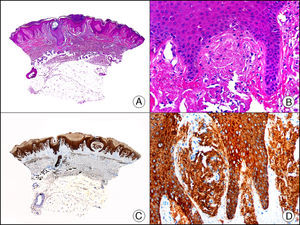
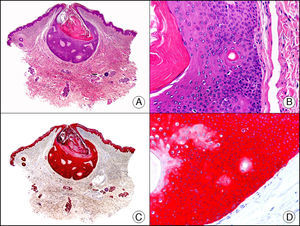
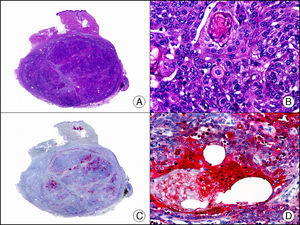
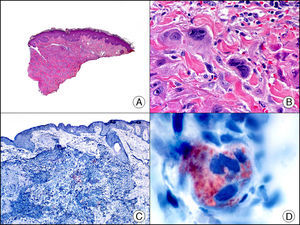
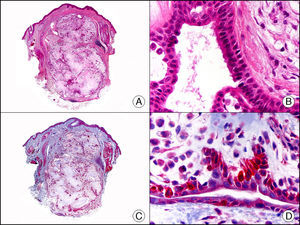
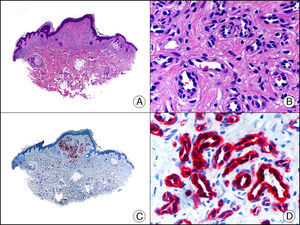
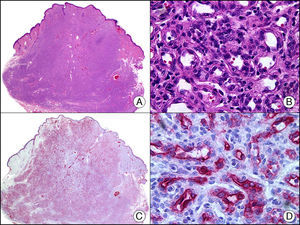
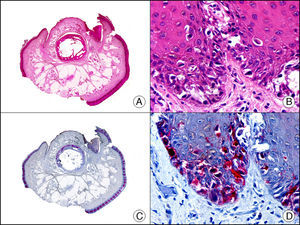
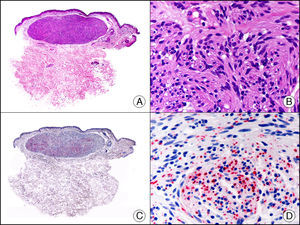
La pan-CK AE1/AE3 es un cóctel de CK que incluye un amplio espectro de PM. Esta CK es muy útil en la identificación de neoplasias de estirpe epitelial, en su clasificación respecto al grado de diferenciación y en la detección de sus micrometástasis. En la piel esta pan-CK marca la epidermis, las glándulas ecrinas y la unidad folículo-sebáceo-apocrina. La pan-CK AE1/AE3 es capaz de identificar la mayor parte de carcinomas (fig. 1), incluso aquellos pobremente diferenciados, por lo que es una CK de alta sensibilidad diagnóstica. Reconoce también algunas neoplasias mesenquimales constituidas por células epitelioides, como el mesotelioma, el sarcoma sinovial o el sarcoma epitelioide, debido a que se trata de neoplasias constituidas por células con una gran cantidad de filamentos intermedios en su citoplasma. La CK AE1 reconoce CK ácidas (CK 10-15-16-19). Es una CK característica de epitelios simples y en la piel solo se expresa en la capa basal de la epidermis1,2. La CK AE3 reconoce CK básicas (CK1-CK8) y es característica de epitelios transicionales y de carcinomas escamosos. Esta citoqueratina se expresa en todo el espesor de la epidermis1,2.
Carcinoma espinocelular. A. Visión panorámica (x10). B. Detalle de las células neoplásicas mostrando núcleos vesiculosos con nucléolo prominente y amplio citoplasma eosinófilo (x400). C. El mismo caso estudiado inmunohistoquímicamente con citoqueratina AE1/AE3. Obsérvese la positividad de la neoplasia, así como del epitelio de la epidermis y los anejos cutáneos de la dermis (x10). D. Detalle a gran aumento de la positividad de las células neoplásicas con la citoqueratina AE1/AE3 (x400).
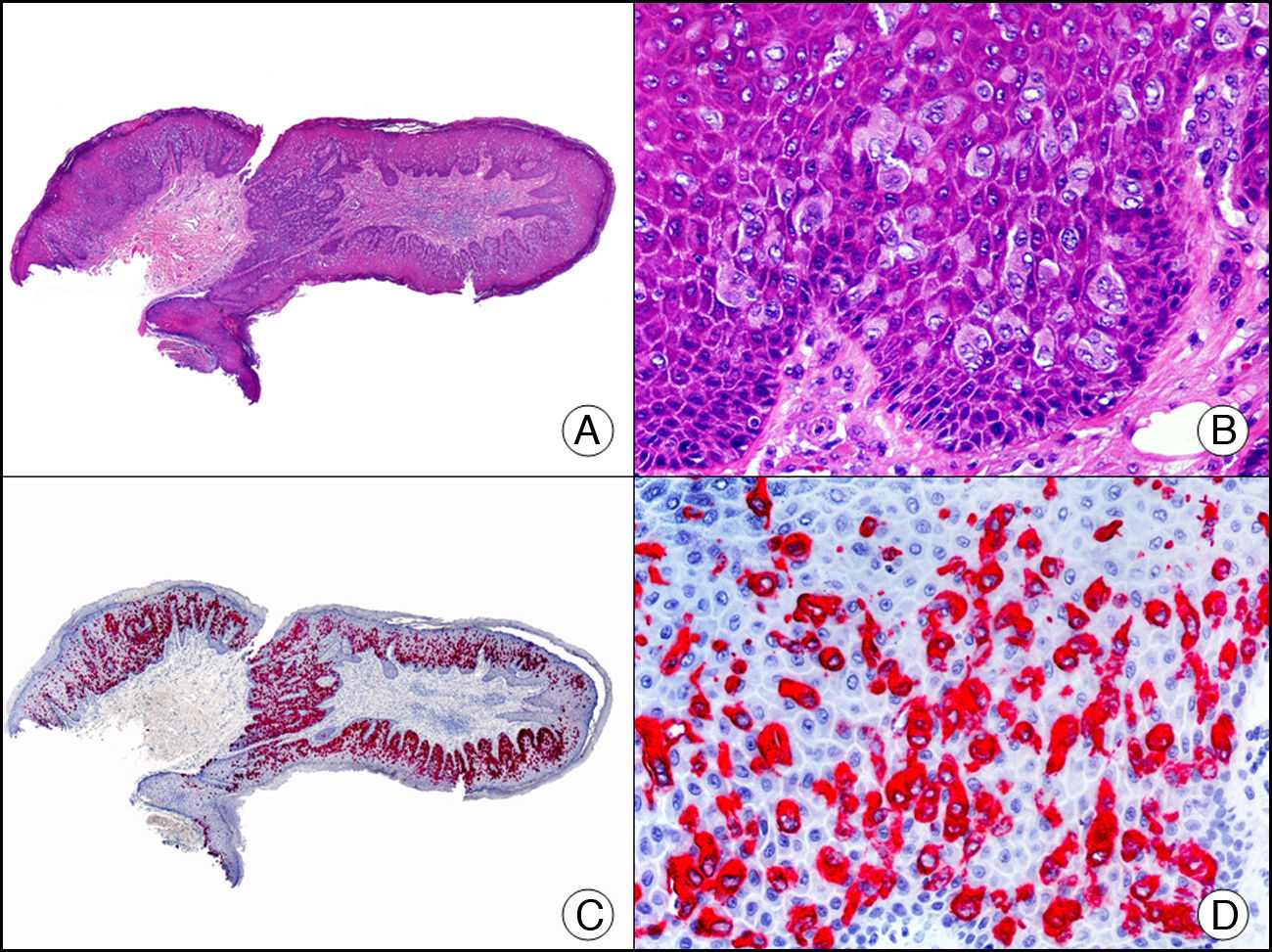
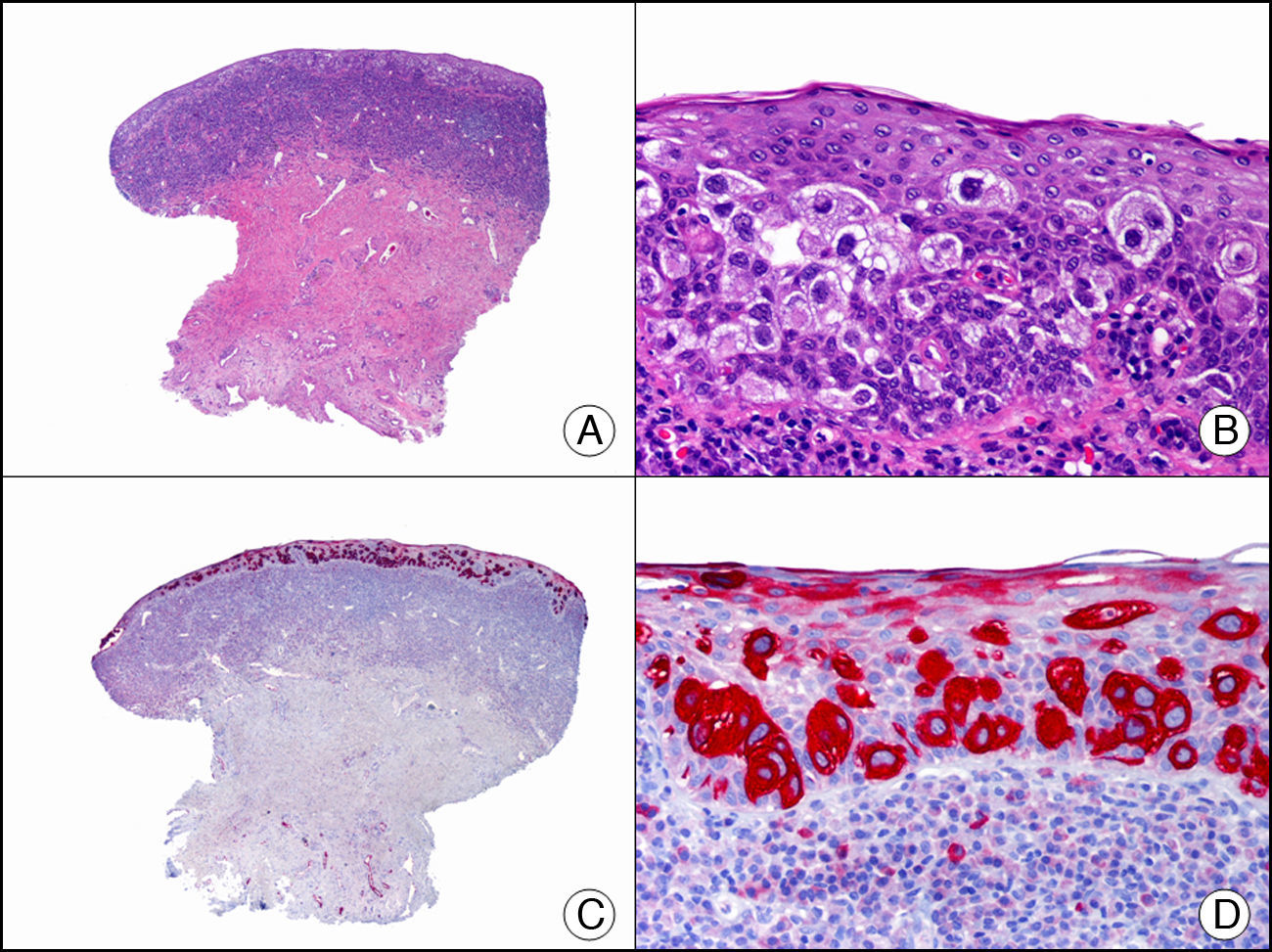
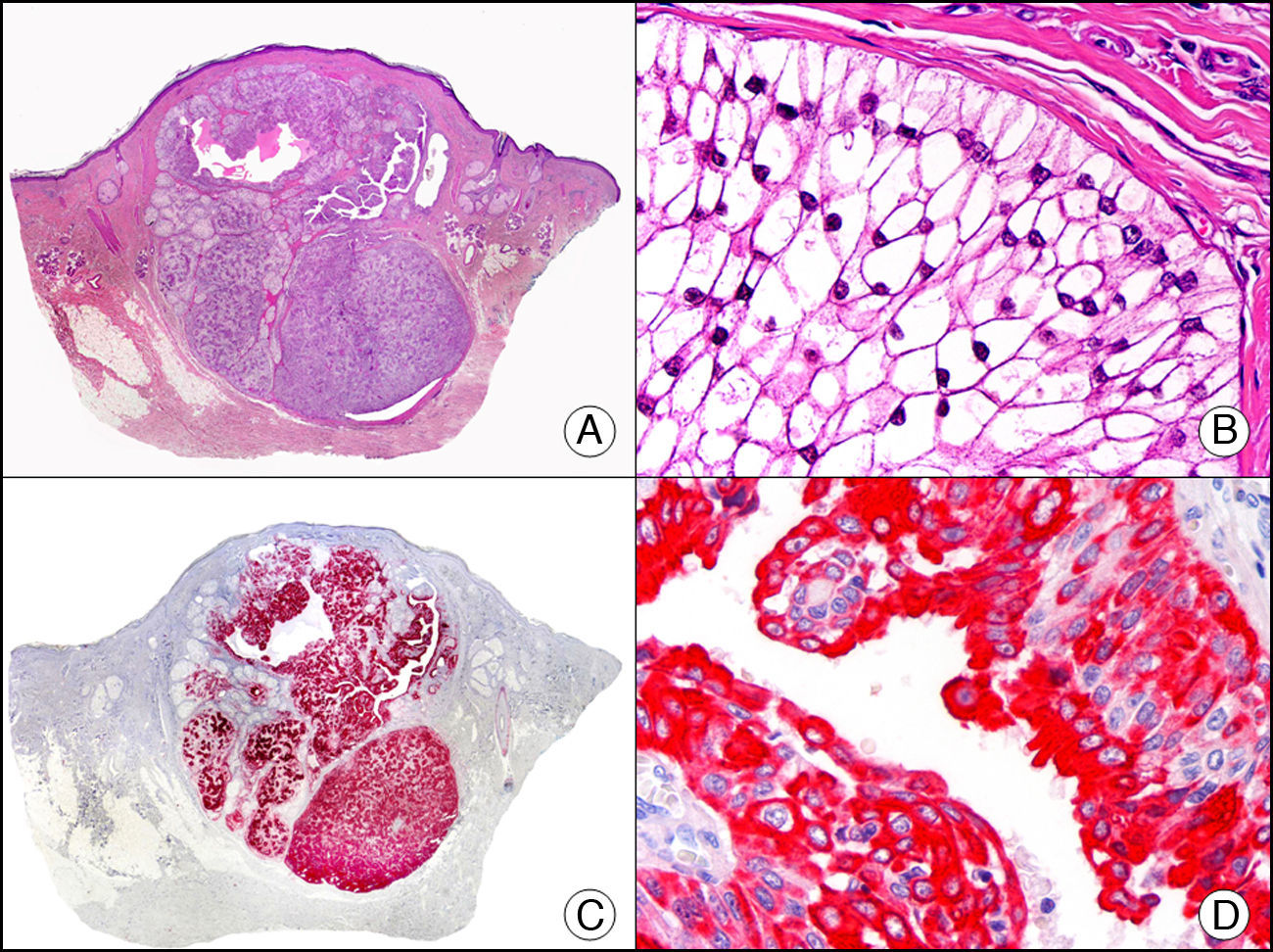
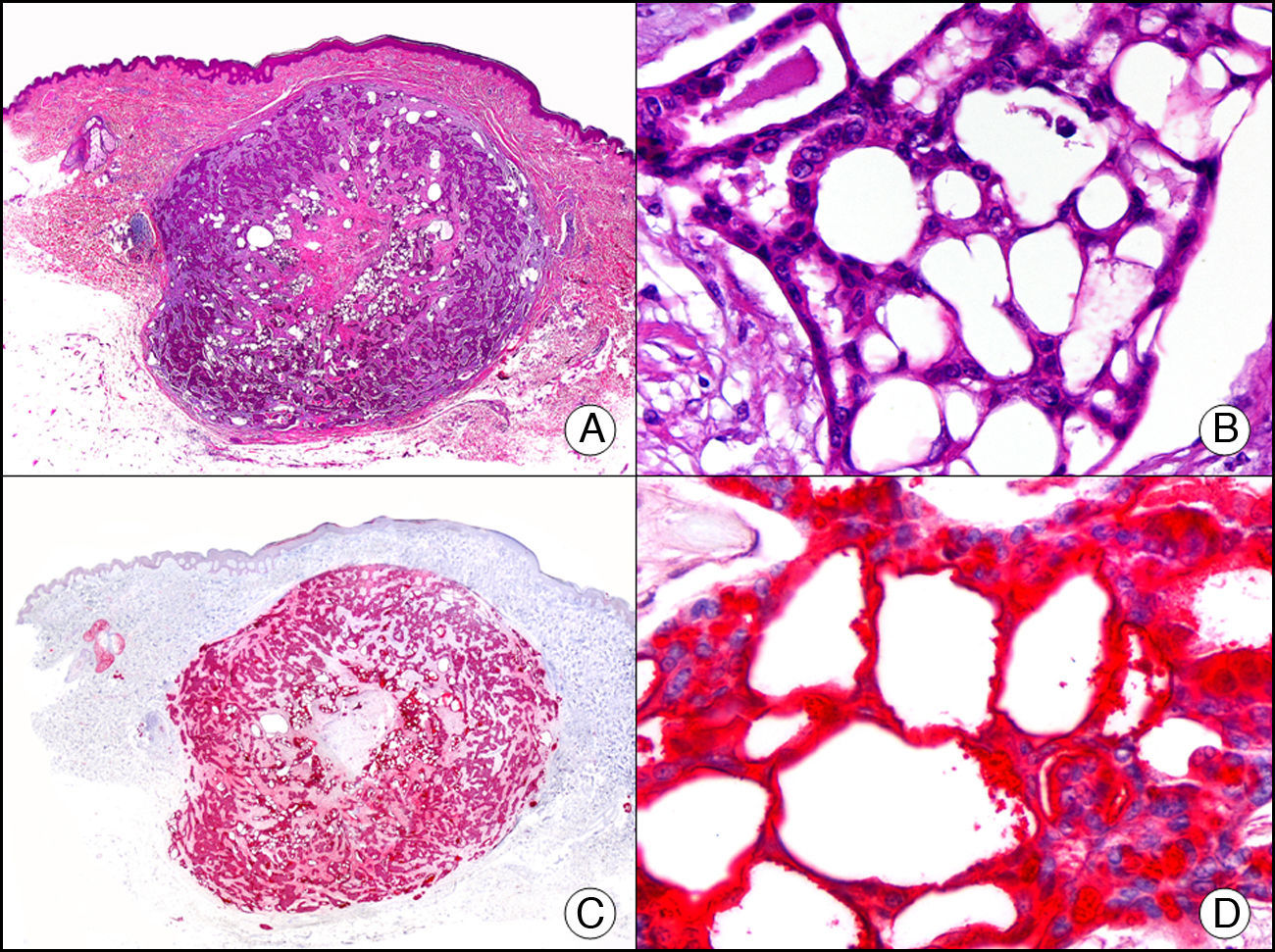
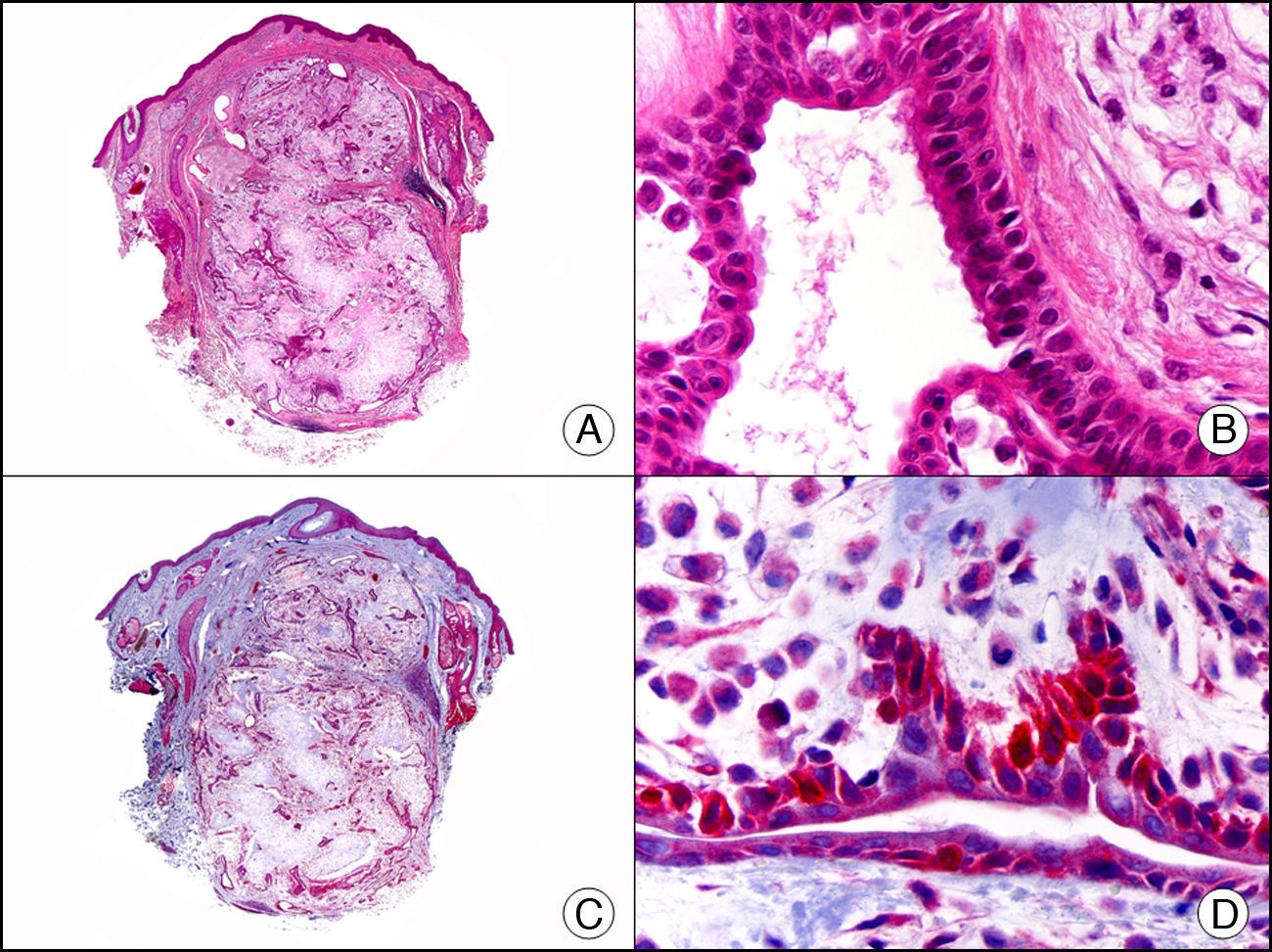
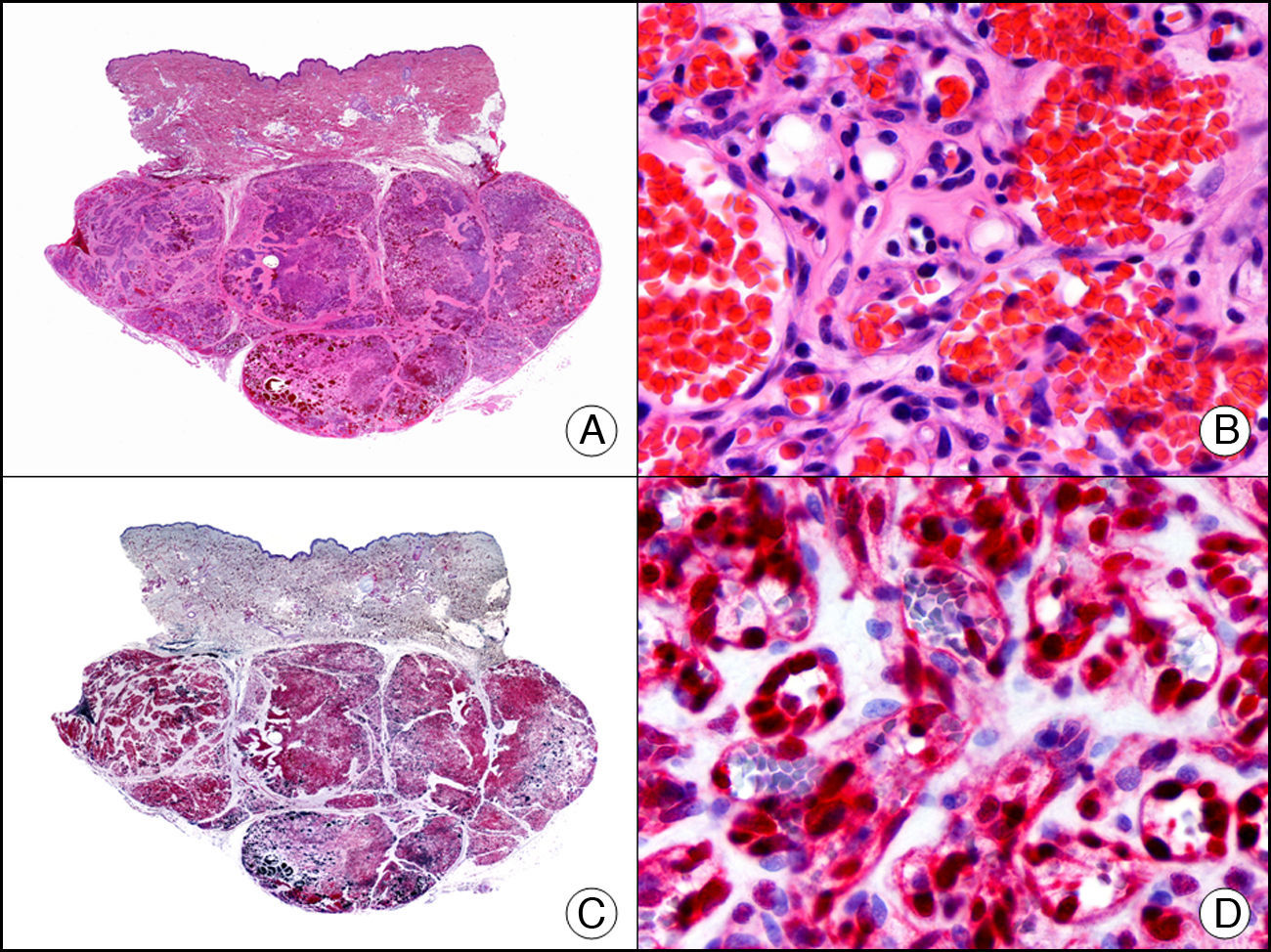
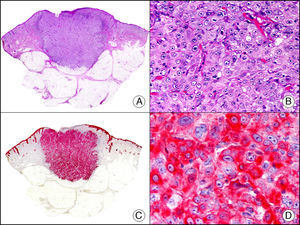
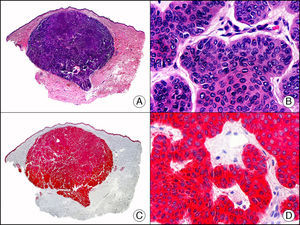
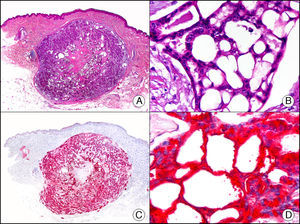
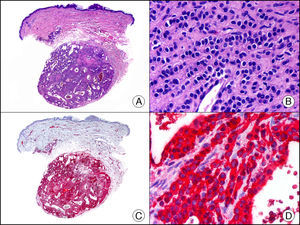
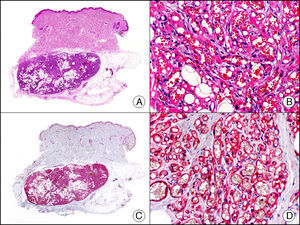
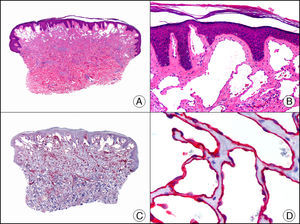
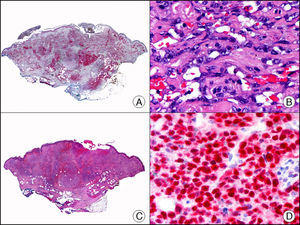
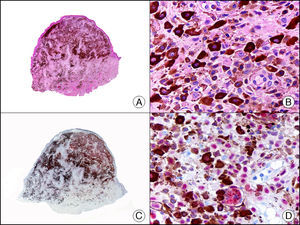
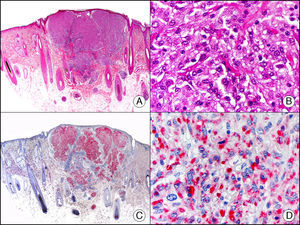
La CK CAM-5.2 reconoce CK de bajo PM en neoplasias glandulares3. Existe controversia en la literatura respecto al tipo de CK reconocidas por la CAM-5.2, ya que en la literatura más antigua se consideraba como marcador de CK 8, 18, 194, pero hoy se sabe que esta CK identifica la CK8 y más débilmente, pero de manera específica, la CK7, pero no la CK185–7. En la piel normal la CK CAM-5.2 marca las unidades ecrinas y apocrinas, pero no los estratos de epidermis normal. En caso de neoplasias muy indiferenciadas permite establecer su estirpe epitelial, por lo que resulta útil en el diagnóstico diferencial histopatológico entre carcinomas pobremente diferenciados, linfomas, melanomas y sarcomas. Resulta también útil en el reconocimiento de tumores con diferenciación neuroendocrina metastásicos en la piel, como el tumor carcinoide o el carcinoma microcítico de pulmón y en tumores neuroendocrinos primarios cutáneos y sus metástasis, como el tumor de Merkel. Por último, es capaz de diferenciar epitelio glandular de bajo PM en el seno del epitelio epidérmico en las enfermedades de Paget mamaria y extramamaria (fig. 2). Resulta también de gran ayuda en el diagnóstico diferencial histopatológico entre la enfermedad de Paget pigmentada de la mama y el melanoma maligno con células de aspecto pagetoide7,8.
Enfermedad de Paget extramamaria. A. Visión panorámica (x10). B. Detalle mostrando numerosas células grandes y atípicas, de citoplasma amplio y basófilo, salpicadas como células aisladas en el espesor de la epidermis (x400). C. El mismo caso estudiado inmunohistoquímicamente con citoqueratina CAM 5.2 (x10). D. Positividad para la citoqueratina CAM5.2 de las células neoplásicas de la enfermedad de Paget extramamaria, mientras que los queratinocitos de la epidermis permanecen negativos (x400).
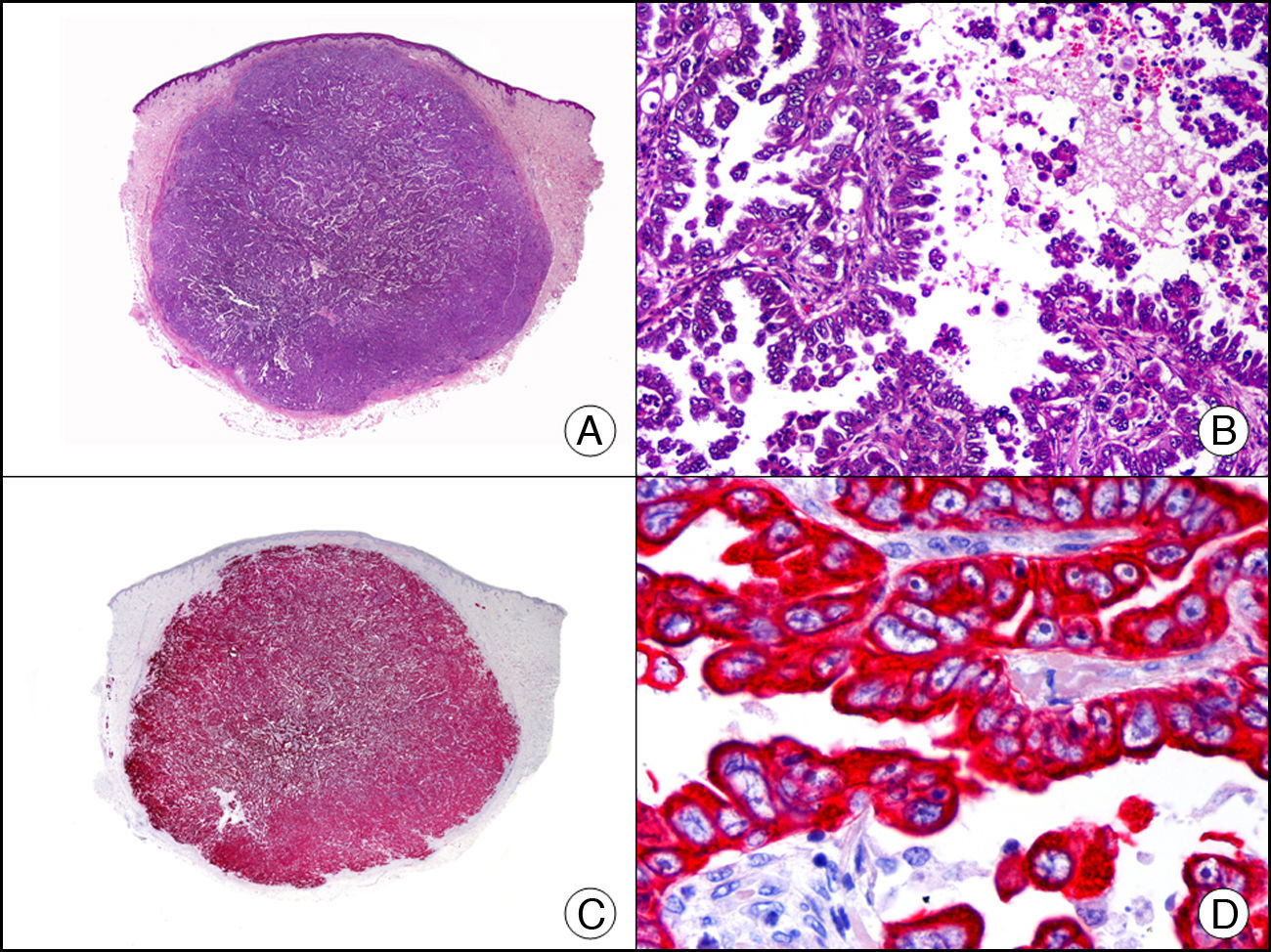
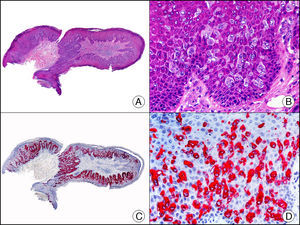
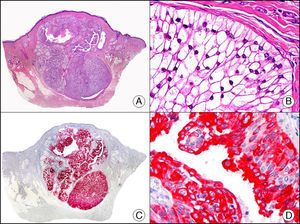
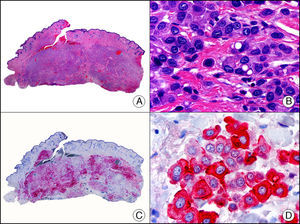
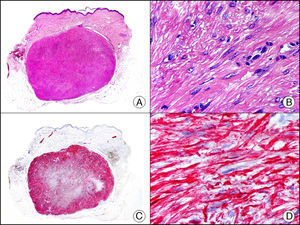
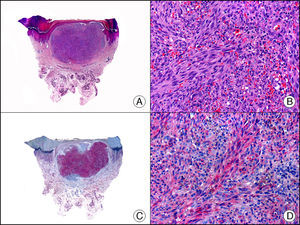
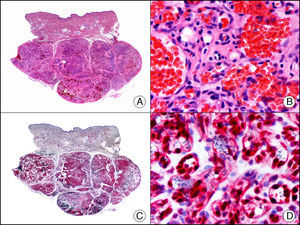
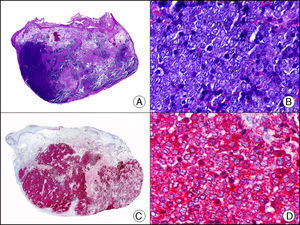
La CK 35BH11 reconoce CK de bajo PM (CK8 y CK18). La CK8 es una CK básica y, junto con la CK18, que es una CK ácida, constituyen probablemente las CK expresadas con más frecuencia dentro de la familia de filamentos intermedios. Se expresan en todos los epitelios simples, incluyendo el epitelio glandular de tiroides, mama, tracto gastrointestinal, tracto respiratorio y tracto urogenital. En el diagnóstico tumoral puede resultar de utilidad para la identificación de adenocarcinomas y carcinomas derivados de epitelio escamoso no queratinizante (fig. 3). En el carcinoma de mama el estudio de la expresión de CK8/18 forma parte de una nueva subclasificación de base molecular con significado pronóstico y predictivo, junto a otros marcadores (receptores de estrógenos [ER], HER2, CK5/6, E-cadherina, c-Kit y epidermal growth factor receptor [EGFR]). En este sentido, se detecta positividad para CK8/18 en los carcinomas ductales de mama, mientras que resulta negativa en los lobulillares.
Metástasis cutánea de carcinoma papilar de endometrio. A. Visión panorámica (x10). B. Detalle a gran aumento mostrando papilas tapizadas por células epiteliales atípicas (x200). C. El mismo caso estudiado inmunohistoquímicamente con citoqueratinas 8/18 (x10). D. Detalle de la positividad para citoqueratinas 8/18 de las células neoplásicas (x400).
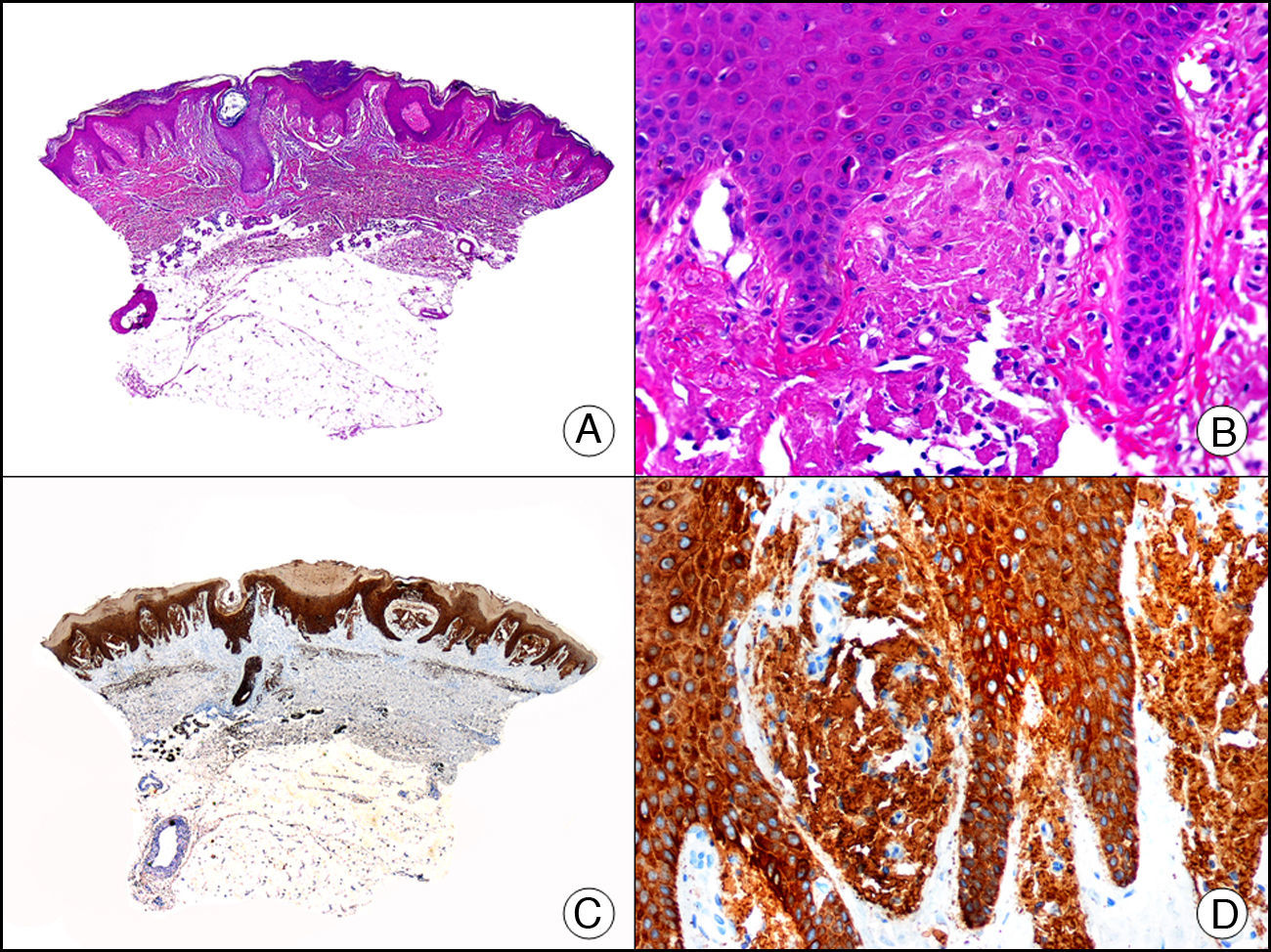
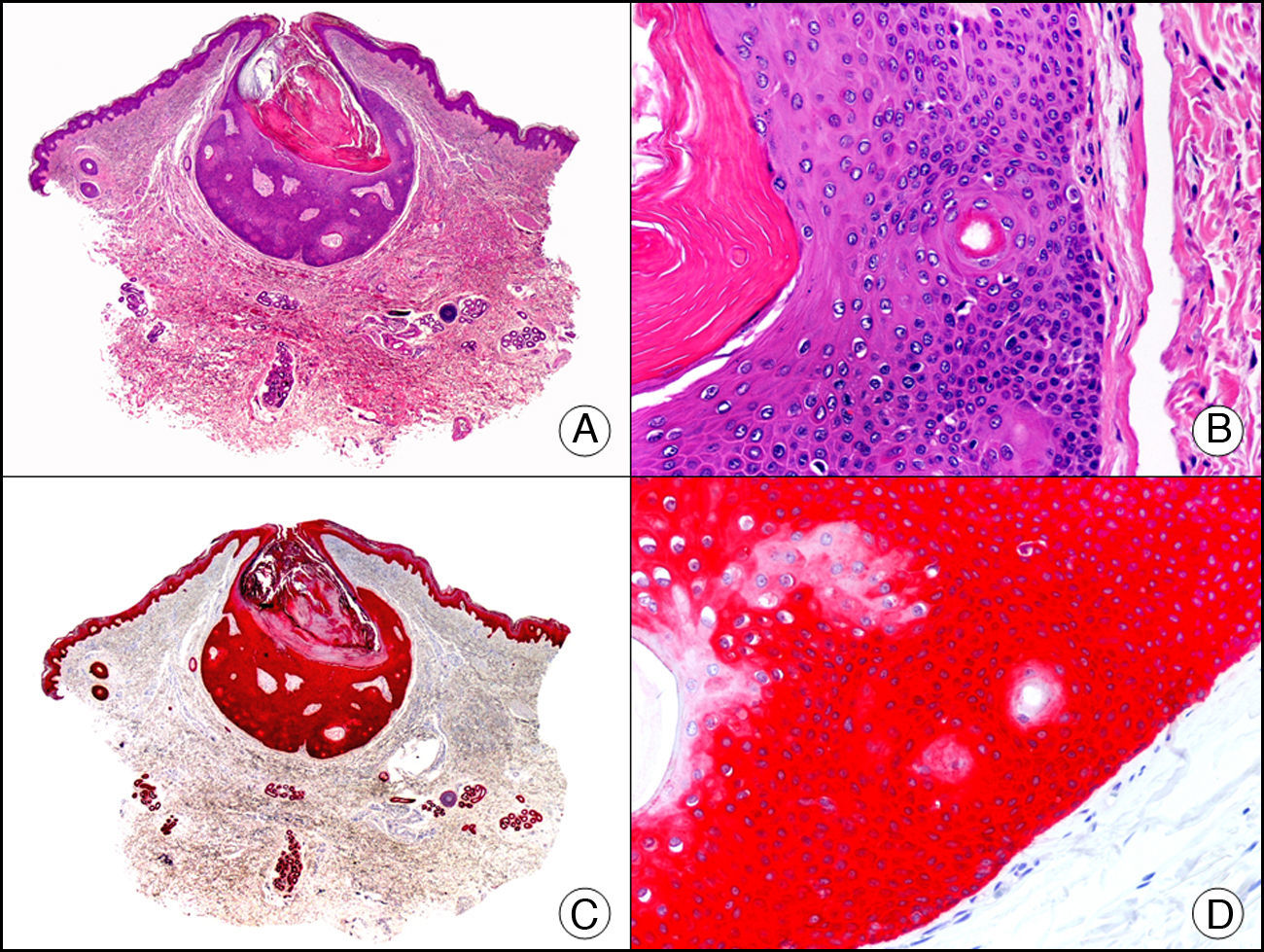
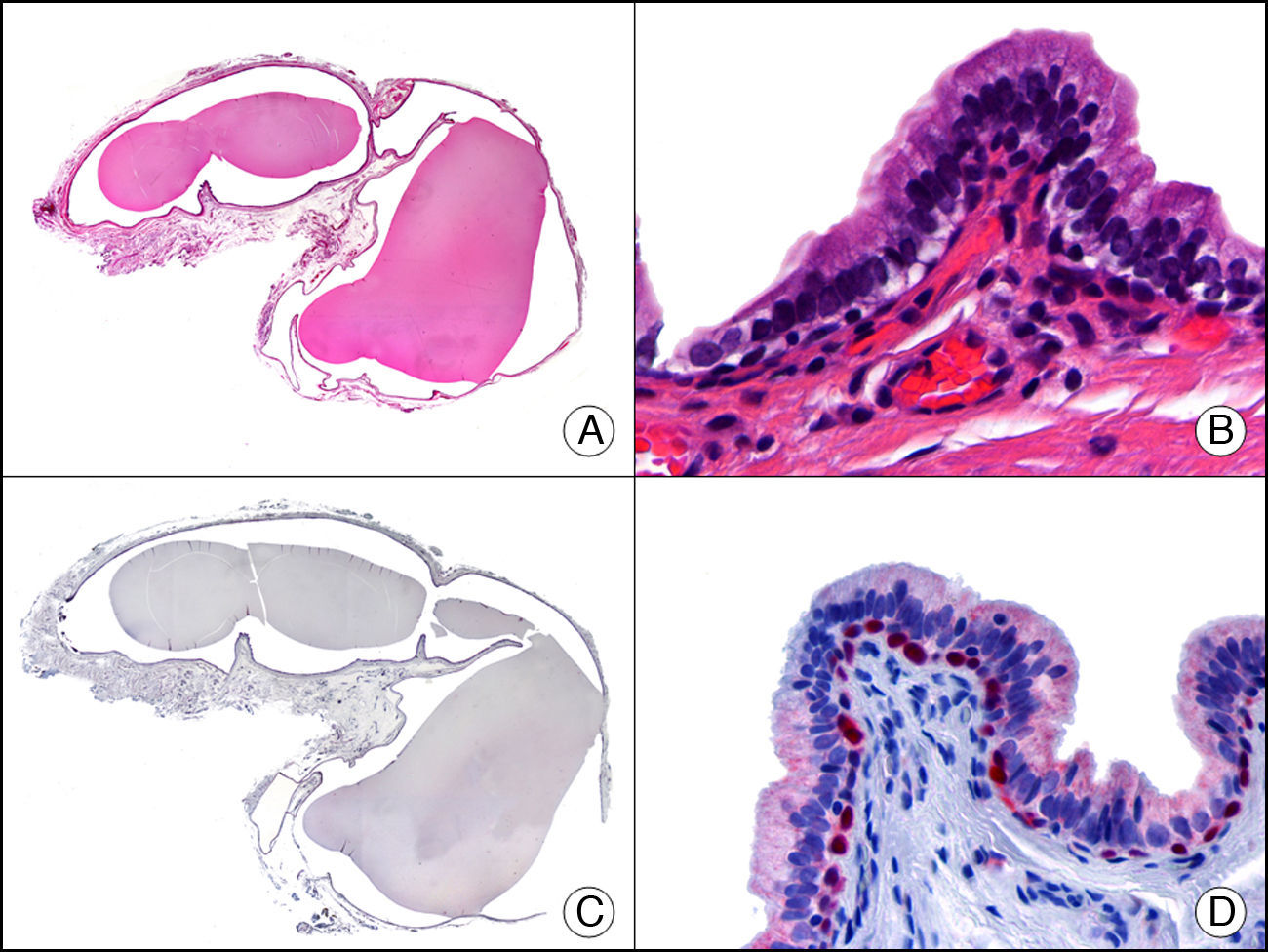
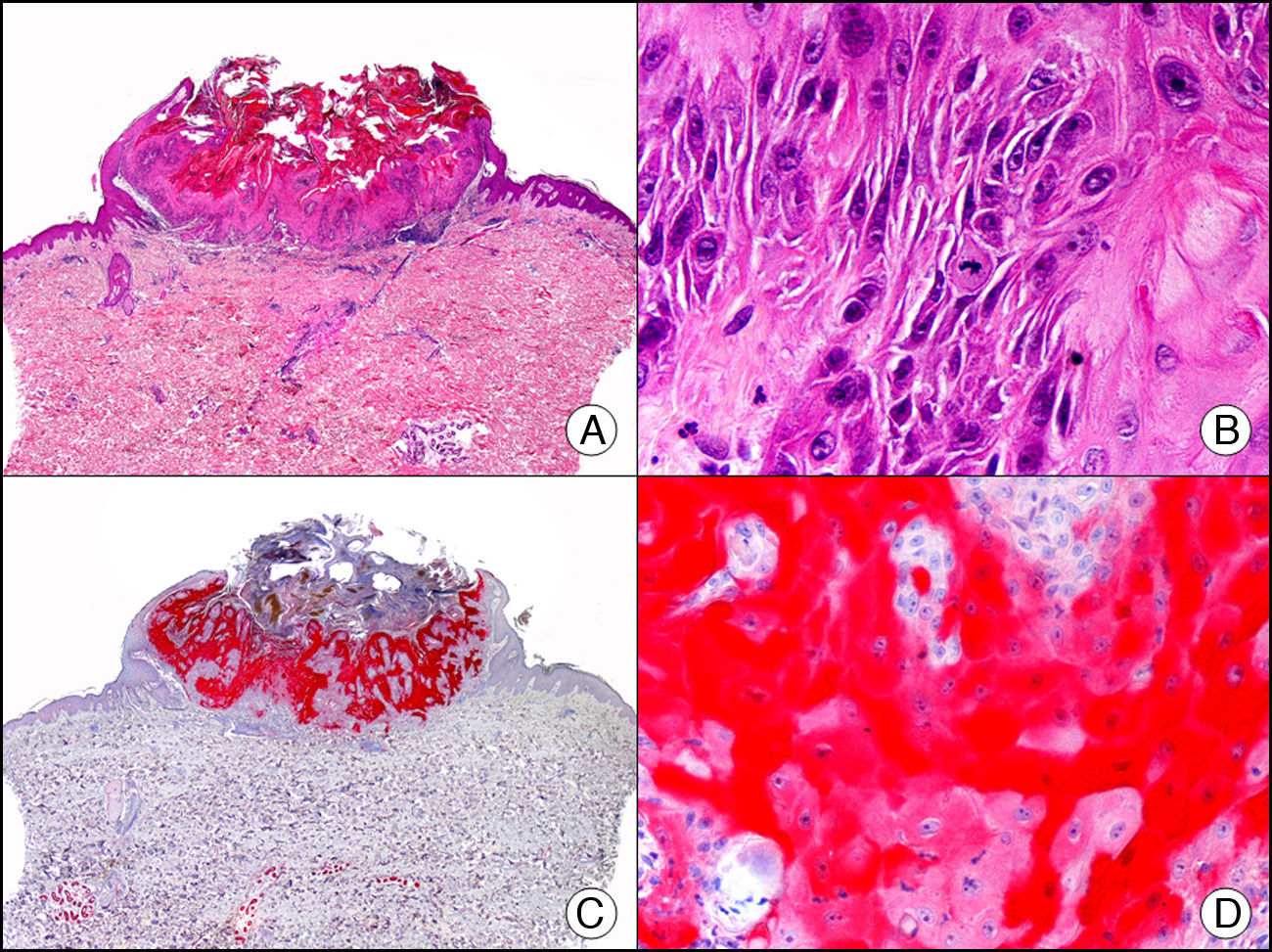
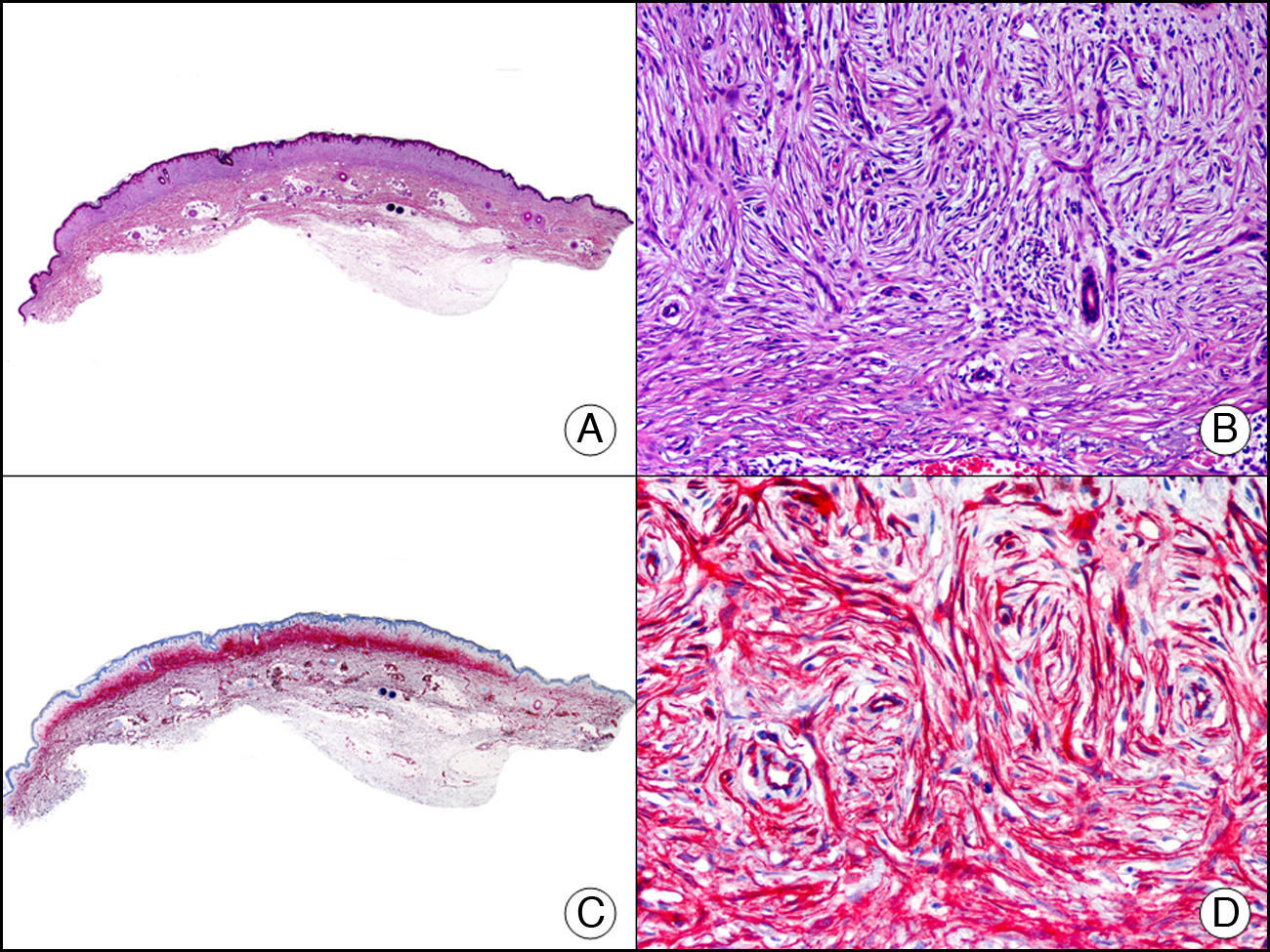
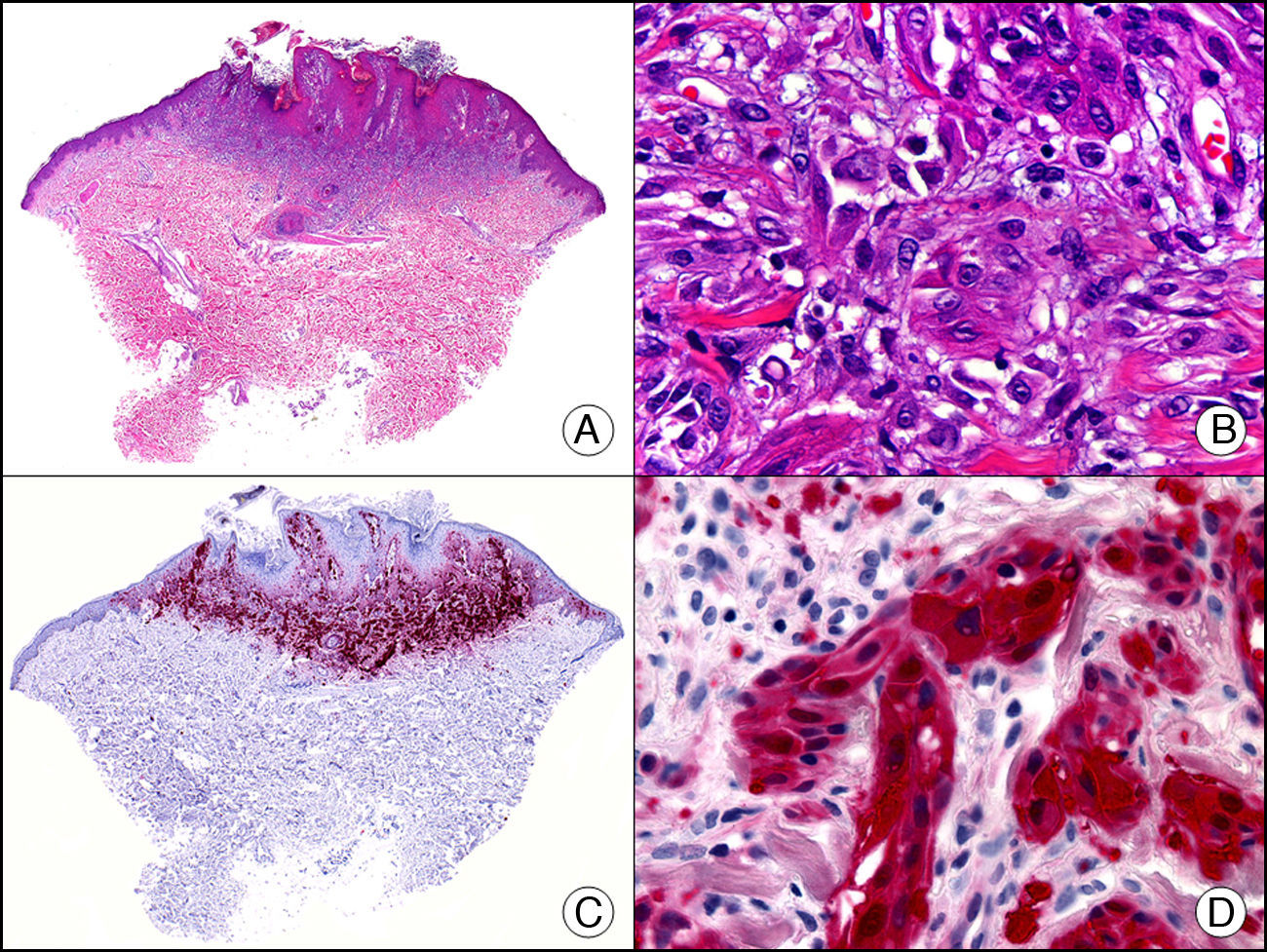
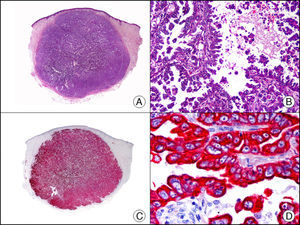
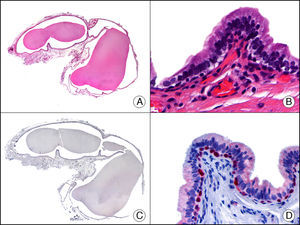
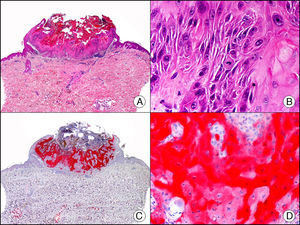
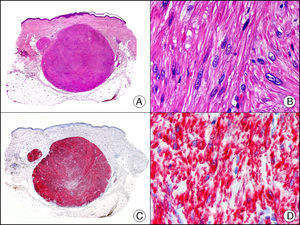
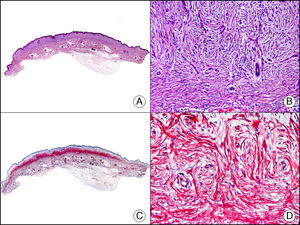
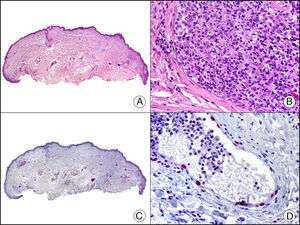
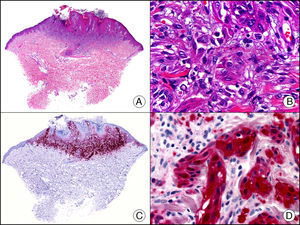
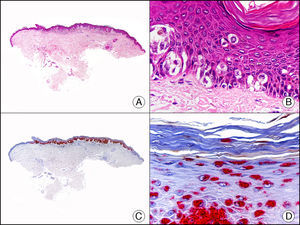
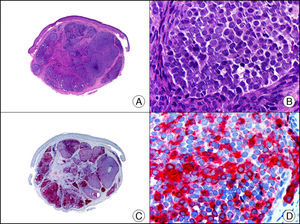
La CK 34βE12/CK 903 es el marcador más utilizado para identificar CK de alto PM. Reconoce las CK 1, 10 y 14, que se expresan en el epitelio ductal, epitelio escamoso, en células basales y en células mioepiteliales3. Esta CK se expresa en adenocarcinomas de mama, páncreas, vías biliares y glándulas salivales, así como en carcinomas de células escamosas y de células transicionales. En dermatopatología esta CK es también muy útil para demostrar la naturaleza epitelial de la sustancia amiloide en las papilas dérmicas en casos de amiloidosis maculosa y liquen amiloideo (fig. 4). En neoplasias cutáneas esta CK es positiva en el carcinoma espinocelular y en tumores anexiales. Recientemente se ha postulado su utilidad en el diagnóstico diferencial entre carcinoma espinocelular atípico y fibroxantoma atípico (FXA)9.
Liquen amiloide. A. Visión panorámica (x10). B. Detalle mostrando hiperplasia de la epidermis y depósitos de sustancia amiloide en la dermis papilar (x200). C. El mismo caso teñido con citoqueratina 903. Obsérvese la positividad tanto de la epidermis como de la sustancia amiloide de la dermis papilar, demostrando su origen epitelial (x10). D. Detalle de la sustancia amiloide en la dermis papilar con positividad de la citoqueratina 903 (x200).
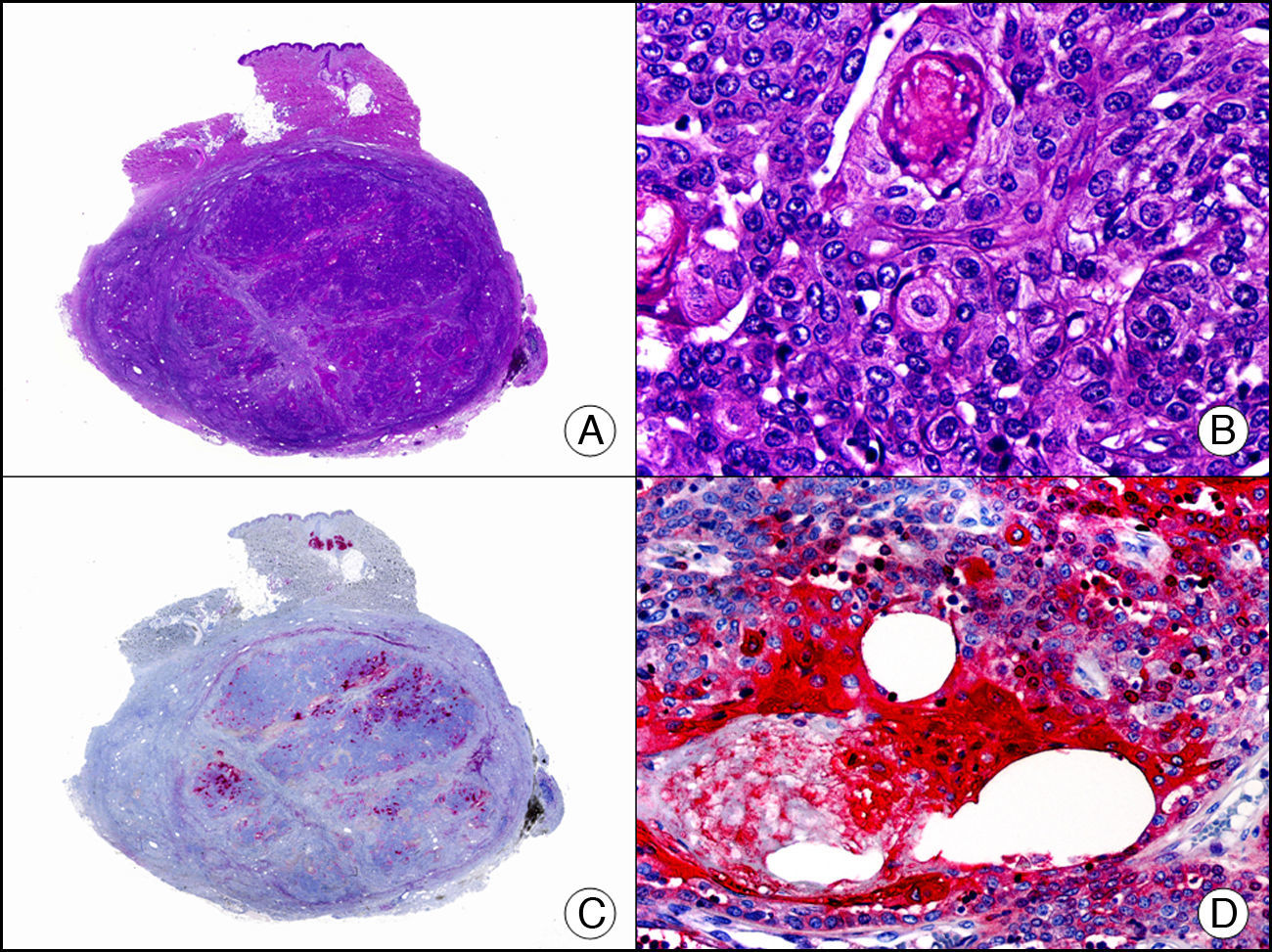
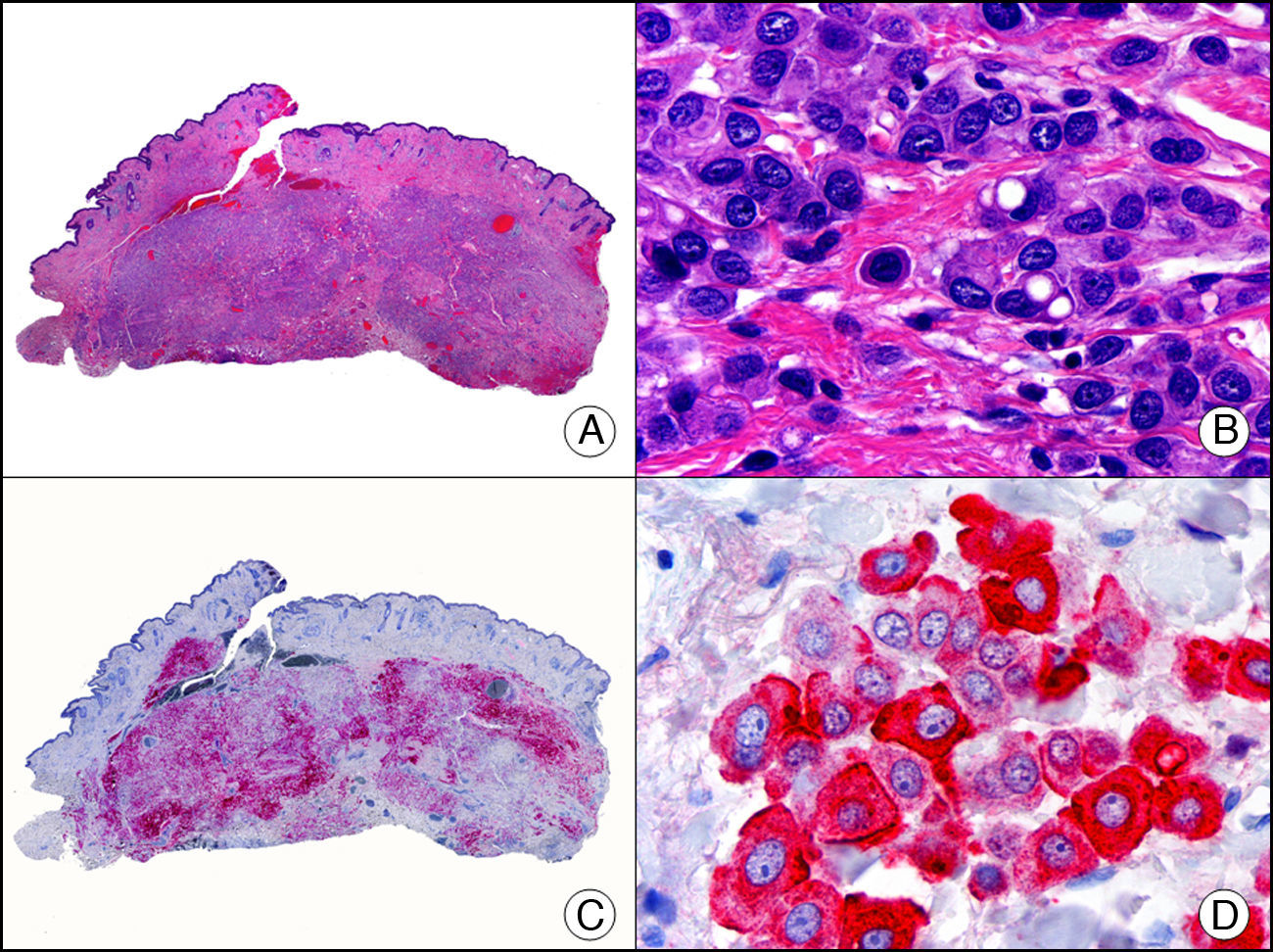
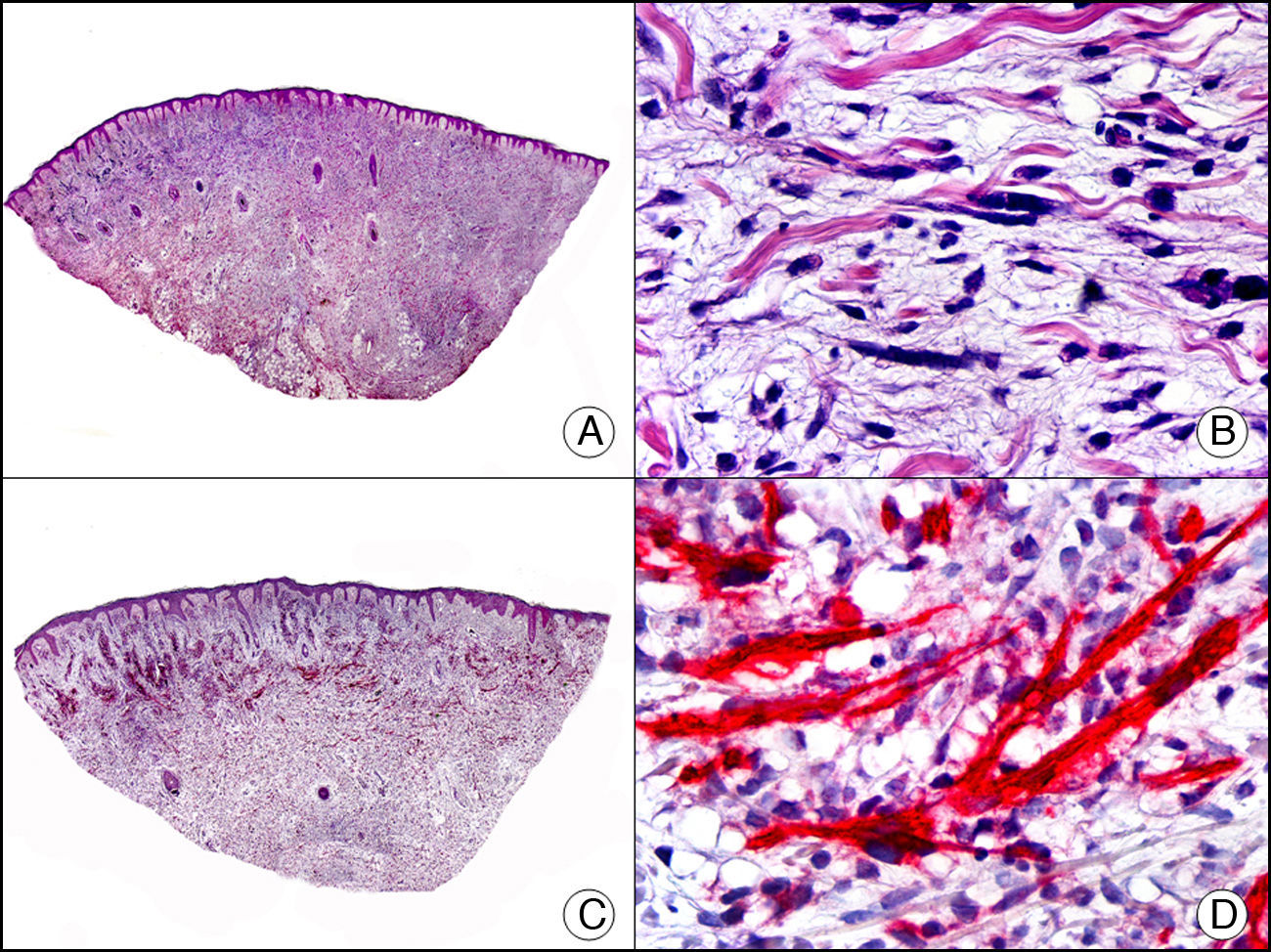
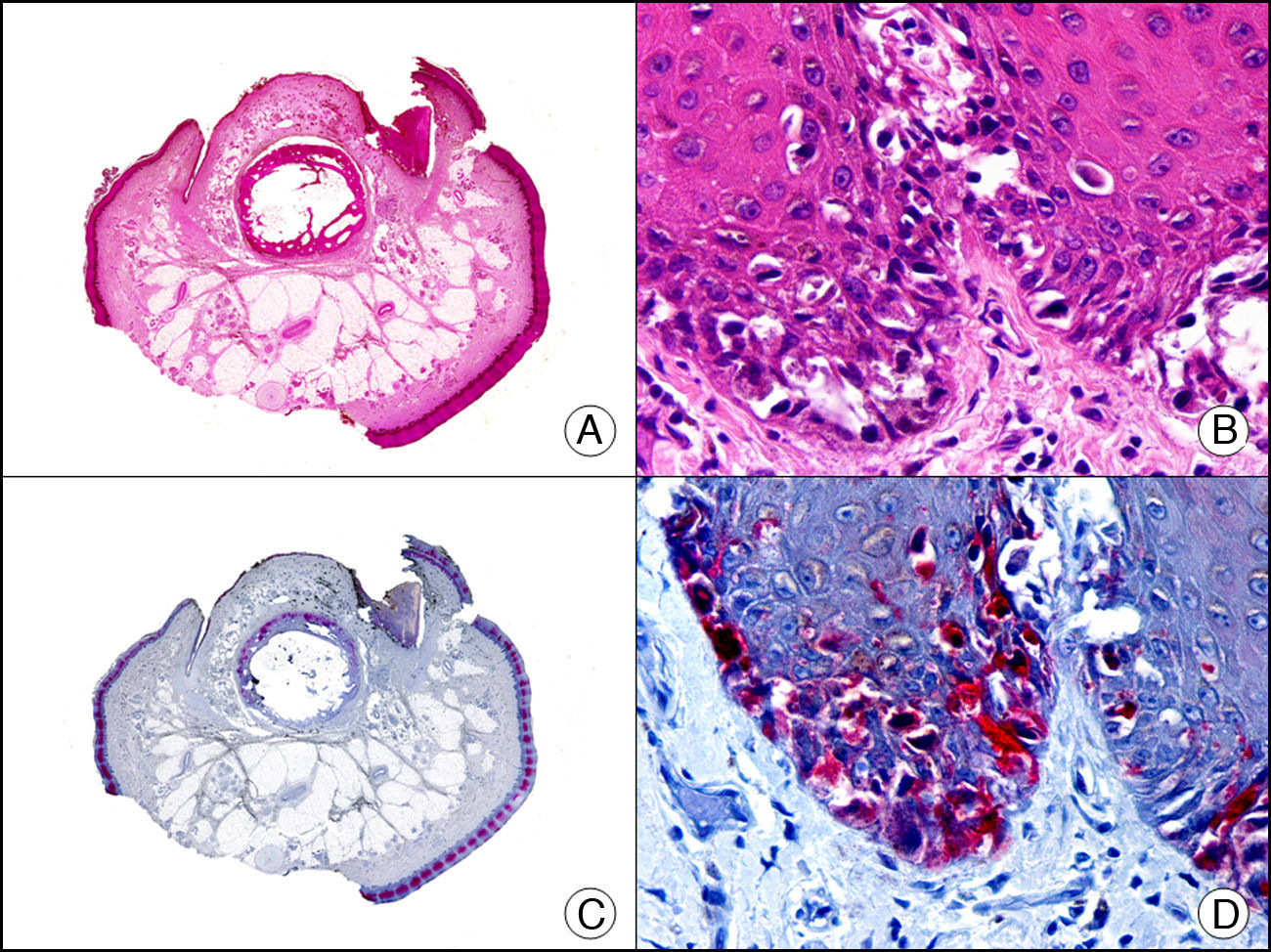
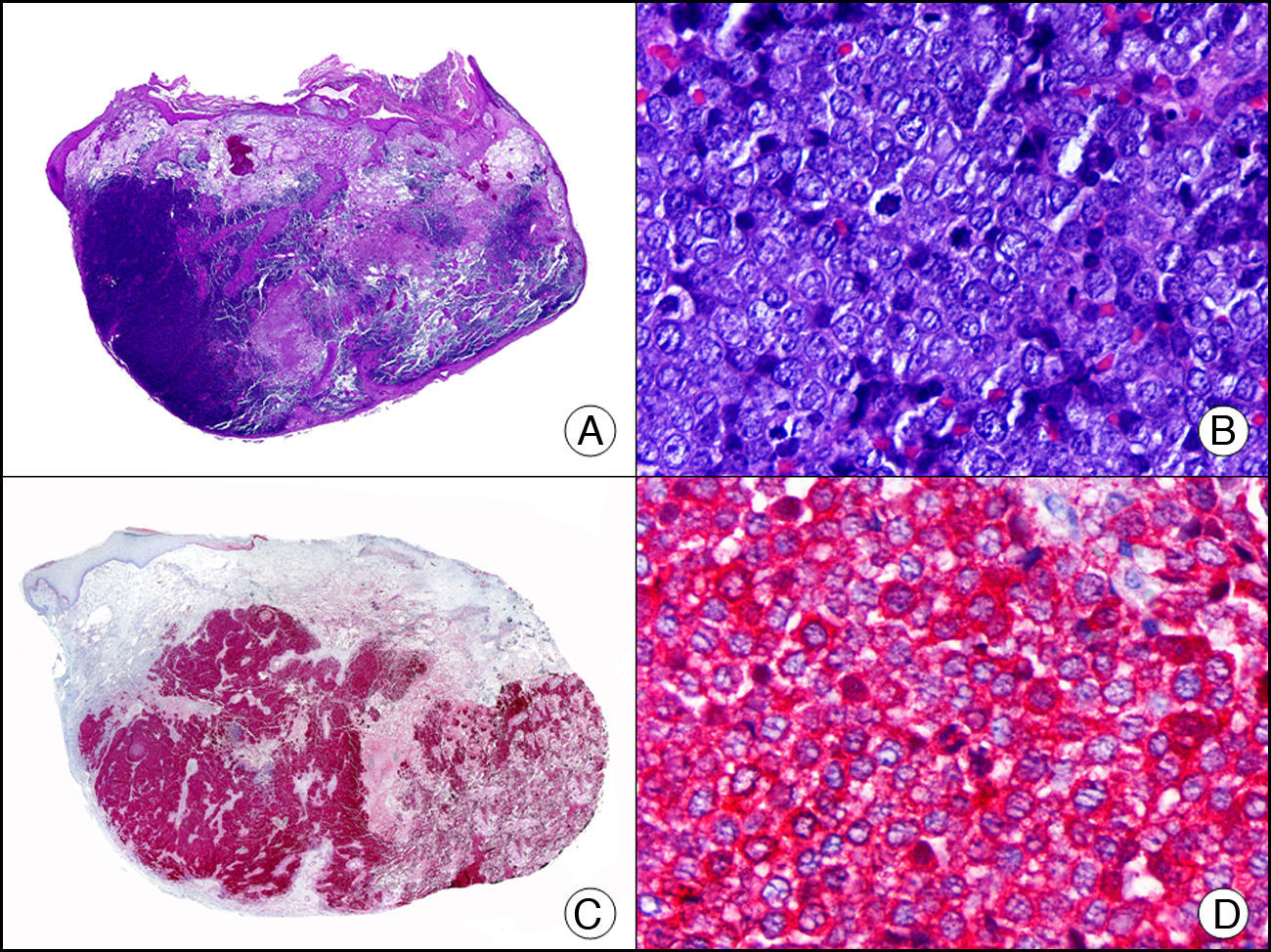
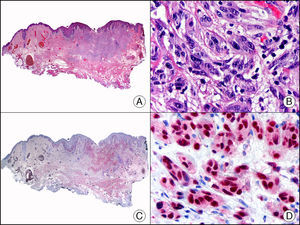
La CK MNF116 es otra pan-CK que reconoce las CK 5, 6, 8, 17 y 19. Presenta un patrón amplio de reactividad desde el epitelio glandular simple al epitelio escamoso estratificado. En la piel normal se expresa de forma particularmente intensa en las células basales de la epidermis y en los anejos cutáneos3. Resulta por tanto positiva en neoplasias epiteliales, tanto benignas como malignas, y negativa en todas las neoplasias mesenquimales y melanocíticas. Es también muy útil en la identificación de algunas variantes histopatológicas poco frecuentes de carcinoma espinocelular indiferenciado, como el carcinoma espinocelular de células fusiformes o el carcinoma espinocelular sarcomatoide10,11 (fig. 5).
Carcinoma espinocelular muy indiferenciado con apariencia sarcomatoide. A. Visión panorámica (x10). B. Detalle de las células neoplásicas mostrando una morfología fusocelular y sin evidencia de queratinización (x400). C. El mismo caso estudiado inmunohistoquímicamente con pancitoqueratina MNF116. Obsérvese la positividad de la epidermis y del epitelio de los anejos de la dermis como control positivo interno (x10). D. A gran aumento, se observa cómo, además de los ductos ecrinos, algunas células neoplásicas expresan positividad para la pancitoqueratina MNF116 en su citoplasma (x400).
La CK7 está presente en gran variedad de epitelios simples. Los carcinomas espinocelulares cutáneos son habitualmente negativos para esta CK, mientras que los originados en otros epitelios escamosos no queratinizantes, como el cuello uterino, resultan positivos. Es un marcador muy sensible y bastante específico en la identificación de las células neoplásicas de la enfermedad de Paget mamaria y extramamaria3,12,13 (fig. 6).
Metástasis epidermotropa de carcinoma de vejiga en la mucosa del glande simulando enfermedad de Paget extramamaria. A. Visión panorámica (x10). B. A mayor aumento se observan células grandes de núcleo pleomórfico y citoplasma amplio salpicadas por todo el espesor del epitelio (x400). C. El mismo caso estudiado inmunohistoquímicamente con citoqueratina 7 (x10). D. A mayor aumento, se observa cómo las células neoplásicas intraepiteliales expresan citoqueratina 7 (x400).
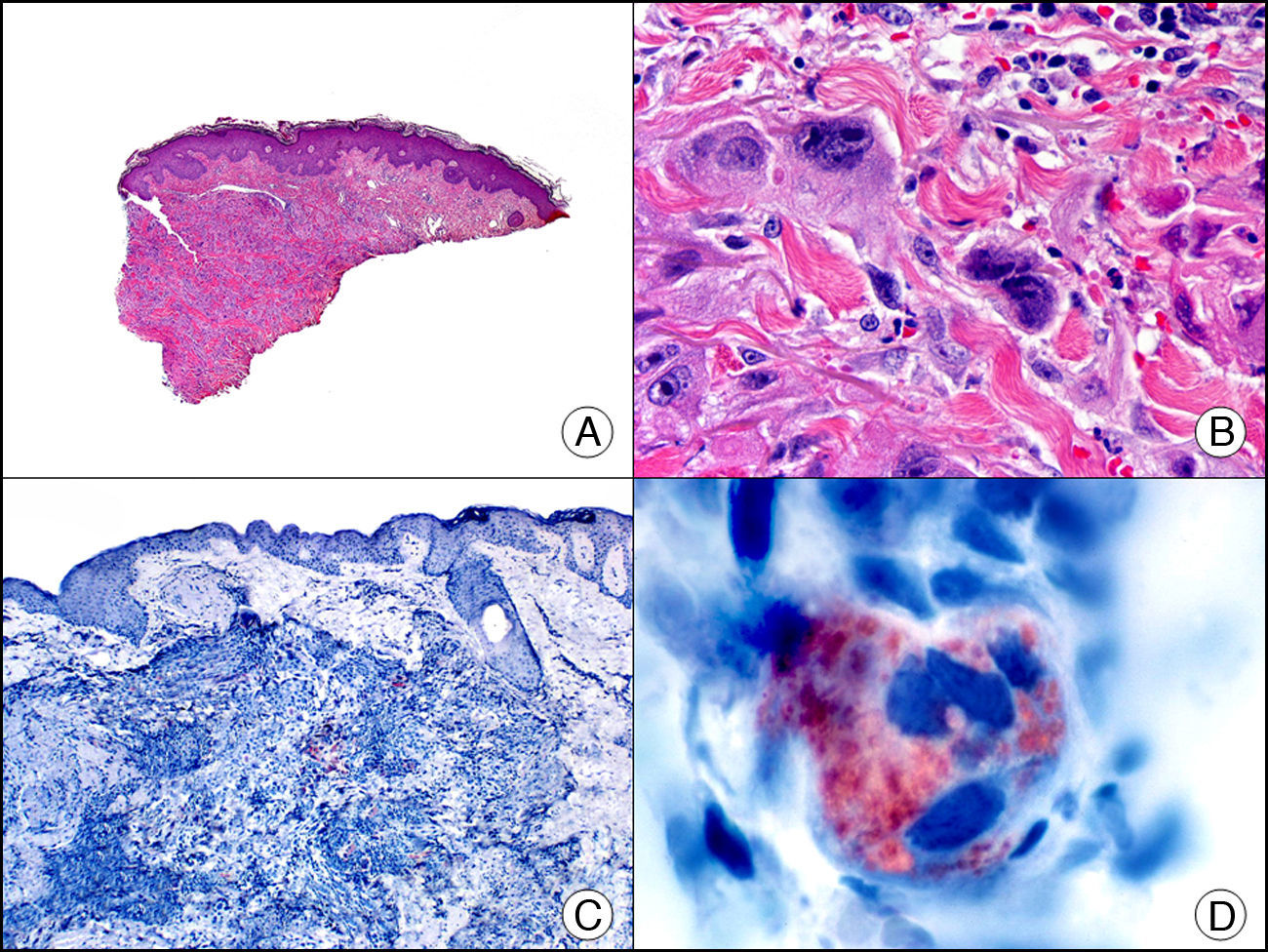
La CK20 muestra un rango de expresión más restringido que la CK7. Es positiva en carcinoma de células transicionales, en el tumor de Merkel (con un patrón muy típico de glóbulo paranuclear) (fig. 7), así como en adenocarcinomas biliares, de páncreas, de colon y de recto, por lo que resulta muy útil en el estudio inmunohistoquímico de neoplasias cutáneas tanto primarias como metastásicas. Su utilidad en el diagnóstico diferencial histopatológico entre la enfermedad de Paget extramamaria primaria (o verdadera enfermedad de Paget extramamaria) y la secundaria (que consiste en realidad en metástasis epidermotropas que simulan enfermedad de Paget extramamaria) es bastante controvertida, porque parece que marca ampliamente (aunque en menor medida que la CK7) lesiones de ambos procesos13. Junto con la CK7 se incluye en los paneles de anticuerpos utilizados para tratar de identificar el tumor primario en las metástasis cutáneas de origen desconocido10.
Tumor de Merkel. A. Visión panorámica (x10). B. Características citológicas de las células neoplásicas a gran aumento mostrando su núcleo redondo y basófilo, con cromatina granular y sin nucléolo y escaso citoplasma (x400). C. El mismo caso estudiado inmunohistoquímicamente con citoqueratina 20 (x10). D. Detalle a gran aumento de la positividad en el glóbulo paranuclear para la citoqueratina 20 en las células neoplásicas (x400).
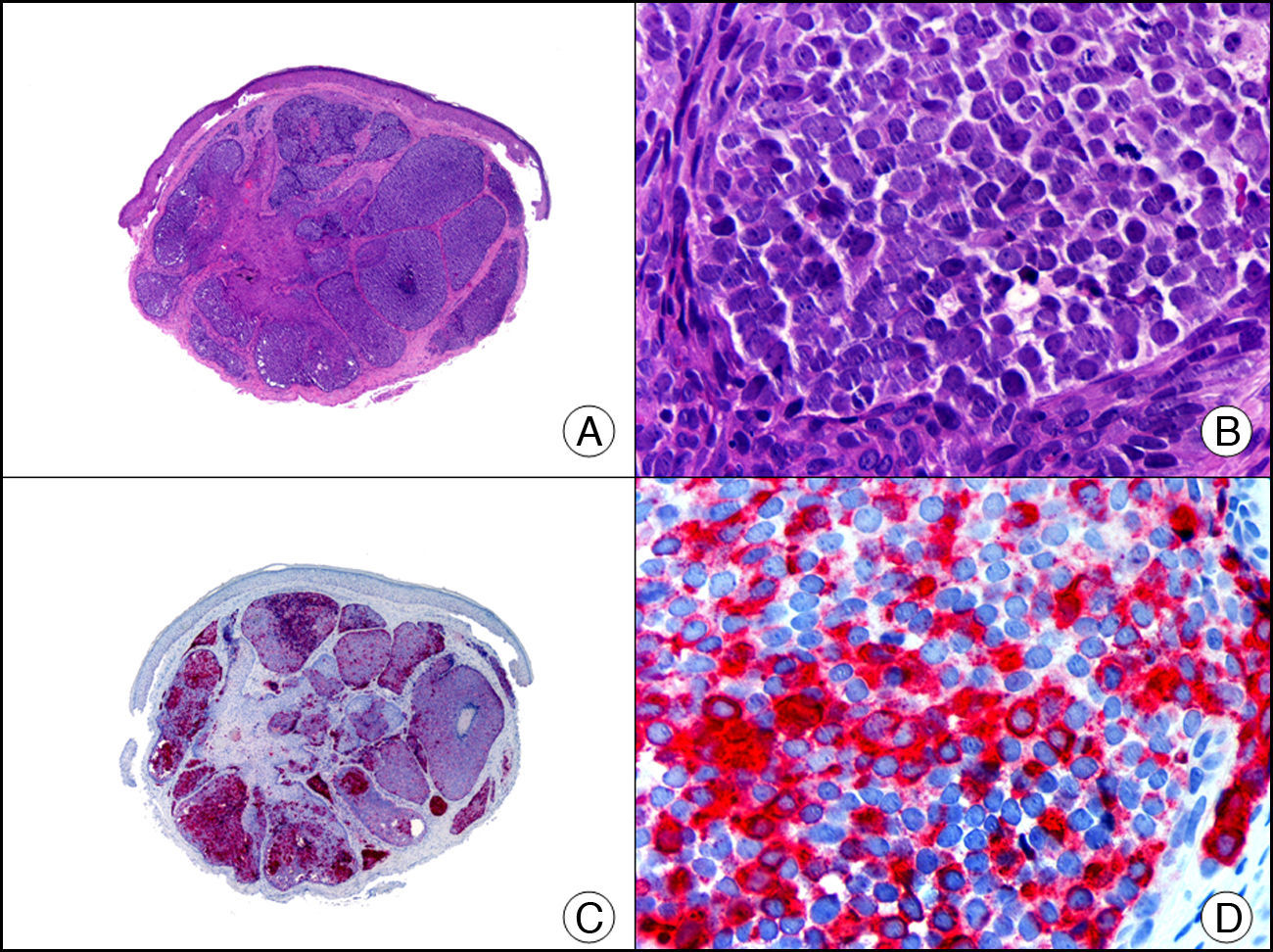
La CK5/6 reconoce CK de alto PM. Es un marcador útil de diferenciación escamosa que resulta positivo en la epidermis y en el epitelio de los anejos, así como en múltiples neoplasias anexiales cutáneas, tanto benignas (fig. 8) como malignas. Parece ser que también se expresa débilmente hasta en el 30% de las metástasis de adenocarcinoma, por lo que posee cierta utilidad en el diagnóstico diferencial histopatológico entre neoplasias cutáneas primarias y metástasis cutáneas de carcinomas viscerales3,14. La mayoría de los mesoteliomas, carcinomas de células escamosas, carcinomas de células basales y carcinomas de células transicionales expresan la CK5/6, mientras que la mayoría de los adenocarcinomas resultan negativos.
Poroma. A. Visión panorámica (x10). B. A mayor aumento se observa que la mayoría de las células neoplásicas son células poroides, pero también existen algunas células cuticulares alrededor de un pequeño ducto (x200). C. El mismo caso estudiado inmunohistoquímicamente con citoqueratinas 5/6 (x10). D. A mayor aumento se observa cómo las células neoplásicas expresan citoqueratinas 5/6 (x200).
La CK14 es positiva en tumores del epitelio epidérmico, como el carcinoma espinocelular y el carcinoma basocelular (fig. 9), así como en neoplasias de epitelio anexial, como el poroma, el adenoma sebáceo, el tumor tricolemal proliferante o el tricoblastoma. Sin embargo, resulta negativa en los adenocarcinomas anexiales.
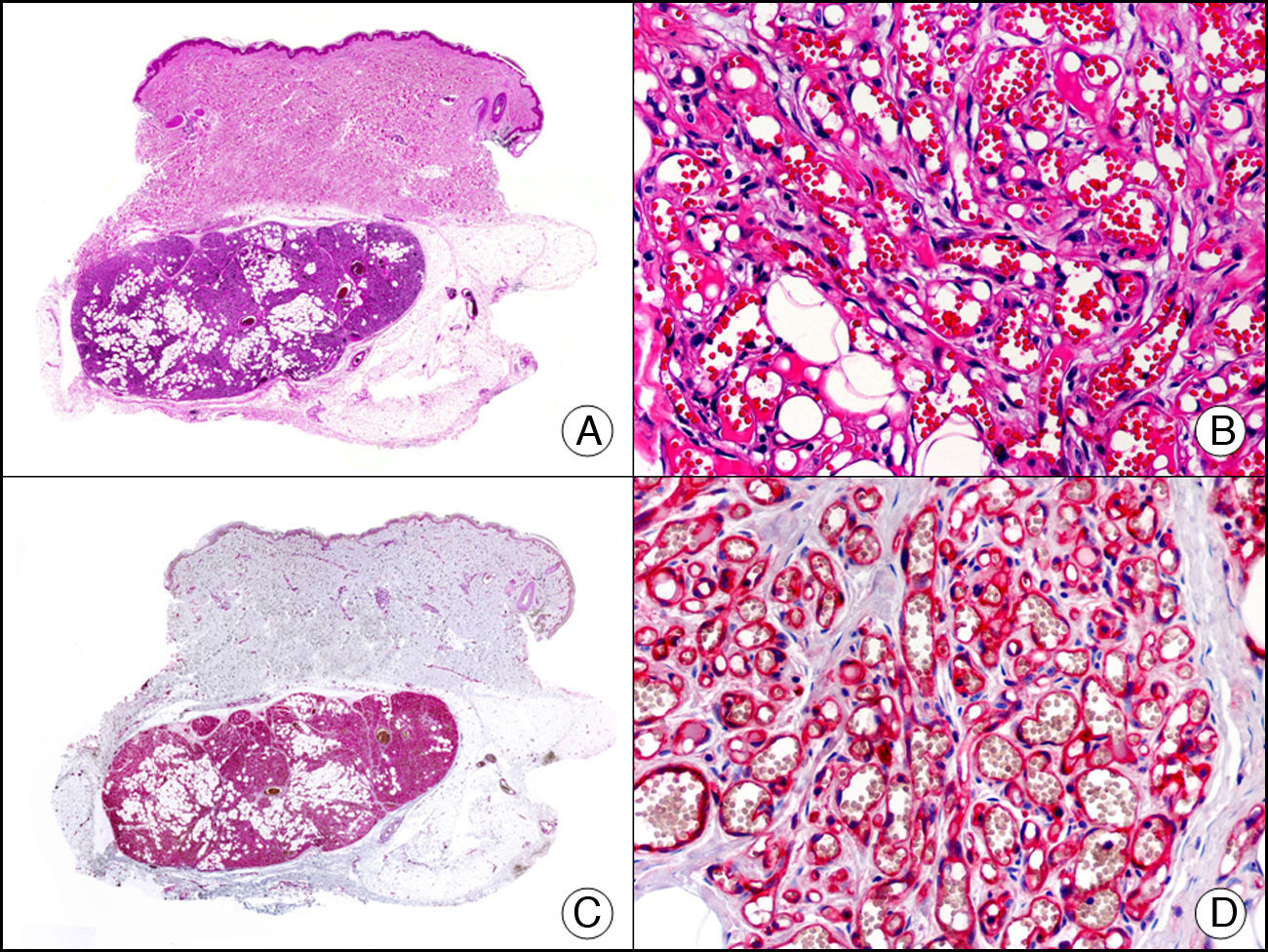
La CK8 resulta negativa tanto en el carcinoma espinocelular como en el carcinoma basocelular y en el mioepitelioma. Sin embargo, esta CK es positiva en algunas neoplasias con diferenciación ecrina y apocrina, como el siringoma o el hidradenoma apocrino (fig. 10).
Hidradenoma apocrino de células claras. A. Visión panorámica (x10). B. Detalle a gran aumento de un agregado de células neoplásicas mostrando su morfología de células claras (x400). C. El mismo caso estudiado inmunohistoquímicamente con citoqueratina 8 (x10). D. Detalle de la positividad para citoqueratina 8 de las células neoplásicas (x400).
El p63 (KET, p73L) es una proteína miembro de la familia p53 de genes supresores tumorales. Tiene la capacidad de actuar como factor de transcripción regulando la progresión del ciclo celular, manteniendo la capacidad proliferativa o induciendo apoptosis, en función del estímulo ambiental recibido por la célula. Se encuentra principalmente en la capa basal del epitelio escamoso estratificado y del epitelio de transición. En la piel se expresa intensamente en el núcleo de las células basales y suprabasales de la epidermis, así como en el de las células mioepiteliales que rodean los ovillos secretores de las glándulas ecrinas y apocrinas. Este marcador está ausente en los fibroblastos dérmicos, las fibras de músculo liso, las células de Schwann y las células endoteliales. También se expresa en las células basales del epitelio del cuello uterino, la vagina, el urotelio, la mucosa bronquial, las glándulas prostáticas y las células mioepiteliales de las glándulas seromucosas (fig. 11). Se ha observado expresión de p63 en algunos carcinomas escamosos, como los de la piel, el pulmón y el cuello uterino, así como en el carcinoma papilar de tiroides. En el carcinoma escamoso fusocelular pobremente diferenciado, habitualmente negativo para muchas CK, la positividad para p63 es especialmente útil para el diagnóstico y para su diagnóstico diferencial con el FXA, el melanoma fusocelular y el leiomiosarcoma cutáneo3. La mayoría de los carcinomas anexiales cutáneos y sus metástasis expresan p63, mientras que este marcador es negativo en adenocarcinomas viscerales y sus metástasis cutáneas, con un valor discriminatorio similar al de la podoplanina (D2-40)15.
Quiste de prepucio en un recién nacido. A. Visión panorámica (x10). B. Detalle del epitelio de la pared del quiste con una hilera de células periféricas cuboideas y una hilera luminal de células columnares (x400). C. El mismo caso estudiado inmunohistoquímicamente con p63 (x10). D. Detalle a gran aumento donde se observa positividad del p63 en los núcleos de las células de la hilera periférica, que probablemente corresponden a células mioepiteliales (x400).
El antígeno epitelial de membrana (EMA) es una proteína glucosilada que se expresa en la superficie de varios epitelios glandulares y sus neoplasias. En la piel normal se ha demostrado su presencia en las glándulas sebáceas, tanto en el ducto excretor como en los sebocitos, tiñendo las microvacuolas lipídicas del citoplasma de estos últimos y, por lo tanto, constituye uno de los marcadores inmunohistoquímicos más utilizados en la investigación de diferenciación sebácea en una neoplasia cutánea (fig. 12). En las glándulas ecrinas y apocrinas en la mayoría de los casos se tiñe tanto su porción secretora como su ducto excretor, aunque en algunos estudios el ducto ecrino ha resultado ser EMA negativo16–19. También se expresa el EMA en las células perineurales. Este antígeno no se expresa en el epitelio escamoso normal, aunque con frecuencia resulta positivo en el carcinoma escamoso19,20. El EMA es también positivo en las células plasmáticas e identifica las células neoplásicas de la enfermedad de Paget extramamaria, diferenciándolas claramente de los queratinocitos epidérmicos vecinos2. Por último, este antígeno se ha demostrado en células neoplásicas de proliferaciones de estirpe tan variada como meningiomas, mesoteliomas, muchos tumores mesenquimales e incluso algunos linfomas como el linfoma anaplásico de células grandes CD30 positivo.
Carcinoma sebáceo. A. Visión panorámica (x10). B. A gran aumento se observan hallazgos indicativos de diferenciación sebácea en forma de sebocitos inmaduros y ductos sebáceos (x400). C. El mismo caso estudiado inmunohistoquímicamente con EMA. Obsérvese el control interno positivo de las glándulas sebáceas normales de la dermis (x10). D. Detalle de la positividad para el EMA en las áreas con diferenciación sebácea más evidente (x400).
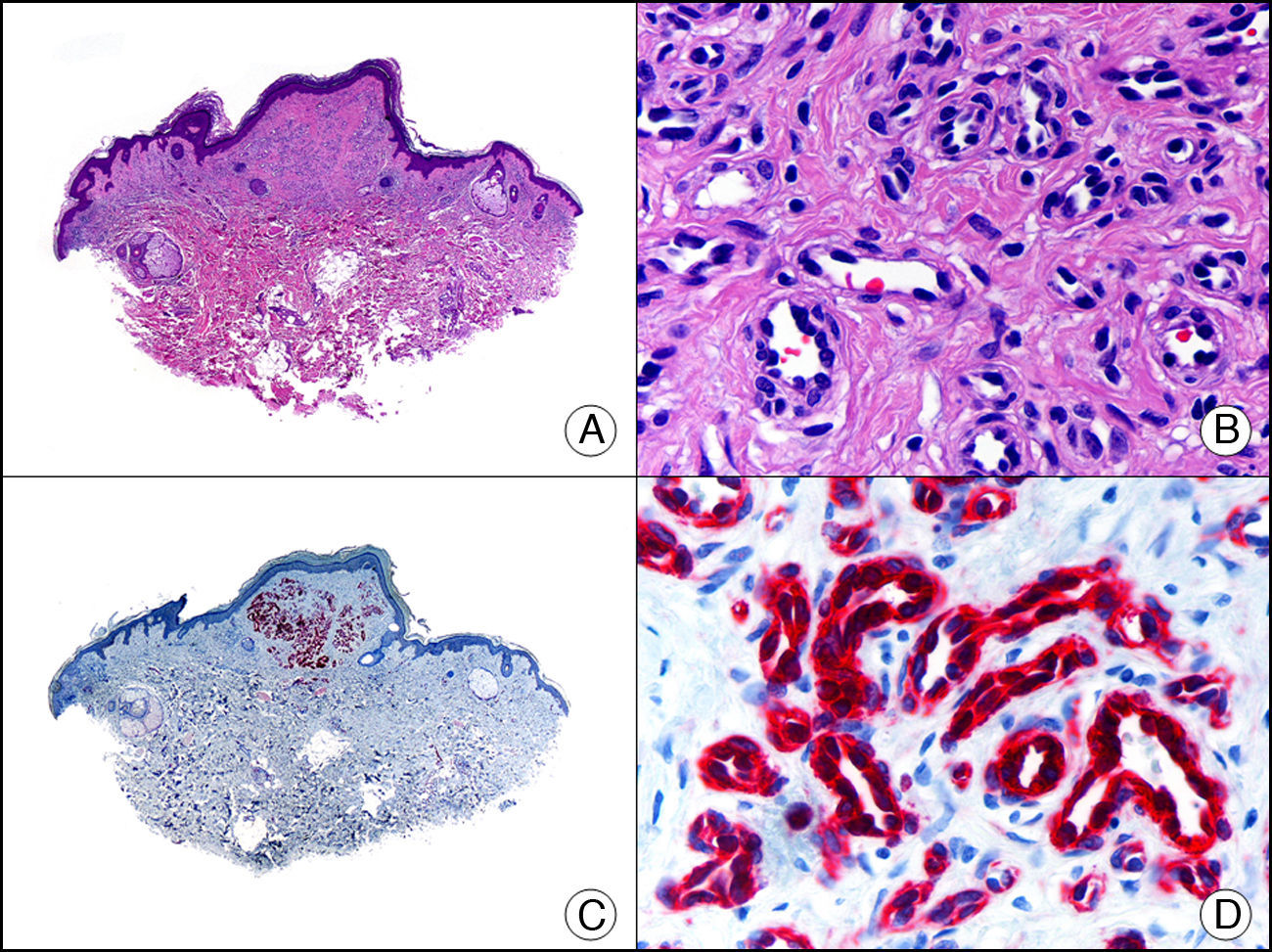
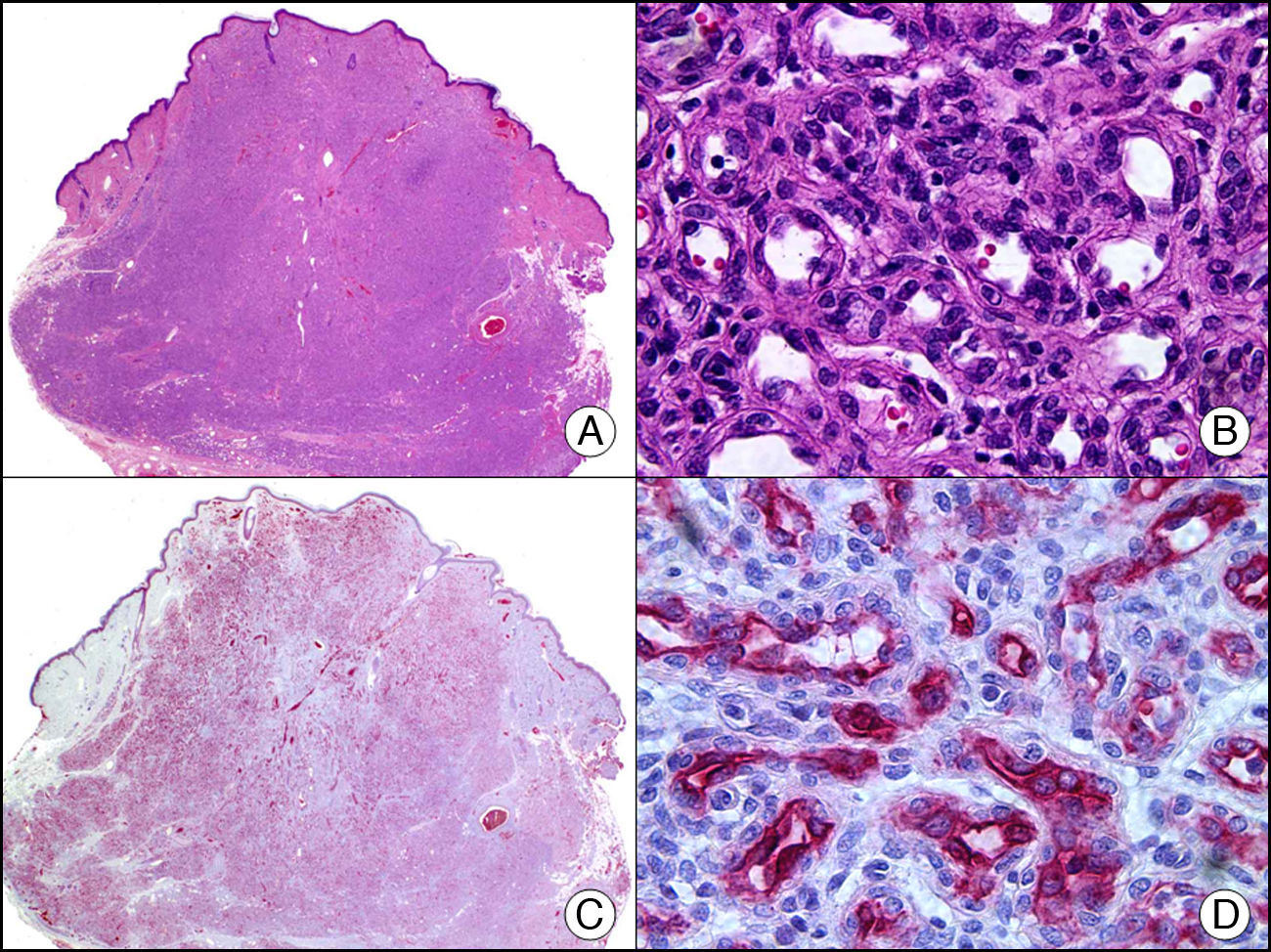
El antígeno carcinoembrionario (CEA) es otra proteína glucosilada que en la piel normal se encuentra presente en glándulas ecrinas y apocrinas, pero no en las glándulas sebáceas2. Dentro de las glándulas ecrinas el CEA se expresa tanto en su porción secretora como excretora, mientras que en las glándulas apocrinas se observa intensa positividad en la cutícula luminar del ducto excretor, pero con frecuencia la porción secretora resulta CEA negativa21. El CEA es un importante marcador de adenocarcinomas, tanto primarios cutáneos (fig. 13), como metástasis cutáneas de adenocarcinomas viscerales, y también se expresa en las células neoplásicas de la enfermedad de Paget mamaria y extramamaria8.
Carcinoma cribiforme primario cutáneo. A. Visión panorámica (x10). B. Detalle del patrón cribiforme de los islotes epiteliales de la neoplasia (x400). C. El mismo caso estudiado inmunohistoquímicamente con CEA (x10). D. Detalle de la positividad para el CEA de las células neoplásicas (D x400).
La proteína del líquido de la enfermedad quística (gross cystic disease fluid protein [GCDFP]) está constituida por una familia de proteínas originalmente aisladas del fluido de la mastopatía fibroquística. Tanto el borde luminal de las estructuras tubulares secretoras, como los ductos excretores de las glándulas ecrinas y apocrinas muestran intensa inmunorreactividad para este marcador2. Se ha observado también expresión variable de este marcador en muchas neoplasias ductales y secretoras, con diferenciación ecrina y apocrina (fig. 14), así como en las células neoplásicas de la enfermedad de Paget mamaria y extramamaria12,22.
Carcinoma de células histiocitoides primario de párpado. A. Visión panorámica (x10). B. Detalle del aspecto histiocitoide de las células neoplásicas. Algunas células muestran vacuolización citoplasmática (x400). C. El mismo caso estudiado inmunohistoquímicamente con GCDFP-15 (x10). D. Detalle de la positividad para GCDFP-15 en las células neoplásicas (x400).
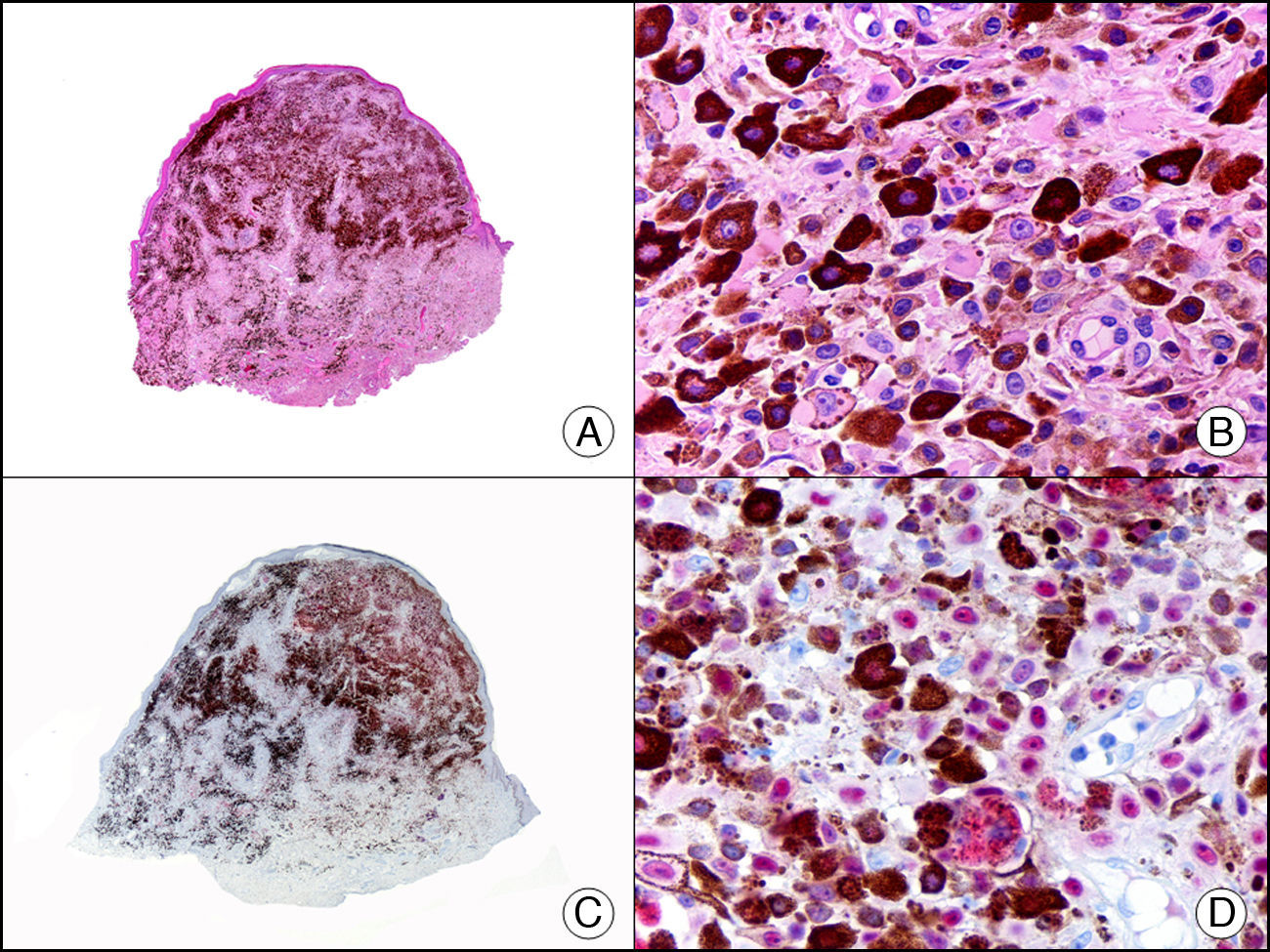
La calretinina es una proteína fijadora de calcio de 32- kDa que pertenece a la familia de proteínas EF, que son proteínas cuya secuencia de aminoácidos se pliega para formar una estructura helicoidal en lazo. La estructura de la calretinina se caracteriza por poseer 6 dominios EF y 5 puntos fijadores de calcio. Su principal función es la de actuar como tampón, previniendo la excesiva acumulación de calcio intracelular. La expresión de calretinina se ha demostrado en distintas fases del ciclo celular en una amplia variedad de tejidos normales y neoplásicos. En la piel normal se expresa en la denominada capa acompañante, que es la capa más interna de la vaina radicular externa del folículo piloso, en el conducto sebáceo y en la porción secretora de las glándulas ecrinas, mientras que la porción secretora de las glándulas apocrinas, así como los ductos excretores ecrinos y apocrinos son calretinina negativos23–25. En neoplasias cutáneas se observa positividad para la calretinina en proliferaciones que muestran diferenciación hacia la vaina radicular externa del folículo piloso (diferenciación tricolémica), diferenciación sebácea ductal y diferenciación secretora ecrina, como el tumor mixto ecrino23–25. Curiosamente, las células neoplásicas de proliferaciones cutáneas tan dispares como el tumor de células granulosas, el queratoacantoma (fig. 15) y el carcinoma espinocelular también muestran intensa positividad para la calretinina.
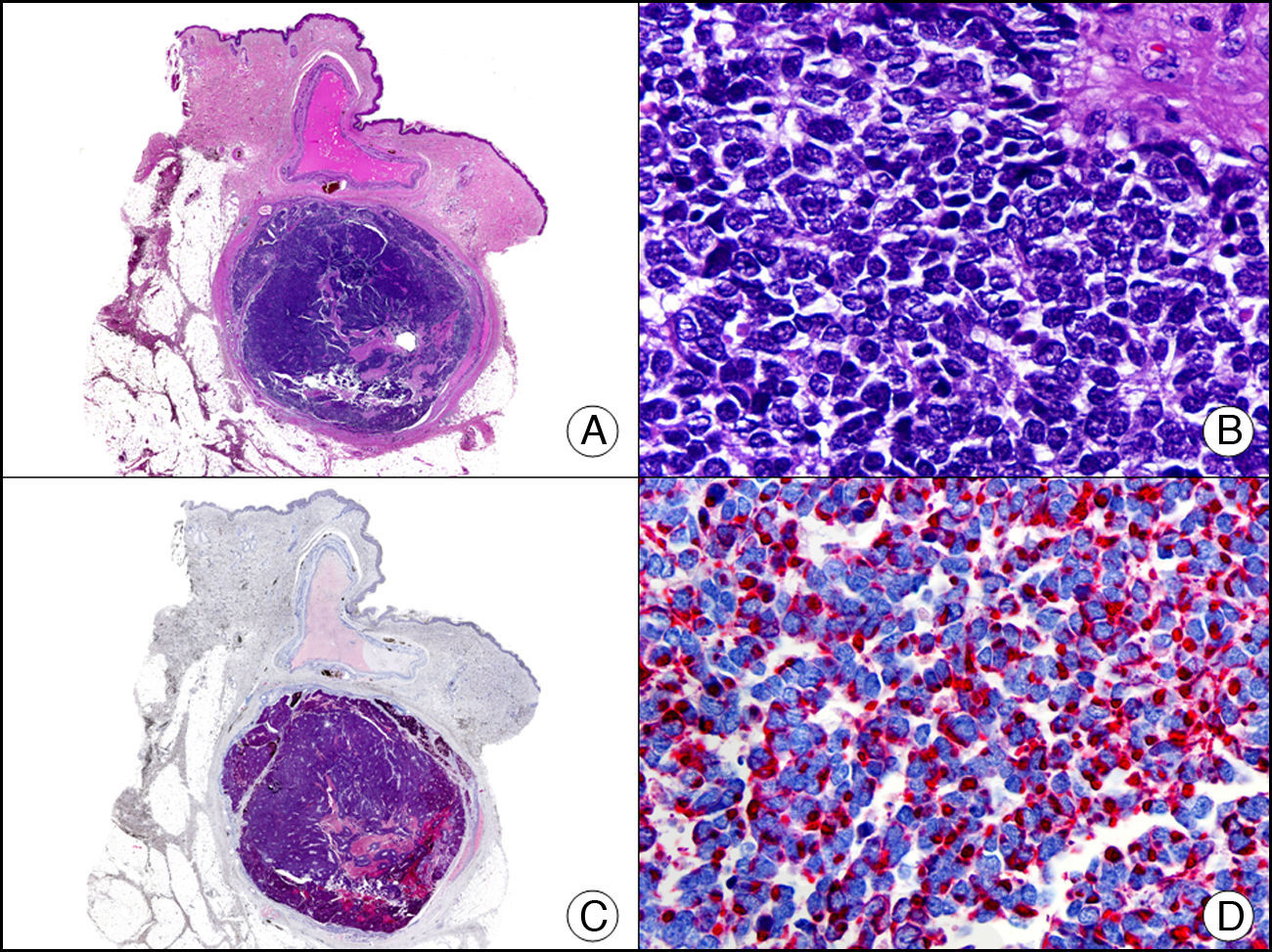
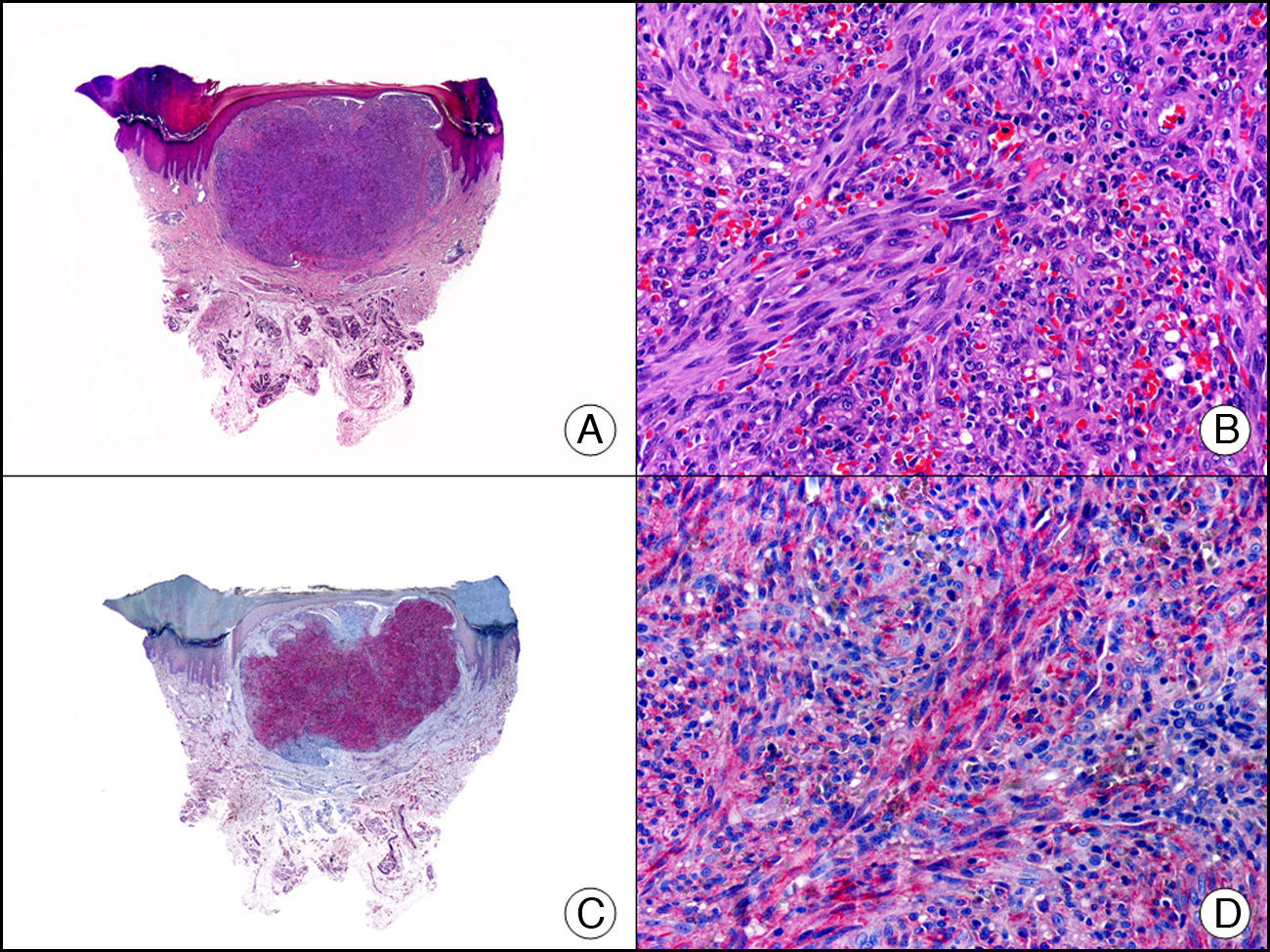
La gonadotrofina coriónica humana es una glucoproteína de 40kDa. Está compuesta por una subunidad alfa y otra beta. La subunidad beta (βHCG) es secretada por la placenta y normalmente es detectable en sangre solo durante la gestación. La βHCG es el marcador más importante de las células trofoblásticas gestacionales, está presente en las células del sincitiotrofoblasto y células del trofoblasto intermedio, pero ausente en el citotrofoblasto. Este marcador tiñe de forma intensa y difusa las células sincitiotrofoblásticas del coriocarcinoma (fig. 16). La expresión de βHCG en otros tumores no trofoblásticos puede indicar un comportamiento agresivo de los mismos26.
Metástasis cutánea de coriocarcinoma de testículo. A. Visión panorámica (x10). B. Detalle de las células de sincitiotrofoblasto (x400). C. El mismo caso estudiado inmunohistoquímicamente con beta-gonadotrofina coriónica (x40). D. Detalle de la positividad para beta-gonadotrofina coriónica en las células del sincitiotrofoblasto (x400).
La vimentina está presente prácticamente en todas las células embrionarias y en la mayoría de células adultas, sea cual sea su estirpe, en cultivos celulares. Durante la embriogénesis este filamento es reemplazado progresivamente por filamentos intermedios específicos para cada línea celular, pero se mantiene en las células mesenquimales. En la piel normal este marcador se expresa en los melanocitos de la unión dermo-epidérmica, así como en los fibroblastos, dendrocitos, vasos sanguíneos y linfáticos, músculo liso de la dermis y los adipocitos de la hipodermis. En oncología la expresión de vimentina se ha demostrado en todo tipo de sarcomas, melanomas, carcinomas fusocelulares y algunos no fusocelulares1. Además también son vimentina positivos la mayoría de mesoteliomas y gliomas. En dermatopatología resulta útil para demostrar diferenciación mesenquimal o para apoyar el diagnóstico de diferenciación melanocítica en melanomas amelanóticos pobremente diferenciados2. Esta expresión tan ubicua de la vimentina ha determinado que cada vez tenga menos valor diagnóstico por su escasa especificidad. Sin embargo, teniendo en cuenta su alta sensibilidad, algunos autores defienden la utilidad de la vimentina para establecer la idoneidad de un determinado tejido para su estudio con otros marcadores inmunohistoquímicos, ya que la positividad para la vimentina indica que los antígenos presentes en el tejido están bien conservados.
Marcadores de diferenciación muscularLa actina de músculo liso, como marcador individual, resulta el tipo de actina más útil en el diagnóstico histopatológico. Se expresa en el músculo liso, los miofibroblastos, los pericitos, las células glómicas y las células mioepiteliales, y es por tanto un marcador muy sensible para detectar diferenciación hacia músculo liso y miofibroblástica en tumores cutáneos1,2 (fig. 17). Sin embargo, como sucede con otros marcadores, la actina de músculo liso también está presente en otros muchos tumores no musculares de partes blandas.
Glomangioma cutáneo. A. Visión panorámica (x10). B. Detalle a gran aumento de las células neoplásicas alrededor de las luces vasculares mostrando su núcleo redondo y monomorfo y escaso citoplasma (x400). C. El mismo caso estudiado inmunohistoquímicamente con actina alfa de músculo liso (x10). D. Detalle de la positividad de las células neoplásicas para la actina alfa de músculo liso (x400).
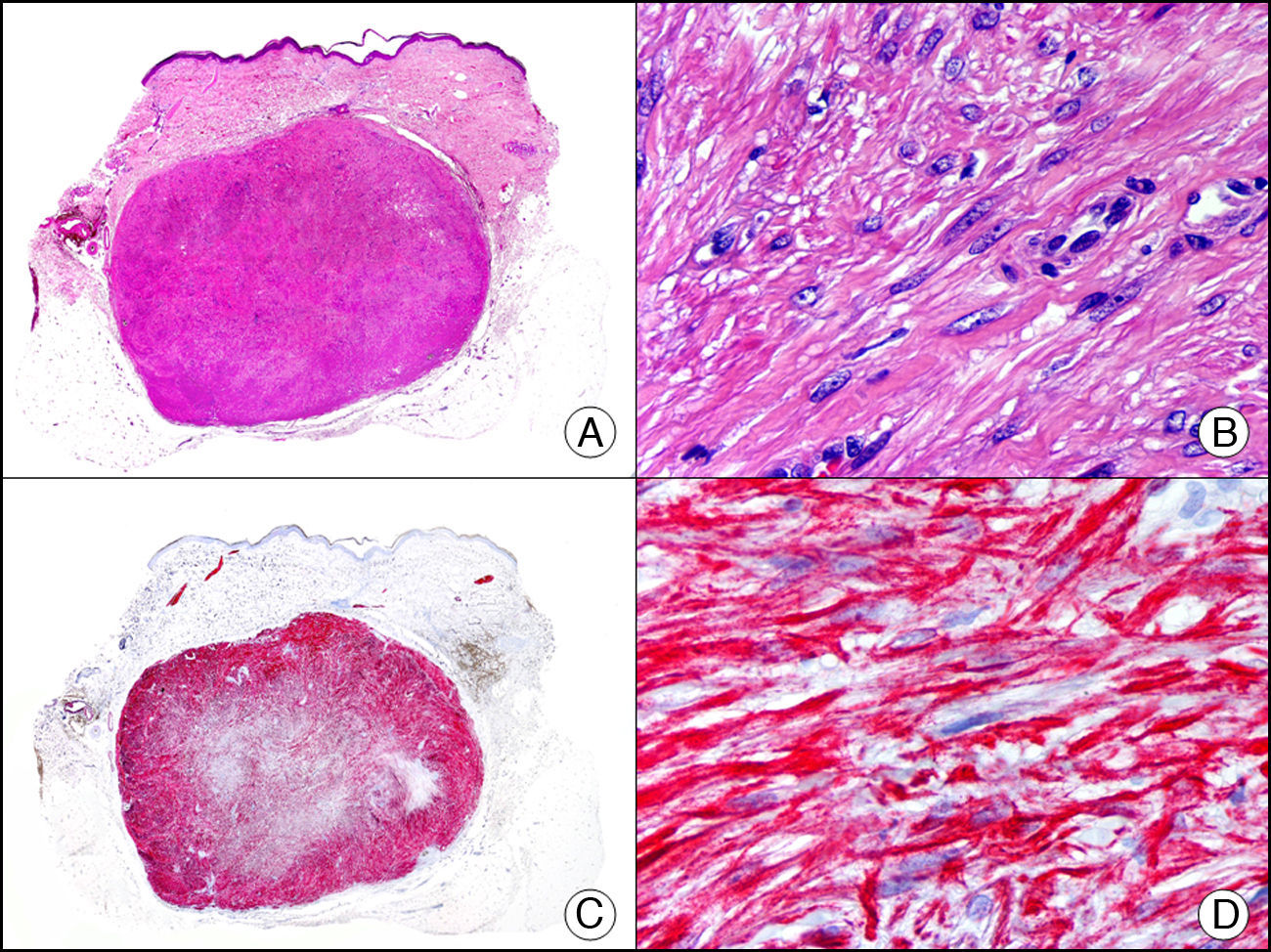
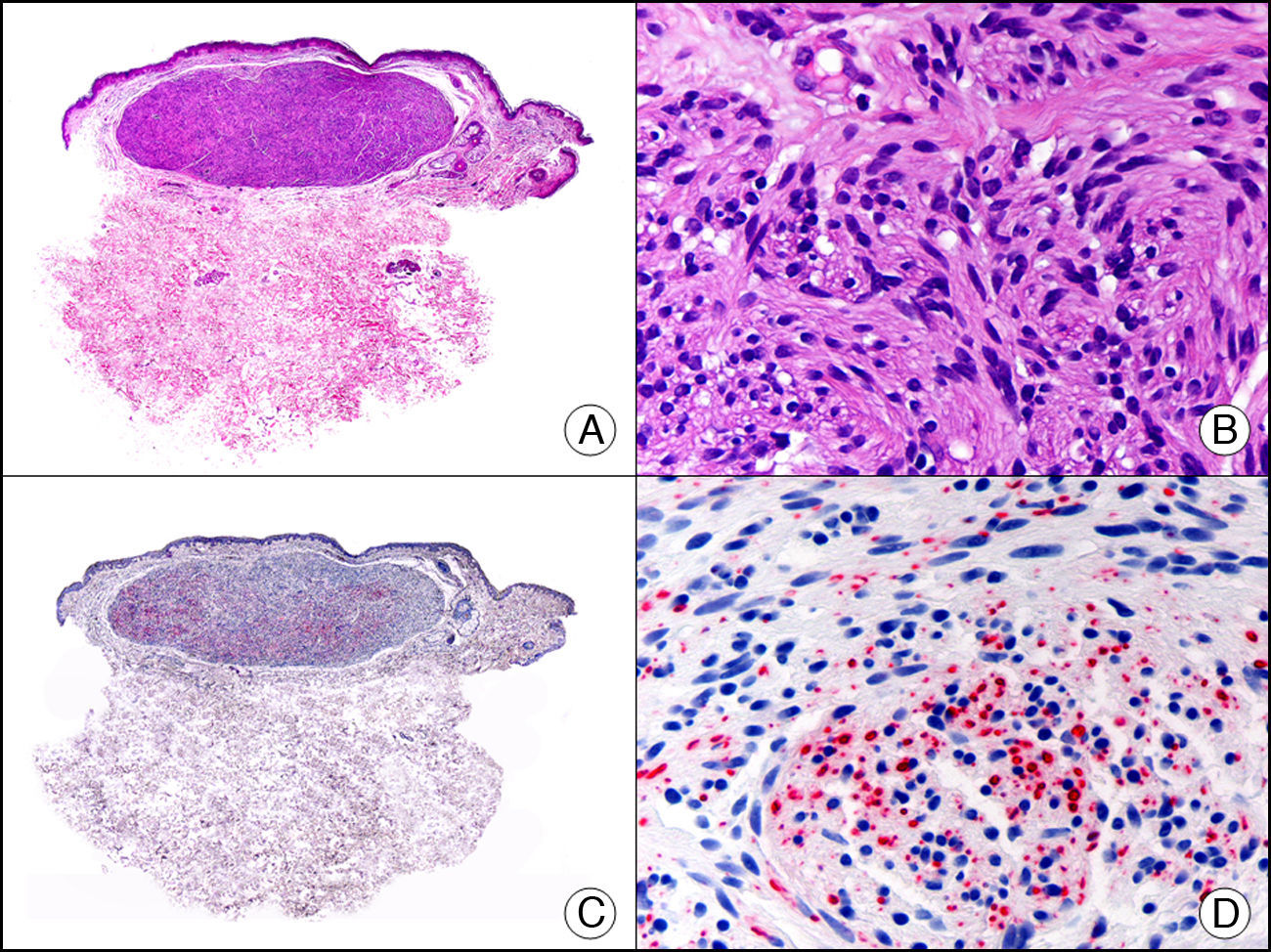
La desmina es un filamento intermedio que se encuentra en las células de origen muscular, ya sea esquelético, cardiaco o liso, así como en fibroblastos submesoteliales, en algunas células dendríticas ganglionares y en las células del estroma endometrial. Se considera específica de diferenciación muscular, especialmente hacia músculo esquelético o estriado e identifica tanto tumores benignos (leiomiomas [fig. 18], rabdomiomas) como malignos (leiomiosarcomas, rabdomiosarcomas). La intensidad de expresión de desmina también varía de unos tejidos musculares a otros, siendo por ejemplo mucho más intensa en el músculo uterino que en el músculo cutáneo erector del pelo. Puede observarse también una tinción débil y focal para desmina en proliferaciones con diferenciación miofibroblástica, como en la fibromatosis, el dermatofibrosarcoma protuberans y algunos ejemplos de fibrohistiocitoma maligno. Por lo tanto, puede resultar útil para diferenciar tumores de músculo liso y tumores de origen miofibroblástico, ya que generalmente en estos últimos la tinción con desmina suele ser muy débil o es inexistente1.
Angioleiomioma cutáneo. A. Visión panorámica (x10). B. Detalle a gran aumento de las células neoplásicas mostrando núcleo alargado de extremos romos y citoplasma eosinófilo (x400). C. El mismo caso estudiado inmunohistoquímicamente con desmina (x10). D. Detalle de la positividad de las células neoplásicas para la desmina (x400).
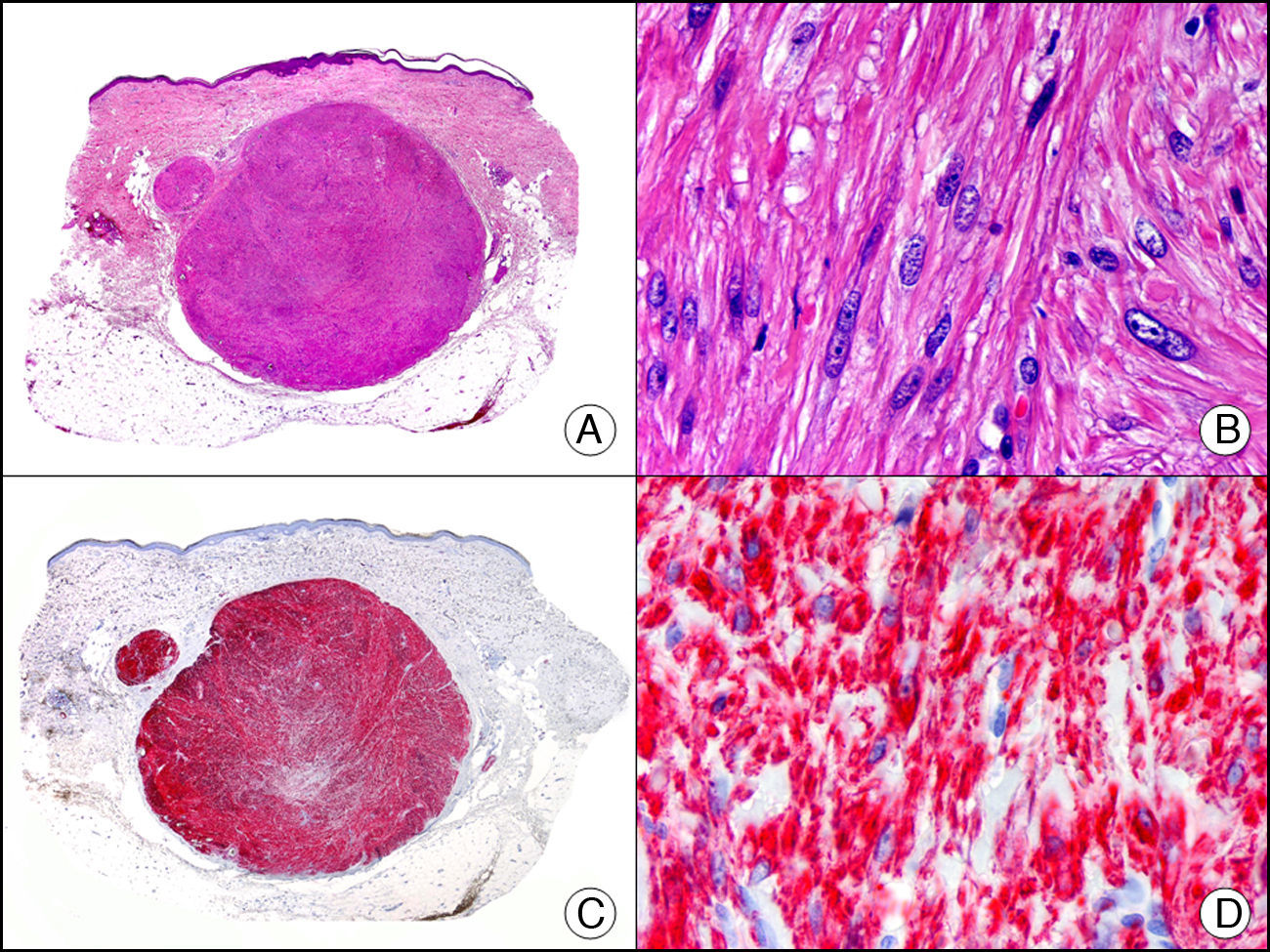
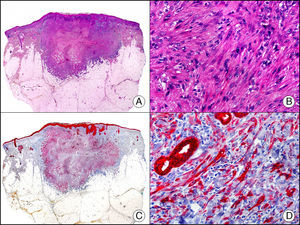
El caldesmón es una proteína asociada al citoesqueleto que se encuentra en células musculares y se encarga de inhibir las contracciones calcio-dependientes del músculo liso. Existe una forma de bajo PM presente en múltiples tipos celulares y una forma de alto PM en principio restringida al músculo liso visceral y vascular y células mioepiteliales. Las células mioepiteliales muestran una tinción variable, mientras que una serie de proliferaciones de supuesta diferenciación mioepitelial estudiadas por Watanabe et al. resultaron todas negativas27. Este marcador parece ser más específico para identificar músculo liso que la actina muscular específica, la desmina y la actina alfa de músculo liso. En dermatopatología su principal utilidad reside en la distinción entre verdaderos tumores de músculo liso (fig. 19) y tumores miofibroblásticos28. También marca intensamente las células glómicas de los tumores glómicos y de las malformaciones glomo-venosas.
Angioleiomioma cutáneo. A. Visión panorámica (x10). B. Detalle a gran aumento de las células neoplásicas mostrando núcleo alargado de extremos romos y citoplasma eosinófilo (x400). C. El mismo caso estudiado inmunohistoquímicamente con caldesmón (x10). D. Detalle de la positividad de las células neoplásicas con caldesmón (x400).
La calponina es una proteína tipo calmodulina específica del músculo liso que se une fuertemente a la actina de forma calcio independiente, y que parece estar implicada en la regulación de la contracción de estas fibras. En inmunohistoquímica es un marcador indicador de diferenciación hacia músculo liso (parenquimal y vascular), pero se ha demostrado también en miofibroblastos de estroma desmoplásico, en el histiocitoma fibroso angiomatoide (maligno), en las células mioepiteliales de los tumores de glándulas sudoríparas (fig. 20) y salivales, del mioepitelioma y del carcinoma mioepitelial de partes blandas. También se ha descrito inmunorreactividad para la calponina en las células proliferantes de neoplasias de estirpe muy variada, incluyendo el neurotecoma, los tumores glómicos, el miofibrosarcoma de hueso e incluso, de manera focal, en el sarcoma sinovial29,30.
Tumor mixto apocrino. A. Visión panorámica (x10). B. Detalle a gran aumento de las estructuras ductales alargadas tapizadas por una doble hilera de células (x400). C. El mismo caso estudiado inmunohistoquímicamente con calponina (x10). D. Detalle de la positividad para calponina de las células de la hilera periférica que tapiza los ductos, apoyando su naturaleza mioepitelial (x400).
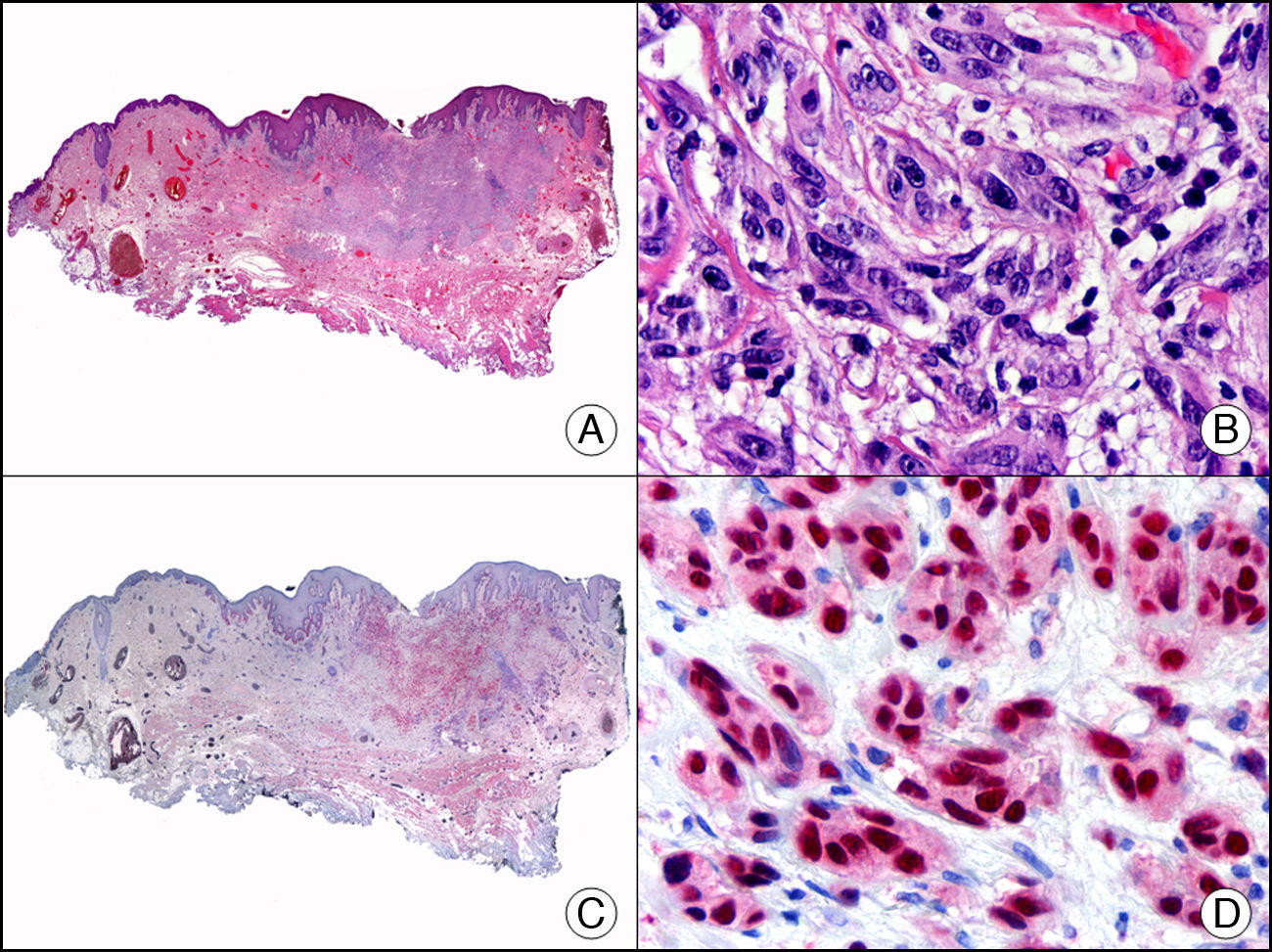
La miogenina es una proteína humana con un importante papel en la regulación de la diferenciación del tejido muscular. Pertenece a una familia de proteínas conocidas como factores reguladores miogénicos (MRF). Son factores de transcripción con dominios hélice-bucle-hélice básicos que actúan secuencialmente en el proceso de diferenciación miogénica. Entre los miembros de la familia MRF cabe destacar MyoD, Myf5, miogenina y MRF4 (Myf6). La expresión de miogenina está restringida a las células del músculo esquelético y parece ser inversamente proporcional al grado de diferenciación celular. Se ha descrito expresión de miogenina en algunos rabdomiosarcomas (fig. 21), así como en casos de fibromatosis y miofibromatosis infantil, en algunos sarcomas sinoviales y en leiomiosarcomas31.
Rabdomiosarcoma cutáneo. A. Visión panorámica (x10). B. Detalle de las células neoplásicas mostrando un núcleo atípico, alargado e hipercromático (x400). C. El mismo caso estudiado inmunohistoquímicamente con MyoD (x10). D. Detalle de la positividad de las células neoplásicas con MyoD (x400).
La miosina es una proteína fibrosa implicada en la contracción muscular en interacción con la actina. Es la proteína más abundante del músculo esquelético, ya que representa entre el 60 y 70% de las proteínas totales del músculo, y es el mayor constituyente de los filamentos gruesos. La miosina es por tanto un marcador muy útil para establecer diferenciación hacia músculo liso y estriado.
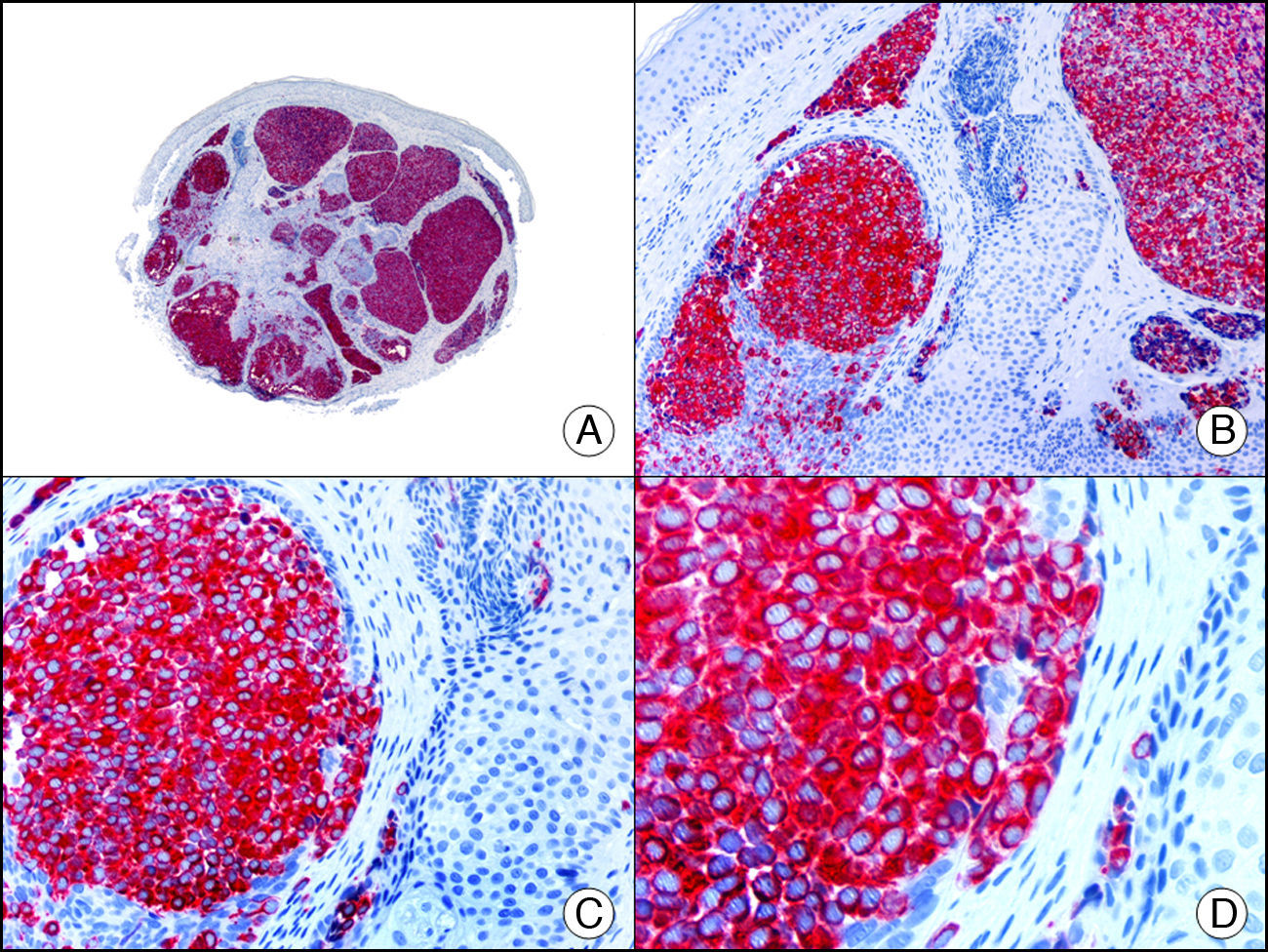
Marcadores de diferenciación endotelialEl CD31 es una glucoproteína transmembrana que se expresa en todos los endotelios continuos (arterias, arteriolas, vénulas, venas y capilares no sinusoidales), así como en las células endoteliales discontinuas de los vasos linfáticos y en macrófagos y plaquetas. Esta glucoproteína está implicada en la unión entre células endoteliales y entre estas y los linfocitos. Resulta el marcador más sensible y específico para establecer diferenciación endotelial. En la práctica identifica las células neoplásicas de la gran mayoría de tumores vasculares benignos (fig. 22), así como más del 90% de los hemangioendoteliomas y angiosarcomas. Resulta también muy útil para evaluar la angiogénesis tumoral. Sin embargo, la expresión de CD31 en los macrófagos existentes en el estroma de tumores, tanto vasculares como no vasculares, puede dar lugar a confusión y llevar a diagnósticos erróneos32.
Hemangioma infantil en el tejido celular subcutáneo. A. Visión panorámica (x10). B. Detalle a gran aumento de los vasos capilares tapizados por las células endoteliales monomorfas y sin atipia (x200). C. El mismo caso estudiado inmunohistoquímicamente con CD31 (x10). D. Detalle de la positividad para el CD31 de las células endoteliales que tapizan las luces de los capilares (x200).
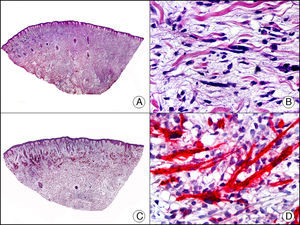
El CD34 es una sialomucina cuya síntesis está codificada por un gen situado en el cromosoma 1q32. Se encuentra en las células endoteliales, en células precursoras del sistema hematopoyético y en fibroblastos dendríticos. Se emplea principalmente como marcador endotelial y en el diagnóstico diferencial de tumores de partes blandas. Se expresa en el 90% de las neoplasias endoteliales benignas o malignas, siendo un marcador muy sensible para identificar las células neoplásicas del sarcoma de Kaposi y diferenciarlo de lesiones de pseudokaposi en la acroangiodermatitis secundaria a insuficiencia venosa crónica de las extremidades inferiores33. Sin embargo, la expresión de CD34 no es exclusiva de proliferaciones de células endoteliales, ya que también se observa positividad en las células neoplásicas del sarcoma epitelioide, el dermatofibrosarcoma protuberans (resultando de utilidad para el diagnóstico diferencial histopatológico con el dermatofibroma), en el fibroma dérmico en placa (previamente denominado hamartoma en medallón) (fig. 23), el leiomiosarcoma, el lipoma de células fusiformes, el tumor fibroso solitario, la pápula fibrosa nasal, el neurofibroma, la fibromatosis extraabdominal y otras muchas proliferaciones de estirpe no endotelial34.
Fibroma dérmico en placa. A. Visión panorámica mostrando una lesión con infiltración horizontal de la dermis superficial (x10). B. A gran aumento se observa que la lesión está constituida por células fusiformes dispuestas en remolinos alrededor de los vasos (x200). C. El mismo caso estudiado inmunohistoquímicamente con CD34 (x10). D. Detalle de la positividad para el CD34 de las células neoplásicas (x200).
En dermatopatología se ha propuesto también su utilidad para diferenciar histopatológicamente un tricoblastoma de un carcinoma basocelular, ya que se observa positividad de este marcador en los fibrocitos del estroma del tricoblastoma, pero no en los del carcinoma basocelular35–38. Algunas proliferaciones con diferenciación hacia la vaina radicular externa del folículo piloso, como el tricolemoma39,40, el tricolemoma desmoplásico39,41, la queratosis tricolemal42 y el tumor tricolemal proliferante40 han mostrado también grados variables de positividad para el CD34 en las células epiteliales proliferantes. En contraste, el CD34 es negativo en otros carcinomas anexiales cutáneos y la mayoría de las neoplasias de naturaleza epitelial1.
El anticuerpo monoclonal WT-1 (Wilms’ tumor 1 protein) identifica un factor de transcripción codificado por un gen localizado en el cromosoma 11p13, que participa en la regulación de la transcripción de otros genes y puede funcionar como activador y como represor de la transcripción. Se detecta por inmunohistoquímica en el núcleo de células normales de estirpe muy variada, como el epitelio glomerular, las células gonadales en desarrollo, las células de Sertoli, las células epiteliales y las células de la granulosa del ovario, así como en células de neoplasias tan dispares como leucemias, cáncer de pulmón, cáncer colorrectal, cáncer de mama, tumores cerebrales y tumores desmoides. En dermatopatología resulta de gran utilidad como marcador para diferenciar neoplasias vasculares de malformaciones vasculares43, ya que esta proteína se expresa en el endotelio proliferante estimulado por angiopoyetina 2 de las hiperplasias y neoplasias vasculares (fig. 24); sin embargo, resulta negativo en las células endoteliales no proliferantes de malformaciones vasculares, ya que defectos en la señal de WT-1 indican la incapacidad de estas células para llevar a cabo la apoptosis y el remodelamiento fisiológico44,45. Además, se ha estudiado la expresión de este marcador en proliferaciones melanocíticas, y en estudios recientes se ha observado que el WT-1 se expresa en el citoplasma de los melanocitos proliferantes tanto de nevos melanocíticos como de melanomas, pero la tinción es más intensa en el citoplasma de las células neoplásicas de melanomas en estadios más avanzados, confiriendo por tanto a los tumores melanocíticos positivos para el WT-1 un peor pronóstico46.
Hemangioma capilar lobulillar. A. Visión panorámica (x10). B. Detalle de los capilares tapizados por células endoteliales que constituyen la lesión (x400). C. El mismo caso estudiado inmunohistoquímicamente con WT1 (x10). D. Detalle de la positividad para el WT1 en el núcleo de las células endoteliales proliferantes (x400).
La podoplanina es una sialoglucoproteína de superficie que se detecta por inmunohistoquímica en diversos tipos celulares, incluyendo el endotelio linfático, las células germinales testiculares, las células dendríticas foliculares, las células intersticiales de Cajal, las células mioepiteliales y las células basales de epitelio glandular. Como marcador endotelial se expresa en el citoplasma de las células del endotelio linfático del tejido sano y de malformaciones linfáticas (fig. 25), pero además su positividad apoya una diferenciación hacia el endotelio linfático de una serie de proliferaciones vasculares de histogénesis controvertida, como el sarcoma de Kaposi, el angioendotelioma papilar intralinfático (PILA) o tumor de Dabska, el hemangioendotelioma epitelioide y el hemangioma de células en tachuela. Se expresa también en las células neoplásicas de la mayoría de los angiosarcomas cutáneos en todas sus variantes clinicopatológicas (el de cara y cuero cabelludo en ancianos, el asociado a linfedema crónico, el secundario a radioterapia y el de células epitelioides). Se utiliza también para demostrar la naturaleza linfática de los vasos conteniendo células neoplásicas en su luz en émbolos tumorales, tanto de tumores cutáneos primarios como de metástasis cutáneas. También es útil para diferenciar histopatológicamente neoplasias cutáneas primarias, especialmente adenocarcinomas anexiales, de metástasis cutáneas de adenocarcinomas de vísceras internas, ya que la podoplanina se expresa en las células neoplásicas de los primeros, pero no de los segundos47,48. Por último, estudios recientes han propuesto utilizar este marcador junto con otros marcadores endoteliales, como Lyve-1 y CD31 en la predicción de metástasis en el ganglio centinela de melanomas, valorando la invasión intralinfática del tumor primario49.
Malformación linfática superficial. A. Visión panorámica (x10). B. Detalle de los vasos dilatados de pared fina y tapizados por una hilera discontinua de células endoteliales aplanadas que ocupan la dermis superficial (x200). C. El mismo caso estudiado inmunohistoquímicamente con podoplanina (x10). D. Detalle de la positividad para la podoplanina en el citoplasma de las células endoteliales (x200).
El Lyve-1 o factor de transcripción nuclear del endotelio linfático es un receptor de hialuronidasa cuya expresión está prácticamente limitada al endotelio linfático. Su función no está totalmente aclarada, pero parece estar relacionado con el transporte e intercambio de la hialuronidasa o con la localización de esta enzima en la superficie del endotelio linfático. El Lyve-1 se expresa en ambas superficies, luminal y abluminal del endotelio linfático y también en los sinusoides hepáticos. Varios estudios han demostrado su utilidad no solo para identificar tejido linfático, sino también linfangiogénesis, principalmente en enfermedades inflamatorias de la córnea y la piel. También se ha utilizado como marcador de linfangiogénesis en distintas neoplasias, teniendo por tanto valor no solo en el diagnóstico, sino también en el pronóstico de estas proliferaciones49. En dermatopatología su utilidad es similar a la de la podoplanina (fig. 26), aunque el Lyve-1 es menos específico, ya que también se expresa en macrófagos y adipocitos. Ambos marcadores pierden intensidad en la tinción de endotelio de vasos linfáticos de gran calibre50.
Sarcoma de Kaposi en fase nodular. A. Visión panorámica (x10). B. A mayor aumento se observan fascículos de células fusiformes y pequeños espacios vasculares ocupados por hematíes (x200). C. El mismo caso estudiado inmunohistoquímicamente con Lyve-1 (x10). D. Positividad para el Lyve-1 en las células neoplásicas (x200).
El Prox-1 es un factor de transcripción nuclear que desempeña un papel fundamental durante la linfangiogénesis embrionaria. Como marcador inmunohistoquímico resulta muy útil en la diferenciación de células endoteliales linfáticas de células endoteliales sanguíneas, ya que en la piel y mucosa sanas el Prox-1 marca de forma específica el núcleo de las células endoteliales linfáticas (fig. 27), pero no el de células de endotelio sanguíneo. A pesar de ser altamente específico de endotelio linfático, el Prox-1 se expresa también en otras células no endoteliales, como hepatocitos y células del sistema nervioso central, por lo que es recomendable utilizarlo conjuntamente con otros marcadores endoteliales como el CD31 y el VEGFR351. El Prox-1 se incluye por tanto en el panel de diagnóstico inmunohistoquímico de múltiples neoplasias y malformaciones de naturaleza vascular52,53.
Histiocitosis intralinfática. A. Visión panorámica (x10). B. A mayor aumento se observan agregados de histiocitos intravasculares (x200). C. El mismo caso estudiado inmunohistoquímicamente con Prox-1 (x10). D. A mayor aumento se observa que los núcleos de las células que tapizan los vasos que contienen histiocitos expresan Prox-1, lo que demuestra su naturaleza linfática (x200).
El VEGFR3 es un receptor del factor de crecimiento del endotelio vascular, que inicialmente se expresa en el endotelio de los vasos sanguíneos embrionarios, y posteriormente su expresión queda restringida prácticamente a los vasos linfáticos53. Este marcador posee una relativa especificidad para el endotelio linfático, aunque algo menor que la demostrada por la podoplanina, el Lyve-1 y el Prox-1, ya que algunas proliferaciones de endotelio sanguíneo también pueden expresar VEGFR354. Sin embargo, el VEGFR3 es muy sensible para este tejido, con una sensibilidad similar a la del Prox-1, pero superior a la de la podoplanina55.
El GLUT-1 es un anticuerpo similar al transportador de glucosa en los hematíes que tiñe la membrana citoplasmática de células endoteliales de algunos tejidos barrera, como la barrera hematoencefálica y la placenta. Es especialmente útil en la identificación de la célula endotelial proliferante de los hemangiomas infantiles (fig. 28), marcando específicamente el endotelio de estas lesiones en todas sus fases evolutivas. Sin embargo, está ausente en el endotelio de malformaciones vasculares, así como en el de algunas hiperplasias vasculares, como granulomas piogénicos y tejido de granulación. Tampoco se expresa en el endotelio de algunos raros hemangiomas infantiles congénitos, ya sean rápidamente involutivos (RICH) o no (NICH)3. Curiosamente, el GLUT-1 constituye un excelente marcador de las células neoplásicas del perineuroma cutáneo.
Hemangioma infantil. A. Visión panorámica (x10). B. Detalle a gran aumento de las células endoteliales proliferantes (x400). C. El mismo caso estudiado inmunohistoquímicamente con Glut-1 (x10). D. Detalle de la positividad para el Glut-1 de las células endoteliales tapizando las luces de los capilares neoformados (x400).
La proteína FLI-1 es un marcador que se utilizó inicialmente en el diagnóstico del sarcoma de Ewing y de otros tumores primitivos neuroectodérmicos. En tejido sano identifica células endoteliales y linfocitos pequeños, posiblemente células T. Al igual que el Prox-1, el FLI-1 tiene la ventaja sobre otros marcadores endoteliales de ser un marcador nuclear, lo que facilita la interpretación de los resultados inmunohistoquímicos. Este marcador es además muy sensible en la identificación de las células proliferantes de hemangiomas, hemangioendoteliomas, angiosarcomas y sarcomas de Kaposi. Sin embargo, y como sucede con otros marcadores endoteliales, no discrimina entre proliferaciones vasculares malignas o benignas; pero también tiene valor su resultado negativo, ya que no se expresa en células neoplásicas de sarcomas no vasculares, melanomas y carcinomas. No se debe olvidar en la interpretación de los resultados de los estudios con FLI-1 su expresión en linfocitos, por lo que hay que tener cuidado para no confundir linfocitos con células tumorales3.
Durante años se ha investigado en la búsqueda de aberraciones cromosómicas en los angiosarcomas con resultado negativo. Sin embargo, recientemente se ha comprobado que los angiosarcomas asociados a linfedema crónico y los secundarios a radioterapia presentan algunas alteraciones genéticas bastante constantes en todas las lesiones, que no están presentes con tanta frecuencia en el angiosarcoma de cara y cuero cabelludo de los ancianos (angiosarcoma de Wilson Jones). La anomalía genética más frecuentemente detectada en estos angiosarcomas consiste en la presencia de amplificaciones genéticas en el cromosoma 8q24.21 (50%) seguida del 10p12.33 (33%) y del 5q35.3 (11%). La amplificación del oncogén c-Myc en el cromosoma 8q24.21 es la alteración genética más frecuente, observándose en más del 50% de los angiosarcomas secundarios a radioterapia y a linfedema crónico, lo que conlleva importantes implicaciones en el diagnóstico y, probablemente en un futuro cercano, en el tratamiento de estos tumores56. Inicialmente estudiado mediante técnicas de FISH, en la actualidad se ha comercializado un anticuerpo que demuestra la amplificación del c-Myc por inmunohistoquímica en los tejidos fijados en formol e incluidos en parafina (fig. 29). También es importante el hecho de que no se detectan amplificaciones del c-Myc en las proliferaciones vasculares atípicas benignas inducidas por radioterapia, que a veces son muy difíciles de diferenciar histopatológicamente de los verdaderos angiosarcomas postradioterapia. En cualquier caso, conviene recordar que esta amplificación de c-Myc no es exclusiva del angiosarcoma, ya que se ha demostrado también en otras neoplasias como el sarcoma de Kaposi, el histiocitoma fibroso maligno del hueso, el condrosarcoma de alto grado y el osteosarcoma resistente a metotrexato57.
Angiosarcoma afectando la piel de la mama posradioterapia por cáncer de mama. A. Visión panorámica (x10). B. Vasos irregulares tapizados por células endoteliales atípicas (x400). C. El mismo caso estudiado inmunohistoquímicamente para la amplificación del gen c-Myc (x10). D. Intensa positividad de c-Myc en la mayoría de los núcleos de las células neoplásicas (x400).
El avian erythroblastosis E26 virus oncogen homolog (ERG) es un factor de transcripción de la familia de los genes ETS. Se expresa en células endoteliales de vasos sanguíneos y linfáticos, tanto normales como neoplásicos, resultando un marcador altamente específico para endotelio vascular (fig. 30). Sin embargo, también resulta positivo en las células epiteliales neoplásicas del 50% de los carcinomas de próstata, tanto primarios como metastásicos (aunque curiosamente no se expresa en el tejido prostático normal), en las células mieloides inmaduras de médula ósea, en las células de leucemia mieloide crónica y en las células de sarcoma de Ewing. Teniendo en cuenta su elevada especificidad en el contexto de proliferaciones vasculares, este marcador es de gran utilidad en el diagnóstico de angiosarcomas, hemangioendoteliomas y sarcomas de Kaposi. Además, su positividad en el carcinoma de próstata, en contraste con su negatividad prácticamente en la totalidad del resto de los carcinomas, confiere también a este marcador una gran utilidad en las baterías inmunohistoquímicas de identificación de metástasis cutáneas de origen desconocido58.
Hemangioma capilar lobulillar. A. Visión panorámica (x10). B. Detalle de los capilares tapizados por células endoteliales que constituyen la lesión (x400). C. El mismo caso estudiado inmunohistoquímicamente con ERG (x10). D. Detalle de la positividad para el ERG en el núcleo de las células endoteliales proliferantes (x400).
La proteína S-100 es una proteína ácida que debe su nombre a su solubilidad en sulfato de amonio al 100%. Está constituida por 2 subunidades (α y β) con 3 isotipos:a) proteína S-100 αα, expresada en el músculo;b) proteína S-100 αβ expresada en melanocitos, células de la glía, condrocitos y células mioepiteliales de los ovillos secretores de las unidades ecrinas y apocrinas; y c) proteína S-100 ββ, expresada en células de Langerhans y células de Schwann. La proteína S-100 está distribuida ampliamente en el sistema nervioso central y periférico y también está presente en algunos tejidos no neurales. Se expresa en prácticamente el 100% de los nevos melanocíticos (fig. 31) y hasta en el 98% de los melanomas, lo que confiere a esta proteína el papel de marcador más sensible de proliferaciones melanocíticas, pero resulta también positiva en otras neoplasias, como algunos carcinomas (no espinocelulares), tumores mioepiteliales, tumores de músculo liso y tumores de la vaina nerviosa de nervios periféricos1.
Nevo de Spitz. A. Visión panorámica (x10). B. Detalle de los melanocitos con núcleo vesiculoso, nucléolo prominente y citoplasma amplio y eosinófilo (x400). C. El mismo caso estudiado inmunohistoquímicamente con proteína S100 (x10). D. Intensa positividad de los melanocitos neoplásicos para la proteína S100 (x400).
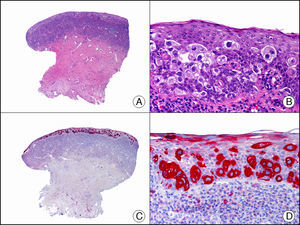
El Melan-A es un componente de la membrana del premelanosoma, producto del gen MART-11. Es un antígeno de diferenciación melanocítica, reconocido por células T citotóxicas, que se expresa tanto en melanocitos normales como en las células proliferantes de nevos melanocíticos y melanomas (fig. 32). También se expresa en células de la retina, la corteza suprarrenal, el ovario y las células de Leydig del testículo. Junto con la proteína S-100 este marcador es el más utilizado para demostrar la estirpe melanocítica de una neoplasia. Su tinción es más difusa, pero más intensa que la de la proteína S-100. Las únicas neoplasias melanocíticas que no son identificables con el Melan-A son el melanoma desmoplásico y algunos melanomas de células fusiformes59. Sin embargo, hay que tener cuidado con este marcador cuando se estudian proliferaciones melanocíticas intraepidérmicas en áreas de piel con importante daño actínico crónico, ya que la inmunotinción con Melan-A se extiende desde los melanocitos dendríticos a los queratinocitos vecinos, y puede confundirse una queratosis actínica hiperpigmentada o una piel con daño actínico crónico y numerosos melanocitos con un auténtico melanoma in situ60. Este marcador resulta también útil en el protocolo de estudio histopatológico del ganglio centinela del melanoma.
Melanoma subungueal in situ. A. Visión panorámica (x10). B. A mayor aumento se observan numerosos melanocitos de núcleo pleomórfico e hipercromático salpicados en las hileras basal y suprabasales del epitelio (x400). C. El mismo caso estudiado inmunohistoquímicamente con Melan A (x10). D. Detalle de la positividad para Melan A de los melanocitos neoplásicos (x400).
El HMB45 es un anticuerpo monoclonal dirigido contra una glucoproteína componente del premelanosoma, la gp100. Identifica melanocitos activados, melanocitos inmaduros y melanocitos intraepidérmicos, pero resulta negativo en melanocitos adultos (melanocitos quiescentes). Tiene una sensibilidad del 78 al 93% en el diagnóstico de melanoma10 (del 85% para demostrar melanomas epitelioides [fig. 33] y del 30 al 50% para melanomas sarcomatoides), lo que convierte a este anticuerpo en uno de los marcadores más útiles en la confirmación del diagnóstico de melanoma en casos de tumores malignos de histogénesis dudosa. La excepción, como sucede con otros marcadores melanocíticos, es el melanoma desmoplásico, ya que el HMB45 solo marca su componente intraepidérmico y juntural, mientras que el componente dérmico resulta HMB45 negativo1,10,61. Sin embargo, quizá el HMB45 es el marcador más sensible de proliferaciones melanocíticas, ya que también marca nevos de Spitz, nevos azules y nevos displásicos10,59. También suele ser positivo, aunque sea de manera focal, en las metástasis de melanoma10. No debemos olvidar, sin embargo, que el HMB45 puede ser también positivo en lesiones no melanocíticas que contengan premelanosomas fagocitados, como en el caso de melanófagos, o transferidos a queratinocitos desde melanocitos dendríticos vecinos, como en queratosis actínicas pigmentadas y otras lesiones epiteliales conteniendo abundante pigmento melánico59.
Melanoma in situ. A. Visión panorámica (x10). B. Melanocitos pagetoides salpicando como células aisladas las capas basal y suprabasal de la epidermis (x200). C. El mismo caso estudiado inmunohistoquímicamente con HMB-45 (x10). D. Intensa positividad para el HMB45 de los melanocitos neoplásicos salpicando capas altas de la epidermis (x200).
El MiTF-1 (Microphtalmia transcription factor 1) es una proteína nuclear implicada en el desarrollo embriológico de los melanocitos y la regulación de la síntesis de melanina59. Se expresa en la mayoría de las proliferaciones melanocíticas, aunque posee poca especificidad, ya que también es positiva en macrófagos, linfocitos, fibroblastos, músculo liso y células de Schwann. Se trata de un marcador nuclear, lo que facilita su interpretación (fig. 34). Se ha observado positividad para MiTF-1 hasta en un 88% de las metástasis de melanoma10.
Nevo azul de células epitelioides. A. Visión panorámica (x10). B. Células epitelioides con citoplasma amplio y conteniendo abundante pigmento melánico (x400). C. El mismo caso estudiado inmunohistoquímicamente con MiTF-1 (x10). D. Detalle de la positividad nuclear para MiTF-1 de los melanocitos epitelioides, mientras que el núcleo de los melanófagos resulta negativo (x400).
El Sox-10 es un factor de transcripción de la cresta neural que parece ser crucial para la diferenciación, maduración y mantenimiento de estas células pluripotenciales hacia la formación de células de Schwann y de melanocitos. El anticuerpo anti-Sox-10 se expresa en todo tipo de neoplasias melanocíticas benignas y malignas, pero también en las neoplasias de células de Schwann, como el schwannoma, el neurofibroma y los tumores malignos de la vaina del nervio periférico, y en las células neoplásicas de otros tumores neuroectodérmicos como el ganglioneuroma, el neuroblastoma, el sarcoma de Ewing, el oligodendroglioma, el meduloblastoma o el astrocitoma. Además también se observa expresión de Sox-10 en las células mioepiteliales y sus proliferaciones neoplásicas. Su expresión nuclear (fig. 35), como en el caso de MiTF-1, hace que sea más fácil su interpretación que la inmunotinción con proteína S-100, Melan A o HMB-45. Además de su gran sensibilidad, resulta más específico que la proteína S-100 como marcador de melanocitos, ya que algunos melanomas desmoplásicos negativos para la proteína S-100 han resultado ser Sox-10 positivos62. También ha demostrado su utilidad en la distinción entre la proliferación de melanocitos dendríticos que a veces se observa en las cicatrices de extirpación de melanomas desmoplásicos y la verdadera persistencia de un melanoma desmoplásico, ya que la tinción con Sox-10 marca de manera más específica los restos de melanoma y no los melanocitos dendríticos de la cicatriz, como sucede con la tinción con la proteína S-10063.
Melanoma desmoplásico. A. Visión panorámica (x10). B. Detalle de los melanocitos neoplásicos en la dermis reticular (x400). C. El mismo caso estudiado inmunohistoquímicamente con Sox 10 (x10). D. Detalle de la positividad nuclear para Sox 10 de los melanocitos neoplásicos de la dermis (x400).
La tinción con neurofilamentos detecta axones neuronales en los nervios periféricos, así como células ganglionares simpáticas y células de la médula adrenal. Es útil en el diagnóstico de neuromas64 (fig. 36), neurofibromas, ganglioneuromas, neuroblastomas y feocromocitomas.
Neuroma encapsulado en empalizada. A. Visión panorámica (x10). B. Detalle de las células neoplásicas de núcleo fusiforme (x400). C. El mismo caso estudiado inmunohistoquímicamente con neurofilamentos (x10). D. Detalle de la positividad para neurofilamentos de los axones de las fibras nerviosas proliferantes (x400).
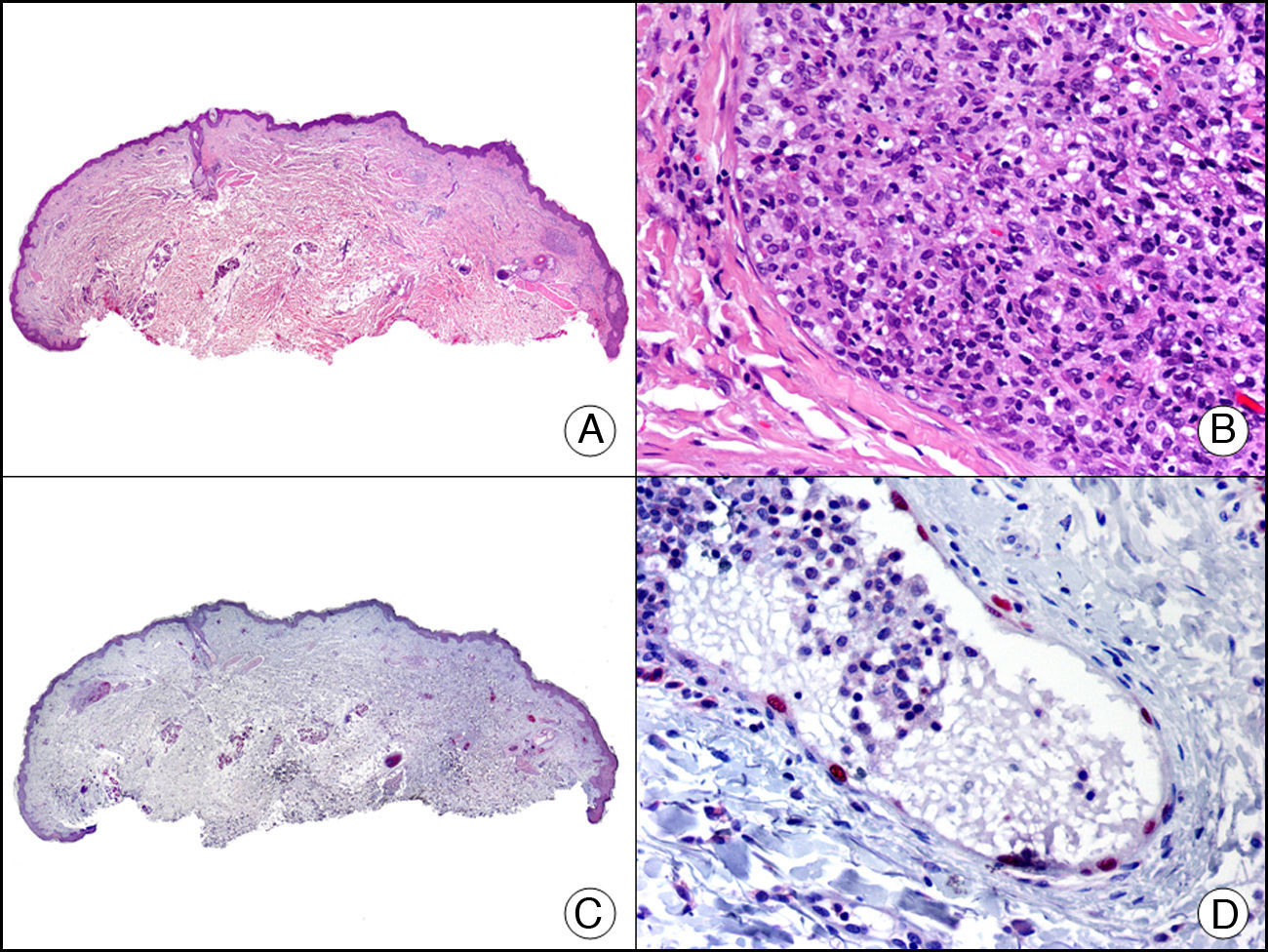
La PGP 9.5 es una proteína de función desconocida que está presente en prácticamente todos los componentes celulares del sistema nervioso central y periférico y en muchas células neuroendocrinas, pero también en parte del túbulo renal, en espermatogonias y cuerpo lúteo, en células de Merkel de la epidermis y en fibroblastos dérmicos, entre otras células. Es útil por tanto como marcador neuronal en el estudio de síndromes degenerativos nerviosos. En dermatopatología se ha estudiado su presencia en múltiples dermatosis, y se ha demostrado su positividad en las células neoplásicas del denominado neurotecoma celular, siendo este hallazgo uno de los pocos argumentos que apoyan la diferenciación neural de esta enigmática neoplasia65 (fig. 37). También se ha demostrado positividad de la proteína PGP 9.5 en el citoplasma de las células neoplásicas de algunos ejemplos de carcinoma escamoso y queratoacantoma y en estos casos se ha relacionado esta positividad con una mayor agresividad66.
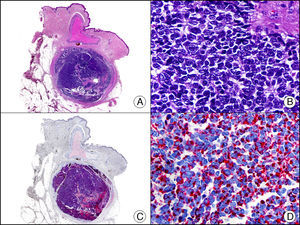
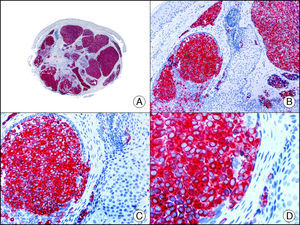
Marcadores de diferenciación neuroendocrinaLa enolasa o hidratasa de fosfopiruvato es una enzima que cataliza la transformación de 2-fosfo-D-piruvato a fosfoenolpiruvato. Se conocen 5 isoenzimas de la misma compuestas por la combinación de 3 subunidades (alfa, beta y gamma). La denominada enolasa neuronal específica corresponde a la isoenzima gamma (formada a su vez por 2 subunidades gamma). Se expresa principalmente en neuronas, células neuroendocrinas, células ganglionares del tracto gastrointestinal y fibras nerviosas. Es positiva en tumores gliales, neurales y neuroendocrinos (carcinoma microcítico de pulmón, tumor de Merkel [fig. 38], tumor de Wilms y tumor carcinoide), pero su utilidad diagnóstica es muy limitada dada su baja especificidad, por lo que algunos autores han propuesto cambiar su nombre original por el de «enolasa neuronal inespecífica».
Tumor de Merkel. A. Visión panorámica (x10). B. Detalle de las células neoplásicas mostrando un núcleo redondo con cromatina granular y numerosas imágenes de mitosis (x400). C. El mismo caso estudiado inmunohistoquímicamente con enolasa neuronal específica (x10). D. Positividad de las células neoplásicas para la enolasa neuronal específica (x400).
La cromogranina/CHR es una proteína asociada a los gránulos de neurosecreción cuya función exacta se desconoce2. Está presente en una gran variedad de células endocrinas y en las neuronas. Resulta específica para establecer diferenciación neuroendocrina, pero su positividad depende de la cantidad de gránulos neurosecretores y suele perderse en tumores de alto grado de malignidad pobremente diferenciados. Su negatividad, por tanto, no excluye una diferenciación neuroendocrina. En dermatopatología su principal utilidad es en el estudio del tumor de Merkel (fig. 39) y de las metástasis cutáneas de tumores neuroendocrinos viscerales.
La sinaptofisina es una glucoproteína transmembrana que se expresa en la mayoría de células neuronales, neuroendocrinas y sus neoplasias2. Constituye pues, junto con la cromogranina y la enolasa neuronal específica, otro de los componentes del panel inmunohistoquímico habitual para el estudio de tumores cutáneos neuroendocrinos (fig. 40), tanto primarios como metastásicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.