El análisis inmunofenotípico de las células inflamatorias en el microambiente tumoral de los melanomas con regresión histológica es objeto de actual debate. Por otro lado, los halo nevus benignos, de manera paradigmática, muestran también una inflamación marcada. La caracterización de perfiles inmunológicos en estas lesiones inflamadas puede proporcionar información sobre la respuesta inmunitaria local, la patogénesis y su diagnóstico diferencial.
MetodologíaSe evaluó una cohorte de 16 nevus de Sutton clínicamente atípicos del Hospital Clínic de Barcelona, España, y 70 melanomas con regresión del Hospital Universitario de Turín, Italia. Los evaluadores analizaron la densidad de la inflamación, su localización, la fibrosis y los marcadores CD3, CD4, CD8, CD25, FOXP3 y PD1.
ResultadosLos nevus de Sutton mostraron una mayor densidad inflamatoria que los melanomas con regresión, pero similar localización y cantidad de fibrosis. Los nevus de Sutton presentaron mayores ratios de CD8/CD3, mientras que los melanomas presentaron índices más altos de CD4/CD3 y CD4/CD8. Marcadores, como CD25/CD4, FOXP3/CD4 y PD1/CD4, fueron más comunes en los nevus de Sutton.
ConclusionesLos resultados indican una reacción citotóxica más fuerte y, consecuentemente, un mecanismo regulador en los halo nevus, caracterizado por un aumento de PD1, FOXP3 y CD25. Este artículo caracteriza más a fondo los halo nevus y los melanomas con regresión y plantea posibles pistas para distinguirlos entre ellos.
The immunophenotypic analysis of inflammatory cells in the tumor microenvironment of regressing melanomas is object of ongoing debate. On the other hand, benign halo nevi paradigmatically show marked inflammation. Characterizing these immune profiles can provide insights into the local immune response, its pathogenesis, and differential diagnosis.
MethodologyA cohort of 16 clinically atypical Sutton nevi from Hospital Clínic de Barcelona, Spain, and 70 regressing melanomas from Turin University Hospital, Italy, were evaluated. Histological assessments analyzed inflammation density, location, fibrosis, and markers like CD3, CD4, CD8, CD25, FOXP3, and PD1.
ResultsSutton nevi showed higher inflammation density than regressing melanomas, but similar location and quantity of fibrosis. Sutton nevi had higher CD8/CD3 ratios and melanomas, higher CD4/CD3 and CD4/CD8 ratios. Markers such as CD25/CD4, FOXP3/CD4, and PD1/CD4 were more common in Sutton nevi.
ConclusionResults indicate a stronger cytotoxic reaction and consequently a regulatory mechanism in halo nevi, characterized by increased PD1, FOXP3, and CD25. This research further characterizes halo nevi and regressing melanomas, and shows possible clues to distinguish those challenging inflamed melanocytic tumors from melanomas.
El melanoma maligno es un tipo de cáncer de piel. Es el responsable de una creciente preocupación en salud pública debido al incremento paulatino en la tasa de incidencia y a su elevado potencial metastásico1,2. Además, la mejora de las técnicas de imagen dermatológica para identificar melanomas precoces y de difícil diagnóstico ha hecho que se detecten un mayor número de tumores, los que tendrán un diagnóstico histopatológico de mayor complejidad3. El estudio de algunas características específicas, como son la regresión tumoral y el infiltrado inflamatorio, ha despertado un gran interés, ya que estas podrían conducir a un diagnóstico histopatológico erróneo de las lesiones melanocíticas4. Por lo tanto, es muy importante comprender los mecanismos inmunológicos implicados en estos fenómenos, ya que pueden ayudar a mejorar el diagnóstico y ser muy útiles para el desarrollo de terapias dirigidas específicas5,6. La regresión tumoral, un fenómeno observado en un porcentaje significativo de los melanomas (la frecuencia oscila entre el 10% y el 58%) se caracteriza por la reducción parcial o completa del componente melanocítico acompañada de un infiltrado inflamatorio variable, melanófagos, nuevos vasos y cierto grado de fibrosis7. La influencia de la regresión en el pronóstico del melanoma ha suscitado un amplio debate a lo largo de los años8. Algunos estudios consideran que la regresión es un factor pronóstico negativo, ya que podría interferir en la medición precisa del grosor del melanoma, afectando así a la correcta estadificación del tumor. Otros estudios sugieren que la regresión histológica aumenta el riesgo de metástasis. Por el contrario, algunos informes proponen que la regresión no altera el pronóstico y, en ciertos casos, puede incluso actuar como factor protector9–11. Diversos estudios han revelado que las distintas características biológicas y de malignidad de los tumores se ven afectados no solo por sus anomalías genéticas, sino también por la interacción entre las células malignas y el microambiente que las rodea. La interacción entre el tumor y el sistema inmunitario del huésped es especialmente interesante, sobre todo teniendo en cuenta la gran eficacia clínica de las terapias dirigidas a estas vías específicas12. De hecho, la presencia de un infiltrado denso de linfocitos en el tumor se ha asociado a una mejor respuesta a los inhibidores del punto de control inmunitario13. Del mismo modo, los nevus de Sutton, que son lesiones benignas caracterizadas clínicamente por un halo acromático que rodea al nevus melanocítico, también han mostrado asociaciones con la activación de respuestas inmunitarias locales6,14. El fenómeno del halo, que se manifiesta como un halo despigmentado asociado principalmente a los nevus melanocíticos adquiridos, también puede observarse en otros tumores melanocíticos de la piel, siendo el melanoma el que plantea una mayor preocupación14. En este escenario, la microscopía confocal de reflectancia ha surgido como una potencial herramienta para diferenciar los nevus benignos inflamados del melanoma15. Se ha sugerido que la integración de la edad del paciente y el examen meticuloso de la unión dermoepidérmica mediante microscopia confocal de reflectancia mejoran la precisión diagnóstica15.
Recientemente, el análisis inmunofenotípico de las células inflamatorias presentes en el microambiente tumoral de melanomas y halo nevus en regresión ha cobrado un creciente interés9,16. La identificación y caracterización del perfil inmunofenotípico en estas lesiones podría aportar nuevos conocimientos sobre la respuesta inmunitaria local y sus posibles implicaciones en la patogenia y progresión de estas entidades cutáneas. La caracterización del infiltrado inmune en melanomas con regresión histológica reveló una prevalencia de células T efectoras y supresoras, células B, células NK, macrófagos y células dendríticas reguladoras, todas ellas capaces de ejercer efectos inmunoestimuladores o inmunosupresores contrastados dentro del microambiente tumoral10. Por el contrario, el infiltrado inflamatorio observado en los halo nevus destaca por una mayor cantidad de células T citotóxicas activas y células T reguladoras PD1-positivas frente al infiltrado observado en el melanoma en regresión9. En esta investigación, pretendemos examinar el perfil inmunofenotípico de las células inflamatorias presentes en los halo nevus mediante un análisis detallado de marcadores histológicos, comparándolos con una cohorte de melanomas con regresión recientemente publicada, para mejorar una comprensión más profunda de los mecanismos inmunológicos vinculados a estas lesiones cutáneas.
Material y métodosRealizamos una cohorte retrospectiva de 70 melanomas que demostraron regresión histológica diagnosticados en el Hospital Universitario de Turín desde enero de 2003 hasta diciembre de 2014 y la comparamos con una cohorte prospectiva que incluía 16 nevus de Sutton dermatoscópicamente atípicos, extirpados en el Hospital Clínic de Barcelona desde enero de 2017 hasta diciembre de 2020. En este último grupo se incluyeron aquellas lesiones melanocíticas atípicas dermatoscópicas que fueron extirpadas para descartar melanoma y posteriormente fueron diagnosticadas histológicamente como nevus de Sutton. La evaluación histológica incluyó el grado y la localización del infiltrado inflamatorio dentro de la lesión, el grado de fibrosis y la evaluación de marcadores inmunohistoquímicos específicos —CD3, CD4, CD8, CD25, FOXP3 y PD1— en ambas cohortes. Todos los pacientes dieron su consentimiento informado permitiendo el uso de sus muestras biológicas en un biobanco. El estudio recibió la aprobación de los comités éticos locales del Hospital Clínic de Barcelona y del Hospital Universitario de Turín. El grupo de nevus incluyó únicamente aquellos nevus que mostraban características dermatoscópicas atípicas acompañadas de regresión histológica o fenómenos inflamatorios intensos. Por el contrario, no se analizaron los nevus que presentaban exclusivamente características histológicas de regresión. Para garantizar una evaluación exhaustiva de los parámetros histológicos, solo se tuvieron en cuenta las muestras en las que se extirpó el tumor completamente y que incluían todo el espesor de la lesión melanocítica en el examen. En consecuencia, se excluyeron del estudio las biopsias por afeitado y en sacabocados, las extirpaciones parciales y las muestras con material inadecuado. Las características demográficas, clínicas y patológicas de los pacientes se documentaron y actualizaron en una base de datos interna.
En todos los casos, 2 dermatopatólogos (LC y RS) evaluaron las características histopatológicas en secciones teñidas con hematoxilina y eosina (H&E). Esta evaluación incluyó el grado de infiltrado inflamatorio, clasificado como bajo (<30%), medio (30-60%) o alto (>60%), el patrón/localización del infiltrado inflamatorio (difusamente infiltrativo, parcheado perivascular o intratumoral, debajo del tumor) y grado de fibrosis (ausente, baja<30%, moderada 30-60% o alta>60%). En caso de desacuerdo, se consultó a un tercer dermatopatólogo (APC) para su resolución. En el grupo de melanoma, para distinguirlo de los linfocitos infiltrantes de tumores (TIL), el criterio principal para definir la regresión fue la necrosis, la apoptosis o la desaparición completa de las células tumorales malignas, con una evidente descomposición activa parcial o total de los nidos melanocíticos, sustituidos en la fase inicial por células inflamatorias, y en la fase tardía por fibrosis con vasos dilatados, y melanófagos17. Se excluyeron de la consideración las regiones de ulceración o las estrechamente relacionadas o adyacentes a ella.
Las muestras quirúrgicas se fijaron en formol tamponado al 4%, se procesaron de forma rutinaria y se incluyeron en parafina. Para cada caso, se analizaron inmunohistoquímicamente secciones de parafina de 3μm de grosor recogidas en portaobjetos «Superfrost Plus». El análisis inmunohistoquímico se realizó utilizando una plataforma automatizada de procesamiento de portaobjetos (Ventana BenchMark XT Autostainer; Ventana Medical Systems, Estados Unidos). Toda la cohorte de halo nevus se tiñó con CD3 (Confirm anti-CD3, clon 2GV6; Ventana, Roche); CD4 (Confirm anti-CD4, clon SP35; Ventana, Roche); CD8 (Confirm anti-CD8, clon SP57; Ventana, Roche); CD25 (clon 4C9; Cell Marque, Sigma Aldrich); FOXP3 (clon 236A/E7; eBiosciences); y PD1 (clon NAT 105; Cell Marque, Sigma-Aldrich).
Las poblaciones de subconjuntos de linfocitos se investigaron evaluando la expresión inmunohistoquímica de CD3, CD4, CD8, FOXP3 y PD1. Para cada marcador, se contó manualmente el número de células positivas por campo de alta potencia (HPF). Cada HPF corresponde a un campo de microscopio de gran aumento (400×) que mide 500μm de diámetro en un objetivo 40×/0,65 montado en un microscopio Olympus modelo BX41 (Olympus, Japón). Los recuentos se realizaron en al menos 4 (máximo 8) campos HPF para cada tipo de área y el valor absoluto total se normalizó a 1mm2 (4 HPF corresponden a 1mm2). Además, se calcularon los siguientes ratios para cada lesión: CD4+/CD3+, CD8+/CD3+, CD4+/CD8+, CD25+/CD4+, FOXP3+/CD4+, PD1+/CD4+.
Las tablas estadísticas descriptivas resumen las características de los pacientes y las lesiones. La prueba de Mann-Whitney comparó datos continuos distribuidos de forma no normal entre 2 grupos. La prueba exacta de Fisher examinó las asociaciones en datos nominales emparejados, especialmente en muestras de pequeño tamaño. La prueba del chi-cuadrado evaluó las asociaciones en conjuntos de datos nominales emparejados más grandes. Los valores p<0,05 se consideraron estadísticamente significativos. El análisis estadístico se realizó con Stata/SE.v.18 (StataCorp, College Station, TX, Estados Unidos).
ResultadosUn total de 39 de los 70 pacientes con melanoma con una regresión histológica (56%) eran hombres y 31 (44%), mujeres, con una mediana de edad de 58 años (rango, 23-78)10. Los tumores primarios se localizaron en el tronco en el 58,6% de los casos (41/70), seguidos de las extremidades inferiores (22/70, 31,4%), extremidades superiores (4/70, 5,7%) y cabeza/cuello (3/70, 4,3%). El tipo histológico más frecuente fue el melanoma de extensión superficial, observado en el 80% de los casos (56/70). El grosor medio de Breslow fue de 2,73mm (DE, 2,10). El 33% de las lesiones (23/70) presentaban ulceración. Se observó un recuento mitótico>1/mm2 en el 61% (43/70), con un 38,5% (27/70) de neoangiogénesis difusa y un 48,6% (34/70) de invasión vascular. Los TIL se describieron como «brisk» en el 28,6% de los casos (20/70). La afectación metastásica del ganglio linfático centinela (GLC) se observó en el 37% de los pacientes (26/70).
En cuanto a la población de nevus de Sutton, un total de 16 casos fueron aptos para el análisis. La mediana de edad de los pacientes era de 30 años (rango 16-53). De los 16 individuos, 11 eran hombres (68,75%) y 5 mujeres (31,25%). Las lesiones se localizaban con mayor frecuencia en la región interescapular (4/16, 25%), seguida de las zonas lumbar y escapular (3/16, 18,8% cada una). Las zonas del hombro y el abdomen representaron cada una 2/16 (12,5%) de los casos. Otras localizaciones, como las zonas retroauricular y paravertebral, representaron cada una 1/16 (6,25%) del número total de lesiones. El tamaño de los nevus de Sutton atípicos varió, con una mediana de 5,5mm (rango, 2-10mm). Los tamaños registrados con más frecuencia fueron 5mm (25% de los casos), 4mm (12,5%) y 7mm (12,5%). Las lesiones clínicamente palpables estaban presentes en 4 de los 16 casos (25%). Dermatoscópicamente, 8 de 16 casos (50%) mostraban un patrón reticular-globular, mientras que 4 de 16 (25%) mostraban un patrón reticular, y 4 de 16 (25%) un patrón globular. Según la lista de comprobación de 7 puntos comúnmente utilizada para las lesiones melanocíticas, se registró una puntuación≥3 en 15 casos (93,75%), mientras que solamente en un caso (6,25%) se registró una puntuación<318. En cuanto a las características confocales según la puntuación de Barcelona (p.ej., umbral para descartar un melanoma=0), la puntuación más frecuente fue 1 (8/16, 50%), seguida de la puntuación 0 (6/16, 37,5%) y la puntuación 2 (2/16, 12,5%)15.
En la evaluación histopatológica, 8 de los 16 casos (50%) presentaban un infiltrado inflamatorio alto (>60%). En 7 de 16 casos (43,75%), el infiltrado era moderado (30-60%), y en el caso restante (1/16, 6,25%), era bajo (<30%). Ningún caso mostraba fibrosis difusa; sin embargo, 14 de 16 casos (87,5%) presentaban fibrosis baja (9/16, 56,25%) o moderada (5/16, 31,25%), estando ausente la fibrosis en 2 de 16 casos (12,5%). El patrón de localización inflamatoria fue difusamente infiltrativo en 7 de 16 casos (43,75%), parcheado perivascular o intratumoral en 6 de 16 casos (37,5%), y localizado debajo del tumor en 3 de 16 casos (18,75%).
En cuanto al análisis comparativo entre los 2 grupos en términos de inmunotinción, el grupo de nevus atípicos de Sutton presentó una densidad inflamatoria significativamente mayor que el grupo de melanomas con regresión (p=0,008 para la inflamación de baja densidad y p<0,001 para la inflamación de alta densidad, respectivamente). Sin embargo, no se observaron diferencias en cuanto a la localización de la inflamación dentro de la lesión (difusa, por debajo de la lesión melanocítica o en parches). En cuanto a la cantidad de fibrosis, no se observaron diferencias significativas entre los 2 grupos (p>0,05). Sin embargo, al evaluar la calidad de la fibrosis, el grupo de nevus de Sutton presentaba predominantemente una fibrosis leve-delicada, mientras que el grupo de melanoma mostraba una fibrosis bien establecida, caracterizada como esclerótica, desmoplásica, laminar o compacta.
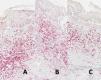
En cuanto a la evaluación de la inmunotinción, los nevus atípicos de Sutton muestran una mayor proporción de población CD8/CD3, mientras que los melanomas con regresión mostraron mayores proporciones CD4/CD3 y CD4/CD8 (todas ellas estadísticamente significativas a p<0,05) (tabla 1, figs. 1 y 2A-C).
Entre otros marcadores inmunohistoquímicos, los cocientes CD25/CD4, FOXP3/CD4 y PD1/CD4 fueron estadísticamente superiores en los nevus de Sutton atípicos (p<0,05) (tabla 1, fig. 3).
DiscusiónHistológicamente, un halo nevus muestra un denso infiltrado linfocítico que gradualmente oscurece y sustituye a las células del nevus. De forma similar, la regresión en el melanoma comparte esta característica, mostrando un denso infiltrado linfocítico y áreas en las que las células neoplásicas han desaparecido por completo. Conceptualmente, tanto la regresión como el halo nevus demuestran una respuesta inmunitaria activa contra la lesión melanocítica.
El inmunofenotipo de las células inflamatorias que acompañan a la regresión en el melanoma y los nevus de Sutton ha sido poco estudiado. En 2015, un estudio de Botella et al. encontró una mayor reacción citotóxica en halo nevus frente a melanomas con regresión, validando nuestro estudio, que mostró un mayor ratio CD8/CD3 en el grupo de nevus de Sutton9. Se encontraron resultados similares en una serie de lesiones melanocíticas spitzoides, cuando estas lesiones se agruparon en tumores benignos/de bajo grado y tumores malignos/de alto grado16. Sin embargo, el estudio de Botella et al. también observó un infiltrado más denso de células marcadas con PD1 en los nevus de Sutton, aunque no encontró diferencias significativas en la expresión de FOXP3. Por el contrario, nuestro estudio sí encontró diferencias significativas, con mayor presencia de PD1 y FOXP3 en el grupo de Sutton frente al de melanoma9.
Estos hallazgos sugieren un mecanismo regulador activo junto con la respuesta citotóxica en los nevus de Sutton. La evidencia combinada de un infiltrado más denso de PD1, FOXP3 y CD25 apunta a un entorno inmunitario más activo, que contribuye a una mejor regulación de la respuesta inmunitaria, especialmente en los nevus de Sutton19.
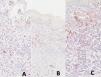
Ribero et al. sugirieron que, en los melanomas, ciertos clones neoplásicos podrían eludir la respuesta inmunitaria, dando lugar a un crecimiento descontrolado11. En este escenario, la ineficacia de la respuesta citotóxica en los melanomas podría estar relacionada con una disminución de CD8, así como con una reducción del entorno inmunitario regulador marcado por PD1, CD25 y FOXP3 (fig. 4A-C).
Los recientes hallazgos alentadores de Cho et al. sugieren que un compuesto denominado Celastrol muestra una eficacia significativa en la inhibición del crecimiento tumoral en el melanoma20. Este efecto se consigue mediante el bloqueo de la unión entre IL-2 y CD25, potenciando así la actividad antitumoral de las células T. Esto podría ser muy prometedor, especialmente en el caso de las células T que se encuentran en la fase de crecimiento y en combinación con otras terapias dirigidas en los melanomas avanzados21,22.
En los melanomas, la presencia de células FOXP3+ se ha asociado con una reducción de la respuesta inmunitaria tanto innata como adquirida contra el tumor, empleando un mecanismo típicamente implicado en el blindaje del organismo contra la autoinmunidad20,23,24. Cuando evaluamos la relación FOXP3/CD4 en nuestro estudio, observamos niveles de expresión más altos en los nevus de Sutton y niveles más bajos en los melanomas con regresión. Esta discrepancia sugiere un estado distinto de tolerancia inmunitaria entre los nevus de Sutton y los melanomas con regresión, lo que podría servir como indicador temprano de la desactivación del sistema inmunitario en los melanomas. Esta observación concuerda con las pruebas que indican que, en el melanoma metastásico, las células inmunitarias FOXP3+ infiltradas en el tumor podrían servir como posible biomarcador predictivo de la respuesta al tratamiento y la supervivencia global. Balatoni et al. demostraron que la densidad de células FOXP3+ infiltradas en las metástasis de los ganglios linfáticos era el factor predictivo más potente de la respuesta al tratamiento con ipilimumab25.
Este estudio se centra en 2 entidades que son difíciles de diferenciar en nuestra práctica diaria: los halo nevus y el melanoma maligno con regresión. Los fenómenos autoinmunes observados en los nevus de Sutton podrían inducir una atipia reactiva, lo que complicaría su diferenciación, incluso para los patólogos expertos26. El objetivo del presente estudio era describir la reacción inmunitaria en ambas entidades: en primer lugar, se observó que el infiltrado inflamatorio en los halo nevus es más activo, mientras que hay una respuesta citotóxica pronunciada en los nevus de Sutton. En segundo lugar, se observó un mecanismo regulador paralelo a la respuesta citotóxica con un infiltrado más denso de PD1, FOXP3 y CD25. En conclusión, el estudio del perfil inmunitario de los tumores melanocíticos podría ser útil en casos de solapamiento de características morfológicas, que dificultan la distinción entre melanoma con regresión y el nevus de Sutton. Sin embargo, los presentes resultados no permiten extrapolar la utilidad del inmunofenotipo de inflamación para diferenciar el melanoma de las lesiones melanocíticas con regresión. Las limitaciones de nuestro estudio incluyen la naturaleza subjetiva del método de evaluación inmunohistoquímica. Además, el pequeño tamaño de la muestra en ambos grupos limita la solidez del estudio, siendo el tamaño de la muestra del grupo de nevus de Sutton significativamente inferior al del grupo de melanoma, ya que el diagnóstico de los nevus de Sutton suele ser clínico/dermatoscópico y no requiere escisión quirúrgica. Los casos incluidos en el estudio fueron aquellos nevus de Sutton que presentaban características clínicas atípicas, que requerían escisión y planteaban un reto diagnóstico. Estos casos específicos son menos frecuentes en nuestra práctica clínica habitual. Otra limitación es que solo se incluyeron presentaciones clínicas atípicas de nevus de Sutton, lo que puede limitar la generalización de los resultados a todos los tipos de nevus de Sutton. Ninguno de estos casos ha recidivado hasta la fecha.
Comprender la composición del infiltrado inmunitario en los casos en que los melanomas desaparecen total o parcialmente es crucial en una era de tratamientos diseñados para potenciar la respuesta inmunitaria frente a este tumor. En base a nuestros hallazgos, recomendamos la realización de nuevos estudios para profundizar en el conocimiento del inmunofenotipo de los nevus de Sutton y de los mecanismos subyacentes a la regresión histológica en melanomas, contribuyendo así a avanzar en el conocimiento clínico y patológico.
Declaración del comité de revisión institucionalEl estudio se realizó en pleno cumplimiento de la Declaración de Helsinki, y fue revisado y aprobado por el Comité de Ética de la Investigación del CEI del Hospital Clínic de Barcelona; aprobación HCB/2018/0872 (15 de junio de 2022).
Declaración de consentimiento informadoSe obtuvo el consentimiento informado de todos los sujetos implicados en el estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Disponibilidad de datosLos datos están disponibles previa solicitud a los autores.