La dificultad de los fotoprotectores tradicionales en prevenir las queratosis actínicas (QA) y el cáncer cutáneo queratinocitario han hecho necesaria la búsqueda de nuevas formas de fotoprotección. Las enzimas reparadoras del ADN son compuestos que tienen como objetivo aumentar la reparación del ADN dañado par la radiación UV y reducir así el riesgo de carcinogénesis.
Se realizó una revisión sistemática sobre el uso de enzimas reparadoras de ADN en la prevención y tratamiento del precáncer y cáncer cutáneo de acuerdo con la guía PRISMA, incluyendo estudios publicados entre 2000 y 2024.
Se identificaron 486 artículos, de los cuales se incluyeron 20 estudios: 9 ensayos clínicos aleatorizados y 11 ensayos cuasiexperimentales. Se incluyeron 8 estudios sobre la fotoliasa; 6 estudios sobre la endonucleasa y 6 estudios sobre combinaciones de distintas enzimas reparadoras de ADN.
Las enzimas reparadoras de ADN reducen el daño del ADN y previenen el cáncer de piel, en especial, cuando se combinan entre sí así como con fotoprotectores tradicionales y otras sustancias como los antioxidantes. La heterogeneidad de los estudios limita la posibilidad de establecer conclusiones firmes.
The difficulty of traditional photoprotectors in preventing actinic keratoses (AK) and keratinocyte skin cancer has led to research into new photoprotection measures. DNA repair enzymes are compounds that aim to increase the repair of DNA damaged by UV radiation and thus reduce the risk of carcinogenesis.
We conducted a systematic review on the use of DNA repair enzymes in the prevention and treatment of precancerous and cancerous skin conditions in full compliance with the PRISMA guidelines, including stud
ies published from 2000 through 2024.
A total of 486 articles were identified, 20 of which 20 were included: 9 randomized clinical trials and 11 quasi-experimental trials. A total of 8 studies focused on photolyase, 6 on endonuclease, and 6 on combinations of different DNA repair enzymes.
DNA repair enzymes reduce DNA damage and prevent skin cancer, especially when combined with each other as well as with traditional photoprotectors and other substances such as antioxidants. The heterogeneity of the studies limits the ability to draw definitive
conclusions.
La radiación ultravioleta (RUV) es el principal factor asociado al desarrollo de cáncer cutáneo y de fotoenvejecimiento. Es capaz de dañar de forma directa e indirecta las proteínas y el ADN nuclear y mitocondrial. El organismo dispone de mecanismos reparadores de ADN pero pueden ser insuficientes, por lo que este daño se va acumulando y, con el tiempo, da lugar a la aparición de cáncer cutáneo, principalmente en forma de queratosis actínicas (QA) y cáncer queratinocítico1.
La RUV, principalmente UVB (290-320nm), produce daño en el ADN de forma directa, dando lugar a la formación de fotoproductos como los dímeros de ciclobutano pirimidina (CPD), que son los mayoritarios (75%) y los 6-4 pirimidina pirimidona (6-4 PP) (25%)2. Estos fotoproductos son los principales responsables de las quemaduras, la apoptosis, la hiperplasia de la epidermis y la inducción de mutaciones en genes supresores tumorales como p53 o PTCH u oncogenes como ras, que finalmente conducen al cáncer cutáneo1,3,4.
Por otra parte, el daño en el ADN conduce a un estado de inmunosupresión, ya que se produce un aumento de mediadores como IL-6, IL-10, TNF y TGF-β con efectos inmunosupresores que facilitan el escape de células cancerígenas2.
Finalmente, la RUV acelera el acortamiento de los telómeros1 y es capaz de dañar los mecanismos de reparación, como el sistema de reparación por escisión de nucleótidos (NER) y el sistema de reparación por escisión de bases (BER) que reparan los CPD y 6-4 PP, así como el daño producido por las especies reactivas de oxígeno (ERO), respectivamente1,3.
Otro mecanismo importante por el que la RUV produce daño en la piel es a través de la producción de ERO, originadas fundamentalmente por la radiación UVA (320-400nm)1,2,4. Altos niveles de ERO producen daño en el ADN y en los fibroblastos encargados de mantener el tejido conectivo así como alteraciones en el colágeno y la elastina. Además, la RUV-A induce la producción de metaloproteinasa-1 (MMP-1), que destruye el colágeno I1. La 8-hydroxi-2’-desoxiguanosina (8-OHdG) es uno de los fotoproductos más importantes que surgen de la interacción de las ERO con el ADN y su detección nos permite cuantificar el daño oxidativo1,4.
Las QA son una de las principales lesiones cutáneas producidas por la exposición solar a lo largo de los años5. Supone una de las consultas dermatológicas más frecuentes con una prevalencia estimada en España de 28,6% en pacientes de más de 45 años5. Frecuentemente, las QA se encuentran dentro de un «campo de cancerización»6. Las QA tienen un potencial riesgo individual de evolucionar hacia un carcinoma escamoso invasivo (CEi) de entre el 0 y 0,075% por lesión-año6,7. Sin embargo, se ha propuesto que el desarrollo de un CEi puede ocurrir o bien a partir de una QA preexistente (0,1-16%) o bien de novo, a partir de una célula dañada del campo de cancerización, no visible clínicamente, siendo esta vía la más habitual (80%)6. Es por ello que la tendencia actual es hablar de «tratamiento del campo de cancerización»6. Además, no hay que olvidar localizaciones especiales como el labio, dado que la queilitis actínica tiene un riesgo de progresión a CEi entre un 3 y un 14%8-10.
Hasta ahora, los fotoprotectores tradicionales han demostrado un efecto protector moderado frente a las QA y el CEi y no han demostrado efecto frente al carcinoma basocelular (CBC)3,11.
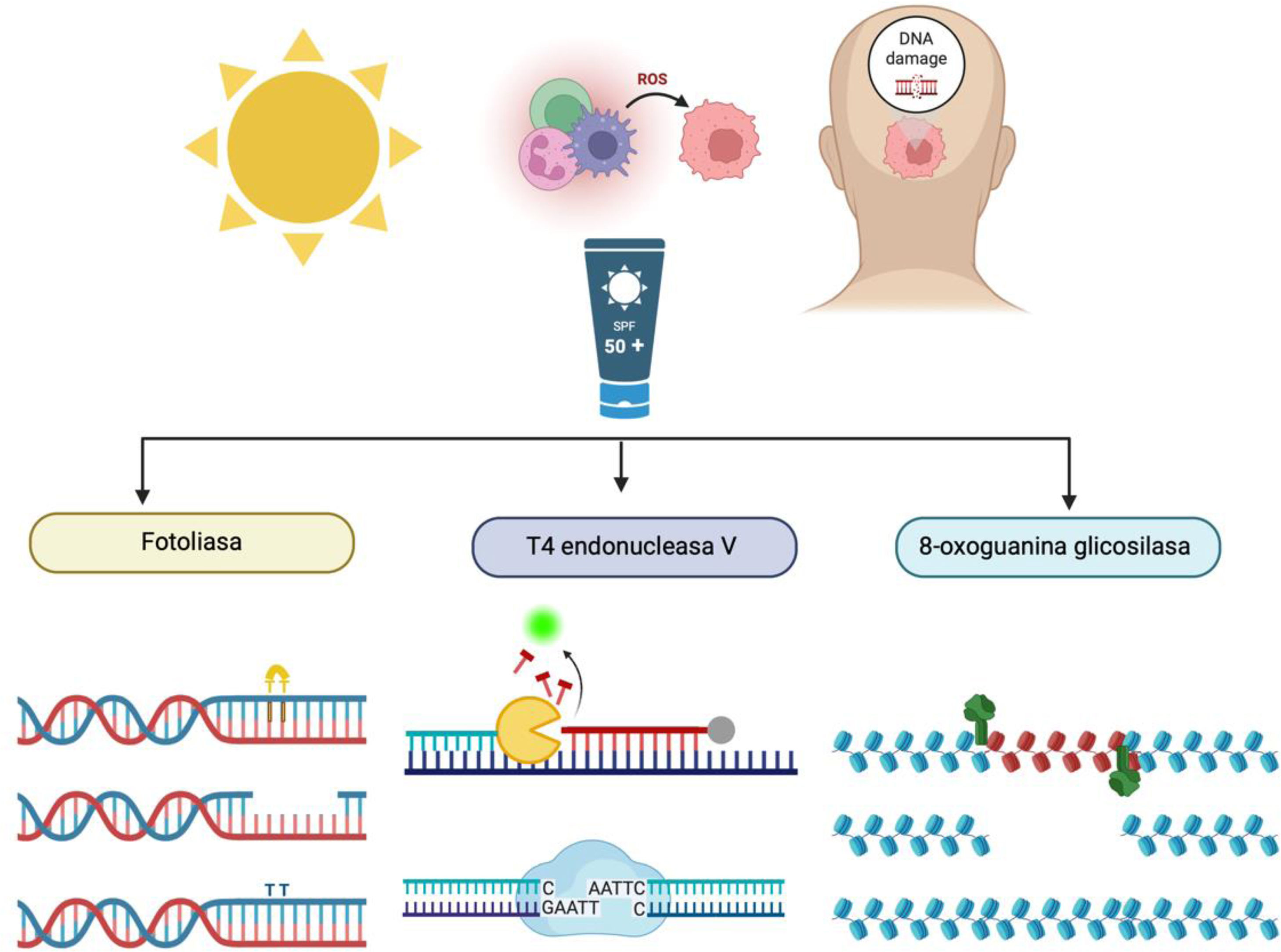
Por lo expuesto anteriormente y, dadas las limitaciones de los fotoprotectores tradicionales, se habla cada vez más de la «fotoprotección activa», que se basa en el uso de fotoprotectores que contienen sustancias que, sin ser filtros, tienen un efecto fotoprotector, como los antioxidantes o las enzimas reparadoras de ADN1,12. Entre las enzimas reparadoras de ADN más utilizados encontramos: la fotoliasa, la endonucleasa V (T4V5) y la 8-oxoguanina glicosilasa (OGG1), habiéndose centrado los estudios principalmente en las 2 primeras (fig. 1).
La fotoliasa es una flavoenzima que está presente en algas, peces, anfibios y algunos mamíferos no placentarios, pero no en los seres humanos. Reconoce los dímeros de pirimidina dañados y los convierte en su forma monomérica mediante la absorción directa de luz azul (300-500nm), mecanismo denominado fotoreactivación2,12-15.
Por otro lado, la T4V5 es una enzima que se aisló inicialmente de Escherichia coli infectada por T4 bacteriófago. Actúa potenciando el mecanismo NER presente en los seres humanos, de manera que reconoce áreas de daño en el ADN, las escinde y sintetiza una nueva cadena con la inserción de los pares de bases correctos2,3,14,15.
Por último, la OGG1 es un enzima presente en bacterias, hongos, plantas y mamíferos que reconoce e inicia la reparación de daño causando por las ERO, siendo capaz de disminuir la 8-OHdG, que como se ha comentado previamente, permite cuantificar el daño oxidativo2,16. Además, tiene alta especificidad por el ADN mitocondrial, disminuye la secreción de MMP-1 y previene la pérdida de colágeno16.
El objetivo de esta revisión es recopilar y resumir la información que se dispone actualmente de estos sistemas de fotoprotección para prevenir y tratar el precáncer y cáncer cutáneo queratinocitario.
Material y métodosSe realizó una búsqueda bibliográfica para identificar todos los trabajos publicados desde 2000 hasta 2024, sobre el uso tópico de enzimas reparadoras en la prevención y el tratamiento del precáncer y cáncer cutáneo.
Los resultados se han limitado a estudios realizados en humanos y publicados en español o inglés.
Se realizó una búsqueda sistemática exhaustiva en las siguientes bases de datos: PubMed, The Cochrane Library, Web of Science y EMBASE/Elsevier de acuerdo con la guía Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) guideline17. Las palabras claves utilizadas han sido las siguientes: DNA repair enzymes, prevention, treatment and skin cancer.
Se clasificaron y analizaron los artículos elegibles y se analizaron las referencias de los artículos incluidos para buscar artículos adicionales para su inclusión en la revisión.
Finalmente, con el objetivo de identificar las revisiones sistemáticas sobre enzimas reparadoras para la prevención de cáncer de piel que se están llevando a cabo en este momento, se ha realizado una búsqueda electrónica en PROSPERO, registro internacional de revisiones sistemáticas.
La estrategia de búsqueda ha sido la siguiente:
- –
(DNA repair enzymes) AND (skin cancer).
- –
(DNA repair enzymes) AND (actinic keratosis) AND (field cancerization).
- –
(Photolyase) AND (skin cancer).
- –
(Endonuclease) AND (skin cancer).
- –
(DNA Repair) AND (oxoguanine glycosylase 1, human) AND (skin Neoplasms).
- –
(Ogg1 enzyme) AND (DNA repair) AND (skin cancer).
Los criterios de inclusión de los estudios fueron los siguientes:
- –
Tipos de estudios: metaanálisis, revisiones sistemáticas y ensayos clínicos.
- –
Población: pacientes mayores de edad que han recibido tratamiento con enzimas reparadoras de ADN de manera tópica, independientemente del sexo, la etnia, la comorbilidad y el tratamiento previo.
- –
Para que lo estudios sean considerados, deben incluir pacientes con tratamiento con enzimas reparadoras (fotoliasa, T4V5 y OGG1) como prevención de cáncer cutáneo.
- –
Se aplicó restricción a los siguientes idiomas: español e inglés.
Los criterios de exclusión de los estudios fueron:
- –
Estudios publicados fuera del rango de tiempo establecido.
- –
Estudios que no utilicen medidas de evaluación clínicas y analíticas aceptadas y validadas para campo de cancerización.
- –
Estudios observacionales y series de casos.
- –
Ensayos clínicos con un número de pacientes inferior a 10.
- –
Editoriales y revisiones narrativas.
Los resultados de las búsquedas se descargaron en un gestor de referencias bibliográficas, Mendeley®, donde se realizaron filtros basados en el título y el resumen de los trabajos. Durante este proceso, se registraron todas las referencias duplicadas, descartadas y seleccionadas mediante un diagrama de flujo (fig. 2). Es importante destacar que la búsqueda no se limitó a autores específicos, revistas o instituciones.
Tras realizar la búsqueda, se tuvo en cuenta el título y el abstract de los artículos encontrados para determinar si cumplían los criterios de inclusión. Una vez realizado esto, se buscó el texto completo y se realizó una lectura crítica. Finalmente, se determinó la calidad de los estudios incluidos mediante la evaluación del riesgo de sesgo de los ensayos clínicos (herramienta del grupo Cochrane). En base a estos resultados, se objetivó el nivel de evidencia de todos los estudios (niveles de evidencia de SIGN).
El riesgo de sesgo puede producirse en el análisis y la selección de los artículos para su inclusión, en la extracción de los datos y en su elaboración y análisis.
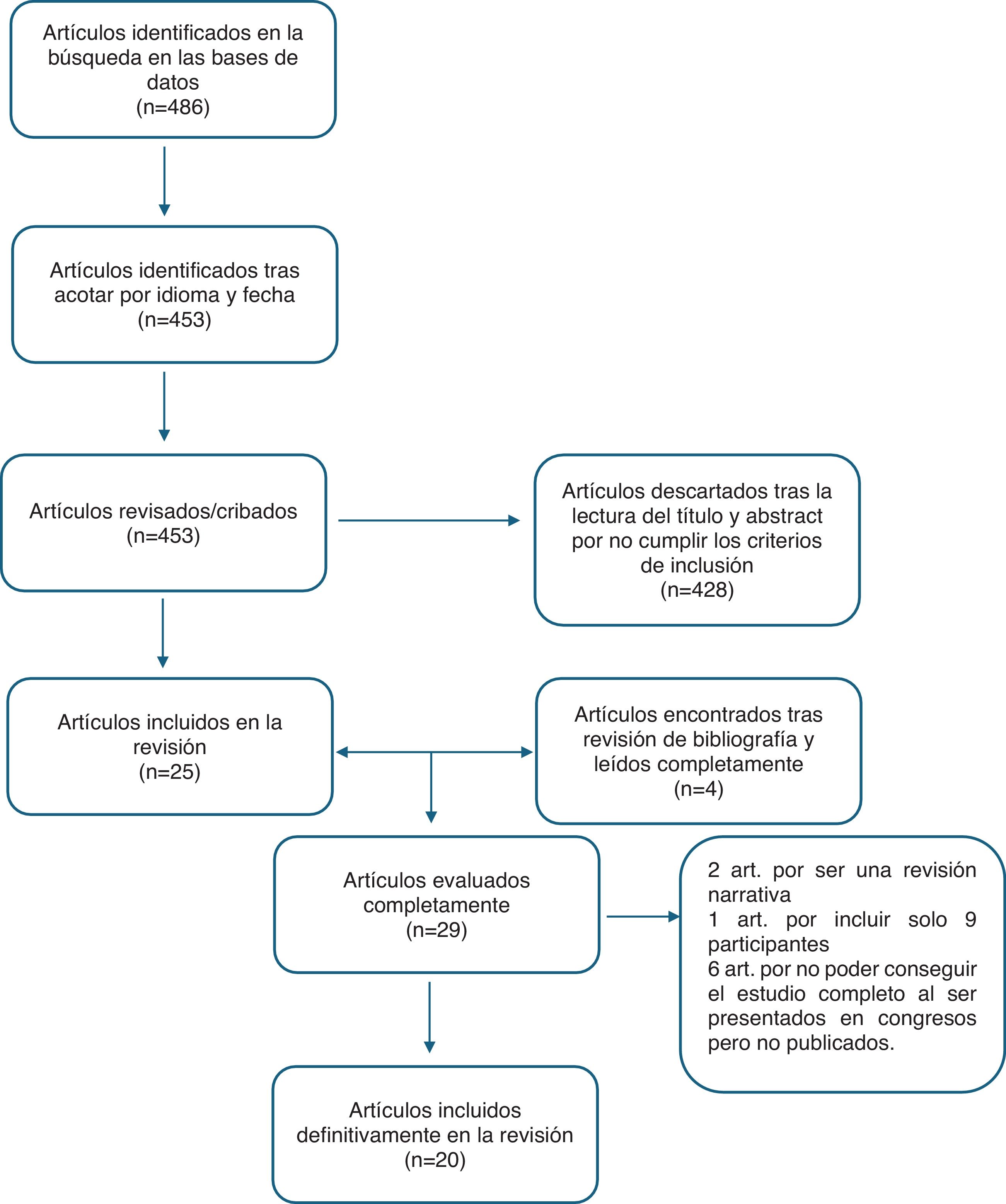
ResultadosEncontramos un total de 486 artículos en la búsqueda inicial, que tras acotar por año entre 2000 y 2024, ambos inclusive, y por idioma, se redujeron a 453. Después de la lectura del título y el abstract se descartaron 428 artículos por no cumplir con los criterios de inclusión, por lo que finalmente se incluyeron 25 artículos en la revisión. Valoramos las referencias de cada uno de estos artículos en busca de estudios que pudieran haberse escapado a la búsqueda bibliográfica, encontrando 4 artículos que por el título y el abstract cumplían inicialmente los criterios de inclusión. Realizamos una lectura completa y crítica de estos 29 artículos, descartando finalmente 9 por no cumplir con los criterios de inclusión: 2 por ser revisiones narrativas y no sistemáticas, 1 por incluir solo 9 participantes en el estudio y 6 artículos porque no se disponía de los estudios originales y solo de los resúmenes presentados en distintas reuniones científicas (fig. 2). Por todo ello, finalmente se incluyeron un total de 20 estudios, 8 sobre fotoliasa (tabla 1), 6 sobre endonucleasa (tabla 2) y 6 sobre combinaciones de distintas enzimas reparadoras de ADN (tabla 3). No encontramos ningún estudio que cumpliera con nuestros criterios de inclusión sobre OGG1.
Estudios con fotoliasa
| Año | Título | Tipo de artículo | Intervención | Resultados | Riesgo de sesgo y nivel de evidencia | |
|---|---|---|---|---|---|---|
| Stege et al. | 2000 | Enzyme plus light therapy to repair DNA damage in ultraviolet-B-irradiated human skin | Estudio cuasiexperimetal | N = 19 voluntarios sanos.Loción con fotoliasa 15 (sin FT) | Disminución del 40-45% de los CPD, del eritema y de las células quemadura a los 30 min de fotorreactivación; inhibición completa de la supresión de ICAM-1 | Alto1– |
| Berardesca et al. | 2012 | Reduced ultraviolet-induced DNA damage and apoptosis in human skin with topical application of a photolyase-containing DNA repair enzyme cream: Clues to skin cancer prevention | Estudio cuasiexperimental | N=10 voluntarios sanosEfecto de un FT FPS 50 vs placebo.Efecto del mismo fotoprotector suplementado con fotoliasa vs placebo | FT FPS 50 redujo la formación de CPD y la apoptosis, un 62% y un 40%, respectivamente frente a placeboEl mismo FT con fotololiasa redujo la formación de CPD y la apoptosis, un 93% y un 82%, respectivamente frente a placebo | Alto1– |
| Rstom et al. | 2014 | Evaluation of the effects of a cream containing liposome- encapsulated photolyase and SPF 100 sunscreen on facial actinic keratosis: clinical, dermoscopic, and confocal microscopy based analysis | Estudio cuasiexperimental | N=14 pacientes con QA.FT FPS 100 + fotoliasa | Se observó una mejoría clínica así como en la dermatoscopia y en la microscopía confocal de la mayoría de QA grado I a diferencia de las QA grado II, donde no hubo cambios | Alto1– |
| Puig et al. | 2014 | Field cancerisation improvement with topical application of a film-forming medical device containing photolyase and UV filters in patients with actinic keratosis, a pilot study | Estudio cuasiexperimental | N=13 pacientes con QAFT FPS 100 (3) vs FPS 100 + fotoliasa (9) | El grupo de FPS 100 + fotoliasa obtuvo una mejoría significativa tanto clínica, desmatoscópica, histopatológica así como en microscopía confocal; a diferencia del grupo FPS 100Hubo una disminución significativa de la expresión p21, pero no de p53 y bcl2 en el grupo de SPF 100 + fotoliasa. | Alto1– |
| Laino et al. | 2015 | The efficacy of a photolyase-based device on the cancerization field: a clinical and thermographic study | Estudio cuasiexperimental | N=30 pacientes con QA.Aplicación de FT FPS100 + fotoliasa 2 veces al día durante 9 meses | El uso de FT SPF100 + fotoliasa durante 9 meses redujo el halo hipertérmico una media de 2,82cm2 a los 9 meses. En 5 casos, desapareció completamente | Alto1– |
| Eibenschutz et al. | 2016 | A 9-month, randomized, assessor-blinded parallel-group study to evaluate clinical effects of a film-forming medical devices containing photolyase and sun-filters in the treatment of cancerization field in comparison with sunscreen in patients after successful PDT for actinic keratosis | Ensayo clínico, aleatorizado, paralelo, simple ciego | N=30 pacientes con QAAplicación tras una sesión de TFD, de un FT FPS 50+ (N=15) frente a FT 100 con fotoliasa (N=15) | Hubo un aumento del número de QA tras 9 meses de tratamiento en los participantes que utilizaron FT FPS 50+ mientras que en el grupo de la fotoliasa hubo una disminución | Alto1– |
| Moscarella et al. | 2017 | Management of cancerization field with a medical device containing photolyase: a randomized, double-blind, parallel-group pilot study | Ensayo clínico aleatorizado, paralelo, doble ciego | N=36 pacientes con QAFotoprotector FPS 100 + fotoliasa (N=17) vs fotoprotector FPS 50+ (N=19) | No se observó diferencias en el número de QA entre el grupo de FT+fotoliasa y el de FT a los 6 mesesEn el subgrupo de pacientes con≤10 QA, el fotoprotector con fotoliasa fue superior en la reducción del número de QA frente al FT | Alto1– |
| Alvares et al. | 2021 | Efficacy of sunscreen with photolyase or regular sunscreen associated with topical antioxidants in treating advanced photodamage and cutaneous field cancerization: a randomized clinical trial | Ensayo clínico, aleatorizado, factorial, abierto para fotoprotector habitual frente a fotoprotector con fotoliasa, doble ciego para crema con antioxidantes vs. placebo | N=40 pacientes con QA2 grupos:fotoprotector con fotoliasa FPS 99 (N=20) vs fotoprotector convencional FPS 99 (N=20)4 subgrupos: Fotoprotector con fotoliasa + crema con antioxidantes (N=10) Fotoprotector con fotoliasa + placebo (N=10) Fotoprotector convencional + crema con antioxidantes (N=10) Fotoprotector convencional + placebo (N=10) | No se encontraron diferencias estadísticamente significativas entre el FT y el fotoprotector con fotoliasa en el aclaramiento de QA y la mejora en la escala de fotoenvejecimiento a las 8 semanas. Los antioxidantes son más efectivos en reducir el número de QA frente a placebo | Medio1+ |
Estudios con endonucleasa
| Autor | Año | Título | Tipo de artículo | Intervención | Resultados | Riesgo de sesgo y nivel de evidencia |
|---|---|---|---|---|---|---|
| Wolf et al. | 2000 | Topical treatment with liposomes containing T4 endonuclease V protects human skin in vivo from ultraviolet-induced upregulation of interleukin-10 and tumor necrosis factor α | Ensayo clínico, aleatorizado. Ciego desconocidoCada paciente es su propio control | N=15 pacientesLoción con T4N5 activa (sin FT) vs. loción con T4N5 inactiva (sin FT) | No hay una diferencia estadísticamente significativa en el número de CPD, reparación de ADN, eritema, pigmentación o células quemadura a las 6 h.Hay una disminución estadísticamente significativa del ARNm de IL-10 y el TNF-α, así como de la proteína IL-10 con T4N5 a las 6 h | Medio1+ |
| Yarosh et al. | 2001 | Effect of topically applied T4 endonuclease V in liposomes on skin cancer in xeroderma pigmentosum: A randomised study | Ensayo clínico, aleatorizado, doble ciego | N=30 pacientes con xeroderma pigmentosoLoción con T4N5 (N=20) (sin FT) vs. loción con placebo (N=10) | El número de QA y de CBC fue menor en el grupo de tratamiento (T4N5) frente al grupo placebo, con una diferencia estadísticamente significativa. No se observó incremento de QA y CBC en los 6 meses posteriores | Medio1+ |
| DeBoyes et al. | 2010 | Reduced number of actinic keratoses with topical application of DNA repair enzyme creams | Estudio cuasiexperimental | N=17 pacientes con QA (5 pérdidas)Aplicación de loción T4N5 (sin FT) | A las 48 semanas se observó una reducción estadísticamente significativa en el número de QA | Alto1– |
| Emanuele et al. | 2013 | Topical application of preparations containing DNA repair enzymes prevents ultraviolet-induced telomere shortening and c-FOS proto-oncogene hyperexpression in human skin: An experimental pilot study | Estudio cuasiexperimental | N=12 voluntarios sanosPlacebo vs. FT FPS 50 vs. FT FPS 50 + endonucleasa vs. FT FPS 50 + fotoliasa + endonucleasa | El acortamiento de los telómeros y el aumento de c-FOS fue menor con el uso de FT FPS 50 + endonucleasa. La combinación de FT FPS 50 + fotoliasa + endonucleasa obtuvo mejores resultados en ambos casos | Alto1– |
| Rosenthal et al. | 2019 | DNA repair enzyme containing lip balm for the treatmentof actinic cheilitis: A pilot study | Ensayo cuasiexperimental | N=29 pacientes con queilitis actínicaAplicación de un bálsamo labial con SPF 30 + T4N5 | Hubo una disminución significativa en la superficie labial afectada así como en la ACS y en el GAIS | Alto1– |
| Anderson et al. | 2023 | Ultraviolet B-rays induced gene alterations and DNA repair enzymes in skin tissue | Ensayo clínico unicéntrico, aleatorizadoCiego desconocidoCada paciente es su propio control | N=48 voluntarios sanosCrema con T4N5 (sin FT) (N=24) vs controlCrema con fotoliasa (sin FT) (N=24) vs. control | No se encontraron diferencias estadísticamente significativas entre la zona control y la zona de tratamiento a las 2 semanas respecto a la expresión génica | Alto1– |
Estudios con combinaciones de enzimas reparadoras de ADN
| Año | Título | Tipo de artículo | Intervención | Resultados | Riesgo de sesgo y nivel de evidencia | |
|---|---|---|---|---|---|---|
| Spencer et al. | 2013 | Topical formulation engendered alteration in p53 and cyclobutene pyrimidine dimer expression in chronic photodamaged patiens | Estudio cuasiexperimental | N=20 voluntarios sanos.Aplicación de un serum con fotoliasa, endonucleasa y OGG1 | Se observa una reducción estadísticamente significativa de mutaciones en p53 y de CPD Además, en el 50% de los pacientes hubo una disminución en la elastosis solar | Alto1– |
| Emanuele et al. | 2014 | An experimental double-blind irradiation study of a novel topical product (TPF 50) compared to other topical products with DNA repair enzymes, antioxidants and growth factors with sunscreens: implications for preventing sking aging and cancer | Estudio cuasiexperimental, doble ciego | N=60 voluntarios sanosSubestudio 1: N=20, vehículo vs. FT FPS50 vs FT FPS50+AO vs. AO solo vs FT FPS40 + enzimas reparadoras de ADN vs. enzimas reparadoras de ADN solas vs FT FPS50 + AO+ enzimas reparadoras de ADNSubestudio 2: N=40 en que se compara producto TPF 50 (combinación de FT SPF 50 + 3 enzimas reparadoras de ADN + 3 AO) vs. crema con FT SP50 y enzimas reparadoras de ADN vs FT SP50 y AO vs FT SP50 y factores de crecimiento | Subestudio 1:la combinación de FT FPS50+AO+ enzimas reparadoras de ADN tuvo un efecto multiplicativo en la reducción de CPD y la carbonilación de proteínas y un efecto aditivo en la disminución de 8OHdG frente al resto de comparadoresSubestudio 2: la combinación de FT FPS50 + AO + enzimas reparadoras de ADN es más efectiva que su uso por separado | Alto1– |
| Carducci et al. | 2015 | Comparative effects of sunscreens alone vs sunscreens plus DNA repair enzymes in patients with actinic keratosis: clinical and molecular findings from a 6-month, randomized, clinical study | Ensayo clínico, aleatorizado, controlado, ciego para el evaluador | N=28 pacientes con QAComparación de FT FPS50 + enzimas reparadoras de ADN (N=14) vs. FT FPS50 solo (N=14) | El FT FPS50 con enzimas reparadoras de ADN fue igual de efectivo en la reducción de la hiperqueratosis pero más efectivo en la reducción del campo de cancerización y de los CPD | Medio1+ |
| Stoddard et al. | 2017 | Improvement of actinic keratoses using topical DNA repair enzymes: a randomized placebo-controlled trial | Ensayo clínico aleatorizado, controlado, doble ciego | N=15 pacientes con QALoción con 3 enzimas reparadoras (N=10) vs. placebo (N=5) | Hubo una mayor reducción de QA en el grupo de tratamiento frente al grupo placebo, siendo estadísticamente significativo a las 12 semanas | Alto1– |
| Pavone et al. | 2018 | Efficacy of different photoprotection strategies in preventing actnic keratosis new lesions after photodynamic therapy. The ATHENA study: a two center, randomized. Prospective, assessor-blinded pragmatic trial | Ensayo clínico, aleatorizado, controlado, ciego para el evaluador | N=68 pacientes con QAFT FPS 50+ con piroxicam 0,8% (N=34) vs. FT (FPS 50+, N 17 y FPS100 + fotoliasa, N 17) | Hubo una reducción del número de QA con ambos tratamientos, siendo mayor en el grupo de piroxicam | Medio1+ |
| Minoretti et al. | 2023 | Exploring the protective efficacy of topical products of actinic keratosis against ultraviolet-induced DNA and protein damage: an experimental, doble-blind irradiation study | Estudio cuasiexperimental, doble ciego | N=12 voluntarios sanosFT + fotoliasa 1% vs. FT FPS 100 + fotoliasa vs FT FPS 100 + fotoliasa + endonuclesa + OGG1 vs. proxicam vs. productos con urea, ácido láctido y ácido octatrieno vs. placebo | El producto con FT (no se especifica el FPS) y fotoliasa al 1% fue el más efectivo en reducir los CPD, seguido de los productos con FT FPS 100 + fotoliasa + endonucleasa + OGG1 y del FT FPS 100 + fotoliasaEn cuanto a disminución de la carbonilación de las proteínas, el más efectivo fue la crema con FT FPS 100 + fotoliasa + endonucleasa + OGG1 (que además contiene antioxidantes) | Alto1– |
Hubo 5 estudios que evaluaron las enzimas reparadoras de ADN de forma independiente, sin ningún fotoprotector tradicional añadido; mientras que el resto, 15 estudios, vieron el efecto de las enzimas reparadoras de ADN en combinación con fotoprotectores tradicionales, la mayoría con FPS 50 o 100.
Por otra parte, de todos los estudios, 9 fueron ensayos clínicos aleatorizados18-26 y 11 ensayos cuasiexperimentales27-37. Se admitieron en la revisión los estudios cuasiexperimentales dado que cumplían con nuestros criterios de inclusión y no eran estudios puramente observacionales, sino que el investigador controlaba la intervención, pese a que no son los estudios metodológicamente más deseables. No se encontró ninguna revisión sistemática centrada en el efecto que las enzimas reparadoras del ADN tienen sobre el cáncer cutáneo, aunque sí se ha tenido en cuenta una revisión sistemática sobre estas y el fotoenvejecimiento1 como apoyo informativo para este trabajo, así como varias revisiones narrativas.
Entre todos los estudios se dispuso de una muestra de 546 participantes, sin tener en cuenta las pérdidas. De estos, 181 fueron voluntarios sanos y 365 pacientes con QA, campo de cancerización, historia de cáncer queratinocítico o queilitis actínica. En cuanto a los tratamientos realizados, 192 utilizaron cremas con fotoliasa, 151 cremas con endonucleasa y 203 combinaciones de distintas enzimas reparadoras de ADN.
Respecto a los resultados, teniendo en cuenta la evaluación del número de CPD y de QA se observó que:
- –
La fotoliasa consiguió disminuir el número de CPD en los dos estudios donde esto se evaluó, entre un 40 y un 93%. Además, en 5 de los 6 estudios donde se valoraron las QA, consiguió una mejoría tanto clínica como dermatoscópica e histológica de estas, mientras que en un estudio no observaron mejoría.
- –
La endonucleasa no demostró disminuir de forma estadísticamente significativa los CPD respecto placebo en el único estudio en el que esto se midió. Respecto a las QA, en 3 de los 4 estudios donde se evaluaron, observaron una disminución de estas con el uso de endonucleasa.
- –
La combinación de varias enzimas reparadoras de ADN logró disminuir el número de CPD en los 4 estudios donde esto se valoró, siendo la reducción entre un 47 y un 67%. Por último respecto a las QA, se evaluaron en 2 estudios, observando disminución en uno de ellos mientras que en el otro, pese a que se observó mejoría, la crema con piroxicam fue superior a la combinación de enzimas reparadoras de ADN.
Metodológicamente, la mayoría de los estudios tuvieron un riesgo de sesgo alto y un nivel de evidencia 1–, debido, en la mayor parte de casos, por el diseño del estudio, al no ser ensayos clínicos, aleatorizados, doble ciego y con grupo control. Todos los estudios cuasiexperimentales se consideraron como un riesgo de sesgo alto dado que no existe aleatorización ni cegamiento y en algunos de ellos, tampoco grupo de control. Por otra parte, los estudios de Wolf et al.21, Yarrosh et al.22, Alvares et al.20, Carducci et al.24 y Pavone et al.26 obtuvieron un riesgo de sesgo medio. El primero debido a que no hace referencia explícita al cegamiento, aunque se entiende que este es doble ciego ya que los productos se codifican en A y B, y según los autores, tienen la misma composición química salvo que uno tiene la T4V5 activa y el otro inactiva. Por su parte, el estudio de Yarrosh et al., pese a que inicialmente los grupos eran similares en cuanto a características demográficas y gravedad de la enfermedad, los grupos tienen una distribución desproporcionada (20 en el grupo de tratamiento y 10 en el de placebo) que todavía se acentúa más con la pérdida de 2 pacientes del grupo placebo, siendo uno de ellos el de mayor edad del grupo y previsiblemente el que tuviera mayor daño actínico. Pese a ello, los autores salvan el sesgo de atrición realizando un análisis por intención de tratar. Esto junto con el hecho de que la pérdida del paciente más añoso del grupo placebo le confiriera ventaja a este grupo y, aun así, los resultados fueron a favor del grupo de tratamiento, han hecho que se considere un estudio con un riesgo de sesgo medio y nivel de evidencia 1+. Por otra parte, el estudio de Alvares et al., pese a ser metodológicamente correcto, tiene como limitaciones que el cegamiento solo se hace para la comparación entre placebo y crema con antioxidantes, no hay una comparación directa entre fotoprotector convencional y fotoprotector con fotoliasa y el tiempo evaluado es corto. Respecto al estudio de Carducci et al.24, se considera que tiene un riesgo de sesgo medio porque no especifica el cegamiento aunque se da a entender que fue ciego únicamente para el evaluador, al igual que ocurre en el estudio de Pavone et al.26.
DiscusiónEl continuo incremento en las cifras de cáncer cutáneo subyace a la necesidad de investigar nuevas formas no solo de fotoprotección, sino también de métodos para revertir el daño por la RUV una vez se ha producido. Estos hechos han precipitado el estudio de múltiples sustancias que, añadidas a los fotoprotectores tradicionales, pudieran otorgarles mayor capacidad de proteger y reparar la piel. Entre estas sustancias destacan las enzimas reparadoras de ADN, donde encontramos fundamentalmente 3: la fotoliasa, las endonucleasa y la OGG-1.
La fotoliasa es capaz de reparar los CPD y 6-4 PP tal y como demostraron Stege et al.27, quienes observaron una reducción en los CPD del 45% con la aplicación de una loción con fotoliasa al 1% y su posterior fotorreactivación con un dispositivo de RUVA (340-540nm) durante 30 min. También en el estudio de Berardesca et al.28 se observó, tras 4 días consecutivos de irradiación RUV utilizando un simulador solar (Oriel Solar simulator) con una dosis de 3 veces la DEM, una reducción de la formación de CPD y de la apoptosis con un fotoprotector tradicional con FPS 50 más fotoliasa de un 93 y un 82%, respectivamente, mientras que el fotoprotector tradicional con FPS 50 obtuvo un 62 y un 40%, respectivamente, y el placebo un 62 y un 40%, respectivamente. Los valores superiores de este último estudio frente a los de Stege et al. quizás se deba al hecho de que el fotoprotector tradicional tenga efectos sinérgicos con la fotoliasa, por lo que es preferible la combinación de ambos. No obstante, como comenta el grupo de Stege, una reparación parcial de los CPD formados, produce respuestas biológicas desproporcionadas, quizás porque ciertos CPD tienen más relevancia que otros y porque no todos están en regiones codificantes.
Es esperable que una disminución en la producción de CPD se traduzca, clínicamente, en una mejoría del campo de cancerización y una disminución en el número de QA, y así se demuestra en cuatro de los estudios encontrados18,19,29,30, mientras que en otro no hubo diferencias respecto al fotoprotector tradicional20. Sin embargo, la mejoría es más evidente sobre todo en el campo de cancerización y en las QA grado I, como observaron Rstom et al. y Moscarella et al. en sus respectivos estudios19,29. En esta línea se centró el estudio de Laino et al.31, quienes valoraron los efectos sobre el campo de cancerización de un fotoprotector tradicional FPS 100 con fotoliasa aplicado 2 veces al día durante 9 meses. Para valorar dicho campo utilizaron un método no invasivo como es la termografía activa o dinámica, que a diferencia de la clásica, aplica calor o frío sobre la zona a estudio y valora el tiempo de recuperación térmica de la zona. Los autores observaron que alrededor de las QA, las cuales se veían como zonas calientes en la termografía, existía un halo hipertérmico que se extendía de 2 a 4cm2 alrededor, de menor intensidad que la lesión, sugiriendo que esto fuera la traducción termográfica del concepto de campo de cancerización. Además, observaron mediante biopsia que en esta zona había más elastosis solar y mayor expresión de p53 y Ki67 que en las zonas perilesionales no hipertérmicas. Así, tras 9 meses observaron que dicho campo se redujo desde una media de 3,46cm2 hasta 0,64cm2, llegando a desaparecer completamente en 5 pacientes, demostrando que la fotoliasa es efectiva en el tratamiento del campo de cancerización.
Es por esto que los fotoprotectores con fotoliasa, posiblemente deban de utilizarse de forma coadyuvante a otros tratamientos clásicos para las QA, como la crioterapia, el diclofenaco, el imiquimod, el 5-fluorouracilo o la terapia fotodinámica (TFD), de forma que prolonguen el efecto terapéutico de estos en el tiempo. Eibenschutz et al.18 realizaron un ensayo clínico aleatorizado con 30 participantes para evaluar la eficacia de un fotoprotector tradicional con FPS 100 y fotoliasa frente a un fotoprotector tradicional con FPS 50+ en el tratamiento de las QA y el campo de cancerización de la cara y el cuero cabelludo aplicados durante 9 meses y tras una sesión de TFD. La media de QA al inicio del estudio fue de 6,6 en el grupo de la fotoliasa y de 8,4 en el del fotoprotector tradicional y tras la sesión de TFD de 2 y 0,6, respectivamente. Al final del estudio, se observó una disminución del número de QA en el grupo con fotoliasa (media de 1 QA) estadísticamente significativa, mientras que hubo un aumento en el grupo control (media de 3-4 QA), siendo la diferencia entre ambos grupos estadísticamente significativa. Además, el grupo de la fotoliasa no necesitó un nuevo tratamiento de campo en los meses de seguimiento mientras que 10 de los 15 participantes del grupo control necesitaron una nueva sesión de TFD.
Por su parte, Pavone et al.26 realizaron un ensayo clínico con 64 participantes con QA a los que, tras una sesión de TFD convencional o con luz de día, se les aplicó un fotoprotector con FPS 50 con piroxicam al 0,8% (34 participantes) y se les comparó frente al grupo control (34 participantes) a los que se les subdividió a utilizar un fotoprotector con FPS 50 (17 participantes) o un fotoprotector con FPS 100 y fotoliasa (17 participantes), aplicados 2 veces al día durante 6 meses. Tras este tiempo, se observó una reducción mayor de QA en el grupo del piroxicam (1,8 ± 1,6) frente al grupo control (3,2 ± 2,3), siendo la diferencia estadísticamente significativa, por lo que los autores sugieren que el uso de un inhibidor de COX2 asociado a un fotoprotector tradicional es más eficaz que una fotoprotector FPS 100 y fotoliasa. No obstante, cabe destacar que los autores engloban en el mismo grupo los resultados del fotoprotector tradicional con FPS 50 y el fotoprotector con FPS 100 más fotoliasa, por lo que los efectos de este último cabría pensar que pudieran ser enmascarados por el menor efecto del fotoprotector tradicional.
Por otro parte, como sugiere el grupo de Puig et al.30, no solo los pacientes con QA se podrían beneficiar de fotoprotectores con enzimas reparadoras de ADN, sino que otras poblaciones, como los pacientes con xeroderma pigmentoso, también lo harían. Esto mismo demuestra el estudio de Giustini et al.38 que, aunque no se ha incluido en la presente revisión sistemática por no cumplir con los criterios de inclusión, observa que el uso de enzimas reparadoras del ADN fue ventajoso para estos enfermos reduciendo el número de QA, CBC y CEC durante el estudio.
Finalmente, además de actuar a nivel de los fotoproductos, la fotoliasa también parece tener un papel sobre el efecto inmunosupresor de la RUV. Stege et al.27 observaron una recuperación completa de la molécula de adhesión intercelular (ICAM), que interviene en los procesos de inflamación e inmunidad, por lo que la fotoliasa podría tener un papel inhibitorio sobre el efecto inmunosupresor de la RUV.
Por otro lado, la T4 endonucleasa V (T4V5), al actuar potenciando el mecanismo NER, inicialmente, se estudió en pacientes con xeroderma pigementoso. Así, Yarosh et al.22 observaron en un grupo de 30 participantes con dicha enfermedad que aplicaron durante 1 año una loción con T4V5 (20 participantes) o una loción con placebo (10 participantes), una disminución de QA y carcinomas basocelulares (CBC) del 68 y el 30%, respectivamente, frente al grupo placebo, con una diferencia estadísticamente significativa. Además, estos resultados se mantuvieron en los 6 meses posteriores. Así, los autores demostraron que la deficiencia del sistema NER de estos pacientes se podría suplir, en parte, con la endonucleasa.
No obstante, la endonucleasa también es útil en pacientes con el sistema NER íntegro, y no solo a nivel cutáneo, sino que también podría tener un papel sobre la queilitis actínica32; de hecho, se ha observado una reducción del área afectada, así como del eritema, la descamación, la erosión, la ulceración, el sangrado y la sensibilidad típicos de la enfermedad34. Esto abre las puertas a futuras investigaciones no solo con cremas como vehículo, sino también con bálsamos o fotoprotectores labiales.
Por otra parte, la endonucleasa, al igual que la fotoliasa, parece tener un papel sobre el aumento de citoquinas inmunosupresoras que aumentan con la exposición a la RUV, ya que se ha observado una menor elevación de citoquinas como IL-10 o TNF-α21.
Además, la RUV es capaz de producir cambios genéticos ya en las 24 h postexposición, como observaron Anderson et al. en su estudio23 evidenciando cambios en 8 de los 18 genes analizados. En este caso, la aplicación de endonucleasa o fotoliasa durante 2 semanas no evitó esos cambios genéticos y los autores consideran que quizás se necesiten periodos de evaluación más largos para poder determinar la efectividad de las enzimas reparadoras de ADN en los cambios genéticos inducidos por la RUV.
Por último, en aras de aumentar la eficacia de las enzimas reparadoras del ADN, algunos estudios optan por la combinación de varias, ya sea de forma secuencial o en un mismo producto y ver si tienen un efecto sinérgico. Así lo observaron Emanuele et al.25, quienes vieron que la combinación secuencial de un fotoprotector FPS 50+ al que le añadieron una fotoliasa antes de la exposición solar y la aplicación de una loción con endonucleasa posteriormente a esta, conseguía mejores resultados que dichas sustancias de forma individual; y no solo esto, sino que conseguía que la longitud de los telómeros y los niveles de protooncogén c-FOS fueran prácticamente iguales que en las zonas no irradiadas, mientras que los resultados con las sustancias por separado eran peores. También Carducci et al.24 incluyeron a 28 pacientes con QA a los que asignaron o bien a aplicar un fotoprotector tradicional con FPS 50, endonucleasa, fotoliasa y OGG1 o un fotoprotector con FPS 50, aplicados 2 veces al día durante 6 meses. De esta forma, no observaron diferencias entre los grupos en cuanto a la hiperqueratosis clínica, pero sí una disminución mayor y estadísticamente significativa en el primer grupo de la fluorescencia emitida tras la aplicación de metilaminolevulinato y la reducción de los CPD, siendo esta de un 61 y un 35%, respectivamente. Por su parte, Spencer et al.35 también valoraron el efecto conjunto de una loción que combinaba fotoliasa, endonucleasa y OGG1 en 20 sujetos, aplicado 2 veces al día durante 8 semanas, observando una disminución estadísticamente significativa en los niveles de CPD y p53. Finalmente, Stoddard et al.25 compararon una loción con endonucleasa, fotoliasa y OGG1 frente a una loción con placebo, aplicados 2 veces al día durante 8 semanas, tiempo en el que no observaron diferencias pero, sí las evidenciaron en la semana 12, es decir, 4 semanas después de haber terminado con el tratamiento. Esto puede significar que o bien es necesario tiempos de estudio más prolongados para poder observar diferencias o bien que las enzimas reparadoras de ADN tienen un efecto duradero en el tiempo. Cabe señalar como gran limitación de los estudios de Spencer y Stoddard que pese a que ambos utilizan lociones con enzimas reparadoras de ADN, a todos los pacientes se les administra de forma adicional un fotoprotector tradicional (con FPS 29 y 100, respectivamente), que podían aplicar en la zona estudio y sin especificarse de qué forma ni cuántas veces al día, lo que puede introducir un sesgo en los resultados.
Finalmente, parece que el uso de antioxidantes junto a distintas enzimas reparadoras de ADN podría aportar un beneficio adicional. Así lo demuestran Minoretti et al.37 en su estudio, en el que a 12 voluntarios sanos se les aplicó en 7 áreas de la zona lumbar distintos productos: un fotoprotector tradicional del cual no se especifica el FPS que además contiene fotoliasa al 1%; un fotoprotector tradicional con FPS 100 + fotoliasa (sin especificarse la concentración) y un fotoprotector tradicional con FPS 100 que contine además endonucleasa, fotoliasa, OGG1 así como varias sustancias antioxidantes, entre otros. Todos ellos se aplicaron durante 8 días consecutivos y se irradiaron con un dispositivo de RUV a dosis de 6 veces la DEM, observándose una reducción mayor de CPD con aquellos productos con mayor FPS y mayor concentración de fotoliasa, mientras que la carbonilación de proteínas fue menor con aquellos que contenían sustancias antioxidantes. Así, los autores concluyen que habría que utilizar productos que incorporaran enzimas rapadores de ADN para reparar el daño directo inducido por la RUVB sobre el ADN así como abordar el daño oxidativo de las proteínas inducido indirectamente por la radiación a través de antioxidantes. A esta misma conclusión llegan Emanuele et al.36 en su estudio.
Como limitaciones de esta revisión se encuentran fundamentalmente la imposibilidad de basarse únicamente en estudios de un nivel de evidencia alto, ante la falta de estudios metodológicamente robustos y coherentes entre sí, subrayando esto la falta de ensayos clínicos existes sobre este tema con una metodología clara, fiable y reproducible. Esto hace que la revisión pierda calidad. Por otro lado, los estudios incluidos en esta revisión tienen, por lo general, un tamaño muestral pequeño, no hay aleatorización ni cegamiento en su gran mayoría, los grupos no siempre son equiparables en cuanto a número de participantes y características epidemiológicas y clínicas; y los protocolos de actuación no son claros en todos ellos, siendo frecuentemente heterogéneos en cuanto a sustancias reparadoras utilizadas, sus combinaciones o no con fotoprotectores de diferentes FPS, así como los días y forma de aplicación. Todo esto puede comprometer la validez y generalización de sus resultados, pudiendo incurrirse en un riesgo alfa y beta.
Además, en cuanto a la realización de este trabajo, es posible que haya un sesgo de selección dado que la búsqueda ha sido la anteriormente mencionada y es posible que, pese a que se ha realizado de forma minuciosa, algún estudio pueda haberse perdido y con ello información relevante. En este sentido, el haber acotado por años, idioma y número de pacientes, también puede conllevar este riesgo de sesgo. Además, puede existir un riesgo de sesgo de información a la hora de extraer la información, analizarla y elaborar conclusiones.
ConclusionesNumerosos estudios demuestran que las enzimas reparadoras de ADN pueden tener un papel en la prevención del cáncer cutáneo queratinocitario, dado que actúan, principalmente, a nivel de los fotoproductos causados por la RUV en el ADN de los queratinocitos, y con ello el cáncer cutáneo1,2,13,39-41. Su principal efecto terapéutico lo han demostrado en las QA no hiperqueratósicas y en el campo de cancerización19,29,31,40,41. Por ello, cada vez más se habla de su uso como coadyuvante a los tratamientos clásicos para mantener durante más tiempo las respuestas terapéuticas25,42. La fotoliasa parece que es más rápida y efectiva que la endonucleasa a la hora de reparar los CPD, dado que, como no está presente en los seres humanos, supone añadir un sistema de reparación extra, mientras que la endonucleasa se serviría del sistema NER ya presente43. Por otro lado, aunque cada estudio sigue su propio protocolo, lo más habitual es la pauta de 2 aplicaciones diarias. Tampoco se puede determinar el tiempo que es necesario aplicarlos para obtener resultados clínicos, aunque se han observado efectos con tan solo un mes de aplicación30. Lo que sí parece entreverse es que las enzimas reparadoras de ADN tienen mayor utilidad cuando se combinan con el fotoprotector tradicional y, aún más, si se combinan distintas enzimas reparadoras de ADN y sustancias que actúan a otros niveles como son los antioxidantes24,33,35-37. No obstante, tampoco se pueden extraer conclusiones claras sobre si añadir enzimas rapadores de ADN permitiría reducir el FPS de los productos o si existe diferencias significativas entre los productos que contienen enzimas reparadoras de ADN con FPS 50+ o 100. Se necesitan más ensayos clínicos, aleatorizados y cegados que aporten mayor validez a estos resultados, así como tiempos de seguimiento mayores.
Finalmente, existe todavía una gran línea de investigación y desarrollo en el campo de los enzimas rapadores de ADN. Por un lado, el uso de moléculas todavía no muy estudiadas como la OGG1 que parece tener un papel tanto en cáncer queratinocitario44 como en melanoma45, al contrarrestar a los ROS y tener mayor selectividad por reparar el ADN mitocondrial46. Y, por otro lado, existe un interés creciente sobre el papel que pudieran tener los enzimas rapadores de ADN en productos como el aftersun dado el reciente descubrimiento de los dímeros de ciclobutano pirimidina oscuros que se producen horas después de haber finalizado la exposición a la RUV47,48. Por todo ello, cabe esperar nuevas publicaciones y aplicaciones de los enzimas rapadores de ADN.
Conflictos de interéslos autores declaran no tener ningún conflicto de interés.