Un varón de 49 años, con pólipos nasales desde la juventud, presentó a los 40 años un brote de urticaria de 15 meses de duración, constituido por múltiples habones pruriginosos, diseminados por el tronco, que duraban menos de 24 h, acompañándose de edema labial, palpebral y disfonía. No manifestó fiebre ni artralgias. Siguió el tratamiento con rupatadina 10mg/8 h, sustituida por ebastina 20mg/8 h, y posteriormente por bilastina 20mg/6 h, hasta que desaparecieron los habones.
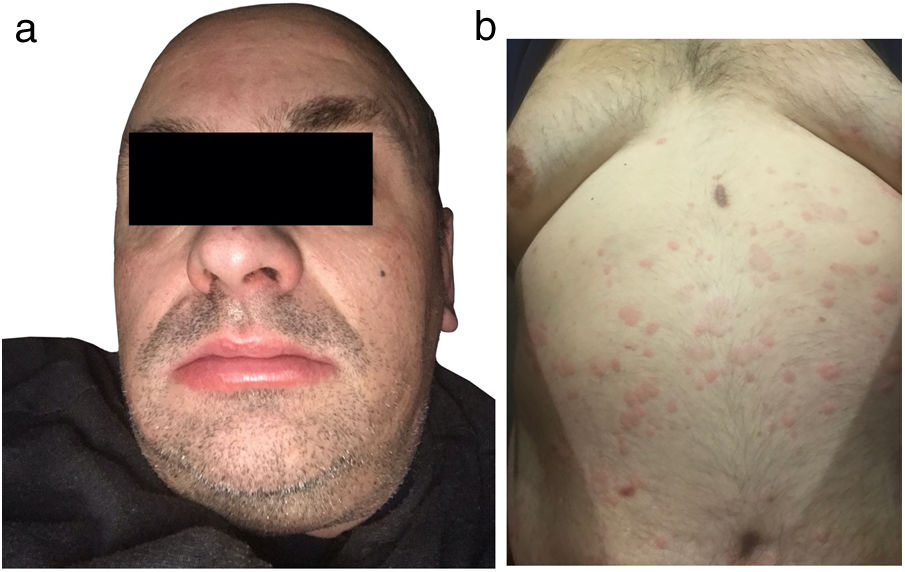
Actualmente el paciente acude a consulta por habones pruriginosos generalizados (fig. 1) de similares características, de cinco meses de evolución, tratado con cetirizina 10mg/6 h. Sin embargo, se ha observado un control insatisfactorio de la afección, que ha perdurado durante seis meses. Refería episodios de dolor en el tercio superior del brazo derecho. La biopsia de un habón (fig. 2A) mostró un discreto edema con dilatación de pequeños vasos en la dermis superior, un infiltrado inflamatorio perivascular compuesto por neutrófilos y ocasionales eosinófilos, sin necrosis fibrinoide en los vasos, ni hemorragia, ni leucocitoclastia, compatible con urticaria.
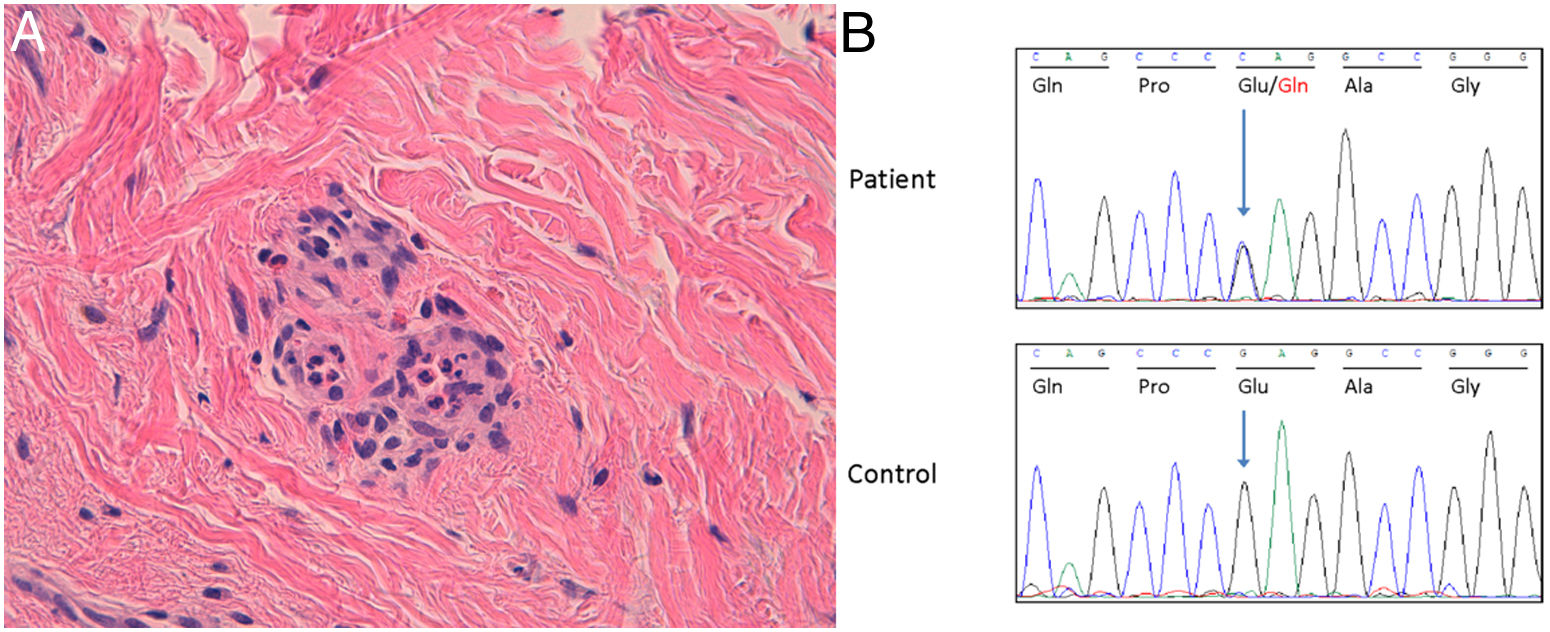
A: hematoxilina eosina x200. Se comprueba que el infiltrado está compuesto por neutrófilos y ocasionales eosinófilos. No se observan necrosis ni hemorragia o leucocitoclastia. El patrón morfológico es compatible con urticaria.
B: el cromatograma Sanger del paciente índice (cuadro superior) y de un sujeto sano (cuadro inferior). Las flechas indican la posición del nucleótido donde se encuentra la variante de MEFV. La Reference Sequence (RefSeq, https://www.ensembl.org/index.html) para el gen MEFV es NM_000243.2.
Ala: alanina; Gln: glutamina; Glu: ácido glutámico; Gly: glicina; Pro: prolina.
El análisis reveló una leucocitosis de 17.12 x10x9/L (normal: 4.800 -10.800), neutrofilia de 10.750 (normal: 1.400 - 6.500), la proteína C reactiva de 11,9mg/L (normal: 0,2–5,0), y la interleucina 6 (IL-6) de 16,9 pg/mL (normal: 5,3–7,5). La inmunoglobulina E (IgE) fue de 106 UI/mL (normal: 0–150). La inmunofijación sérica mostró un componente monoclonal de isotipo inmunoglobulina G (IgG)-kappa, sin componente monoclonal en la orina. La α-1-antitripsina, ceruloplasmina, anticuerpos antinucleares, factor reumatoideo, anticuerpos antimicrosomales de hígado y riñón (LKM), anticuerpos antimitocondriales, anticuerpos antimúsculo liso, anticuerpos anticardiolipina y anticuerpos anticitoplasma de neutrófilo, estaban dentro de los parámetros normales. Una tomografía computarizada (TC) torácica-abdominal evidenció una lesión osteolítica en la diáfisis del húmero derecho, sugestiva de encondroma. Además, no se mostraron adenopatías.
Se realizó un screening genético de enfermedades autoinflamatorias mediante un panel Next-Generation Sequencing con coberturas>10x. No se detectaron variantes germinales o somáticas en los genes estudiados que fueran clasificables como patogénicas o probablemente patogénicas de acuerdo con los criterios del American College of Clinical Genetics and Genomics. Se identificó la variante heterocigota p.(Glu148Gln) en el exón 2 del gen MEFV, clasificada como variante de significado incierto (fig. 2B). No se administró anakinra debido a la resolución de los habones.
Se diagnosticó el síndrome de Schnitzler (SS) de acuerdo con los criterios de Estrasburgo1, presentando como criterios mayores la urticaria crónica y la gammapatía monoclonal de tipo IgG-kappa, y como menores la lesión osteolítica en el húmero derecho, el infiltrado neutrofílico en la biopsia de piel y la neutrofilia. El SS2,3 cursa con brotes de urticaria autolimitados, de larga duración, y mal controlados con antihistamínicos. Entre los brotes pueden transcurrir años. La biopsia de piel en el SS manifiesta vasculitis, infiltración por neutrófilos, edema y leucocitoclastia. En este caso la biopsia mostró un infiltrado inflamatorio perivascular compuesto por neutrófilos, sin vasculitis. En la revisión de Koning et al.4, solo 20% de pacientes presentaban vasculitis en la biopsia.
La urticaria puede estar relacionada con la IL-6, ya que puede producir la activación y degranulación de los mastocitos, que a su vez liberan IL-6 y otros mediadores inflamatorios, entre ellos la histamina, leucotrienos, y prostaglandinas, produciendo vasodilatación y extravasación del plasma cutáneo y subcutáneo. Este paciente presentaba IL-6 elevada. El dolor osteomuscular es frecuente en aquellos con SS. Radiológicamente puede aparecer un aumento de la densidad ósea, lesiones óseas líticas5 y engrosamiento perióstico. Los dolores en el tercio superior del brazo derecho se atribuyeron a la lesión osteolítica de la diáfisis humeral.
El análisis mostró el componente monoclonal de tipo IgG-kappa. Aunque la forma clásica del isotipo del componente monoclonal es la inmunoglobulina M (IgM), hay otra menos frecuente denominada forma variante de SS, en la cual el componente monoclonal es de isotipo IgG, como en este caso. La vida del individuo no está acortada en el SS, pero 12% de los pacientes pueden evolucionar hacia procesos linfoproliferativos, siendo el más frecuente la macroglobulinemia de Waldenström3.
Se ha demostrado la existencia de mutaciones poscigóticas del gen NLRP3 en aquellos con diagnóstico de SS-variante4. El estudio genético realizado no demostró ni mutaciones germinales ni poscigóticas en este gen, ni en ninguno de los demás, salvo en MEFV. En este, se identificó la variante heterocigota p.(Glu148Gln), que se asoció a la fiebre mediterránea familiar6,7 (FMF), en pacientes con fiebre, artritis, dolor abdominal y urticaria. El gen MEFV codifica a la pirina, una proteína que inhibe el inflamasoma. Hay casos publicados de urticaria crónica asociados a mutaciones en MEFV8-10. En la FMF se observa una elevación de la IL-6 atribuida a la hiperactividad del inflamasoma, por la alteración de la función de la pirina, normalizándose en los periodos intercrisis, que posiblemente se relacione con la urticaria.
La poliposis nasal se ha asociado a la enfermedad autoinflamatoria. En este caso es difícil atribuir una relación causal entre la variante heterocigota p.(Glu148Gln) en el gen MEFV y el SS.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.