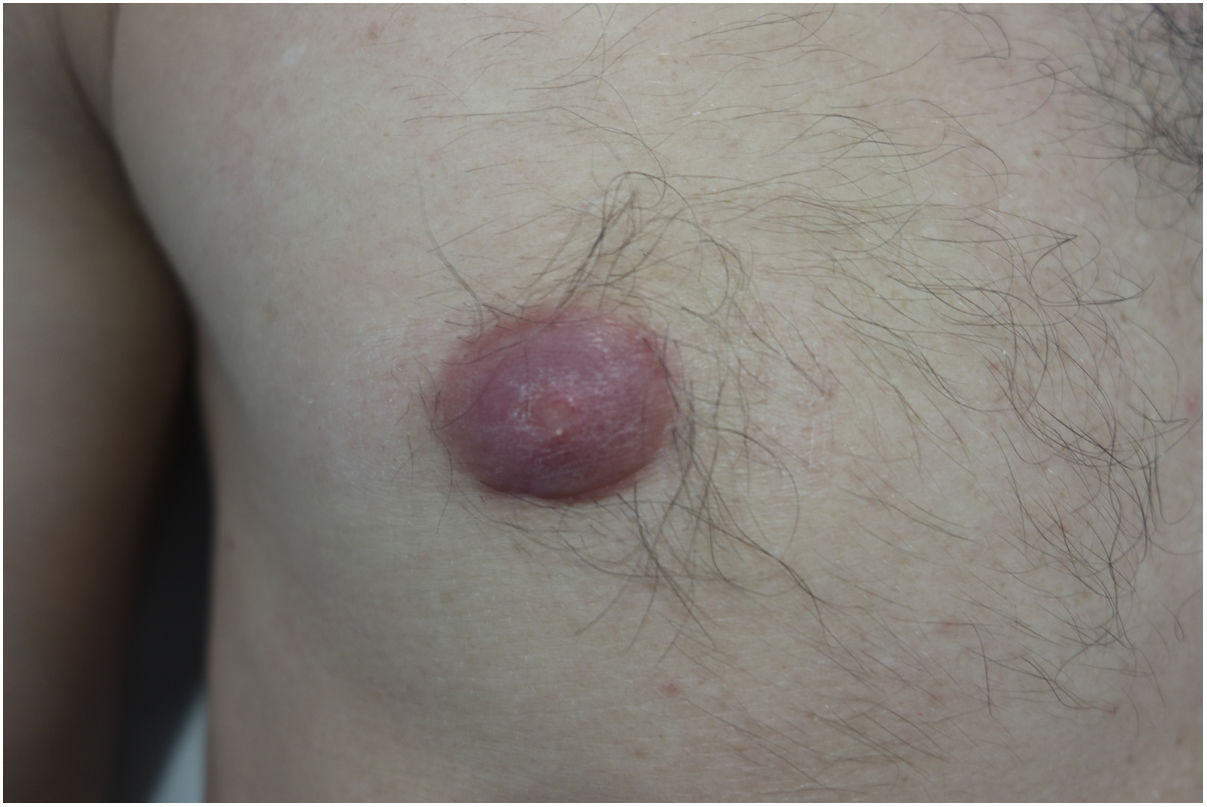
Varón de 40 años, sin antecedentes personales de interés, que consultó por presentar desde hacía unos 5 meses eritema, prurito y una infiltración difusa de la aréola mamaria derecha, sin ningún factor desencadenante ni sintomatología sistémica asociada.
Exploración físicaA la exploración se objetivó una aréola mamaria derecha eritemato-violácea, engrosada, infiltrada al tacto (fig. 1), sin objetivarse adenopatías locorregionales ni otras lesiones en el resto del tegumento.
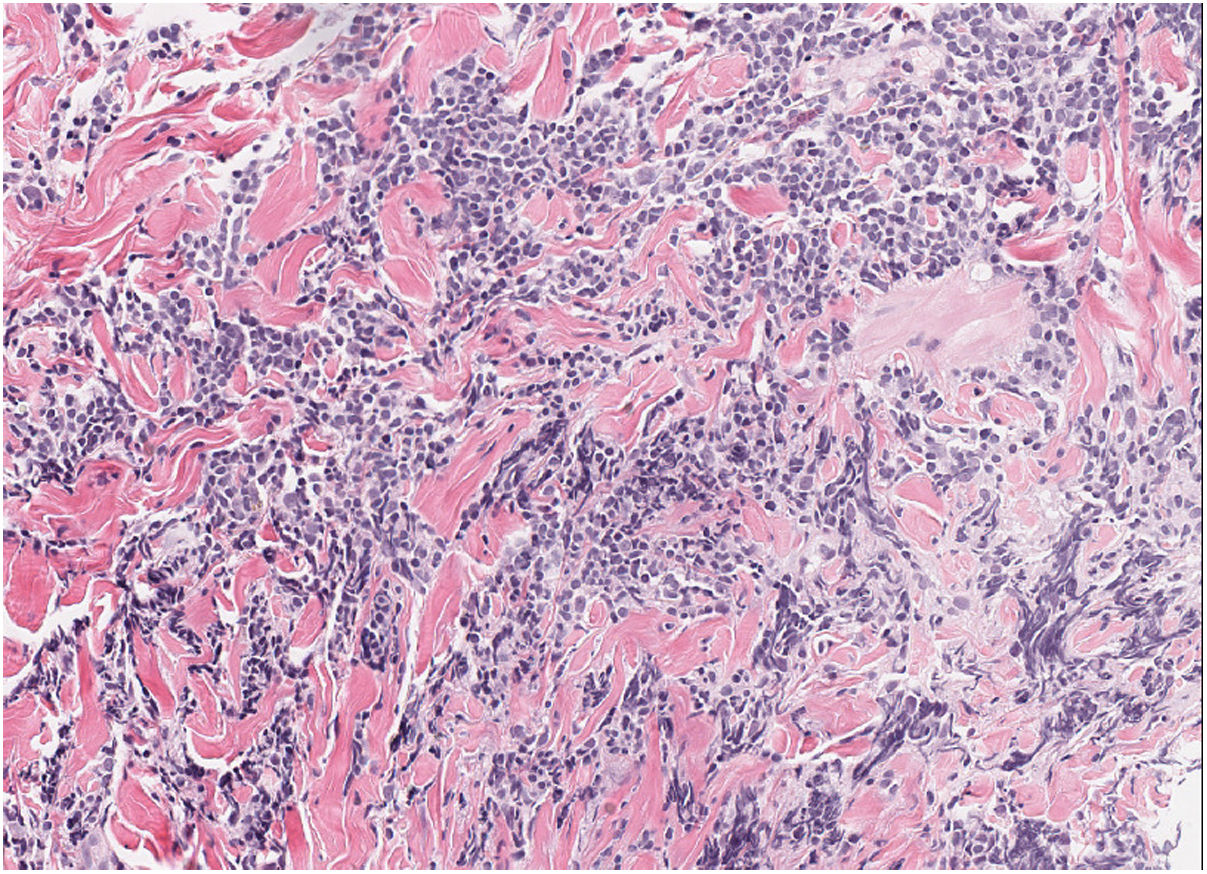
HistopatologíaLa biopsia cutánea reveló un denso infiltrado linfoide dérmico formado por células de tamaño intermedio con ocasionales células grandes, así como algún eosinófilo acompañante (fig. 2). Presencia de centros germinales y no confluentes en dermis profunda. Estudio inmunofenotípico: infiltrado mixto de células T (CD3+, CD4+, CD7+) CD30− con ocasionales células PD1+, y células B (CD20+, CD79a+) bcl2− con positividad focal para CD10 y CD21. No se observó restricción de cadenas ligeras de las inmunoglobulinas por hibridación in situ. Reordenamiento de los genes del receptor de células T y de las cadenas pesadas de las inmunoglobulinas: patrón policlonal.
Otras pruebas complementariasEl hemograma, el recuento, la fórmula y la bioquímica estándar no mostraron alteraciones. Se realizó una ecografía mamaria que mostró un engrosamiento cutáneo del complejo aréola-pezón, sin identificar tejido fibroglandular ni lesiones focales subyacentes.
¿Cuál es el diagnóstico?.
DiagnósticoHiperplasia linfoide reactiva cutánea.
Evolución y tratamientoReinterrogando al paciente, refirió haber viajado a Suecia 6 meses previos a la consulta, reconociendo haber sufrido diversas picaduras de garrapatas. Se solicitaron serologías para Borrelia burgdorferi, observando anticuerpos de tipo IgM negativos e IgG positivos débiles, así como PCR positiva para B. burgdorferi (Gen ospA) en la biopsia cutánea, llegándose así al diagnóstico de limfocitoma cutis por Borrelia. Se inició tratamiento con doxiciclina 100 mg cada 12 horas durante dos semanas con resolución completa del cuadro clínico.
ComentarioLas hiperplasias linfoides cutáneas reactivas (HLCR) o pseudolinfomas cutáneos constituyen un grupo heterogéneo de reacciones linfoproliferativas hiperplásicas benignas que simulan clínica y/o histológicamente un proceso linfoproliferativo maligno1.
El linfocitoma cutis (LC) es considerado el prototipo de pseudolinfoma cutáneo de células B nodular con patrón folicular. Puede ser inducido por distintos estímulos antigénicos, incluyendo mordeduras de artrópodos, fármacos y vacunas. En regiones endémicas, B. burgdorferi es el principal agente causal, siendo poco frecuente en nuestro medio. El LC por Borrelia es una manifestación cutánea rara de la enfermedad de Lyme que acontece semanas o meses después de la picadura de la garrapata de genero Ixodes. Suele observarse en niños y adultos jóvenes con discreto predominio en mujeres. Existen varias descripciones en la literatura de casos parecidos al expuesto2-4.
Clínicamente se manifiesta como un nódulo o placa eritemato-violáceo indoloro que afecta principalmente al lóbulo de la oreja, al complejo aréola-pezón o al escroto5. Se acompaña habitualmente de adenopatías regionales.
El estudio histopatológico evidencia un infiltrado linfoide nodular, sin atipia celular, que afecta a toda la dermis, con formación de centros germinales grandes y confluentes con una zona del manto reducida o ausente. El infiltrado se compone por células plasmáticas, eosinófilos, linfocitos T reactivos y macrófagos con células apoptóticas fagocitadas en su interior (tingible bodies). El inmunofenotipo demuestra una proliferación linfoide con predominio de célula B del centro germinal, con positividad para CD20, CD10 y bcl-6 y negatividad para bcl-2, con expresión politípica de las cadenas ligeras de las inmunoglobulinas6.
Su diagnóstico es clínico y requiere un alto nivel de sospecha7. La presencia de una infiltración difusa de la aréola mamaria, con hallazgos histopatológicos de una infiltración linfoide dérmica nodular con formación de centros germinales, debe plantear el diagnostico de una HLCR de células B con patrón nodular y, dentro del contexto epidemiológico adecuado, secundaria a B. burgdorferi. El diagnóstico se confirma mediante el examen histopatológico, serologías y/o la detección del ADN de B. burgdorferi en tejido mediante PCR.
El diagnóstico diferencial clínico se establece con linfomas cutáneos primarios o secundarios, la sarcoidosis, la ginecomastia nodular, la mucinosis folicular urticariforme, la mastitis lúpica y otras etiologías de HLCR.
El tratamiento consiste en la administración de doxiciclina 100 mg dos veces al día, o amoxicilina 500 mg cada 8 horas durante 2-3 semanas8.
FinanciaciónNo existe entidad financiadora de la investigación ni se ha recibido ninguna beca al tratarse de un caso para diagnóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.