INTRODUCCION
La necrolisis epidérmica tóxica (NET), o síndrome de Lyell, y el síndrome de Stevens-Johnson (SSJ) son reacciones de hipersensibilidad que se consideran formas polares clínico-patológicas de una misma entidad, por lo que puede hablarse del complejo SSJ/NET 1-3.
Por tanto, se sigue aceptando que los pacientes con SSJ/NET constituyen un espectro de enfermedad con lesiones similares y distinguibles del eritema multiforme (EM) por su etiología, histología, pronóstico y tratamiento 4.
El porcentaje de superficie cutánea afectada es de gran importancia pronóstica y permite subdividir el SSJ/NET en tres grupos: a) SSJ, cuando afecta a menos del 10 % de la superficie corporal; b) superposición SSJ/NET, afecta el 10-30 % de superficie cutánea; c) NET, despegamiento cutáneo superior al 30 % 1,2. La frecuencia de la NET oscila en 1,2-6 casos por millón de habitantes y año, y la mortalidad es del 20-40 %, mayor que en quemaduras de 2.º grado con extensión similar 1-3. Cualquier fármaco puede provocar una NET, pero los más frecuentes son sulfamidas, antiepilépticos, antiinflamatorios no esteroideos, y alopurinol. Con frecuencia, se trata de pacientes polimedicados 1,3,5. También hay que tener en cuenta vacunas, aditivos alimentarios, hierbas medicinales 6, infecciones víricas, bacterianas y por micoplasma pneumoniae 1,2.
La NET es más frecuente en pacientes con alotrasplante medular y en aquéllos con alteraciones inmunológicas 7. El primer episodio surge 1-3 semanas después de la actuación del agente responsable y 48 h después en las recidivas.
Para comprender la patogenia de la NET, hay que tener en cuenta que, en condiciones normales, los queratinocitos expresan receptores de muerte celular denominados Fas y Fas ligando (Fas L) en escasa cantidad. En la NET, aumenta Fas L, que se une a Fas y provoca una apoptosis masiva de queratinocitos o muerte celular 1,2,8,9. Algunos autores consideran la sobreproducción de Fas L un mecanismo de defensa de los queratinocitos 10,11.
A continuación describimos un paciente que comenzó con un SSJ y que evolucionó posteriormente a NET.
DESCRIPCION DEL CASO
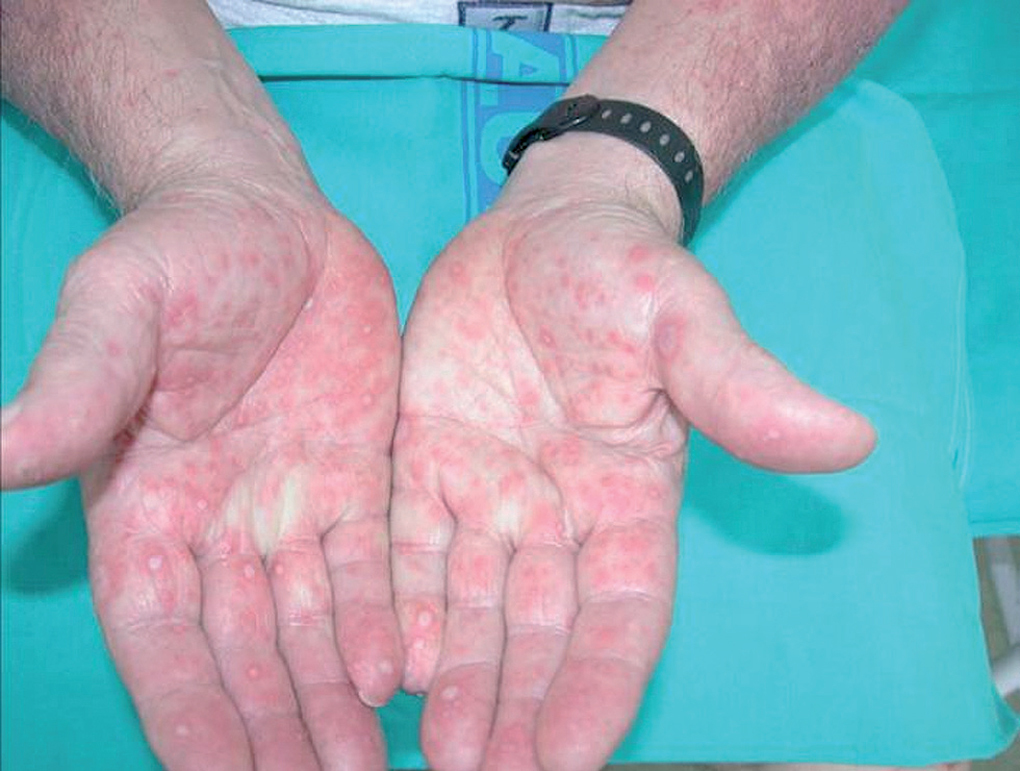
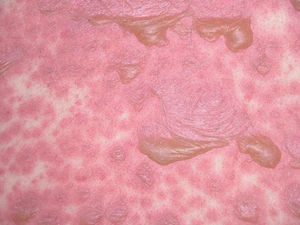
Un varón de 75 años, con antecedentes personales de hipertensión arterial en tratamiento con doxazosina desde hace años, hipercolesterolemia y glaucoma tomaba extracto de ginkgo biloba para mejorar el riego sanguíneo, aunque no supo especificar el tiempo exacto que llevaba ingiriéndolo. Acudió a nuestra consulta por un cuadro de 5 días de evolución que comenzó con molestias oculares y en mucosa oral. Se apreciaba hiperemia conjuntival, costras melicéricas y lesiones erosivo-costrosas en labios y endomucosa de boca. Posteriormente, surgieron lesiones en escarapela en tronco, antebrazos y manos, algunas con centro ampolloso (fig. 1). Se objetivó fiebre alta y el paciente se hallaba postrado, impresionando de gravedad.
Fig. 1.--Lesiones en escarapela en las palmas de las manos.
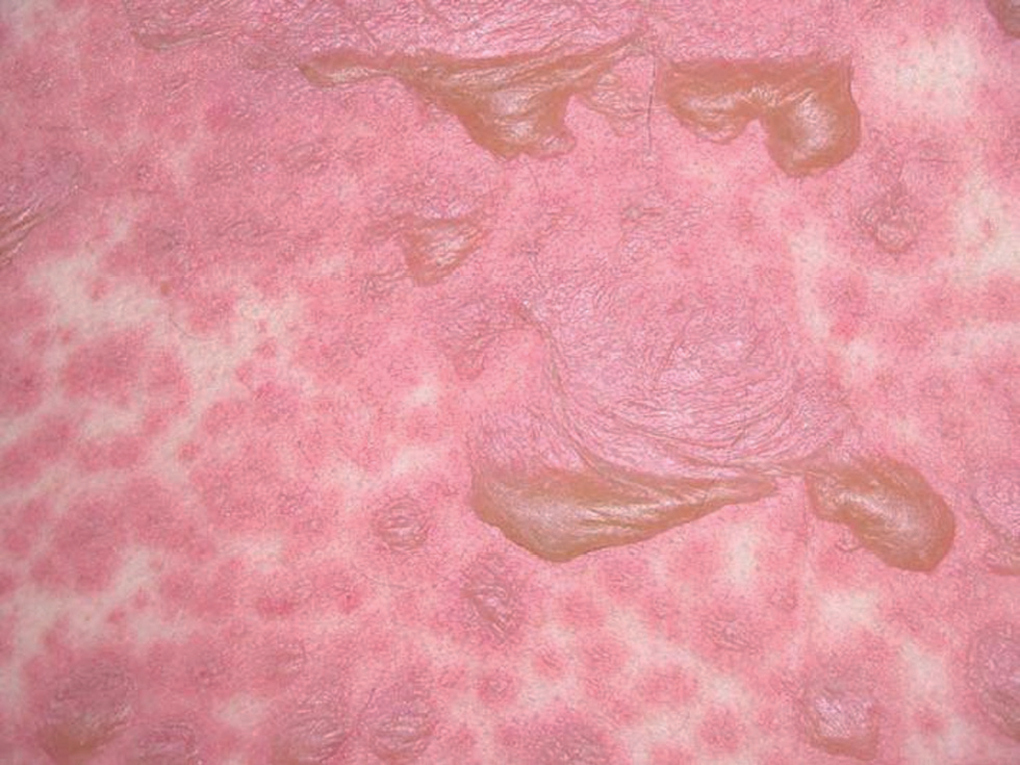
En la analítica y la placa de tórax no se apreciaron alteraciones destacables y los hemocultivos fueron negativos. Se inició un tratamiento con dosis elevadas de corticoides intravenosos, que se mantuvieron 48 h, a pesar de lo cual se produjo una importante extensión del proceso. Las lesiones se hicieron confluyentes en la cara, tronco y extremidades superiores y provocaron amplios despegamientos con signo de Nikolsky positivo (fig. 2). Aparecieron lesiones erosivas en los genitales, aisladas en las extremidades inferiores y grandes ampollas en las plantas de los pies, que se denudaron por completo.
Fig. 2.--Despegamiento cutáneo en la espalda.
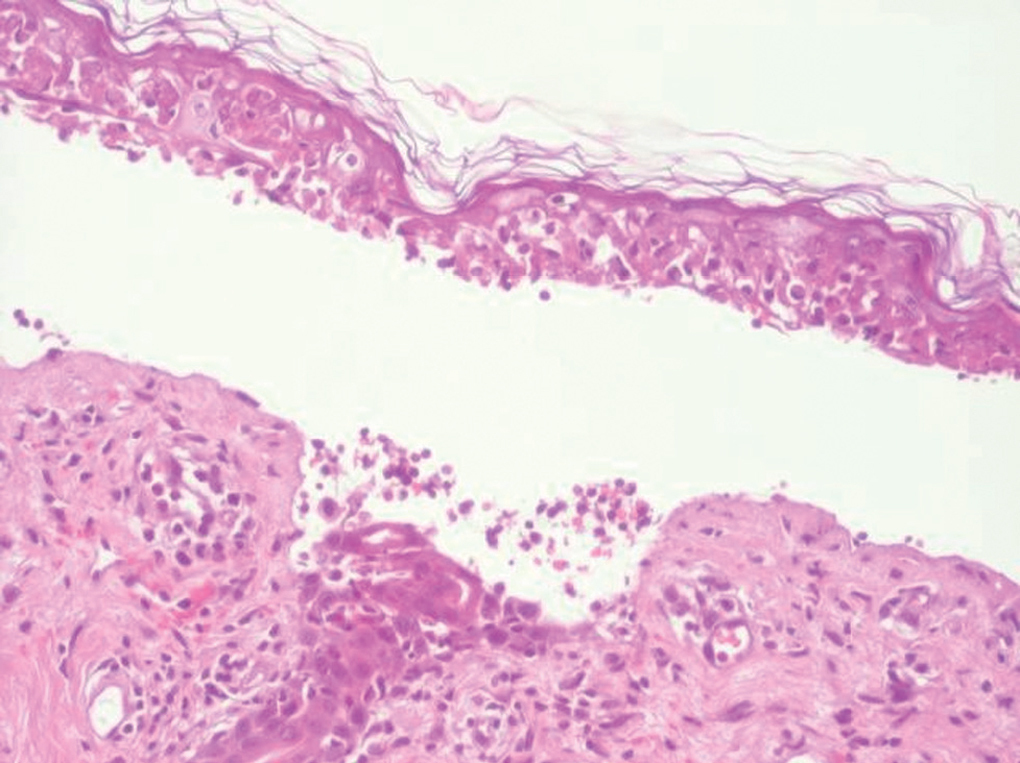
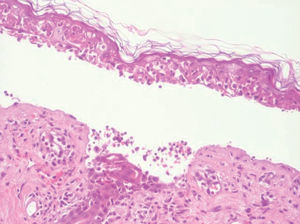
Se realizó biopsia cutánea, que mostró necrosis de queratinocitos, individuales y en grandes áreas, ampolla subepidérmica y discreto infiltrado linfohistiocitario perivascular superficial (fig. 3).
Fig. 3.--Queratinocitos necróticos y ampolla subepidérmica. (Hematoxilina-eosina, x400.)
Dado que el despegamiento cutáneo fue superior al 30 %, se le diagnosticó de SSJ con evolución a NET en probable relación con la ingesta de extracto de ginkgo biloba.
Ante la escasa respuesta a corticoides sistémicos y el mal estado general, fue trasladado a la unidad de cuidados intensivos y se inició tratamiento con inmunoglobulinas (Ig) intravenosas, en dosis de 0,5 g/kg/día durante 5 días. Además, recibió antibióticos tópicos y sistémicos, heparina subcutánea, omeprazol y cuidados oftalmológicos.
A las 48 h se frenó el proceso, ya que remitió la fiebre, no aparecieron lesiones nuevas y se inició la epitelización, que se completó en 15 días. La analítica de control fue normal y el paciente sólo refería cefalea nocturna los días que se perfundieron las Ig i.v.
Como secuelas, desarrolló entropión bilateral que requirió intervención quirúrgica; tuvo eritema facial y quistes de milium, parches hipopigmentados e hiperpigmentados en el tronco, pérdida de uñas de manos y pies y por último, desarrolló una depresión que respondió al tratamiento.
DISCUSION
El tratamiento específico de la NET continúa siendo discutido y aún no está estandarizado. En general, se puede admitir el uso de corticoides sistémicos si es breve y precoz. Con resultados irregulares se ha utilizado ciclosporina, ciclofosfamida, plasmaféresis, pentoxifilina, talidomida, n-acetilcisteína 1,2,3,12 y, por último, inmunoglobulinas intravenosas 9,13,14.
Las Ig i.v. se desarrollaron a partir de 1980. Son un hemoderivado obtenido de la recolección del plasma de 10.000-20.000 donantes. En su composición, el 90 % es IgG y en menor proporción poseen IgA, IgM y otros anticuerpos. Se someten a procesos de inactivación y detección de virus (hepatitis B, C, virus de inmunodeficiencia humana [VIH]) y lúes. Su semivida es de 3 semanas 8,9,14,15. En 1998, Viard et al 16 trataron 10 pacientes con NET con mejoría. Posteriormente, son varias las publicaciones que aportan este tratamiento, aunque teniendo en cuenta lo infrecuente del proceso, no existen grandes series 13,17-22.
La dosis utilizada oscila de 0,2 a 5,8 g/kg/día durante 3-5 días. Su mecanismo de acción estriba en que poseen anticuerpos anti-Fas que inhiben la interacción Fas-Fas L, responsable, para algunos autores, de la apoptosis de queratinocitos 1,2,8,9. Además, tienen un efecto antiinfeccioso porque se unen a antígenos microbianos. También suponen una reposición de proteínas y fluidos 8,9,13.
A los pacientes que reciben este tratamiento conviene realizarles previamente hemograma, función hepática y renal, IgA y serologías de hepatitis, lúes y prueba del VIH 14,17,18.
Sus efectos secundarios son poco frecuentes. Habitualmente son bien toleradas, aunque pueden surgir fenómenos de flushing, mialgias, cefaleas, reacciones de hipersensibilidad o anafilácticas en pacientes deficitarios de IgA, anemia hemolítica, meningitis aséptica, alteraciones renales (conviene disminuir la dosis en pacientes con insuficiencia renal) y episodios trombóticos por aumento de viscosidad sanguínea 8,9.
El uso de las Ig i.v. en NET, se justifica argumentando que, utilizadas de forma precoz, disminuyen la mortalidad, acortan la duración del proceso, son bien toleradas y no interaccionan con otros medicamentos. Aunque su precio es elevado, el periodo de ingreso del paciente puede ser menor 9,13,17. Sin embargo, aportaciones más recientes 18-20, realizando estudios comparativos entre pacientes con NET tratados con Ig i.v. y un grupo control con NET no tratados con Ig i.v., llegan a la conclusión de que no hay diferencias estadísticamente significativas en la evolución e incidencia de mortalidad en NET entre ambos grupos. Apuntan, además, que las Ig i.v. pueden contribuir a detener la progresión del proceso de forma más rápida, pero no influyen en la epitelización total. Por tanto, no apoyan el uso rutinario de Ig i.v. en NET, si no se realizan estudios más amplios.
En la etiología de la NET de este paciente, se implica el extracto de ginkgo biloba, ya que fue el último elemento introducido y su potencial alergénico está demostrado 6. La buena evolución que tuvo se consideró ligada en el tiempo a la instauración del tratamiento con Ig i.v. Como efecto secundario, sólo se detectó cefalea tolerable por la noche los días de la infusión de Ig i.v.