La sífilis congénita, aunque poco frecuente en la mayoría de los países desarrollados, ha experimentado un ligero resurgimiento en varios países de Europa, entre los que cabe incluir a España. Necesitamos, por lo tanto, familiarizarnos más con sus síntomas y signos, y reconsiderar el diagnóstico de sífilis congénita en pacientes con síntomas poco manifiestos. Además, en aquellos pacientes que presentan en los test diagnósticos títulos bajos o inconsistentes, el diagnóstico de sífilis congénita puede ser difícil o incluso imposible. La piedra angular del control de la sífilis congénita es la detección prenatal en madres y el tratamiento con penicilina, intervención eficaz y rentable. En este artículo se describen con detalle, a partir de los datos aportados por la literatura, las manifestaciones clínicas de la sífilis congénita, así como las distintas formas de su diagnóstico y terapéutica. Asimismo, el presente trabajo se enriquece con datos procedentes de nuestra propia experiencia clínica.
While the prevalence of congenital syphilis continues to be low throughout most of the developed world, there has been a slight resurgence of the disease in several European countries, including Spain. In this context, we need to become more familiar with the signs and symptoms of this disease and consider its diagnosis in patients with only mild clinical manifestations. A definitive diagnosis may be difficult or even impossible in patients whose diagnostic tests reveal low positive titers or inconsistent results. The cornerstone of congenital syphilis control is prenatal screening and the treatment of infected mothers with penicillin, an effective and economical intervention. Based on a review of the literature supplemented by data from our own clinical experience, this article provides a detailed description of the clinical manifestations of congenital syphilis as well as the various diagnostic methods and treatments available.
La sífilis congénita (SC) es el resultado de la infección transplacentaria producida por la espiroqueta Treponema pallidum subespecie pallidum, que más raramente puede suceder por contagio del niño en el momento del parto. La enfermedad es conocida desde hace más de 500 años.
Las descripciones de las devastadoras manifestaciones clínicas y patológicas, tempranas y tardías, de la enfermedad han sido recopiladas en excelentes tratados en la literatura antigua. La presentación clínica menos agresiva de la enfermedad observada en la era posterior al descubrimiento de la penicilina es también objeto de varios informes en la literatura moderna.
Según la teoría precolombina, el hallazgo de esqueletos encontrados en asentamientos neolíticos con lesiones óseas aparentemente de origen sifilítico habla en favor de la SC. Sin embargo, en la ciudad romana de Pompeya se han hallado esqueletos con lesiones características de sífilis congénita.
Era tan usual presentar sífilis en el siglo xvi que el humanista Erasmo de Rotterdam (1469-1536) decía cínicamente: «Un hombre noble sin sífilis o no era demasiado noble o no era demasiado hombre». Los Habsburgo, tanto en su rama española como en su rama austríaca, fueron una familia real aquejada de sífilis. Fueron sifilíticos Felipe II y su tercera esposa, Isabel de Valois, así como su hijo Carlos, que tenía síntomas de sífilis hereditaria. El rey Felipe IV de España contrajo sífilis e infectó a Mariana de Austria, que a su vez la transmitió al hijo de ambos, Carlos II. Los Habsburgo de Austria, como Francisco José I, esposo de Sissy (Emperatriz de Austria), el hijo de ambos, Rodolfo de Habsburgo, su esposa Estefanía y su amante María Vetsera padecieron sífilis1.
La SC fue motivo de un buen número de trabajos científicos. El interés por este tema provenía, independientemente de su vergonzosa forma de transmisión, de la constante disminución de la población, que se observaba desde el último tercio del siglo xvii a causa del gran número de abortos sifilítico. Entre los autores que se ocuparon de ella citaremos a Colles (1773-1843), Diday (1812-1894) y sobre todo a Jonathan Hutchinson, médico inglés del London Hospital que, en 1861, describió la denominada Tríada de Hutchinson, consistente en sordera, afección de la visión y dientes en forma de muesca2. Fue Fournier (1832-1914)–a quien le preocupaba especialmente la SC–el que afirmó que «la herencia sifilítica constituye el mayor problema de toda la sífilis». Cabe recordar que la hipótesis de que es la madre quien transmite la infección al feto durante el embarazo fue de implantación tardía, y no consiguió su plena aceptación hasta los últimos años del siglo xix. Kassowitz, en 1876, afirmó que la mortalidad en niños de madre sifilítica disminuye en partos sucesivos, realidad que fue, posteriormente, contrastada y aceptada3,4.
Fue en el año 1906, con la aparición de las técnicas de diagnóstico serológico, cuando se demostró que para la transmisión de la sífilis al feto se requiere la infección previa de la madre. Son hechos incontestables actualmente tanto su verdadadera etiología (desde que se descubrió el agente etiológico de la enfermedad y su demostración en tejidos fetales por Levaditti), como la evidencia de que el tratamiento previo de la madre evita la infección fetal4.
Partiendo de la consideración de que la metodología elegida depende de los postulados que el investigador crea que son validos, y de que la acción metodológica es la herramienta del investigador para analizar la realidad estudiada, nosotros en este trabajo tratamos de ofrecer una visión actual y completa de la SC. Para ello recurrimos a la bibliografía específica aportada por la comunidad científica a este respecto, la analizamos y la procesamos con el objetivo de buscar estrategias válidas para aumentar el conocimiento científico del lector. Además, aportamos nuestra experiencia, fruto de una dilatada vida laboral con pacientes de muy diferentes lugares, de los que obtuvimos abundante y valiosa información. Estructuramos este apartado en las siguientes subdivisiones: epidemiología, agente y transmisión, clínica, prevención, tratamiento y seguimiento.
EpidemiologíaA pesar de existir medidas profilácticas, como el uso del preservativo, y opciones terapéuticas eficaces y relativamente baratas, la sífilis sigue constituyendo un problema a escala mundial, con 12 millones de personas infectadas cada año. A pesar de todo, por lo general sigue infravalorándose la carga que representa la SC5.
En América Latina y El Caribe, la sífilis afecta a personas sexualmente activas y presenta prevalencias elevadas en grupos vulnerables. Así, en Centroamérica, el estudio Proyecto Acción SIDA de Centroamérica, realizado en 2003, determinó que la prevalencia de sífilis en hombres que tienen sexo con hombres oscilaba entre un 5% en Honduras y un 13,3% en Guatemala, mientras que en trabajadoras comerciales del sexo osciló entre el 6,8% en Honduras y el 15,3%, en El Salvador. La incidencia de sífilis en embarazadas varió entre el 0,4% en Panamá y el 6,2% en El Salvador6. La incidencia de SC es<0,1/1.000 nacidos vivos en Cuba y 4/1.000 nacidos vivos en Brasil6,7. Con respecto a Europa, la incidencia en Reino Unido es 1,9/100.000 nacidos vivos, en Polonia 3,7/100.000 nacidos vivos, en la República Checa alcanza 12,1/100.000 nacidos vivos8–10 y en Italia la cifra es de 20/100.000 nacidos vivos; esta cifra es debida a las madres infectadas procedentes de otros países (76%), de las cuales un 44% procede de la Europa del este, el 20% de África y el 12% de América del Sur11.
En mayo de 2004 tuvo lugar una consulta de expertos en República Dominicana, con el propósito de elaborar el marco de referencia para la «eliminación de la sífilis congénita en América Latina y el Caribe». Las conclusiones de esta reunión fueron la base para la elaboración del documento «Eliminación de la sífilis congénita en América Latina y El Caribe. Marco de referencia para su implementación», el cual presenta, entre otras aportaciones, recomendaciones para la vigilancia12,13.
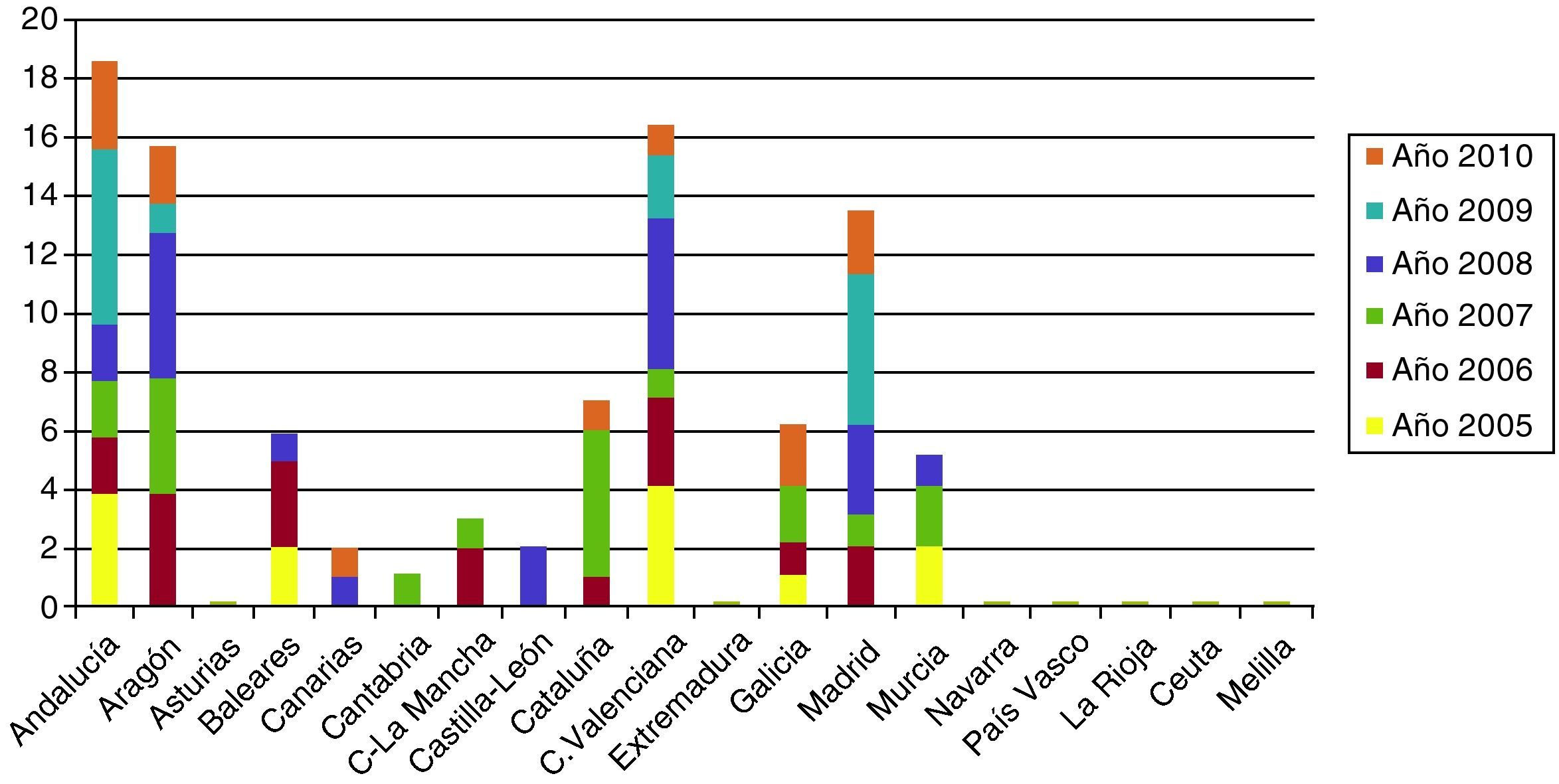
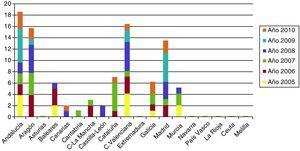
Sin embargo, en los últimos años el número de casos de sífilis primaria y secundaria se ha incrementado en los Estados Unidos y en muchos países europeos. En los países de altos ingresos, hasta muy recientemente, muy pocos niños nacieron con SC, pero ha habido un leve resurgimiento en la última década. En Reino Unido el número de niños con sífilis aumentó de 2 en 1996 a 14 en 2005, y los informes anecdóticos indican que se han visto muchos más casos de SC que los cuantificados y que, si las estrategias de control no se mejoran, la sífilis podría convertirse en una pandemia14. En España, según los datos registrados por el Centro Nacional de Epidemiología, se han registrado casi 100 casos en los últimos 5 años, frente a los 34 casos registrados entre l998 y 2002 (fig. 1)15. Datos muy similares aportan Sendagorta et al. en sus trabajos16. Actualmente en España, la incidencia de la sífilis congénita es menor de 1/100.000 nacidos vivos. Los datos acerca de la procedencia geográfica de las madres son escasos. Existen solamente cifras parcialmente recogidas por el Servicio Nacional de Epidemiología, ubicado en el Instituto de Salud Carlos III. Estas cifras se refieren al año 2009, y se está intentando completarlas con las referidas al año 2010. En ellas se recogen únicamente 4 procedencias geográficas: 3 de madres rumanas y 1 de madre africana. También podemos ver en las últimas estadísticas que las cifras más altas de SC se sitúan en las comunidades donde la acogida de inmigrantes es mayor.
En los Estados Unidos se ha producido una caída constante en el número de niños nacidos con sífilis, de un máximo, en 1991, de 4.410, a 353 en 2004 (una tasa de 8,8/100.000 nacidos vivos). La SC era muy rara antes de 1990 en Europa del Este y la antigua Unión Soviética, pero el número de bebés que nacen con sífilis en la Federación de Rusia aumentó de 29 en 1991 a 743 en 1999, un incremento de 0,9 a 8,5 casos/100.000 nacidos vivos9,17–22.
En África subsahariana la sífilis es común entre las mujeres en edad fértil, con tasas que van desde el 3,1% en Uganda al 4,2% en Madagascar, el 6,6% en Ghana y el 8,3% en Zambia. Entre las mujeres embarazadas, la prevalencia alcanza hasta un 17%. La reinfección de la enfermedad durante el embarazo se produce en aproximadamente el 10% de las mujeres infectadas23–25.
La OMS estima entre un 45% y un 75% la probabilidad de transmisión vertical. El número de casos de SC varía entre 700.000 y 1,5 millones cada año, con una estimación de 420.000 a 600.000 muertes perinatales, que se distribuye entre un 40% de nacidos muertos y un 20% de neonatos muertos. El 20% restante representa a los niños nacidos vivos pero con SC5,26–28.
En octubre de 2007, en la Conferencia Women Deliver en Londres, la OMS puso en marcha una nueva iniciativa mundial «para la eliminación de la SC como problema de salud pública», con la adhesión de más de 60 naciones, organismos internacionales de salud y académicas e instituciones de todo el mundo. La iniciativa tiene por objeto considerar la SC en el contexto de la salud pública. De acuerdo con esta iniciativa, nuestra pretensión es sensibilizar a nuestros compañeros más jóvenes acerca del control epidemiológico de la SC, los retos en el diagnóstico y tratamiento, y las oportunidades de prevención a gran escala.
Agente y transmisiónLos treponemas son bacterias macroaerofílicas gramnegativas, con unas dimensiones que oscilan entre los 6-20mm de largo y los 0,1-0,5mm de diámetro. El genoma se secuenció en 1998; la membrana externa está en su mayor parte compuesta de lípidos y contiene pocas proteínas, lo que dificulta la aparición de nuevos tests diagnósticos, así como el desarrollo de vacunas efectivas29.
Aunque la sífilis puede ser transmitida de forma excepcional al recién nacido intra partum, en la mayoría de los casos el niño contrae la infección en el útero, de manera que el Treponema pallidum atravesaría los tejidos maternos y fetales. Otra posibilidad sería que el Treponema pallidum accediera a la circulación fetal, atravesando primero las membranas fetales y, posteriormente, infectando el líquido amniótico30,31. La presencia de Treponema pallidum en el líquido amniótico no solo puede desempeñar un importante papel en el diagnóstico prenatal de la SC, sino que algunos autores lo relacionan con la severidad de la enfermedad en el feto32. Los cambios del cérvix, tales como hiperemia y friabilidad típicas durante el embarazo, pueden facilitar la entrada y multiplicación del Treponema pallidum33.
Las estadísticas son variables: se estima que el 18-50% de las madres infectadas van a transmitir la infección al niño, pero el riesgo de infección y su severidad van disminuyendo en los sucesivos embarazos; asimismo, la cantidad materna de treponemas va descendiendo con el tiempo, y es más alto el riesgo de transmisión en la infección reciente que en la tardía. Sin embargo, no existen datos suficientes acerca de los mecanismos inmunológicos que afectan a la unidad materno-fetal y que explicarían la historia natural de la enfermedad, su progresión clínica, fase de latencia, recaídas y la correcta evaluación de los resultados terapéuticos15,34–37.
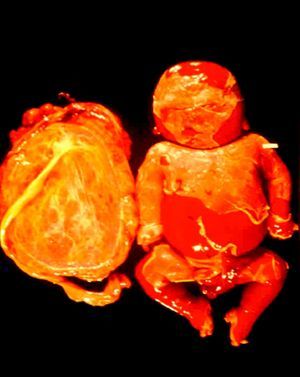
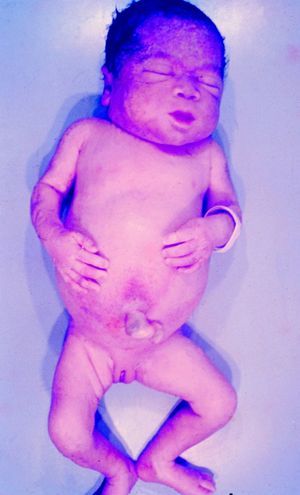
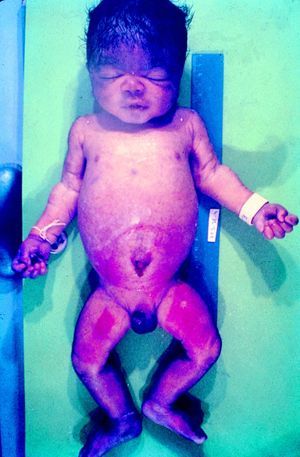
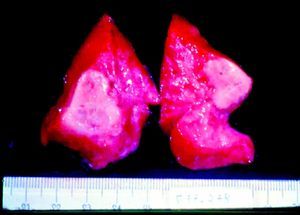
ClínicaLa infección sifilítica del feto produce, según nuestros datos y dependiendo de su severidad: aborto tardío espontáneo (20-40%), mortinato (20-25%), parto pretérmino (15-55%) con infección congénita o recién nacido vivo a término con infección congénita (40-70%). La infección congénita puede manifestarse, según su severidad, como muerte neonatal, como enfermedad neonatal o como infección latente, pudiendo desarrollar secuelas tardías. La muerte prenatal es el resultado más frecuente, pues ocurre entre el 40 y hasta el 70% de las gestaciones de mujeres con sífilis no tratada o tratada inadecuadamente; la mayoría de los recién nacidos vivos son asintomáticos, pero pueden desarrollar manifestaciones tardías15. Las manifestaciones clínicas pueden ser tempranas o tardías y su espectro es muy variado. La SC puede afectar a cualquier órgano del feto, más comúnmente hígado, riñones, médula, páncreas, bazo, pulmones, corazón y cerebro. De forma similar a la sífilis adquirida, la histología más característica de la SC es una endoarteritis obliterante, con infiltrado perivascular de linfocitos y células plasmáticas, acompañada de hiperplasia de la íntima de los vasos. Fibrosis y gomas se observan frecuentemente en esta enfermedad. En la placenta existe proliferación focal de las vellosidades con necrosis e infiltración focal de linfocitos maternos y células plasmáticas (fig. 2). Dichas vellosidades son inmaduras y están aumentadas de tamaño y amontonadas. El cordón umbilical también puede estar afectado, con la presencia de cambios inflamatorios y necróticos38. Existen estudios que apoyan la relación con la prematuridad, el bajo peso en el nacimiento y el pequeño tamaño para la edad gestacional; también con el aborto espontáneo, el cual puede ocurrir durante el segundo y principios del tercer trimestre39–42.
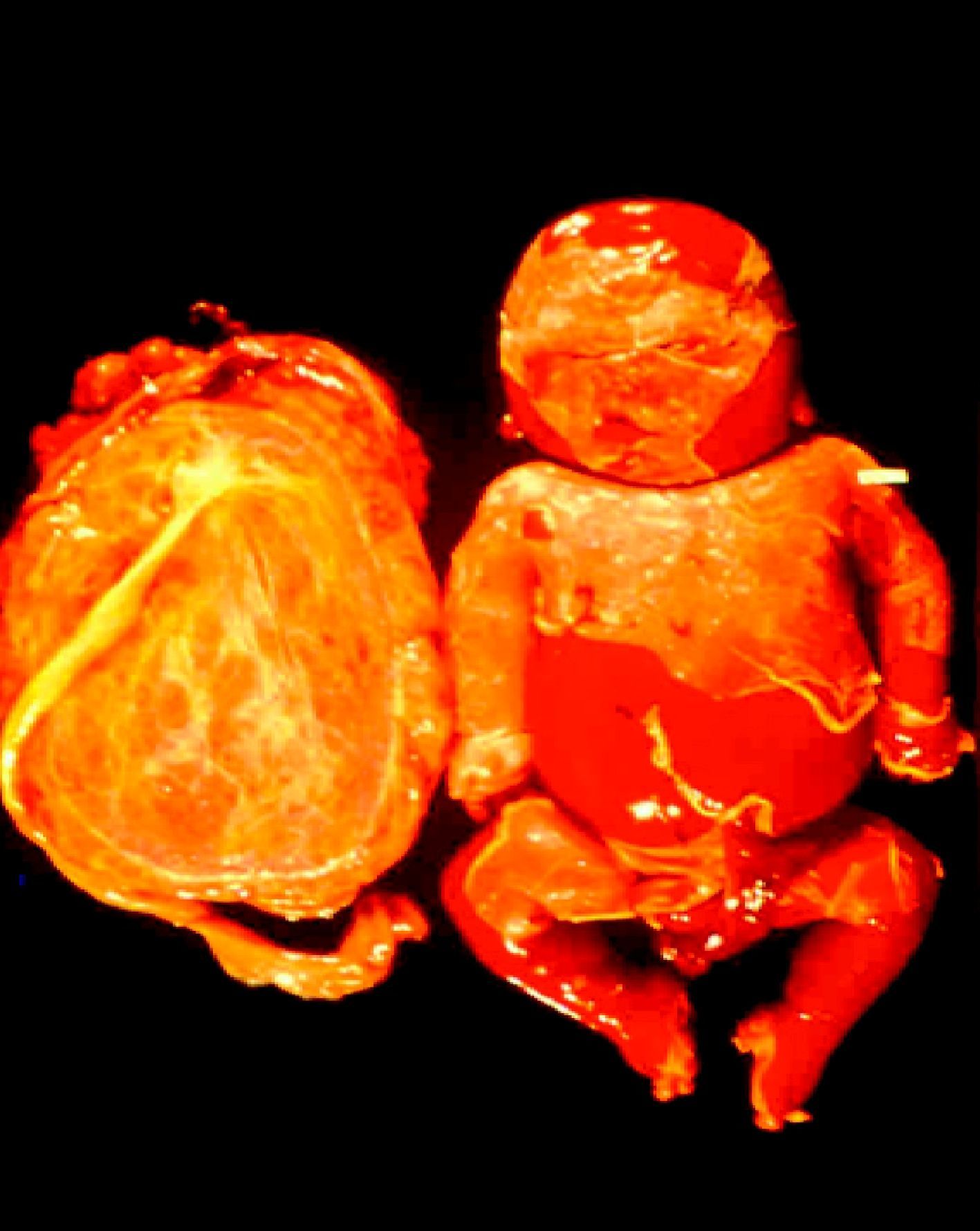
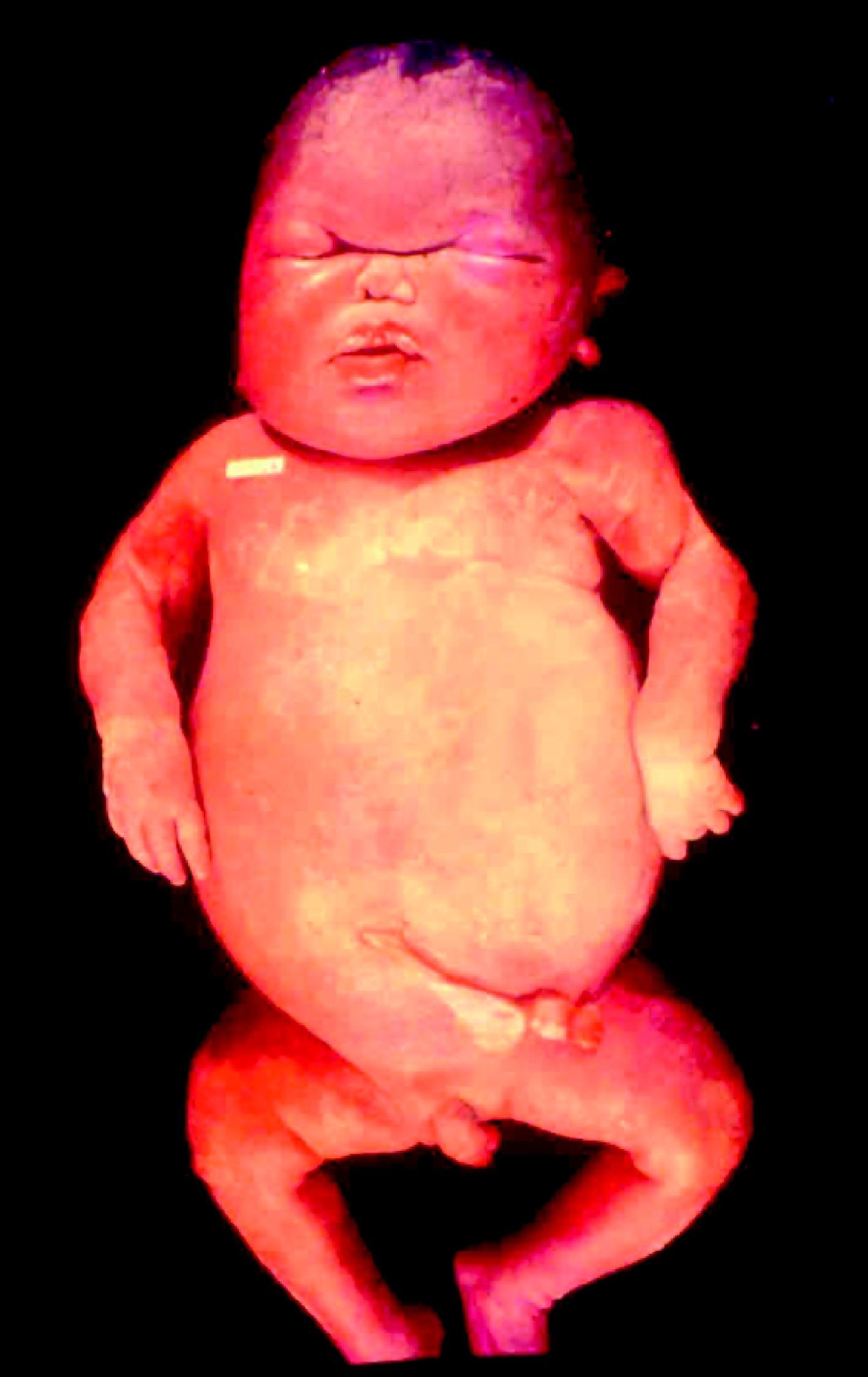
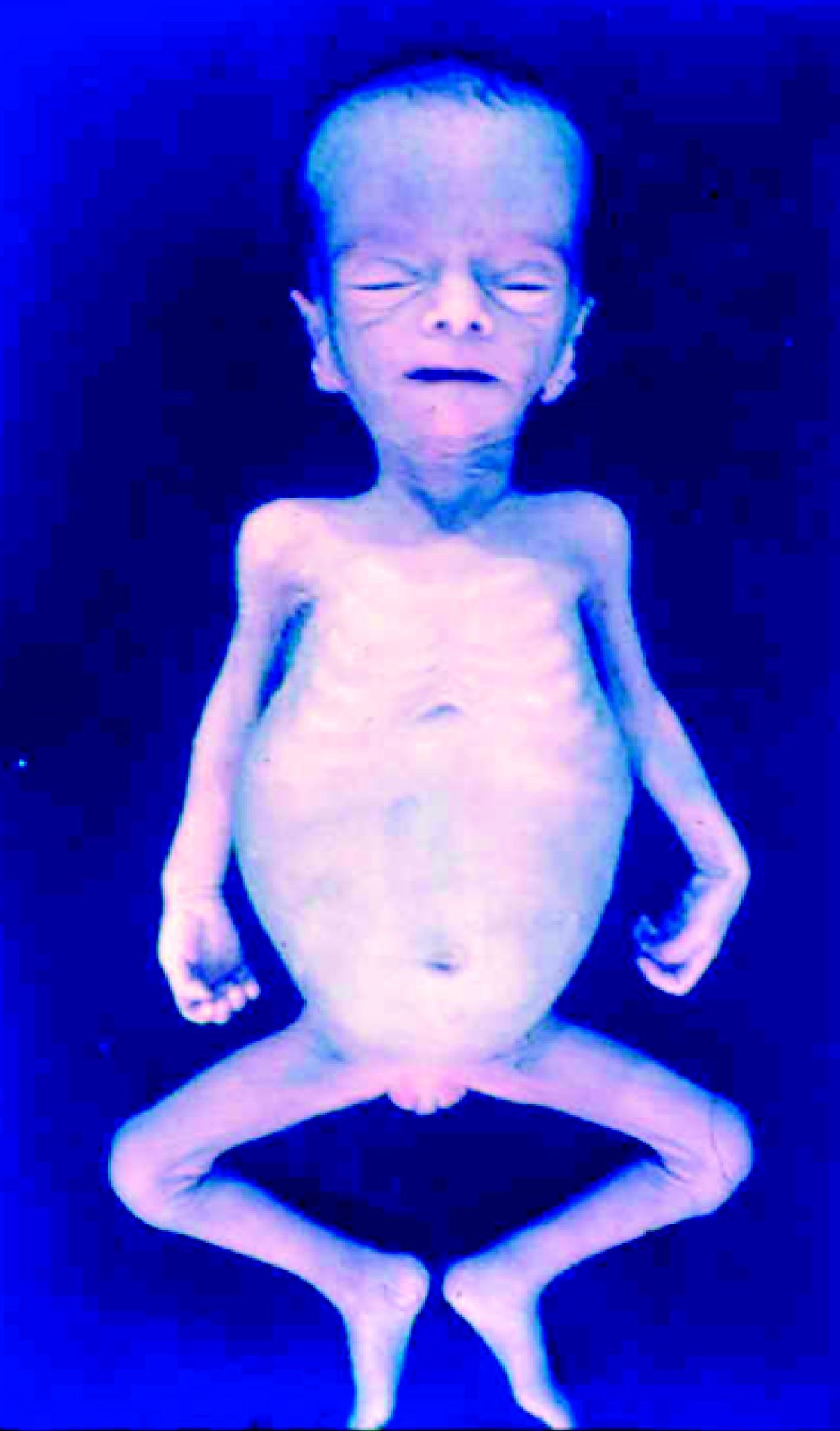
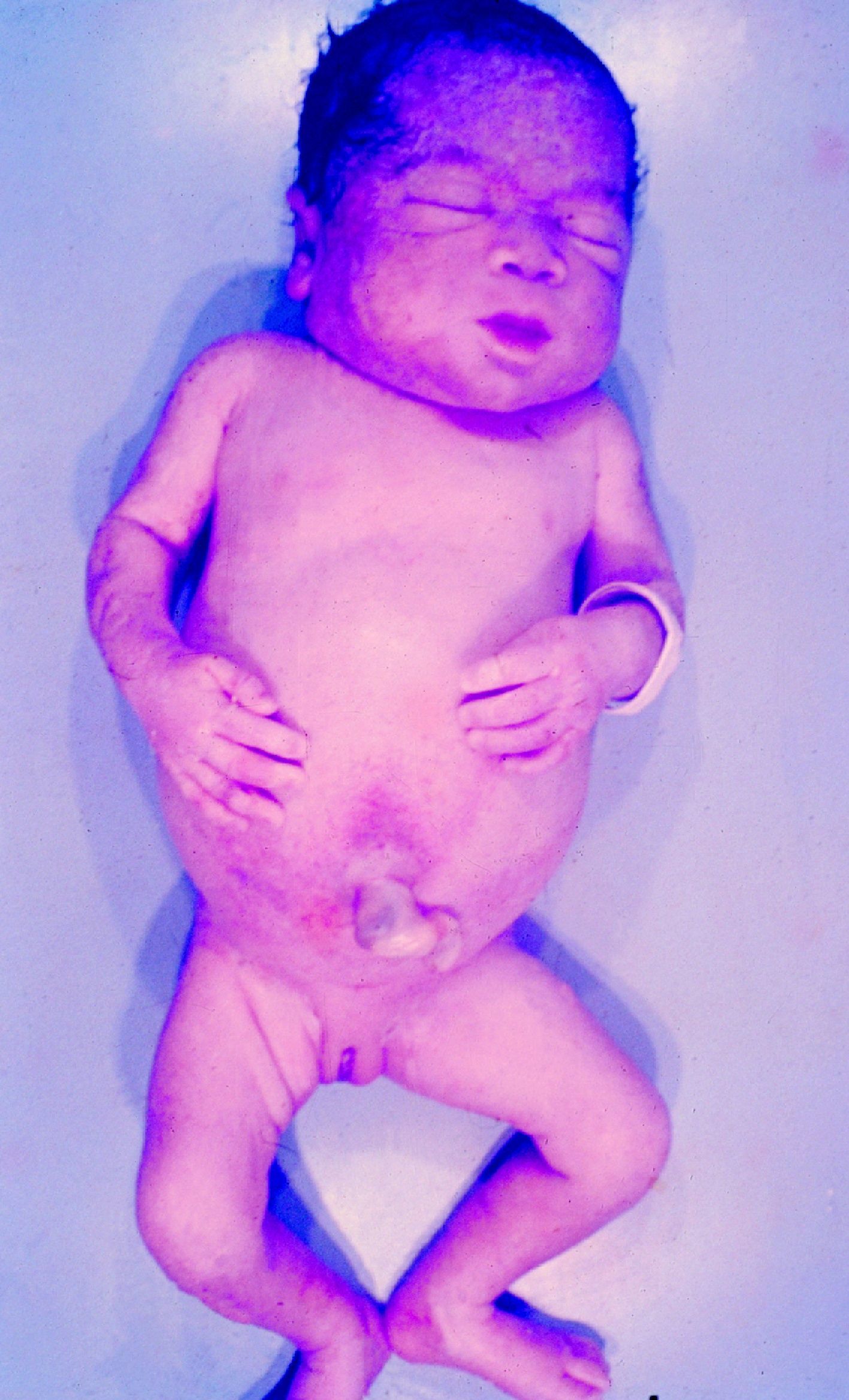
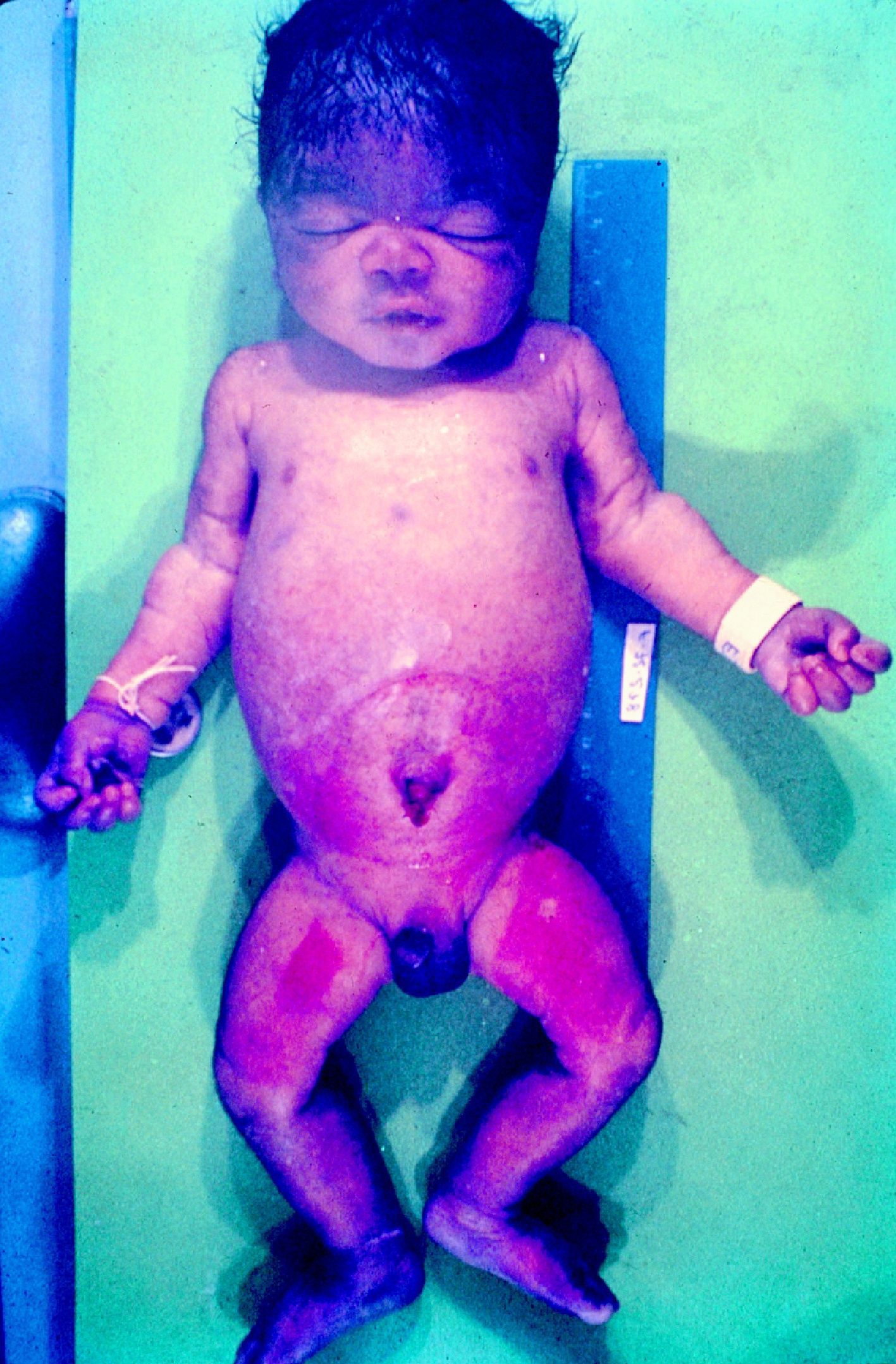
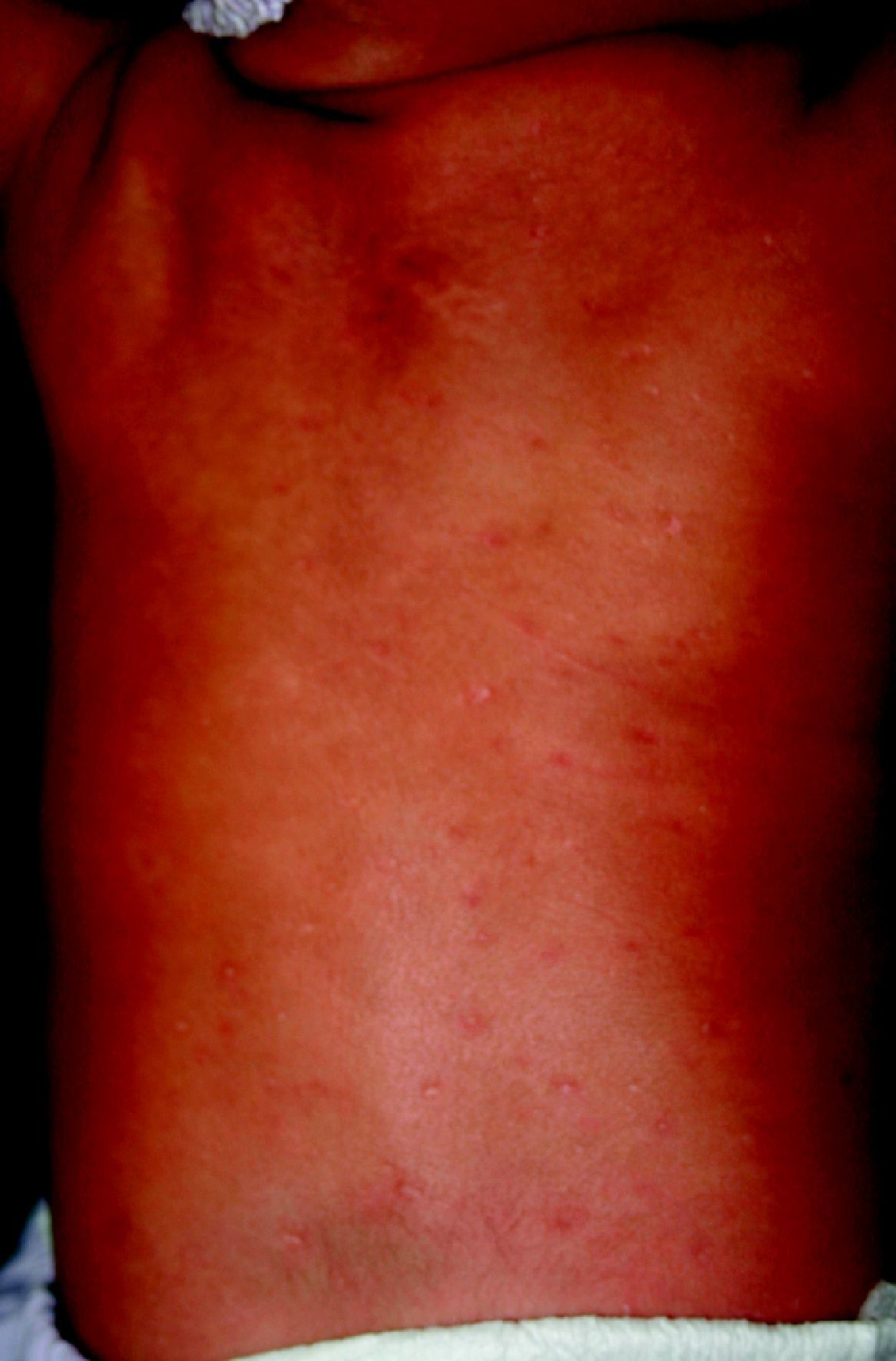
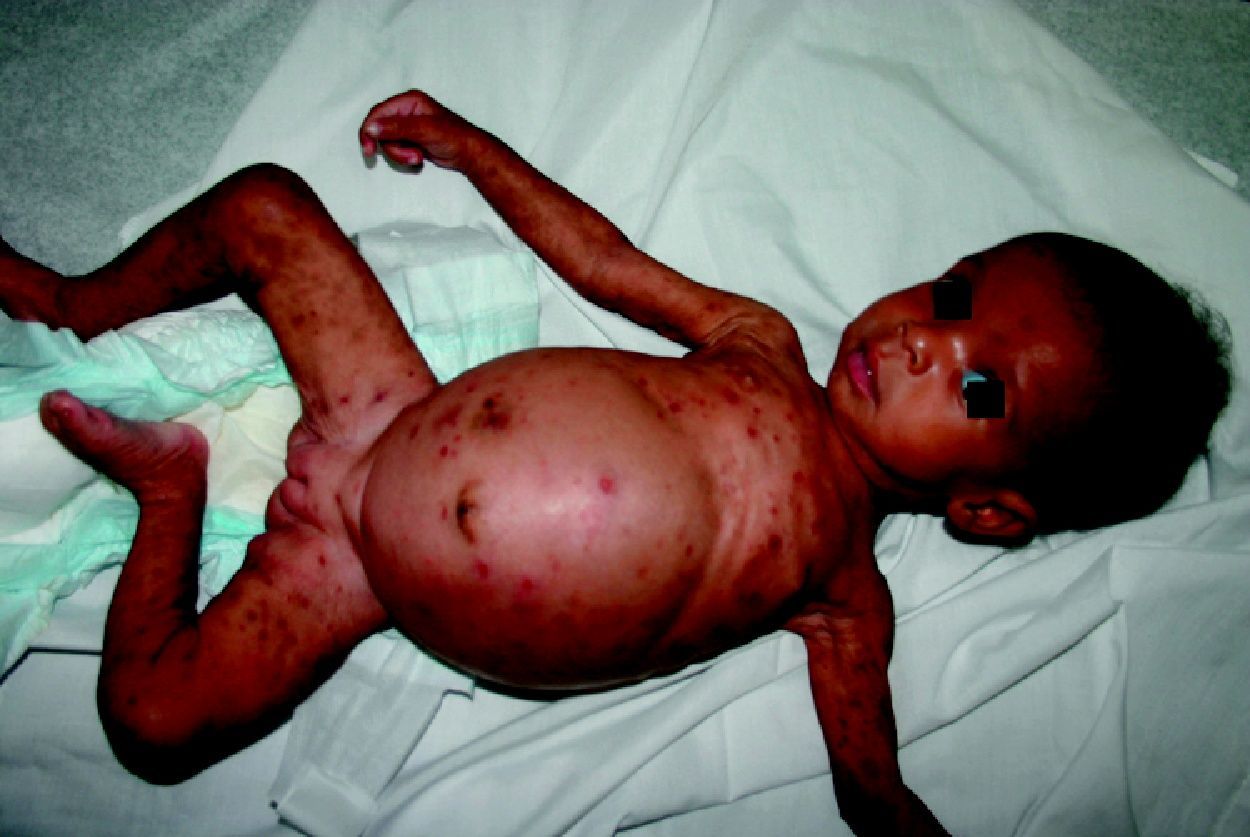
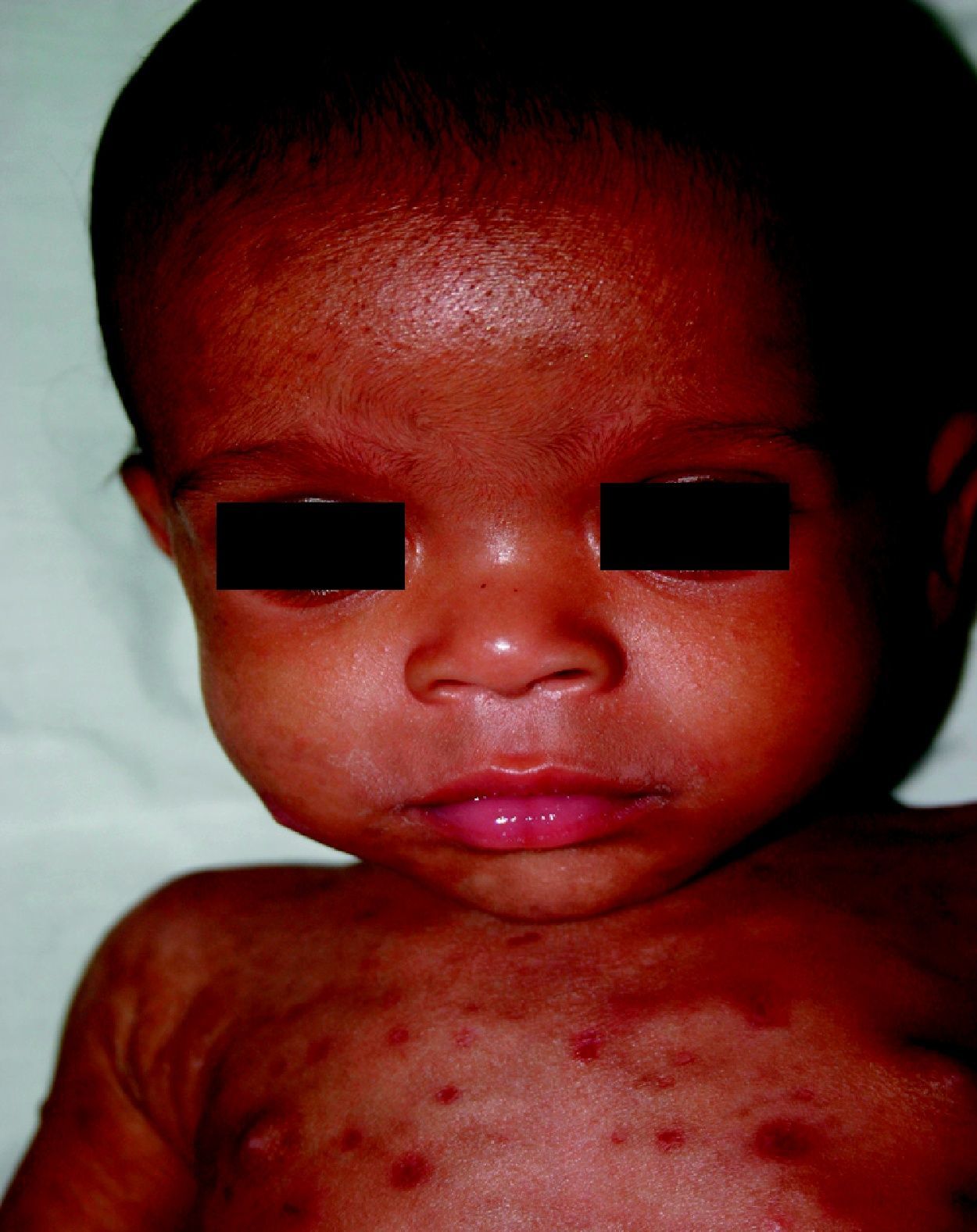
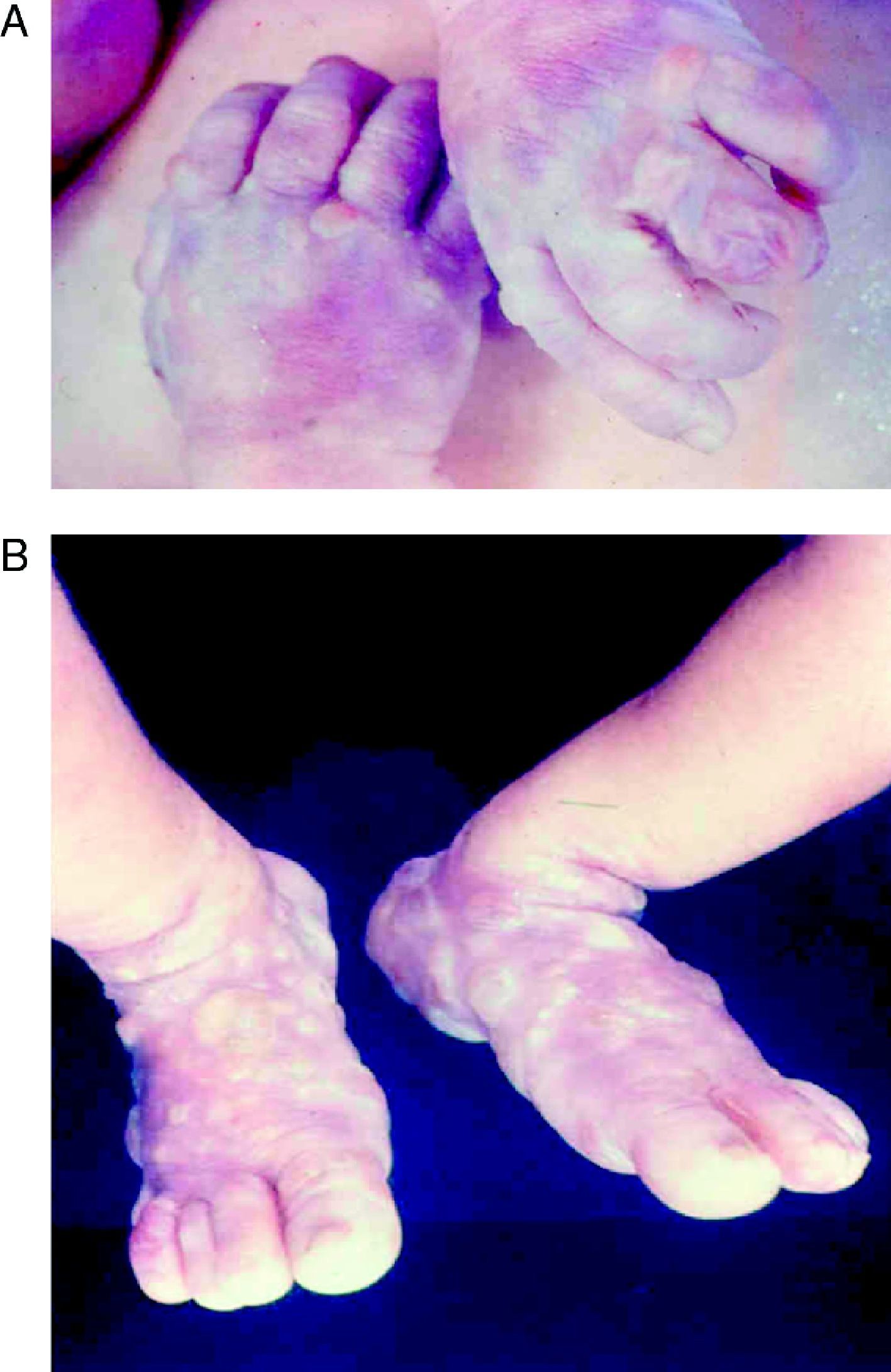
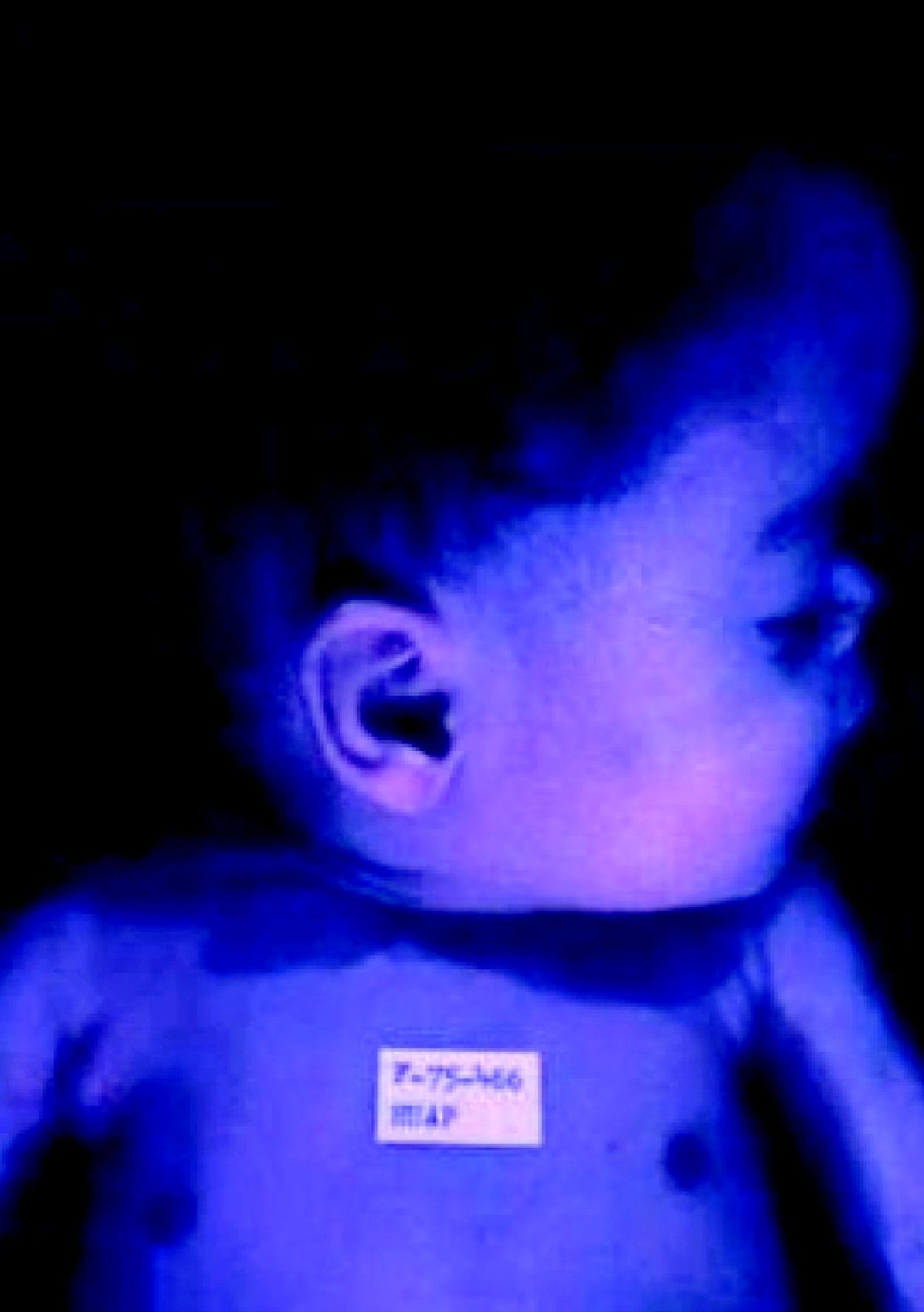
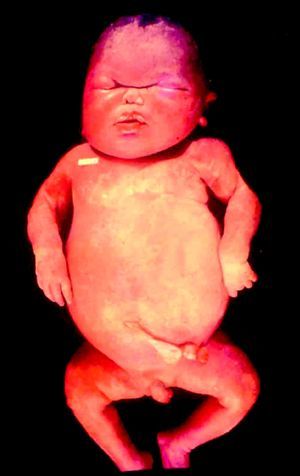
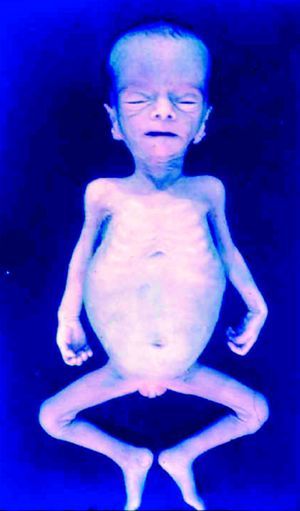
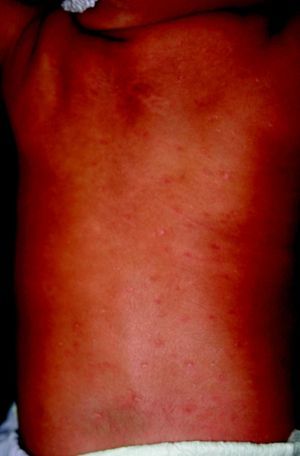
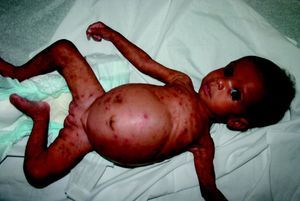
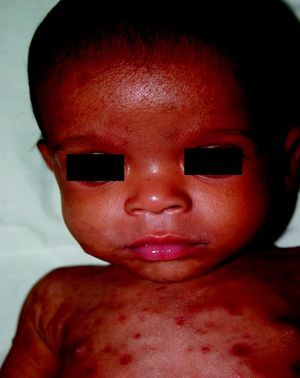
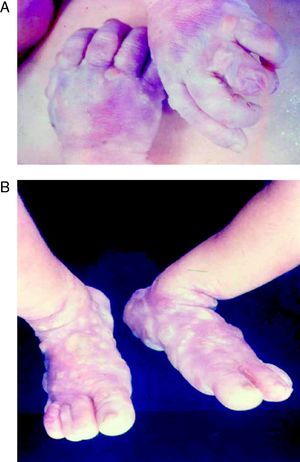
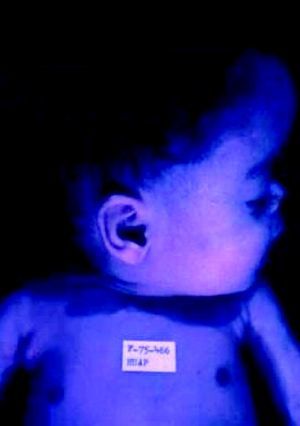
La SC temprana ocurre hasta los primeros 2 años de vida y, en la mayoría de los casos, surge dentro del periodo perinatal43. Existe un número importante de pacientes con SC que no presentan síntomas, por lo que el diagnóstico se demora varias semanas. Estos niños pueden comenzar con hidrops fetal no inmunológico, fallo en el desarrollo, fallo renal, hipotiroidismo, mixedema, rinitis o neumonía (figs. 3–5). Clásicamente los niños tienen mocos con un contenido claro, purulento o sanguinolento, los cuales son un rico foco de treponemas; también condritis, con la consecuente destrucción del cartílago nasal y afección laríngea, que puede dar lugar a un llanto afónico. Las lesiones cutáneas maculopapulosas (figs. 6–9) aparecen en el 30 al 60% de los casos y son generalmente similares a las de la sífilis secundaria del adulto. Además, también puede ocurrir un rash vesiculoampolloso de localización primordial en palmas y en plantas, de diverso tamaño y de contenido seropurulento o hemorrágico. Posteriormente darán lugar a úlceras y costras. Estas lesiones son altamente contagiosas44–47 (figs. 10 y 11).
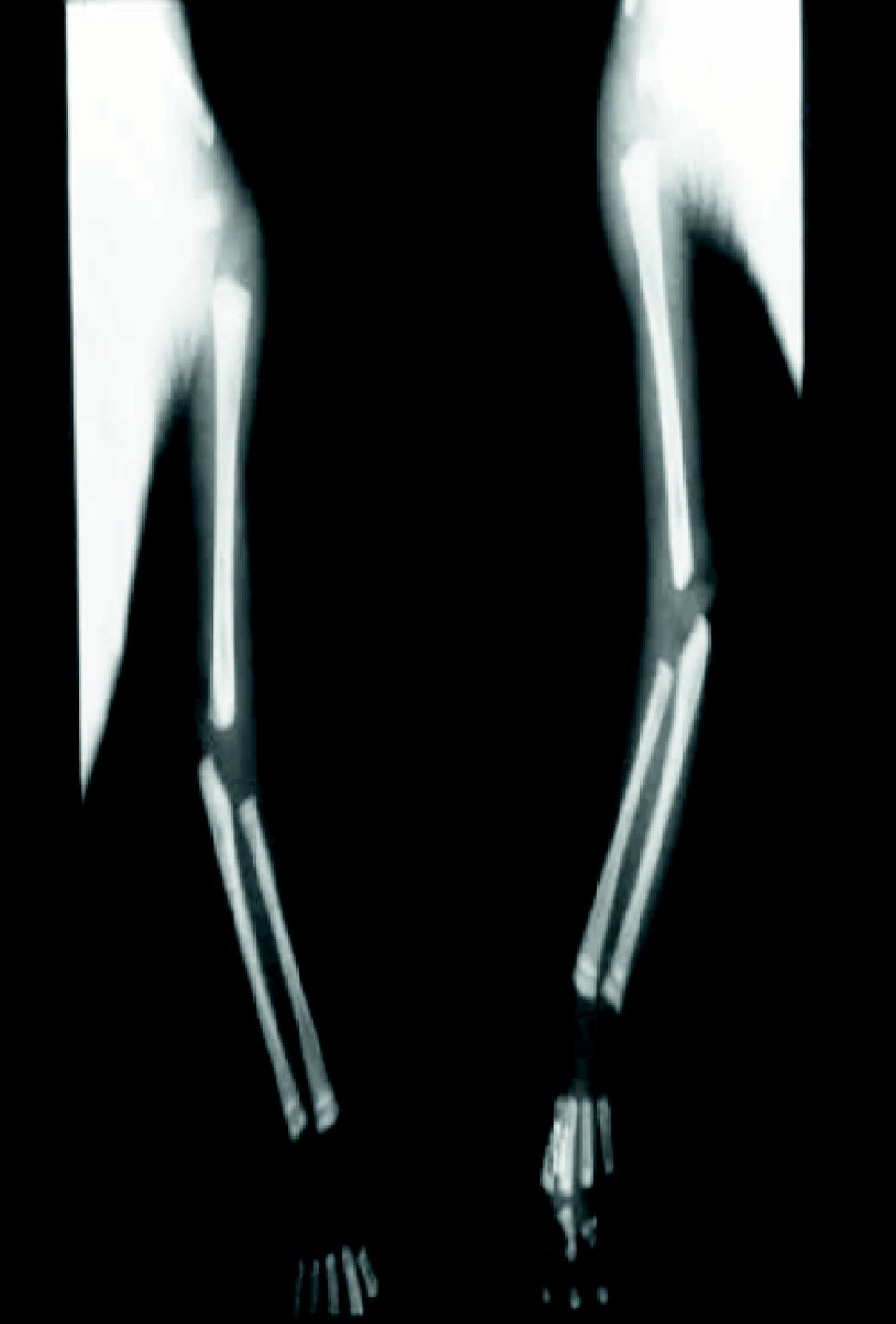
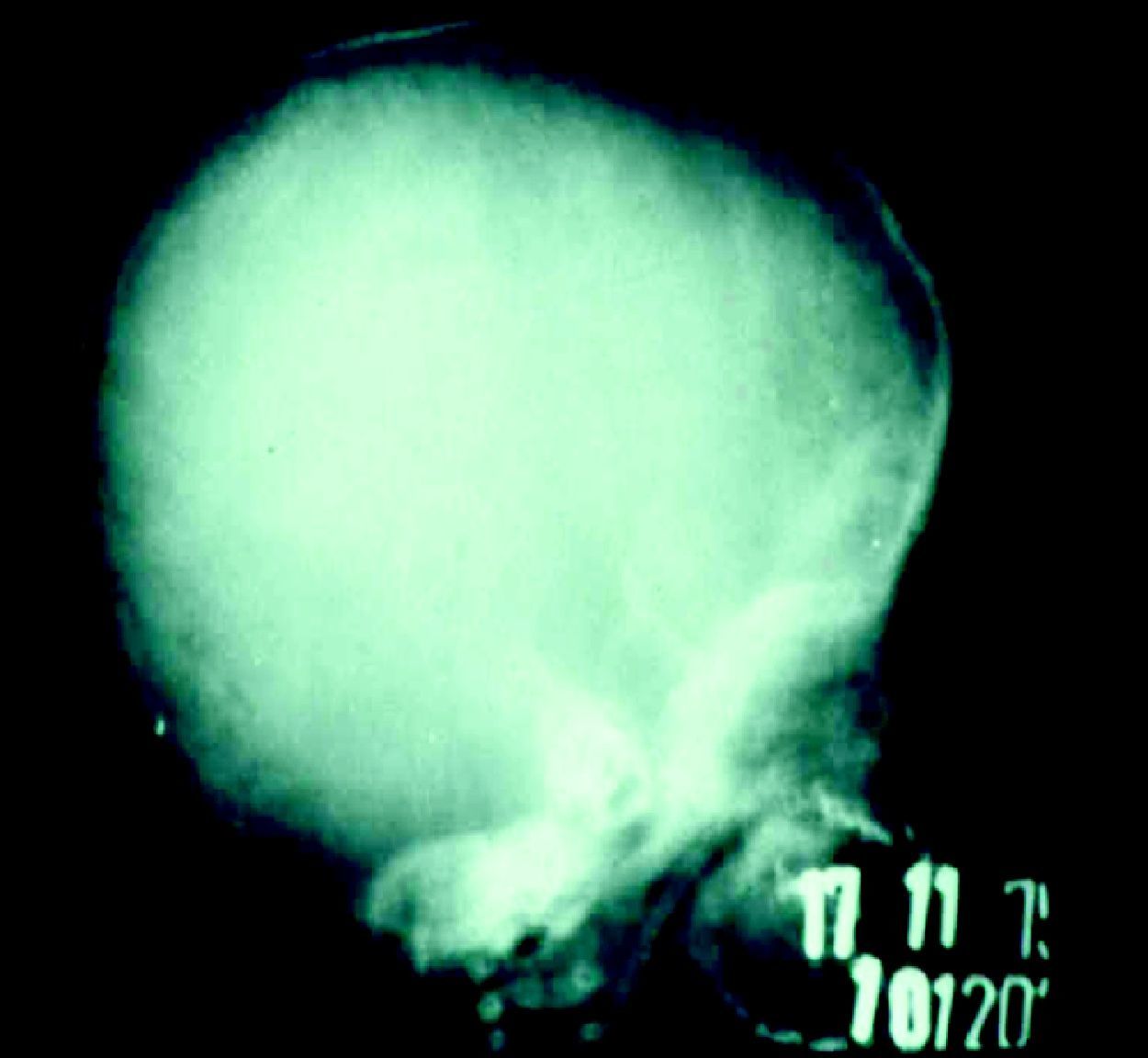
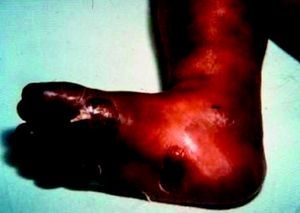
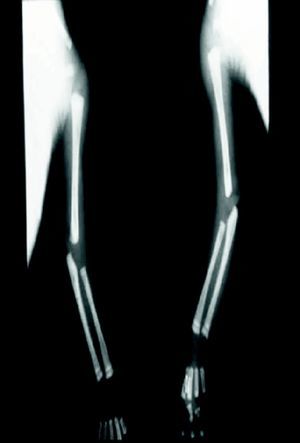
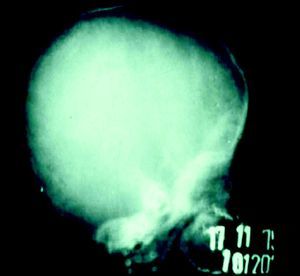
En cuanto a la afección del sistema nervioso, las manifestaciones tempranas corresponden a la meningitis y la hidrocefalia, que pueden dejar como secuela retardo mental o psicomotriz, ya sea leve o severo. La afectación pulmonar más conocida es la neumonía con patrón intersticial proliferativo o neumonía alba48. Hay afección renal y, aun en ausencia de manifestaciones neurológicas, pueden existir alteraciones en el líquido cefalorraquídeo (LCR). La mayoría de los niños con SC aparentemente asintomáticos pueden manifestar alteraciones radiográficas en forma de osteocondritis o pericondritis, periostitis y osteomielitis diafisaria (figs. 12 y 13). En ocasiones las lesiones óseas pueden ser dolorosas con destrucción ósea o tener fracturas superpuestas, dando lugar a seudoparálisis del miembro afectado, más conocido como seudoparálisis de Parrot48,49.
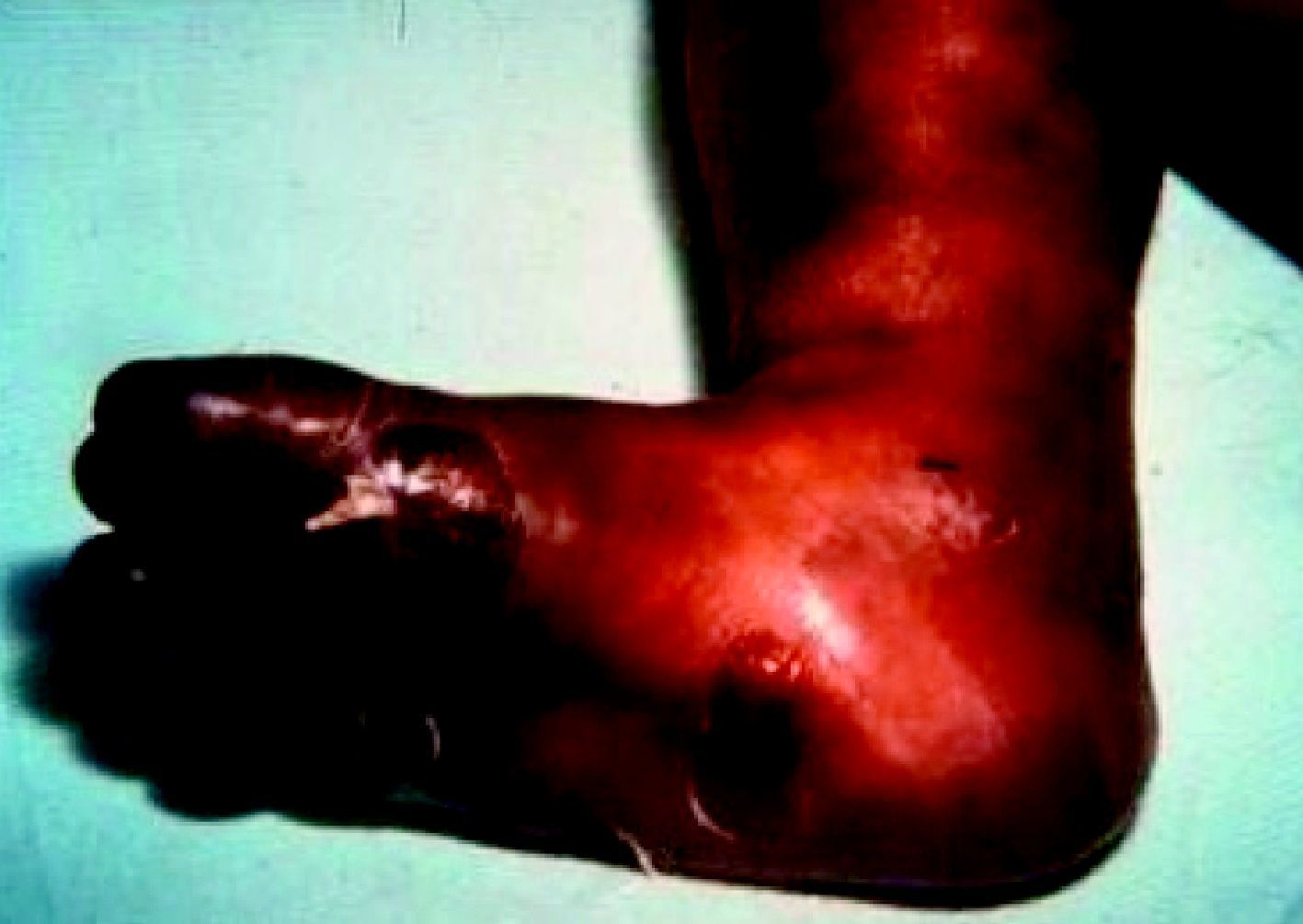
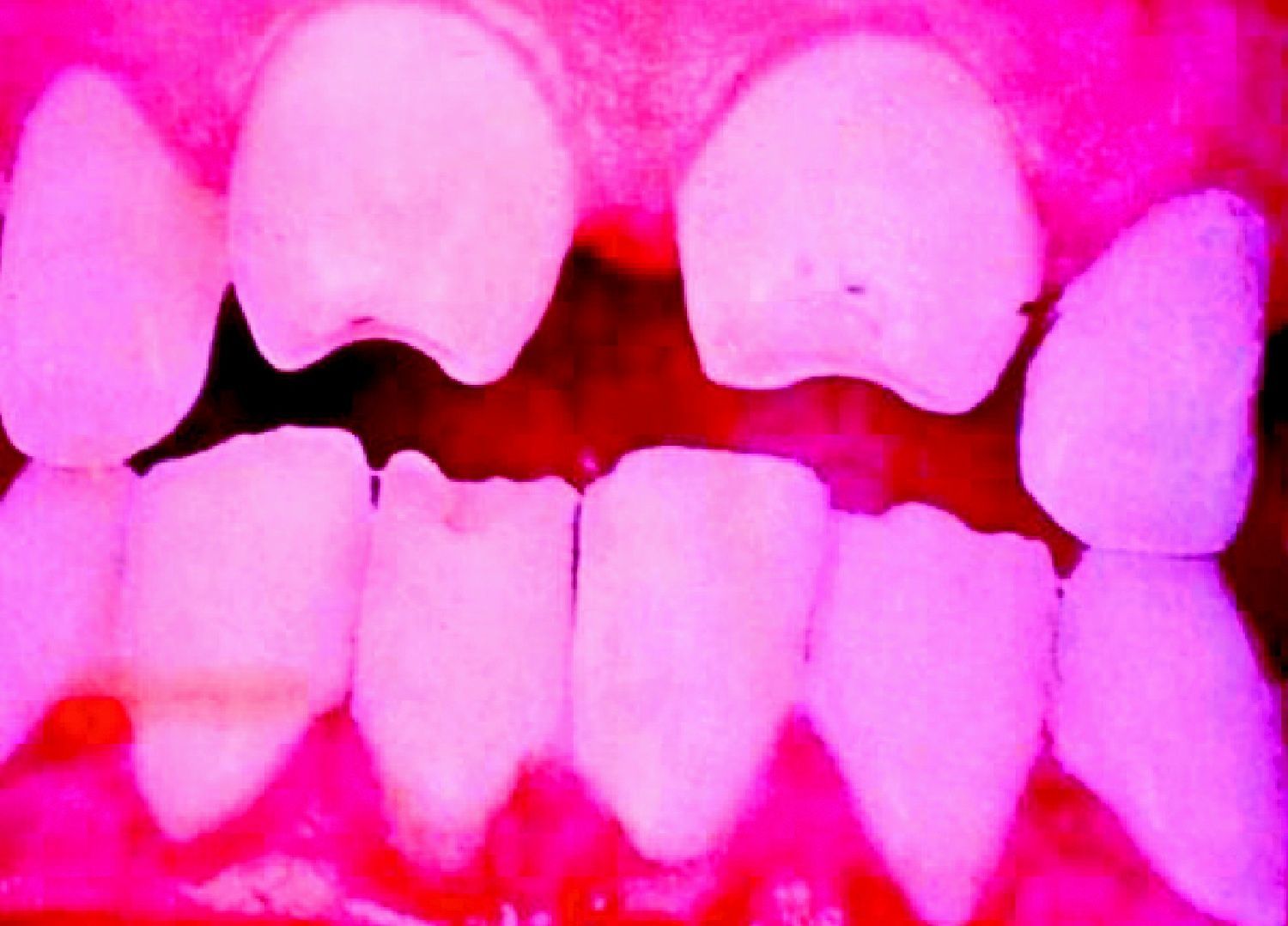
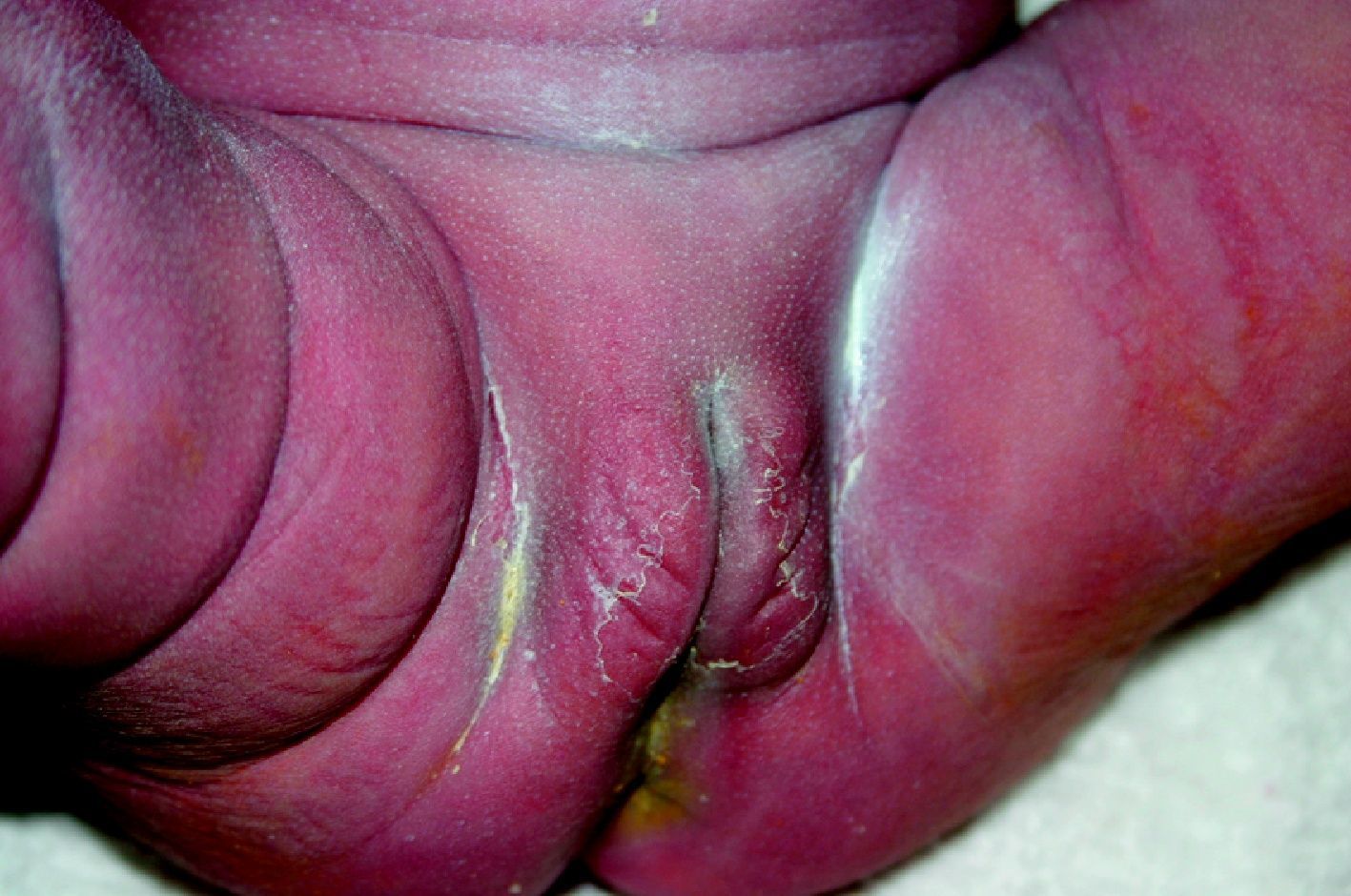
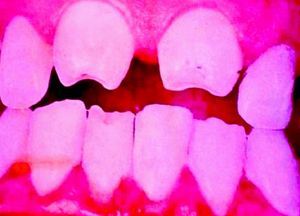
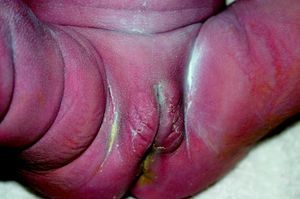
La SC tardía es similar a la enfermedad del adulto, excepto por la rareza de afección del sistema cardiovascular. Las manifestaciones pueden ocurrir bien a través de malformaciones (estigmas), las cuales ocurren porque la infección sucede en un estado crucial del desarrollo o crecimiento, bien debidas a la propia actividad de la enfermedad50. Dentro de las primeras se incluyen el abultamiento del frontal; la nariz en silla de montar (fig. 14), la tibia en sable, los incisivos escasa o pobremente esmaltados y los molares mal formados. De las lesiones inflamatorias, la queratitis intersticial es la más conocida. Está usualmente presente en el niño y se manifiesta con visión borrosa, fotofobia y exceso de lagrimeo; cuando esta se cura, puede hacerse explícita la retinitis sifilítica. La sordera por afección del VIII par craneal suele presentarse tardíamente, con afección tanto unilateral como, la más frecuente, bilateral, y puede cursar con nistagmo y vértigos. Cuando la queratitis intersticial concurre con los dientes de Hutchinson (fig. 15) y la sordera, a esta tríada se la conoce como tríada de Hutchinson y es muy predictiva de SC. Esto proporciona una facies característica a la SC. En orificios naturales es posible que aparezcan las rágades que caracterizan la SC (fig. 16)15,16. En el curso de la enfermedad pueden aparecer gomas en iris, cuerpo ciliar y músculos extrínsecos e intrínsecos del ojo. Igualmente pueden comprometerse otros órganos como los pulmones (fig. 17). La afectación osteomuscular en forma de osteoperiostitis o inflamación indolora simétrica de las rodillas es conocida como articulaciones de Clutton. Los gomas del paladar blando comienzan en la infancia tardía. Las formas juveniles aparecen en el 1 al 5% de los casos de SC y tienden a ser más rápidamente progresivas que las formas del adulto. Hay una forma característica de osteomielitis diafisiaria que compromete falanges, metacarpianos y metatarsianos. Estos gomas pueden posteriormente, y según lo exitoso y precoz del tratamiento, generar o no fístulas, quistes y fracturas patológicas con deformidades múltiples muy dolorosas (fig. 18). Las alteraciones tardías se evidencian después de la edad preescolar, entre los 5 y los 14 años de edad. Generalmente coexisten la periostitis y la osteomielitis diafisiaria que compromete principalmente las tibias, que con el reblandecimiento llevan al arqueamiento, que persistirá cuando se haya llegado a la etapa de condensación y engrosamiento de la enfermedad, dando lugar a la deformidad llamada «tibias en sable»51–53. Los síntomas más característicos de la SC (se reflejan de forma especial los muco-cutáneos) se recogen en la tabla 1.
Manifestaciones clínicas de la sífilis congénita
| Fase antenatal |
| • Retraso en el crecimiento intrauterino |
| • Hepatoesplenomegalia |
| • Intestino ecogénico |
| • Hidrops fetal |
| • Oclusión intestinal |
| • Muerte fetal |
| Fase precoz |
| En neonatos (recuerda a la sepsis neonatal) |
| • Prematuridad, bajo peso al nacer, tamaño mucho más pequeño que el que corresponde para la edad gestacional |
| • Rash vesiculoampolloso, ictericia* |
| • Hepatomegalia, esplenomegalia, anemia, fiebre y septicemia |
| En niños menores de 2 años (recuerda a la sífilis secundaria) |
| • Retraso en el crecimiento y desarrollo infantil |
| • Manifestaciones otorrinolaringológicas: rinitis, perforación del cartílago nasal, su extensión hacia la garganta da lugar a laringitis y ronquidos o llanto afónico |
| • Muco-cutáneo: rash maculopapuloso, erupción vesiculoampollosa preferentemente de localización palmo-plantar (pénfigo sifilítico), condilomas planos, fisuras periorificiales de boca, nariz o ano, petequias, paroniquia, alopecia de las cejas, cabello quebradizo* |
| • Ocular: uveítis, coriorretinitis, glaucoma |
| • Hematológico: anemia, leucocitosis o leucopenia, trombocitopenia, coagulación intravascular diseminada |
| • Renal: síndrome nefrótico o nefrítico con edema y ascitis |
| • Sistema nervioso central: leptomeningitis con vómitos, rigidez de nuca, abombamiento craneal con separación de las suturas. Hidrocefalia progresiva |
| • Esqueleto: osteocondritis y epifisitis, periostitis, osteomielitis sifilítica de las falanges proximales (dactilitis), seudoparálisis de Parrot |
| • Otros: hepatoesplenomegalia, pancreatitis, poliadenopatías, neumonía alba, miocarditis |
| Fase tardía |
| En niños mayores de 2 años (recuerda a una sífilis terciaria) |
| • Muco-cutáneos: fisuras periorificiales más pronunciadas, gomas, perforación del paladar* |
| • Ocular: queratitis intersticial, uveítis, glaucoma |
| • Auditivo: sordera (parálisis del VIII par), nistagmo, vértigos |
| • Dental: molares en mora o de Moon, dientes de Hutchinson (incisivos centrales superiores en forma de tonel con melladuras en su borde inferior), distrofia del esmalte |
| • Neurológico: neurosífilis asintomática (de 1/4 a 1/3 de los pacientes), o sintomática con tabes dorsal (articulaciones de Charcot y mal perforante plantar), encefalitis (parálisis general juvenil) que lleva consigo ataxia, alteraciones de la sensibilidad, cambios de humor, convulsiones, alteraciones pupilares |
| • Esqueleto: prominencia del frontal, acortamiento del maxilar, arco del paladar alto, mandíbula prominente, nariz en silla de montar, arco del paladar alto, tibia en sable, signo de Clutton (hidrartrosis dolorosa), escápula escafoidea, signo de Higoumenakis (engrosamiento proximal de la clavícula) |
| • Otras: hemoglobulinuria por frío |
Se lleva a cabo intraútero. El diagnóstico es esencialmente ecográfico, con manifestaciones características como hepatoesplenomegalia, hidropesía fetal con edema del cuero cabelludo, engrosamiento de la placenta y polihidramnios. Está presente en el 40% de las madres con sífilis latente precoz y en el 10% de las madres con sífilis latente tardía. También se evidencian hepatoesplenomegalia, placentomegalia, obstrucción intestinal y dilatación del intestino delgado54–56.
Estos signos son también subjetivos de posible fallo terapéutico57,58. La ecografía fetal debe ser repetida, pues a las 3 semanas de tratamiento estos signos suelen desaparecer. Un estudio del líquido amniótico o sangre fetal no estaría de más, ya que, paralelamente, puede detectar una trisomía 21. Una punción en la ascitis fetal puede poner de manifiesto el Treponema pallidum. Con la punción de sangre fetal podemos obtener datos indirectos de fetopatía, si bien las intervenciones muy invasivas no suelen estar indicadas, ya que una ecografía fetal con signos de fetopatía unida a una serología materna positiva son datos suficientes para diagnosticar una SC54.
De forma sistemática, y siguiendo las recomendaciones dadas por los Centros para el Control y la Prevención de las Enfermedades (CDC), los tests serológicos comúnmente se usan para el diagnóstico de la sífilis en el embarazo, ya que la mayoría de las pacientes no tienen síntomas17,59. En España, de forma rutinaria en el primer trimestre del embarazo, se solicita serología para lúes, toxoplasma, rubeola, hepatitis y virus de la inmunodeficiencia humana (VIH). En el segundo trimestre solo se solicita toxoplasma en caso de que la mujer no sea inmune, es decir, negativo. En el tercer trimestre se repite hepatitis, VIH y toxoplasma, si es negativo. Toda gestante seropositiva debe ser considerada infectada a menos que exista un historial clínico documentado con un tratamiento adecuado y los títulos serológicos hayan declinado. Se deben instaurar protocolos de actuación17.
Las pacientes VIH positivas pueden tener serologías atípicas con títulos inusualmente altos, bajos o fluctuantes15,28.
No deben realizarse sistemáticamente determinaciones en suero y cordón umbilical del recién nacido. Es preferible llevar a cabo pruebas de detección en el suero de la madre, ya que si los títulos de esta son demasiado bajos o fue infectada al final de la gestación, no son perceptibles en las muestras del cordón umbilical. Durante bastante tiempo se usó el IgM FTA-ABS (prueba con anticuerpos treponémicos fluorescentes), pero la experiencia demostró alternancia en su fiabilidad, debido posiblemente a que un gran porcentaje de la IgM detectada era anti IgG materna o incluso la IgM presente en la inmunofluorescencia estaba bloqueada. Un título elevado es un signo de infección. Las técnicas de inmunofluorescencia parecen ser bastante precisas para la detección de Treponema pallidum en muestras procedentes de autopsias recientes59–61.
Actualmente se han desarrollado nuevas técnicas diagnósticas, entre las que incluimos el enzimoinmunoanálisis, que pueden alcanzar una sensibilidad del 100% y una especificidad del 99% cuando se utilizan en gestantes. Mediante técnicas de immunoblotting, Wendel et al. detectaron anticuerpos IgM contra el Treponema pallidum en sangre fetal obtenida por cordocentesis62–64. La reacción en cadena de la polimerasa se usa para la detección de ADN del Treponema pallidum en diferentes fluidos fetales y del recién nacido, y es de gran utilidad en el diagnóstico de la SC. Son pruebas de gran sensibilidad, aunque los resultados deben manejarse con cuidado65,66. En el recién nacido, el diagnóstico inmediato es posible, a veces, mediante el examen de secreciones nasales o lesiones de piel en el microscopio de campo oscuro62. Los estudios anatomopatológicos de productos de la concepción anteriormente mencionados también pueden ser de utilidad en el diagnóstico de la SC. El Treponema pallidum puede ser visualizado mediante tinciones de plata y por métodos inmunohistoquímicos. En ausencia de la demostración directa del Treponema pallidum en las muestras clínicas, el diagnóstico debe basarse en criterios clínicos y serológicos (tablas 1 y 2).
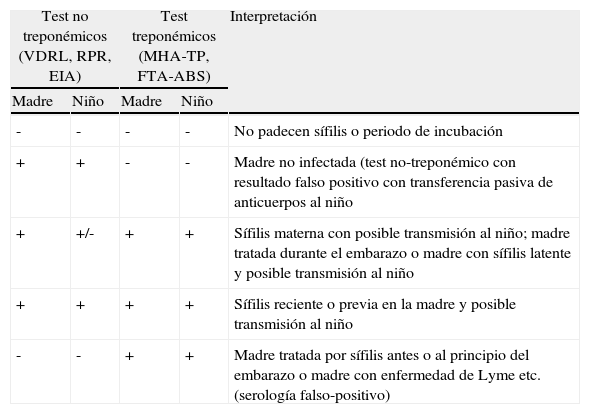
Guía para interpretación de los resultados de los test serológicos para la sífilis en las madres y sus niños
| Test no treponémicos (VDRL, RPR, EIA) | Test treponémicos (MHA-TP, FTA-ABS) | Interpretación | ||
| Madre | Niño | Madre | Niño | |
| - | - | - | - | No padecen sífilis o periodo de incubación |
| + | + | - | - | Madre no infectada (test no-treponémico con resultado falso positivo con transferencia pasiva de anticuerpos al niño |
| + | +/- | + | + | Sífilis materna con posible transmisión al niño; madre tratada durante el embarazo o madre con sífilis latente y posible transmisión al niño |
| + | + | + | + | Sífilis reciente o previa en la madre y posible transmisión al niño |
| - | - | + | + | Madre tratada por sífilis antes o al principio del embarazo o madre con enfermedad de Lyme etc. (serología falso-positivo) |
EIA: enzimoinmunoanálisis; FTA-ABS: técnica de inmunofluorescencia (fluorescent treponemal antibody absorbed); MHA-TP: microhemaglutinación assay-Treponema pallidum; RPR: rapid plasma reagin; VDRL: venereal disease research laboratory.
Modificada de la Academia Americana de Pediatría.
Conviene destacar como novedad en este apartado la aparición de pruebas de diagnóstico de la sífilis más fáciles de utilizar en países en vías de desarrollo; así, aparecieron nuevos reactivos para determinar RPR que son estables a temperatura ambiente, tests treponémicos que no requieren electricidad u otro equipo y están disponibles con sensibilidades, especificidades y costos similares a los de la TPPA.
Otras pruebas de las denominadas rápidas para la detección de la sífilis ya están disponibles, como la tira inmunocromatográfica o el formato de flujo lateral, que utilizan el dedo-pinchazo o sangre venosa y que pueden leerse en 10-15 minutos y no necesitan un laboratorio específico. Un ensayo de campo realizado en Mozambique puso de manifiesto los buenos resultados de estas técnicas67,68.
Prevención, tratamiento y seguimientoActualmente las estrategias para la prevención de la SC se clasifican en 3 grupos: a) detección de casos: tratamiento de todos los casos de sífilis primaria y secundaria existentes en la comunidad con seguimiento de los contactos, junto con un nuevo cribado de las mujeres embarazadas con alto riesgo después de haberles realizado una serología inicial (esto reduciría la incidencia de sífilis temprana en la población de pacientes en edad fértil); b) seguimiento de las serologías positivas mediante investigación de todas aquellas serologías positivas procedentes del laboratorio y un cribado selectivo de los grupos con alto riesgo (esto podría reducir la prevalencia de sífilis latente) y c) examen prenatal habitual (esta estrategia constituye la mejor forma de defensa contra la SC). Además, debemos repetir dicho examen para la detección de la posible adquisición de la sífilis durante el embarazo63,64.
Los pacientes que tienen un alto riesgo de padecer sífilis, que habitan en áreas con un alto índice de morbilidad sifilítica, que carecen de exámenes previos o que tienen una serología positiva en el primer trimestre deben ser examinados de nuevo a principios del tercer trimestre (28 semanas de gestación) y al nacimiento. Como ya hemos mencionado anteriormente, en países como la Federación de Rusia se han dictado normas específicas de prevención y extremado las medidas al máximo. Algunos países realizan exámenes a todas las mujeres en el momento del parto. Los niños no deben abandonar el hospital mientras no se haya llevado a cabo una serología luética a la madre, al menos una vez durante el embarazo y, preferiblemente, de nuevo en el momento del parto. A cualquier mujer que dé a luz a un niño muerto debería realizársele analítica específica para la sífilis. A toda gestante con sífilis debería hacérsele también un test para el VIH (tabla 3). El tratamiento de la sífilis en la gestante consiste en la administración de las dosis apropiadas de penicilina, según su estadio. Algunos autores recomiendan una segunda dosis de penicilina benzatina por vía intramuscular (i.m.) una semana después de la dosis inicial, en los casos de sífilis adquirida precoz o tempranamente de menos de un año de duración. Debemos mencionar la ya conocida reacción de Jarisch-Herxheimer, que puede ocurrir en el 45% de las gestantes tratadas. En cuanto a la SC, la penicilina G cristalina acuosa vía parenteral es la preferida para asegurarnos de que se alcanzan concentraciones adecuadas en LCR. Si la terapia se interrumpe durante más de un día, esta debe reiniciarse. El tratamiento y las evaluaciones recomendados para los pacientes con SC se recogen, en parte, en la tabla 3, aunque a estos debemos añadir 2 supuestos a mayores: por una parte, los niños con examen físico normal y con valores en suero iguales o 4 veces menores que los títulos de la madre, y, por otra, las madres bien tratadas y tratadas con posterioridad a las 4 últimas semanas previas al parto y sin signos de reinfección o recaída. En estos casos no es necesario hacerle ninguna evaluación complementaria al niño y el tratamiento recomendado es penicilina G benzatina 50.000 UI/kg/i.m. en dosis única. Por último, en niños con examen físico normal y con valores en suero iguales o 4 veces menores que los títulos de la madre, y en madres tratadas adecuadamente con tests serológicos estables, tampoco es necesario hacer ninguna evaluación complementaria al niño ni administrarle tratamiento; sin embargo, algunos especialistas recomiendan aplicar penicilina G benzatina 50.000 UI/kg en dosis única, particularmente si el seguimiento no está claro17.
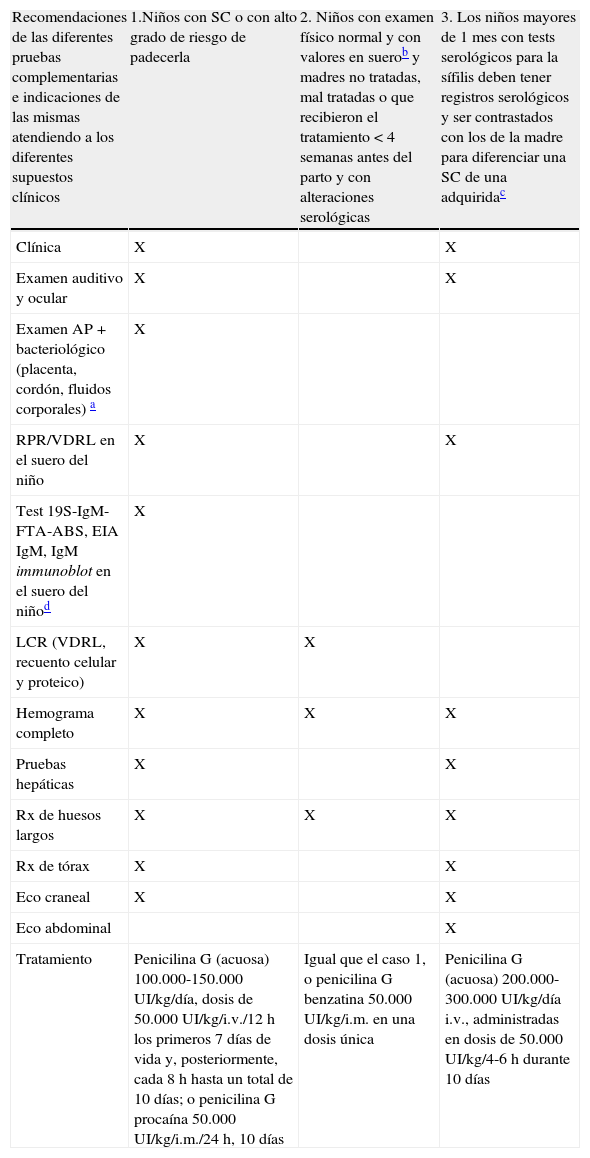
Evaluación y tratamiento de los recién nacidos con sífilis congénita
| Recomendaciones de las diferentes pruebas complementarias e indicaciones de las mismas atendiendo a los diferentes supuestos clínicos | 1.Niños con SC o con alto grado de riesgo de padecerla | 2. Niños con examen físico normal y con valores en suerob y madres no tratadas, mal tratadas o que recibieron el tratamiento<4 semanas antes del parto y con alteraciones serológicas | 3. Los niños mayores de 1 mes con tests serológicos para la sífilis deben tener registros serológicos y ser contrastados con los de la madre para diferenciar una SC de una adquiridac |
| Clínica | X | X | |
| Examen auditivo y ocular | X | X | |
| Examen AP+bacteriológico (placenta, cordón, fluidos corporales) a | X | ||
| RPR/VDRL en el suero del niño | X | X | |
| Test 19S-IgM-FTA-ABS, EIA IgM, IgM immunoblot en el suero del niñod | X | ||
| LCR (VDRL, recuento celular y proteico) | X | X | |
| Hemograma completo | X | X | X |
| Pruebas hepáticas | X | X | |
| Rx de huesos largos | X | X | X |
| Rx de tórax | X | X | |
| Eco craneal | X | X | |
| Eco abdominal | X | ||
| Tratamiento | Penicilina G (acuosa) 100.000-150.000 UI/kg/día, dosis de 50.000 UI/kg/i.v./12 h los primeros 7 días de vida y, posteriormente, cada 8 h hasta un total de 10 días; o penicilina G procaína 50.000 UI/kg/i.m./24h, 10 días | Igual que el caso 1, o penicilina G benzatina 50.000 UI/kg/i.m. en una dosis única | Penicilina G (acuosa) 200.000-300.000 UI/kg/día i.v., administradas en dosis de 50.000 UI/kg/4-6 h durante 10 días |
AP: anatomía patológica; EIA: enzimoinmunoanálisis; FTA-ABS: técnica de inmunofluorescencia (fluorescent treponemal antibody absorbed); i.m.: vía intramuscular; i.v.: vía intravenosa; LCR: líquido cefalorraquídeo; RPR: rapid plasma reagin; Rx: radiografía; SC: sífilis congénita; VDRL: venereal disease research laboratory.
A todos los niños serorreactivos o niños cuyas madres fueron positivas en el momento del nacimiento se les debe realizar un cuidadoso examen clínico y tests serológicos (p.ej. un test no treponémico cada 2-3 meses hasta que los tests se vuelvan negativos o el valor haya decrecido 4 veces). Los títulos de anticuerpos no treponémicos deberían decrecer a los 3 meses de edad y deberían ser no reactivos a los 6 meses, si el niño no fue infectado (p.ej. si el test reactivo fue causado por la transferencia pasiva de anticuerpos IgG de la madre) o fue infectado pero adecuadamente tratado. Si los títulos serológicos permanecen estables o aumentados a los 6-12 meses de edad, el niño debe ser evaluado (estudio del LCR) y tratado durante 10 días con penicilina G parenteral, según las dosis recomendadas17,66.
Si un test treponémico no es reactivo a los 18 meses de edad, no serían necesarios una evaluación ni un tratamiento posterior. Si los tests treponémicos son reactivos a esta edad, los niños deben ser totalmente reevaluados y tratados de SC. A los niños con evaluaciones iniciales anormales en LCR se les ha de realizar punciones lumbares aproximadamente cada 6 meses hasta que los resultados sean normales62.
Debería tenerse una consideración especial con todos los niños que requieran tratamiento para la sífilis, pero que tengan una historia de alergia a la penicilina o desarrollen una reacción presumiblemente secundaria a la penicilina. A estos deberían desensibilizarlos y luego tratarlos con penicilina, según las pautas indicadas. Carecemos de datos suficientes acerca de la eficacia del tratamiento con otros antimicrobianos, como la ceftriaxona, en el tratamiento de la SC, para la que existen pautas de uso ajustadas según la edad y el peso del niño. Para los lactantes con edad ≥ 30 días, se recomienda el uso de 75mg/kg vía intravenosa (i.v.)/i.m. al día, en una sola dosis al día, durante 10-14 días. Sin embargo, podría ser necesario el ajuste de dosis según el peso real. Para los niños mayores, la dosis debe ser de 100mg/kg al día, en una dosis única diaria. Para los bebés prematuros que no tienen otra evidencia clínica de infección, puede usarse la ceftriaxona i.v., cuya dosis se debe ajustar según la edad y el peso al nacer. En todos los casos debe hacerse un riguroso control del LCR17,60.
No hay datos suficientes acerca de si los niños que tienen SC y cuyas madres estaban coinfectadas con el VIH necesitan evaluación, terapia y seguimiento para la sífilis diferentes de los recomendados para todos los niños17,62,66.
Por último, quisieramos mencionar brevemente la utilidad que supondría tener a nuestro alcance una vacuna eficaz, la cual debería abarcar la prevención de la sífilis y, de manera general, las complicaciones que esta produce a largo plazo, la reinfección, así como la transmisión. Adicionalmente podría reducirse la transmisión de la infección por el VIH69.
DiscusiónEn España, la incidencia de la SC es baja. Lo mismo sucede en otros países europeos, tal y como se refleja en los datos epidemiológicos, aunque muy probablemente esté subestimada. En Italia, la elevada tasa de SC existente está fundamentalmente conformada por madres infectadas procedentes de otros países, mayoritariamente de la Europa del Este y de África11. En España, aunque los datos son muy escasos, se espera una tendencia similar.
Con datos recogidos por nosotros de estudios epidemiológicos procedentes de República Dominicana (Secretaria de Estado de Salud Pública y Asistencia Social [SESPAS] perteneciente al Ministerio de Salud Publica y Asistencia Social) y del Brasil a través del Sistema de Informação de Agravos de Notificação (SINAN) organismo dependiente del Ministério da Saúde, y clínicos procedentes del hospital Materno-Infantil de Santo Domingo (República Dominicana) y de la facultad de Medicina (departamento de Anatomía Patológica de la Universidad Federal Fluminense) de Niterói (Brasil), llegamos a la conclusión de que los niños eran significativamente más propensos a tener menos peso al nacer y edad gestacional que otros bebés nacidos de madres seropositivas recogidos en la literatura. De los datos que nosotros disponemos se extrae que solo el 32% de los recién nacidos infectados mostraron signos de SC. Un 16% tenía una IgM positiva en suero como el único signo de la enfermedad, el 12% tenía LCR VDRL positivo y el 8% un título serológico más alto que sus madres.
Está extensamente documentada la importancia de detectar la sífilis durante el embarazo, porque la prueba es muy rentable incluso en los países con baja prevalencia de la enfermedad. En Reino Unido y Estados Unidos la mayoría de los servicios recomiendan pruebas para la sífilis a todas las mujeres embarazadas al inicio del embarazo, a las 28 semanas y, si el riesgo de padecer sífilis es alto, también se hace en el momento del nacimiento. En la Federación de Rusia se realiza al inicio del embarazo y a las 21 y 36 semanas de gestación9,14,19,70.
En otros países como Francia o Italia está establecido por decreto (Decreto 92-143/2/1992 y Decreto10/09/1998) que las pruebas prenatales para detectar la sífilis sean gratuitas, aunque se realizan solo en el primer trimestre del embarazo70,71. En España únicamente se lleva a cabo de forma sistemática la serología para sífilis en el primer trimestre del embarazo. Esta se solicita conjuntamente con la serología para toxoplasma, rubéola, hepatitis y VIH. En Italia, se realiza de igual forma y actualmente se está presenciando un incremento por las poblaciones emigrantes procedentes del este de Europa.
Debemos seguir investigando si la seroprevalencia de sífilis en el embarazo sigue aumentando en las madres procedentes de otros países como está sucediendo en Italia, aunque el riesgo de tener un bebé infectado debería ser el mismo en las mujeres inmigrantes, ya que estas pueden hacer uso de los servicios nacionales de salud en igualdad y equidad. Sin embargo, creemos necesario añadir a los posibles factores de riesgo de la madre previamente considerados las múltiples parejas, la prostitución, la drogadicción, la infección por el VIH, así como que esta sea originaria de otros países y en especial donde la sífilis es una enfermedad endémica. De esta forma se debería de repetir la serología para sífilis en la 28 semana de gestación y al nacimiento.
En los países en desarrollo es necesario hacer un mejor control de la SC, aumentando la eficacia del cribado prenatal y del tratamiento de los recién nacidos infectados. Esto incluiría la promoción de la asistencia temprana en la atención prenatal y la información a las mujeres (y hombres) de los beneficios del cribado de la sífilis adquirida y su tratamiento precoz, así como promover la modificación de las conductas sexuales de alto riesgo y el uso preservativos. Sería muy conveniente la implementación de la ejecución descentralizada y en el mismo día de la detección del Treponema pallidum y la instauración del tratamiento, mediante el manejo de los nuevos tests rápidos para la detección de la enfermedad que ya anteriormente hemos descrito. Además, debe instaurarse tratamiento para la pareja sexual siempre que sea posible. Ha de llevarse a cabo una segunda prueba al final del embarazo para descartar reinfecciones y, por supuesto, realizar pruebas a todas las embarazadas no controladas durante su embarazo. También se debe instaurar el oportuno tratamiento a todos los niños probables, sospechosos y confirmados de SC.
El tratamiento masivo de los adultos de 15 y 49 años con azitromicina 1g fue una estrategia de tratamiento realizado en una zona de Uganda que dio como resultado una reducción significativa en la prevalencia de sífilis. Los ensayos realizados en Uganda y Tanzania han mostrado que la azitromicina sola o en combinación con bencilpenicilina benzatina fue al menos tan eficaz como bencilpenicilina benzatina sola en el tratamiento de la sífilis precoz. Esta ofrece las ventajas considerables de adherencia al tratamiento sobre el uso tradicional de la penicilina inyectable. Sin embargo, en los últimos informes descritos se encontraron resistencias a la azitromicina, por lo que debemos seguir muy de cerca estos acontecimientos, así como su posible utilización en embarazadas72,73.
La secuenciación del genoma del Treponema pallidum en 1998 abrió una puerta a la esperanza de lograr una vacuna profiláctica para la sífilis. Una reciente revisión de la literatura nos informa que una vacuna eficaz sería fácilmente alcanzable durante la próxima década, pero falta financiación74.
Sigue existiendo la necesidad de mejores herramientas para simplificar la tarea de diagnosticar la sífilis y, en particular, la SC, por ejemplo, técnicas no invasivas de diagnóstico, como pruebas con saliva y una prueba sencilla para identificar a los bebés al nacer que necesitan un tratamiento posterior y un seguimiento debido a una exposición prenatal por haber recibido un tratamiento insuficiente.
La Asamblea Mundial de la Salud celebrada en mayo de 2006 adoptó una «estrategia global para la prevención y control de las infecciones de transmisión sexual», la cual incluye la eliminación de la SC como una prioridad mundial y destacó la importancia de incorporar esto en iniciativas más amplias con que hacer frente a las infecciones de transmisión sexual.
Esto debería incluir programas sinérgicos con el VIH-sida que tengan en cuenta el cribado de la sífilis en los programas de prevención de la transmisión del VIH de madre a hijo75.
Los recursos para la eliminación de la SC son inadecuados y hay una necesidad urgente de la creación de un grupo de trabajo de ámbito mundial que sensibilice a los organismos internacionales de salud para hacer frente a esta trágica situación. Esto podría ser parte de una estrategia a favor de los pobres para cumplir con los objetivos de desarrollo del milenio, donde la diana está dirigida hacia la salud de la mujer y los niños.
ConclusionesDesde el punto de vista clínico, este trabajo pone de relieve el cuadro clínico tan variable que puede presentar la SC y sirve como un ejemplo de lo difícil que puede ser llegar a su correcto diagnóstico, sobre todo, si no se está acostumbrado a manejar esta enfermedad.
Como conclusiones destacamos lo siguiente:
- •
Se debe aplicar el test para la sífilis a todas las mujeres embrazadas al comienzo del embarazo, así como a las mujeres con alto riesgo de infección o procedentes de países donde la incidencia es alta también a las 28 semanas de gestación y en el momento del nacimiento.
- •
Las mujeres embarazadas no seguidas durante el embrazo deben ser examinadas antes de salir de la unidad de maternidad.
- •
A todas las mujeres que han tenido un niño nacido muerto después de 20 semanas de gestación se les debe hacer la prueba de la sífilis.
- •
Cerca de dos tercios de los recién nacidos con SC no presentan síntomas al nacer, por lo que los pediatras y dermatólogos deben estar atentos a la aparición de posibles casos de SC.
- •
La penicilina sigue siendo el tratamiento más efectivo para la sífilis.
- •
Todos los bebés sospechosos y confirmados de SC deben ser tratados lo antes posible, y deben ser seguidos y comprobar que el tratamiento ha sido efectivo.
- •
En los países en vías de desarrollo debe promoverse el cuidado prenatal y los beneficios del cribado de la sífilis y su tratamiento precoz, y modificar los patrones de comportamiento de alto riesgo fomentando el uso del preservativo.
Creemos que publicaciones de las características de la nuestra tienen una especial relevancia en nuestro país, donde, además, las referencias a esta enfermedad son escasas, si bien se están realizando esfuerzos importantes de recopilación de datos epidemiológicos y clínicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Salvador de Mateo Ontañón, del Servicio de Vigilancia Epidemiológica, Centro Nacional de Epidemiología (Instituto de Salud Carlos III de Madrid), por su importante aportación de los datos epidemiológicos.
A Rafael Alcántara Cáceres, del Instituto de Dermatología y Cirugía de la Piel (IDCP) de Santo Domingo (Republica Dominicana) y miembro de la ULACETS (Unión Latino-Americana contra las ITS), organismo asesor en materia de ITS de la OPS/OMS, por los datos facilitados y porque es siempre una agradable experiencia el poder trabajar con él.