La coexistencia de psoriasis con la infección por el virus de la inmunodeficiencia humana (VIH) implica dificultades diagnósticas y terapéuticas para el especialista en Dermatología.
En este artículo se revisan las peculiaridades de dicha coexistencia desde el punto de vista epidemiológico, patogénico, anatomopatológico, clínico y pronóstico. Se describen las principales dermatosis que se incluyen en el diagnóstico diferencial. También se analizan las diferentes posibilidades terapéuticas en estos pacientes, dependiendo del grado de inmunosupresión. Se incluyen como opción de tratamiento la terapia antirretroviral, el tratamiento tópico, los retinoides, los fármacos inmunosupresores clásicos y se revisa la literatura actual sobre el uso de las nuevas terapias biológicas en pacientes con infección por el VIH. Finalmente, se describe el riesgo de interacciones farmacológicas que tienen lugar en el tratamiento de la psoriasis en estos pacientes, que reciben múltiples fármacos.
Dermatologists face diagnostic and therapeutic difficulties when psoriasis coexists with human immunodeficiency virus (HIV) infection.
This article will review some of the aspects of this coexistence from the epidemiologic, pathogenic, histopathologic, clinical, and prognostic point of view. The main skin diseases that should be included in the differential diagnosis are described. Also analyzed are the different therapeutic options in these patients according to the degree of immunodeficiency. Possibilities include antiretroviral treatment, topical treatment, retinoids, and classic immunosuppressants. The review will also cover current literature on the use of new biologic therapies in patients with HIV infection. Finally, we will discuss the risk of drug interactions during psoriasis treatment in these patients, who receive multiple pharmacologic therapies.
A diferencia de otras dermatosis cuya frecuencia es mayor en los pacientes infectados por el virus de la inmunodeficiencia humana (VIH), la psoriasis se caracteriza por presentar unas tasas de prevalencia similar a las de la población general. Sin embargo, la psoriasis que presentan estos pacientes tiene unas características peculiares, tanto desde el punto de vista clínico como terapéutico, que hemos de conocer y que repasaremos en esta revisión.
Por otra parte, la terapia antirretroviral de gran actividad (TARGA) ha supuesto una mejoría radical en la calidad y la esperanza de vida de los pacientes infectados por el VIH. Este hecho, sumado al aumento en el número de casos de infección por el VIH diagnosticados en nuestro medio desde el año 20021, son dos factores implicados en el aumento de la prevalencia de esta infección. Por este motivo, la asociación de psoriasis y VIH cada vez es más frecuente en la consulta dermatológica.
EpidemiologíaLa frecuencia real de pacientes con psoriasis e infección por VIH varía según las series. Un estudio realizado en San Francisco sobre 2.000 pacientes infectados muestra una prevalencia del 2,5%2, cifra que es comparable con la de la población general. Otro estudio sobre 700 pacientes infectados de Berlín arroja cifras de prevalencia del 5%3, valor superior al de la población de referencia. En la población española hay datos de prevalencia de infección por VIH con psoriasis asociada del 4%4. Sin embargo, esta cifra se obtuvo a partir de una población seleccionada en la que predominaban pacientes adictos a drogas por vía parenteral y con cifras de CD4 muy bajas, motivo por el que no es comparable con la media española, que está estimada en el 1,4%5.
Por otra parte, en las diferentes series estudiadas no se ha visto relación entre el mecanismo de transmisión del VIH y el desarrollo de lesiones de psoriasis.
Relación con el estado inmunitarioLos primeros estudios sugirieron una relación entre el avance de la inmunosupresión y la gravedad de la psoriasis, como en un trabajo español con 1.161 pacientes con recuentos de CD4 < 450 mm-3, de los que el 81 % presentaba lesiones de psoriasis4. La tendencia a desarrollar formas más graves de psoriasis en pacientes con recuentos de CD4 bajos fue observada también en diversos trabajos posteriores.
En un estudio reciente llevado a cabo en Singapur a partir de 96 pacientes VIH positivos de los que 24 presentaban lesiones de psoriasis6, se observó que el 70 % desarrolló lesiones coincidiendo con el diagnóstico o después, lo que sugiere que el VIH tiene una influencia directa sobre el desarrollo de la psoriasis. Además, los pacientes que presentaban un mayor grado de inmunosupresión (CD4 < 200 mm-3) tenían un riesgo 9 veces mayor de padecer lesiones de psoriasis.
InmunopatogeniaTanto la psoriasis como la infección por el VIH se han relacionado con una sobreexpresión del factor de necrosis tumoral (TNF-α) y del interferón-γ (INF-γ)7, que se conoce como patrón de respuesta inflamatoria Th18,9. Se han encontrado niveles elevados de estas citoquinas también en el líquido sinovial10 y en las lesiones cutáneas en los pacientes con psoriasis11.
La elevación del TNF-α en la infección por el VIH tiene lugar en todas las fases de la infección12. Se ha relacionado con el aumento de la replicación viral, la depleción de los linfocitos T CD4 + y algunas manifestaciones clínicas como la fiebre, la caquexia, las úlceras aftosas, la fatiga o la demencia13,14. El efecto directo sobre la replicación viral se traduce en que los niveles de TNF-α presentan correlación directa con la carga viral15. También se ha comprobado que los niveles de TNF-α en la infección por el VIH alcanzan sus valores máximos cuando aparecen infecciones oportunistas como la tuberculosis16.
En este sentido, los dos inhibidores no selectivos del TNF-α, talidomida17 y pentoxifilina18, han demostrado disminuir la carga viral cuando son administrados a pacientes VIH positivos, tanto asintomáticos como con infecciones activas por M. tuberculosis. El tratamiento con talidomida consiguió reducir también los niveles de TNF-α, mientras que no fue así con la pentoxifilina.
En relación con la asociación entre la infección por el VIH y el TNF-α existen varios estudios que pretenden valorar la seguridad, tolerabilidad y eficacia de los tratamientos anti-TNF en los pacientes positivos para el VIH. En este sentido existe un ensayo de Wallis et al19 que incluye a 16 pacientes positivos para el VIH con niveles de CD4 < 200 mm-3 diagnosticados de una tuberculosis pulmonar activa. Estos fueron tratados con etanercept a dosis de 25 mg dos veces por semana durante 4 semanas e iniciaron la terapia antituberculosa estándar. Comparados con un grupo control, a pesar de la baja potencia estadística del estudio, se observó una respuesta más favorable en el grupo que recibió etanercept al valorar la respuesta radiológica o el tiempo de negativización del cultivo de esputo, y también al valorar los síntomas constitucionales. El tratamiento con etanercept se demostró seguro en este estudio de fase I. Desde el punto de vista analítico se demostró una elevación del 25 % de los niveles de CD4 al final del período de tratamiento sin afectación de la carga viral.
Mallon et al20 aportaron nuevos datos sobre los mecanismos patogénicos de la psoriasis al estudiar la prevalencia de alelos HLA-C en el contexto específico de la psoriasis y la infección por el VIH. Sobre una muestra de pacientes con psoriasis encontraron diferencias significativas entre la prevalencia del alelo Cw*0602 entre aquellos infectados por el VIH y los que no estaban afectos (79 frente a 25 %). La disregulación inmune que tiene lugar en la infección por el VIH podría actuar como el factor desencadenante de la psoriasis en aquellos individuos genéticamente predispuestos por el alelo Cw*0602. Este alelo también se ha visto relacionado con casos de psoriasis en gotas que habían aparecido tras una faringoamigdalitis o en que los títulos de estreptolisinas eran > 200 IU/ml al compararlo con una población control (100 frente a 20 %)21.
Manifestaciones clínicasLa primera referencia sobre la relación entre la psoriasis y el VIH fue publicada en 1985, momento en que se detectó que esta infección podía precipitar o agravar una psoriasis o un síndrome de Reiter22.
Obuch et al, en su trabajo clásico, distinguieron dos grupos entre los pacientes infectados por el VIH que presentaban lesiones de psoriasis según hubieran sido diagnosticados de psoriasis antes (1/3) o después (2/3) de contraer la infección por este virus2. Otro estudio más reciente dividía a los pacientes según presentaran antecedentes personales o familiares de psoriasis23.
El primer grupo, compuesto por los pacientes en los que la psoriasis apareció antes de la infección por el VIH o que tenían antecedentes familiares, presentó lesiones de psoriasis similares a la población general, siendo la psoriasis en placas la forma clínica más frecuente. Por el contrario, entre los pacientes que desarrollaron lesiones de psoriasis después de la infección por el VIH existía un mayor porcentaje que presentaba formas graves y extensas. Así, a pesar de que la presentación más frecuente también fue la forma en placas, existía un porcentaje estadísticamente significativo en que predominaban las formas de psoriasis invertida, con afectación intensa del cuero cabelludo, axilas e ingles. También fue más frecuente la afectación palmoplantar y las formas pustulosas localizadas o generalizadas. No hubo diferencias entre grupos respecto a las formas eritrodérmicas.
En ambos grupos se diagnosticaron brotes de psoriasis en gotas, algunos en relación con una infección faríngea estreptocócica previa. En los pacientes del primer grupo las lesiones mejoraron tras la terapia antibiótica, mientras que los del segundo grupo eran refractarios a dicho tratamiento. Se vio aumentada también la frecuencia de sobreinfecciones por estafilococos o cándidas, con algún caso de sepsis de foco cutáneo por S. aureus24.
Por lo tanto, la exacerbación repentina de una psoriasis inflamatoria, extensa y grave debe hacer sospechar la infección por el VIH y obliga a realizar un estudio serológico. En los pacientes positivos para el VIH ya diagnosticados, la gran eficacia de los nuevos fármacos antirretrovirales ha hecho que predominen las formas clínicas clásicas, dada la buena situación inmunológica de los mismos.
Desde el punto de vista articular, los sujetos positivos para el VIH presentan diferentes tipos de espondiloartropatías en las que se observa una afectación articular grave con destrucción articular, así como afectación ungueal y lesiones palmoplantares asociadas. La afectación articular de los pacientes con psoriasis e infección por el VIH también se caracteriza por la afectación articular agresiva, que comparada con los pacientes negativos para el VIH es más prevalente y más florida clínicamente25. A diferencia de lo que ocurre en la enfermedad de Reiter, el compromiso sacroilíaco y axial es raro en estos pacientes.
A modo de resumen, se recogen en la tabla 1 las características clínicas que presenta la psoriasis en los pacientes con infección por el VIH26.
Otras dermatosis psoriasiformes en la infección por el VIHExisten algunas enfermedades de la piel que comparten con la psoriasis algunas manifestaciones clínicas, y que es importante saber diferenciar. Esto puede resultar complicado en los pacientes VIH positivos, ya que como hemos dicho anteriormente la psoriasis puede presentarse en ellos de manera atípica.
Enfermedad de ReiterEl síndrome de Reiter ilustra la dificultad en el diagnóstico diferencial en los pacientes infectados por el VIH, dada la intensa afectación articular y la morfología abigarrada de las lesiones que pueden presentar los sujetos con psoriasis. Nos ha de guiar a favor del diagnóstico de enfermedad de Reiter la presencia de la tríada característica de poliartritis, uretritis y conjuntivitis, junto con las lesiones cutáneas típicas.
La enfermedad afecta con mayor frecuencia a varones jóvenes, y es característica la asociación con el HLA-B27, que está presente en aproximadamente el 80-90 % de los pacientes. Los individuos que muestran esta asociación se caracterizan por padecer un curso más grave.
La infección por el VIH, como otras infecciones intestinales y del tracto genitourinario, se ha implicado en la etiopatogenia de la enfermedad. Por ello, la prevalencia de la enfermedad de Reiter entre los pacientes positivos para el VIH se encuentra aumentada con respecto a la población general.
Es típico el brote de lesiones vesículo-pustulosas en las palmas y las plantas, que en su evolución confluyen y evolucionan a costras e hiperqueratosis. También es típica la afectación de los genitales, en forma de una balanitis perimeatal circinada y la afectación ungueal. En menor medida también pueden afectarse las superficies de extensión de las extremidades y el cuero cabelludo. Sin embargo, por su similitud clínica con las lesiones de psoriasis, la presencia de más elementos de la tríada es la que nos dará el diagnóstico.
Desde el punto de vista terapéutico esta entidad presenta las mismas opciones de tratamiento que la psoriasis. En los pacientes positivos para el VIH se considera de primera elección acitretino oral27.
Pitiriasis rubra pilarisLa pitiriasis rubra pilaris (PRP) es una enfermedad poco frecuente que se caracteriza clínicamente por la aparición de pápulas hiperqueratósicas foliculares sobre una base eritematosa. Las lesiones presentan una marcada tendencia a la confluencia, extendiéndose caudalmente, pero dejando islotes de piel respetada. Con frecuencia se afectan también las palmas y las plantas en forma de queratodermia rojo-anaranjada de aspecto céreo. Es característico el desarrollo de grados variables de eritrodermia.
La mayoría de los casos de PRP son adquiridos, aunque existen casos familiares esporádicos. Como desencadenantes se han considerado diversos factores ambientales, entre ellos las infecciones y particularmente el VIH.
Las PRP se clasifican según Griffiths28 en 5 grupos dependiendo de la edad, duración y tipo de afectación cutánea. Se ha propuesto un tipo VI para la forma de PRP que asocia la infección por el VIH29. Clínicamente los pacientes positivos para el VIH, además de las lesiones típicas, también pueden presentar lesiones nódulo-quísticas de acné conglobata e hidrosadenitis supurativa, además de espículas foliculares alargadas. Respecto al tratamiento suelen ser resistentes al convencional, tanto tópico como oral con acitretino. Sin embargo, pueden responder a la TARGA.
Pustulosis amicrobianasExisten diversas enfermedades que se manifiestan con pústulas estériles de polimorfonucleares y que se encuentran en el diagnóstico diferencial de la psoriasis pustulosa. Se clasifican en dos grupos según las pústulas se agrupen en el área palmoplantar (formas localizadas) o se encuentren dispersas por toda la superficie corporal (formas generalizadas). A continuación se describen brevemente tres entidades a modo de ejemplo:
Síndrome SAPHOLas pustulosis palmoplantares pueden asociarse a lesiones óseas inflamatorias estériles. El síndrome SAPHO es una entidad que se manifiesta frecuentemente con lesiones pustulosas localizas en la región palmoplantar y afectación ósea, especialmente de la pared torácica anterior. Su nombre es el acrónimo de sus manifestaciones más prevalentes: sinovitis, acné, pustulosis, hiperostosis y osteítis. El diagnóstico se establece en función de unos criterios clínicos establecidos, ya que las lesiones palmoplantares de forma aislada son indistinguibles de una psoriasis pustulosa palmoplantar.
Dermatosis pustulosa subcórnea o enfermedad de Snedon-WilkinsonSe trata de una dermatosis que afecta de forma predominante a mujeres de edad media. Las lesiones pustulosas se agrupan formando placas redondeadas o circinadas de predominio en el abdomen, y las zonas intertriginosas como las axilas y las ingles. La afectación palmoplantar es rara, así como la afectación de las mucosas.
Esta enfermedad tiene un curso cíclico: según desaparecen las pústulas antiguas se desprende una descamación superficial y se forman pústulas nuevas.
A diferencia de la psoriasis pustulosa suele responder bien a dapsona oral.
Pustulosis exantemática aguda generalizadaSe trata de un proceso agudo no recidivante que se ha relacionado clásicamente con múltiples fármacos, y más recientemente con las infecciones por enterovirus, la hipersensibilidad al mercurio y las picaduras de araña. Afecta de igual manera a cualquier grupo de edad y a ambos sexos.
La clínica se inicia de forma aguda con fiebre elevada durante dos o tres días. Las lesiones, en forma de pequeñas pústulas, se inician coincidiendo con la afectación del estado general en un pliegue o la cara, desde donde se extienden rápidamente. El cuadro se resuelve en una o dos semanas, con una descamación laminar generalizada.
Anatomía patológicaLa psoriasis que presentan los individuos positivos para el VIH es indistinguible desde el punto de vista histológico de la que tienen los pacientes no infectados. Sin embargo, los microabscesos de Munro aparecen con menos frecuencia en los pacientes infectados por el VIH, la acantosis es más irregular y con un adelgazamiento menos llamativo de la capa suprabasal30. También es más frecuente la presencia de queratinocitos necróticos.
En el infiltrado de los pacientes seropositivos es más frecuente observar células plasmáticas e histiocitos.
Mientras que en los pacientes negativos para el VIH la proporción de células CD4/CD8 en las lesiones de psoriasis se estima en 2,05, en los seropositivos esta proporción se invierte encontrándose la media del cociente CD4/CD8 en el intervalo 0,5-0,831.
PronósticoLa psoriasis no se considera una enfermedad diagnóstica de sida, ni influye en la supervivencia; sin embargo, sí determina una afectación importante de la calidad de vida de estos pacientes32. Por otra parte, alguno de los fármacos utilizados para su tratamiento puede tener repercusiones graves, tanto por su efecto inmunosupresor como por sus interacciones farmacológicas.
TratamientoDesde las primeras publicaciones que relacionan la psoriasis con la infección por el VIH se ha hecho hincapié en la resistencia que presentan estos pacientes al tratamiento convencional. Por otra parte, existen pocos datos en la literatura, especialmente casos aislados o series cortas.
Tratamiento antirretroviralEl agravamiento de las lesiones de psoriasis a medida que aumenta el grado de inmunosupresión sugirió que una de las estrategias terapéuticas era el tratamiento antirretroviral. En este sentido, con la introducción de los primeros medicamentos que actuaban específicamente contra el VIH, con zidovudina (AZT) como único fármaco disponible, se describieron varios casos de mejoría parcial de lesiones de psoriasis previamente refractarias a otros tratamientos33. El fármaco demostró ser útil y seguro, aunque con un mecanismo de acción antipsoriásico desconocido. Probablemente actúe disminuyendo la proliferación de los queratinocitos por su mecanismo de interferencia en la síntesis del ADN.
El inicio de las terapias combinadas ha hecho muy difícil valorar el efecto de estos fármacos por separado, por lo que no hay literatura al respecto. De la misma manera que la antigua monoterapia, las terapias combinadas actuales consiguen la mejoría clínica de las lesiones de psoriasis34, incluso en casos recalcitrantes y resistentes a otros tratamientos6,35,36. Anecdóticamente, algunos pacientes presentan exacerbaciones graves coincidiendo con el inicio de la TARGA37. La gravedad del cuadro se correlaciona con la mejoría de los valores de células CD4 + . Esta respuesta paradójica se ha relacionado con el síndrome de reconstitución inmune.
Pero aparte del efecto directo, reduciendo la frecuencia y la gravedad de las lesiones de psoriasis, la terapia antirretroviral disponible en la actualidad consigue un grado de reconstitución inmunitaria tal que los pacientes pueden ser capaces de tolerar tratamientos de la psoriasis con un efecto inmunosupresor que no eran admisibles en la era pre-TARGA.
Tratamiento tópicoCualquiera de los distintos tratamientos tópicos disponibles en el mercado para la psoriasis pueden ser utilizados en estos pacientes38. Sin embargo, puesto que las formas graves son frecuentes, suelen resultar insuficientes.
FototerapiaSu uso está ampliamente aceptado para el tratamiento de la psoriasis asociada a la infección por el VIH, así como en otras enfermedades que presentan los pacientes seropositivos como: prurito, eccema, prúrigo o foliculitis eosinofílica39. De hecho, tradicionalmente la fototerapia y los retinoides, solos o en combinación, han sido considerados el tratamiento de elección en la psoriasis que presentan los pacientes positivos para el VIH.
En pacientes seropositivos es posible utilizar tanto pautas con ultravioletas B (UVB), como psoralenos más ultravioletas A (PUVA)40. Sin embargo, existen algunos trabajos antiguos que recomiendan la terapia PUVA sobre la UVB41.
La exposición a dosis altas acumuladas de luz ultravioleta puede aumentar la carga viral cuando los pacientes no reciben tratamiento antirretroviral. Sin embargo, la exposición a pautas cortas de fototerapia en pacientes en tratamiento antirretroviral no empeora la situación basal previa. El fototipo influye en esta respuesta; así, los pacientes más pigmentados que requieren dosis más elevadas de radiación son más susceptibles al empeoramiento de su carga viral42.
La fototerapia empeora la evolución del sarcoma de Kaposi, por lo que su existencia es una contraindicación para este tipo de tratamiento.
RetinoidesTanto acitretino como etretinato son efectivos, especialmente en las formas de psoriasis eritrodérmica, pustulosa y palmoplantar. Esto, sumado al hecho de que no provocan inmunosupresión43, los convierte en fármacos de primera elección. Las dosis habituales se encuentran entre los 0,5-1 mg/kg/día44.
Por otra parte, las manifestaciones articulares también responden al tratamiento en la mayoría de los pacientes.
Aunque en general son muy bien tolerados45, un efecto secundario que puede limitar su uso es su influencia negativa sobre el perfil lipídico. En los pacientes positivos para el VIH existe una alteración de las lipoproteínas con aumento de los triglicéridos y ácidos grasos libres. Este perfil empeora con la introducción de la triple terapia antirretroviral. Si los valores de triglicéridos son muy elevados puede ser motivo de contraindicación o suspensión del tratamiento con retinoides.
Inmunosupresores: ciclosporina y metotrexatoLa inmunodepresión que caracteriza la infección por el VIH clásicamente se ha considerado una contraindicación absoluta para el tratamiento con metotrexato o ciclosporina en pacientes con psoriasis moderada-grave. La capacidad de ciclosporina para disminuir el recuento de células CD4 es bien conocida46. De hecho, se detectaron complicaciones graves por el uso de estos fármacos en pacientes muy inmunodeprimidos, como el sarcoma de Kaposi fulminante o la neumonía por P. jirovecii (anteriormente conocido como P. carinii)47. Por otra parte, la frecuente asociación de la infección por el VIH con un consumo excesivo de alcohol u otras drogas, o con infecciones crónicas por virus hepatotropos, limita el uso de estos fármacos.
A pesar del recelo de los dermatólogos de tratar a pacientes inmunosuprimidos, como los positivos para el VIH, con terapias que pudieran aumentar su grado de inmunosupresión, en casos seleccionados se utilizan para la artritis psoriásica o enfermedad de Reiter en pacientes VIH positivos48.
Existen publicaciones sobre el uso de la ciclosporina en fases iniciales de la infección por el VIH con resultados alentadores49. Su uso a dosis de 2 mg/kg/día en pacientes positivos para el VIH en fases iniciales con valores de CD4 > 500 mm-3 mostró un aumento de la carga viral, sin variaciones en los valores de CD4 ni aumento del riesgo de infecciones50.
La introducción de la TARGA y el cambio radical que ha supuesto inmunológicamente ha generado más seguridad entre los especialistas a la hora de prescribir estos fármacos51. Los estudios más recientes han probado el uso de metotrexato a largo plazo, demostrándose que es un fármaco seguro52. A pesar de esto, las complicaciones infecciosas y neoplásicas siguen apareciendo con mayor frecuencia que en la población seronegativa.
Terapias biológicasLa introducción de las terapias biológicas en los últimos años está suponiendo una nueva esperanza en el tratamiento de los pacientes con psoriasis e infección por el VIH. Profesionales de otras especialidades a través de su experiencia nos aportan datos sobre la seguridad y eficacia de estos fármacos en el tratamiento de otras patologías en pacientes positivos para el VIH53. Esto ha motivado a diferentes dermatólogos de todo el mundo a proponerlos como tratamiento a sus pacientes con resultados alentadores.
A pesar de que el uso de fármacos anti-TNF estaba contraindicado por las guías clínicas hasta hace relativamente poco54, a partir de la literatura más reciente se puede especular que su uso no parece aumentar de forma significativa las tasas de morbimortalidad de estos pacientes55. Tampoco parece que la inhibición del TNF-α afecte negativamente los recuentos de CD4 ni la carga viral12.
De todas formas, ya que el riesgo del uso de estos fármacos en pacientes positivos para el VIH no ha sido valorado por estudios controlados, es obligado durante el tratamiento realizar la terapia antirretroviral óptima, las profilaxis infecciosas recomendadas, así como un seguimiento clínico y analítico estrecho.
InfliximabEs ampliamente conocido el aumento en la susceptibilidad a patógenos intracelulares que provocan los fármacos que actúan bloqueando el TNF-α. Con respecto a los otros fármacos anti-TNF, infliximab presenta un riesgo mayor de reactivar tuberculosis latentes. Se cree que esto es debido a su efecto combinado como bloqueador de TNF-α e INF-γ56.
A pesar de ello existen diversas publicaciones en las que se ha utilizado para el tratamiento de la psoriasis o de otras enfermedades reumatológicas en pacientes positivos para el VIH con buenos resultados.
Bartke et al37 trataron un paciente de 46 años que presentó un brote de psoriasis grave con afectación cutánea y articular tras el inicio de la TARGA con didanosina, lamivudina y lopinavir. El brote no se controló con la combinación de acitretino 50 mg/día, prednisolona 30 mg/día, metotrexato 25 mg/semana, UVB, analgésicos y tratamiento tópico con triamcinolona acetónido 0,05 % y tazaroteno 0,025 %. Se instauró el tratamiento con infliximab a la dosis de 3 mg/kg, con lo que se obtuvo una mejoría rápida que empezó a los dos días de la infusión hasta el control del brote. La carga viral se mantuvo indetectable. Los niveles de CD4 + que inicialmente eran de 68 mm-3, ascendieron a 193 mm-3 con el inicio de la TARGA. Posteriormente descendieron con la terapia combinada de prednisolona y metotrexato, ascendiendo nuevamente a 107 mm-3 al iniciar el tratamiento con infliximab.
Sellam et al57 trataron dos pacientes con una artritis psoriásica grave, refractaria al tratamiento combinado con metotrexato y corticoides, y con afectación cutánea extensa con infliximab. Ambos pacientes presentaron una gran mejoría tanto a nivel articular como cutáneo, y durante los 2 y 4 años de tratamiento no presentaron complicaciones infecciosas ni neoplásicas.
El primer paciente inició el tratamiento con infliximab 6 meses después del comienzo de la TARGA con efavirenz, lamivudina y didanosina, presentando unos niveles de CD4 de 425 mm-3 y una carga viral < 50 copias en ese momento. Durante el tratamiento con infliximab los valores de CD4 se mantuvieron entre 350 y 480 mm-3. El ascenso de la carga viral hasta 2.818 copias/ml a los dos años motivó el cambio de la pauta de antirretrovirales.
El segundo paciente inició el tratamiento con infliximab en una situación inmunitaria muy comprometida, con unos niveles de CD4 de 16 mm-3 y una carga viral de 300.000 copias/ml. La terapia antirretroviral tuvo que ser modificada en varias ocasiones debido a efectos secundarios o aumentos de la carga viral. El uso de 7 fármacos simultáneamente (tenofovir, ritonavir, atazanavir, enfurvitide, estavudina, abacavir y lamivudina) logró unos niveles de CD4 de 233 mm-3 y una carga viral de 5.900 copias/ml a los 4 años de tratamiento con infliximab.
En ambos casos el tratamiento con metotrexato (a dosis de 20 y 12,5 mg/semana respectivamente) se mantuvo asociado a infliximab, así como la profilaxis de las infecciones oportunistas indicadas en cada caso en función del recuento de CD4.
Al respecto del uso de infliximab en el tratamiento de la enfermedad de Reiter existe un caso publicado de Gaylis en el que observó una buena respuesta58. Se trataba de un paciente de 41 años cuya enfermedad era grave y resistente a la combinación de corticoides y metotretaxo. Previo al inicio del tratamiento con infliximab realizaba cuádruple terapia antirretroviral y mostraba un recuento de CD4 de 770 mm-3, con una carga viral inferior a 500 copias/ml. Se inició tratamiento con infliximab, manteniendo metotrexato y disminuyendo progresivamente los corticoides hasta suspenderlos. A los dos meses la clínica cutánea se había resuelto, las molestias articulares estaban controladas y se habían normalizado los marcadores analíticos de actividad. A los 6 meses de tratamiento se mantuvo la mejoría clínica y tenía un recuento de CD4 de 814 mm-3, con una carga viral inferior a 400 copias/ml. Durante los 18 meses de tratamiento infliximab fue bien tolerado sin ningún efecto secundario.
Sin embargo, la prudencia debe ser la norma, ya que un paciente negativo para el VIH tratado con infliximab y ciclofosfamida por una artritis reumatoide presentó una disminución de los niveles de CD4 durante el tratamiento59.
EfalizumabHasta el momento en la literatura no hay ninguna referencia respecto del uso de efalizumab en pacientes positivos para el VIH. Sin embargo, en 4 ensayos clínicos realizados en pacientes negativos para el VIH y virus de la hepatitis C (VHC) se ha demostrado que la incidencia de infecciones no aumentaba entre los pacientes que recibían efalizumab y los del grupo placebo60.
EtanerceptUna revisión reciente sobre el uso de etanercept en la psoriasis y la artritis psoriásica concluye que es un tratamiento eficaz y seguro para pacientes infectados por el VIH o el VHC61. En pacientes con VHC, etanercept no modificó la carga viral, no afectó la función hepática ni aumentó el riesgo de infecciones62. De hecho en función de su efecto anti-TNF se ha probado como coadyuvante de la terapia con rivabirina e interferón para el tratamiento de la infección crónica por el VHC63.
Sin embargo, un paciente positivo para el VIH que presentaba recuentos de CD4 < 50 mm-3 y una carga viral de 4.200 copias/ml, a pesar de la terapia antirretroviral desarrolló una psoriasis en placas extensa con una afectación articular intensa que no respondió a diferentes tratamientos modificadores del curso de la enfermedad, incluyendo corticoides, hidrocloroquina y minociclina. Dada la progresión se decidió iniciar tratamiento con etanercept. A las tres semanas, con dosis de 25 mg dos veces por semana, las lesiones cutáneas mejoraron de forma drástica y la artritis se estabilizó. Durante 4 meses el recuento linfocitario y la carga viral se mantuvo estable, pero experimentó infecciones polimicrobianas recurrentes por gérmenes como S. maltophilia y P. aeruginosa, por lo que se decidió suspender el tratamiento64.
Recientemente se ha publicado el primer caso de un paciente coinfectado por el VIH y el VHC que fue tratado con etanercept65. Sufría una artritis psoriásica grave asociada a lesiones cutáneas de psoriasis que no respondió a la combinación de metotrexato y ciclosporina. Dosis de etanercept de 25 mg dos veces por semana consiguieron la remisión del cuadro cutáneo y articular.
La experiencia existente con etanercept para el tratamiento de otras patologías distintas de la psoriasis en pacientes positivos para el VIH también avala su seguridad, como en el caso de un paciente positivo para el VIH con una artritis reumatoide grave y resistente al tratamiento convencional que respondió a etanercept, manteniendo su carga viral controlada con la terapia antirretroviral66.
Riesgo de interacciones farmacológicas en el tratamiento de la psoriasisLos pacientes positivos para el VIH habitualmente deben recibir diversos fármacos, tanto para el tratamiento del virus como para la profilaxis de las infecciones oportunistas asociadas. Este hecho obliga a aumentar las precauciones a la hora de prescribir otros fármacos.
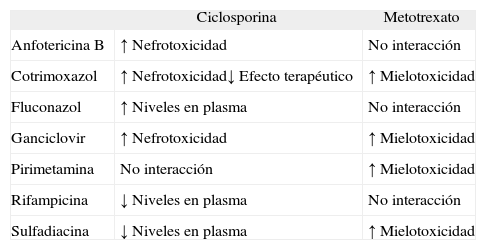
En primer lugar deberían evitarse aquellos fármacos que pueden desencadenar brotes de psoriasis, que se hallan recogidos en la tabla 2.
El uso de trimetoprim-sulfametoxazol para el tratamiento o la profilaxis primaria o secundaria del P. jirovecii en pacientes en tratamiento con metotrexato favorece la inhibición de la vía metabólica del folato que realiza el metotrexato, a la vez que disminuye su excreción renal, con el consiguiente riesgo de toxicidad hematológica. Respecto a la asociación de ciclosporina y cotrimoxazol se ha observado un deterioro reversible en la función renal en pacientes con un trasplante renal67. También se ha observado una disminución de la actividad de ciclosporina cuando se administra en asociación con sulfamidas.
Ganciclovir, fármaco utilizado para el tratamiento y la profilaxis secundaria de la infección por citomegalovirus (CMV), es mielotóxico y nefrotóxico68. La mielotoxicidad es reversible, pero su riesgo aumenta si se administra de forma simultánea con otros fármacos mielotóxicos como metotrexato. La nefrotoxicidad puede limitar el uso de ciclosporina en pacientes que estén en tratamiento con ganciclovir.
Sulfadiazina, fármaco utilizado en el tratamiento y la profilaxis del T. gondii mediante la inducción del citocromo 3A4, ocasiona una reducción de los niveles plasmáticos de ciclosporina, y por tanto la pérdida de su eficacia como inmunosupresor69. En el caso del uso de sulfadiazina en asociación con metotrexato se ha visto un aumento de los efectos secundarios hematológicos por desplazamiento proteico.
Pirimetamina, fármaco que se utiliza en combinación con sulfadiazina en el tratamiento y la profilaxis de T. gondii, por su mecanismo de acción deprime el metabolismo del folato. Por tanto, en pacientes que reciben metotrexato puede potenciar su toxicidad hematológica. En pacientes en edad pediátrica con leucemia que afecta al sistema nervioso central, esta combinación ha provocado convulsiones.
El uso de fluconazol, fármaco utilizado para la profilaxis secundaria del C. neoformans, en pacientes en tratamiento con ciclosporina, puede aumentar las concentraciones plasmásticas de esta última.
La anfotericina B, tratamiento de elección de C. neoformans, puede potenciar el efecto nefrotóxico de ciclosporina cuando se administran conjuntamente70.
Rifampicina, usada para el tratamiento de la tuberculosis, puede disminuir el efecto de ciclosporina.
La asociación de los otros fármacos utilizados en la profilaxis o el tratamiento de la tuberculosis (isoniazida, rifampicina y pirazinamida) y el M. avium intracellullare (claritromicina) no ha mostrado interacciones destacables con los diferentes fármacos utilizados en el tratamiento de la psoriasis.
Estas interacciones se resumen en la tabla 3.
Interacciones farmacológicas entre los fármacos utilizados para el tratamiento de la psoriasis y las infecciones oportunistas
| Ciclosporina | Metotrexato | |
| Anfotericina B | ↑ Nefrotoxicidad | No interacción |
| Cotrimoxazol | ↑ Nefrotoxicidad↓ Efecto terapéutico | ↑ Mielotoxicidad |
| Fluconazol | ↑ Niveles en plasma | No interacción |
| Ganciclovir | ↑ Nefrotoxicidad | ↑ Mielotoxicidad |
| Pirimetamina | No interacción | ↑ Mielotoxicidad |
| Rifampicina | ↓ Niveles en plasma | No interacción |
| Sulfadiacina | ↓ Niveles en plasma | ↑ Mielotoxicidad |
En el momento actual la terapia antirretroviral, con combinaciones de al menos tres fármacos, constituye el tratamiento de inicio de elección de la infección crónica por el VIH. Estas pautas deben incluir dos inhibidores de la transcriptasa inversa análogos de los nucleósidos más un análogo no nucleósido, o la combinación de dos inhibidores de la transcriptasa inversa análogos de los nucleótidos nucleósidos y un inhibidor de la proteasa.
No existen estudios controlados sobre el efecto de los diferentes fármacos antirretrovirales en combinación con los fármacos utilizados para el tratamiento de la psoriasis. Por ello, el riesgo de interacciones farmacológicas se calcula únicamente de forma teórica al conocerse el mecanismo de acción de los diferentes fármacos.
Algunos inhibidores de la transcriptasa inversa análogos de los nucleósidos, especialmente AZT, pueden provocar grados variables de mielotoxicidad. Por ello, no sería recomendable su uso en combinación con metotrexato. Se recomienda evitar la asociación de tenofovir, otro inhibidor de la transcriptasa análogo de los nucleósidos, con fármacos nefrotóxicos como ciclosporina por riesgo de aumento de la toxicidad renal.
Algunos inhibidores de la transcriptasa inversa no análogos de los nucleósidos, especialmente delavirdina, actúan sobre el CYP3A4, por lo que es posible que reduzcan el metabolismo de ciclosporina, incrementándose su concentración plasmática71.
Algunos inhibidores de la proteasa, como ritonavir o nelfinavir, son inductores de las UDP-glucuroniltransferasas. Además, ritonavir es un potente inductor del citocromo p450. A pesar de que estas características determinan interacciones con múltiples fármacos72, entre ellos no se encuentran metotrexato ni ciclosporina. Sin embargo, debido al efecto inhibidor de los inhibidores de la proteasa sobre el CYP3A4 es posible que se reduzca el metabolismo de ciclosporina incrementándose su concentración plasmática. En este sentido se ha observado que en pacientes trasplantados de hígado o riñón, tratados con inhibidores de la proteasa, es necesario ir reduciendo progresivamente la dosis de ciclosporina a lo largo del tiempo debido a un aumento en su absorción73.
Los retinoides se eliminan mediante la enzima alcohol deshidrogenasa. Es posible la interacción con abacavir, un inhibidor de la transcriptasa análogo de los nucleósidos que se metaboliza por esta vía, pero esta relación no ha sido demostrada en la clínica. Por otra parte, la asociación de acitretino a fármacos inhibidores de la proteasa puede potenciar su efecto negativo sobre el perfil lipídico.
ConclusionesEl dermatólogo observador podría sospechar una infección por el VIH no conocida previamente a través de la observación de las lesiones cutáneas de psoriasis en pacientes con una infección por el VIH asintomática y en fases precoces de la enfermedad. En estos pacientes la psoriasis revela la existencia de una enfermedad sistémica y es la clave para el diagnóstico precoz.
Respecto del tratamiento de la psoriasis la experiencia sobre el tratamiento de pacientes infectados por el VIH con terapias inmunosupresoras es limitado. Probablemente las terapias biológicas supongan un arma más a tener en cuenta en el tratamiento de la psoriasis en pacientes positivos para el VIH. Sin embargo, la prudencia obligaría a reservar dicha terapia para pacientes en fases iniciales de la infección o que siguen tratamiento antirretroviral, especialmente los que mantienen recuentos de CD4 dentro de los límites de la normalidad (359–1.519 mm-3) o ligeramente disminuidos. Es en estos pacientes donde la relación riesgo-beneficio puede ser más favorable.
No debemos olvidar, por otra parte, que los pacientes pueden estar recibiendo otros tratamientos por su enfermedad de base, por lo que es fundamental en el momento de iniciar un tratamiento tener en cuenta las diferentes interacciones farmacológicas que existen entre los diferentes fármacos.
Declaración de conflicto de intereses
La Dra. Leal declara que no tiene ningún conflicto de intereses. El Dr. M. Ribera declara haber participado en ponencias remuneradas de Wyeth, Merck-Serono, Scheung-Plough y Novartis. El Dr. E. Daudén realiza o ha realizado las siguientes actividades: miembro de Advisory Board, consultor, recepción de becas, apoyo a la investigación, participación en ensayos clínicos, honorarios por impartir ponencias, con las siguientes compañías farmacéuticas: Abbott, Astellas, Biogen, Galderma, Glaxo, Janssen-Cilag, Leo Pharma, Merck-Serono, Novartis, Schering-Plough, Stiefel, Wyeth Pharmaceuticals, 3 M.