INTRODUCCION
Los avances en la tecnología han supuesto una presencia importante de los láseres en medicina. En dermatología, el tratamiento con láser constituye una importante arma terapéutica en un gran número de trastornos cutáneos. Por ello, es útil para el clínico, comprender y conocer sus aplicaciones y mantenerse al corriente de los rápidos avances tecnológicos en el láser dermatológico. Esta revisión sólo intenta aportar alguna de las últimas novedades aparecidas en este campo en los últimos años, pero no pretende llevar a cabo una revisión minuciosa del tratamiento láser en dermatología. El artículo se ha dividido en los siguientes apartados:
1.Sistemas de enfriamiento epidérmico.
2.Láseres en lesiones vasculares.
3.Láseres en lesiones pigmentadas.
4.Láseres, luz y acné.
5.Láser en depilación.
6.Rejuvenecimiento facial con láser ablativo y no ablativo.
7.Diagnóstico-láser.
8.Láser en psoriasis y otras patologías.
9.Otros procesos patológicos.
SISTEMAS DE ENFRIAMIENTO EPIDÉRMICO
Hoy día existen diversos sistemas de enfriamiento cutáneo destinados básicamente a aumentar el umbral de lesión térmica de la epidermis, protegiéndola así del daño fotónico del láser. Mediante un adecuado empleo de estos sistemas pueden minimizarse los riesgos de la irradiación láser de una epidermis sana, maximizando el daño térmico en el cromóforo diana1. Los sistemas de enfriamiento determinan una disminución del dolor, de la inflamación y del riesgo de quemaduras1,2. De igual forma, permiten administrar fluencias más altas de una forma segura para el tratamiento de lesiones resistentes, con menor riesgo de alteraciones cicatrizales epidérmicas3,4. Asimismo permiten tratar pacientes de pieles más oscuras, en los que existe importante absorción de la irradiación láser por la melanina, con el consiguiente aumento de temperatura epidérmica y riesgo de lesión térmica letal. El enfriamiento en estos pacientes corrige esta competición de la melanina por la irradiación láser, evitando la aparición de alteraciones cicatrizales1,3,5.
Todos los métodos de enfriamiento tratan básicamente de eliminar calor de la superficie cutánea mediante la conducción a un medio externo. Las diferencias entre los distintos métodos radican en la cantidad de calor que eliminan, cuándo y mediante qué medio externo1. Existe un límite intrínseco en el enfriamiento cutáneo que vendría limitado por la congelación letal epidérmica que ocurre aproximadamente a 10 °C. El calor generado por el tratamiento láser que puede dañar la epidermis proviene de la absorción directa de la luz incidente por la melanina epidérmica, de la absorción directa de la luz incidente por la diana y de la refracción interna de la luz y dispersión en la superficie cutánea.
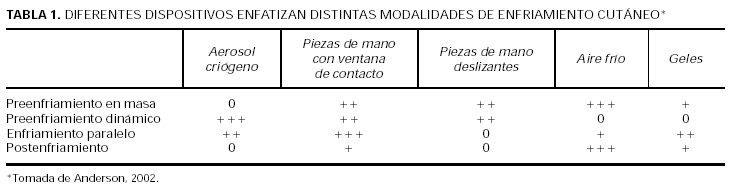
Hoy en día hay cuatro formas de enfriamiento cutáneo6 (tabla 1).
1. Preenfriamiento en masa. Enfriamiento de todo el espesor cutáneo previo a la administración de luz. Disminuye el riesgo de quemaduras de tercer grado y el de dolor6.
2.Preenfriamiento dinámico. Enfría la epidermis antes de la administración de la luz láser. Proporciona protección epidérmica para pulsos cortos (< 10 ms)7,8.
3.Enfriamiento paralelo. Enfría la epidermis durante la administración de la luz. Proporciona protección epidérmica para pulsos largos (> 10 ms)7,8.
4.Postenfriamiento. Enfría toda la piel tras la administración de luz. Disminuye el dolor y la inflamación tras el tratamiento6.
En la práctica existen diversos sistemas mecánicos (líquidos, sólidos o gaseosos) para la aplicación de los métodos de enfriamiento descritos. Los sistemas más utilizados son: aplicación de aerosol criógeno, enfriamiento por contacto, enfriamiento mediante aire frío, geles acuosos y bolsas de hielo.
Aplicación de aerosol criógeno
El tetrafluoroetano no es inflamable, no es tóxico ni daña la capa de ozono. Suele emplearse para llevar a cabo un preenfriamiento dinámico7. Está indicado en el tratamiento de las lesiones vasculares superficiales y profundas2,3,9,10, en el rejuvenecimiento no ablativo1,11-13 y en la fotodepilación1,6,14. El criógeno líquido es atomizado mediante un aerosol orientado exactamente en el área que impacta el láser. La rápida evaporación del criógeno a 60 °C extrae calor de la superficie cutánea6. Proporciona un enfriamiento cutáneo eficaz, rápido y espacialmente selectivo. Cuando el criógeno se aplica sobre la superficie cutánea en un breve período de tiempo, habitualmente decenas de milisegundos, la distribución espacial del enfriamiento queda restringida a la epidermis15. la temperatura dérmica se mantiene, por tanto, invariable y no interfiere en el efecto fototermolítico de la irradiación láser en estructuras dérmicas2,3,9,16. Esta premisa es básica para conseguir protección epidérmica sin disminuir la eficacia del láser. Se estima que son suficientes pulsos de 50-60 ms para conseguir enfriamiento hasta la membrana basal6. No obstante, el concepto de selectividad espacial óptima ha ido más allá, y se alcanza cuando la diferencia de temperatura entre el cromóforo diana y la membrana basal de la epidermis es máxima17. Estudios basados en modelos informáticos indican que, a pesar de que los pulsos mayores de 100 ms pueden enfriar un hipotético cromóforo diana que se encuentre en la dermis superficial, enfrían proporcionalmente más la membrana basal, por lo que nos acercaríamos a la definición de selectividad espacial óptima17 (mayor diferencia de temperatura entre cromóforo y capa basal).
La existencia de criógeno líquido sobre la superficie cutánea cientos de milisegundos tras la aplicación del aerosol determina que el enfriamiento se prolongue mediante la evaporización del criógeno, siendo ésta máxima en los primeros milisegundos tras el depósito del criógeno en la superficie cutánea2,5. Esta es la razón por la que en los dispositivos de enfriamiento dotados de aerosol criógeno no sólo puede calibrarse la duración del pulso, sino también la dilación entre la finalización del pulso criógeno y el inicio del pulso láser. La evaporación extrae más calor durante el pulso que cuando todo el criógeno está depositado en la piel; por eso, en vez de emplear 30 ms de pulso y 30 ms de dilación, suelen utilizarse 30-50 ms de pulso y 10-20 ms de dilación3,18,19. No obstante, no debe olvidarse que estos parámetros no están todavía perfeccionados, y modelos informáticos apuntan a que pulsos de 100-250 ms de aerosol criógeno6,20 proporcionan más protección epidérmica y selectividad espacial que pulsos de 30-50 ms6,17,20. Es más, se requerirían pulsos criogénicos de hasta 200 ms para contrarrestar el calor epidérmico generado por altas fluencias de la irradiación láser en sujetos pigmentados16.
El pulso y la dilación entre el término de la emisión del vaporizador y el pulso del láser se controlan electrónicamente, lo que trae como resultado un enfriamiento predecible con selectividad espacial reproducible9. El aerosol criógeno es el sistema de enfriamiento de elección cuando el pulso láser es menor de 10 ms y el cromóforo se localiza en la dermis superficial6,21.
El área de piel vaporizada y el coeficiente de extracción térmica varían con la distancia de la boquilla del aerosol criógeno a la superficie de la piel. A mayor distancia aumenta el diámetro medio de las gotas y el área de piel vaporizada, con lo que se obtiene un menor enfriamiento de la superficie cutánea22,23.
Un inconveniente de la aplicación del aerosol criógeno es la formación de escarcha en la superficie cutánea por condensación del vapor atmosférico, sobre todo en ambientes húmedos5,23, que puede ocasionar refracción óptica de hasta el 10 % de la irradiación láser6. Además actúa como aislante térmico, lo que supone una pérdida en la capacidad de extracción térmica5. Sin embargo, reduce el riesgo de lesión criogénica de la epidermis en enfriamientos prolongados5. La escarcha comienza a formarse a los 100 ms de haberse depositado el criógeno en la superficie cutánea, por lo que una demora de 10-30 ms entre el final del pulso del criógeno y el láser impide su formación2,17.
Enfriamiento por contacto
Se trata de dispositivos constituidos por piezas de mano con ventanas de contacto de cristal de zafiro entre 10 y 4 °C, que son atravesadas por el haz del láser1. Con menos frecuencia se emplean planchas frías metálicas que se deslizan manualmente antes de emitir el pulso del láser24. Está indicado principalmente en el tratamiento con láser de las lesiones vasculares profundas de mediano y grueso calibre y en la fotodepilación1. El empleo de ventanas frías de cristal de zafiro es el mejor método para llevar a cabo el enfriamiento paralelo7, ya que se extrae el calor a la vez que aplicamos un pulso de láser largo (> 10 ms) a través de la pieza6.
No obstante, varios autores han comunicado varios inconvenientes de la técnica. En la práctica, la resistencia térmica en la interfase de la superficie intervenida y el cristal deteriora la extracción del calor al medio externo. Aire, burbujas, pelos, anestésicos y otras sustancias pueden impedir el contacto directo entre la superficie de la piel y el cristal helado1. En determinadas situaciones la pieza de mano es poco manejable y no se adapta a los contornos faciales. La duración del pre y postenfriamiento se controla manualmente en muchos casos. Esto determina que la distribución espacial del enfriamiento sea difícilmente controlable y reproducible25. El gradiente de temperatura que se requiere para obtener selectividad espacial óptima es muy difícil de conseguir, por lo que la técnica se emplea cuando los cromóforos no se encuentran en dermis superficial1. Finalmente, el agua condensada en el cristal a temperaturas por debajo de 0 °C se congela, sobre todo en ambientes húmedos, acumulándose una capa de hielo. Cuando incide la luz de láser se produce refracción de una parte de la misma, lo que conlleva una disminución de la energía que llega al cromóforo6.
Las planchas de mano frías metálicas deslizantes se emplean en láser de Nd:YAG (neodinium: Yttrium Aluminium Garnet) (CoolGlide, Altus Medical Inc., Burlingame, California), y proporcionan preenfriamiento en masa y, en menor medida, preenfriamiento dinámico; este último depende de la rapidez con la que el dermatólogo deslice la pieza de mano7.
Enfriamiento mediante aire frío
Raulin et al26 fueron pioneros en el empleo de aire frío en el tratamiento láser de hipertricosis, nevus flammeus, hemangiomas, telangiectasias y tatuajes, lo que permitió el uso de fluencias más altas con menor incidencia de efectos secundarios (eritema, púrpura y costra postoperatoria). El aire frío como sistema de enfriamiento se caracteriza por su baja velocidad de enfriamiento, debido a que su coeficiente de transferencia térmica es bajo1. Por tanto, se requieren períodos de enfriamiento largos (varios segundos) para conseguir un descenso significativo de la temperatura en la membrana basal7. El resultado final suele ser un enfriamiento en masa de la piel, con escasa selectividad espacial. Por esta razón suele tratarse del método que más analgesia proporciona en sí mismo7,27. Este sistema de enfriamiento está indicado principalmente en el tratamiento láser de lesiones vasculares profundas de mediano y grueso calibre y en la fotodepilación6.
Existe protección epidérmica añadida cuando se irradia piel húmeda enfriada con aire, ya sea agua o gel transparente de ultrasonidos4. No obstante, el gel es más fácil de usar, porque el agua desaparece rápidamente del campo quirúrgico por evaporación y porque es empujada por el aire frío.
El aire frío se emplea para preenfriamiento y postenfriamiento de la piel cuando se utilizan piezas de enfriamiento por contacto. Sin embargo, el preenfriamiento cutáneo con aire frío previo a la aplicación de aerosol criógeno puede prolongar el tiempo de contacto del criógeno con la piel, y llegar a producir lesiones. Sin embargo, si el aire frío se emplea tras la aplicación del aerosol, aumenta la evaporación de éste, que desaparece tres veces más deprisa16. Esta evaporación acelerada implica aumentar la eficacia del enfriamiento y evitar la formación de escarcha16.
Geles acuosos
La extracción de calor de la superficie cutánea con los métodos anteriormente descritos se ve limitada por el estrato córneo, el cual posee una conductividad muy baja por su escaso nivel de hidratación. Una fina capa de gel puede incrementar la conductividad de la capa córnea1, y es útil por tanto como coadyuvante en cualquier sistema de enfriamiento1,7. Además el gel frío, por sí mismo, extrae calor de la epidermis.
Bolsas de hielo
Fue el primer sistema de enfriamiento empleado28. Proporciona preenfriamiento y postenfriamiento en masa24.
La penetración anatómica del enfriamiento dependerá del tiempo de enfriamiento y en su caso de la capacidad de extracción térmica del criógeno. La epidermis se enfría en décimas de milisegundo, mientras que un enfriamiento en masa de la piel requiere varios segundos6. Si los cromóforos diana se encuentran en la dermis superficial, el tiempo de enfriamiento debe ser breve. Los parámetros ideales de enfriamiento deberían seleccionarse basándose en las características de un paciente concreto, dependiendo del grosor y pigmentación epidérmica, y de la profundidad, el tamaño y la densidad del cromóforo diana. Por ejemplo, en el caso de malformaciones capilares superficiales y rejuvenecimiento no ablativo, se requiere elevada selectividad térmica, ya que los cromóforos diana se encuentran en la dermis superficial. Para estructuras profundas, como es el caso del folículo piloso, los tiempos de enfriamiento pueden ser más prolongados1.
Los sistemas de enfriamiento son fundamentales en la depilación láser1,6,14, el rejuvenecimiento no ablativo1,11-13 y en el tratamiento de lesiones vasculares2,3,9,10,27. Ya en 1995, Nelson et al29 comunicaron que la aplicación de aerosol criógeno (20-80 ms) en el tratamiento láser de colorante pulsado 585 nm de los angiomas planos le permitía utilizar parámetros (10 J/cm2, 450 ms) que de otro modo determinaban la necrosis epidérmica. La utilización de un sistema de enfriamiento dinámico con aerosol criogénico o aire frío y láser de colorante pulsado 585-595 nm a altas fluencias en el tratamiento de angiomas planos mejora la respuesta clínica a la vez que minimiza el daño epidérmico15,21,27,30,31. De igual forma, la disminución del dolor debida al tratamiento láser más un sistema de enfriamiento (junto con los anestésicos tópicos) ha permitido disminuir el porcentaje de intervenciones con anestesia general en niños32. En una cohorte de 196 pacientes, Chang y Nelson3 emplearon enfriamiento dinámico (pulso de 50 ms, dilación 10 ms) y fluencias elevadas en la mitad (8-10 J/cm2), aplicando menores fluencias (5-7 J/cm2) sin sistema de enfriamiento en la otra mitad. Obtuvo diferencias estadísticamente significativas en el blanqueamiento conseguido a favor del primer grupo. De igual modo, hubo menor incidencia de alteraciones cicatrizales y alteraciones de la pigmentación, a pesar del empleo de mayor fluencia.
En el tratamiento del angioma plano es importante que el enfriamiento permanezca confinado en las 100-200 mm superficiales de la piel, por lo que la selectividad espacial debe ser máxima, con control de los tiempos de enfriamiento5,17. Pfefer et al8 desarrollaron el primer estudio experimental en el que se analizaban conjuntamente parámetros del láser y del preenfriamiento dinámico. Mediante modelos informáticos de distribución espacial, establecieron como óptimo 60 ms de pulso criogénico, con pulsos de láser de 2 ms. Esta combinación de parámetros proporciona coagulación vascular hasta una profundidad de 300 mm, sin coagulación epidérmica.
En los pacientes muy pigmentados (fototipos V-VI), incluso con eficiencia de enfriamiento del 100 %, no conseguimos proteger de manera adecuada la epidermis si se emplean pulsos aislados de láser de colorante pulsado y de aerosol criógeno. Para intentar solucionar este problema, estudios recientes han postulado optimizar la duración del pulso del aerosol criógeno para maximizar la diferencia de temperatura entre la epidermis y los vasos del angioma plano17,33. Otros estudios se han centrado en incrementar la tasa de extracción de calor de la superficie cutánea con diferentes estrategias, como la variación del diámetro de la boquilla del aerosol34,35, de la distancia de la piel a la boquilla22,23, del tamaño de las gotas y densidad del aerosol36, e incrementando la evaporación de la película de criógeno16. Aguilar et al20 evaluaron, empleando un modelo informático, la conveniencia de aplicar pulsos múltiples de láser alternándolos de modo intermitente con pulsos de criógeno. Con múltiples pulsos de láser la temperatura de los vasos puede incrementarse paulatinamente, a la vez que los pulsos intermitentes de aerosol criógeno (50-60 ms) están protegiendo la epidermis, suministrando la protección epidérmica necesaria para fototipos V-VI.
En el tratamiento de hemangiomas, si se emplea un sistema de enfriamiento dinámico con fluencias elevadas (9-10 J/cm2) de láser de colorante pulsado de 585 nm, se obtienen mejores resultados que al emplear menores fluencias (5,5-8 J/cm2) sin sistema de enfriamiento. Chang et al10 encontraron diferencias significativas en el número de sesiones y en la mejoría clínica de los hemangiomas (extensión, volumen, textura y color).
El empleo de un sistema de enfriamiento dinámico en el láser de resurfactación no ablativo es un método seguro y efectivo para proteger la epidermis selectivamente y de ese modo evitar de manera significativa la morbilidad asociada a este procedimiento1,11-13. De igual modo, se han incorporado tanto piezas de contacto frías como aerosol criógeno a los dispositivos láser para tratar telangiectasias en piernas y cara7,37-39. Permiten emplear fluencias elevadas con menor incidencia de efectos secundarios. El enfriamiento está justificado, sobre todo en las piernas, ya que, debido a la elevada presión hidrostática en estos vasos, se emplean altas fluencias en su tratamiento1,39-42.
Los pulsos largos y fluencias altas de los láseres empleados en fotodepilación hacen recomendable el empleo de sistemas de enfriamiento paralelos, sobre todo en fototipos pigmentados7,14,43,44. Debido a la profunda localización de la melanina del bulbo piloso, pueden aplicarse enfriamientos largos (> 100 ms) sin comprometer la selectividad espacial7, por lo que las ventanas de contacto frías de cristal de zafiro son el método más empleado14.
LÁSERES EN LESIONES VASCULARES
Desde la aparición en 1980 del láser de colorante pulsado, basado en el principio de fototermólisis selectiva para el tratamiento de malformaciones vasculares cutáneas superficiales, se han introducido algunas modificaciones para intentar incrementar su eficacia o para disminuir sus efectos secundarios y complicaciones45,46.
Longitud de onda. Se ha incrementado desde 577 nm hasta 585, 590, 595 y 600 nm. Aunque la absorción máxima se produce a 577 nm, aumentando la longitud de onda se obtiene una menor absorción por la oxihemoglobina (compensada con un aumento de la energía administrada), pero una mayor penetración cutánea47. Aunque la longitud de onda más empleada hoy día es probablemente 595 nm, Chang ha mostrado recientemente en un estudio retrospectivo de 64 pacientes con manchas de vino de Oporto, que el aclaramiento con 585 nm es superior al de 595 nm. Sin embargo, hay que considerar que utiliza en ambos casos similares rangos de fluencias48.
Duración del pulso. La duración del pulso se ha incrementado (desde 0,5 hasta 40 ms) para tratar de coagular vasos de mayor tamaño49 y para producir un calentamiento lento del vaso que permita reducir el efecto purpúrico tras el tratamiento. Asimismo, los vasos de menor calibre (no dilatados) quedan preservados ya que pulsos largos permiten un enfriamiento intrapulso de dianas menores del mismo cromóforo (selectividad termocinética). Para el tratamiento de cuperosis pueden emplearse pulsos largos, en ocasiones con varios pases, que producen mayor eritema y edema de corta duración (24-48 h). El umbral de energía necesario para producir «púrpura» aumenta al alargar el pulso. Sin embargo, la respuesta es mayor cuando el efecto purpúrico es más intenso. Por lo tanto, en función del paciente, se optará por tratamientos más intensos (purpúricos) con respuestas más rápidas o tratamientos más lentos con menor respuesta purpúrica. Para el tratamiento de las manchas en vino de Oporto es necesario utilizar dosis purpúricas50. Se ha propuesto la utilización de vitamina K tópica para disminuir la intensidad y duración del efecto purpúrico51.
Entre los inconvenientes encontramos que, con pulsos largos, se requieren mayores fluencias para producir coagulación (podrían dañar la epidermis y la dermis perivascular a fluencias altas) y que pulsos demasiado largos pueden no ser capaces de tratar vasos dilatados de menor calibre.
Diámetro del haz. El uso de aplicadores de gran diámetro permite tratamientos más rápidos, más uniformes, con más densidad fotónica central y con mayor lesión vascular a menores fluencias. Con diámetros mayores se requiere menos energía para producir «púrpura». De igual forma, teóricamente el haz penetra más profundamente debido a la menor dispersión de la luz.
Telangiectasias lineales de cara y nariz
Existen muchos láseres capaces de tratar este tipo de lesiones. El láser pulsado KTP 532 nm (luz verde) es muy eficaz y no produce púrpura postratamiento52-54. También son efectivos otros láseres de luz amarilla, como los de colorante pulsado, kriptón y láseres de onda continua (argón sintonizable, vapor de cobre)55. Aunque la luz amarilla parece proporcionar una mayor especificidad en el tratamiento de lesiones vasculares al coincidir con el pico beta de absorción de la oxihemoglobina, pueden usarse asimismo otras longitudes de onda como el láser de Nd:YAG 1.064 nm (especialmente en vasos más profundos de mayor calibre y aspecto azulado), el láser de argón de onda continua (para telangiectasias lineales faciales), láser de alejandrita (ms) y láser de diodo (ms), siendo también muy eficaz la luz intensa pulsada (LIP). En cuperosis o eritemas difusos será más adecuado el láser de colorante pulsado o la LIP.
Telangiectasias en piernas («varículas»)56-60. La escleroterapia sigue siendo hoy día el método de elección en el tratamiento de estas lesiones. Sin embargo, la terapia láser ha avanzado mucho en los últimos años. Han aparecido láseres con una duración de pulso más prolongada y de longitudes de onda mayores que penetran más en el tejido, asociados a sistemas de enfriamiento epidérmico. Son especialmente útiles en vasos del pie y alrededor del tobillo.
Antes de realizar cualquier tratamiento, habrá que asegurarse de que no existe reflujo. El láser de colorante pulsado (LCP), especialmente con pulsos largos, puede ser útil para vasos de pequeño calibre (< 1 mm de diámetro)61. Existen en el mercado fundamentalmente 4 LCP de pulso largo: 2 láseres de 1,5 ms (Scleroplus [Candela] y Photogenica VLS [Cynosure] y 2 de pulsos de hasta 40 ms (Photogenica V-Star [Cynosure]) y V-Beam [Candela]). Se han usado asimismo otros láseres para el tratamiento de las telangiectasias o «varículas» en extremidades inferiores (como KTP pulsado62,63 (Versapulse [Lumenis], Illustra [Cynosure], Ayra-Orion [Laserscope], Diolite [Iriderm]), alejandrita pulso largo64 (Apogee [Cynosure], GentleLASE [Candela], EpiTouch [Lumenis]), diodo65 (LightSheer [Lumenis] y FeatherLite [Laserlite]) y Nd:YAG 1.064 nm de pulso largo (hasta 100 ms) (Coolglide [Altus], Lyra [Laserscope], CoolTouch Varia [Cooltouch], Vasculight [Lumenis], VeinLase [HGM Medical]) y láser de luz amarilla 578 nm cobre-bromo66, así como luz pulsada intensa67 (Photoderm VL [Lumenis]). También se han utilizado tratamientos combinando diversos láseres y luz pulsada68. Para vasos de mayor calibre (violáceos, de más de 1 mm de diámetro) el láser de Nd:YAG 1.064 nm pulsado69-71 es una buena opción, debido a su mayor poder de penetración. Así, por ejemplo, recientemente se han obtenido buenos resultados (aclaramiento de más del 75 % en varículas reticuladas de piernas entre 1 y 3 mm) con láser Nd:YAG 1.064 nm, un tratamiento con pulsos de 50 ms y fluencias72 de 100 J/cm2.
En recientes estudios comparativos, el láser Nd:YAG 1.064 nm pulsado parece superior en resultados y más seguro en fototipos más altos (V) al láser de diodo y alejandrita en el tratamiento de vasos de 0,3 a 3 mm de diámetro73. En ocasiones, puede haber complicaciones como hiperpigmentación, o formación de trombos, e incluso se han descrito ulceraciones, a veces por dañar vasos arteriales, por sobreponer múltiples pulsos o por insuficiente enfriamiento epidérmico. También se han combinado tratamientos con LIP y láser pulsado de Nd:YAG en telangiectasias de piernas68,74. La introducción de fibras láser por vía intravenosa es otra técnica novedosa con gran futuro71-77. Sin embargo, los resultados del tratamiento de las varículas de extremidades inferiores son todavía poco predecibles y los parámetros no están todavía bien tipificados.
Malformaciones capilares superficiales
Las malformaciones capilares (o venulares) superficiales (nevo flámeo, manchas en vino de Oporto o angiomas planos) pueden tratarse con diversos láseres. Hoy día existe un amplio consenso en la utilización del LCP como tratamiento de primera línea en estos pacientes, particularmente en niños. Sin embargo, la erradicación completa de la lesión se produce sólo en una pequeña minoría de pacientes. La gran mayoría de pacientes tratados con el LCP presentan un aclaramiento parcial de su lesión, en menor o mayor grado. La mejor respuesta se obtiene en las lesiones más superficiales, con independencia de su color. Las lesiones localizadas en cuello y párpados presentan una buena respuesta. La zona centrofacial presenta peor respuesta que las zonas faciales laterales. El diámetro de los vasos y su profundidad puede estar parcialmente anticipado por el color y la localización de la lesión. La aplicación combinada de enfriamiento epidérmico permite utilizar fluencias más elevadas y conseguir un mayor aclaramiento78,79. En pieles más oscuras la aplicación de enfriamiento epidérmico deberá aumentarse para permitir incrementar de manera significativa la fluencia80,81.
Sin embargo, todavía existe un grupo de pacientes que presentan una respuesta pobre o en los que el aclaramiento progresa muy lentamente. La respuesta a los primeros tratamientos láser parece ser un buen indicador del pronóstico de estos pacientes82,83. Entre las hipótesis que existen para explicar la resistencia de estos pacientes destacan la mayor profundidad de los vasos, el diámetro vascular, la proporción de eritrocitos intravasculares, el grosor de la pared vascular y el número de vasos84. En estos pacientes deberemos intentar con el LCP usar fluencias mayores con protección epidérmica mediante más enfriamiento79,85-88 o intentar pulsos más largos89. Sin embargo, recientemente se ha visto que en contra de lo esperado en teoría, pulsos más largos no obtienen mejor respuesta ni siquiera en vasos de mayor calibre90. También se han obtenido buenos resultados en casos aislados utilizando múltiples pases91-93. Incluso, recientemente, se ha propuesto utilizar múltiples ciclos de láser y enfriamiento94 y la aplicación de agentes hiperosmóticos. Pueden emplearse la luz pulsada no coherente (que ha obtenido buena respuesta en algunos pacientes resistentes al LCP)95-97, el láser98 KTP 532 nm (aunque penetra menos y tiene una mayor absorción por la melanina), el láser Nd:YAG 1.064 nm de pulso largo (ms), láseres de onda continua (argón, CO2, vapor de cobre, criptón, etc.) y otros láseres (alejandrita, diodo)8. Estos láseres son especialmente útiles cuando los nevos flámeos forman lesiones tuberosas99.
Existen diversos métodos de valoración de la respuesta al tratamiento láser100, como valoración clínica, mediante fotografías digitales101, colorimetría, ultrasonidos102, tomografía infrarroja, epiluminiscencia103 y videomicroscopia. Con este último método, se describen vasos tipo 1 (superficiales, tortuosos, asas capilares terminales) con mejor respuesta, frente a vasos tipo 2 (vasos en anillos, dilatados en el plexo horizontal más profundo), con peor respuesta104.
Sin embargo, todavía existe la necesidad de disponer de métodos no invasivos para predecir la morfología vascular de las lesiones105-107. En un futuro quizá técnicas como los ultrasonidos de alta resolución, la tomografía óptica Doppler (sondas fotoacústicas que combinan la fluometría por láser Doppler con la tomografía de coherencia óptica para obtener imágenes de alta resolución del flujo vascular en piel humana in situ y en tiempo real)108, la radiometría fototérmica pulsada109,110 o la microscopia confocal111 permitan una evaluación del estado de los vasos y su respuesta al tratamiento en tiempo real.
Hemangiomas
Existen dos «ventanas» o períodos en la evolución del hemangioma en los cuales puede ser útil el tratamiento láser. La primera, en el inicio de la fase proliferativa, aunque se han descrito ocasionalmente complicaciones con ulceraciones, y para el tratamiento del componente vascular residual una vez ha involucionado el hemangioma. Así, para el componente superficial de los hemangiomas puede ser útil en determinados casos el tratamiento con LCP112. Sin embargo, en un estudio prospectivo reciente en 121 niños de menos de 14 semanas el LCP no mostró mejores resultados que la simple observación, y los pacientes tratados con este láser tuvieron mayor frecuencia de hipopigmentación y atrofia cutánea113. El LCP puede ser útil en hemangiomas ulcerados114. Asimismo, se ha utilizado en ciertos casos más profundos el láser de Nd:YAG pulsado115.
Eritema difuso y poiquiloderma de Civatte
Para el tratamiento del eritema facial difuso con finas telangiectasias son especialmente eficaces el LCP116 y la LIP117,118, a dosis subpurpúricas o purpúricas119. Se ha utilizado con buena respuesta el láser120 KTP 532 nm.
Malformaciones venosas
El enfoque terapéutico (cirugía, escleroterapia, láser) de las malformaciones venosas dependerá de cada caso particular. El láser de Nd:YAG (de pulso largo) y el láser de diodo son útiles en algunos casos. También se emplea (en pequeñas lesiones superficiales) la LIP121 y el LCP, pero su respuesta es más lenta. También se ha utilizado el láser de alejandrita de pulso largo con buena respuesta en lesiones superficiales.
LÁSERES EN LESIONES PIGMENTADAS
En los años 1960, con la creación del láser de rubí, se comenzaron a tratar lesiones pigmentadas. También se emplearon los láseres continuos de kriptón a 521 y 530 nm y de vapor de cobre a 511 nm. Pero fue con el advenimiento de los láseres de conmutación Q (Q-switched, QS) cuando se desarrolló el tratamiento con láser de las lesiones pigmentadas. Se emplea un dispositivo electroóptico o QS para producir pulsos de duración entre 4-100 ns y potencia elevada (106-9 W/cm2). Estos pulsos, según la teoría de la fototermólisis selectiva122,123, determinan destrucción específica de organelas subcelulares, como melanosomas y partículas de tatuajes124-127 por efecto fotoacústico128-130 (fragmentación) y fototérmico131.
Recientemente se han introducido los pulsos de subnanosegundos (femtosegundos y picosegundos) en un intento de confinar más el daño mecanoacústico sin dañar el tejido circundante y aumentar la eficacia132,133. Sin embargo, debido a su alto coste, aún no se han comercializado. Por el momento contamos con los siguientes láseres de pulso corto y alta intensidad:
Láser de rubí QS. Produce pulsos de luz roja a 694 nm de 20-40 ns de alta intensidad. Esta longitud de onda no penetra en la dermis134 más de 1 mm, pero es mejor absorbida por la melanina que 755 nm y 1.064 nm, por lo que este láser es efectivo en el tratamiento de lesiones epidérmicas y dérmicas superficiales, así como en tatuajes azules, negros y verdes. La respuesta es variable en lesiones dérmicas profundas.
Láser de Nd:YAG QS. Produce pulsos de 5 a 20 ns a 1.064 nm. Su frecuencia puede ser doblada a través de un cristal de KTP, produciendo luz verde a 532 nm. La longitud de onda de 1.064 nm penetra varios milímetros en dermis profunda (2-3 mm), por lo que es adecuada para tratar lesiones pigmentadas profundas135, incluyendo tatuajes negros y azules. El KTP 532 nm tiene menor poder de penetración pero es absorbida con más afinidad por la melanina, y es útil para lesiones pigmentadas superficiales y tatuajes rojos, naranjas y púrpuras.
Láser de alejandrita QS. Produce pulsos de 50-100 ns a 755 nm (luz roja). Al igual que el láser de rubí QS, el de alejandrita es efectivo para lesiones pigmentadas epidérmicas, dérmicas poco profundas, y tatuajes azules, negros, verdes, marrones y violetas.
Láser de colorante pulsado de 510 nm. Produce pulsos de 300 ns de luz verde, y una energía entre 2-3 J/cm2. Se usa en lesiones pigmentadas epidérmicas y tatuajes rojos, naranjas y púrpuras136. Su longitud de onda no permite penetrar suficientemente para tratar lesiones pigmentadas dérmicas, como el nevos de Ota.
Láseres de pulso largo. Los láseres de pulso largo (ms) de alejandrita, diodo, Nd:YAG y rubí también son capaces de eliminar lesiones pigmentadas pero con mucha menor selectividad y, a pesar de emplear sistemas de enfriamiento epidérmico, a expensas de mayor daño del tejido circundante.
Láseres no selectivos. Los láseres no selectivos utilizados para resurfactación, como el CO2 (10.600 nm) y Er:YAG (erbium: Yttrium Aluminium Garnet) (2.940 nm) pueden eliminar el pigmento superficial epidérmico como evento secundario124. Suelen emplearse en lesiones con carga importante de pigmento, como nevos melanocíticos o melasma. En este tipo de lesiones estos láseres eliminan las capas de tejido con alta concentración de pigmento, permitiendo posteriormente la actuación de láseres más selectivos.
Lámparas de luz pulsada intensa incoherente. Se están empleando en la eliminación de lesiones pigmentadas pero, dejando aparte casos anecdóticos137-139 y series pequeñas, no existen estudios amplios y con seguimiento suficiente que permitan conocer su eficacia en este tipo de lesiones1. Moreno-Arias y Fernando140 obtienen tasas elevadas de aclaramiento (76-100 %) en lesiones epidérmicas empleando un filtro de 590 nm. En lesiones dérmicas emplean filtros de 610 y 755 nm, con resultados discretos (aclaramiento del 25 %).
El uso de láseres de pulso corto QS para eliminar los pigmentos de los tatuajes ofrece mejores resultados estéticos que otros métodos más invasivos141. Las longitudes de ondas cortas son útiles para tratar pigmentos de color claro, mientras que las largas se emplean en colores oscuros. La eliminación de los pigmentos azules y negros no suele ocasionar problemas, ya que tienen un rango amplio de absorción de longitudes de onda en el espectro de luz visible cercano al infrarrojo, con poca reflexión de la energía lumínica. Los pigmentos verdes, aunque pueden ser muy resistentes al tratamiento, absorben preferentemente luz roja142, por lo que responden mejor a los láseres de QS de rubí QS (694 nm)143 y de alejandrita (755 nm)144,145. Los pigmentos rojos responden mejor a la luz verde emitida por el láser KTP 532 nm146. El Nd:YAG es efectivo para eliminar pigmentos azules y negros, y cuando se dobla su frecuencia (KTP) para pigmentos rojos, pero es pobremente absorbido por pigmentos verdes147. Se ha empleado con éxito para eliminar tatuajes en pieles pigmentadas148. Su larga longitud de onda hace recomendable su empleo en estos pacientes148,149.
Los tatuajes no profesionales por lo general requieren mucho menos esfuerzo terapéutico que los profesionales, debido a la presencia en estos últimos de múltiples colores y alta concentración de pigmento150, así como mayor concentración de carbono en los tatuajes no profesionales125.
Un problema importante radica en la resistencia de algunos tatuajes al tratamiento con láser QS. Ocurre sobre todo con los pigmentos verdes y amarillos y, en menor medida, con los rojos, marrones y azules. Cuando el láser incide sobre estos pigmentos se activan procesos de oxidación-reducción, lo que les hace virar a colores más oscuros125,151,152 como gris-pizarra y negro, difíciles de tratar. La resistencia de los tatuajes al tratamiento con láseres QS se relaciona con la presencia en los pigmentos de óxido de hierro u óxido de titanio125,153,154.
Recientemente se han descrito posibilidades terapéuticas para hacer frente a los tatuajes resistentes a los láseres QS. Así, se ha empleado, en modelos animales, láseres QS combinados con campos magnéticos para la eliminación de los pigmentos con óxido de hierro155. Si el campo magnético se aplica inmediatamente después del QS, determina un aumento significativo en la eliminación del pigmento. Por el contrario, aplicado 3 semanas más tarde determina oscurecimiento. Los pigmentos amarillos son los más difíciles de tratar. Para estos pigmentos se han obtenido buenas respuestas cuando usamos láseres con longitud de onda azul. No obstante, estos láseres no están aún comercializados156. En modelos informáticos157 los láseres de subnanosegundos132 parecen ser óptimos para tratar los tatuajes. Estos pulsos generan ondas fotoacústicas que determinan desintegración de nanopartículas y micropartículas de pigmentos, responsables en ocasiones de la resistencia al tratamiento158. Sin embargo, como dijimos anteriormente, estos láseres no se han comercializado por su alto coste.
Se han descrito otras alternativas en el tratamiento de tatuajes. En ocasiones, láseres de pulso largo (ms) o sesiones repetidas con láseres QS acaban aclarando los tatuajes resistentes. Con LIP, Mosquera159 obtiene un 50 % de aclaramiento tras dos sesiones, sin mejoría posterior. Otra opción consiste en tratar estos tatuajes con terapias menos específicas y más destructivas, como el coagulador infrarrojo, que fue usado por Colver et al160 para eliminar tatuajes. Debe tenerse en cuenta que el empleo de estas técnicas en muchas ocasiones conlleva la producción de alteraciones cicatrizales. Se ha empleado láser de resurfactación ablativo para aclarar tatuajes. Puede eliminarse el pigmento epidérmico empleando Er:YAG o CO2. Ort et al161 llevaron a cabo un estudio para determinar si un pase de láser de resurfactación CO2 seguido de QS es más efectivo que el uso aislado de QS, pero no obtuvo ningún beneficio con el uso de ninguno de los dos láseres. Quizás obtuvo este resultado porque sólo realizaba un pase de láser de resurfactación. Con un segundo pase, Weiss obtiene más eliminación del pigmento que empleando sólo QS.
Las efélides, lentigos y queratosis seborreicas poco elevadas, responden completa y rápidamente a láseres QS162-167. Una a lo sumo dos sesiones suelen ser suficientes para eliminar la lesiones, sin diferencias en cuanto a efectividad entre los distintos tipos de láseres. Comparándolos con el tratamiento convencional de lentigos solares con crioterapia o peelings de ácido tricloroacético, los láseres QS muestran mejor respuesta clínica y menor incidencia de efectos secundarios168,169. La mayor preocupación es la aparición de alteraciones en la pigmentación postoperatorias, sobre todo en sujetos bronceados y/o con fototipos III y IV. En estos casos es recomendable realizar tratamiento despigmentante previo124. Debe recordarse que los láseres QS KTP y colorante pulsado producen púrpura. El riesgo de hipopigmentación postinflamatoria es mayor para el QS de rubí que para el de alejandrita y el de Nd:YAG170. Esta es más difícil de tratar que la hiperpigmentación, y puede ser permanente.
Láseres diseñados para depilación también pueden tratar correctamente los lentigos solares. Rosenbach et al171 muestra en un estudio a doble ciego la eficacia y seguridad del láser de alejandrita de depilación (Cynosure Apogee, Chelmsford, Massachusetts) para la eliminación de lentigos solares moderadamente pigmentados. Se realizó el estudio en 11 pacientes, con 32 lentigos solares. Once se dejaron sin tratar, como el grupo control. Se empleó una fluencia de 35 a 40 J/cm2, con tamaño de impacto de 7 mm y duración de los pulsos de 5 ms. En 19 de los 21 lentigos tratados los resultados fueron excelentes. Sólo en cinco lentigos fue necesaria segunda sesión de láser. Los resultados fueron estadísticamente significativos comparados con los lentigos no tratados, sin prácticamente efectos secundarios.
Las manchas café con leche muestran respuestas variables a los láseres QS, y difíciles de predecir. Grossman et al172 sometieron nueve manchas a dos sesiones de láser QS, la primera con rubí, y una segunda con KTP, ambos a 6 J/cm2. Ambas sesiones blanquearon seis lesiones, oscurecieron una, y no hubo cambios en las dos restantes. Si conseguimos blanquearlas, suele haber recurrencia de las lesiones en casi el 50 % de los casos en el primer año postratamiento172,173, incluso tras la eliminación total de la lesión172. Por lo general, requieren tratamientos repetidos a lo largo de meses, incluso años. Alster174 consigue blanqueamiento completo de 34 lesiones, aplicando de 4 a 14 sesiones de láser de colorante pulsado de pigmento de 510 nm, sin recurrencia al año. Somyos et al175 emplearon láser continuo de vapor de cobre de 511 nm en 16 pacientes, con respuesta en 15 de las 16 manchas tras dos sesiones. No hubo recurrencias tras 22 meses de seguimiento. Existe poca experiencia en el empleo de los láseres de resurfactación en estas lesiones. Alora y Arndt176 presentó un caso de mancha café con leche resistente a QS tratado con Er:YAG sin recidiva, tras seguimiento de un año.
La respuesta al láser de las lesiones pigmentadas dérmicas suele ser más discreta, y requiere longitudes de onda más largas y múltiples tratamientos. La recurrencia suele ser la norma. Hay pocas referencias del tratamiento con láser del nevo moteado. En la serie más amplia descrita hasta la fecha, Grevelink et al177 trataron a 6 pacientes con nevo moteado con láseres rubí QS y Nd:YAG, y todos mostraron un blanqueamiento de la lesión superior al 90 % tras someterse de una a cinco sesiones. El rubí QS fue el más efectivo (5,5-10 J/cm2). En un paciente hubo hipopigmentación transitoria, y otro desarrolló hiperpigmentación periférica. La mayoría de referencias evalúan la respuesta del nevo moteado al láser rubí QS135,163,177,178, pero también se han empleado los láseres QS de colorante pulsado de pigmento 504 nm179, de Nd:YAG135,177 y de alejandrita180. Con este último, Moreno-Arias et al180 emplean una fluencia de 7,28 ± 0,37 J/cm2, y obtienen un 50 % de aclaramiento tras 16 sesiones semanales. La mayoría de los autores consiguen una respuesta pobre y transitoria de los elementos papulares sobreelevados181. De manera similar a lo que ocurre con las manchas café con leche, suelen ser necesarias múltiples sesiones, con frecuentes recurrencias163. No obstante, la aparición de alteraciones cicatrizales, texturales y de la pigmentación son infrecuentes.
En cuanto al nevo de Becker, se consigue aclaramiento significativo de la hiperpigmentación con rubí QS135,178,182, Nd:YAG14 FD QS y colorante pulsado de pigmento 504-510 nm179. Suelen mostrar hipopigmentación, eliminación incompleta y frecuentes recurrencias, probablemente porque los queratinocitos pigmentados y los melanocitos en el folículo piloso actúan como reservorio para la repigmentación183. Por tanto, sería beneficioso para evitar la recidiva el empleo de un láser de pulso largo de depilación. De hecho, tras tres sesiones con láser de rubí de pulso largo se consigue un 90 % de reducción del pelo y pigmentación, con 10 meses de seguimiento183. Es más, se consiguieron excelentes resultados en un paciente en el que se combinó rubí QS y rubí de pulso largo, con resolución total de la lesión y de la pigmentación184.
El nevus de Ota responde bien a la larga longitud de onda del láser Nd:YAG QS185. También se ha comunicado buena respuesta al rubí QS186-192 y alejandrita QS193-195 pero por lo general se requieren más sesiones para su blanqueamiento. Las recurrencias son muy infrecuentes. Chan et al196 en un análisis comparativo entre alejandrita QS-755 nm y Nd:YAG QS-1.064 obtuvieron, después de tres o más sesiones, mayor aclaramiento con Nd:YAG que con alejandrita. En un análisis retrospectivo posterior197 de 171 pacientes, se observó que el riesgo de hipopigmentación es mínimo cuando se emplea sólo el Nd:YAG. El mayor riesgo de hipopigmentación se obtiene cuando se emplea el láser Nd:YAG QS y posteriormente el alejandrita QS. No obstante, cuando se emplea un láser de forma aislada, el mayor riesgo de hipopigmentación se obtiene con el de rubí QS, un 16,8 %185.
Ueda et al198 relacionaron la coloración del nevo con la respuesta al tratamiento, requiriendo más sesiones para conseguir aclaramiento en los azules-grises que en los marrones-violetas. Kang et al199 mostraron cómo la profundidad de los melanocitos dérmicos predice la respuesta, siendo de menos 1 mm los que mejor responden. Por su parte, Chan et al200 establecieron una clasificación de los nevos de Ota relacionando la respuesta al láser con la existencia de otras manchas congénitas, y afectación extracutánea. El empleo de láser para tratar la pigmentación de la esclerótica es considerado por muchos autores el próximo objetivo en este campo201.
En los nevos epidérmicos la laserterapia puede ser una opción cuando no pueden emplearse otros métodos quirúrgicos o éstos han fracasado. Tradicionalmente, se ha empleado láseres continuos como el de argón para las partes más planas y aterciopeladas, y CO2 para la zona hiperqueratósica202,203. En la actualidad, los láseres de resurfactación (CO2 pulsado y Er:YAG)204 pueden ofrecer una alternativa terapéutica. Boyce y Alster205 obtuvieron buena respuesta al láser de CO2 en tres nevos epidérmicos extensos, sin recurrencia a los 13 meses. No obstante, estas lesiones no siempre ofrecen buenos resultados al láser de CO2, sobre todo por la variable profundidad de éstas.
Se han usado láseres de rubí de pulso largo206,207 con buenos resultados cosméticos y sin recurrencia con 2 a 3 años de seguimiento, con hipopigmentación secundaria en algunos casos. Alster208 obtuvo buena respuesta de un nevo epidérmico verrugoso inflamatorio lineal con láser de colorante pulsado de 585 nm.
Los nevos congénitos y adquiridos se han tratado con láseres de argón, rubí, alejandrita y Nd:YAG134,209-216. Esta es una práctica común de dermatólogos asiáticos cuando estos nevos se localizan en zonas del cuerpo en las que se persigue un buen resultado estético. No obstante, este tratamiento es un tema controvertido, sobre todo porque se desconocen los efectos de la irradiación láser sobre las células névicas. Sin embargo, en el único estudio con un seguimiento a largo plazo, Imayama y Ueda217 no encontraron demostración histológica de cambios malignos 8 años después del tratamiento con láser de rubí en nevos congénitos. Deben valorarse con prudencia los resultados obtenidos por Imayama y Ueda217, ya que los melanomas son mucho más infrecuentes entre la raza amarilla (2 casos por millón de habitantes218 que entre la raza blanca (más de 100 casos por millón)219. Quizás exista un diferente comportamiento de los melanocitos en pacientes de distinto origen étnico. Es más, la mayor parte de los melanomas hallados en la población asiática son acrales. Estos datos indican que probablemente los de los estudios asiáticos en estos aspectos no sean extrapolables a la población de raza blanca. Estudios in vitro indican que, tras un daño subletal mediante láser de los melanocitos de un melanoma, hay una alteración en la expresión de integrinas220,221 que faculta a las células con mayor motilidad y capacidad metastásica. Aunque estos datos no sean extrapolables a células normales de un nevo melanocítico, la terapia láser de los nevos debe considerarse todavía experimental. En asiáticos, su uso debe evitarse si el nevo se encuentra en zonas acrales o existe antecedente familiar de melanoma222.
Los estudios histológicos de pacientes tratados134,209,211 muestran que, aunque obtengamos eliminación clínica de la lesión, permanecen nidos de células en partes profundas del área tratada, lo que puede explicar la eficacia parcial en algunos casos y la recurrencia incluso tras múltiples sesiones210. Esta respuesta incompleta se ha atribuido al hecho de que los pulsos cortos no son suficientes para la destrucción térmica de los nidos profundos localizados en dermis papilar. El desarrollo de láseres de pulsos largos especialmente ideados para depilación ofrecen una alternativa teórica para el tratamiento de ciertos nevos nevomelanocíticos, pues destruyen nidos de células que se encuentran profundamente situadas en la dermis. De hecho, el uso de láser rubí de pulso largo (0,3-3 ms) a fluencias de 10-20 J/cm2 ha aclarado nevos congénitos214,217,223. Duke et al210 evaluaron el efecto de láser rubí QS (40-60 ns, 7,5-8 J/cm2, tamaño de impacto 5 mm) y rubí en modo normal (3 ms, 40 J/cm2, tamaño de impacto 7 mm) en nevos benignos, atípicos y congénitos. Ninguna lesión mostró eliminación histológica completa de nevomelanocitos con dos sesiones de láser. Los mejores resultados se obtenían empleando el rubí QS y a las 2 semanas el láser rubí de pulso largo. Esto puede explicarse porque en la primera sesión con láser QS se eliminaría el pigmento superficial, y a las 2 semanas el láser de pulso largo actuaría sobre los nidos profundos, siendo probablemente sólo dos sesiones insuficientes para eliminar la totalidad de las células névicas.
Goldman et al215 trataron nevos congénitos y adquiridos con los 4 láseres QS (rubí, Nd:YAG, alejandrita y colorante pulsado de pigmento 510 nm), y obtuvieron más del 50 % de aclaramiento de los nevos. No encontraron diferencias entre ellos, excepto que el colorante pulsado de pigmento no era eficaz. Waldorf et al209 y Grevelink et al134 muestran con el rubí QS más del 90 % de aclaramiento tras múltiples sesiones, pero con repigmentaciones parciales.
El láser rubí QS no es efectivo para tratar lentigos solares atípicos, o al menos no es efectivo para evitar su evolución a lentigo maligno melanoma224. Lee et al224 consiguen blanqueamiento de las lesiones, pero con recidiva a los meses y posterior desarrollo de lentigo maligno. Se han tratado lentigos malignos irresecables con rubí QS (10 J/cm2), con aclaramiento significativo, pero con frecuente recurrencia225.
En el melasma, los resultados de la laserterapia son impredecibles y dejan con frecuencia lesiones pigmentadas226,227. Se han empleado láseres QS y ablativos (CO2 y Er:YAG) sin lograr resultados consistentes y a largo plazo, y la norma es la recurrencia226-228. Además, presentan un riesgo elevado de hiperpigmentación secundaria228,229, por lo que muchos autores recomiendan no aplicar láser en el melasma124. Hasta la fecha no hay referencias que nos hagan decidir sobre el uso de QS o láser de resurfactación para su tratamiento. Con el láser de resurfactación Er:YAG existe riesgo de hiperpigmentación postinflamatoria230; no obstante, tras un seguimiento de 6 meses Manaloto y Alster230 obtienen aclaramiento significativo de las lesiones. Nouri et al231 consiguieron una completa resolución de melasma dérmico combinando CO2 seguido de alejandrita QS.
Recientemente se han empleado la LIP y el láser KTP (532 nm) con pulsos de milisegundos, que homogenizan la pigmentación que padecen estos pacientes sin riesgo de empeoramiento229,232,233, por lo que son útiles tanto en melasma como en casos de hiperpigmentación postinflamatoria.
El tratamiento de las hiperpigmentaciones postinflamatorias muestra resultados desalentadores124,227,228. De hecho, el láser en ocasiones empeora la pigmentación166. Probablemente, el fracaso terapéutico se deba a la incapacidad de los láseres actuales de actuar sobre las nanopartículas y micropartículas de melanina dispersas en la dermis. Es posible que con la nueva generación de pulsos ultracortos de pico y femtosegundos podamos ser más efectivos234. Ross229 defiende que la hiperpigmentación precoz responde mal al láser, pero la que se ha instaurado hace tiempo, la prolongada, tanto si es tras escleroterapia, traumatismo o crioterapia, suele responder bien con alejandrita QS.
La hemosiderina depositada en extremidades inferiores en asociación con insuficiencia venosa, escleroterapia, traumatismos, cirugía, vasculitis, y cualquier proceso que implique extravasación hemática, puede ocasionalmente responder a láser235. No se ha descrito el láser idóneo para esta alteración, y se han obtenido resultados variables con alejandrita QS y rubí QS, con aclaramiento parcial de las lesiones.
La pigmentación inducida por tratamiento con minociclina responde muy bien al tratamiento con los láseres QS de rubí236-238, alejandrita239 y KTP (532 nm)240, con aclaramiento clínico e histológico. La respuesta es pobre con Nd:YAG (1.064 nm)236,240.
Se obtienen también buenos resultados en las pigmentaciones inducidas por amiodarona tratadas con rubí QS241. Se han comunicado respuestas espectaculares de otras lesiones no melanocíticas al láser rubí QS, como pigmentación por antimaláricos, imipramina, y terapia citotóxica242-244.
Ocasionalmente, los láseres QS pueden originar hiperpigmentación en pacientes que reciben ciertos fármacos. Se desarrolló crisiasis localizada en un paciente que recibía terapia parenteral con oro que de manera simultánea estaba siendo tratado con rubí QS245,246. Probablemente el láser QS altere químicamente el oro depositado en la dermis. Otro caso descrito por Anderson, informó de una paciente que recibió 20 años atrás sales de oro y desarrolló crisiasis cuando se aplicó alejandrita QS para tratar lentigos faciales. La crisiasis fue tratada con láser de rubí de pulso largo (50 J/cm2, 3 ms) con resultados excelentes.
LASERES, LUZ Y ACNÉ
Es bien conocido por todos los dermatólogos que un elevado porcentaje de pacientes con acné mejora con la exposición solar durante los meses de verano. No obstante, hasta hace pocos años no existía evidencia científica de esta observación. De manera intuitiva podría pensarse que la radiación ultravioleta es la responsable de este efecto. Pero, por el contrario, tanto la radiación ultravioleta A (UVA) como la B (UVB) determinan un aumento en la secreción de sebo, comedogénesis y empeoramiento de las lesiones de acné247-249. La mejoría del acné no está relacionada con la exposición a la luz ultravioleta, sino a la luz visible250. Con el advenimiento de la terapia fotodinámica se ha podido conocer el rango del espectro electromagnético que actúa beneficiosamente sobre el acné, así como su modo de actuación. La terapia fotodinámica está basada en la fotooxidación de materiales biológicos inducida por un fotosensibilizante, el cual se localiza de manera selectiva en determinadas células. El ácido d -5-aminolevulínico (5-ALA) ha sido el fotosensibilizante más utilizado, el cual es convertido en el fotosensibilizante activo, la protoporfirina IX, por determinadas células251-253.
Esta terapia es efectiva en el tratamiento de queratosis actínicas, enfermedad de Bowen, y tumores cutáneos superficiales no melanocíticos251,254,255. Sin embargo, la acumulación relativa de protoporfirina IX no es específica para el tejido neoplásico, sino que se ha encontrado en determinados tejidos sanos y lesiones cutáneas proliferativas benignas, como glándulas sebáceas, dermatosis asociadas con el virus del papiloma humano y placas de psoriasis256-258.
Propionibacterium acnes es capaz de liberar porfirinas, que si absorben ciertas longitudes de onda (pico de absorción máxima a 400-430 nm, y un segundo pico menor alrededor de 630 nm) provocan una reacción fotoquímica con liberación final de radicales de oxígeno simple259,260. Estos radicales serán capaces de destruir el propio P. acnes y dañar la glándula sebácea administrando muy poca energía. Sin embargo, a éstas relativamente cortas longitudes de onda (sobre todo en el caso de la luz azul a 400-430 nm) la penetración cutánea es mínima (0,25-1 mm). Recientemente han aparecido diversas fuentes de luz para el tratamiento del acné. Se ha introducido una fuente de luz de banda estrecha, de 405-420 nm en onda continua (ClearLight® [Lumenis]) capaz de iniciar una reacción fotoquímica en la piel acneica (efecto fotodinámico), que produce un efecto fototóxico sobre el P. acnes261. Asimismo, ha aparecido otra fuente de luz pulsada con longitudes de onda entre 430-1.100 nm y pulsos de 35 ms (ClearTouch® [Radiancy Inc.]). A diferencia de otros sistemas, éste no bloquea el calor generado por las lámparas. Este calor, teóricamente, contribuiría al resultado mediante un efecto aditivo de energía sobre la diana y aumentando el índice de la reacción fotoquímica mediante la ecuación de Arrhenius e, incluso, ayudaría a abrir los comedones. Además, dado que los fotoproductos generados al iluminar la protoporfirina IX tienen un pico de absorción cercano a 700 nm, parece teóricamente adecuado utilizar una fuente de luz con un espectro de emisión amplio que permita la excitación de éstos253. Los estudios preliminares han mostrado una eficacia parcial y todavía no se dispone de resultados a largo plazo.
Aunque la luz roja es absorbida con menor intensidad por las porfirinas que la luz azul, su mayor longitud de onda permite mayor penetración en la dermis papilar, y se ha mostrado útil en el tratamiento del acné. Hongcharu et al262 dividieron la espalda de 22 pacientes con acné vulgar en cuatro áreas, sometidas de modo paralelo a tratamiento con ALA tópico al 20 % seguido de luz roja, ALA solo y luz sola. Un área permaneció sin tratamiento, como control. El 50 % de los pacientes recibió sólo una sesión, la otra mitad tres sesiones, con una lámpara de 550-770 nm, a 150 J/cm2. Se demostró mejoría clínica y de parámetros objetivables (excreción de sebo, daño de unidades pilosebáceas y concentración bacteriana) estadísticamente significativa durante 20 semanas en la zona sometida a ALA y luz roja, tras tres tratamientos con intervalos semanales y durante 10 semanas tras una única sesión. Como efectos adversos observados destacaron foliculitis acneiforme transitoria, hiperpigmentación postinflamatoria, exfoliación superficial y formación de costras, todos resueltos sin dejar cicatriz.
Itoh et al263 emplearon una lámpara halógena que emite luz visible policromática a 600-700 nm, con intensidad de energía de 17 mW/cm2 y dosis total 13 J/cm2 para tratar 13 pacientes con acné resistente al tratamiento tópico. Con una sesión, la franca disminución de las lesiones de acné se mantuvo durante 6 meses. Los efectos adversos fueron similares a los descritos anteriormente.
No obstante, el pico máximo de absorción de las porfirinas, y el que determina mayor toxicidad celular, es de 410 nm. Pero, como se ha comentado anteriormente, a esta longitud de onda la penetración es escasa (0,25-1 mm). Kawada et al264, empleando lámpara de luz azul de banda estrecha, 2 veces por semana durante 5 semanas, consiguieron una mejoría de un 64 % en el acné leve-moderado respecto al grupo control, con demostración in vitro de la disminución en el número de P. acnes. Papageorgiou et al265 realizaron un ensayo a doble ciego aleatorizado en 117 pacientes con acné leve-moderado, que distribuyeron en cuatro grupos de tratamiento: luz azul (415 nm), luz azul y roja combinadas (picos a 415 y 660 nm), luz blanca fría y peróxido de benzoilo tópico al 5 %. Se expusieron a la luz diariamente, durante 15 min. A las 12 semanas, el grupo de luz azul y roja mejoró las lesiones inflamatorias de acné en el 76 % como media (66-87 %), y fue significativamente superior al resto de grupos.
El láser también puede emplearse como fuente de luz. Itoh et al266 llevaron a cabo un tratamiento efectivo del acné con una única sesión de láser de colorante pulsado (635 nm, 5 J/cm2), precedida de aplicación oclusiva durante 4 h de 5-ALA al 20 %. Este procedimiento previno el desarrollo de nuevas lesiones tras un período de seguimiento de 8 meses.
Recientemente, Lloyd y Mirkov267 han intentado una fototermólisis selectiva de las glándulas sebáceas utilizando un colorante (verde de indocianina) y un láser de diodo (810 nm) de pulso largo. Se aplicaba una emulsión de indocianina en cura oclusiva durante 24 h y posteriormente se utilizó un láser de diodo de 810 nm, pulso de 50 ms, tamaño de impacto de 4 mm y fluencia de 40 J/cm2. Las biopsias posteriores al tratamiento mostraron una destrucción selectiva de las glándulas sebáceas, y una mejoría clínica de las lesiones de acné tras un seguimiento de 10 meses.
De igual modo, y con el objetivo de producir un daño térmico de las glándulas sebáceas, Ross et al268 y Paithankar et al269 han utilizado un láser no ablativo, el láser de diodo de 1.450 nm (SmoothBeam [Candela]), en pacientes con acné. Así, observaron una desaparición del 100 % de las lesiones en 16 de 17 pacientes, con un seguimiento de 6 meses. En estudios en piel animal y humana ex vivo encontraron daño térmico de glándulas sebáceas, con conservación epidérmica gracias al empleo de sistema de enfriamiento epidérmico por aerosol. Otros láseres, e incluso aparatos de radiofrecuencia, pueden ser capaces teóricamente de producir un daño térmico en las glándulas sebáceas. Incluso se han empleado de forma anecdótica láseres vasculares (láser de colorante pulsado y KTP).
No existen diferencias en cuanto a eficacia en la utilización de fuentes de luz policromática o láser en la terapia fotodinámica. Las primeras son más económicas y con una emisión de longitudes de onda más amplia (400-720 nm), lo que puede ofrecer la adicional ventaja de activación de fotoproductos del fotosensibilizante principal270. Las lámparas tienen mejor perfil de rentabilidad, proporcionan iluminación uniforme y mejor tasa de eficiencia-tiempo en grandes áreas270. Como inconveniente, su empleo data de hace pocos años, por lo que se desconocen sus efectos sobre los tejidos a largo plazo. Además, es difícil llegar a conclusiones con los resultados obtenidos por los distintos autores, ya que los protocolos utilizados son poco comparables271 en cuanto a intervalo y duración de la exposición, parámetros de luz empleada, dosis total, número de sesiones, variabilidad en formulación de del fármaco y otros).
Aunque estos estudios pueden ser prometedores, los resultados son preliminares y deben considerarse como tales272,273. Hasta la fecha, las referencias sobre el tratamiento de otras enfermedades distintas a tumores no melanocíticos con terapia fotodinámica se restringen a pequeñas series y casos aislados273. Antes de sacar conclusiones definitivas debemos esperar a que se realicen amplios estudios prospectivos, ciegos, comparativos con terapias convencionales antiacné y con suficiente seguimiento.
Por último, es bien conocida la aplicación de los láseres para el rejuvenecimiento facial (CO2 pulsado y Erb:YAG) en las cicatrices residuales de acné274. También se ha empleado el láser de colorante pulsado de 585 nm para el tratamiento de cicatrices leves deprimidas275 e hipertróficas, así como eritematosas276. Con una sola sesión y a baja fluencia, Patel y Clement276 comunicaron una importante mejoría de 10 pacientes con cicatrices deprimidas leves-moderadas, con una reducción en la profundidad de las cicatrices del 47,8 % y seguimiento de 120 días.
LASERES EN DEPILACION
El láser depilatorio se ha convertido en la actualidad en un método popular, ampliamente difundido para eliminar pelo no deseado277. Actualmente disponemos de muchos láseres e instrumentos basados en la luz para la depilación capilar, como láser de rubí (694 nm, 3 ms); de alejandrita de pulso largo (755 nm, 3-40 ms); diodo (810 nm, hasta 30, 100 o 1000 ms); de Nd:YAG (1.064 nm, rango de milisegundos); LIP (lámparas de amplio espectro); terapia fotodinámica y LIP combinada con radiofrecuencia.
Se han empleado longitudes de onda tanto en el espectro visible como en el infrarrojo cercano. El pelo es dañado mediante el principio de la fototermólisis selectiva. Los folículos capilares contienen melanina en la vaina radicular externa del folículo y el área de la matriz278, que absorbe la energía láser, con lo cual se destruye selectivamente el pelo y las capas celulares circundantes al folículo sin dañar el tejido circundante. El tratamiento con láser produce un enlentecimiento del crecimiento capilar; el pelo muestra un diámetro más fino, color más claro y una densidad disminuida. Además de proporcionar una adecuada longitud de onda, la duración279 del pulso emitido debe ser suficiente para destruir el folículo capilar sin calentar excesivamente la piel de la vecindad. La duración óptima del pulso láser debe extenderse entre el tiempo de relajación térmica de la epidermis y el de la estructura objetivo del láser (cromóforo). La fluencia necesaria administrada para destruir el folículo es proporcional al diámetro del conducto capilar y al grosor capilar. Cuanto más fino sea el pelo, menor nivel de densidad energético se necesitará para la coagulación. Se ha demostrado que inmediatamente después de la exposición al láser, los folículos capilares ya están lesionados.
En los últimos años, muchos sistemas de láser se han constituido como métodos efectivos y seguros para la depilación280. También se han investigado los cambios histológicos en la piel humana tras la exposición al láser.
Parámetros óptimos en depilación con láser281
Longitud de onda óptima. Para pelo oscuro y piel clara cualquier longitud de onda 694-1.064 nm es efectiva. Longitudes de onda mayores penetran más en el tejido. Las longitudes de onda cortas son más adecuadas para tratar pelo más claro (poco pigmentado) y delgado en diámetro. En cambio, las longitudes de onda más largas permiten tratar fototipos más oscuros de forma más segura, pero no son tan efectivos en el pelo fino y claro.
Duración de pulso. Respecto a este parámetro se ha producido un cambio brusco en los últimos 3 años. Las duraciones de pulso inferiores a 30 ms se clasifican como cortas, y las mayores o iguales a 30 ms como largas. Las primeras probablemente constituyen el modo más efectivo para tratar fototipos claros, mientras que las segundas son más seguras para fototipos oscuros. Con una adecuada protección epidérmica los pulsos cortos son probablemente más efectivos. Para pelos finos se aconseja usar pulsos cortos, mientras que para pelos más gruesos es mejor utilizar pulsos más largos. En pieles más oscuras deben utilizarse pulsos más largos.
La fluencia que debe utilizarse será la mayor sin llegar a producir vesiculación, y el tamaño del impacto el más grande posible con una fluencia efectiva. Así se logra una mayor penetración y un tratamiento más rápido.
Características óptimas del paciente. Para pacientes de piel clara, el láser de rubí, alejandrita o incluso el de diodo de pulso corto, serían muy adecuados. Para tratar de forma segura pacientes de piel oscura, se usa el láser de diodo de pulso largo, superlargo o el de Nd:YAG. También puede emplearse la LIP. Los más efectivos en cabello más claro son el de rubí, alejandrita, diodo pulso corto y la LIP. Son efectivos en cabello fino el de rubí, alejandrita, diodo pulso corto y LIP.
Método óptimo de enfriamiento. No debería existir duda de que el enfriamiento cutáneo es una parte esencial en la fotodepilación con láser. Cuanto más pigmentada sea la piel del paciente, más necesidad tendremos de usar un sistema de enfriamiento, el cual reduce el daño epidérmico, el eritema, el edema, el dolor y hace que puedan administrarse fluencias mayores para obtener mejores resultados. Cuanto más larga sea la duración del pulso empleado, el enfriamiento paralelo es el método de enfriamiento más indicado. En cambio, para duraciones cortas de pulso, el preenfriamiento es probablemente tan efectivo como el enfriamiento paralelo.
Necesidad de consentimiento informado. Kilmer281 recomienda la introducción de las siguientes premisas en el consentimiento informado de la fotodepilación con láser:
1.La necesidad de realizar múltiples tratamientos.
2.El hecho de que el cabello claro responde de forma más pobre.
3.Algunos pelos pueden no responder al tratamiento láser.
4.Algunos pelos pueden hacerse más finos y claros282, lo cual dificultará aún más el tratamiento. Podrá emplearse en estos casos la crema de eflornitina (Vaniqa®, http://www.vaniqa.com).
5.Existen casos raros, aunque documentados de incremento del crecimiento capilar tras tratamiento láser o luz pulsada intensa283,284.
6.Existe la posibilidad de inducir hipo e hiperpigmentación y cambios texturales.
7.Está prohibido broncearse durante el tratamiento.
Láser de Nd:YAG de pulso largo
Los láseres más conocidos y con más experiencia en depilación son los de rubí, alejandrita, diodo y LIP. Existen muchas revisiones actualizadas sobre su uso285-287 Aquí sólo vamos a comentar el láser de Nd:YAG de pulso largo por ser el más novedoso. Se han aprobado recientemente por la Food and Drug Administration (FDA) muchos láseres de este tipo que administran pulsos en el dominio de milisegundos288-291 para depilación capilar de cualquier fototipo. Se espera que los pulsos largos de milisegundos sean también capaces de inducir pérdida capilar a largo plazo. Sin embargo, se necesitan fluencias de alta energía para compensar la absorción más baja de melanina con este láser. La pobre absorción de melanina a esta longitud de onda se acopla con un instrumento de enfriamiento epidérmico lo cual hace de este láser una opción terapéutica segura para pacientes que presentan fototipos más oscuros (III-VI)288-291.
Chui et al291 evaluaron los cambios histológicos inmediatamente después de la exposición a láser de Nd:Yag pulsado largo, con fluencias de 60 a 100 J/cm2 y duraciones de pulso de 40 a 50 ms. Encontraron daño focal de la vaina radicular externa a nivel del bulbo capilar por coagulación térmica que se acompañaba de eosinofilia plasmática y elongación nuclear. El colágeno dérmico circundante era normal en aspecto y distribución. Dado que se observó que la administración de fluencias más altas se asociaba con mayor dolor y mayor riesgo de inducir cicatrización por daño térmico, deberán utilizarse las fluencias efectivas más bajas.
Alster et al289 emplearon el láser de Nd:YAG de 1.064 nm de pulso largo en pacientes con fototipos más oscuros, produciendo una lesión folicular suficiente con mínimo daño epidérmico. Los efectos secundarios incluían sensación de quemazón con fluencias altas, y eritema transitorio y dolor suave a moderado. A diferencia de otros láseres, que pueden producir diversos efectos adversos, el láser de Nd:YAG pulsado muestra menor riesgo de hipo e hiperpigmentación, y está particularmente indicado para sujetos de piel oscura, tal como confirma la aprobación de la FDA del láser de Nd:YAG pulsado para fotodepilación de sujetos con fototipo VI de la clasificación de Fitzpatrick. Esto se debe a la baja absorción de la melanina a 1.064 nm, lo cual no da lugar a daño térmico de la epidermis pero sí resulta suficiente para inducir daño folicular. Aunque un dispositivo de enfriamiento no parece absolutamente necesario, con su uso se reduce el dolor o la sensación de calor y podría mejorar de forma importante la aceptación de este láser, en particular para el tratamiento facial.
Sistema de microondas
Se ha desarrollado un nuevo sistema depilatorio basado en microondas para depilación capilar. Este instrumento proporciona pulsos de energía mediante microondas en conjunción con un sistema de enfriamiento epidérmico. La FDA lo ha aprobado para depilación capilar de todo tipo de pieles y para cualquier parte del cuerpo, excepto la cara, que ha obtenido la autorización recientemente. Se están realizando estudios dirigidos actualmente a recoger datos sobre depilación capilar facial.
Terapia fotodinámica
Recientemente se está empleando la terapia fotodinámica para depilación capilar292,293. Grossman et al293 en un estudio piloto, emplearon como fotosensibilizante tópico el ácido aminolevulínico. La capacidad de esta técnica para realizar depilación no está en función del color del pelo, sino de la concentración del fármaco en el epitelio folicular. La ventaja es que pueden tratarse todos los colores de cabello. Entre los efectos secundarios se ha observado la aparición de alteraciones de la pigmentación, generalmente transitorias. Requiere la aplicación en forma oclusiva de ALA durante algunas horas previas a la irradiación.
Sistemas de radiofrecuencia combinados con LIP
Se conocen bien las ventajas del empleo de energía por radiofrecuencia en medicina. Se deben medir y controlar durante el tratamiento todos los parámetros como voltaje, corriente, impedancia. La impedancia cutánea depende de la temperatura y puede emplearse para monitorizar el calentamiento de la piel.
Este sistema281 carece de efecto sobre la melanina. Básicamente consiste en aplicar energía por radiofrecuencia que primero mide los parámetros comentados, posteriormente se emite un pulso intenso de luz pulsada y, finalmente, emite la energía de radiofrecuencia con un ajuste fino del calor emitido.
El pulso de luz aplicado tiene como finalidad precalentar el blanco o lesión tratada (que puede ser vascular o pigmentada). La temperatura alcanzada por este «blanco» es más alta que la del tejido circundante, mientras que la impedancia del blanco es más baja que la de este tejido. El enfriamiento aumenta la impedancia de la epidermis haciéndola resistente al calentamiento por radiofrecuencia. La luz calienta la vaina folicular de forma selectiva, con lo cual el bulbo y el folículo resultan dañados por transferencia de calor. Posteriormente, la radiofrecuencia produce calentamiento en la capa de 30 mm que rodea la vaina capilar, la cual incluye el folículo capilar y el bulbo.
Al combinar los dos tipos de energía (luz y radiofrecuencia) se produce un calentamiento uniforme de la cubierta capilar y el folículo. La selectividad de la radiofrecuencia consigue que la densidad de corriente sea 2 veces más alta en el folículo que en el tejido circundante, con lo cual la generación de calor es 4 veces más alta en el primero. Este sistema parece prometedor y permitirá tratar el pelo rubio.
REJUVENECIMIENTO FACIAL CON LASER ABLATIVO Y NO ABLATIVO
Con la edad existe una disminución en el número y función de las fibras elásticas, al igual que acontecen cambios en el colágeno y en la actividad de la colagenasa294. Sin embargo, la exposición solar y el daño fotoinducido resultante parecen ser más significativos que el envejecimiento cronológico en la producción de los cambios típicos asociados con la piel envejecida295 como pérdida del tono cutáneo con laxitud, aparición de arrugas, surcos profundos y cambios pigmentarios y texturales.
La exposición crónica a la radiación ultravioleta, en especial los UVA, produce una evidente elastosis solar clínica e histológica, con acumulación anormal de material elastótico en la dermis superficial y media. Este material reemplaza el colágeno normalmente dispuesto y las fibras elásticas295-297. De forma adicional, la exposición crónica solar causa tanto una disminución en las fibras colágenas como una disrupción de la morfología y organización fibrilar normal295. En 1996, Fitzpatrick et al298 postularon que el fotoenvejecimiento se debe en parte a la degradación del colágeno por metaloproteinasas inducidas por la exposición a radiación ultravioleta299, principalmente UVA.
Actualmente existen infinidad de métodos que pueden usarse para tratar la piel fotoenvejecida. Éstos incluyen diversos agentes tópicos (ácido retinoico300, alfahidroxiácidos, tanto en peelings como en aplicación en forma de cremas antienvejecimiento), la dermoabrasión y la resurfactación con láser.
Estos tratamientos301,302 persiguen corregir el daño actínico crónico induciendo un daño térmico, mecánico o químico de la dermis, con la consecuente respuesta biológica299 a esta agresión que se traduce en deposición de una nueva matriz extracelular, mejoría del ordenamiento normal de las fibras colágenas y elásticas y un engrosamiento de la zona limitante entre dermis y epidermis.
La resurfactación mediante láser produce la ablación del tejido y puede añadir un efecto térmico al tejido no ablacionado.
La fluencia del láser, la densidad de la superposición entre disparos, las diferencias en el tipo de láser y la duración del pulso empleado determinan tanto la cantidad de calor dérmico depositado como la profundidad del tejido desnaturalizado301,302. La evidencia experimental ha demostrado que, al incrementar la temperatura del colágeno hasta 60-70 °C, se producen cambios que conducen a un remodelado facial303. Los estudios recientes con láser muestran que existe una evidencia bastante clara que correlaciona el efecto térmico del láser con la mayor reducción en las arrugas304. También parece existir una correlación entre el mayor daño térmico y el mayor riesgo de complicaciones, principalmente aparición de cicatrices305.
La clave en la que se basan los láseres ablativos es la modulación de la deposición térmica al nivel más pequeño que conduzca a cambios clínicamente relevantes en la remodelación del colágeno, entre ellos, la reducción macroscópica de arrugas. En relación a lo expuesto, el concepto de la fototermólisis selectiva hace referencia al hecho de que un láser con una determinada longitud de onda sea absorbido en grado máximo por el tejido deseado o «diana» y que su energía se disperse lo mínimo posible al tejido circundante306. La resurfactación con láser de CO2 está limitada por su prolongado tiempo de recuperación y el riesgo de complicaciones307-312 como trastornos pigmentarios y molestias, incluyendo la necesidad de anestesia regional, e incluso general313 en algunas ocasiones.
El objetivo del láser no ablativo, también denominado de subsurfactación o remodelación dérmica, es restaurar el colágeno dérmico sin lesionar la epidermis suprayacente. El mecanismo de acción es el daño selectivo de la dermis y, por ende, al colágeno envejecido y desestructurado con una energía lumínica que causa una respuesta inflamatoria con la consiguiente reparación tisular y colágena, lo cual conduce a una disminución de las arrugas302,314-316.
Además, la resurfactación con láser no ablativo ofrece la ventaja de que no existe un período aparentemente «muerto» o inactivo de recuperación. Para disminuir el riesgo de daño térmico a la epidermis suprayacente los sistemas no ablativos emplean por lo general sistemas de enfriamiento epidérmico317,318.
Láser ablativo
El tratamiento con láser de CO2 estimula la biosíntesis de colágeno y elastina mediante una ablación epidérmica, lo cual resulta en una expansión tisular y un arrancamiento de fibras elásticas curvadas y plegadas307-312,319. Las complicaciones320 más frecuentes que limitan su uso son:
1.El dolor, tanto durante como después del procedimiento.
2.Necesidad de un cuidado exhaustivo y extenso de las heridas.
3.Tiempo de inactividad laboral (precisa anestesia general en su ejecución, con lenta recuperación domiciliaria).
4.Hiperpigmentación321, relacionada con el grado al nivel de pigmentación natural preexistente y fototipo, la existencia de un melasma previo o pigmentación inducida por la radiación ultravioleta.
5.Eritema prolongado, relacionado con la profundidad del procedimiento322-325, el daño térmico, la posible infección quirúrgica309,323,326 y la existencia de una dermatitis de contacto o alérgica concomitante.
6.Acné, milia, por disrupción de las glándulas sebáceas o del epitelio folicular, por efectos térmicos, por el empleo de terapia oclusiva o por factores intrínsecos.
7.Hipopigmentación312,327, debida a sustitución del tejido fotodañado con tejido sano, incapacidad del tejido lesionado para repigmentar de forma adecuada, o inactivación de melanocitos.
8.Cicatrización debida a mala ejecución técnica, factores relacionados con la reepitelización de las heridas (infección, dermatitis de contacto) y factores intrínsecos anormales.
La resurfactación con láser de CO2 en pase único328 sin desbridamiento cutáneo es una técnica efectiva de rejuvenecimiento con escasas complicaciones. Dentro de los láseres ablativos, el láser de Er:YAG es probablemente el más fácil329 de realizar puesto que incluso es realizable con anestesia tópica con EMLA en las 2 h previas, retirando aproximadamente 10-30 mm de tejido. Con un pase único329 de Er:YAG a una fluencia aproximada entre 5-10 J/cm2, se consigue aumentar la hidratación a nivel de la dermis y una débil mejoría (25 %) en el bronceado actínico329. Como complicaciones se encuentra una molestia moderada y un eritema leve a moderado que dura de 2 a 3 días.
Weiss et al330 realizaron un ensayo clínico sobre resurfactación periorbitaria con Er:YAG tratando a 50 pacientes con 3 pases, y observaron una reepitelización a los 2,65 días y una mejoría del 50 al 75 %. El eritema postratamiento se prolongó hasta el día 15. Los tratamientos secuenciales331 con el láser de Er:YAG inducen una destrucción parcial de la epidermis, clínicamente óptima con escaso tiempo de recuperación (epitelización completa en un período de 2-4 días) con cambios tanto epidérmicos como dérmicos altos. Se consigue mejorar las cicatrices de acné y una eliminación sutil y discreta de las arrugas finas.
Respecto a la eficacia contrastada entre los procedimientos ablativos328, parece que el láser de CO2 clásico es más efectivo y posee mayor capacidad para causar adelgazamiento cutáneo que el láser de Er:YAG, aunque produce mayor hipopigmentación permanente. El uso secuencial de CO2 seguido de Er:YAG es un procedimiento menos agresivo que reduce el tiempo de curación, el eritema persistente, la cicatrización y otras complicaciones332. Las terapias combinadas con microdermabrasión, peelings químicos y toxina botulínica purificada pueden mejorar el resultado final.
Coablación: resurfactación con radiofrecuencia
Este sistema, usado inicialmente en la cirugía artroscópica para eliminar los meniscos dañados333, ligamentos y cartílago articular degenerado, se ha introducido recientemente como un método de rejuvenecimiento no ablativo. Se trata de un instrumento bipolar334,335 que genera energía eléctrica que actúa calentando de forma no selectiva el tejido sobre el cual se aplica, pudiendo suministrar más calor y a un nivel más profundo que un láser no ablativo al cual se añade un sistema de enfriamiento que emplea para este fin una irrigación con solución salina fría que limita el daño térmico del colágeno dérmico. Una ventaja de este sistema es que el operador puede controlar la cantidad de energía administrada y, de esta forma, la penetración y la intensidad de la energía suministrada.
Con su aplicación se produce una contracción del colágeno336 a temperaturas de 60 a 65 °C con una separación epidérmica y un menor daño térmico de dermis alta e infundíbulo folicular334. Para un número dado de pases, de 1 a 3 en los estudios realizados, existe una correlación entre la profundidad de la lesión y el número de pases. En cambio, no se ha observado una correlación entre el daño térmico residual del colágeno y el voltaje empleado.
Los efectos adversos334 incluyen eritema suave, hipopigmentación, hiperpigmentación, edema, dolor leve y, muy raramente, aparición de cicatrices hipertróficas, empleando hasta 25 pases y niveles variables de energía.
En un estudio337 realizado con este nuevo sistema sobre 95 pacientes, con fototipos I a III de Fitzpatrick y con arrugas peribucales y periorbitarias, se observó una rápida curación tras el procedimiento con una epitelización completa en 2 a 4 semanas, junto con una mejor apariencia estética observada tanto por los médicos que lo aplicaron como por los pacientes tratados.
Se observó que hubo una mejor respuesta en los sujetos que recibieron tres pases frente a los que se les dio un número menor, y los pacientes que recibieron un voltaje superior a 125 V.
En resumen, este procedimiento seguro y efectivo se piensa que es un sistema de resurfactación adecuado para pacientes con fotoenvejecimiento de leve a moderado en zonas concretas, ofreciendo como ventaja fundamental un período de recuperación más rápido que el observado con el láser ablativo tradicional.
Sistemas de láser no ablativos disponibles en la actualidad
Láser de colorante pulsado. Este láser emite una longitud de onda entre 585-600 nm con una duración de pulso que oscila entre 350 ms y 40 ms.
Durante la pasada década, al tratar lesiones vasculares se observó una mejoría notable en la elasticidad, textura cutánea, e incluso en las estrías338. El cromóforo sobre el que actúa es la hemoglobina contenida en los vasos dérmicos. Este láser potencialmente induce un aumento en el número de mastocitos regionales que segregan citocinas que modulan la respuesta inflamatoria con un incremento del colágeno339,340, elastina y producción de colagenasa.
Zelickson et al341, en un estudio clínico demostraron una mejoría del 90 % en arrugas de suaves a moderadas y del 40 % en arrugas de moderadas a graves después de una sesión de tratamiento con este láser (585 nm, 450 ms) de duración variable durante un período de seguimiento de 12 meses. Histológicamente se apreció depósito de fibras colágenas y elásticas en un patrón bien ordenado, engrosamiento del estrato espinoso y de la capa colágena de tinción normal contenida en la dermis y una compresión del tejido conjuntivo basofílico subyacente.
Zelickson y Coles342 en un estudio que compara el láser de colorante pulsado administrado con aerosol criógeno en una hemicara de 10 sujetos con únicamente aerosol criógeno en la otra hemicara de los otros 10 sujetos demostraron una suave mejoría de arrugas, hiperpigmentación y eritema (en tres sesiones, separadas por intervalos de 6 semanas, fluencias de 4,5 a 7 J/cm2, amplitud de pulso de 20 a 30 ms).
Bjerring et al343 postularon que el aumento en la síntesis colágena resultaba de disparar con láser la microvascularización dérmica, pero que al tratar de manera repetida algunas zonas, la producción de procolágeno disminuía. Este hecho sugiere que dosis adicionales de energía tienen un efecto fisiológico negativo paradójico.
Rostan et al344 compararon el efecto terapéutico empleando láser de colorante pulsado de baja fluencia y sistema de enfriamiento con un tratamiento crioterápico, y demostraron una mejoría estadísticamente significativa (p = 0,004) en el primer grupo.
El tratamiento tradicional con láser de colorante pulsado se asocia con frecuencia a púrpura. Para obviar esto, un estudio reciente con láser de colorante pulsado empleando fluencias más bajas y duración más corta de pulso, ha mostrado un incremento en la producción de fibras colágenas con ausencia de púrpura343.
Los láseres de colorante pulsado empleados en la actualidad para subsurfactación incluyen el V-star ([Cynosure] con sistema de enfriamiento por aire y longitud de onda entre 585-600 nm), el V-Beam ([Candela] con enfriamiento criogénico, 595 nm amplitud de pulso entre 1,5-30 ms) y el Nlite (ICN/Medical Aliance) (no enfriamiento, 585 nm y 350 ms).
Láser de Nd:YAG de conmutación Q
Este láser de 1.064 nm ha sido el primero evaluado en resurfactación no ablativo que se utilizó para eliminar tatuajes y lesiones pigmentadas en la década de 1980. Su absorción en la piel puede conducir a un efecto fotomecánico no específico a nivel de la dermis. Goldberg et al345 trataron 11 pacientes con arrugas periorales y perioculares con este láser (fluencia de 5,5 J/cm2, tamaño de impacto de 3 mm, superposición entre pases, sin sistema de enfriamiento epidérmico), observando al cabo de 3 meses mejoría clínica en 9 de 11 pacientes pero sólo comparable a la resurfactación ablativa en tres de ellos.
En un estudio de seguimiento a largo plazo, Goldberg et al346, utilizando un láser de Nd:YAG QS con una solución carbónica como cromófero añadido y fluencias más bajas que las del estudio previo, trataron a un grupo de pacientes en tres sesiones a intervalos de 4 semanas, sin observar disrupción epidérmica y apreciando algún grado de mejoría304 en más del 85 % a los 8 meses.
Cisneros et al347 emplearon láser de Nd:YAG de frecuencia cuádruple y diferentes longitudes de onda (1.064, 650, 585 y 532 nm) en tres grupos de sujetos (arrugas periorbitarias, cicatrices postacné y pigmentación periorbitaria) con estudio histológico postratamiento, y obtuvieron un resultado muy satisfactorio en el primer grupo (arrugas faciales) con dos tratamientos, y un resultado óptimo en los otros 2 grupos, resultados según el autor comparables a los obtenidos con láser de CO2 pulsado.
Se han realizado otros estudios348 empleando láser de Nd:YAG sin QS, con fluencias entre 100-130 J/cm2, duración de pulso de 3-8 ms y 5 sesiones durante 8 semanas. La mayoría de los pacientes mostró alguna mejoría clínica. Los láseres de Nd:YAG pulsados de uso habitual incluyen el versapulse y el medlite IV.
Láser de Nd:YAG (1.320 nm)
Este láser fue el primero comercializado para resurfactación no ablativa como cromóforo agua dérmica. Debido al mayor grado de absorción del agua y a su daño dérmico no específico, la absorción de este láser es más superficial en comparación con su homólogo de 1.064 nm, por lo cual se añade un sistema de enfriamiento epidérmico para prevenir la aparición de ampollas. Se produce una mejoría clínica con su empleo que se correlaciona con el reemplazamiento histológico de las bandas de colágeno desestructuradas por nuevas fibras colágenas349, por lo que se ha sugerido también como terapia adyuvante completa en fotoenvejecimiento facial350-352. Para alcanzar la mejoría histológica debe producirse una lesión subclínica que se acompaña de espongiosis a nivel de la unión dermoepidérmica, debiendo alcanzarse para ello temperaturas en la superficie epidérmica en torno a 45-48 °C, medido por el fotómetro, con lo cual induce un recambio epidérmico con lesión de los vasos superficiales353.
Básicamente existen dos generaciones de este láser (CoolTouch), la segunda de las cuales emplea un sistema de enfriamiento antes y después de la exposición láser y un tamaño de impacto mayor (10 mm), lo cual conduce a mejorar el control de la inducción de daño térmico en capas profundas. El CoolTouch 2 está indicado para el tratamiento de arrugas finas a moderadas (especialmente perioculares), telangiectasias y cicatrices de acné no eritematosas, usándose en ocasiones de forma conjunta con toxina botulínica. La aplicación del CoolTouch de 1.320 nm induce una lesión subclínica, en ocasiones superior a la esperada, calentando la piel hasta 44-47 °C, para la cual se requieren múltiples pases. De los sistemas no ablativos es uno de los más eficaces, designándolo algunos autores como la «verdadera resurfactación no ablativa».
Nelson et al354 estaban entre los primeros que demostraron la mejoría pequeña, aunque estadísticamente significativa, en el tratamiento de arrugas usando la primera generación de este láser citado con tres sesiones a intervalos de 2 semanas. El enfriamiento epidérmico resultaba imprescindible. Goldberg et al352 demostraron una mejoría en todos los aspectos relacionados con fotoenvejecimiento al emplear este láser para remodelación dérmica en un grupo de 10 pacientes, a los que trató en 5 sesiones a intervalos de 3-4 semanas, con mejoría histológica y evidencia de neoformación de colágeno en todos ellos.
Láser de diodo (1.450 y 980 nm)
Este láser se ha introducido recientemente para el remodelado del colágeno dérmico; utiliza como cromóforo el agua de la dermis, un cromóforo no específico y conduce a un daño térmico suave que promueve el remodelado y la deposición de nuevo colágeno organizado. Un estudio aleatorizado reciente355 que empleó este láser conjuntamente con un sistema de enfriamiento dinámico (Smoothbeam) y comparando su efecto con la aplicación únicamente de aerosol criógeno, avala la eficacia de este sistema de láser, que ha demostrado una mejoría en las arrugas, textura, tono y calidad de la piel en 13 de 20 pacientes.
Muccini et al356 emplearon un láser de diodo de 980 nm en el tratamiento de sujetos con elastosis solar realizando para ello un estudio en vivo e in vitro, mediante aplicación en el pecho, párpados y tejido periorbitario, y observaron una contracción tisular del 16 %, desnaturalización colágena y deposición de nuevas fibras colágenas y elásticas, con persistencia de los cambios histológicos durante al menos un año después del tratamiento.
Láser de cristal: erbio
Fueron Fournier et al357 quienes evaluaron el efecto de este láser de 1.540 nm en 60 sujetos a los cuales trataron en cuatro sesiones separadas por intervalos de 6 semanas. La mejoría clínica observada se comprobó mediante fotografía, perfilometría y métodos ecográficos. También observaron la evidencia histológica de deposición de nuevo colágeno organizado.
Luz intensa pulsada
Estos instrumentos son aparatos no láser de lámpara centelleante que proporcionan alta energía lumínica en forma de pulsos de múltiples longitudes de onda. La longitud de onda emitida se controla mediante el uso de un filtro de salida que limita la longitud de onda a un rango específico entre 500 y 1.200 nm. Son instrumentos más versátiles que la mayoría de láseres, y se emplean para remodelación no ablativa, entre otras indicaciones. Cuando se elige un filtro que permite la emisión de longitudes de onda en el rango de 550-800 nm, el cromóforo superficial sobre el que recae su energía es la melanina epidérmica y la oxihemoglobina dérmica, lo cual conduce a una mejoría significativa de los cambios pigmentarios epidérmicos con aclaramiento de pequeños vasos superficiales y telangiectasias. Con emisión de longitudes de onda más largas, con un distinto filtro de salida, actúa entonces sobre el agua de la dermis, donde determina una absorción no específica que determina un calentamiento dérmico de amplia difusión local que causa inflamación del colágeno con la subsiguiente reparación y remodelado.
Esta técnica se describe en la actualidad como fotorrejuvenecimiento I si sólo busca tratar los cambios pigmentarios y vasculares, y fotorrejuvenecimiento II si persigue que acontezcan cambios dérmicos más profundos. Además, los pacientes con rosácea, lentigos solares y daño actínico suave son buenos candidatos para este procedimiento.
Las indicaciones358-360 en las que resulta adecuado el tratamiento con LIP para fotorrejuvenecimiento son: tratamiento de telangiectasias finas, pigmentación moteada, donde puede combinarse con microdermabrasión, teniendo un efecto sinérgico, lentigos solares y poiquilodermia de Civatte, arrugas finas, superficiales donde puede añadirse tratamiento con toxina botulínica, pequeñas marcas y cicatrices eritematosas secundarias a acné combinable con microdermabrasión, la láser adecuada para fototipos claros con predominio de telangiectasias. Se ha de tener especial cuidado al tratar fototipos oscuros por las alteraciones pigmentarias que puede inducir. Hay que hacer constar que los resultados conseguidos se mantienen en el tiempo.
Como efectos adversos cabe citar la hipopigmentación transitoria, la apariencia de una «mirada sucia» en relación a que la melanina fotooxidada persiste de 3 a 14 días tras el procedimiento láser y aparición de rojeces entre 1,5 h y 2 días posteriores, al igual que inflamación cutánea pasajera desde las 10 h posteriores a los 3 días. Su aplicación reduce de manera significativa el tamaño de los «poros» hasta un 57 % clínicamente y mejora la textura cutánea en un 40 % tras un solo tratamiento. A nivel histológico, conduce a una reacción fototóxica, una necrosis con formación de vesículas licuefactivas, y degradación de la melanina que aparece en el epitelio superficial y el interior de las vesículas, pero lo más llamativo es que aumenta la síntesis de procolágeno III en el 92,8 %.
Las nuevas generaciones de estos instrumentos de LIP buscan aproximaciones terapéuticas más concretas y esperables. Entre éstos tenemos al Quantum SR (amarillo, rojo, infrarrojo), Ellipse Flex y otros instrumentos de LIP de banda ancha. Con estos aparatos se emplea un procedimiento de exposición doble, consiguiendo disminuir las telangiectasias y la pigmentación moteada desde la primera sesión, y el resultado se obtiene óptimo tratado en un segundo momento.
Sadick et al361 observaron que, con la aplicación del Quantum SR a un grupo de 24 sujetos a quienes trataron en cinco sesiones a intervalos mensuales con 25 a 46 J/cm2 con control histológico, a los 6 meses tras el último tratamiento aparecía formación de nuevo colágeno sin necrosis dérmica o epidérmica y un ordenamiento más compacto de las fibras de colágeno dentro de la dermis papilar, visto por análisis ultraestructural, con coagulación de Demodex folliculorum lo que también justificaba la mejoría del eritema previo observado.
El primer estudio362 que evaluó los efectos dérmicos de la LIP trató a 30 mujeres, de una a cuatro sesiones en 10 semanas, de edades comprendidas entre 35 y 65 años, fototipo I-II de Fitzpatrick, fenotipos cutáneos de clase I-II, aplicándola en región periorbitaria, perioral y frente (LIP de 645 a 1.100 nm, filtro de salida de 645 nm, a través de un instrumento de congelación interpuesto, en pulsos triples de 7 ms con un retraso interpulso de 50 ms), y se observó que, pasados 6 meses, 16 mujeres mostraron alguna mejoría mientras que 9 de ellas experimentaron una mejoría sustancial. Como efectos adversos, se apreció formación de ampollas en 3 de 30 sujetos, y eritema en todos los pacientes, que se resolvió en escasos días. Se observó deposición de nuevo colágeno363, pero los cambios observados parecen ser más sutiles que los obtenidos con técnicas ablativas.
Bitter359 en un estudio reciente sobre 49 pacientes con diversos grados de fotoenvejecimiento y arrugas, realizó tratamientos faciales completos en número de cuatro a seis con fluencias de 30-50 J/cm2 separados por intervalos de 3 semanas315, empleando la evaluación individual y la biopsia cutánea para la valoración de resultados. Comunicó que todos los aspectos relacionados con el fotoenvejecimiento como elasticidad cutánea, laxitud cutánea, pigmentación irregular, rojeces y rubefacción presentaban una mejoría visible en más del 90 % de los pacientes. Los efectos adversos que acontecieron fueron mínimos.
Negishi et al364 informaron sobre el uso de LIP para el rejuvenecimiento cutáneo de una población asiática, tratando un total de 97 pacientes de edades entre 22 y 70 años, y se evaluaron los resultados tanto por los sujetos sobre los que recayó el tratamiento como por los médicos que lo administraron apreciando más del 65 % de los pacientes puntuaron el tratamiento como bueno o excelente en relación a la mejoría en la textura cutánea.
El único estudio que compara la LIP con otro láser (Nd:YAG de 1.064 nm) es el realizado por Goldberg y Samady348 quienes observaron resultados similares con ambas técnicas en el tratamiento de arrugas finas. Sin embargo, el número de complicaciones y efectos adversos observados fue menor en el caso del láser de Nd:YAG.
Actualmente las técnicas no ablativas figuran en la vanguardia de la resurfactación cutánea. Se deberán esperar muchos años para acumular datos suficientes respecto al tratamiento clínico con estos instrumentos. Sin embargo, es probable que quienes esperen obtener resultados similares a los vistos con láser ablativo resulten decepcionados pero, en contraste, las expectativas realistas en la mejoría de la calidad cutánea, el tono y textura obtenidos con estos procedimientos están haciendo de éstos que sean la parcela de más rápida expansión en el campo de la cirugía láser estética.
DIAGNOSTICO-LASER
Las herramientas diagnósticas basadas en fuentes de luz surgieron, en parte, con el objetivo de predecir la respuesta al láser de los nevos flámeos, ya que en muchas ocasiones ésta es variable e impredecible. Aunque son bien conocidas algunas características clínicas de estas malformaciones vasculares que estiman la respuesta al láser, sobre todo su localización corporal y/o asociación con cuadros sindrómicos364, el principal factor pronóstico es la profundidad media y el diámetro de los vasos dilatados. Los nevos flámeos con vasos más superficiales presentan una mejor respuesta365,366. El pronóstico terapéutico podría mejorarse seleccionando de manera adecuada los parámetros de longitud de onda, duración del pulso y fluencia más adecuada al tipo histológico individual de cada nevo flámeo367,368. A esto debe añadirse la energía absorbida por el cromóforo dérmico según el grosor de la epidermis y su contenido en melanina, lo cual puede explicar la distinta respuesta al láser en pacientes con nevo flámeo con características clínicas e histológicas semejantes. Estas características histológicas, geométricas y opticotérmicas varían de un paciente a otro, e incluso en un mismo paciente en distintas áreas del nevo. Por ello, serían útiles herramientas diagnósticas no invasivas con tal de caracterizar in vivo anatómica y fisiológicamente el nevo para mejorar los parámetros láser empleados368.
Radiometría fototérmica pulsada
Mediante esta técnica se obtiene básicamente la distribución geométrica del calor generado por los cromóforos tras la irradiación por un pulso de láser369. El procesamiento de esta información mediante sistemas informáticos permite determinar in vivo las características de los vasos dilatados de los nevos370. La lesión es irradiada con láser de colorante pulsado (585-600 nm) en dosis subterapéuticas. El calentamiento de la epidermis debido a la absorción de la energía por la melanina epidérmica genera una emisión infrarroja. Posteriormente, el calor generado en los vasos debido a la absorción de energía por la hemoglobina genera otra onda térmica371,372. Esta secuencia de emisiones infrarrojas, así como la magnitud y dilación entre éstas, son captadas por una cámara y transformadas en imágenes espaciales a tiempo real. Mediante un algoritmo tridimensional de reconstrucción tomográfica se procesa la distribución espaciotemporal de la temperatura tras la irradiación del pulso láser371, y se realiza una estimación de la dimensión, profundidad y características térmicas de los cromóforos diana y de la epidermis373. En ocasiones, esta técnica discrimina con dificultad los vasos sanguíneos cuando se encuentran muy cercanos a la membrana basal epidérmica. Para aumentar la discriminación en estos casos, Majaron et al374 irradian el tejido con dos longitudes de onda (585 y 600 nm), lo cual aumenta la sensibilidad de la señal infrarroja de los componentes vascular y epidérmico.
Aunque la radiometría fototérmica pulsada es una técnica que nos proporciona información diagnóstica muy sensible, el desarrollo de un modelo in vivo útil para establecer in situ los parámetros láser óptimos que debe emplearse en cada momento en el tratamiento del angioma plano exigirá un conocimiento exhaustivo de los mecanismos que determinan una lesión vascular irreversible368, por lo que se trata todavía de una técnica empleada sólo en ámbitos experimentales y casos clínicos aislados.
Tomografía óptica Doppler
Combina la flujometría Doppler con la tomografía de coherencia óptica para obtener imágenes de alta resolución del flujo sanguíneo en los vasos dilatados in situ y en tiempo real375. La excepcional alta resolución de esta técnica (2-10 mm) permite, mediante un método no invasivo, visualizar imágenes de la microcirculación vascular in vivo y de las estructuras tisulares que rodean los vasos376, así como reproducir tridimensionalmente la profundidad de los vasos y su diámetro377. Al objetivar los cambios en el flujo de los vasos sanguíneos en respuesta al láser, permite optimizar el tratamiento, a la vez que realiza una evaluación semicuantitativa de la eficacia del láser en tiempo real. Un restablecimiento parcial del flujo sanguíneo de los vasos del nevo flámeo tras la exposición al láser refleja un daño del cromóforo diana subletal, lo que orientaría a la necesidad de tratar la lesión con fluencias más elevadas375.
Microscopio láser confocal
Este microscopio se basa en un láser de baja potencia de longitud de onda cercana a la luz infrarroja habitualmente Nd:YAG o diodo que realiza un barrido a través de un área de la superficie cutánea. Debido a los distintos índices de refracción de las microestructuras que atraviesa el láser, éstas emiten múltiples señales que hacen posible configurar una imagen digital bidimensional. La fuente de luz, el punto iluminado y el detector poseen el mismo foco. Se trata de una citología no invasiva in vivo de alta resolución, que permite visualizar estructuras celulares y subcelulares sin necesidad de procesar el tejido378,379. La principal limitación del microscopio confocal es su escasa capacidad de penetración, de no más de 300-350 mm380. Por tanto, sólo pueden identificarse estructuras cuya localización se limite a epidermis o dermis superficial. Eso sí, las imágenes de lesiones superficiales que se obtienen con este dispositivo poseen tal resolución que permiten en ocasiones obviar la realización de estudios histológicos convencionales380.
Existen casos aislados y series pequeñas que informan sobre la capacidad del microscopio confocal de proporcionar in vivo y en tiempo real imágenes diagnósticas de varias entidades sin necesidad de biopsia, tanto inflamatorias como psoriasis381, foliculitis382, dermatitis alérgica de contacto383, como infecciosas como onicomicosis384, infección herpética385 y tumorales como hiperplasia sebácea386, queratosis actínicas387, nevo388, melanomas388,389, carcinomas basocelulares superficiales380 y espinocelulares390. Asimismo, se han definido características micromorfológicas distintivas en epidermis y dermis papilar de pacientes con esclerosis sistémica estadísticamente significativas comparadas con piel de sujetos normales391.
El microscopio confocal también puede ser útil para valorar la respuesta al láser de lesiones vasculares. De hecho, se ha empleado para objetivar los eventos fisiológicos que ocurren tras irradiar puntos rubí con láser de colorante pulsado 585 nm y láser criptón392. Permite también la realización in situ de estudios de inmunofluorescencia basados en la demostración de anticuerpos contra estructuras de la epidermis y/o membrana basal. Recientemente393 se han descrito alteraciones en la distribución de la laminina a1 en la membrana basal de las placas de psoriasis mediante estudios inmunohistoquímicos empleando el microscopio láser confocal. Es útil también en el diagnóstico diferencial del penfigoide ampolloso y la epidermólisis ampollosa adquirida en base a la inmunofluorescencia de IgG y marcadores de membrana basal como integrinas, lamininas y colágeno tipo IV394.
Se ha empleado en la cirugía de Mohs para establecer la presencia o ausencia de tumor en los márgenes del tejido extirpado ex vivo395. Al eliminar la necesidad de procesar histológicamente el tejido, el microscopio confocal reduce de manera significativa el tiempo requerido para llevar a cabo este procedimiento quirúrgico. En un estudio realizado por Rohrer390 con 17 carcinomas basocelulares y espinocelulares, la correlación entre los hallazgos obtenidos por el microscopio confocal y por el método tradicional con hematoxilina-eosina fue del 89-96 %. Las limitaciones del microscopio confocal en este trabajo se encontraron en el diagnóstico de carcinomas basocelulares esclerodermiformes y algunos carcinomas espinocelulares.
Podemos concluir, por tanto, que el microscopio confocal es un método diagnóstico de alta resolución prometedor, no invasivo, que permite la evaluación in vivo de lesiones cutáneas superficiales. Puede ser en el futuro un método de especial interés en pacientes inmunocomprometidos, en los que la rapidez en el diagnóstico puede representar una mejoría significativa en el pronóstico o en pacientes en los que está contraindicada la realización de biopsias385. No obstante, dada la escasa experiencia con la que se cuenta hasta el momento, se requieren estudios adicionales para probar la sensibilidad y especificidad de este método.
LASER EN PSORIASIS Y OTRAS ENFERMEDADES
La fototerapia de las lesiones de psoriasis con luz ultravioleta UVB, PUVA y UVB de banda estrecha (308-311 nm) es, en determinados pacientes, una buena opción terapéutica. Se han aplicado diversos sistemas láser en los últimos años para intentar mejorar las placas psoriásicas. Aunque existe algún trabajo aislado396 con láser de CO2 y argón, han sido el láser de colorante pulsado y el láser excímero los que se han mostrado más eficaces.
Láser de colorante pulsado397-399
Los cambios microvasculares dérmicos detectados en los bordes de las placas de psoriasis activas sugieren que los cambios vasculares son una de las primeras manifestaciones en el desarrollo de una placa de psoriasis. Esta microvasculatura dérmica está aumentada y presenta alteraciones morfológicas. Así, se ha demostrado que existe una importante angiogénesis estimulada por numerosos factores como factor de crecimiento tumoral alfa (TGF-a, interleucina-8, factor de necrosis tumoral alfa (TNF-a), VEGF, bFGF, leucotrieno B4, neuropéptidos, y otros). Por ello, se ha utilizado un láser capaz de destruir o disminuir esta vascularización mediante fototermólisis selectiva. El láser de colorante pulsado ha resultado parcialmente eficaz en algunos tipos de placas de psoriasis, requiriendo para ello varios tratamientos. Existen estudios donde hasta el 40-60 % de los pacientes muestran resultados buenos o excelentes. Se han publicado remisiones de hasta 9 meses400. Los efectos secundarios incluyen ulceraciones, vesiculación y cicatrices de forma excepcional. Los parámetros utilizados son, para un tamaño de impacto de 5 mm, pulso de 0,2, 0,45 o 1,5 ms, longitud de onda 585 nm y fluencias de 7 a 9 J/cm2. Los tratamientos se realizan cada 2 a 4 semanas. Sin embargo, todavía no se conocen los parámetros óptimos.
Debido a que no es un tratamiento sencillo de realizar por un tamaño de impacto pequeño y un ritmo de repetición del pulso bajo, la posible indicación de tratamiento con este láser en psoriasis sería en la enfermedad localizada resistente a otras modalidades terapéuticas.
Láser excímero (UVB 308 nm)400-408
Este láser que emite alta energía en la longitud de onda del ultravioleta, de pulso corto se ha usado con fines ablativos en la industria y la medicina, más notablemente en la cirugía oftalmológica refractiva y en procedimientos vasculares de angioplastia. La idea de aplicar una terapia ultravioleta localizada parte de que las placas de psoriasis pueden tolerar más radiación ultravioleta que la piel normal adyacente a la placa, se evita la innecesaria radiación de la piel sana y las placas de psoriasis aclaran más rápidamente si se les administran selectivamente dosis mayores de luz ultravioleta.
Mientras que el tratamiento con UVB tradicional requiere aproximadamente 25 o más sesiones, con el láser excímero se ha observado una mejoría considerable con un protocolo de 10 sesiones o incluso un aclaramiento considerable con un solo tratamiento. Este factor puede incrementar la adhesión del paciente al tratamiento. La alta intensidad a la que se administran las dosis de láser permite la posibilidad de una respuesta más rápida con menos tratamientos, con lo cual se consigue una dosis acumulativa administrada en un período más corto de tiempo que con la fototerapia convencional. La alta intensidad de ultravioleta administrada resulta comúnmente en eritema y formación de ampollas, pero estos efectos secundarios parecen ser por lo general bien tolerados.
El láser excímero (XTRAC® [Photomedex], EX308 [SurgiLight]), de reciente introducción, ha mostrado buenos resultados en el tratamiento de placas localizadas y resistentes. Permite tratar de forma selectiva las áreas de psoriasis y administrar dosis mayores que las toleradas por la piel sana. También se ha utilizado para lesiones de vitíligo, repigmentación de cicatrices y estrías, así como para cualquier otra lesión susceptible de tratamiento con luz ultravioleta.
Otras terapias
Se ha empleado de forma aislada la terapia fotodinámica409-410 con cierta mejoría de las placas. Últimamente se han introducido lámparas de luz ultravioleta B pulsada (290-320 nm) transmitidas mediante fibra óptica, con un tamaño de impacto de 16 mm2 y pulsos de 0,5 a 2 s (B-Clear® [Lumenis]). Ruiz Esparza411 trató 3 pacientes con láser de Nd:YAG de 1.320 nm y encontró únicamente una respuesta parcial.
OTROS PROCESOS PATOLOGICOS
Finalmente, entre otras patologías dermatológicas tratadas con láser, muy recientemente han aparecido algunos casos aislados de granuloma facial412,413, lupus pernio414, mucinosis eritematosa reticular415, liquen escleroso y atrófico416-417, lupus eritematoso418, dermatitis liquenoide419, amiloidosis nodular420, prurigo nodular421, liquen amiloide422, elastosis perforante serpiginosa423, queratosis pilaris atrófica424, hiperplasia angiolinfoide con eosinofilia425,426, hidrocistomas ecrinos427, necrobiosis lipoídica428, tricostasis espinulosa429, seudofoliculitis de la barba430-432 y queratosis actínicas con terapia fotodinámica con ALA y luz pulsada intensa433.
PAGINAS WEB DE INTERÉS
http://www.aslms.org/index.htm
http://www.laserforum.com/
http://www.lasernews.net
http://www.edae.gr/laser.html
http://www.rosacea.org/
http://www.birthmark.org/
http://www.cosmeticsurgeryonline.com/
http://www.lasertraining.com/med-art.htm
http://www.candelalaser.com/index.html
http://www.cynosurelaser.com/
http://www.radiancy.com/
http://www.laserscope.com/
http://www.lumenis.com/site/content/
http://www.sciton.com/
http://www.altusmedical.com/altus.asp
http://www.meditec.zeiss.com/
http://www.palmed.com/laser.html
http://www.depilase.com/
http://www.continuumlasers.com/mainswf.html
http://www.thermage.com/
http://www.coherentmedical.com/
http://www.diomedinc.com/
http://www.dermlaser.com/
http://www.naalt.org/
http://www.walt.nu/
http://www.hms.harvard.edu/
http://atla-inc.netfirms.com/index.htm
http://tattoos.com/
http://www.lasertreatments.com/
http://www.centerforderm.com/
http://www.ialms.info/links.htm
http://www.laserinventor.com/