INTRODUCCION. LAS METALOPROTEINASAS
Desde hace tiempo se conocía la circunstancia de que el tejido conjuntivo se degrada en muchas situaciones fisiológicas como la remodelación ósea, la involución del útero tras el parto o en situaciones patológicas muy comunes como las úlceras de decúbito, el cáncer o la artritis; sin embargo, el factor responsable de esta degradación no se había identificado.
La remodelación de la matriz extracelular, constituida por un complejo engranaje de glucoproteínas y proteoglucanos, es un proceso multifactorial combinado en el que participa la degradación localizada de la matriz preexistente, el reordenamiento citosquelético, la translocación celular y el depósito de nuevos componentes. Aunque todos estos pasos están controlados por una gran diversidad de mecanismos moleculares, es probable que el inicio dependa de la presencia de enzimas secretadas capaces de desencadenar la degradación.
En 1962, Gross y Lapiére1 demostraron que la piel que cubre el rabo reabsorbido de la rana metamorfoseada, cuando es cultivada, sintetiza una enzima que ataca a la triple hélice del colágeno. Esta enzima conseguía digerir colágeno a pH neutro y 27 °C. Ésta es la primera referencia de lo que actualmente se conoce como metaloproteinasas de la matriz. Desde este primer trabajo hemos asistido a un gran desarrollo en este campo. A partir de los años sesenta se han multiplicado las referencias sobre este tema; se piensa que hay unas diez mil al respecto y que en los últimos años se añaden unas mil anuales. Sobre metaloproteinasas de la matriz existen en la literatura médica una serie de revisiones de las que destacan las de Alexander y Werb2, Birkedal-Hansen et al3, Emonard y Grimaud4, Matrisian5 y Woesner6.
Las metaloproteinasas son endopeptidasas que, además de desarrollar una función degradativa, están relacionadas estructuralmente y se clasifican según su especificidad de sustrato y su estructura primaria. Las primeras clasificaciones surgieron tras la conferencia de Dustin Beach de 19917. Su nomenclatura, consecuencia de esta reunión, fue publicada en 19928. Existen más de 200 metaloproteinasas que se caracterizan porque casi todas ellas tienen cinc en el centro activo para desarrollar su función catalítica. Basándose en su estructura tridimensional y en la consideración de la secuencia de aminoácidos de determinadas zonas, se dividen en clanes y en familias9. Empleando estos criterios las metaloproteinasas se clasifican en ocho clanes y 40 familias.
Las metaloproteinasas de la matriz (MMP) son una familia de enzimas proteolíticas que se encargan del remodelado de la matriz extracelular y que en conjunto pueden degradar todos los constituyentes de ésta.
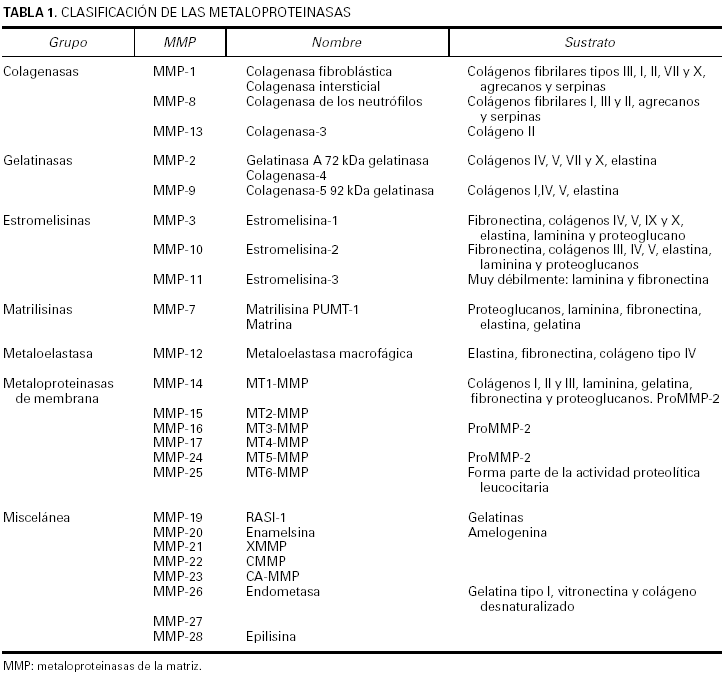
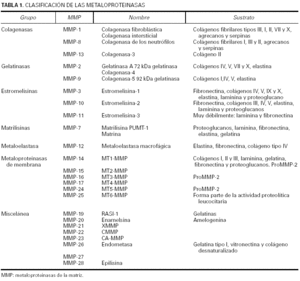
La clasificación de esta familia de enzimas10 se ha ido modificando durante los últimos años y aunque se tiende a agruparlas según la estructura en dominios de la proteína, el criterio empleado todavía es el que tiene en cuenta el sustrato sobre el que actúan de manera específica las metaloproteinasas (tabla 1).
Actualmente se conocen seis subfamilias de metaloproteinasas de la matriz. Las colagenasas, que son capaces de degradar todo el colágeno del tejido conjuntivo; las gelatinasas, que actúan sobre los colágenos tipo IV, V, VII y X, la elastina y los colágenos desnaturalizados; las estromelisinas y la matrilisina, que degradan el núcleo de proteoglucanos de las proteínas, la laminina, la fibronectina, la elastina y la gelatina; las metaloproteinasas de membrana, que degradan la fibronectina, la laminina y otras metaloproteinasas; y la metaloelastasa macrofágica, que actúa sobre la elastina insoluble, el colágeno IV, la fibronectina, la laminina y los proteoglucanos. La denominación de las proteinasas se efectúa siguiendo una numeración correlativa, según su fecha de descripción, pero existen para ellas nombres alternativos que por lo general hacen referencia al sustrato al que se dirigen o a su ubicación.
Mediante técnicas de clonación y secuenciación de ADN se han identificado diversas metaloproteinasas, y ello ha permitido conocer su estructura11-20.
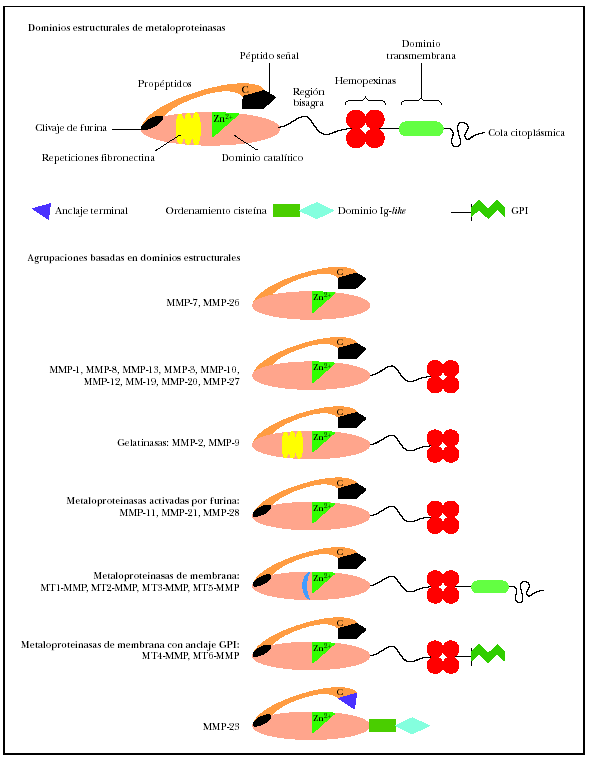
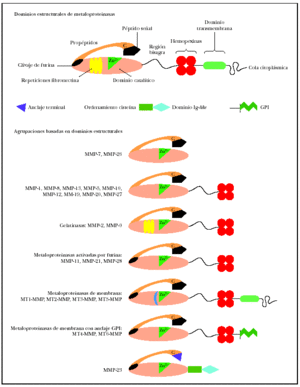
El análisis de la estructura primaria de estas enzimas, que se representa21 por el esquema (fig. 1) permite identificar los dominios estructurales22,23. Todos los miembros de las metaloproteinasas de la matriz contienen un péptido señal, un propéptido (alrededor de 80 aminoácidos) obtenido mediante la activación del precursor o cimógeno y un dominio catalítico aminoterminal (alrededor de 170 aminoácidos), que contiene el sitio fijador de cinc.
Fig. 1.--Estructura de las metaloproteinasas de la matriz. Modificada de Lafleur et al21.
En las colagenasas, estromelisinas, metaloelastasas y metaloelastasas tipo membrana (MT-MMP), el dominio catalítico está adherido al dominio similar a pexina carboxilo terminal (alrededor de 210 aminoácidos) por una pequeña «bisagra». Este dominio, formado por cuatro repeticiones hemopexinas, no existe en la matrilisina, el miembro más simple de la familia MMP. El dominio similar a la fibronectina está presente solo en las gelatinasas A y B y consiste en tres secuencias repetitivas de 58 residuos desde la cabeza hasta la cola. La gelatinasa B posee un dominio característico de 54 aminoácidos de longitud, con alto contenido en prolina, similar a la cadena alfa-2 del colágeno tipo V.
Junto a las metaloproteinasas secretadas, existen actualmente seis MT-MMP que contienen una secuencia transmembrana unida a una porción citoplasmática a continuación del dominio transmembrana. MT1-, MT2-, MT3- y MT5-MMPS. Tienen un dominio intracelular corto, mientras que MT4- y MT6-MMPS están ancladas en la membrana plasmática por un glucosilfosfatidilinositol (GPI)24. Las metaloproteinasas de membrana tienen un sitio de clivaje para una proteasa, la furina; esta circunstancia interviene en la activación de la enzima latente. La metaloproteinasa 23 no tiene un péptido señal reconocible, presentando en ese lugar una secuencia de menor tamaño. Tampoco muestra repeticiones hemopexina, estando su dominio terminal considerablemente acortado25. La MMP-23, a continuación del dominio catalítico, tiene dos nuevos dominios: el ordenamiento cisteína y el similar a la Ig-like26.
Todas las metaloproteinasas de membrana tienen cinc en el sitio activo relacionadas con las secuencias de aminoácidos conservadas HEXXHXXGXXH (his-glu-x-x-his-x-x-gli-x-x-his, donde X es cualquier tipo de aminoácido). Todas requieren la unión octaédrica de iones calcio para mantener la identidad estructural. La conservación de la secuencia de aminoácidos PRCVPD (pro-arg-cis-val-pro-asp), importante para la activación del cimógeno, se observa en el interior de los dominios aminoterminales de todos los miembros de la familia inmediatamente por encima del extremo aminoterminal de las enzimas activas.
La actividad de las metaloproteinasas está regulada en diferentes sitios. En cultivos celulares se ha comprobado que la actividad basal de las metaloproteinasas es modificada en la transcripción, en la activación de precursores y en la inhibición de la actividad proteolítica. La regulación se efectúa en la transcripción por citocinas y factores de desarrollo como las interleucinas 1 y 6, el factor de necrosis tumoral, el factor de desarrollo epidérmico, el factor derivado de las plaquetas y el factor de desarrollo fibroblástico. Todos estos estímulos extracelulares actúan activando un factor de transcripción nuclear22.
Muchas metaloproteinasas son secretadas como precursores latentes o cimógenos, que son proteolíticamente activados en el espacio extracelular. La latencia depende del llamado «interruptor de cisteína», formado por la interacción de una cisteína del propéptido con el cinc del dominio catalítico que bloquea el acceso de éste al sustrato. La activación de la metaloproteinasa latente tiene lugar por la actuación de determinadas sustancias como los organomercuriales o por clivaje proteolítico del propéptido, consiguiendo así disociar la unión covalente entre la cisteína y el cinc catalítico22.
Otro mecanismo de regulación consiste en la actuación de inhibidores de la actividad proteolítica. Los inhibidores pueden ser no específicos, como la a2-macroglobulina o la a1-antiproteasa, o específicos, los llamados tisulares de metaloproteinasas (TIMP).
Los TIMP se identificaron en 1975 y desde entonces se han descrito cuatro tipos27. Los TIMP-1 y TIMP-2 son capaces de unirse directamente al dominio hemopexina de las metaloproteinasas MMP-9 y MMP-2, respectivamente, y ejercer un control en la activación del proceso. Además, los inhibidores de las metaloproteinasas tienen otros papeles, actúan como factores estimulantes del desarrollo, en la esteroidogénesis y en la modulación del crecimiento celular. Un dato que resulta orientativo sobre la importancia de los TIMP en este campo, es el hecho de que de las mil referencias anuales que suelen surgir sobre el mundo de las metaloproteinasas, el 25 % aproximado aportan información sobre los TIMP. Cabe destacar la interesante y completa revisión que sobre los TIMP ha publicado el grupo de Gómez28.
METALOPROTEINASAS DE LA MATRIZ EN LA PIEL
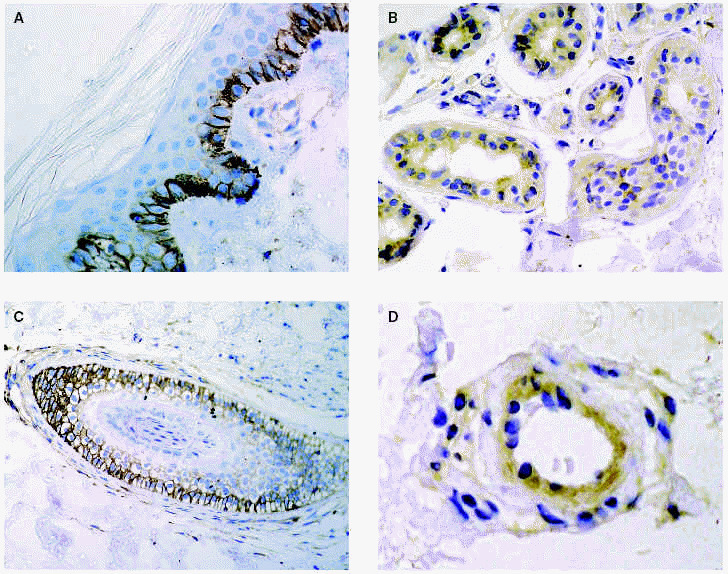
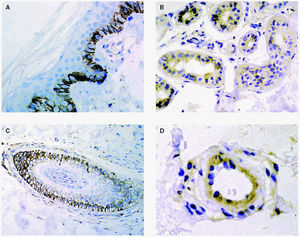
En la piel son varios los tipos celulares capaces de producir metaloproteinasas: células epiteliales, fibroblastos, macrófagos, células endoteliales, mastocitos, eosinófilos y neutrófilos (figs. 2A-D). Sin embargo, el contenido de metaloproteinasas es variable y depende de la cantidad almacenada y de la inducción en respuesta a señales exógenas como citocinas, factores de desarrollo, interacciones célula-matriz y alteraciones de determinados contactos intercelulares29.
Fig. 2.--Metaloproteinasas expresadas en queratinocitos basales (A), glándulas sudoríparas (B), folículo piloso (C) y células endoteliales (D).
Existe una serie de circunstancias, tanto fisiológicas como patológicas, en las que se evidencia un aumento de la producción de metaloproteinasas. Este hecho ocurre en la reparación de las heridas, en el proceso de envejecimiento cutáneo, en algunas enfermedades ampollosas, en las enfermedades en las que se produce fibrosis dérmica y en la invasión tumoral.
La actuación de las metaloproteinasas es específica, es decir, cada una de ellas se dirige a un determinado sustrato. La colagenasa I (MMP-1) degrada colágeno tipo III más eficientemente que los tipos I o II, mientras que la tipo MMP-8 es más eficaz degradando colágeno tipo I que tipo III o II. La colagenasa III (MMP-13) degrada colágeno tipo II seis veces más eficazmente que tipo I y III, además su amplio espectro de actuación lo distingue de otras colagenasas, ya que es capaz de degradar colágenos tipo IV, IX, X y XIV, tenascina y fibronectina.
La gelatinasa A (MMP-2) se evidencia en cultivo en queratinocitos y fibroblastos dérmicos. La gelatinasa B (MMP-9) la producen los queratinocitos y es almacenada por los neutrófilos y los eosinófilos, pero no se expresa en fibroblastos dérmicos. Ambas gelatinasas tienen un papel importante en la degradación final del colágeno, una vez que éste ha sido modificado inicialmente por otras colagenasas; no obstante, ambas poseen cierta actividad colagenolítica; la MMP-2 rompe colágeno tipo IV, V, I y la MMP-9 rompe colágenos I, II, IV y V.
La estromelisina 1 (MMP-3) y la estromelisina 2 (MMP-10), se expresan tanto en queratinocitos como en fibroblastos y son capaces de degradar una gama de sustratos extensa que incluye fibronectina, colágenos tipo IV, V, IX y X, elastina, laminina, gelatina y proteoglucanos. La estromelisina 3 (MMP-11) degrada muy tenuemente productos de la matriz extracelular; es una enzima peculiar que precisa para poder actuar la secreción previa por parte del aparato de Golgi de una proteinasa asociada, la furina.
En cuanto a las metaloproteinasas de membrana, sabemos que la MT1-MMP (MMP-14) actúa activando MMP-2 latente19, y también degradando colágeno I, II y III, gelatina, fibronectina, laminina 1 y proteoglucanos30. Los sustratos a los que se dirigen las otras metaloproteinasas de membrana no se conocen. En la piel humana se ha demostrado la presencia de MT1-MMT en queratinocitos basales, glándulas sudoríparas, epitelio del folículo piloso, glándulas sebáceas y fibroblastos31.
La matrilisina (MMP-7) es la metaloproteinasa más pequeña, ya que no tiene en su estructura dominios tipo hemopexina. Esta circunstancia probablemente explica la extensa capacidad de actuación sobre sustratos variados como fibronectina, laminina, entactina, colágenos tipo IV y proteoglucanos.
La metaloelastasa macrofágica (MMP-12) degrada elastina y se ha encontrado en macrófagos y en células estromales durante el desarrollo fetal, y principalmente en zonas donde la matriz tiene un elevado recambio.
En la piel normal, la degradación de la sustancia fundamental es necesaria durante el desarrollo embriológico para la expansión epidérmica y el desarrollo de los apéndices, y en la vida adulta para el desarrollo cíclico de los apéndices pilosos. Durante el tercer mes de gestación la MMP-1 se constata en células basales epidérmicas y en fibroblastos dérmicos, así como en células de los folículos pilosos. Cuando el desarrollo progresa, la cantidad de MMP-1 disminuye. La presencia de matrilisina (MMP-7) se ha demostrado en la epidermis y los anejos durante el período fetal, pero en la vida adulta sólo se evidencia alrededor de los folículos pilosos y en la porción secretora de la glándula ecrina. La MMP-9 se ve en el período fetal en las células mesenquimatosas de la dermis, en la vida adulta puede observarse en las capas inferiores de la epidermis. La MMP-2 puede estar presente como un elemento constitutivo de la piel normal, localizándose en los fibroblastos dérmicos y ocasionalmente en los queratinocitos. La MMP-3 no suele observarse habitualmente, pero en ocasiones puede expresarse en los folículos pilosos. Con respecto a los TIMP, el TIMP-1 es expresado en la dermis por fibroblastos ocasionales pero no se ve en epidermis; esporádicamente puede marcar glándulas sebáceas y folículos pilosos28.
METALOPROTEINASAS EN PROCESOS FISIOLOGICOS CUTANEOS
Metaloproteinasas y curación de las heridas
Las metaloproteinasas participan en funciones tan habituales como son la curación de las heridas32. Intervienen en diferentes fases del proceso, contribuyendo a la limpieza del tejido desvitalizado y participando en las interacciones epidérmico-mesenquimatosas, durante la migración queratinocítica, contribuyendo en la angiogénesis y remodelando el nuevo tejido conjuntivo durante la maduración de éste. La producción de MMP-1 por queratinocitos migradores puede ayudar a disociar la célula del colágeno dérmico. Los queratinocitos del borde de las heridas producen MMP-3 y MMP-10, durante el proceso reparativo. Los fibroblastos dérmicos expresan MMP-1 y MMP-3. La MMP-11 se aprecia en fibroblastos en las fases tardías de la fibrosis reparativa y la MMP-13 está presente en los fibroblastos del lecho de la úlcera y es importante en la degradación de los colágenos I y III.
Metaloproteinasas en los procesos
de envejecimiento cutáneo
Las metaloproteinasas también ejercen un papel relevante en los procesos de envejecimiento cutáneo. Sabemos que la exposición reiterada al sol produce fotoenvejecimiento caracterizado por la existencia de distintas alteraciones de la matriz extracelular dérmica. Existen fibras elásticas anormales en las que se aprecia un aumento de la cantidad de elastina y fibrilina 1; también se constata la presencia de versicán, un condroitín sulfato que se encuentra asociado a las mismas. Todo esto condiciona una baja elasticidad de la piel33. Por el contrario, el colágeno tipo I, el componente más abundante de la matriz extracelular dérmica, y la decorina, un proteoglucano dermatán sulfato asociado a estas fibras, se encuentran reducidas en la piel crónicamente fotodañada34.
Se ha demostrado en experimentos in vivo que la UVB, incluso en dosis inferiores a las que habitualmente inducen eritema, puede hacer que se expresen en la epidermis MMP-1, MMP-3 y MMP-9. La aplicación de ácido transretinoico en piel sana hace que no se observen estas metaloproteinasas, circunstancia interesante pues permite especular con la posibilidad de que el ácido retinoico prevenga alteraciones en la matriz extracelular a largo plazo35. Los UVA inducen in vivo la expresión de MMP-1 en los fibroblastos dérmicos y de MMP-1, MMP-2 y MMP-3 en cultivos36.
Estas observaciones permiten afirmar que en la génesis del daño solar crónico intervienen dos circunstancias, el aumento en queratinocitos epidérmicos de metaloproteinasas inducidas por UVB y el aumento de metaloproteinasas en los fibroblastos dérmicos inducidos por UVA. En este modelo, la MMP-1 latente derivada de los queratinocitos o de los fibroblastos dérmicos debe ser activada por MMP-3 y posteriormente, iniciar la degradación de colágenos I y III que debe ser completada posteriormente por MMP-2 y MMP-9. Además, la expresión de MMP-2, MMP-9 y MMP-3 produce la degradación de los componentes no colágenos de la matriz extracelular, incluyendo la membrana basal y los proteoglucanos.
LAS METALOPROTEINASAS EN DIFERENTES PROCESOS PATOLOGICOS CUTANEOS
Enfermedades ampollares
En las enfermedades ampollosas cutáneas las metaloproteinasas tienen un papel protagonista, pues son capaces de intervenir en la zona donde asientan estas enfermedades37. Las metaloproteinasas 1, 2, 3 y 9 son capaces de degradar colágeno tipo VII. El colágeno tipo IV es el sustrato donde actúan las metaloproteinasas 2, 3, 7, 9 y 10, y la laminina 1 puede ser degradada por las metaloproteinasas 2, 3, 7 y 14.
Las metaloproteinasas intervienen en las enfermedades ampollosas, pero no participan en su patogenia. Estudiando muestras de pénfigo y de dermatosis acantolítica transitoria se constató que en las lesiones iniciales no existía aumento de MMP-1. Tampoco cuando se ha completado la reepitelización, aunque la membrana basal no se haya reconstruido totalmente38, como se comprobó haciendo experimentos en ampollas de succión. Parece pues que los niveles de metaloproteinasa están relacionados con el proceso de migración queratinocítica.
En la epidermolisis ampollosa distrófica recesiva se constata un aumento de producción de MMP-1 y MMP-3 en los fibroblastos de piel afectada y no afectada; estas metaloproteinasas son capaces de degradar colágeno tipo VII, por lo que se piensa que intervienen en este proceso en la degradación de la membrana basal39. En una pequeña serie de casos de epidermolisis ampollosa simple y adquirida se ha demostrado MMP-1 en los queratinocitos basales esta circunstancia y se ha relacionado con procesos de regeneración epidérmica.
La dermatitis herpetiforme se caracteriza por la destrucción de colágeno tipo IV y laminina 1 en la membrana basal, que conducen a la formación de las ampollas. En los queratinocitos basales que rodean a los microabscesos de neutrófilos se expresan las metaloproteinasas I y III; esto suele ser un fenómeno precoz y mantenido durante todo el proceso e independiente de los fenómenos de reepitelización40. La estromelisina 1 (MMP-3) puede contribuir a la formación de las ampollas por degradación de colágeno tipo IV y laminina y la MMP-1 puede hacerlo por degradación de colágeno tipo VII.
En el penfigoide ampolloso se detecta un aumento de MMP-9 fundamentalmente en los eosinófilos acumulados alrededor de las ampollas41. Se sabe por experimentación in vitro que la MMP-9 es capaz de degradar el colágeno tipo XVII, que es un componente fundamental de los hemidesmosomas. Precisamente el autoantígeno del penfigoide está compuesto por esta sustancia.
Liquen plano
En el liquen plano existe destrucción del sistema epitelial de anclaje, degeneración de los queratinocitos basales, disminución de los tonofilamentos y hemidesmosomas y formación de vesículas. En las formas agudas de liquen plano se expresa MMP-2, que es capaz de romper la laminina 5 in vitro y, por tanto, de digerir la membrana basal. Por este mecanismo puede contribuir a la patogenia del liquen plano mediante la inducción de una expresión alterada de integrinas en queratinocitos basales, que conduce finalmente a la formación de ampollas42.
Granulomas no infecciosos
Muchos granulomas se caracterizan por un depósito de sustancias alteradas en la matriz extracelular y cambios degenerativos en el colágeno y la elastina. En los granulomas anulares y en la necrobiosis lipoídica se encuentra actividad tanto de MMP-1 como de TIMP-1; ambos se expresan en estas lesiones de manera precoz y pueden contribuir a la remodelación del conjuntivo consustancial a estos trastornos. El TIMP-1 se expresa en mayor medida en la zona externa de la empalizada del granuloma anular y en el infiltrado linfohistiocitario situado alrededor de los vasos en la necrobiosis lipoídica43.
Fibrosis dérmica
En cuanto a la fibrosis dérmica se ha estudiado la esclerodermia sistémica y la localizada. Existe una fase temprana caracterizada por una inflamación de disposición fundamentalmente perivascular, seguida de una acumulación excesiva de matriz extracelular, en particular de colágenos de tipo I y III en la dermis. Se ha comprobado que, en la esclerodermia, los fibroblastos cultivados producen menos MMP-1 y menos MMP-3 y más cantidad de TIMP-1 que los fibroblastos normales44. Además, existe un llamativo trabajo de investigación que relaciona los niveles más o menos altos de TIMP-1 sérico con la actividad de la esclerodermia45. Otra aportación muy interesante al respecto es la constatación, en estudios in vivo de fibroblastos de la esclerodermia, de niveles elevados de TIMP-3; esta circunstancia permite especular con la posibilidad de que este inhibidor tenga responsabilidad en la patogenia de la fibrosis dérmica que ocurre en la esclerodermia sistémica y localizada46.
METALOPROTEINASAS EN PROCESOS TUMORALES CUTANEOS
La angiogénesis producida por los tumores es esencial para su progresión. Los vasos neoformados son un vehículo de infiltración y en los tumores malignos, a través de ellos pueden pasar células a la circulación47. La interacción de las células tumorales con el estroma y células de la matriz extracelular es un factor importante en el desarrollo tumoral; éstos inducen en muchos casos una respuesta proliferativa en el estroma adyacente, que se interpreta como una respuesta inespecífica del huésped para intentar frenar la progresión del tumor48. Aunque las metaloproteinasas están producidas también por células no tumorales, la mayoría se han sintetizado y clonado a partir de líneas celulares tumorales y existen estudios que afirman que hay una clara relación entre la expresión de las metaloproteinasas y la capacidad de invasión y metástasis de los tumores; al respecto se encuentran estudios realizados en tumores de colon, pulmón, cabeza y cuello, mama, tiroides, próstata, ovario, estómago y en piel en carcinomas basocelulares y espinocelulares49. En los tumores, las metaloproteinasas no son producidas exclusivamente por las células tumorales, sino que también lo son por las células de la estroma adyacente. Sin embargo, para sacar conclusiones pronósticas de los niveles de metaloproteinasas en tumores sería deseable el desarrollo de anticuerpos que sean capaces de distinguir entre proenzimas y enzimas activadas y entre las diferentes metaloproteinasas libres o unidas a TIMPS50.
La matrilisina es una metaloproteinasa constitutiva del epitelio ecrino y apocrino de la piel; esta enzima también se expresa en diversos tumores glandulares51 y se ha demostrado en siringomas, cilindromas y espiradenomas ecrinos. Su expresión está más relacionada con el mantenimiento de la capacidad secretoria que con su capacidad invasiva o con fenómenos de remodelación.
En los dermatofibromas52 se constata la presencia de estromelisina 3 (MMP-12), circunstancia que no ocurre en los dermatofibrosarcomas, por lo que se piensa que los fibroblastos que lo producen son capaces de inducir fibrosis en procesos exclusivamente benignos. Los dermatofibromas tienen una expresión mucho menor de TIMP-1 y TIMP-2 que los dermatofibrosarcomas53.
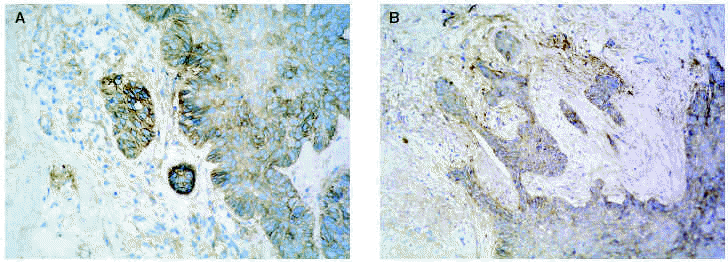
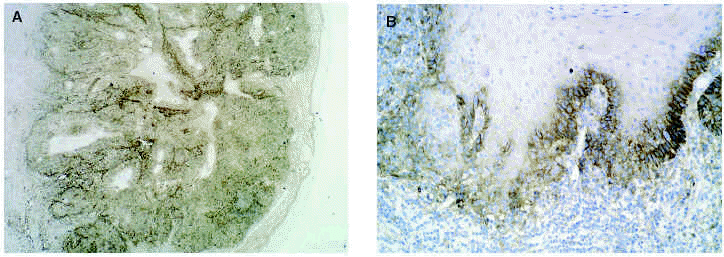
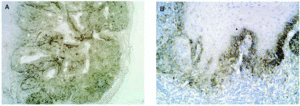
En cuanto a los tumores epiteliales49, en los carcinomas basocelulares, MMP-1, MMP-2, MMP-9 y MMP-11 se expresan en las células estromales que rodean los islotes tumorales. También se ha encontrado MMP-9 en los eosinófilos y en los neutrófilos del infiltrado inflamatorio que rodea los nidos tumorales. El TIMP-2 muestra unos niveles mucho más altos en carcinomas basocelulares que en espinocelulares lo que indica una relación inversa con la capacidad metastásica. La MT1-MMP en el carcinoma basocelular se evidencia en los fibroblastos que rodean los nidos de invasión tumoral y en las células epiteliales de la periferia de los nidos tumorales (figs. 3A y B). En el carcinoma espinocelular, tanto en células tumorales como en fibroblastos adyacentes a la zona de invasión, existen niveles altos de MMP-1 y MMP-10; en cambio, MMP-2 y MMP-11 solamente se detectan en fibroblastos estromales situados junto a los nidos de invasión tumoral. La MT1-MMP, en el carcinoma espinocelular, se expresa tanto en nidos tumorales como en fibroblastos que los rodean (figs. 4A y B). Se piensa que el contacto entre las células tumorales y los fibroblastos que están alrededor estimula la producción de MT1-MMP, que a su vez induce la producción de MMP-2, lo cual está estrechamente relacionada con la invasión tumoral54.
Fig. 3.--MT1-MMP en carcinoma basocelular (A). Expresión en fibroblastos adyacentes a los nidos (B).
Fig. 4.--MT1-MMP en carcinoma espinocelular (A). Expresión en frente de crecimiento tumoral y fibroblastos adyacentes (B).
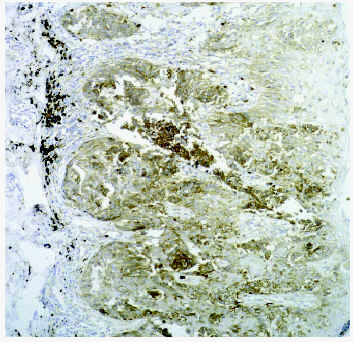
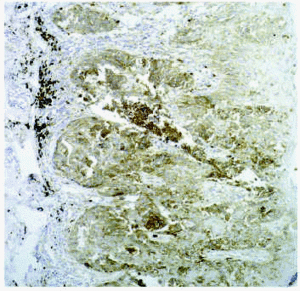
La degradación de la membrana basal es un requisito necesario en caso de proliferación epitelial melanocítica hacia la dermis; también lo es la degradación de un material parecido a la membrana basal que rodea a los nidos de melanomas y nevos55. En los melanomas (fig. 5) se observa un aumento de la actividad de la gelatinasa MMP-2, que es la metaloproteinasa que degrada el colágeno tipo IV, predominante en la membrana basal. También existe un aumento de producción de MMP-9, MMP-1 y MMP-3. La MMP-2 presenta actividad de manera precoz cuando existe proliferación melanocítica, y también aumenta su expresión cuanto mayor es la desorganización y atipia en el melanoma. La MT1-MMP56 aumenta prácticamente en todas las circunstancias en las que existe aumento de MMP-2. En los melanomas con niveles III y IV de Clark existe un aumento de niveles de TIMP-1 y TIMP-3, lo cual no se observa en los melanomas de nivel I y II. Destacamos algunos estudios de la literatura médica sobre el papel de las metaloproteinasas en los aspectos proliferativos del melanoma57-61.
Fig. 5.--Expresión de MT1-MMP en melanoma.
CONCLUSION
Los comentarios efectuados en este texto ilustran el papel tan importante que desempeñan las metaloproteinasas en la biología de la piel normal y en algunas enfermedades cutáneas.
Fármacos tan familiares en medicina como las tetraciclinas ejercen su papel terapéutico en muchas patologías, actuando sobre las metaloproteinasas62. El futuro desarrollo de inhibidores específicos no tóxicos de las metaloproteinasas puede tener un papel importante en la terapéutica del fotoenvejecimiento, los tumores cutáneos, la curación de heridas o las enfermedades ampollosas. Existen al respecto datos esperanzadores en la literatura científica, con líneas abiertas de estudio en animales63 y en cultivos celulares64.
Una búsqueda en internet muestra cómo un gran número de registros de la oficina de patentes americana lo son de inhibidores de las metaloproteinasas y cómo estas han sido adquiridas por los grandes laboratorios farmacéuticos del mundo. La terapéutica con inhibidores de metaloproteinasas puede ser una realidad en un futuro próximo.