INTRODUCCION
El paclitaxel es un fármaco antineoplásico de la familia de los taxanos. Este fármaco se obtiene de la corteza del árbol Taxus brevifolia, originario de América. Este fármaco es difícil de aislar, ya que su obtención conlleva la muerte del árbol. Ese hecho ha motivado la investigación de nuevos taxanos, como el docetaxel, un análogo semisintético del paclitaxel extraído de las hojas del árbol Taxus baccata, originario de Europa1. Sin embargo, el paclitaxel se sigue empleando en protocolos de tratamiento para el cáncer metastásico de mama, ovario, pulmón y de cabeza y cuello, entre otros. Su actividad antineoplásica radica en la capacidad de esta sustancia de paralizar el huso mitótico en la fase de proliferación celular. Los taxanos promueven la polimerización de la tubulina formando microtúbulos estables, que no se despolimerizan, se acumulan en la célula y por tanto, impiden la división celular y, con ello, la muerte celular2,3.
Los efectos secundarios más importantes y limitantes del paclitaxel son su cardiotoxicidad, neurotoxicidad y las reacciones de hipersensibilidad. Las reacciones adversas cutáneas más conocidas son la eritrodisestesia, edemas, rubor, erupción fija ampollosa, fenómenos de evocación, onicolisis y alopecia4. Sin embargo, los cambios cutáneos esclerodermiformes son infrecuentes en los taxanos. Así tan sólo existen 5 casos de fibrosis cutánea inducida por el docetaxel2,3,5, uno de ellos con repercusión sistémica2, y recientemente 3 casos inducidos por el paclitaxel6-8. Se describe un caso más de fibrosis cutánea o cambios esclerodermiformes en miembros inferiores en una paciente en tratamiento con paclitaxel por cáncer de mama.
DESCRIPCION DEL CASO
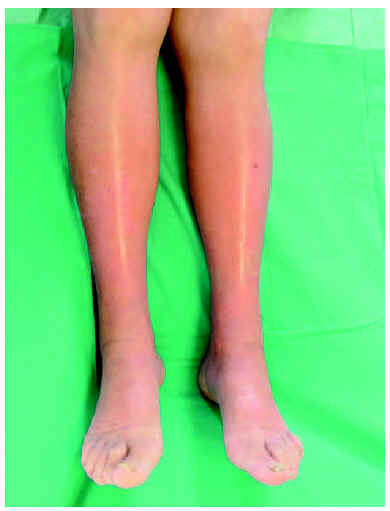
Una mujer de 64 años estaba diagnosticada de un carcinoma lobulillar invasivo de mama (T2N1M0). Se le realizó una mastectomía radical modificada y recibió posteriormente quimioterapia. En primer lugar recibió 4 ciclos de 5-fluorouracilo, epirrubicina y ciclofosfamida. Posteriormente, se programaron 8 ciclos semanales de paclitaxel, 100 mg/m2. A partir del cuarto ciclo de tratamiento con el paclitaxel apareció un edema con fóvea que afectaba, a ambas piernas alcanzando de forma progresiva hasta mitad de los muslos (fig. 1) en el sexto ciclo y sin responder a tratamiento con diuréticos, tanto a la hidroclorotiazida como a la espironolactona. Este edema evolucionó hacia una piel indurada y brillante y con limitación del movimiento en las articulaciones de las rodillas y tobillos. Debido a la progresión del cuadro se suspendió el tratamiento con paclitaxel en el sexto ciclo y no se concluyeron los 8 ciclos que estaban programados.
Fig. 1.--Piel brillante, indurada y edematizada que afecta a ambas piernas.
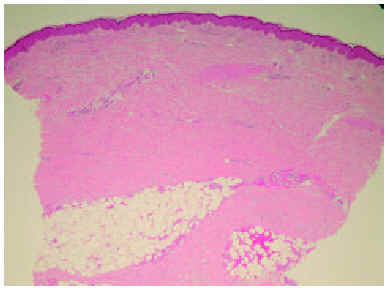
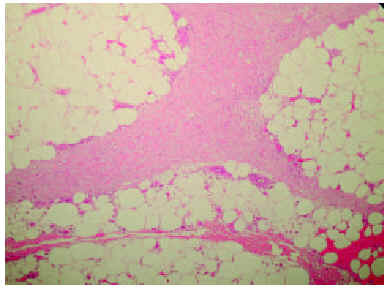
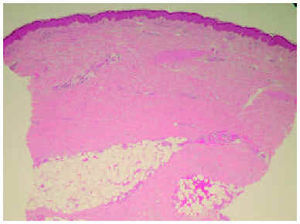
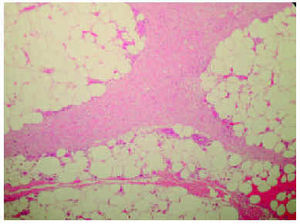
Una biopsia cutánea de la pierna mostró cambios compatibles con una esclerodermia (figs. 2 y 3). Destacaba una dermis engrosada formada por haces de colágeno engrosados y ausencia de anejos cutáneos, así como un engrosamiento y fibrosis de los septos interlobulillares del tejido celular subcutáneo.
Fig. 2.--Dermis engrosada compuesta por haces de colágeno esclerótico y atrofia de los anejos. (Hematoxilina-eosina, x10.)
Fig. 3.--Afectación del tejido celular subcutáneo con engrosamiento de los tabiques interlobulillares. (Hematoxilina-eosina, x40.)
Se realizó una anamnesis dirigida, una exploración física y un estudio de extensión, incluyendo batería de autoanticuerpos y tomografía computarizada (TC) de tórax, abdomen y pelvis, que descartó una esclerodermia sistémica y progresión tumoral. Aunque en cuanto se suspendió el paclitaxel se inició tratamiento con corticoides sistémicos, éstos sólo se mantuvieron 2 meses debido a la escasa mejoría.
No obstante, después de un año y medio de la suspensión del tratamiento con paclitaxel, la induración de las piernas había ido remitiendo lentamente, pero no por completo, afectando actualmente el tercio inferior de ambas piernas y recuperando capacidad de flexión y extensión articular después de ser remitida al servicio de rehabilitación de nuestro hospital.
COMENTARIO
Los efectos secundarios cutáneos asociados a los taxanos más frecuentemente descritos se resumen en la tabla 14. Estas reacciones cutáneas normalmente son asintomáticas o poco sintomáticas y no suelen interferir en el ritmo de los ciclos, ya que suelen remitir en unos días o semanas1. Sin embargo, la fibrosis cutánea asociada a taxanos es un efecto adverso infrecuente, pero que puede resultar incapacitante. Todos los casos descritos de fibrosis por taxanos son muy recientes. Los primeros que se describieron fueron debidos al docetaxel2,3,5, pero en el último año se han publicado 3 casos debidos al paclitaxel6-8, y todos tienen características similares. La esclerodermia suele iniciarse en miembros inferiores con un edema con fóvea que no responde a diuréticos después de varios ciclos del quimioterápico y empeora hasta que es retirado. Entonces la mejoría es lenta pero progresiva. Respecto a los casos desencadenados por el docetaxel son cinco los publicados hasta la actualidad. Estos pacientes desarrollaron una fibrosis de miembros inferiores tras la aparición de un edema que no respondía a diuréticos a partir del tercer, quinto y séptimo ciclo de quimioterapia con docetaxel. En 2 pacientes tuvo que ser retirado el docetaxel por otras complicaciones. En los tres el cuadro fue revirtiendo, y se curó tras un año en uno de ellos, 5 meses en otro y en el tercero existía un engrosamiento residual persistente al año3.
Cleveland et al5 han descrito otro caso de fibrosis cutánea inducida por docetaxel. En este caso, el paciente desarrolló una fibrosis cutánea generalizada, que se inició después del ciclo 18 y que revirtió a las 6 semanas de retirar el quimioterápico. El caso más reciente de esclerodermia asociada al docetaxel difiere un poco de los cuatro anteriores2. La esclerodermia cutánea fue generalizada, iniciándose en los miembros superiores y afectando incluso la apertura de la boca, asociada a telangiectasias y sinovitis. Además, los anticuerpos antinucleares (ANA) resultaron positivos a títulos altos, lo que sugería un proceso autoinmune coincidiendo con la quimioterapia, ya que también se había descartado que fuera un síndrome paraneoplásico revelador de progresión del tumor. Sin embargo, a los 6 meses de retirar el docetaxel, no había evidencia de fibrosis. Dado que todas las esclerodermias descritas hasta ese momento estaban relacionadas con el docetaxel y no con el paclitaxel, estos autores planteaban la posibilidad de que fuera el vehículo empleado en la elaboración del fármaco, el Tween 80, y no el propio principio activo el causante de este efecto adverso. Por otro lado el cremophor EL es un componente del excipiente tanto de docetaxel como del paclitaxel y es la principal causa de las reacciones de hipersensibilidad por taxanos, ya que actúa como un liberador de histamina. Algunos autores sugieren que el cremophor EL al igual que puede inducir reacciones anafilactoides, también podría desencadenar otros procesos autoinmunes9,10.
Lauchli et al6 describieron el primer caso de esclerodermia relacionada con el paclitaxel. Se trataba de una mujer que desarrolló una esclerodermia que se inició como un edema en miembros inferiores resistente a diuréticos después de tres ciclos de paclitaxel, pero esta esclerodermia empeoró provocando microstomía, retracción de la lengua y mínima afectación pulmonar y renal. El estudio de autoinmunidad fue negativo. Además, ni la retirada del fármaco, la administración de corticoides sistémicos ni la PUVA (psoraleno y luz ultravioleta) lograron mejorar el cuadro. Los autores comentan que sólo el tiempo, la fisioterapia y la infusión de iloprost consiguieron paliar los síntomas. Posteriomente, dos nuevos casos de esclerodermia relacionada con paclitaxel se recogen en la literatura médica. Kupfer et al7 describen una mujer en la cual el cuadro clínico se inició como un eritema en cara, cuello, y mano izquierda, que evolucionó hacia una esclerosis grave de la parte alta de la espalda, los hombros, el cuello y la mano izquierda con fascitis y retracción de la misma. El estudio de autoanticuerpos también resultó negativo, y las lesiones mejoraron lentamente en 5 meses, momento en el que la paciente falleció7. De Angelis et al8 recogen otro caso muy parecido. Se trata de una mujer que desarrolló un cuadro de esclerodermia progresiva indistinguible de una esclerosis sistémica relacionada temporalmente con la toma de paclitaxel por un cáncer metastásico de ovario. Como en el caso anterior, el estudio de autoanticuerpos fue negativo y no existía fenómeno de Raynaud ni calcinosis8.
Nuestro caso apoya el hecho de que los taxanos, tanto el docetaxel como el paclitaxel, aunque de forma excepcional, pueden provocar una fibrosis cutánea de forma dependiente de la dosis. Parece que, en los 2 casos descritos, al igual que el nuestro, la mejoría tras la retirada el fármaco no es tan rápida y completa como en los casos descritos de fibrosis por docetaxel. Además, también es importante considerar que la fibrosis puede afectar no sólo a los miembros inferiores, aunque esta es la localización afectada con más frecuencia.
Por lo tanto, los taxanos deberían incluirse en la lista de fármacos que pueden provocar reacciones esclerodermiformes, como ya ocurre con la bleomicina. Hasta en el 10 % de los pacientes en tratamiento con bleomicina se desarrollan esclerodactilia, fenómeno de Raynaud o incluso una necrosis digital. En muchos casos la esclerodermia es progresiva y es indistinguible de una esclerodermia sistémica, y en ocasiones puede ocasionar una fibrosis pulmonar. Por otra parte, este cuadro no suele remitir con la suspensión del fármaco11-13.