La reciente publicación de los resultados de ensayos clínicos en los que la disección ganglionar no ha demostrado beneficio de supervivencia en pacientes con metástasis en el ganglio centinela plantea la necesidad de modificar el tratamiento del paciente con melanoma. El presente trabajo aporta una actualización de la evidencia sobre diferentes aspectos necesarios (vías de progresión metastásica, factores predictores, tratamiento adyuvante, etc.) para la toma de decisiones en el paciente con melanoma y metástasis en el ganglio centinela y plantea un algoritmo de toma de decisiones para este escenario clínico. La evidencia actualmente disponible respalda el abandono de la disección ganglionar en aquellos pacientes con metástasis de bajo riesgo en el ganglio centinela (carga tumoral en el ganglio centinela inferior o igual a 1mm).
Recent publication of the results of clinical trials in which lymph node dissection was not associated with any survival benefit in patients with sentinel node metastasis makes it necessary to reconsider the treatment of patients with melanoma. This article provides an update on the available evidence on the diverse factors (routes of metastatic spread, predictors, adjuvant therapy, etc.) that must be considered when treating patients with sentinel node-positive melanoma. The authors propose a decision-making algorithm for use in this clinical setting. The current evidence no longer supports lymph node dissection in patients with low-risk sentinel node metastasis (sentinel node tumor load ≤1mm).
Los protocolos de melanoma cutáneo vigentes recomiendan, una vez confirmado el diagnóstico mediante el estudio anatomopatológico, la exéresis del tumor primario con márgenes de seguridad y la realización de la biopsia selectiva del ganglio centinela (BSGC) en función del espesor de Breslow1,2. En aquellos pacientes en los que se identifican metástasis en el ganglio centinela (GC), el procedimiento estándar hasta este momento ha sido la disección ganglionar completa de la región del GC metastásico y la valoración de adyuvancia con interferón.
La BSGC fue introducida por Morton et al. como un procedimiento pronóstico mínimamente invasivo, con menos complicaciones que la disección ganglionar electiva que hasta ese momento se realizaba a todos los pacientes con melanoma3. Los resultados del Multicenter Selective Lymphadenectomy Trial-I confirmaron la ventaja de la BSGC para la estadificación ganglionar y planteaban la posibilidad de que la disección ganglionar podría mejorar la supervivencia en aquellos pacientes con metástasis en el GC4. Desde entonces, la BSGC y la posterior disección ganglionar en aquellos pacientes con micrometástasis en el GC se convirtieron en el tratamiento estándar del paciente con melanoma cutáneo.
Más de dos décadas después, el tratamiento del paciente con melanoma se enfrenta a una transformación igualmente relevante y que de nuevo plantea la substitución de la disección ganglionar en el paciente con metástasis del GC por un abordaje menos invasivo y mórbido, sin comprometer la supervivencia específica por melanoma.
Progresión metastásica del melanomaDurante décadas se ha aceptado la hipótesis de progresión secuencial del melanoma primario según la cual las células con potencial metastásico alcanzarían los ganglios linfáticos y, posteriormente, y a partir de este, el torrente sanguíneo hasta implantarse en otros órganos. Esta hipótesis halstediana (Halsted, 1907) fue confrontada en los años 70 por una hipótesis alternativa según la cual la metástasis ganglionar actuaría simplemente como indicador, y no como desencadenante, de las metástasis a distancia5. Según esta hipótesis no debería esperarse que la disección ganglionar radical mejorase la supervivencia de los pacientes así tratados. Además de los estudios iniciales en el cáncer de mama, otras publicaciones en el campo del melanoma respaldan también la posible diseminación a distancia de forma directa, e independiente de la existencia de metástasis ganglionar previa6,7.
Un reciente estudio del Registro Central de Melanoma de Alemania incluyó 2.299 pacientes con melanoma estadios IA-IIC (7.a edición de la American Joint Committee on Cancer [AJCC]) que progresaron a estadios III y/o IV durante el seguimiento. En esta cohorte se diferenciaron 3 subgrupos de pacientes en función de la progresión metastásica observada: pacientes con metástasis linfática exclusivamente (38,4%), pacientes que desarrollaron metástasis a distancia exclusivamente (16,2%) y pacientes que desarrollaron metástasis ganglionares y a distancia (45,4%)7. La supervivencia libre de metástasis a distancia, la supervivencia global (SG) y la supervivencia específica por melanoma fueron las mismas independientemente de la presencia o no de metástasis ganglionares previas a la progresión a distancia. A partir de esta observación, los autores concluyeron que ambas localizaciones metastásicas se originan a partir del tumor primario siguiendo un modelo de progresión paralela en lugar de secuencial7. Este modelo de progresión podría además explicar la ausencia de beneficio de supervivencia observado después de la disección ganglionar en pacientes con BSGC positiva.
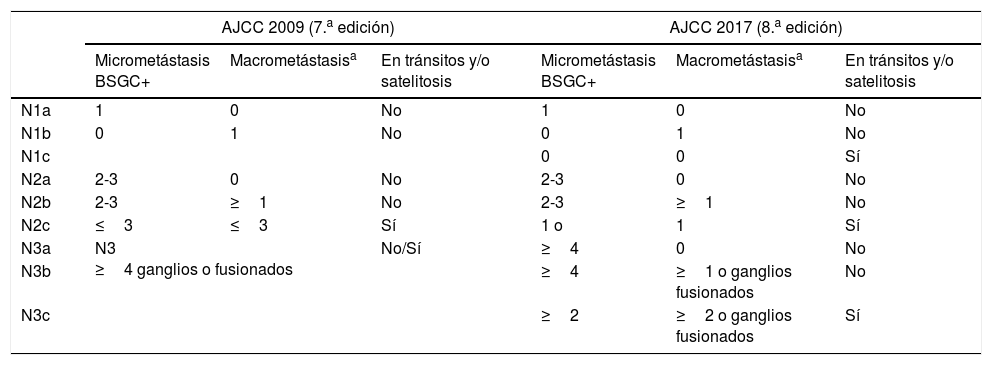
Factores predictores de supervivencia en el paciente con metástasis en el ganglio centinela. El estadio III en la 8.a versión de la American Joint Committee on CancerLa 8.a edición de la clasificación TNM de la AJCC mantiene el espesor de Breslow y la ulceración del tumor primario como los predictores pronósticos más importantes en el paciente con melanoma localizado8. En pacientes con metástasis ganglionar (estadio III) esta clasificación mantiene como factores pronósticos la presencia de satelitosis (micro o macroscópicas) (N1c, N2c, N3c), número de ganglios afectados (N1-3) y carga tumoral. Respecto a la carga tumoral, esta versión introduce el concepto de «metástasis clínicamente oculta» para referirse a aquellos pacientes con metástasis identificadas mediante BSGC y sin evidencia clínica o radiológica de enfermedad (N1a, N2a, N3a) (descrita como «microscópica» en la versión 7.a de la AJCC)9 (tabla 1). Aquellas metástasis identificadas mediante exploración física o estudios de imagen, y definidas como «macroscópicas» en la 7.a edición, son consideradas metástasis «clínicamente detectadas» en la versión actual (N1b, N2b, N3b). Las curvas de supervivencia de la AJCC demuestran que estos parámetros permiten estratificar a los pacientes con melanoma y metástasis locorregionales, con una mejor supervivencia de los pacientes con metástasis ganglionar clínicamente oculta y menor número de ganglios metastásicos8,9.
Estadificación ganglionar (N) en las clasificaciones de la American Joint Committee on Cancer 2009 y 2017
| AJCC 2009 (7.a edición) | AJCC 2017 (8.a edición) | |||||
|---|---|---|---|---|---|---|
| Micrometástasis BSGC+ | Macrometástasisa | En tránsitos y/o satelitosis | Micrometástasis BSGC+ | Macrometástasisa | En tránsitos y/o satelitosis | |
| N1a | 1 | 0 | No | 1 | 0 | No |
| N1b | 0 | 1 | No | 0 | 1 | No |
| N1c | 0 | 0 | Sí | |||
| N2a | 2-3 | 0 | No | 2-3 | 0 | No |
| N2b | 2-3 | ≥1 | No | 2-3 | ≥1 | No |
| N2c | ≤3 | ≤3 | Sí | 1 o | 1 | Sí |
| N3a | N3 ≥4 ganglios o fusionados | No/Sí | ≥4 | 0 | No | |
| N3b | ≥4 | ≥1 o ganglios fusionados | No | |||
| N3c | ≥2 | ≥2 o ganglios fusionados | Sí | |||
BSGC: biopsia selectiva del ganglio centinela.
Los estudios que analizaron la supervivencia de pacientes con metástasis en el GC sometidos o no a disección ganglionar incluyeron, como era de esperar, pacientes con baja carga tumoral. En el ensayo DeCOG-SLT el 91% de los pacientes del grupo de observación y el 93% de los pacientes sometidos a disección presentaron metástasis en un solo GC (N1), mientras que el 9 y el 7%, respectivamente, presentaron metástasis en 2 o más GC (N2 y N3). Además, el 68% de los pacientes del grupo de observación y el 63% del grupo de disección presentaron metástasis del GC inferiores o iguales a 1mm, con un 25 y 26% de pacientes con metástasis mayores de 1mm en cada grupo de estudio10. En el ensayo clínico alemán la carga tumoral en el GC (≤1mm vs. >1mm) fue identificada como factor predictor independiente de supervivencia libre de recurrencia (SLR), SLR a distancia y SG10. Sin embargo, la baja proporción de pacientes con carga tumoral superior a 1mm (25-26%) no permitió alcanzar la potencia estadística necesaria para emitir recomendaciones definitivas sobre el abandono de la disección ganglionar en pacientes con carga tumoral superior a 1mm. De la misma forma, en el Multicenter Selective Lymphadenectomy Trial-II (MSLT-II), el 65,5 y 66,8% de los pacientes de los grupos de observación y disección, respectivamente, presentaron metástasis inferiores o iguales a 1mm en el GC, con un diámetro mediano de 0,67 y 0,61mm en cada uno de los grupos de estudio11. En el MSLT-II, el diámetro tumoral superior a 1mm no fue identificado como predictor independiente de supervivencia en ninguno de los grupos de estudio (disección vs. observación)11. De la misma forma, el número de GC metastásicos, analizado como estadio N, no demostró papel predictor de supervivencia en ninguno de los ensayos clínicos (DeCOG-SLT, MSLT-II). Por otro lado, la extensión extracapsular de la metástasis del GC no fue analizada en el MSLT-II ni en el DeCOG-SLT, en tanto que este criterio fue considerado como criterio de exclusión para el reclutamiento en ambos ensayos11.
Un estudio reciente de la EORTC y el Instituto de Melanoma de Australia basado en una cohorte de 1.539 pacientes con metástasis del GC evaluó la relevancia de la carga tumoral del GC como factor predictor mediante criterios micromorfométricos: la clasificación de Rotterdam de diámetro tumoral máximo (<0,1mm, 0,1-1,0mm, >1,0mm), la localización intranodal mediante la clasificación de Dewar (subcapsular, no subcapsular) y la profundidad tumoral en el GC (clasificación de Starz)12. El análisis multivariante identificó como predictores de pobre supervivencia específica por melanoma la localización no subcapsular de la metástasis, una profundidad tumoral en el GC>1mm y un diámetro tumoral máximo superior a 1mm. El umbral de 1mm de carga tumoral en el GC fue el predictor más consistente de positividad de ganglios no centinela, de supervivencia libre de enfermedad y de supervivencia específica por melanoma reducidas12.
Por lo tanto, y en relación con la carga tumoral del GC como factor para la toma de decisiones, debe destacarse la utilidad de este indicador como marcador de una mayor probabilidad de progresión regional y a distancia, y de una peor supervivencia específica por melanoma. Desde la perspectiva de la toma de decisiones terapéuticas, si bien la disección ganglionar podría proporcionar un mejor control regional, no sería esperable una mejora de la supervivencia específica, beneficio que sí se está observando con los nuevos regímenes de adyuvancia.
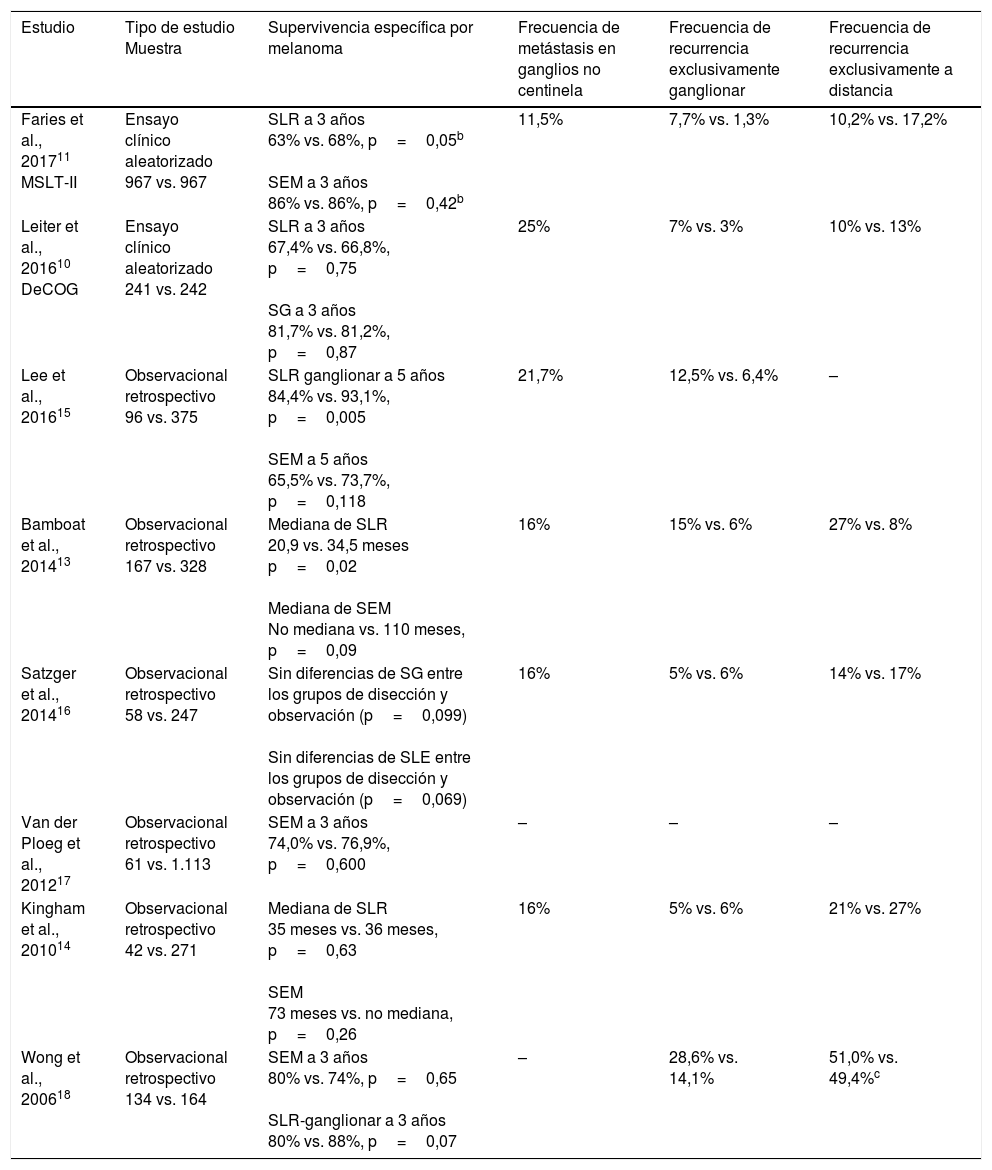
Disección ganglionar en el paciente con metástasis en el ganglio centinela: evidencia actualLa reciente publicación de los resultados finales del MSLT-II ha abierto el debate sobre la necesidad o no de completar la disección ganglionar en pacientes con metástasis microscópicas de melanoma, es decir, identificadas mediante la BSGC11. Este ensayo clínico demuestra que la disección ganglionar inmediata no mejora la supervivencia de este grupo de pacientes con respecto a la observación y disección ganglionar terapéutica una vez que el paciente desarrolla metástasis ganglionar identificada mediante exploración física o estudios de imagen. Estos hallazgos fueron precedidos por resultados similares observados en el ensayo clínico del Grupo Cooperativo Alemán (DeCOG-SLT)10, y en otros estudios retrospectivos que también han aportado resultados en contra de la disección ganglionar en pacientes con melanoma y con metástasis en el GC13-18 (tabla 2).
Estudios que analizan resultados en pacientes con metástasis en el ganglio centinela sometidos a observación o disección ganglionar inmediataa
| Estudio | Tipo de estudio Muestra | Supervivencia específica por melanoma | Frecuencia de metástasis en ganglios no centinela | Frecuencia de recurrencia exclusivamente ganglionar | Frecuencia de recurrencia exclusivamente a distancia |
|---|---|---|---|---|---|
| Faries et al., 201711 MSLT-II | Ensayo clínico aleatorizado 967 vs. 967 | SLR a 3 años 63% vs. 68%, p=0,05b SEM a 3 años 86% vs. 86%, p=0,42b | 11,5% | 7,7% vs. 1,3% | 10,2% vs. 17,2% |
| Leiter et al., 201610 DeCOG | Ensayo clínico aleatorizado 241 vs. 242 | SLR a 3 años 67,4% vs. 66,8%, p=0,75 SG a 3 años 81,7% vs. 81,2%, p=0,87 | 25% | 7% vs. 3% | 10% vs. 13% |
| Lee et al., 201615 | Observacional retrospectivo 96 vs. 375 | SLR ganglionar a 5 años 84,4% vs. 93,1%, p=0,005 SEM a 5 años 65,5% vs. 73,7%, p=0,118 | 21,7% | 12,5% vs. 6,4% | – |
| Bamboat et al., 201413 | Observacional retrospectivo 167 vs. 328 | Mediana de SLR 20,9 vs. 34,5 meses p=0,02 Mediana de SEM No mediana vs. 110 meses, p=0,09 | 16% | 15% vs. 6% | 27% vs. 8% |
| Satzger et al., 201416 | Observacional retrospectivo 58 vs. 247 | Sin diferencias de SG entre los grupos de disección y observación (p=0,099) Sin diferencias de SLE entre los grupos de disección y observación (p=0,069) | 16% | 5% vs. 6% | 14% vs. 17% |
| Van der Ploeg et al., 201217 | Observacional retrospectivo 61 vs. 1.113 | SEM a 3 años 74,0% vs. 76,9%, p=0,600 | – | – | – |
| Kingham et al., 201014 | Observacional retrospectivo 42 vs. 271 | Mediana de SLR 35 meses vs. 36 meses, p=0,63 SEM 73 meses vs. no mediana, p=0,26 | 16% | 5% vs. 6% | 21% vs. 27% |
| Wong et al., 200618 | Observacional retrospectivo 134 vs. 164 | SEM a 3 años 80% vs. 74%, p=0,65 SLR-ganglionar a 3 años 80% vs. 88%, p=0,07 | – | 28,6% vs. 14,1% | 51,0% vs. 49,4%c |
SEM: supervivencia específica por melanoma; SG: supervivencia global; SLR: supervivencia libre de recurrencia.
Estos estudios analizaron otros resultados secundarios de interés (tabla 2). En primer lugar, entre el 75,0 y el 88,5% de las disecciones realizadas no identificaron metástasis adicionales en ganglios no centinela; en segundo lugar, la frecuencia de morbilidad postoperatoria relevante fue significativamente superior en el grupo de pacientes tratados con disección inmediata (24,2% vs. 6,3% de linfedema en el MSLT-II)11. Por otra parte, tanto el MSLT-II como el DeCOG-SLT confirmaron un mejor control regional de la enfermedad en los pacientes tratados con disección ganglionar inmediata (del 77% vs. 92% a 3 años, p<0,001 en MSLT-II)10,11.
Las versiones más actuales de las guías clínicas internacionales todavía no han incluido de forma clara la recomendación de abandonar la disección ganglionar en pacientes con GC positivo. La edición más reciente de la guía National Comprehensive Cancer Network (NCCN) (v 1.2018, 11 de octubre de 2017) recomienda, en pacientes con BSGC positiva, el seguimiento intensivo de la región ganglionar afectada o la disección ganglionar19. No obstante, esta última versión de la NCCN ya informa sobre los resultados proporcionados por los 2 ensayos clínicos sobre disección ganglionar (MSLT-II y DeCOG-SLT) y destaca la ausencia de beneficio de supervivencia y la mayor morbilidad quirúrgica, aunque también menciona la ventaja de la disección en cuanto a control regional y para la obtención de información pronóstica adicional19.
El European Consensus-Based Multidisciplinary Guidelines ya proponía en 2016, a la luz del ensayo DeCOG-SLT y a pesar de sus limitaciones metodológicas, que la indicación de disección ganglionar en pacientes con metástasis en el GC inferiores a 1mm debe ser «críticamente discutida»20.
La American Society of Clinical Oncology (ASCO) ha actualizado las recomendaciones sobre el tratamiento del paciente con enfermedad ganglionar a partir de los resultados de los ensayos DeCOG-SLT y MSLT-II21. Esta guía diferencia a pacientes con micrometástasis en el GC de bajo y de alto riesgo. Las situaciones de alto riesgo vendrían determinadas por la presencia de algunos de los criterios de exclusión aplicados en el MSLT-II: extensión extracapsular, microsatelitosis simultánea y/o invasión linfovascular en el tumor primario, más de 3 GC metastásicos, más de 2 regiones ganglionares afectadas e inmunosupresión11. Las situaciones de bajo riesgo quedarían definidas por la ausencia de estos criterios. Con respecto a la carga tumoral en el GC, la guía ASCO confirma la representatividad de pacientes con carga tumoral inferior a 1,01mm en ambos ensayos clínicos, con un 66% del tamaño muestral total10,11. Sin embargo, a pesar de que en el tercio de pacientes reclutados con carga tumoral superior a 1mm tampoco se demostró diferencia de supervivencia entre la disección y la observación, la baja proporción relativa de este subgrupo dificulta la generalización de los resultados21. A partir de estas consideraciones la guía ASCO plantea, textualmente, que «la disección o la observación cuidadosa son opciones para los pacientes con enfermedad micrometastásica de bajo riesgo aunque considerando de forma adecuada factores clinicopatológicos». En los pacientes de riesgo más elevado, «la observación puede considerarse solo después de una discusión exhaustiva sobre los riesgos potenciales y beneficios de la disección ganglionar completa»21.
Adyuvancia en el paciente con enfermedad ganglionar clínicamente oculta (microscópica)Las guías de práctica clínica actualmente vigentes recomiendan la valoración de tratamiento adyuvante en aquellos pacientes con metástasis ganglionar sometidos a resección completa de la región ganglionar afectada y libres de enfermedad a distancia, así como en pacientes con tumor primario de alto riesgo (Breslow superior a 4mm y ulcerado)1,2. El interferón continúa siendo el único medicamento autorizado para la adyuvancia en nuestro medio, con base en la mejoría demostrada sobre la SLR. No obstante, los metaanálisis disponibles sobre los resultados de interferón en el tratamiento adyuvante del melanoma demuestran también beneficio de relevancia clínica incierta sobre la SG22-24. En cualquier caso, el beneficio sobre la SLR y sobre la SG han sido confirmados específicamente en pacientes con tumor primario ulcerado25.
El ipilimumab a dosis de 10mg/kg es la primera pauta de inmunoterapia adyuvante autorizada por la FDA para pacientes con melanoma. El ensayo EORTC 18071, que reclutó pacientes con estadio III ganglionar con carga tumoral intranodal superior a 1mm, demostró una mejoría de la SLR, SLR a distancia y SG del 10% a los 5 años (SLR 40,8% vs. 30,3%, SLR a distancia 48,3% vs. 38,9%, SG 65,4% vs. 54,4%)26. No obstante, la toxicidad de este régimen fue relevante, con efectos adversos grado 3-4 en el 54% de los pacientes tratados y un 1,1% de mortalidad por efectos inmunológicos asociados al tratamiento. En pacientes con enfermedad ganglionar clínicamente oculta, la ulceración del tumor primario fue un predictor de respuesta favorable, de la misma forma que ya se había observado en la adyuvancia con interferón26.
Posteriormente, el ensayo COMBI-AD, que comparó dabrafenib-trametinib con placebo en pacientes con mutación BRAF y estadio III con carga tumoral intranodal superior a 1mm, demostró una mejoría de la SLR a 3 años del 58% vs. 39%, y de SG del 88% vs. 77%27. En pacientes con metástasis ganglionar y carga tumoral superior a 1mm se está desarrollando actualmente un ensayo fase III en el que se compara pembrolizumab con placebo (EORTC 1325). También en relación con los nuevos regímenes de adyuvancia cabría mencionar la ventaja de nivolumab con respecto a ipilimumab en cuanto a SLR (65% vs. 53% a los 18 meses); no obstante, este ensayo reclutó pacientes con estadios IIIB y IV resecados28.
Un argumento a favor de la disección en pacientes con metástasis en el GC se fundamenta en el interés de la disección para una estadificación más detallada que la ofrecida por la BSGC. Con esta intención incluso se ha propuesto realizar BSGC «ampliadas» que incluyan 4-5 ganglios linfáticos que ofrecerían mayores posibilidades de diferenciar de forma poco invasiva pacientes con estadio IIIA de pacientes con estadio IIIC, estadios de pronóstico significativamente diferente29. Sin embargo, un reciente estudio retrospectivo demostró un cambio en la estadificación en menos del 6% de los pacientes con metástasis del GC sometidos a disección ganglionar. Los autores de este estudio sugieren que, en ausencia de mejores predictores, la selección de pacientes para terapia adyuvante puede basarse en la carga tumoral del GC30.
Con respecto a la adyuvancia en las guías de práctica clínica, la versión más reciente de la guía de la NCCN (v 1.2018, 11 de octubre de 2017) ya incluye el umbral de carga tumoral superior a 1mm para los regímenes de adyuvancia con ipilimumab a dosis alta y con pauta combinada dabrafenib-trametinib en pacientes con mutación BRAF19. No obstante, con relación a la adyuvancia con ipilimumab el panel de expertos de la NCCN insiste en el adecuado balance entre beneficio esperado y toxicidad, especialmente en pacientes con estadio IIIA debido al pronóstico favorable que suelen presentar. En cualquier caso, la guía NCCN recomienda como primera opción adyuvante el régimen de nivolumab debido a su menor toxicidad respecto a ipilimumab y el beneficio para la SLR, aunque su impacto sobre la SG no ha quedado claramente establecido. No obstante, este esquema de adyuvancia queda restringido en esta guía a pacientes con estadio IIIB y más avanzados19.
Con respecto al interferón, la guía NCCN mantiene la opción de interferón a dosis altas para pacientes con metástasis identificada en la BSGC y destaca el beneficio sobre la SLR aunque no sobre la SG19. Con respecto al papel actual del interferón en la adyuvancia de melanoma, una reciente revisión de Eggermont y Dummer sobre el tema concluye que este papel queda limitado a aquellos países sin acceso a nivolumab o dabrafenib-trametinib y de forma restringida a pacientes con tumor primario ulcerado29. Es importante mencionar que la Agencia Europea del Medicamento no ha autorizado todavía ninguno de estos regímenes de adyuvancia, por lo que no están disponibles en nuestro medio para su uso clínico fuera de ensayo clínico.
Seguimiento ecográfico del paciente con metástasis en el ganglio centinelaEl seguimiento clínico y ecográfico de las regiones ganglionares en las que se localizó el GC metastásico ha proporcionado en el MSLT-II y el DeCOG-SLT los mismos resultados de supervivencia que la disección ganglionar posterior a una BSGC positiva. La reproducibilidad en condiciones de práctica clínica de los resultados de un ensayo clínico requiere la implantación de las mismas intervenciones y procedimientos comparados. En el MSLT-II los pacientes de ambos grupos de estudio fueron incluidos en un programa de seguimiento consistente en la realización de ecografía ganglionar de la región del GC cada 4 meses durante los primeros 2 años y posteriormente cada 6 meses hasta el 5.o año11. En el ensayo DeCOG-SLT el seguimiento incluía ecografía ganglionar cada 3 meses durante los 3 años de seguimiento10. No obstante, en el MSLT-II, además del seguimiento ecográfico estrecho, los centros participantes podían aplicar los protocolos locales de pruebas de imagen (TC, RMN, PET-TC).
La ecografía ganglionar no es un procedimiento novedoso en la atención al paciente con melanoma, e incluso algunas guías de práctica clínica ya la habían incorporado hace unos años1. En el año 2000, Blum et al. demostraron que la ecografía con sondas de 7,5-10MHz mejoraba el diagnóstico de metástasis ganglionar con respecto a la exploración física, con una sensibilidad y especificidad del 89,2 y 99,7% para la ecografía y de un 71,4 y 99,7% para la exploración física, respectivamente31. Existe un conjunto de criterios validados para el diagnóstico precoz de metástasis ganglionar (morfología esférica, estructuras en joroba, ausencia de perfusión central, presencia de perfusión periférica, pérdida de ecogenicidad central, isletas hipoecoicas), que ha sido ampliamente aplicado y que proporciona una sensibilidad del 82%, con un valor predictivo positivo del 52%32,33.
Por lo tanto, la ecografía representa una técnica no invasiva para el diagnóstico precoz de metástasis ganglionar, que cuenta con criterios reproducibles, de coste medio, y que representa un complemento necesario en el seguimiento de pacientes con metástasis en el GC. La ecografía cuenta con la ventaja adicional de poder realizarse a la cabecera del paciente en la unidad de melanoma (point-of-care or bedside sonography), o como prueba complementaria realizada por los servicios de radiología34.
Propuesta de toma de decisiones en el paciente con metástasis del ganglio centinelaMás allá de las posibles dificultades derivadas de la adaptación de recomendaciones procedentes de otros entornos sanitarios, la guía ASCO mantiene la opción de la disección ganglionar tanto en escenarios de bajo como de alto riesgo. Sin embargo, la evidencia disponible en la actualidad respalda el abandono de la disección en las situaciones bien representadas en los ensayos clínicos y en las que se alcanzó la potencia estadística requerida.
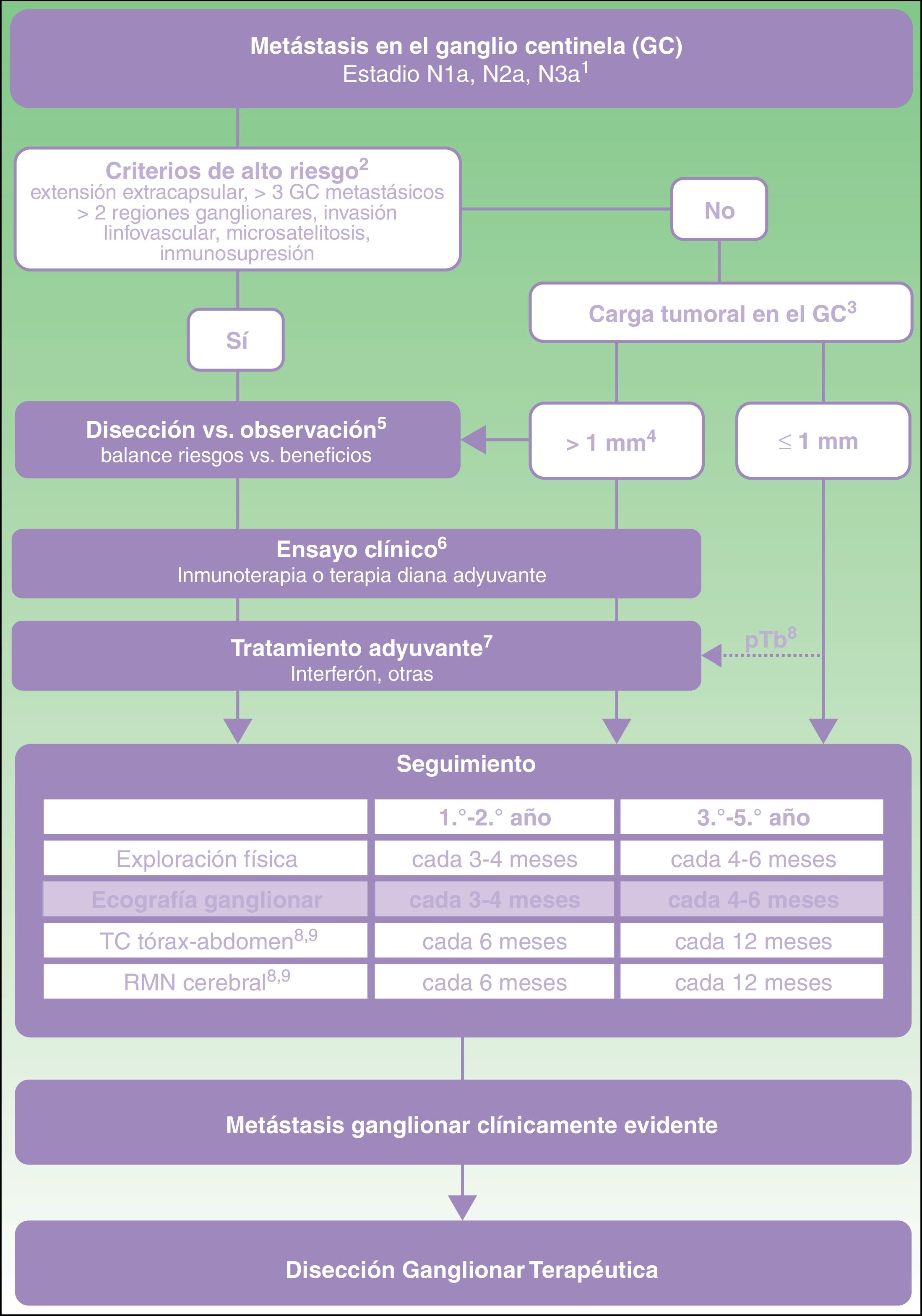
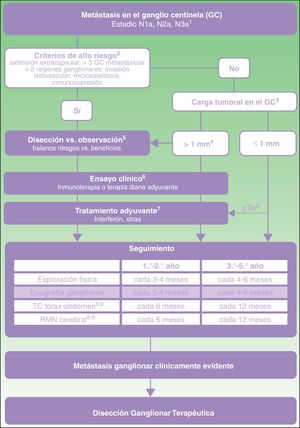
A partir de esta evidencia directa e indirecta (tabla 3), se propone un algoritmo de toma de decisiones en el paciente con melanoma y metástasis en el GC (fig. 1). Esta toma de decisiones se debe iniciar con una valoración exhaustiva de criterios clínicos y hallazgos patológicos en el GC. En aquellos pacientes sin criterios de alto riesgo y con carga tumoral en el GC inferior a 1mm la evidencia actual respalda el abandono de la disección ganglionar. Sin embargo, con carga tumoral superior a 1mm, y especialmente a medida que la carga tumoral alcanza diámetros con menor representación en los ensayos clínicos, y menor potencia estadística, es donde se precisaría una valoración más detallada de los riesgos y beneficios esperados de cada una de las opciones (disección vs. observación).
Evidencia relacionada con la decisión de disección ganglionar inmediata en el paciente con metástasis en el ganglio centinela
| Nivel de evidencia35 | |
|---|---|
| La disección ganglionar no mejora la supervivencia con respecto al seguimiento y disección ganglionar terapéutica10,11 | 1b |
| La disección ganglionar en el paciente con metástasis en el ganglio centinela no identifica metástasis adicionales en un 75,0-88,5%10,11 | 1b |
| La frecuencia de morbilidad quirúrgica es superior en los pacientes sometidos a disección ganglionar inmediata que en los sometidos a seguimiento y disección terapéutica11 | 1b |
| La carga tumoral superior a 1mm en el ganglio centinela representa un factor predictor independiente de progresión regional, a distancia y de supervivencia por melanoma12 | 2b |
| La progresión tumoral del melanoma sigue un patrón paralelo por el que las metástasis ganglionares y a distancia se originan a partir del tumor primario7 | 2b |
Propuesta de atención al paciente con melanoma y metástasis en el ganglio centinela.
1. Clasificación TNM para el melanoma cutáneo de la American Joint Committee on Cancer 20178. 2. Características de alto riesgo basadas en los criterios de exclusión aplicados en los ensayos clínicos sobre disección vs. observación11,21. 3. Carga tumoral en el ganglio centinela (GC) medida como diámetro tumoral máximo del implante tumoral de mayor tamaño (criterios de Rotterdam)36. 4. En el ensayo MSLT-II los grupos de disección y observación incluyeron un 33,2 y 34,5% de pacientes con metástasis en el GC superiores a 1mm. El percentil 75 de carga tumoral fue de 1,32 y 1,38mm en cada uno de los grupos de estudio, respectivamente. En el ensayo DeCOG-SLT el 7% de pacientes reclutados presentaron metástasis en el GC superiores a 2mm, y el 2% superiores a 5mm10,11. 5. La discusión con el paciente debe incluir información sobre la frecuencia esperada de complicaciones y beneficio de supervivencia esperado con cada una de las opciones (disección vs. observación). 6. Valoración en comité de melanoma de la posibilidad de acceder a ensayo clínico de adyuvancia. 7. Actualmente, la única pauta de adyuvancia aprobada en España para el paciente con melanoma es el interferón. Cualquier pauta de adyuvancia autorizada para uso en práctica clínica deberá ser valorada en este mismo punto del algoritmo. 8. pTb, tumor primario ulcerado. El máximo beneficio de la adyuvancia con interferón se ha observado en pacientes con tumor primario ulcerado22-24. 9. En pacientes con criterios de alto riesgo estadios IIIB-IIIC puede valorarse la recomendación de PET-TC semestral durante los dos primeros años y anual entre el tercer y el quinto año37.
Independientemente de la decisión sobre disección u observación, aquellos pacientes con carga tumoral superior a 1mm deben considerarse candidatos a ensayo clínico de adyuvancia debido al mayor riesgo de recaída regional y a distancia (fig. 1). En caso de no existir acceso a ensayo clínico, y mientras se autoriza en nuestro país alguno de estos regímenes de adyuvancia con inmunoterapia o terapias diana, se recomendaría ofrecer tratamiento con interferón particularmente en pacientes con tumor primario ulcerado. Todos estos pacientes, independientemente de si reciben adyuvancia o no, deben ser incluidos en un programa de seguimiento ecográfico intensivo. Además, con el objetivo de identificar precozmente la posible progresión sistémica, se recomendaría continuar aplicando los protocolos de imagen indicados en las guías clínicas y protocolos actuales (TC, RMN, PET-TC) (fig. 1).
La disección ganglionar terapéutica quedaría reservada para aquellos pacientes que durante el seguimiento desarrollan metástasis ganglionar identificada mediante exploración física o pruebas de imagen (fig. 1).
ConclusiónEl tratamiento del paciente con melanoma está experimentando un cambio de paradigma que ofrece la oportunidad de una supervivencia más prolongada con menor morbilidad derivada de procedimientos invasivos. Desde esta nueva perspectiva, la evidencia actualmente disponible requiere una reflexión sobre el abandono de la disección ganglionar en pacientes con GC positivo con el objetivo de generar decisiones homogéneas y consensuadas por el mayor número de unidades de melanoma. Como concluye un reconocido cirujano oncológico en el editorial que introduce los resultados del MSLT-II en el New England Journal of Medicine, «si estos datos no son suficientes para reducir el entusiasmo por la disección ganglionar, ¿qué más se necesita?»38.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Sergi Vidal Sicart del Servicio de Medicina Nuclear del Hospital Clínic de Barcelona, coautor del MSLT-II, por la revisión crítica del manuscrito.