INTRODUCCION
La tendencia de ciertas neoplasias a manifestarse en distintos miembros de la misma familia es uno de los campos de trabajo más atractivos y esperanzadores de la genética molecular. La existencia del cáncer familiar nos indica que existen genes defectuosos que se transmiten de generación en generación. Aquellos individuos que hereden estos alelos defectuosos en algún locus (tabla 1) o región cromosómica asociada específicamente con el desarrollo de un tumor tendrán una susceptibilidad aumentada para desarrollar cáncer. Por tanto, la identificación de estos genes nos ayudará a conocer mejor la etiopatogenia del cáncer y poder diagnosticarlo en estadios cada vez más iniciales.
El melanoma cutáneo representa el 10 % de las neoplasias cutáneas, y es responsable de más del 90 % de las muertes por cáncer de piel. Su incidencia sigue aumentando de forma global en todo el mundo 1, sobre todo entre sujetos de raza blanca expuesta a dosis intensas de radiación solar. Su prevalencia es máxima entre la población australiana caucásica. Se ha estimado que uno de cada 20-30 australianos de raza blanca desarrollarán un melanoma a lo largo de su vida 2.
La susceptibilidad para desarrollar un melanoma cutáneo es muy variable y depende de varios factores. Por un lado, existen familias con una gran susceptibilidad y múltiples casos de melanoma intrafamiliares en todo el mundo. Por otro, las diferentes tasas de prevalencia que existen entre los diferentes países de todo el mundo se cree que son debidas a los diferentes grados de exposición solar y a los diferentes fototipos cutáneos.
Ni la mortalidad ni la incidencia del melanoma en estadios avanzados han disminuido. La necesidad de realizar un diagnóstico precoz, así como una vigilancia especial de la población con mayor susceptibilidad para desarrollar un melanoma, han potenciado la aparición de trabajos de investigación que tratan de explicar el papel que desempeñan tanto los factores ambientales como los factores genéticos en la predisposición individual y familiar del melanoma.
Para una mejor comprensión de la predisposición genética que otorgan algunas mutaciones, como las del gen CDKN2A, o variantes alélicas, como el MC1R, a continuación de comentan los factores etiopatogénicos conocidos sobre el melanoma, así como el papel de algunos de estos genes en la fisiología del sistema pigmentario.
ETIOPATOGENIA DEL MELANOMA CUTANEO
Se ha postulado que el melanoma, como la mayoría de las neoplasias, tiene una etiopatogenia multifactorial que precisa de la interacción de factores genéticos y ambientales. Estos factores aparecen en la tabla 2.
Se han ensayado diferentes modelos experimentales de inducción de melanomas en animales. Los resultados más satisfactorios se han obtenido con peces híbridos del grupo Xyphophorus3. Sin embargo, ningún modelo animal ha permitido imitar fielmente al melanoma humano.
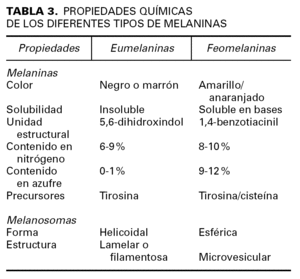
Clásicamente se ha asociado un mayor riesgo de melanoma a individuos de piel clara. Sin embargo, la clasificación de los fototipos cutáneos establecida por Fitzpatrick en 1988 4 no deja de ser un parámetro basado en una observación subjetiva. Debido a los nuevos conocimientos alcanzados en biología molecular y genética sobre la pigmentación cutánea humana, sería más correcto hablar de quimiofototipo 5 en función de las propiedades químicas de la melanina, y de genofototipo 6, según los genes determinantes del color de la piel, cabello y ojos, a la hora de establecer el riesgo individual para el cáncer cutáneo.
FISIOLOGIA DEL SISTEMA PIGMENTARIO
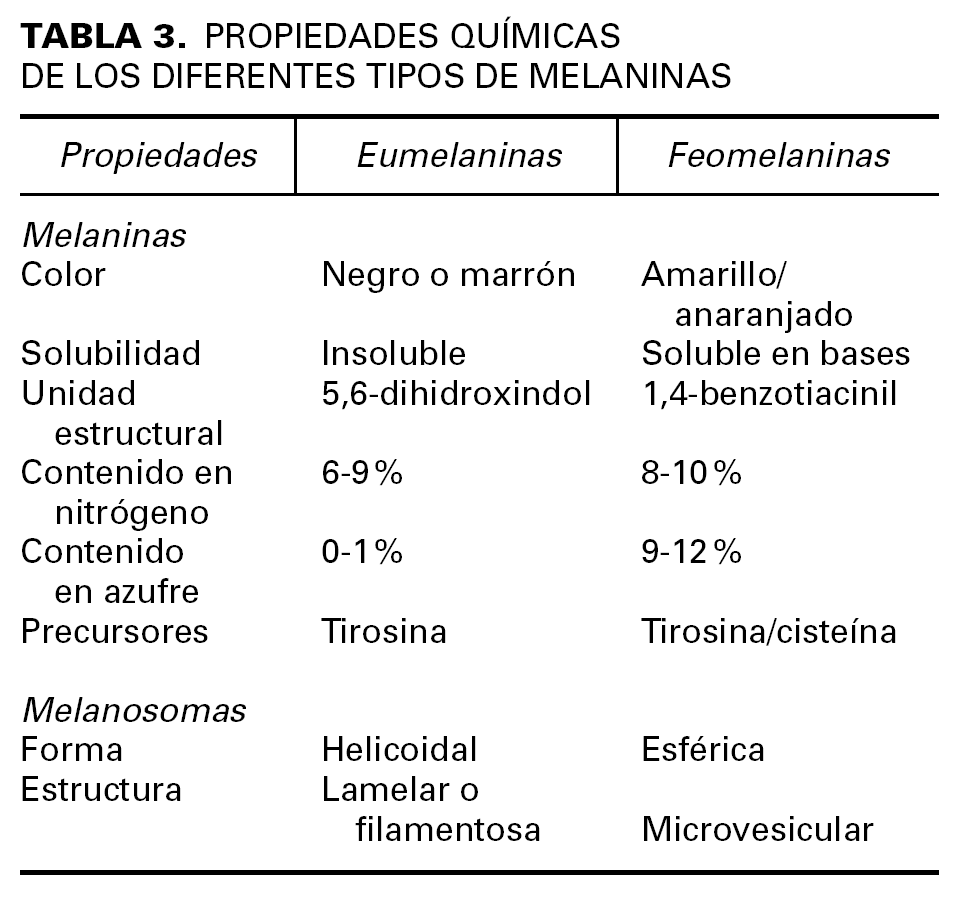
El mayor determinante del color de la piel y los anejos cutáneos es la actividad secretora de melanina por parte de los melanocitos localizados en la capa basal de la epidermis y el bulbo de los folículos pilosos. Las melaninas son unos pigmentos especializados que no pertenecen a ninguna clase bioquímica conocida, sino que constituyen un conjunto de moléculas afines con diferentes grados de polimerización y oxidación, que permiten clasificarlas en dos grandes grupos: eumelaninas y feomelaninas (tabla 3).
La síntesis de la melanina consta de una serie de reacciones enzimáticas que tienen lugar en el interior de unas organelas especializadas llamadas melanosomas. La tirosinasa, la TRP-1 y la TRP-2 son las enzimas más importantes entre las que intervienen en la melanogénesis. La tirosinasa transforma la tirosina en 3-4 DOPA, y posteriormente, convierte ésta en dopaquinona. A continuación, la TRP-1 y TRP-2 intervienen en la síntesis de eumelanina, mientras que la feomelanina se obtiene mediante la incorporación de derivados sulfatados por una vía anabólica alternativa.
La biosíntesis de los melanosomas es un proceso complejo que tiene lugar cerca del núcleo del melanocito, y en el que intervienen determinadas proteínas como Pmel-17 o AP-1 y AP-3 7. A medida que se va produciendo su maduración, los melanosomas son transportados hacia el extremo distal de las dendritas melanocíticas, desde donde serán transferidos a los queratinocitos 8.
La pigmentación melánica está predeterminada genéticamente, y es regulada tanto por la radiación ultravioleta (UV) como por diversos factores químicos. La radiación UV, además de estimular un aumento en el número de melanocitos y sus dendritas, es el principal estímulo para la melanogénesis. Actúa tanto de forma directa sobre los melanocitos, aumentando la expresión y la actividad de la tirosinasa, como de forma indirecta, mediante la inducción de la secreción de factores activadores de la melanogénesis por parte de los queratinocitos y los melanocitos. Estos activadores de la melanogénesis son la hormona estimulante del melanocito alfa (MSH-α), la hormona adrenocorticotropa (ACTH) y el óxido nítrico (NO).
La MSH-α, al igual que la ACTH, son hormonas polipeptídicas derivadas de la división de la proopiomelanocortina (POMC). La MSH-α aumenta la melanogénesis estimulando la actividad de las enzimas tirosinasa, TRP-1 y TRP-2, mediante su unión a un receptor transmembrana expresado en la superficie de los queratinocitos, el receptor de la melanocortina-1 (MC1R en la literatura inglesa). En el ser humano, el fenotipo pelirrojo se asocia a ciertas variedades alélicas del receptor MC1R que implican una afinidad menor de este receptor por la MSH-α 9. Estos hallazgos sugieren que la MSH-α participaría en la melanogénesis humana favoreciendo la síntesis preferente de eumelanina frente a feomelanina 10.
La síntesis de melanina en el ser humano, además de determinar la pigmentación cutánea constitutiva o color de piel, y la pigmentación facultativa o capacidad para broncearse, tiene un papel fotoprotector muy importante, sugerida por la baja incidencia de cáncer cutáneo y fotodermatosis en personas de piel oscura. La melanina actúa mediante dos mecanismos: de forma directa, como un filtro solar que difracta y/o refleja la radiación UV, a través de un fenómeno de reagrupamiento (camping) de los melanosomas al recibir la radiación UV, situándose por encima del ADN de los queratinocitos y melanocitos; y de forma indirecta, neutralizando los radicales libres y otras sustancias químicas producidas por los rayos UV. Sin embargo, la potencia fotoprotectora de la melanina es pequeña, estimándose similar a la de un factor de protección solar de 1,5-2, lo que supone una neutralización del 40-50 % de los rayos UV 11. Además, la feomelanina, tras ser estimulada por la radiación UV, puede generar radicales libres con efectos mutágenos y daño tisular 12.
FACTORES AMBIENTALES
En 1952, McGovern 13 observó que el melanoma era más frecuente en zonas fotoexpuestas, sugiriendo el papel de la exposición solar como agente carcinogénico. La diferencia obvia en la incidencia anual de melanoma entre Australia (50/100.000 habitantes en Queensland) y Europa (10/100.000 habitantes en Gran Bretaña), así como diversos estudios epidemiológicos han confirmado esta observación 14. La radiación UV favorecería tanto el inicio como la progresión del melanoma.
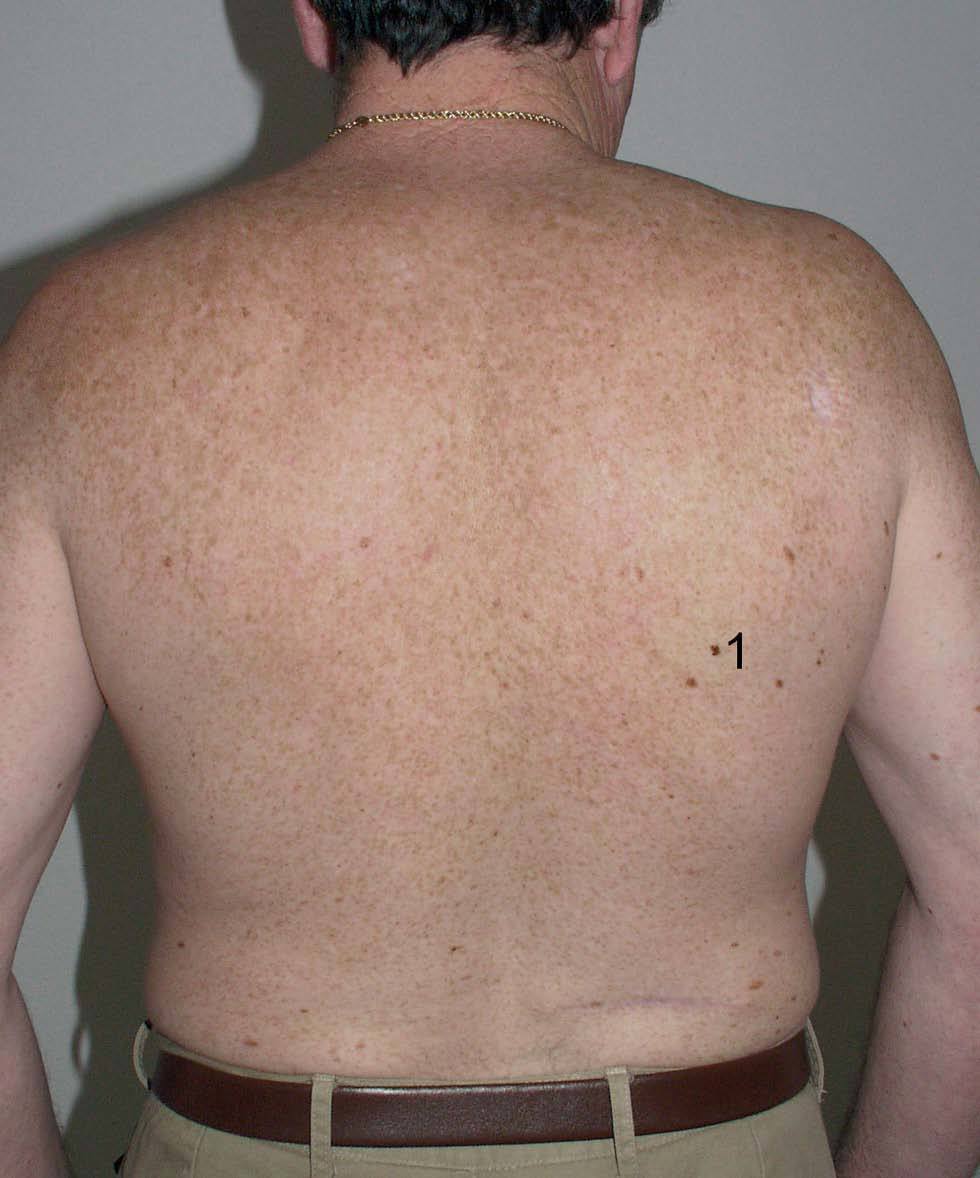
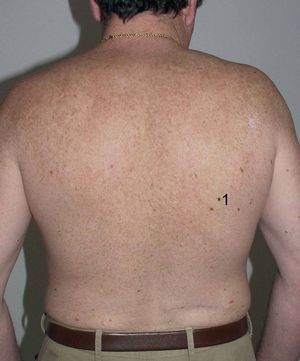
El riesgo de melanoma asociado a la radiación UV no parece depender por tanto de la cantidad total de radiación acumulada, sino de las exposiciones recibidas de forma intermitente o a una intensidad suficiente para producir quemaduras solares, especialmente cuando dichas quemaduras se producen en las primeras décadas de vida (fig. 1) 15.
Fig. 1.--Paciente con múltiples lentigos solares en espalda como consecuencia de haberse «quemado» varias veces tras una exposición solar intensa. Con el número 1 se marca una lesión que correspondía con un melanoma de extensión superficial in situ. A lo largo de su vida, este paciente ha desarrollado 4 melanomas, y también refería antecedentes familiares de melanoma.
Sin embargo, la asociación entre melanoma y exposición solar es muy compleja. Aunque el fototipo cutáneo parece ser un factor muy importante en cuanto a la mayor probabilidad de aparición de melanoma, existen muchos casos de melanoma en sujetos de piel morena y/o gran facilidad para broncearse. Además, la exposición solar crónica de carácter ocupacional se ha propuesto incluso como un factor protector frente al melanoma 15. Destacar que estudios de casos y controles, realizados en todo el mundo, para analizar el riesgo de melanoma atribuible a la exposición solar estival y la presencia de quemaduras solares, mostraron unos valores de riesgo relativo muy pequeños, por la que la exposición solar per se no parece ser un factor pronóstico fiable del riesgo de desarrollar melanoma 16,17.
Estos datos apuntan hacia la necesidad de estudiar la interacción entre los factores ambientales y predisposición genética de ciertos sujetos para comprender completamente el papel de la radiación UV en el melanoma.
GENES DE PREDISPOSICION AL MELANOMA
El melanoma puede ser considerado como una enfermedad poligénica multifactorial. Las alteraciones genómicas subyacentes al desarrollo de melanoma pertenecen a dos grandes clases de genes: a) supresores de tumores, cuya función es evitar la transformación maligna de las células, y a la que pertenecen la mayoría de los genes relacionados con el melanoma, y b) los oncogenes propiamente dichos, cuya función es estimular la progresión tumoral.
Se han identificado genes de susceptibilidad para el melanoma mayores, cuyas determinadas mutaciones, caracterizadas por expresarse con una alta penetrancia, pero con baja prevalencia, se asocian a una gran susceptibilidad para desarrollar melanoma; y otros genes cuyas variedades o polimorfismos son muy frecuentes entre la población general, pero que se expresan con una baja penetrancia.
Genes de baja penetrancia
Existe un menor conocimiento y experiencia respecto a los genes de menor penetrancia de susceptibilidad frente al melanoma. Las mutaciones en estos genes se asociarían a riesgos menores para desarrollar melanoma, pero al detectarse con mayor frecuencia entre la población general, su determinación tendría lógicamente un impacto mayor en la sociedad en términos de prevención sanitaria y seguimiento de pacientes con riesgo.
Entre estos genes se encuentra el del receptor 1 de la melanocortina (MC1R). Este gen se localiza en el extremo telomérico del cromosoma 16q24.3, y codifica un receptor transmembrana acoplado a proteína G expresado por muchos tipos celulares, incluidos los melanocitos de la piel. MC1R es el receptor de péptidos sintetizados en la glándula pituitaria, derivados de la proopiomelanocortina, como la MSH-α y ACTH. Ambos se unen con la misma afinidad a MC1R, activando una adenilciclasa que incrementa la producción intracelular de monofosfato de adenosina cíclico (AMPc). Éste favorece la transcripción y traducción de tirosinasa, y de esta manera, la síntesis fotoprotectora de eumelanina y la proliferación melanocítica 18.
La regulación de la melanogénesis también parece depender de factores paracrinos, como la proteína de señalización agouti (ASP) 19, o antagonistas de MC1R como la endotelina 1 20.
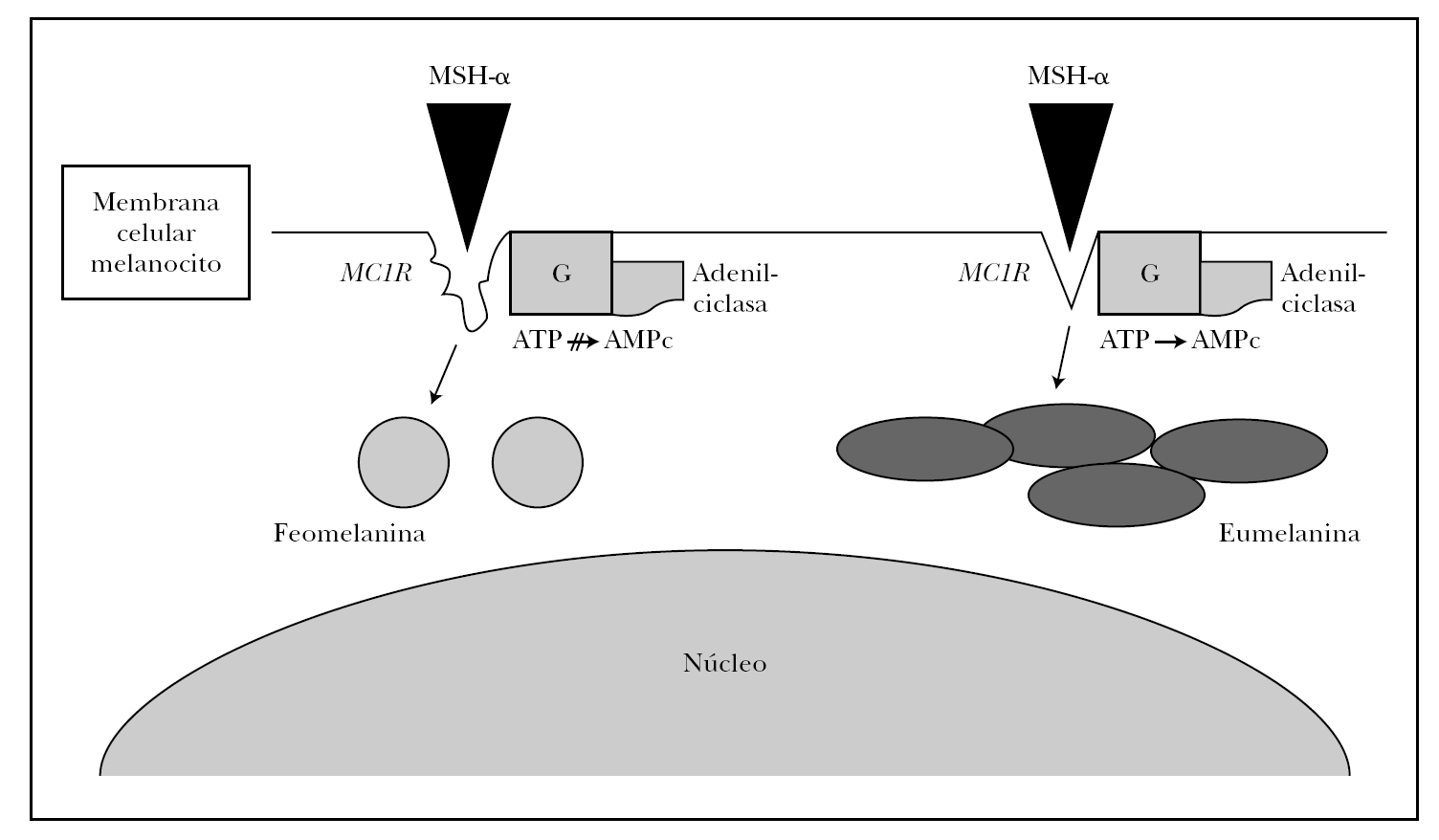
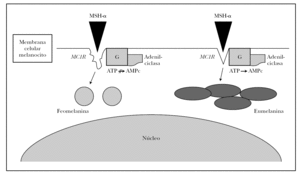
Numerosos polimorfismos del gen MC1R se han aislado en la población mundial, sobre todo en raza caucásica 21-23. Ante tal diversidad, se estableció por consenso entre los resultados de varios grupos de trabajo cuál era la variedad o alelo más frecuente o común (wild type), que recientemente se ha secuenciado completamente y está presente en principio en la población asiática y africana 21,22. Aproximadamente 30 variantes alélicas han sido descritas hasta ahora, nueve de las cuales han demostrado ser variantes con pérdida de función 24. Algunas de estas variantes (Val60Leu, Ile40Thr, Arg142His, Arg151Cys, Arg162Pro, Arg160Trp, Asp294His) son incapaces de sintetizar AMPc con la misma eficacia de la variante común o wild type de MC1R en respuesta a la estimulación de MSH-α 25, mientras que otras variantes (Val122Met) demostraron una menor afinidad de unión con la MSH-α 26. Estos sujetos tendrían una expresión supresora en la función fisiológica del MC1R, es decir, los melanocitos sintetizarían feomelanina en lugar de eumelanina (fig. 2).
Fig. 2.--Esquema de la melanogénesis. La unión de MSH-α al receptor de la melanocortina-1 (MC1R) desencadena la síntesis de eumelanina en condiciones normales mediante la estimulación de la tirosinasa vía AMPc. Alteracionesestructurales o funcionales de MC1R dan origen a la síntesis de feomelanina.
Tres variantes alélicas de MC1R (Arg151Cys, Arg160-Trp, Asp294His) se asocian claramente con la presencia de pelo rojo, piel clara, ausencia de capacidad para broncearse correctamente y una gran predisposición para desarrollar lentigos solares. Además, otros 7 alelos (Val60Leu, 86insA, Asp84Glu, Arg142His, Ile155-Thr, 537insC, His260Pro) pueden considerarse alelos asociados a este fenotipo de forma parcial o total 24. El conjunto de estas características, denominado fenotipo RHC (red hair color), constituye un factor de riesgo tanto para el melanoma como para el cáncer cutáneo no melanocítico, especialmente cuando se combina con factores de riesgo ambientales como la exposición de altas dosis de radiación UV.
Además, algunos trabajos señalan que algunos de estos polimorfismos de MC1R otorgarían una mayor susceptibilidad para el desarrollo de melanoma esporádico y cáncer cutáneo no melanoma de forma independiente a la presencia del fenotipo RHC 21,23,27-29. En 1996, Valverde et al 23 observaron que la variante Asp84Glu se asociaba a la presencia de melanoma de forma independiente al tipo de piel. Posteriormente, Palmer et al 27 estudiaron la relación entre las cinco variedades de MC1R más frecuentes en la población australiana analizando las encontradas en 460 individuos con melanoma familiar o esporádico y 399 controles. Encontraron una fuerte asociación entre los alelos Arg151Cys, Arg160Trp y Asp294His y el riesgo de melanoma. La presencia de uno o varios de estos alelos en un mismo sujeto tendría un efecto aditivo para el desarrollo de melanoma: la presencia de uno de estos alelos otorgaría a un sujeto un riesgo relativo de 2,0 (intervalo de confianza del 95 % [IC 95 %]: 1,6-2,6), y con 2 alelos, el riesgo relativo sería de 4,1 (IC 95 %: 2,1-7,9). No pudo demostrarse la asociación con las variantes Val60Leu y Asp84Glu.
Curiosamente, esta asociación no existía en sujetos de piel clara, pero sí persistía la asociación entre estas variantes de MC1R y el desarrollo de melanoma en sujetos de fototipo oscuro de raza caucásica, por lo que concluyeron que estos polimorfismos del gen MC1R tienen un riesgo de susceptibilidad para el melanoma parcialmente independiente de su efecto en el color del pelo o la incapacidad para broncearse.
La mayoría de los estudios realizados posteriormente coincidieron en que los polimorfismos asociados con un mayor riesgo de melanoma son precisamente Arg151Cys, Arg160Trp y Asp294His 28,29.
Recientemente, Matichard et al 30 han estudiado el papel de las variantes de MC1R en la población francesa. Tras estudiar 108 pacientes con melanoma, incluyendo casos de melanoma familiar y esporádico, pero sin mutaciones en p16, y 105 controles, observaron una diferencia significativa (p < 0,0001) en cuanto a la presencia de variantes de MC1R hipofuncionantes entre casos (68 %) y controles (31 %). Las variantes con asociación significativa fueron Val60Leu, Arg151Cys y Arg160Trp. Este riesgo persistía tras estratificar los resultados según el fenotipo cutáneo, el color de pelo, la presencia de lentigos solares y los parámetros de exposición UV (tabla 4).
Box et al 21 estudiaron el efecto derivado de la presencia de polimorfismos del gen MC1R en familias australianas portadoras de diferentes mutaciones en el gen CDKN2A21. La presencia de una variante alélica del MC1R aumentaba el riesgo de desarrollar un melanoma tanto en portadores de mutaciones de CDKN2A como en no portadores. El impacto sobre el riesgo de melanoma en los portadores de un alelo de MC1R y una mutación en CDKN2A, comparado con los portadores de una única mutación del CDKN2A, se reflejaba al aumentar la penetrancia para desarrollar un melanoma del 50 al 83 %, y un descenso en la edad media de diagnóstico del melanoma de 58,1 a 37,8 años.
A pesar de estos hallazgos, existen todavía muchas cuestiones por resolver en cuanto al papel del MC1R en la susceptibilidad al melanoma. En primer lugar, los estudios realizados hasta ahora se han llevado a cabo en población caucásica, generalmente del norte de Europa con fenotipo RHC, por lo que desconocemos la relación de las variedades de MC1R y melanoma en el resto de la población mundial. Por otro lado, para la mayoría de la comunidad científica no está claro que el riesgo de melanoma atribuible a las variantes de MC1R sea independiente de sus efectos sobre la pigmentación. Tampoco se ha estudiado el papel de MC1R en el melanoma familiar, salvo en familias australianas 27. Y finalmente, se desconoce el papel de MC1R en la interacción que tendría con la radiación UV.
Se han intentado aislar otros genes de baja penetrancia y alta prevalencia para el melanoma. El gen XRCC3 codifica una proteína involucrada en la reparación de la doble cadena de ADN, así como en la reparación de fragmentación, translocación y deleción cromosómica Winsey et al 31 encontraron la presencia de un alelo T en el exón 7 del gen XRCC3 que se asociaba significativamente con el desarrollo en una población de melanoma con alto riesgo de metástasis respecto a grupo control. Sin embargo, otros trabajos no han podido confirmar esta asociación 32,33.
Genes de alta penetrancia
La detección de estas mutaciones de alta penetrancia, pero con baja prevalencia estaría indicada especialmente en familias con varios miembros con melanoma. Sin embargo, estos genes tienen un papel muy pequeño en la mayoría de la población susceptible al melanoma.
El melanoma familiar se define como la presencia de 2 familiares de primer grado afectados de melanoma o de más de dos si son de primer o segundo grado. Esta definición de melanoma familiar, no obstante, no está consensuada hasta la fecha actual. De hecho, en la práctica diaria, en la mayoría de los centros sanitarios y/o de investigación se suele considerar a un paciente con antecedentes familiares de melanoma cuando refiere un único caso de melanoma en su familia, independientemente del grado de parentesco. Es de esperar que la generalización de los estudios de susceptibilidad genética en el melanoma cutáneo nos permita establecer una definición consensuada.
Se estima que entre el 5-10 % de los enfermos con melanoma tienen historia familiar de melanoma 34. Ford et al 35 realizaron un metaanálisis sobre 8 estudios de casos y controles, comprobando que el riesgo de padecer melanoma en la raza caucásica era 2,24 veces mayor si existía algún familiar de primer grado que había padecido un melanoma. El antecedente familiar de melanoma indica, por tanto, una susceptibilidad genética directa debido a una mutación o polimorfismo, o bien una mayor susceptibilidad a los efectos ambientales nocivos, con la radiación UV.
El primero y más importante de estos genes es el gen CDKN2A (Cyclin-dependent kinase inhibitor 2A), localizado en el cromosoma 9p21 por primera vez en 1994 36. Este locus tiene la particularidad de transcribir 2 proteínas de forma alternante (alternative reading frames o ARF). Por un lado es responsable de la codificación de p16, proteína de aproximadamente 16 kDa de peso molecular, que interviene en el control del ciclo y la apoptosis celular. El segundo producto de este locus, conocido como p14ARF, y cuyo papel se comenta más adelante con mayor detalle, regula el ciclo celular pero a través de una vía dependiente de p53.
La proteína p16 se une e inhibe competitivamente a las cinasas dependientes de ciclina (CDK) 4 y 6, por lo que también aparece en la literatura médica como INK4a (inhibidor de la cinasa 4.ª) o p16ink4a. De esta manera se impide la formación del complejo constituido por la unión de CDK4 y la ciclina D1, complejo necesario para la transición desde la fase G1 a la fase S del ciclo celular mediante la fosforilación e inactivación del producto del gen del retinoblastoma.
La frecuencia estimada de mutaciones en el gen de p16 en la población general es de 0,01 % 37. Las mutaciones puntuales o deleciones en el gen p16, tanto adquiridas como hereditarias, aumentan la probabilidad de que el potencial daño mutagénico producido en el ADN escape al proceso de reparación antes de la división celular.
Se han descrito mutaciones del gen p16/CDNK2A asociadas tanto a casos de melanoma esporádico múltiple sin historia familiar 38 como en familias con múltiples casos de melanoma 39. En general, las mutaciones puntuales predominan en el melanoma familiar, mientras que las deleciones constituyen el mecanismo de inactivación más importante en el melanoma esporádico, así como hallarse con mayor frecuencia en los cultivos de células tumorales. Estudios en melanoma metastásico con frecuencia no presentan alteraciones en el gen de p16, por lo que estas mutaciones no parecen tener un papel relevante en la capacidad de metastatizar del melanoma 40, por lo que sería una insuficiente cantidad de p16 y, por tanto, una mala regulación del ciclo celular, la que empujaría a los melanocitos hacia una progresión tumoral 41.
La expresión reducida de p16 en estudios de células de melanoma no cultivadas se ha asociado con un mayor riesgo de recidiva y peor pronóstico 42,43, así como unos niveles de Clark más avanzados y un mayor índice de proliferación celular 44. Otros estudios no han conseguido correlacionar el microestadio del melanoma con la expresión de p16 45.
Las mutaciones en p16 se transmiten de forma autosómica dominante. Alrededor del 25-40 % de las familias con melanoma familiar tienen mutaciones en este gen (tabla). La probabilidad de encontrar dicha mutación en un sujeto aumenta con un mayor número de familiares afectados de melanoma 46. Existen más de 500 familias con mutaciones en este gen identificadas en todo el mundo, lo que confiere a sus miembros un riesgo elevado de melanoma. Se han descrito más de 14 mutaciones diferentes, tanto en el exón 1 como en el exón 2 del CDKN2A, y varían según la región geográfica de las familias estudiadas. El grado de penetrancia de estas mutaciones para el desarrollo de melanoma ha sido estimado en 0,30 (IC 95 %: 0,12-0,62) a los 50 años de edad, y de 0,67 (IC 95 %: 0,31-0,96) a los 80 años de edad. También el grado de penetrancia de estas mutaciones es distinto en función del país de procedencia, existiendo una mayor probabilidad de desarrollar melanoma en Australia que en Estados Unidos o Europa 46. Estas variaciones en la penetrancia de p16 podrían ser debidas a la exposición ambiental o a otras mutaciones genéticas concomitantes. En España, Ruiz et al 47 observaron mutaciones en el 17 % de las familias con melanoma familiar estudiadas, pero no hallaron ningún caso de mutación entre los pacientes de melanoma múltiple no familiar y enfermos con melanoma y otras neoplasias.
En cuanto a la relación entre la radiación UV y las mutaciones en p16, la radiación UV produce un daño directo en el ADN celular, induciendo la formación de dímeros de timina y radicales libres, y detiene a los melanocitos en las fases G1 y G2, lo que puede originar mutaciones genéticas adquiridas y deleciones cromosómicas en genes de supresión tumoral, que inactivan en este caso concreto a p16, y contribuye de esta manera a la progresión y desarrollo del melanoma.
El papel de la variaciones genéticas de p16 en el desarrollo de nevos es controvertido. Mientras que algunos trabajos han señalado la presencia de mutaciones en p16 entre los miembros de familias con melanoma familiar se asoció con un gran número de nevos, otros autores encontraron porcentajes de mutaciones de p16 muy dispares entre familias con melanoma y aquellos miembros de estas familias que además tenían múltiples nevos atípicos, concluyendo que los alelos mutantes de p16 no son responsables del desarrollo de nevos displásicos o atípicos en estas familias 36,48.
Otro gen de alta penetrancia que parece conferir una gran susceptibilidad para el melanoma fue identificado en 1996 por Zuo et al 49. El CDK4 está estrechamente relacionado con la regulación del CDKN2A e interviene en la progresión del ciclo celular en la fase G1 46. Su mutación se localiza en el sitio de unión con p16. Sin embargo, existen muy pocos casos que presenten esta mutación 50.
El locus del CDKN2A también es responsable de la síntesis de p14ARF. Esta proteína pertenece al complejo p16INK4a/ARF, que codifica el inhibidor cinasa ciclina-dependiente (INK) o p16(INK4a) y el p14ARF, activador de p53. Estímulos oncogénicos, como la exposición solar, inducen la expresión de ARF, que activa p53 bloqueando su degradación por la vía de la ubiquitina 51. Aunque la mayoría de las mutaciones identificadas inactivan específicamente a p16(INK4a), algunas pueden producir defectos en la síntesis de p16(INK4a) y p14ARF. Recientemente se ha detectado un caso de asociación entre melanoma y una mutación con alteración específica en p14ARF y no en p16(INK4a) 52. Las familias en las que se han detectado estas mutaciones son muy pocas hasta el momento para establecer cualquier conclusión.
Un cuarto gen de alta penetrancia, localizado en 1p22, ha sido recientemente identificado como marcador de susceptibilidad para el desarrollo de melanoma 53.
Otros genes con posible susceptibilidad en el melanoma
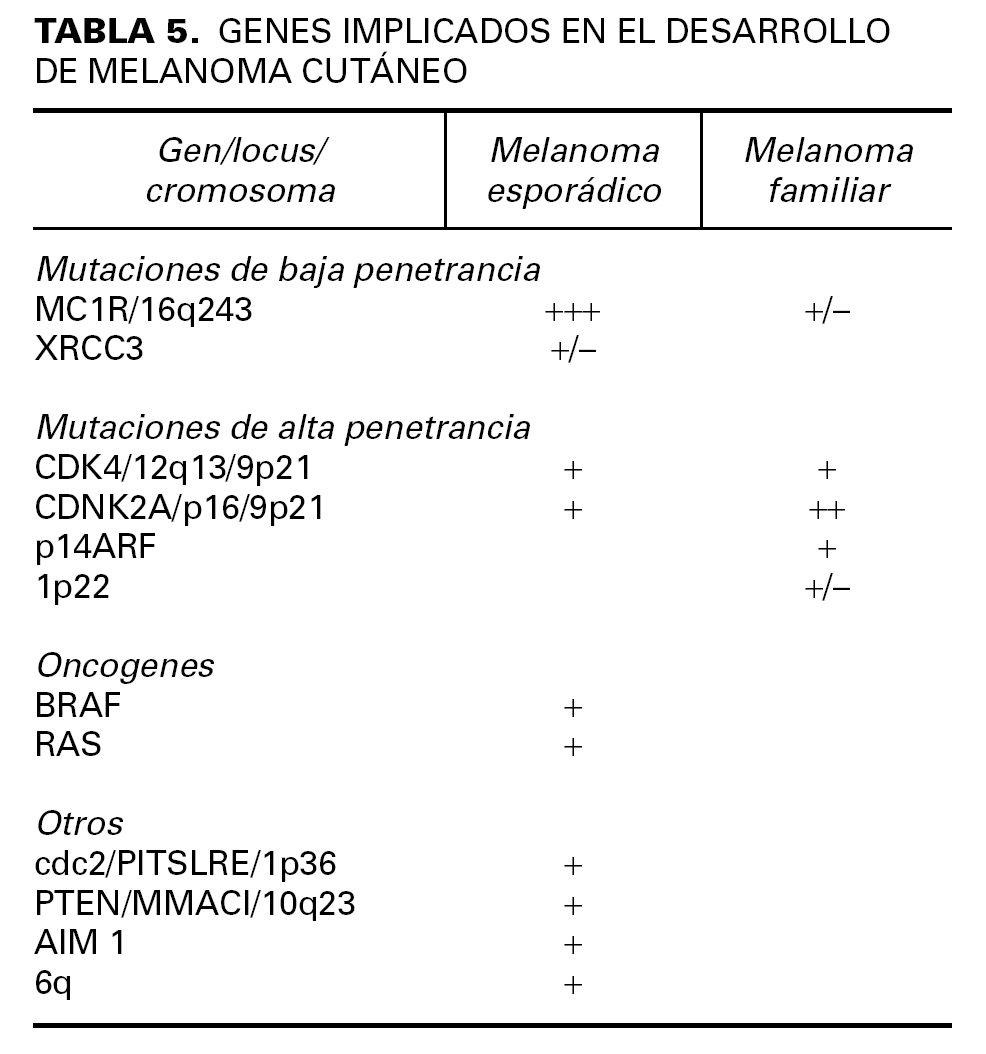
Existen otros genes en los que se ha estudiado su posible susceptibilidad para el desarrollo de melanoma (tabla 5). El estudio de algunas de estas mutaciones ayudaron curiosamente a localizar la mutación del gen p16 en el cromosoma 9p21 54.
Davies et al 55 describieron cambios somáticos en el gen BRAF hasta en el 60 % de los melanomas. Este oncogén está implicado en el desarrollo de hasta el 15 % de todas las neoplasias del ser humano, y codifica una de las tres cinasas reguladas por el también oncogén ras. Se han identificado mutaciones de BRAF en nevos melanocíticos adquiridos, melanomas primarios, metástasis de melanoma y cultivos celulares de melanoma en una proporción similar 55,56. Sin embargo, la presencia de estas mutaciones en melanomas en fase de crecimiento radial es muy inferior (10 %) a la identificada en melanomas en fase de crecimiento vertical y metástasis de melanoma (65-70 %) 56. Estas mutaciones, por tanto, no parecen estar implicadas en la génesis del melanoma, y sí en la progresión del melanoma hacia formas más agresivas y con capacidad metastásica. La presencia de estas mutaciones es más frecuente en melanomas que aparecen en sujetos expuestos de forma intermitente a la luz solar y muy raras en melanomas localizados en piel sometidas a daño solar crónico o regiones anatómicas poco o nada expuestas al sol, como palmas, plantas, subungueal o mucosas 57. Omholt et al 58 confirmaron que las mutaciones en BRAF, siendo Val599Glu la más frecuente, son las mismas en los tumores primarios que en las metástasis del mismo paciente, y que todos estos tumores tenían además la mutación N-Ras. Casula et al 59, tras analizar estas mutaciones en el gen BRAF tanto en ADN de sangre periférica como de muestras tisulares en 569 pacientes con melanoma, observaron que estas mutaciones eran muy frecuentes en las muestras tisulares (59 %), pero solamente cuatro (0,7 %) poseían mutaciones en el ADN de sangre periférica, concluyendo que las mutaciones en el gen BRAF son de carácter somático, y no confieren susceptibilidad hereditaria para padecer melanoma. Estas diferencias apoyan la existencia de distintas vías genéticas de susceptibilidad al melanoma 60.
Experimentos en ratones con déficit en el locus CDKN2A han demostrado su rol en la melanogénesis al inducir melanomas mediante la activación de H-ras 61. La familia de proto-oncogenes ras codifica unas proteínas trifosfato de guanosina (GTP)-dependientes involucradas en la transducción intracelular de señales estimuladoras de la mitosis celular derivadas de la activación de los receptores de los factores de crecimiento. Sus mutaciones son infrecuentes en el melanoma y su papel en la oncogénesis del melanoma sería colaborar en la progresión tumoral tras la iniciación tumoral derivada de una tendencia a la inmortalidad celular, consecuencia por ejemplo de la inactivación de p16 61.
Recientemente, Curtin et al 62 han estudiado la presencia de mutaciones en BRAF y N-ras en 126 pacientes con melanomas, clasificados en cuatro grupos según la localización del melanoma y la exposición a la luz UV. La mayoría de los pacientes con melanomas sin daño solar crónico tenían mutaciones en BRAF o N-ras, concluyendo que las alteraciones genéticas identificadas en melanomas de diferente localización y distintos niveles de exposición solar son independientes y siguen distintos mecanismos genéticos.
Mutaciones en el gen de la fosfatasa PTEN/MMAC1, localizado en el cromosoma 10q23.3, responsable además del síndrome de Cowden, se han descubierto en el 26-48 % de las células de melanoma metastásico, lo que indica la inactivación de este gen durante la progresión del melanoma 63,64.
La expresión del gen cdc2, localizado en el cromosoma 1p36, y que codifica la cinasa PITSLRE, es anormal en las células de melanoma resistentes a la apoptosis mediada por Fas. Este gen se asoció a desarrollo de melanoma en edades tempranas, melanoma múltiple primario y múltiples nevos displásicos, pero estudios posteriores en todo el mundo no han podido confirmar la especificidad de esta asociación 65. Se han implicado defectos en el gen AIM 1 a la fase de crecimiento vertical del melanoma y al desarrollo de metástasis 66. Se han asociado pérdidas de heterogeneidad en el cromosoma 6 a melanomas primarios de gran espesor y melanoma metástasico 67.
Otro hecho interesante es la sobreexpresión de varios receptores de la tirosincinasa en el melanoma, incluyendo el factor de crecimiento fibroblástico, el factor de crecimiento tumoral alfa y el receptor del factor de crecimiento epidérmico (epidermal growth factor o EGF). Se desconocen por el momento las mutaciones responsables de este hecho, confirmado en estudios en animales, así como su importancia en el origen y desarrollo del melanoma. Tampoco se ha podido confirmar que la asociación entre polimorfismos del EGF sea un factor de riesgo de melanoma 68.
Diversos autores, tanto nacionales como extranjeros, han estudiado la posible relación entre el HLA o complejo mayor de histocompatibilidad y la susceptibilidad frente al melanoma, sin encontrar ninguna asociación significativa 69-73. No obstante, la homogeneidad en el locus HLA-DQA1, y probablemente también para el alelo HLA-DQB1*0301, podría considerarse como un factor de riesgo potencial para el desarrollo de melanoma en sujetos con otros factores de riesgos, tanto genéticos como ambientales.
Susceptibilidad de desarrollo de otros tumores en pacientes con melanoma cutáneo
La susceptibilidad para tener un melanoma ha sido descrita en el contexto de varios síndromes neoplásicos familiares que incluían cáncer de mama, laringe, gastrointestinal, y sobre todo, páncreas 74-76. Otros síndromes familiares más raros asociados a melanoma son la neurofibromatosis tipo I, el síndrome de Li-Fraumeni, el retinoblastoma o el melanoma ocular 74-80. Goldstein et al 81 observaron que en algunas familias de Estados Unidos portadoras de mutaciones del gen CDNK2A parecía existir una mayor prevalencia para padecer cáncer de páncreas. Borg et al 82 en Holanda, encontraron que en diferentes familias con melanoma familiar existía un riesgo importante de cáncer de mama y de páncreas. Sin embargo, trabajos posteriores no han confirmado esta asociación entre la predisposición al melanoma y el desarrollo de otro tipo de cáncer visceral, sin que hasta el momento se haya podido establecer claramente que exista un riesgo adicional para el desarrollo de otras neoplasias distintas al melanoma asociado a esta mutación del p16/CDNK2A83. La realización de nuevos estudios es necesaria para determinar si el riesgo de tumores familiares está significativamente aumentado en estas familias, además de investigar los posibles mecanismos genéticos comunes entre el melanoma y otros tumores.
Melanoma cutáneo y melanoma ocular
Son varios los trabajos que han tratado de establecer el papel que desempeñan las mutaciones en MC1R y CDKN2A sobre el desarrollo de melanoma ocular, sin que hasta el momento se halla visto asociación entre las mutaciones que predisponen al desarrollo de ambos tumores 84,85.
CONCLUSION
El melanoma es una entidad muy importante dentro de la salud pública, debido a su todavía creciente incidencia y su todavía mortal evolución en muchos casos.
Los estudios sobre predisposición genética del melanoma deben continuar trabajando en busca de nuevos genes que permitan elucidar el papel etiopatogénico de los factores genéticos y ambientales, así como ejercer un mejor seguimiento de los pacientes con alto riesgo de desarrollar un melanoma 86,87.
Varios loci o genes implicados en la patogénesis del melanoma han sido identificados. La mayoría de los trabajos realizados hasta ahora se han realizado en familias con melanoma múltiple y nevos atípicos, siendo las mutaciones en el CDNK2A/p16 la mejor conocida y de mayor importancia hasta el momento.
Sin embargo, estas mutaciones son muy infrecuentes en la población general, por lo que los esfuerzos en este campo deberían dirigirse a mutaciones o desórdenes más fáciles de observar en la población general, como los polimorfismos del MC1R, que además nos ayudarían a entender la capacidad individual para desarrollar una correcta pigmentación.
Para obtener nuevas respuestas a las preguntas que los hallazgos en la genética del melanoma nos ha planteado en los últimos años, se requieren estudios multihospitalarios, grandes muestras de pacientes, una selección cuidadosa de los controles y que sean confirmados en al menos dos poblaciones distintas, lo que conlleva un alto coste de tiempo y medios hasta que puedan ofrecer resultados satisfactorios.
Los avances obtenidos en futuros estudios nos permitirán realizar tests genéticos de susceptibilidad al melanoma en personas con riesgo tanto de melanoma familiar como melanoma esporádico. También existe la posibilidad de crear nuevas estrategias terapéuticas frente al melanoma basadas en terapia génica o pequeñas moléculas sintetizadas con el objetivo de corregir los defectos en la regulación del ciclo celular, en el caso de p16, o de la capacidad para sintetizar eumelanina, en los polimorfismos de MC1R asociados al melanoma.
Correspondencia:
José A. Avilés. Servicio de Dermatología.
Hospital General Universitario Gregorio Marañón.
Dr. Esquerdo, 46. 28007 Madrid. España.
dermaviles@gmail.com
Recibido el 10 de noviembre de 2005.
Aceptado el 24 de marzo de 2006.