Introducción
La dermatomiositis (DM) es una enfermedad autoinmune del grupo de las miopatías inflamatorias idiopáticas1-4. Los objetivos fundamentales del tratamiento de los pacientes con esta enfermedad consisten en evitar las posibles complicaciones derivadas de la afectación visceral o de la progresión o reagudización del proceso, así como minimizar la posible yatrogenia derivada de su terapia. En las últimas décadas se han intentado identificar parámetros para reconocer las formas especialmente agresivas y para valorar la evolución de la actividad de la enfermedad una vez iniciado el tratamiento. Los parámetros utilizados para el diagnóstico (fuerza muscular, enzimas musculares, hallazgos histológicos, valoración electromiográfica) no son lo suficientemente sensibles ni específicos para evaluar la respuesta al tratamiento5-14. Por ello, diferentes autores han estudiado la relación entre la actividad de la enfermedad y los elementos implicados en la patogenia del proceso, como parámetros relacionados con el grado de lesión muscular15-26, marcadores del grado de lesión endotelial9,27-31, parámetros inmunológicos32-46, citoquinas, moléculas de adhesión35,47-51 y otros52-55.
A pesar de que muchos de estos parámetros han demostrado una cierta utilidad como marcadores de la actividad clínica del proceso, ninguno de ellos ha obtenido un grado de correlación suficiente para sustituir a los marcadores bioquímicos tradicionalmente utilizados.
Evidencias basadas en los hallazgos histopatológicos indican que el daño muscular propio de la DM parece ser consecuencia de una microangiopatía mediada por el complemento56-62. Se ha observado la presencia de depósitos del complejo de ataque de membrana (CAM) C5b-9 en la microvasculatura muscular63 de un significativo porcentaje de pacientes con DM tanto juveniles como del adulto. Estos depósitos se observan en estadios muy tempranos de la enfermedad64-66 y su intensidad se ha relacionado con la agresividad local del proceso.
Por todo ello, la determinación del grado de activación del complemento se plantea como una posible herramienta en la determinación del grado de actividad de la enfermedad. Si bien las determinaciones puntuales y seriadas de parámetros como la actividad hemolítica (CH50) o los niveles séricos de los diferentes componentes pueden ser de cierta utilidad para establecer el estado dinámico del sistema, la determinación de los productos de activación del complemento (PAC) es una medida del estado catabólico y, en consecuencia, es una medida más precisa del grado de activación del mismo. A pesar de las múltiples evidencias de la implicación del sistema del complemento en la patogenia de la DM, hasta el momento existen pocos estudios que se hayan centrado en el análisis de los PAC en pacientes con DM67.
En este trabajo se pretende analizar la relación entre el grado de activación del sistema del complemento determinado a través de la valoración de los niveles plasmáticos de dos PAC (C3a-desArg y SC5b-9) y la actividad clínica de la DM. Dada la implicación de dicho sistema en las fases iniciales del proceso patogénico, pretendemos valorar la utilidad de las determinaciones seriadas de estos parámetros en la predicción de las reagudizaciones de la enfermedad.
Material y métodos
Pacientes
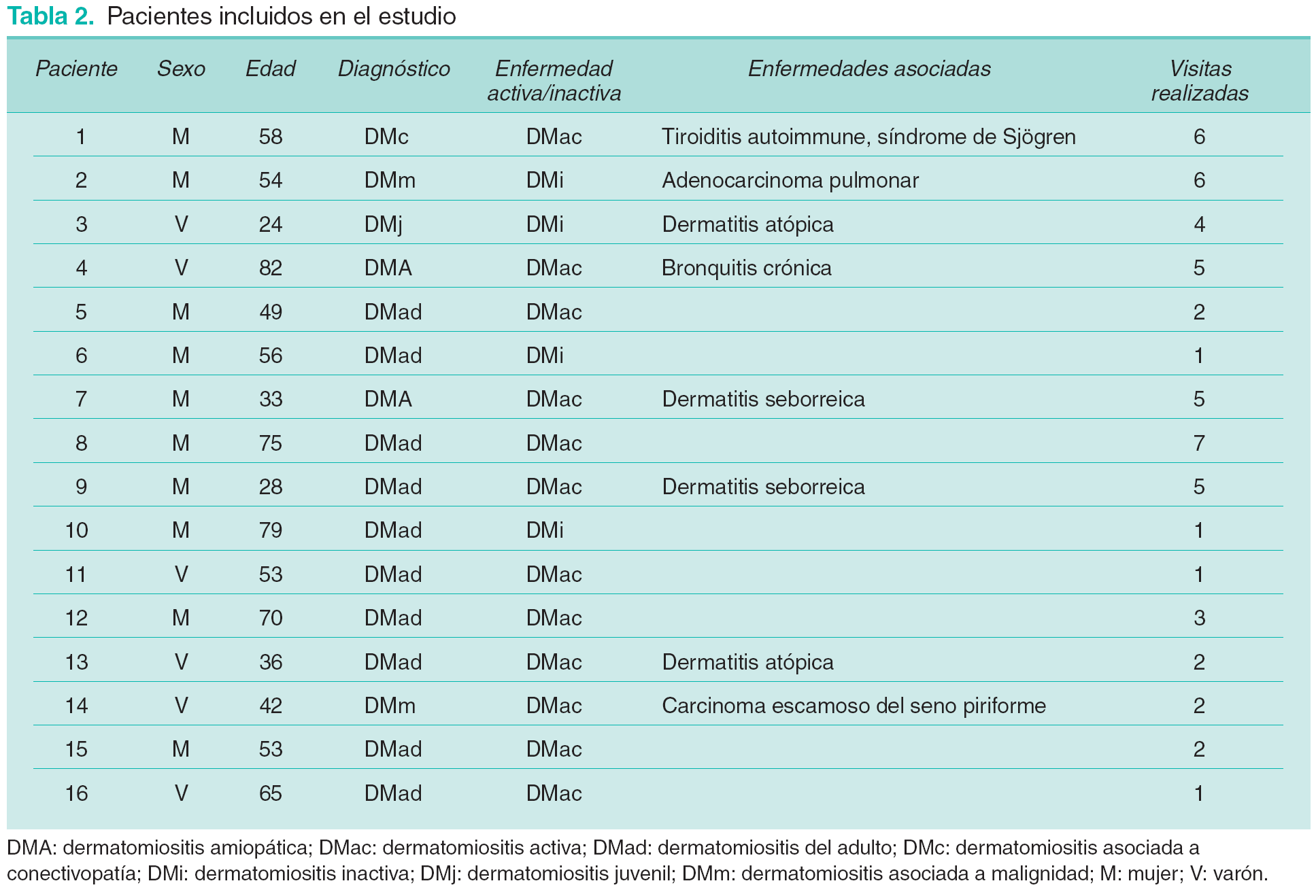
Se incluye a 16 pacientes (10 mujeres, 6 varones, edad media 53 años, rango 24-82) que cumplen los criterios diagnósticos de DM de Bohan y Peter7,8 o de DM amiopática (DMA) de Sontheimer68 procedentes de los servicios de Dermatología, Medicina Interna y Enfermedades Autoinmunes y Sistémicas del Hospital Clínic de Barcelona y del Servicio de Dermatología del Hospital General de Cataluña. Los pacientes se caracterizan por presentar: a) enfermedad activa; b) enfermedad no activa en el momento del estudio, y c) reagudizaciones. El periodo del estudio fue de 21 meses (abril de 1998-enero de 2001). En cada revisión se obtienen muestras de plasma y suero de cada individuo (15 ml de sangre).
Controles
Muestras de plasma de 34 individuos sanos, donantes del banco de sangre del Hospital Clínic de Barcelona (24 mujeres, 10 varones, edad media 45 años, rango 19-65).
Valoración clínica
Los pacientes son valorados cada dos meses, siempre por el mismo investigador9,34,69,70. Éste no participa en el control asistencial habitual del paciente, que es realizado en paralelo y de forma independiente en la unidad correspondiente. El investigador tampoco interviene en las decisiones terapéuticas, ni conoce los resultados de exploraciones complementarias. En cada visita se cuantifica el grado de afectación de 18 grupos musculares proximales, utilizando unas escalas de valoración diseñadas a tal efecto, según criterios ya definidos71.
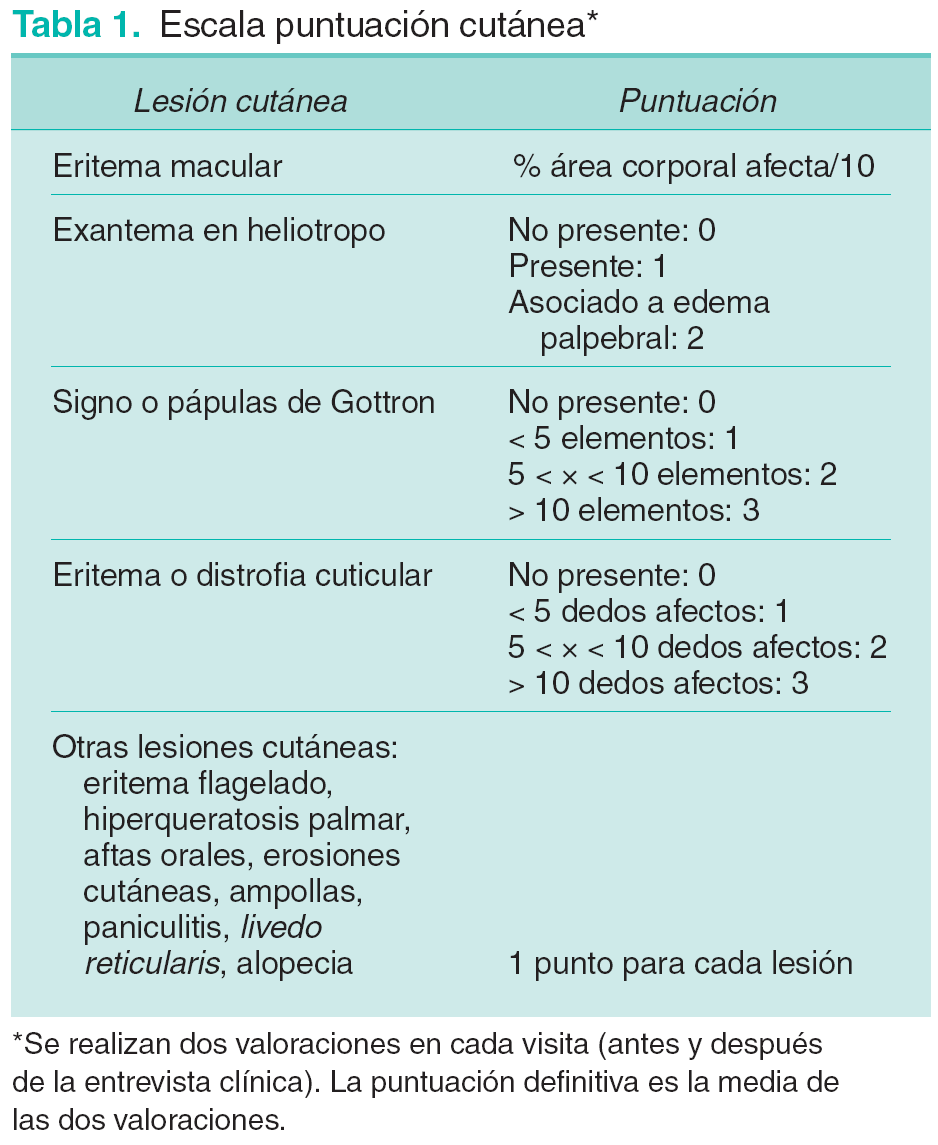
Al no existir escalas prediseñadas para la cuantificación de las lesiones cutáneas de la DM, creamos una escala de valoración propia (tabla 1). La actividad global de la enfermedad se establece como el resultado de la suma de las puntuaciones cutánea y muscular.
También se valora la presencia de mialgia, signos y síntomas de afectación visceral o asociación a vasculitis. Se registra información acerca de la exposición a radiación ultravioleta, del desarrollo de procesos patológicos (infecciosos o inflamatorios) entre visitas y del tratamiento necesario para el control de la enfermedad.
Clasificación de los pacientes y diagnóstico de reagudizaciones en cada revisión
1.DM activa si cumplen: a) puntuación global de actividad superior a 2 y b) necesidad de tratamiento.
2.DM inactiva si no cumplen estos criterios.
3.Reagudización cuando cumple las siguientes condiciones: a) aumento de la puntuación de actividad global con respecto al control anterior, y b) necesidad de aumentar las dosis de medicación habitual, adición de otro fármaco inmunomodulador y/o necesidad de hospitalización coincidiendo con ese aumento en los parámetros de actividad clínica.
Marcadores bioquímicos de actividad tradicionales
En cada revisión se determinan los parámetros bioquímicos tradicionales (velocidad de sedimentación globular [VSG], hemograma, creatinina, creatinfosfoquinasa [CPK], aspartatoaminotransferasa [ASAT], alaninoaminotransferasa [ALAT], lactato deshidrogenasa [LDH], aldolasa, C3 y C4) (laboratorio Hospital Clínic).
Determinación de niveles plasmáticos de PAC
La concentración plasmática de SC5b-9 y C3a-desArg se determina mediante técnica de ELISA, utilizando kits comerciales (Kit ELISA C3a-desArg, Kit ELISA SC5b-9 Quidel (San Diego, CA) y un lector de ELISA automatizado LABOTECH (IFCI CLONE SYSTEMS). Todas las muestras (pacientes y controles) son analizadas simultáneamente por duplicado y en dos ocasiones diferentes, desconociéndose el estado clínico y la identidad del paciente. El valor definitivo de los niveles para cada control se obtiene al calcular la media de los cuatro valores obtenidos.
Métodos de análisis estadístico
Comparación de medias de niveles plasmáticos entre DM activa, DM inactiva y sujetos controles
Se utiliza un modelo lineal mixto en el que por la distribución marcadamente asimétrica y con valores extremos de las variables analizadas (C3a-desArg y SC5b-9) los valores de las mismas son transformados logarítmicamente.
Valoración de la correlación entre niveles de PAC y otros marcadores bioquímicos de actividad con puntuaciones de actividad clínica de la enfermedad
Se calcula la correlación de Spearman entre puntuaciones clínicas y parámetros analíticos en pacientes de los que se disponen los datos de más de tres visitas. Se realiza igualmente una estimación única de la correlación de Spearman a partir de los datos de todos los pacientes.
Valoración de la utilidad de las determinaciones puntuales y/o seriadas de PAC en la predicción de reagudizaciones de la enfermedad
Se identifican las reagudizaciones según los criterios clínicos definidos previamente. Para la valoración de la utilidad de las determinaciones puntuales de C3a-desArg y SC5b-9 como predictores de reagudización se consideran como tests analíticos positivos los que, en los 4 meses previos a dicha reagudización, superan el valor del percentil 95 de la distribución de normalidad del grupo control. En lo referente a la utilidad de las determinaciones seriadas de los diferentes parámetros bioquímicos estudiados, se consideran como tests analíticos positivos las variaciones superiores a un 20 %, o duplicación/reducción al 50 % de niveles si los previos están en el rango de la normalidad en los marcadores bioquímicos tradicionales. En el caso de los PAC, dada la ausencia de trabajos previos que establezcan la significación de las variaciones prospectivas, se consideran todos los incrementos observados como test positivo. Analizamos la sensibilidad y especificidad de dichos marcadores como predictores de dichas reagudizaciones. Considerando el escaso número de reagudizaciones identificadas no se realiza un análisis inferencial (pruebas de significación estadística) de la capacidad predictiva de los diferentes marcadores analíticos de actividad para predecir la actividad clínica.
Resultados
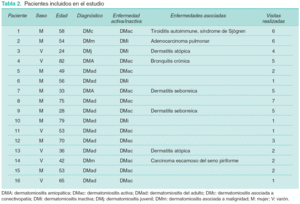
Las características clínicas de los pacientes se resumen en la tabla 2. La duración media de la enfermedad previa al estudio es de 15 meses (rango 0-96). La media temporal entre visitas es de 2,7 meses (rango 1,5-6). Se realizan un total de 54 revisiones (105,5 pacientes-meses) con una media de 3,3 visitas/paciente (rango 1-7). En el momento de ser incluidos en el estudio la enfermedad se considera activa en 12 pacientes e inactiva en 4 (pacientes 2, 3, 6 y 10). Cuatro pacientes pasan de actividad a inactividad durante el seguimiento (pacientes 1, 2, 7, 13).
Comparación de niveles plasmáticos de C3a-desArg y SC5b-9 de pacientes con DM activa, inactiva y controles
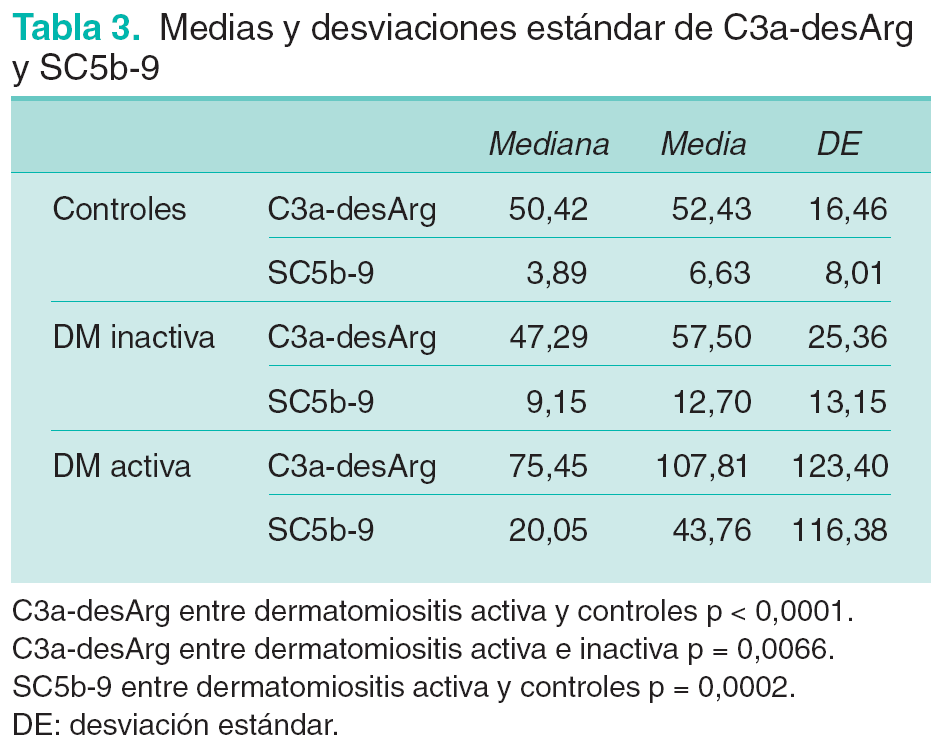
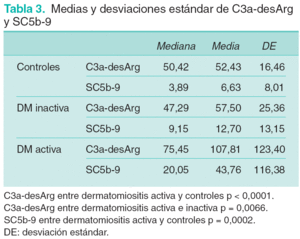
Los valores de las medias, medianas y desviaciones estándar (DE) de C3a-desArg y SC5b-9 en los diferentes grupos (DM activa, DM inactiva y controles) se representan en la tabla 3. En el análisis realizado con el logaritmo natural de C3a-desArg las estimaciones de la diferencia de medias y su intervalo de confianza del 95 % fueron: a) entre controles y DM activa 0,7461 (1,0283 a 0,4639) (p < 0,0001), y b) entre DM activa y DM inactiva 0,5784 (0,1669 a 0,9899) (p = 0,0066). No se observan diferencias significativas entre controles y DM inactiva (p = 0,4197).
En el análisis de SC5b-9 la diferencia entre las medias de los controles y pacientes con DM activa se estima en 1,3160 (1,9846 a 0,6475) (p = 0,0002). La comparación entre DM activa e inactiva y entre DM inactiva y controles no muestra diferencias estadísticamente significativas. Dado que se dispone de tan sólo 8 observaciones en pacientes con DM inactiva no es factible estimar, con una precisión razonable, la sensibilidad y la especificidad de C3a-desArg o SC5b-9 como marcadores de actividad.
Correlación entre actividad cutánea, muscular y global y niveles de los diferentes marcadores bioquímicos analizados
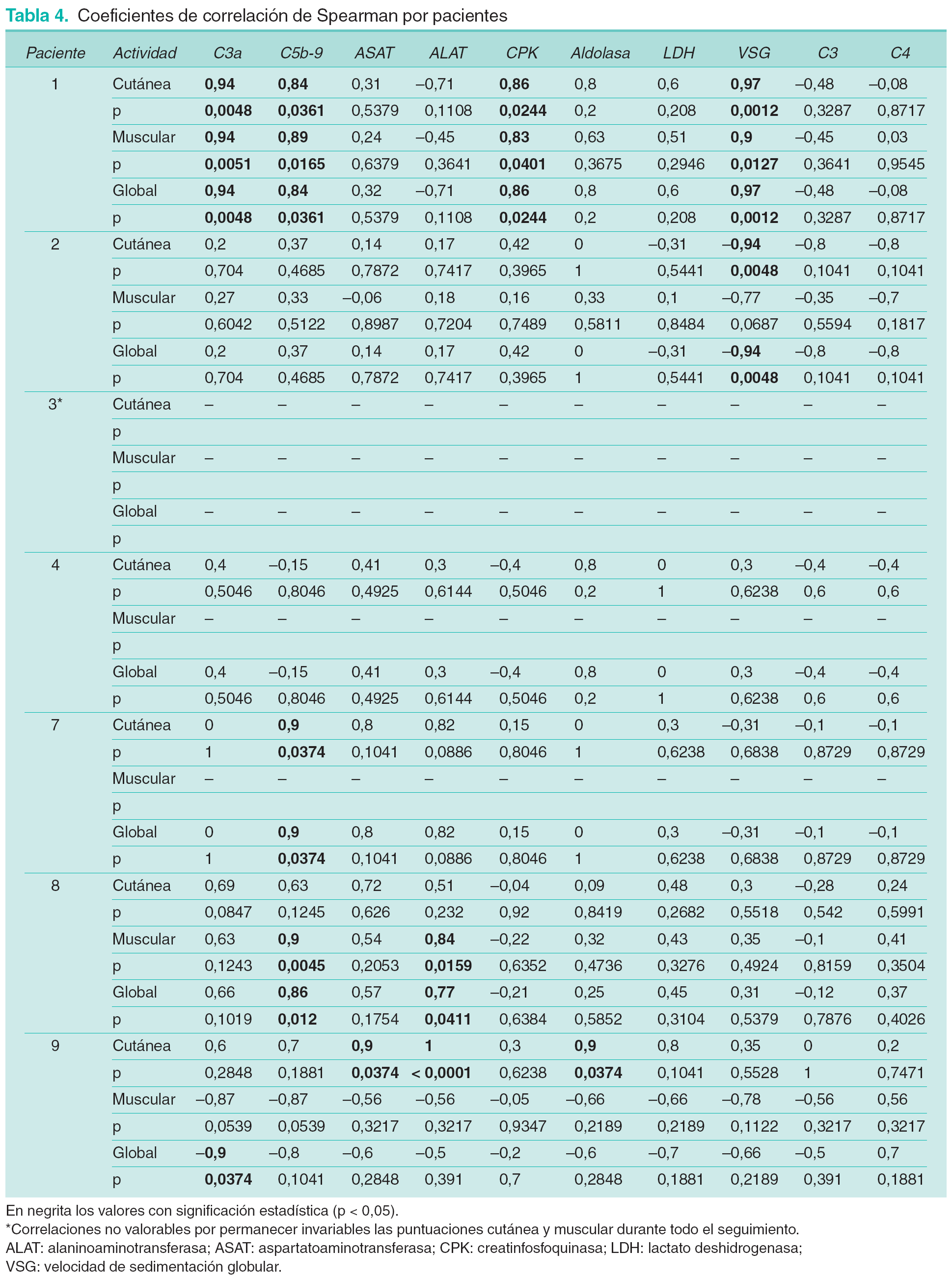
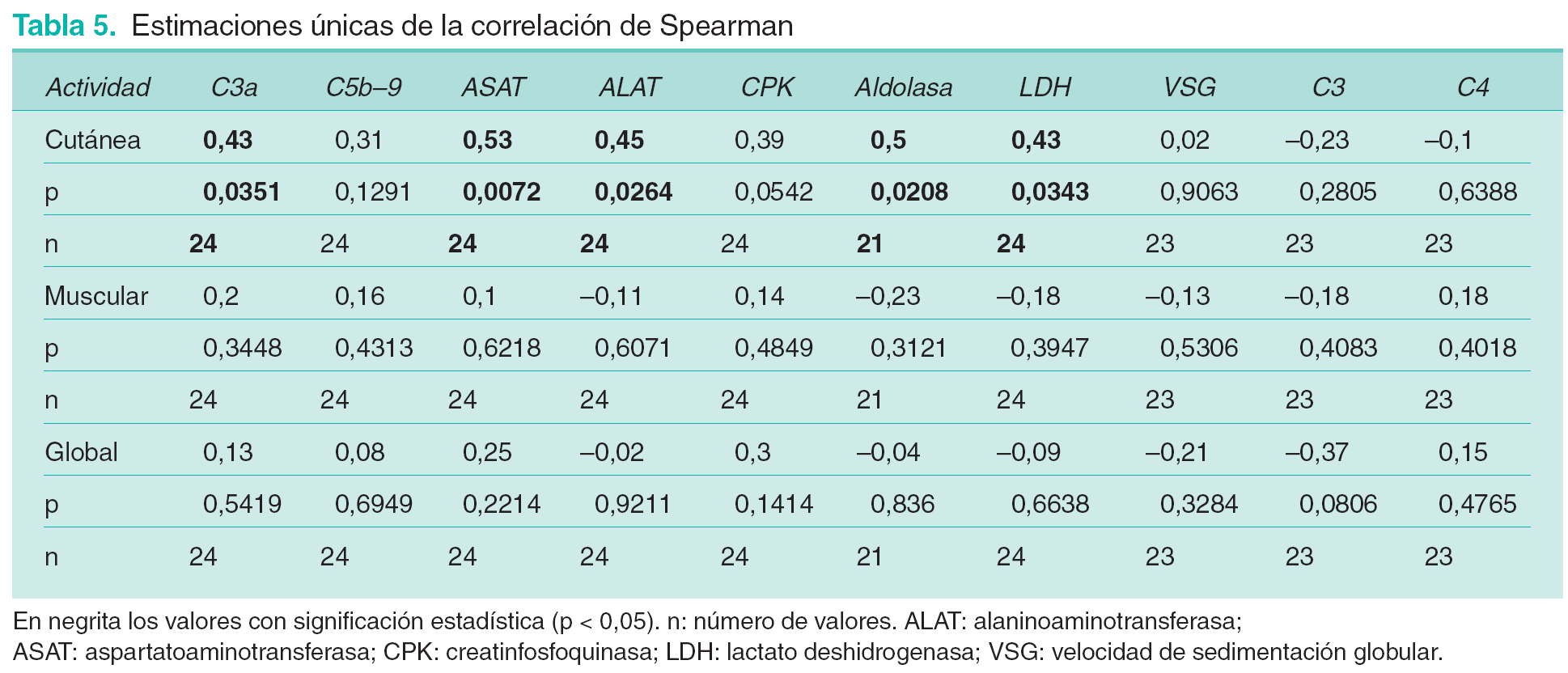
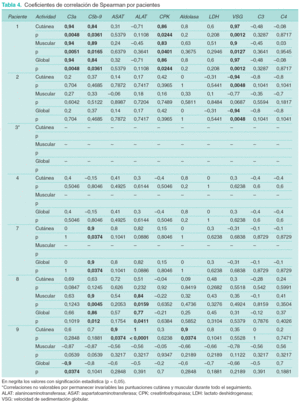
Los coeficientes de correlaciones tanto de C3a-desArg como de SC5b-9 con las puntuaciones cutánea y muscular muestran, salvo excepciones puntuales, valores positivos, aunque con una gran dispersión en su distribución (tabla 4). Tanto aldolasa como CPK y LDH muestran correlaciones positivas con ambos parámetros de actividad clínica. ASAT y ALAT muestran valores de correlación predominantemente positivos con la puntuación cutánea y variables en el caso de la muscular. En el caso de VSG, C3 y C4 se observan correlaciones tanto positivas como negativas. En el paciente número 9 se objetivan correlaciones negativas entre puntuación muscular y la mayoría de marcadores bioquímicos de miositis.
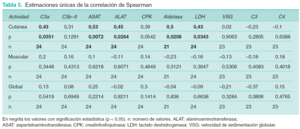
Como consecuencia del escaso número de observaciones, no todas las correlaciones presentaron significación estadística. Por ello se consideraron también todos los pacientes globalmente. Las estimaciones únicas de la correlación de Spearman se muestran en la tabla 5. Con C3a-desArg se observa una correlación positiva significativa únicamente con la puntuación cutánea. SC5b-9 no presenta relación significativa con ninguno de los parámetros de actividad clínica. La puntuación cutánea presenta valores significativos de correlación con ASAT, ALAT, LDH y aldolasa. En el caso de la puntuación muscular y global no se identifican valores significativos de correlación con ninguno de estos parámetros.
Relación entre niveles de marcadores bioquímicos y reagudizaciones de la enfermedad
Considerando los criterios establecidos anteriormente se identificaron 6 episodios de reagudización en el control evolutivo de los pacientes en estudio. Se consideran anormalmente elevados aquellos valores de C3a-desArg y SC5b-9 que superan el percentil 95 del intervalo de normalidad de los controles calculado por métodos no paramétricos (177,04 ng/ml y 61,12 ng/ml, respectivamente).
Relación de reagudización clínica con incrementos en los niveles plasmáticos de C3a-desArg y SC5b-9 en los 4 meses previos
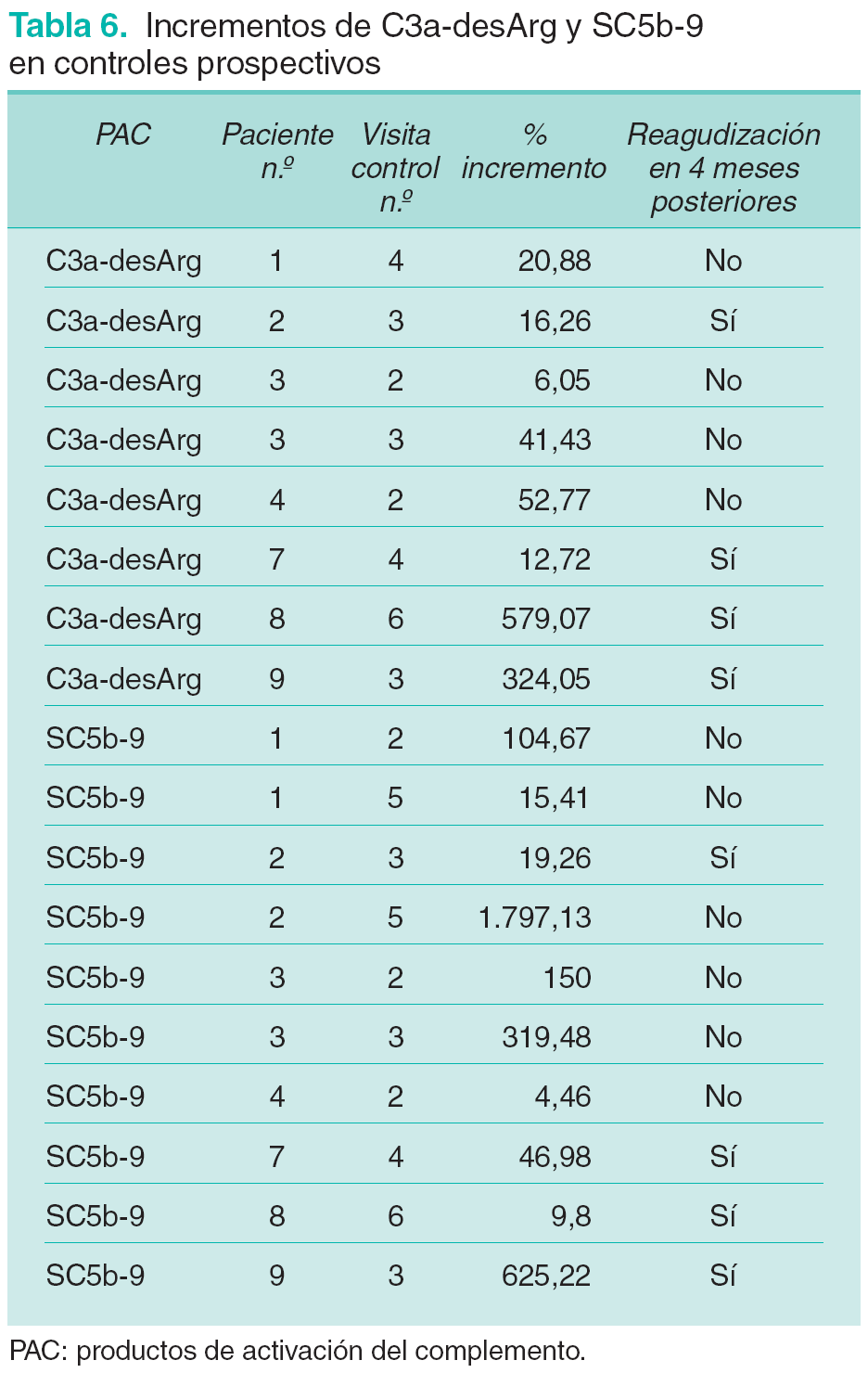
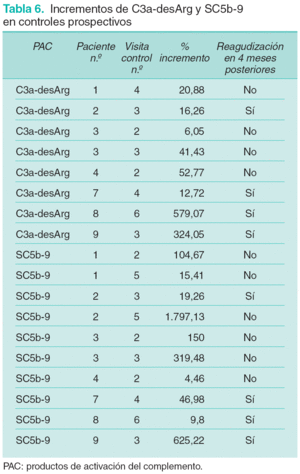
Se valoran los incrementos en los niveles de C3a-desArg y SC5b-9 observados entre visitas sucesivas para evaluar su relación con posteriores reagudizaciones clínicas del proceso. Estos incrementos se expresan en porcentaje con respecto al valor del parámetro en la determinación previa (tabla 6).
A la hora de valorar la especificidad y sensibilidad de los diferentes parámetros bioquímicos como predictores de reagudización se consideraron sólo aquellas determinaciones en las que existían controles clínicos posteriores que permitiesen confirmar o descartar la existencia de reagudizaciones clínicas (4 reagudizaciones clínicas valorables y 18 intervalos de valoración). En el caso de C3a-desArg se identifican incrementos en sus niveles en las 4 reagudizaciones valoradas y en 3 de los 18 intervalos valorados sin relación con reagudizaciones posteriores. En el caso de SC5b-9 se observan incrementos previos en 3 de las 4 reagudizaciones y en 4 de los 18 intervalos sin relación con reagudizaciones posteriores. Con ello se establece una sensibilidad del 100 % para C3a-desArg y del 75 % para SC5b-9, con una especificidad del 83,3 y del 77,7 %, respectivamente, para predecir reagudizaciones en los 4 meses posteriores. La eficacia es del 86,3 % para C3a-desArg y del 77,2 % para SC5b-9, y el valor predictivo positivo o riesgo absoluto de desarrollar una reagudización clínica en los 4 meses posteriores a un aumento en los niveles plasmáticos es del 57,1 % para C3a-desArg y del 42,8 % para SC5b-9.
Relación entre elevaciones en los marcadores bioquímicos de actividad tradicionales y reagudizaciones
La sensibilidad y especificidad de variaciones de un 20 % en los niveles previos para predecir un brote de reagudización en los cuatro meses posteriores son las siguientes: ASAT (25 %; 88,8 %), ALAT (25 %; 94,4 %), LDH (75 %; 94,4 %), CPK (75 %; 88,8 %), aldolasa (33,3 %; 81,2 %), VSG (50 %; 75 %), C3 (0 %; 100 %) y C4 (0 %;100 %). La eficacia como marcadores de reagudización para cada parámetro es: ASAT (77,27 %), ALAT (81,8 %), LDH (90,9 %), CPK (86,3 %), aldolasa (73,6 %), VSG (70 %), C3 (80 %) y C4 (80 %).
El valor predictivo positivo o riesgo absoluto de desarrollar una reagudización clínica en los cuatro meses posteriores a un test positivo para los marcadores comentados es: ASAT (33,3 %), ALAT (50 %), LDH (75 %), CPK (60 %), aldolasa (25 %), VSG (33,3 %) y no valorables en C3 y C4.
Discusión
Comparación de niveles plasmáticos de C3a-desArg y SC5b-9 y actividad de la enfermedad
El hallazgo de incrementos de C3a-desArg y SC5b-9 en pacientes con DM apoya la implicación de la activación del sistema del complemento en la patogenia de la enfermedad. Los resultados obtenidos demuestran también que los niveles de C3a-desArg tienden a estar más elevados en los pacientes con enfermedad activa. Por el contrario, en lo referente a los niveles de SC5b-9, sólo se observan diferencias significativas entre pacientes con enfermedad activa y controles, no existiendo diferencias entre dichos pacientes y los clínicamente inactivos. En definitiva, la determinación puntual de los niveles plasmáticos de C3a-desArg sería útil para diferenciar entre pacientes afectos de DM con enfermedad activa y no activa. En un trabajo previo de Scotty Arroyave28, se comprueban niveles elevados de C3d en 6 de 7 pacientes con DM, siendo además más elevados en aquellos con enfermedad activa, resultados superponibles a los observados en el presente estudio con C3a-desArg. El escaso número de determinaciones en pacientes con enfermedad inactiva y la dependencia de las observaciones de cada paciente no hacen factible la determinación de la sensibilidad y especificidad de estos dos parámetros analíticos como marcadores de actividad de la DM.
En los dos pacientes con forma amiopática de la enfermedad, las variaciones en los niveles plasmáticos de PAC son atribuibles exclusivamente a la actividad cutánea del proceso, observándose correlaciones positivas entre ambos, lo cual apoyaría también la implicación de la activación del sistema del complemento en la patogenia de las lesiones cutáneas características de la enfermedad.
Es de destacar la observación de correlaciones negativas entre los parámetros musculares y la mayoría de marcadores en el paciente número 9. En dicho paciente se comprobó que el empeoramiento de la clínica muscular era debido al desarrollo de atrofia muscular o miopatía esteroidea, en un contexto de mejoría progresiva del resto de parámetros de actividad de la enfermedad. Esto justificaría el aumento de los signos de afectación muscular, a pesar de la disminución de niveles de los marcadores de actividad bioquímica del proceso, explicando el signo negativo de dicha correlación.
Se observa correlación positiva entre los niveles de C3a-desArg y SC5b-9 y los signos de actividad cutánea y muscular, aunque los valores son variables en función del paciente considerado, y con tendencia a ser elevados (superiores a 0,5) entre SC5b-9 y actividad cutánea. Contrariamente a lo esperado, estos marcadores de activación del complemento no mostraron mayor correlación con los parámetros de actividad clínica que el resto de marcadores de actividad tradicionales.
Destaca la correlación positiva entre los parámetros de actividad cutánea y los marcadores bioquímicos de miositis (CPK, aldolasa, ASAT, ALAT y LDH) en la mayoría de pacientes. Este fenómeno es atribuible a la evolución en paralelo de la afección cutánea y muscular de la DM en la mayoría de pacientes. Además, se ha demostrado que los parámetros bioquímicos de miositis se correlacionan mejor con los parámetros de actividad cutánea que con la fuerza muscular, determinada por medio de la exploración física. La determinación de la fuerza muscular, aun siendo una escala de valoración con inminente vocación objetiva, presenta posiblemente limitaciones debidas a la imposibilidad de detectar cambios menores en el grado de afectación de dicha fuerza. Las lesiones cutáneas por el contrario, al ser «más objetivamente» valorables, pueden reflejar más fielmente la actividad inflamatoria del proceso en su conjunto. Estos resultados justificarían la inclusión de la descripción detallada de las lesiones cutáneas en las escalas de valoración de la actividad de la enfermedad, tal como proponen diversos autores72.
Igualmente significativa es la gran correlación entre la VSG y los parámetros de actividad clínica en los pacientes números 1 y 2. En el primero la correlación fue de signo positivo, si bien el paciente presentaba otros procesos autoinmunes asociados (tiroiditis de Hashimoto y síndrome de Sjögren). En el paciente 2, que presentaba una DM asociada a malignidad, la correlación fue de signo negativo, fenómeno atribuible a una elevación de los niveles de VSG en el contexto de una diseminación metastásica, en un paciente con mejoría clínica de la DM tras el tratamiento con dosis elevadas de corticoides sistémicos.
Como consecuencia del consumo de C3 y C4 secundario a la actividad inflamatoria del proceso, se observan correlaciones intrapaciente predominantemente negativas entre estos factores del complemento y la actividad de la enfermedad. Al igual que lo observado por otros autores en otros procesos autoinmunes como el lupus eritematoso sistémico (LES)73,74, los valores de correlación fueron algo mayores para C3, hecho que es atribuido a una activación del sistema del complemento predominantemente por la vía clásica. Por lo general, los valores de correlación de C3a-desArg y SC5b-9 fueron superiores a los obtenidos para C3 y C4 en el mismo paciente, resultados superponibles a los descritos por otros autores en el LES69,75.
Correlación entre actividad cutánea muscular y global y marcadores de actividad valorando los pacientes conjuntamente
Los resultados sugieren que C3a-desArg presenta una mayor correlación que SC5b-9 con los parámetros de actividad de la DM. En otros procesos como el LES, se han publicado trabajos69 con resultados superponibles a los aquí descritos, mientras que otros autores consideran a SC5b-9 como el PAC que mejor se correlaciona con la actividad de la enfermedad74-76.
A pesar de los resultados obtenidos, hemos de considerar que el valor relativamente bajo de la correlación de C3a-desArg con la puntuación cutánea y la ausencia de correlación de este PAC con la puntuación muscular y de SC5b-9 con todos los parámetros de actividad clínica pueden ser debidos al escaso número de pacientes de los cuales se disponía de valores suficientes para realizar este análisis.
En lo referente a los marcadores de actividad tradicionalmente utilizados, los resultados ponen de manifiesto una correlación significativa de los niveles de LDH, ASAT, ALAT, LDH y aldolasa con la puntuación cutánea. No hay correlación significativa de este parámetro clínico y el resto de marcadores bioquímicos tradicionales (VSG, C3 y C4). No hay correlaciones significativas entre puntuación muscular con ninguno de estos parámetros. Las CPK, consideradas como la enzima muscular más útil en el seguimiento de los pacientes con DM, presentan un grado de correlación algo inferior que el resto de enzimas, siendo además una correlación no significativa. Por tanto, considerando a los pacientes globalmente, y contrariamente a lo considerado en las hipótesis del estudio, se confirma que la correlación entre actividad de la enfermedad y niveles de PAC es inferior a la obtenida con los marcadores tradicionales. Se concluye por ello que C3a-desArg y SC5b-9 no son más útiles que el resto de marcadores bioquímicos en la determinación de la actividad de la DM en un momento puntual del control evolutivo.
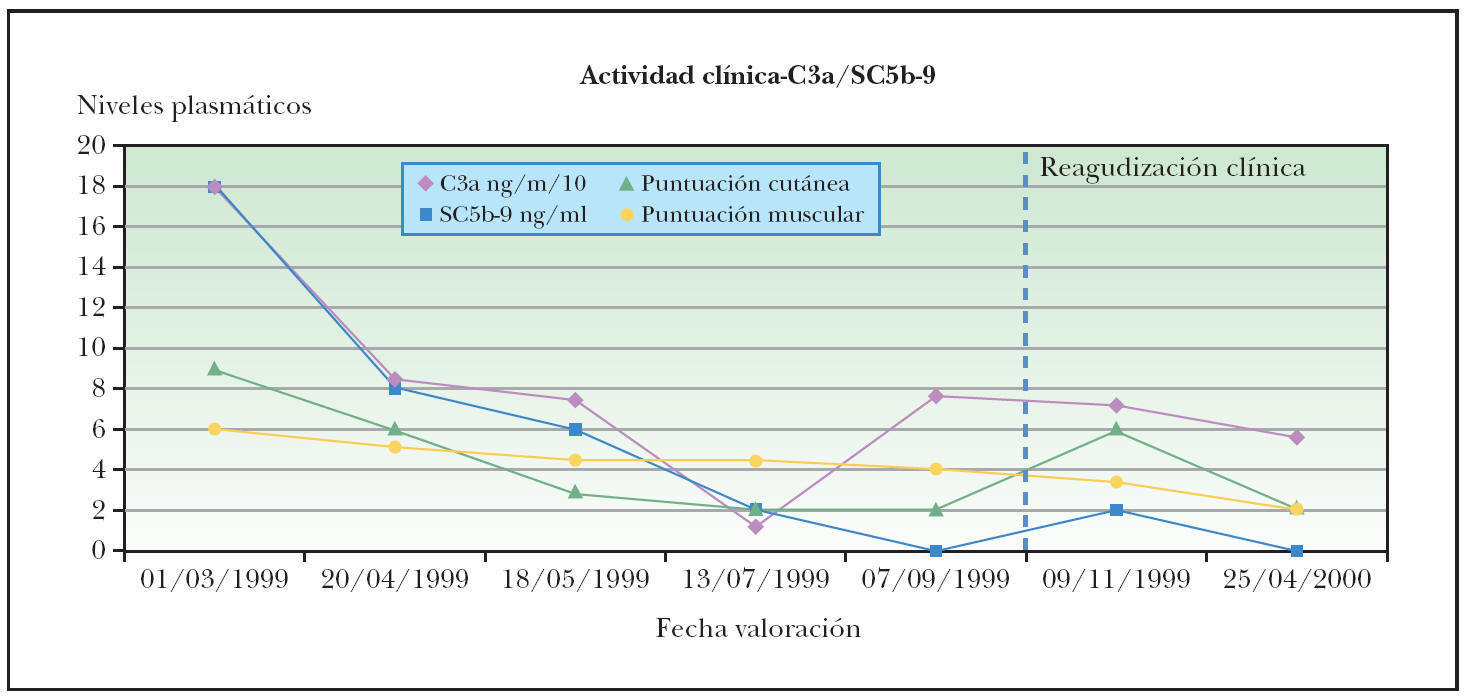
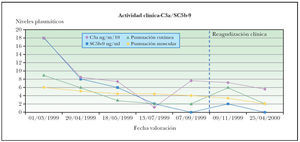
Una posible interpretación a esta menor correlación es que la elevación de niveles de PAC precede a las reagudizaciones clínicas del proceso y en consecuencia a la variación de los parámetros de actividad clínica (fig. 1). Las enzimas musculares son liberadas como consecuencia de la lesión de la fibra muscular, por lo que la correlación temporal entre su incremento y el desarrollo de debilidad muscular es mayor. La instauración de tratamientos inmunomoduladores justificaría también la inhibición del mecanismo patogénico y en consecuencia la reducción de niveles de PAC, precediendo a la recuperación funcional de los tejidos diana. Este decalaje temporal entre las variaciones de PAC y las puntuaciones clínicas podría justificar la menor intensidad en la correlación obtenida para estos marcadores.
Figura 1. Niveles C3a-desArg/SC5b-9 y reagudizaciones en el paciente número 8.
Determinaciones puntuales y seriadas de C3a-desArg y SC5b-9 como predictores de la reagudización de la enfermedad. Comparación con marcadores tradicionales de actividad
Dada la ausencia de estudios previos en DM nos basamos en la experiencia de otros autores en LES para establecer en 4 meses el periodo prerreagudización para la valoración de niveles de los diferentes marcadores bioquímicos70,75. Observamos que de las 4 reagudizaciones consideradas se obtienen niveles previos anormalmente elevados de C3a-desArg en tan sólo dos y en una en el caso de SC5b-9, correspondiéndose con cuadros graves o asociados a afectación visceral. En dos y una ocasiones, respectivamente, observamos niveles anormalmente elevados no relacionados con reagudizaciones posteriores. La determinación aislada de niveles de PAC no parece por ello ofrecer una sensibilidad y especificidad suficientes para predecir las reagudizaciones de los pacientes con DM. La gran variabilidad interindividual en los niveles plasmáticos de PAC, incluso entre pacientes control, podría ser responsable de este hecho.
Por ello consideramos interesante valorar los cambios en el grado de activación del complemento a través de la identificación de variaciones prospectivas en los niveles de PAC en cada paciente9. Observamos que en todos los pacientes que desarrollaron reagudizaciones se detectaron elevaciones de C3a-desArg en los 4 meses previos. Estos incrementos fueron superiores al 12 % en todos los pacientes, alcanzando el 300 y el 500 % en dos de ellos. En lo referente a los niveles de SC5b-9, éstos aumentaron en 3 de las 4 reagudizaciones valoradas y disminuyeron en los meses previos en una. Los incrementos observados superaron el 19 %, alcanzando el 600 % en una ocasión. Los mayores incrementos observados en ambos PAC correspondieron a reagudizaciones graves con lesiones cutáneas extensas y necróticas o asociadas al desarrollo de neumopatía intersticial.
Las determinaciones en las que se obtuvieron incrementos de C3a-desArg y SC5b-9 no relacionados con reagudizaciones posteriores coincidieron con el desarrollo de un cuadro de bronquitis aguda (paciente número 4) y de una pancolitis ulcerosa (paciente número 3). Tan sólo en una ocasión no se identificó ningún proceso intercurrente que justificara dicho incremento. Los datos expuestos sugieren una alta sensibilidad de las elevaciones prospectivas de los niveles plasmáticos de PAC, especialmente de C3a-dseArg, en la predicción de reagudizaciones de la enfermedad y una relación entre el grado de dicho incremento y la gravedad de la citada reagudización. Observamos que en las condiciones planteadas en el estudio las variaciones de los niveles de C3a-desArg son el indicador más sensible de predicción de reagudizaciones, con una sensibilidad del 100 %. Le siguen las variaciones en SC5b-9, LDH y CPK con una sensibilidad del 75 % y la VSG con un 50 %. Esta especial sensibilidad de los PAC se hace patente en el paciente número 9, que desarrollando una grave reagudización con empeoramiento de fuerza muscular y aparición de neumopatía intersticial, sólo presentó incrementos valorables en los niveles de C3a-desArg y SC5b-9. En definitiva, en las condiciones planteadas en el estudio la elevación de niveles de C3a-desArg con respecto a valores previos sería el marcador más sensible para predecir las reagudizaciones clínicas en pacientes con DM, presentando además valores de especificidad elevados.
En conclusión, los resultados apoyan la existencia de una activación del sistema del complemento en los pacientes con DM y que el grado de dicha activación se relaciona con el grado de actividad de la enfermedad. No obstante, la determinación puntual de los niveles de los PAC muestra una utilidad limitada para establecer la actividad de la enfermedad. Únicamente la identificación de niveles muy elevados de C3a-desArg puede contribuir a la predicción de reagudizaciones graves en los meses siguientes. La determinación seriada de C3a-desArg sería el parámetro más sensible para la predicción de reagudizaciones de la enfermedad, existiendo relación entre la gravedad de la reagudización y los niveles de C3a-dseArg. Se precisan estudios multicéntricos que permitan incluir un número de casos y reagudizaciones suficientes para confirmar definitivamente estas observaciones. Por otro lado, los niveles plasmáticos de C3a-desArg y SC5b-9 podrían ser de utilidad para distinguir entre la debilidad muscular secundaria a miositis de miopatía esteroidea o de la atrofia muscular secundaria en los pacientes con DM en tratamiento.
En definitiva, la determinación de los niveles plasmáticos de PAC parece ser una herramienta adicional para el control clínico de pacientes con DM, especialmente en aquellos con formas inestables o graves, al contribuir en la predicción de las reagudizaciones.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Correspondencia:
Antonio Campo Voegeli.
Servicio de Dermatología. Hospital Clínic.
Villarroel 170. 08036 Barcelona. España.
Correo electrónico: 29801acv@comb.es
Aceptado el 3 de abril de 2007.
El estudio ha sido financiado por la beca FIS: 99/0177.