El panitumumab es un anticuerpo monoclonal que inhibe el factor de crecimiento epidérmico (FCE) al unirse a su porción extracelular1. Está aprobado para el tratamiento del carcinoma colorrectal metastásico que exprese receptor para el FCE y KRAS nativo. Los efectos cutáneos adversos pueden ocurrir hasta el 90% de los pacientes1. Presentamos un caso de inflamación de queratosis actínicas subclínicas en relación con panitumumab, un efecto secundario no descrito previamente.
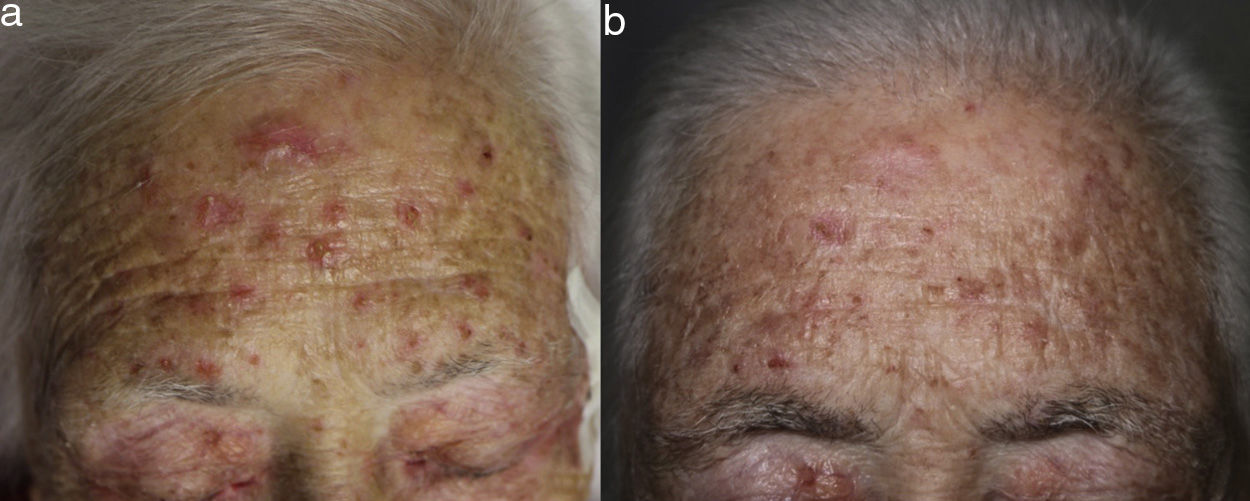
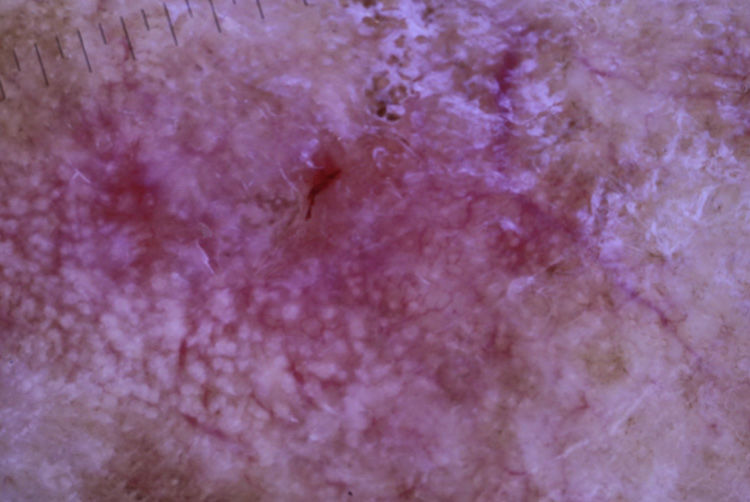
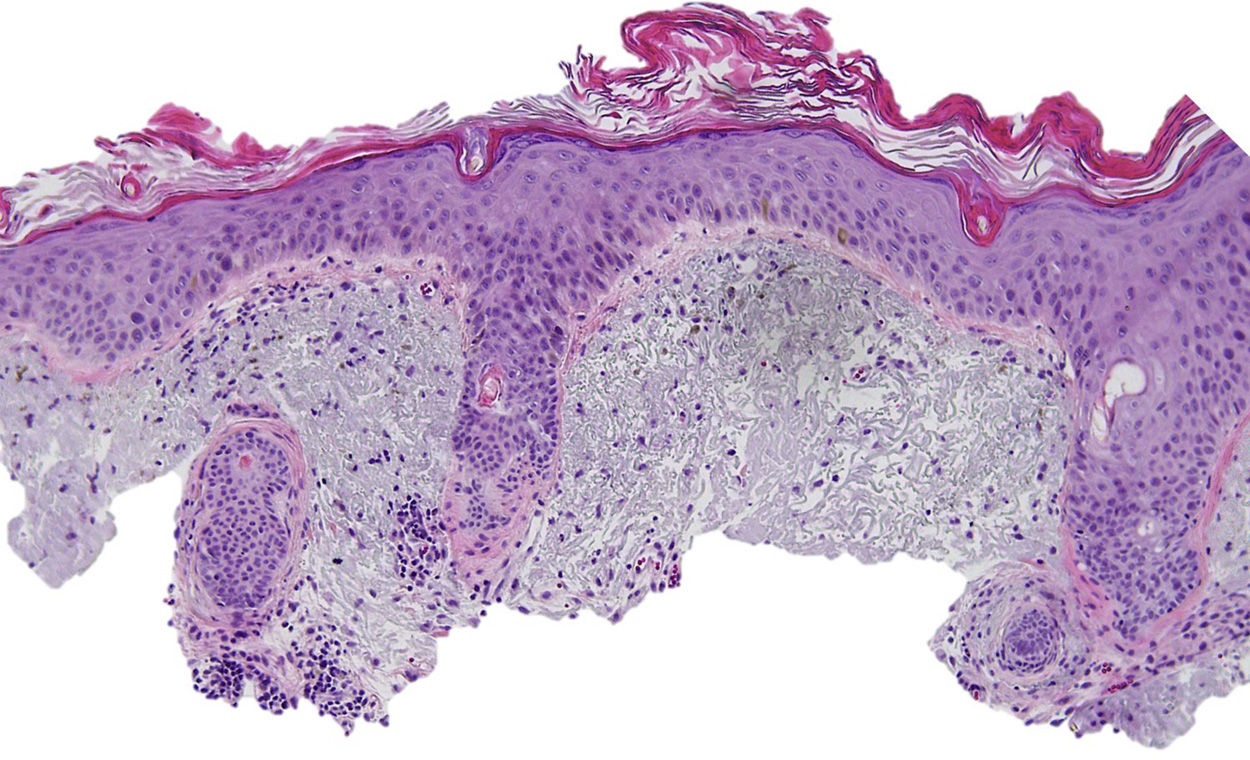
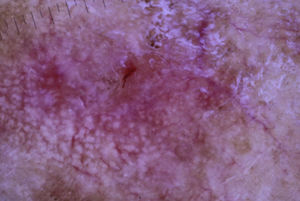
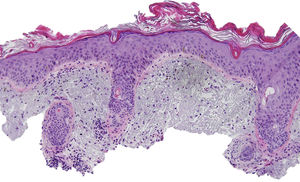
Una mujer de 80 años diagnosticada en 2007 de adenocarcinoma de sigma estadio IV KRAS nativo con metástasis en hígado, pulmón, mediastino y peritoneo. Tras progresión con varias líneas de quimioterapia, inició tratamiento con panitumumab intravenoso en monoterapia cada 3 semanas. Dos meses después del inicio refiere la aparición en la cara de lesiones eritematodescamativas rugosas al tacto, algunas de ellas erosivas (fig. 1), motivo por el que consulta a dermatología. La paciente no tenía antecedentes dermatológicos de interés ni tomaba ninguna otra medicación. En la dermatoscopía había un seudoretículo eritematosa de patrón «en fresa» (fig. 2). Se realizó biopsia de una de las lesiones, en la que se observó atipia queratinocítica prácticamente confinada a la capa basal epidérmica. En la dermis destacaba la presencia de marcada elastosis solar, infiltrado linfocitario sobre todo perifolicular, y melanófagos dispersos (fig. 3). Con el diagnóstico de queratosis actínica grado 1 con inflamación2,3 se pautó una asociación de corticoide tópico y antibiótico durante 2 semanas. La paciente ha recibido un total de 8 ciclos de panitumumab y 5 meses después las lesiones habían regresado dejando una mácula rosada residual (fig. 1b).
En la esfera dermatológica, el panitumumab puede producir alteraciones del pelo y uñas, mucositis, fotosensibilidad, xerosis, fisuras y erupciones papulopustulosas, en ocasiones llegando a requerir reducción de la dosis4.
La inflamación de las queratosis actínicas se observa con frecuencia durante el tratamiento con imiquimod, ingenol mebutato y 5-fluorouracilo tópicos, y su intensidad parece relacionarse con el grado de respuesta clínica5. Es asimismo frecuente que durante estos tratamientos se pongan de manifiesto queratosis actínicas subclínicas en el campo de cancerización5. Varios agentes quimioterápicos sistémicos en monoterapia pueden asimismo producir este efecto, incluyendo fluorouracilo, capecitabina, doxorrubicina, deoxicoformicina, cisplatino, docetaxel y fludarabina. También se ha descrito en terapias de combinación (dactinomicina-dacarbazina-vincristina y doxorrubicina-citarabina-6 tioguanina)6, y con los nuevos fármacos antidiana como sorafenib, sunitinib y erlotinib7–9, aunque no hemos encontrado ningún caso en relación con panitumumab.
La patogenia de esta reacción no se conoce con exactitud. En el caso de los agentes quimioterápicos clásicos podría deberse a citotoxicidad directa sobre los queratinocitos atípicos o a un efecto de «recall» sobre el campo de cancerización8. En el sunitinib se especula un efecto antiangiogénico a nivel de los queratinocitos atípicos7.
Puesto que el receptor para el FCE está alterado en las queratosis actínicas y los carcinomas espinocelulares10, su inhibición por el panitumumab podría haber desencadenado la respuesta inflamatoria de las queratosis actínicas que ocurrió en nuestra paciente. El acúmulo preferencial del fármaco en el infundíbulo folicular pudo favorecer la hiperqueratinización e inflamación secundaria de las queratosis actínicas subclínicas a este nivel, de forma similar a lo propuesto para erlotinib9. Desconocemos si, como ocurre con este último9, su aparición se podría relacionar con una mejor respuesta al fármaco.
En resumen, presentamos el primer caso descrito de queratosis actínicas subclínicas inflamadas y desenmascaradas por panitumumab, un efecto adverso ya descrito para algunos fármacos quimioterápicos clásicos y para las nuevas terapias de diana, aunque de mecanismo aún desconocido.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.