La cirugía micrográfica con márgenes controlados en parafina (PMMS) incluye diversos procedimientos como el slow Mohs o Mohs en diferido, la técnica del Muffin, la torta de Tübingen, y la escisión de márgenes por etapas o espagueti. La PMMS es una modificación de la cirugía de Mohs convencional (MMS) con estudio histológico en diferido. La PMMS requiere una formación mínima y podría ejecutarse en cualquier hospital. Como inconveniente, la PMMS puede requerir realizar procedimientos en distintos días. La PMMS ha demostrado una tasa de recurrencia más baja en comparación con la exéresis convencional en el carcinoma basocelular, y una menor tasa de recurrencia y supervivencia más prolongada en el lentigo maligno. La PMMS también es de gran utilidad en el carcinoma de células escamosas, y en tumores infrecuentes. En este artículo, presentamos una revisión narrativa sobre la PMMS, describiendo técnicas e indicaciones, y destacando sus resultados a largo plazo.
Paraffin-embedded margin-controlled Mohs micrographic surgery (PMMS) includes various procedures such as slow Mohs or deferred Mohs technique, the Muffin and Tübingen techniques, and staged margin excision, or the spaghetti technique. PMMS is a variation of conventional Mohs micrographic surgery (MMS) that allows histopathological examination with delayed margin control. PMMS requires minimum training and may be adopted by any hospital. The setback is that PMMS can require procedures across multiple days. PMMS lowers the rate of recurrence of basal cell carcinoma vs wide local excision in high-risk basal cell carcinoma, and improves the rates of recurrence and survival in lentigo maligna. PMMS can be very useful in high-risk squamous cell carcinoma treatment. Finally, it is a promising technique to treat infrequent skin neoplasms, such as dermatofibrosarcoma protuberans, or extramammary Paget's disease, among others. In this article, we present a literature narrative review on PMMS, describing techniques and indications, and highlighting long-term outcomes.
El tratamiento quirúrgico con márgenes libres (resección R0) es el tratamiento de elección para la mayoría de las neoplasias cutáneas localizadas1. La cirugía micrográfica con márgenes controlados o cirugía de Mohs (MMS, del inglés Mohs MicrographicSurgery) ha demostrado la tasa de curación más alta y la tasa de recidivas más baja en el tratamiento de diversos tumores cutáneos2–5. La MMS tiene numerosas indicaciones y ha sufrido múltiples variaciones desde su descripción original6. Además de sus ventajas en términos de menores tasas de recidiva local, estudios recientes han sugerido menores tasas de recidiva locorregional, con menores tasas de metástasis en tránsito o satelitosis en el melanoma de cabeza y cuello, así como una menor tasa de metástasis a distancia, e incluso una mayor supervivencia7–9. A pesar de sus numerosas ventajas, la MMS presenta varios inconvenientes. Entre ellos se encuentran su elevado coste, la necesidad de disponer de un equipo quirúrgico y técnico con formación avanzada, equipamiento adecuado y el tiempo necesario cuando se requieren varias etapas10,11. En respuesta a estas dificultades, especialmente cuando se trata de depender de un equipo técnico especializado en el momento preciso de la cirugía para el análisis in vivo, a finales de la década de 1970 se empezaron a desarrollar variaciones de la técnica original de la MMS para permitir análisis diferidos, utilizando secciones fijadas en parafina. Estas técnicas se han descrito en la literatura médica científica como Cirugía de Mohs en diferido, “Slow Mohs”, estudio histológico en 3D, evaluación completa del margen circunferencial periférico y profundo con secciones permanentes, técnica del Muffin, técnica de perímetro, técnica del cuadrante, técnica de Tübingen, secciones de parafina rápidas, técnica de escisión marginal y central por etapas o secciones de parafina con cartografía tisular antes del cierre quirúrgico diferido del defecto. Aunque estas técnicas son diferentes, analizan el 100% de los márgenes del tumor, tanto los bordes laterales como en profundidad (el examen histopatológico convencional analiza <1% de los márgenes), y se realizan a través de incisiones en 90°. En todos estos procedimientos, el tejido extirpado se marca para tener una orientación topográfica precisa12,13. Estas técnicas pueden realizarse tanto con secciones congeladas como en parafina. Sin embargo, en la práctica clínica habitual, la mayoría de las veces se realizan con secciones fijadas en parafina. Para evitar confusiones de nomenclatura, nos referiremos a todas las variantes de la MMS con secciones en parafina como cirugía micrográfica de Mohs con márgenes controlados en parafina (PMMS, del inglés paraffin-embedded margin-controlled Mohs micrographic surgery). Con esta técnica se puede conseguir un análisis completo de la pieza extirpada quirúrgicamente al igual que con la MMS, sin tener que realizar un análisis inmediatamente después del procedimiento quirúrgico. Este análisis diferido ha demostrado su eficacia no sólo en el carcinoma basocelular (CBC) y el carcinoma escamoso cutáneo (CEC), sino también en otros en los que el análisis inmediato (en fresco) es más complejo y puede requerir análisis inmunohistoquímico, como el lentigo maligno melanoma (LMM), el fibroxantoma atípico (FXA), el dermatofibrosarcoma protuberans (DFSP) o la enfermedad de Paget extramamaria, entre otros14-16. En la tabla 1 se muestra una comparación entre la cirugía MMS y la PMMS. En este artículo revisaremos los diferentes tipos de PMMS, así como sus indicaciones y resultados en términos de recidiva local en el tratamiento quirúrgico de diversas neoplasias cutáneas.
Comparación entre la cirugía de Mohs convencional y la cirugía controlada microscópicamente en parafina
| Cirugía de Mohs convencional | PMMS | |
|---|---|---|
| Año de instauración | Principios de los años 40 | Finales de los años 70 |
| Número de veces que el paciente entra en el quirófano | Varios | Variable |
| Número de días que el paciente entra en el quirófano | Casi siempre un día | Variable |
| Necesidad de equipo dermatológico y técnico especializado | Si | No |
| Necesidad de equipo dermatológico y técnico especializado disponible el mismo día de la cirugía | Si | No |
| Ángulo de incisión | 45°* | 90° |
| Posible transección del tumor durante la escisión | Mayor | Menor |
| Calidad del tejido analizado | Bueno | Mejor |
| Visualización de las características histológicas (diferenciación, invasión linfovascular o perineural, subtipo histológico, etc.) | Limitado | Adecuado |
| Técnicas de inmunohistoquímica | Limitado | Ampliamente disponible |
| Posibilidad de estudiar piezas de gran tamaño | Limitado | Adecuado |
| Posibilidad de artefactos o errores en el procesamiento de las muestras | Bajo | Muy bajo |
| Cierre del defecto quirúrgico | Puede ser más difícil (ángulos biselados de los márgenes). El tejido biselado puede eliminarse para facilitar el cierre | Más fácil (90°, bordes de heridas verticales) |
| Posibilidad de planificar un cierre quirúrgico | En el momento | De forma planificada |
| Tumores donde más se realiza | CBC (sobre todo) y CEC | CEC, LMM, DFSP |
| Eficacia | Muy buenaa | Óptima |
| Seguridad | Comparable a escisiones locales amplias | Comparable a escisiones locales amplias |
| Satisfacción del paciente | Buena | Buena |
Abreviaturas: CBC: carcinoma basocelular; CEC: carcinoma escamoso cutáneo; LMM: lentigo maligno melanoma; DFSP: dermatofibrosarcoma protuberans; PMMS: cirugía microscópica controlada embebida en parafina.
Se realizó una búsqueda narrativa de la literatura en Medline y Google Scholar durante mayo de 2023 utilizando los términos clave de “Mohs surgery”, “Mohs surgery in paraffin”, “Slow Mohs”, “3D histology”, “complete circumferential peripherals and deep margin assessment with permanent sections”, “Muffin-technique surgery”, “perimeter technique surgery”, “quadrant technique surgery”, “Tubingen technique”, “rush paraffin sections”, “staged marginal and central excision technique”, “spaghetti technique”, ya sea solo o en combinación con las palabras clave “basal cell carcinoma”, “squamous cell carcinoma”, “melanoma”, “lentigo maligna melanoma”, “acral lentiginous melanoma”, “dermatofibrosarcoma protuberans”, “atypical fibroxanthoma”, “microcystic adnexal carcinoma”, “Merkel cell carcinoma”, “extramammary Paget's disease” y “cutaneous adnexal tumors”. Se incluyeron estudios prospectivos y retrospectivos, series de casos de ≥10 pacientes, ensayos clínicos y revisiones sistemáticas (RS) y metanálisis (MA). En cuanto a los tumores poco frecuentes, se recogieron algunas series con <10 pacientes y que tuvieran una calidad metodológica satisfactoria. Dos de los autores (MMP y DMC) realizaron la búsqueda y seleccionaron los artículos.
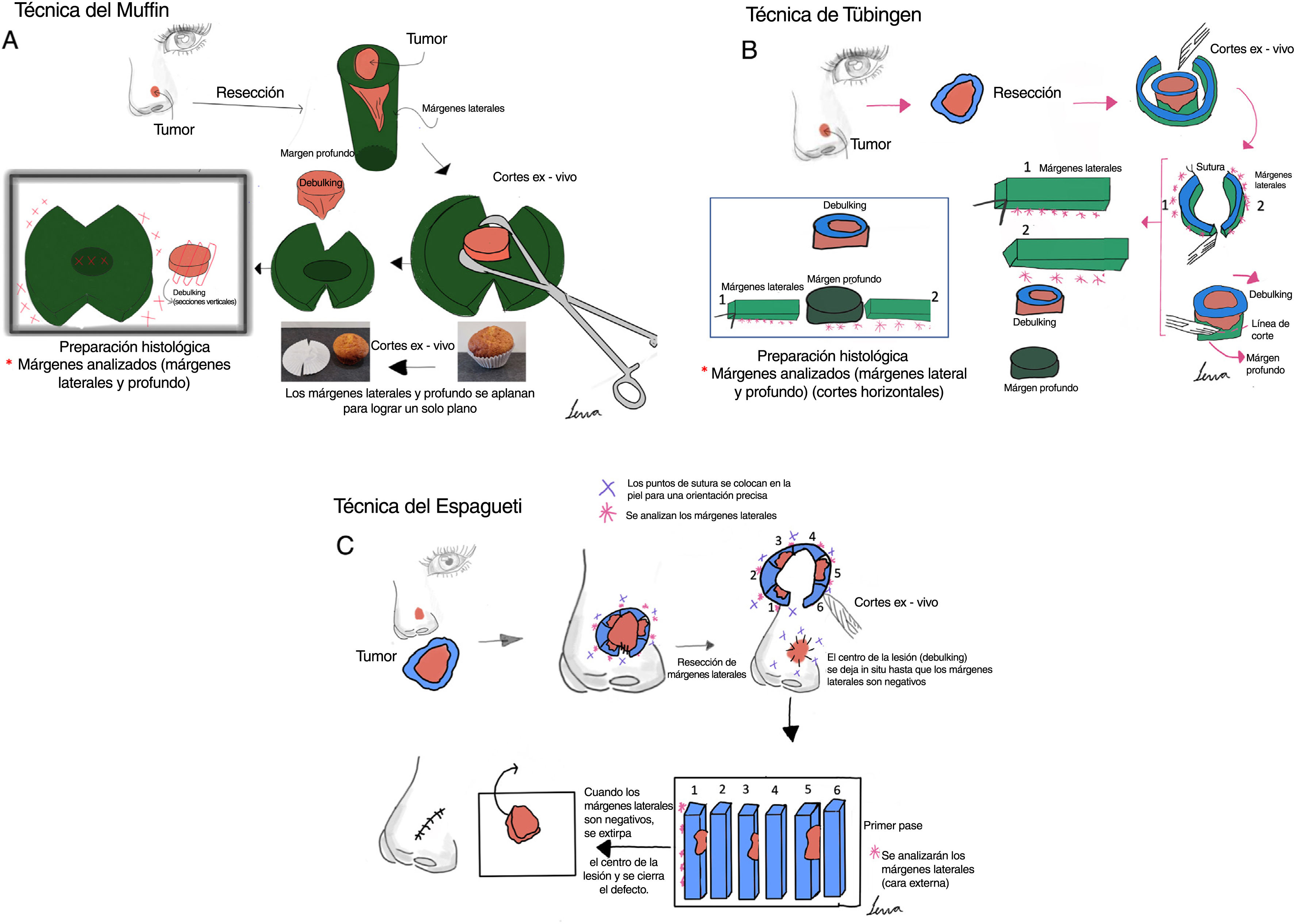
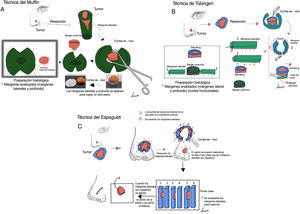
ResultadosTécnicas de control de márgenes embebidas en parafinaSe han descrito numerosas variantes de PMMS, todas las cuales tienen en común el análisis diferido de la pieza quirúrgica. Aunque los términos utilizados son a veces intercambiables, difieren principalmente en el método de corte de la pieza (tabla 2 y fig. 1).
Cirugía controlada microscópicamente embebida en parafina, ventajas e inconvenientes
| Método | Descripción | Cortes in vivo | Cortes ex vivo | Forma de los márgenes laterales | Ventajas | Desventajas | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| Debulking | Márgenes laterales | Margen profundo | Debulking | Márgenes laterales | Margen profundo | |||||
| Técnica delMuffin | Escisión en bloque y corte posterior que permite el aplanamiento del tejido. | No | No | No | Si | Si | Si | Redondeados | - Examen completo de los márgenes quirúrgicos en un solo proceso- Adecuado para escisiones pequeñas- Requiere una formación mínima | - El centro tumoral de las muestras pequeñas es más difícil de evaluar- Se requiere imaginación visual- No adecuado para escisiones grandes |
| Técnica de la tira periférica (tarta de Tübingen) | Similar a la técnica del Muffin, pero se separan la base y los márgenes laterales. | No | No | No | Si | Si | Si | Redondeados | - Examen completo de los márgenes quirúrgicos- Adecuado para escisiones grandes- Requiere una formación mínima | - No es adecuado para escisiones pequeñas |
| Técnica del foso o perimetral | Los márgenes laterales se extirpan en primer lugar. El análisis de los fragmentos perimetrales se realiza preservando el centro del tumor (que se extirpa cuando los márgenes laterales resultan negativos) | No | Si | No | No | No | No | Lineal | - No requiere formación previa- Postoperatorio más cómodo para los pacientes (evita las heridas expuestas mientras se espera el resultado histológico)- Escisión del tumor y reconstrucción el mismo día | - La base sólo puede examinarse en una fase posterior durante la cirugía- Recomendado sólo para tumores superficiales (LM, enfermedad de Paget extramamaria) |
| Espagueti (escisión por etapas) | Igual que la técnica del foso, pero los márgenes laterales son circunferenciales, no lineales. | No | Si | No | No | No | No | Redondeados | - No requiere formación previa- Postoperatorio más cómodo para el paciente (evita la exposición de las heridas a la espera del resultado histológico)- Escisión del tumor y reconstrucción el mismo día | - Posibilidad de invasión del tumor en el centro de la pieza- El uso de suturas puede provocar una reacción inflamatoria local y una alteración de la histología, y puede favorecer las infecciones.- La base sólo puede examinarse en una fase posterior- Sólo se recomienda para tumores superficiales |
| Procedimiento cuadrangular | Escisión en cuadrado. La zona extirpada incluye los márgenes fuera del tumor, y posteriormente se procesa en 4 fragmentos. | No | No | No | Si | Si | Si | Lineal | - Posible análisis completo de los márgenes quirúrgicos | - A veces, la incisión es problemática- Defectos cuadrados de la herida, cierre difícil |
| Técnica del cuadrante | Extirpación de los márgenes de la pieza fija. La pieza se procesa posteriormente en 4 fragmentos longitudinales. | No | No | No | Si | Si | Si | Lineal | - Posible análisis completo de los márgenes quirúrgicos- Ningún trabajo adicional aparte del marcaje con las suturas | - La fijación previa hace aún más problemático el corte plano desde la periferia |
Abreviatura: LM: lentigo maligna.
Cirugía micrográfica de Mohs con márgenes controlados e incluidos en parafina. (A) Técnica del Muffin. Tras la resección, se realizan incisiones profundas a las 6 y a las 12 horas, y los márgenes laterales se pliegan lateralmente hasta un plano horizontal (el mismo plano de la base), que luego se corta tras ser fijado con formaldehído e incluido en parafina en un plano horizontal empezando por la parte inferior de la muestra. Un corte transversal representativo de la parte central del tumor (debulking) puede ayudar a la clasificación diagnóstica. (B) Técnica de Tübingen. Tras la resección, se corta una tira marginal lateral estrecha (1-3mm) alrededor de todo el perímetro del borde del tumor. La tira se coloca plana sobre el lado periférico y luego se corta en trozos que se colocan en casetes de rutina para el examen histopatológico. Posteriormente, se corta una sección horizontal de la parte inferior de la muestra extirpada y también se coloca plana en un casete de histología. (C) Técnica del Espagueti. Se reseca una banda estrecha de piel, “el espagueti”, de 3-5mm más allá del perímetro clínico/dermatoscópico aparente del tumor y se envía para examen histopatológico sin extirpación tumoral. El mismo procedimiento se repite más allá de los segmentos que se muestran “tumor positivo” y después hasta que todos los márgenes laterales estén libres de tumor.
Papel de la cirugía micrográfica de Mohs embebida en parafina en la dermato-oncología
Carcinoma basocelularEl CBC es el tumor maligno más frecuente en humanos. El tratamiento inadecuado o las extirpaciones incompletas pueden dar lugar a tumores infiltrantes que pueden producir importantes complicaciones funcionales y estéticas17. La MMS es óptima para el CBC, especialmente frente a las variantes tumorales de crecimiento más agresivo, las recidivas del CBC y los tumores que presentan factores de riesgo adicionales. Tradicionalmente, la MMS se ha realizado con secciones congeladas17-19. Encontramos 17 estudios sobre el uso de la PMMS en el tratamiento del CBC: 8 estudios retrospectivos13,20-26, 3 estudios prospectivos27-29, 5 ensayos clínicos aleatorizados (ECA)30-34, y 1 RS con MA35 (tabla 3). Ya en 1988, Breuninger et al. publicaron el primer estudio que analizó la PMMS en el tratamiento del CBC, encontrando una tasa de recurrencia <0,1% con un seguimiento medio de 4 años19. Uno de los estudios con la muestra más amplia hasta la fecha, >5200 pacientes, informó de tasas de recurrencia <1% a los 5 años22. En un ECA que comparó la PMMS frente a otras técnicas (incluida la MMS), se encontraron tasas más bajas de recurrencia con la PMMS a los 5 y 10 años, especialmente a los 10 años en los casos de tumores recurrentes31.
Cirugía microscópica controlada en parafina en el carcinoma basocelular
| Autores | Año | n | Descripción | Resultados |
|---|---|---|---|---|
| Breuninger et al.19 | 1988 | 1,281 CBCs primarios y 178 recidivas | Estudio retrospectivo.Institución única.Técnica de Tübingen. | 6 recidivas durante el periodo de seguimiento (4 tumores primarios y 2 recidivantes). Seguimiento medio de 4 años. |
| Holzschuh et al.22 | 1996 | >5,000 | Estudio retrospectivo.Institución única.Técnica no especificada. | Tasa de recurrencia <1% a los 5 años. |
| der Plessis et al.24 | 1998 | 120 | Estudio retrospectivo.Institución única.Sólo casos perioculares.Técnica del Muffin. | Seguimiento entre 6 meses y 5 años, sin ninguna recidiva. |
| Smeets et al.30 | 2004 | 612 | Estudio prospectivo aleatorizado comparando MMS frente a otras modalidades de escisión en el tratamiento del CBC.Unicéntrico.Técnica no especificada. | De los CBC primarios, cinco (3%) recidivaron tras la escisión convencional en comparación con tres (2%) tras la PMMS durante los 30 meses de seguimiento.De los CBC recidivados, tres (3%) recidivaron tras la escisión convencional y ninguno tras la PMMS durante 18 meses de seguimiento. |
| Mosterd et al.32 | 2008 | 612 | Ensayo prospectivo aleatorizado y controlado con 5 años de seguimiento.Método del cuadrante. | Después de cinco años, se observaron diferencias estadísticamente significativas en la tasa de recurrencia de los CBCs recurrentes, no de los CBsC primarios. |
| Lawrence et al.13 | 2009 | 1,090 | Estudio retrospective.Unicéntrico.Técnica no especificada. | Tasas de recurrencia del 2,8% a los 5 años con MMS frente al 0,7% con PMMS. |
| Morris et al.29 | 2009 | 278 | Estudio prospectivo.Unicéntrico.Técnica no especificada. | La recidiva se produjo sólo en un paciente (0,58% de los que tuvieron un seguimiento de 5 años). |
| Häfner et al.27 | 2011 | 5,227 | Estudio prospectivo.Unicéntrico.Técnica deTübingen. | 36 de los 3320 pacientes desarrollaron una recidiva local tras un seguimiento medio de 5 años. |
| Wollina et al.25 | 2014 | 321 | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | Ninguna recidiva durante el seguimiento (media de 10 meses). |
| van Loo et al.31 | 2014 | 612 | Ensayo prospectivo aleatorizado y controlado con 10 años de seguimiento.Técnica no especificada. | Tras diez años de seguimiento, se observó un beneficio significativo para el PMMS frente a la ELA en el CBC primario (4,4% frente a 12,2%) y en el CBC recidivado (3,9% frente a 13,5%) |
| Eberle et al.21 | 2014 | 947 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | Tras una mediana de seguimiento de 47 meses, 10 de los 947 CBCs recidivaron (1,1%). |
| Boehringer et al.33 | 2015 | 283 tumores (51,2%) en el grupo de MMS; 270 tumores (48,8%) en el grupo de la PMMS | Estudio prospectivo aleatorizado y ciego.Unicéntrico.Técnica de Tübingen. | Para la detección de persistencias tumorales, la PMMS tiene casi el doble de sensibilidad que la microscop-a tipo rebanada de pan, especialmente en carcinomas agresivos/infiltrantes. No se determinó la tasa de recidivas. |
| Thornton et al.26 | 2019 | 169 | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | El 2,83% habían recidivado a los 3 años. Un grupo más pequeño de 72 pacientes sobrevivió y tuvo un seguimiento de 5 años, con una tasa de recidiva del 4,16%. |
| Kofler et al.34 | 2021 | 287 CBC en la PMMS y 282 CBC en el grupo de MMS | Estudio aleatorizado, prospectivo y ciego comparando PMMS vs MMS. Unicéntrico.Técnicas del Muffin y de Tübingen. | En el grupo de MMS, fue necesaria la reextirpación en el 21% de los casos; 24 tumores (8,4%) recidivaron tras una mediana de 2,2 años. En el grupo de PMMS, se requirieron reextirpación en el 39% de los casos; 10 tumores recidivaron (3,5%) tras una mediana de 2,8 años. Las tasas de recidiva diferían significativamente entre ambos grupos. |
| Khaddaj et al.28 | 2021 | 407 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | Tasa de recurrencia del 0,3%, seguimiento medio de 36,3 meses. |
| Kofler et al.23 | 2021 | 5,985 | Estudio retrospectivo con todos los tumores analizados con PMMS.Unicéntrico.Técnica de Tübingen. | 0,9% de recidivas (1,7%) en CBC esclerodermiforme). Seguimiento medio de 4 años. |
| Lacerda et al.35 | 2022 | 10,424 | Se incluyeron RS y MA con dieciocho estudios, dos ECA y dieciséis estudios observacionales.Técnicas de Munich, de Tübingen y del Muffin. | Recurrencia global del 3,0% con MMS; 3,0% con la técnica de Munich; 1% con la técnica de Tübingen y 0% con la técnica del Muffin. |
Abreviaturas: CBC: carcinoma basocelular; MMS: cirugía micrográfica de Mohs; PMMS: cirugía controlada microscópicamente de Mohs embebida en parafina; ECA: ensayo clínico aleatorizado; ELA: escisión local amplia; RS: revisión sistemática; MA: metaanálisis.
En general, el pronóstico del CEC es bueno, y el tratamiento quirúrgico se considera la norma asistencial36. Sin embargo, entre el 1% y el 5% de los pacientes experimentan un curso clínico más agresivo, especialmente si se añaden características de alto riesgo. La MMS se ha utilizado con éxito en varias series de pacientes y parece ser la técnica de elección por delante de la PMMS. Sin embargo, la MMS puede asociarse a dificultades en el momento de procesar la pieza37,38. Nuestra búsqueda encontró 9 estudios de PMMS en el manejo del CEC en la literatura médica científica, 7 estudios retrospectivos19,23,28,39-42 y 2 estudios prospectivos27,43 (tabla 4). En el primer estudio de PMMS sobre el CEC, Breuninger et al. describieron una tasa de recurrencia del 1,3% con una mediana de seguimiento de 3 años.19 Estudios posteriores confirmaron estos resultados19,23,27,28,39-43.
Cirugía controlada microscópicamente embebida en parafina en el carcinoma escamoso cutáneo
| Autores | Año | n | Descripción | Resultados |
|---|---|---|---|---|
| Breuninger et al.19 | 1988 | 147 | Estudio retrospectivo Institución única.Técnica de Tübingen. | 2 recidivas locales durante el periodo de seguimiento.Periodo de seguimiento medio de 3 años. |
| Turner et al.39 | 2000 | 61 | Estudio retrospectivo.Unicéntrico.Técnica del Muffin. | 5/61 (8,2%) experimentaron recidivas con una mediana de 4 años de seguimiento, 3 locorregionales y 2 a distancia. |
| Thomas et al.40,* | 2007 | 85a | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | Tasa de recidiva local del 6% durante un periodo de seguimiento medio de 45 meses. |
| Häfner et al.27 | 2011 | 615 | Estudio prospectivo.Unicéntrico.Técnica de Tübingen. | 20 recidivas locales (3%).Seguimiento medio de 2,2 años. |
| Domínguez-Cherit et al.41 | 2017 | 114 | Estudio prospectivo.Unicéntrico.Técnica no especificada. | Recurrencias (definidas como <6 meses desde el primario) en 2,2% y segundos tumores (>6 meses desde el primario) 12,28%.Seguimiento medio de 10 años. |
| Delgado-Jiménez et al.43 | 2018 | 181a | Estudio prospectivo.Multicéntrico.Diferentes técnicas de PMMS. | 8/181 (4,42%) presentaron recidiva durante una mediana de seguimiento de 0,9 años. |
| Khaddaj et al.28 | 2021 | 42 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | Tasa de recurrencia del 3,5%, seguimiento medio de 36,3 meses (seguimiento medio de 5 años). |
| Warnig et al.42 | 2021 | 1296Sólo región de cabeza y cuello | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | Ningún dato de recidiva. R0 en el primer estadio en el 81% de los casos.Mayoría de R1 después del primer estadio en nariz y oído. |
| Kofler et al.23 | 2021 | 2693 | Estudio retrospective.Unicéntrico.Técnica de Tübingen. | 5,4% de recidivas (26,3% en desmoplásicos).Seguimiento medio de 4 años. |
Abreviaturas: MMS, cirugía micrográfica de Mohs; PMMS, cirugía microscópica de Mohs embebida en parafina.
La MMS se ha utilizado con frecuencia para el LM, el LMM y el melanoma lentiginoso acral (MLA). En muchas ocasiones, su uso requiere inmunohistoquímica, bien con secciones congeladas (MMS) o en parafina (PMMS)44,45. Hemos encontrado 30 estudios con PMMS en melanoma (tabla 5), 24 estudios retrospectivos7,19,23,28,45-64, 3 estudios prospectivos65-67, 1 RS68, y 2 RS con MA8,69. El primer estudio significativo data de 1988, cuando Breuninger et al.19 no encontraron recurrencias en 21 pacientes con LM. Posteriormente, numerosos estudios con mayor número de pacientes ratificaron estos resultados7,8,13,23,28,45-62,64-66,68,69. En 2006, Moehrle et al. describieron menores tasas de recurrencia y muerte relacionadas con el LMM en pacientes tratados con PMMS frente a la cirugía convencional66. El estudio con la muestra más amplia hasta la fecha (Hanson et al.) (50,397 casos) demostró una mayor supervivencia en pacientes tratados con PMMS frente a escisión local amplia (ELA)7. Estos resultados también se han publicado recientemente en casos de MLA61. Una RS y un MA recientes con >100 estudios y 13,998 melanomas cutáneos de cabeza y cuello hallaron tasas de recurrencia ligeramente superiores en pacientes con PMMS frente a MMS68.
Cirugía controlada microscópicamente embebida en parafina en el melanoma y en el lentigo Maligno
| Autores | Año | n | Descripción | Resultados |
|---|---|---|---|---|
| Breuninger et al.19 | 1988 | 21 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | No hubo recidivas durante un periodo medio de seguimiento de 3 años. |
| Cohen et al.49 | 1994 | 45 (incluye tanto LM como LMM) | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | Los 45 pacientes estaban libres de enfermedad local y de evidencia de metástasis una media de 29,2 meses después del tratamiento. |
| Cohen et al.50 | 1998 | 45 (incluye tanto LM como LMM) | Estudioretrospectivo.Unicéntrico.Técnica de Tübingen. | Tras una mediana de seguimiento de 58,0 meses hubo una recidiva (<1%). |
| Clayton et al.63 | 2000 | 100 (77 LMs y 100 LMMs) | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | 3 recidivas (3%) durante el periodo de seguimiento (tiempo no especificado). |
| Malhotra et al.65 | 2003 | 141 (ambos LMs o LMMs) | Estudio prospectivo.Unicéntrico.Técnica del foso o perimetral. | 4% de recidivas durante una mediana de seguimiento de 32 meses. |
| Bub et al.51 | 2004 | 62 (55 LMs y 7 LMMs) | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | Tras un seguimiento medio de 57 meses, el 95% de los pacientes estaban libres de recidiva. Tres pacientes presentaron recidiva local y ningún paciente tenía indicios de metástasis. |
| Mahoney et al.47 | 2005 | 11 (solo LMs) | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | No se observaron recidivas durante un seguimiento medio de 4,7 meses. |
| Moehrle et al.66 | 2006 | 292 LMMs (136 analizados con PMMS y 156 con histología convencional) | Estudio prospectivo.Unicéntrico.Técnica del foso o perimetral. | Tasas más elevadas de recidiva y muerte relacionadas con el melanoma en el grupo con histología convencional. |
| Walling et al.52 | 2007 | 59 (50 LMs y 9 LMMs) | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | 3 recidivas (7,3%) en PMMS frente a 6 recidivas (33%) en el grupo MMS (p<0,025), con un seguimiento medio de 95 meses y 117,5 meses, respectivamente. |
| Moller et al.64 | 2009 | 49 (todos LMs) | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | No hubo recidivas durante el periodo de seguimiento (14,3 meses). |
| Then et al.53 | 2009 | 14 (todos LMs)Sólo melanoma periocular | Estudio retrospectivo.Multicéntrico.Técnica del foso o perimetral. | Tras una mediana de seguimiento de 36 meses, hubo dos recidivas locales (14,3%). |
| Licthe et al.45 | 2009 | 241 (143 pacientes con PMMS y 98 con histología convencional)Sólo MLAs | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | Los pacientes con PMMS tuvieron una supervivencia a 5 años del 81% en comparación con el 63% con histología convencional. |
| Gaudy-Marqueste et al.48 | 2011 | 21 (16 LMs y 5 MLAs) | Estudio retrospectivo.Único centro.Técnica del espagueti. | Tras una mediana de seguimiento de 25,36 meses, la tasa de control local fue del 95,24%, con un caso (4,76%) con recidiva invasora en tránsito. |
| Hilari et al.54 | 2012 | 45 (todos eran LMs) | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | 2 recidivas (4,44%) durante el periodo de seguimiento (no especificado). |
| Abdelmalek et al.55 | 2012 | 293 (225 LMs y 68 LMMs) | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | La tasa de recidiva fue del 1,7% con un seguimiento medio de 32,3 meses. |
| Kassi et al.56 | 2014 | 31 (16 MIS y 15 MI) | Estudio retrospectivo.Unicéntrico.Técnica del espagueti. | Un solo paciente (3%) experimentó una recidiva durante un seguimiento medio de 31 meses. |
| Lawrence et al.67 | 2014 | 74 (todos con LMs) | Estudio prospectivo.Unicéntrico.Técnica del foso o perimetral. | 7/74 (12%) recidivas durante un seguimiento de 5 años. |
| Patel et al.57 | 2014 | 21 (18 LMs y 3 LMMs) | Estudio retrospectivo.Unicéntrico.Procedimiento cuadrangular. | 1 recidiva (1,9%) durante el periodo de seguimiento (entre 0 y 5 años). |
| de Vries et al.58 | 2016 | 100 (todos LMs) | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | Tras un seguimiento medio de 60 meses, 4 pacientes (2,5%) presentaron una recidiva. |
| García et al.59 | 2017 | 39 (todos MIS) | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | No se observaron recidivas durante un seguimiento medio de 31,5 meses. |
| Stanciu et al.60 | 2020 | 5 (todos LMs) | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | Ninguna recidiva durante el periodo de seguimiento (entre 1 y 5 años). |
| Surmanowicz et al.46 | 2021 | 5 (todos LMs) | Estudio retrospectivo.Unicéntrico.Técnica del Muffin. | Ninguna recidiva durante un seguimiento medio de 40 meses. |
| Hanson et al.7 | 2021 | 50,397 casos de melanoma de cabeza y cuello (todos los tipos):- 3510 (7%) se trataron con PMMS- 46,887 (93%) con ELA | Estudio retrospectivo.Multicéntrico (base de datos nacional).Técnica no especificada. | Los pacientes tratados con MMS tenían más probabilidades que los tratados con ELA de sobrevivir después de 5 años (hazard ratio [HR] 1,181; intervalo de confianza [IC] del 95%: 1,083-1,288; P<,001). |
| Khaddaj et al.28 | 2021 | 45 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | Ninguna recurrencia durante 36,3 meses de seguimiento. |
| Kofler et al.23 | 2021 | 460 (219 LMMs, 192 MLAs y 49 melanoma desmoplásico) | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | 5,7% de recidivas con una media de seguimiento de 4 años: 2,9% en los LMM, 4,2% en los MLA y 22,4% en el melanoma desmoplásico. |
| Seo et al.61 | 2021 | 210 pacientes, todos MLA66 tratados con PMMS y 144, con ELA | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | La recidiva local de los MLA se produjo en el 3,7% de los pacientes después de la PMMS y en el 10,7% de los pacientes después de la ELA. Seguimiento medio ≥3 años. |
| Bittar et al.68 | 2021 | 13,99851,0% (7138) tratados mediante ELA, 34,5% (4826) con MMS, y 14,5% (2034) con PMMS | RSTodas las técnicas. | Las tasas de recurrencia local más bajas correspondieron a la MMS (0,61%; IC 95%, 0,1%-1,4%), seguida de la PMMS (1,8%; IC 95%, 1,0%-2,9%) y la ELA (7,8%; IC 95%, 6,4%-9,3%). |
| Pride et al.69 | 2022 | 71 estudios incluídos (16,575 pacientes). Todos los tipos de melanoma incluídos | RS y MA.Todas las técnicas. | La recidiva local del melanoma fue significativamente menor tras la MMS (1%) y la PMMS (3%), en comparación con la ELA (7%). |
| Bladen et al.62 | 2023 | 22 (todos los casos de MIS)Localización palpebral | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | La recidiva local fue del 36%; seis invasivas (27%) a una media de 24 meses (intervalo de 1,5-5 años), y dos para la MIS a una media de 15 meses (intervalo de 1-1,5 años). |
| Elshot et al.8 | 2023 | 380 MMS, 1920 Mohs con inmunohistoquímica, 229 PMMS | RS y MA sobre técnicas quirúrgicas y mapeo prequirúrgico por microscop-a confocal de reflectancia en LM.Todas las técnicas de PMMS. | Recurrencia local global del 1,3%.2,7% con MMS; 0,6% con MMS combinada con inmunohistoquímica; 7,9% con PMMS; y 13% con ELA.Seguimiento medio de 27, 67, 33 y 57 meses, respectivamente. |
Abreviaturas: MMS: cirugía micrográfica de Mohs; PMMS: cirugía controlada microscópicamente de Mohs embebida en parafina; LM: lentigo maligno; LMM: lentigo maligno melanoma; MLA: melanoma lentiginoso acral; MIS: melanoma in situ; MI: melanoma invasivo; DE: desviación estándar; ELA: escisión local amplia.
En términos de menor recurrencia, la MMS ha demostrado ser superior a la ELA en el tratamiento del dermatofibrosarcoma protuberans (DFSP)70. De hecho, las directrices de la National Comprehensive Cancer Network recomiendan ahora la MMS como abordaje preferente en el DFSP. Al igual que ocurre con el LM, el LMM y el MLA, debido a la dificultad de estudiarlos en secciones congeladas, generalmente se utiliza la PMMS en el DFSP. Encontramos 14 estudios de PMMS para DFSP, 12 estudios retrospectivos23,28,40,71-78 y 2 estudios prospectivos79,80 (tabla 6).
Cirugía microscópica controlada en parafina en dermatofibrosarcoma protuberans
| Autores | Año | n | Descripción | Resultados |
|---|---|---|---|---|
| Wacker et al.73 | 2004 | 22 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | Durante el periodo de seguimiento (media de 54 meses), no se detectaron recidivas. |
| Thomas et al.*,40 | 2007 | 35 | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | Ninguna recidiva local durante un seguimiento medio de 39 meses. |
| Paradisi et al.74 | 2008 | 79(38 ELA y 41 PMMS) | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | 5/38 de los pacientes con ELA (seguimiento de 4,8 años) presentaron recidivas (13,2%) frente a ninguno de los 41 pacientes con PMMS (seguimiento de 5,4 años). |
| Häfner et al.80 | 2008 | 70(54 primarios y 16 tumores recurrentes) | Estudio prospectivo.Unicéntrico.Técnica de Tübingen. | 1,8% de recidivas durante el periodo de seguimiento (60 meses). |
| Hancox et al.75 | 2008 | 25(15 primarios y 10 tumores recurrentes) | Estudio retrospectivo.Único centro.Técnica de Tübingen. | Ninguna recidiva evidente durante el periodo de seguimiento (media de 102 meses). |
| Tan et al.76 | 2011 | 35 | Estudio retrospectivo.Único centro.Técnica de Tübingen. | No se evidenciaron recidivas durante el periodo de seguimiento (media de 30 meses). |
| Veronese et al.77 | 2017 | 135(62 PMMS y 73 ELA) | Estudio retrospectivo.Multicéntrico.Técnica de Tübingen. | En el grupo de ELA, el 8,1% experimentó recidivas (seguimiento medio de 4,7 años) frente al 5,5% en el grupo de PMMS (seguimiento medio de 9 años). |
| Lee et al.71 | 2018 | 71 pacientes (30 MMS y 41 PMMS) | Estudio retrospectivo.Único centro.Técnica no especificada. | La tasa de recidiva local del grupo MMS (3,3%) fue inferior a la del grupo PMMS (7,3%), pero no estadísticamente significativa. |
| Cammarata et al.78 | 2020 | 17 | Estudio retrospectivo.Único centro.Técnica de Tübingen. | No se observaron recidivas ni metástasis en ninguno de los pacientes tras una mediana de seguimiento de 38 meses. |
| Khaddaj et al.28 | 2021 | 25 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | Ninguna recidiva durante el periodo de seguimiento (mediana de 36,3 meses). |
| Kofler et al.23 | 2021 | 113 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | 12,8% de recidivas durante una media de 4 años de seguimiento. |
| González et al.72 | 2021 | 103 | Estudio retrospectivo.Multicéntrico.Técnica del Muffin. | Durante un seguimiento medio de 92,6 meses, la recidiva local fue del 2,4%. |
| Nieto et al.79 | 2021 | 163(51 MMS y 112 PMMS) | Estudio prospectivo.Multicéntrico.Todas las técnicas de PMMS. | 3,9% de recidivas en el grupo de MMS frente a 1,79% en el grupo PMMS. Mediana de seguimiento de ≥3 años. |
| Shijing et al.101 | 2023 | 7567 | Estudio retrospectivo.Multicéntrico.Técnica no especificada.MMS y PMMS. | Los pacientes sometidos a MMS o PMMS tuvieron un mejor pronóstico de supervivencia global que los demás tratamientos. No se observaron diferencias significativas en la supervivencia específica del cáncer. |
Abreviaturas: MMS: cirugía micrográfica de Mohs; PMMS, cirugía controlada microscópicamente embebida en parafina.
La MMS ha demostrado disminuir la tasa de recidiva frente a la ELA en el manejo del FXA y (aunque menos definido en la literatura) en el manejo del sarcoma dérmico pleomórfico (SDP), tumores con características y pronósticos diferentes, pero muy probablemente dentro del mismo espectro4,81. Pocas series amplias (>5 pacientes) han investigado la PMMS con estas neoplasias (tabla 7). Nuestra búsqueda encontró 3 estudios retrospectivos23,81,82 y 1 estudio prospectivo14. En estos estudios, se encontraron tasas bajas de recurrencia para el FXA, pero fueron más altas para el SDP14,23,81,82.
Cirugía controlada microscópicamente embebida en parafina en tumores infrecuentes
| Tumor | Autores | Año | n | Descripción | Resultados |
|---|---|---|---|---|---|
| FXA | Wylie et al.82 | 2010 | 16 | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | 1 paciente (6,25%) experimentó una recidiva durante el periodo de seguimiento (no especificada). |
| FXA y SDP | Rodríguez-Jiménez et al.14 | 2020 | 18* | Estudio prospectivo de cohortes en España.Multicéntrico.Todas las técnicas de PMMS. | Sin evidencia de recurrencias durante el periodo de seguimiento (mediana de 0,9 años). |
| SDP | Ríos-Viñuela et al.81 | 2020 | 16 | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | En comparación con las tasas de recurrencia del 31% con cirugía convencional en SDP, la PMMS presentó alrededor del 17%. |
| Kofler et al.23 | 2021 | 43 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | 20,9% de recurrencias durante una media de seguimiento de 4 años. | |
| CCM | Thomas et al.*40 | 2007 | 3 | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | Ninguna recidiva durante el período de seguimiento (media de 21,3 meses). |
| Herbert et al.85 | 2014 | 21* | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | La tasa de recidiva local fue del 10%, la tasa de recidiva ganglionar regional fue del 10% y la tasa de metástasis fue del 19%. | |
| Kline et al.86 | 2016 | 22 | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | La tasa global de recidiva local fue del 4,5% (1/22). | |
| Rodríguez-Jiménez et al.14 | 2020 | 5 | Estudio prospectivo de cohortes en España.Multicéntrico.Todas las técnicas de PMMS. | 3/5 (60%) recurrieron con una mediana de seguimiento de 0,9 años. | |
| Kofler et al.23 | 2021 | 25 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | 24% de recidivas durante un seguimiento de 4 años. | |
| Enfermedad de Paget extramamaria | Hendi et al.89 | 2003 | 27* | Estudio retrospectivo.Unicéntrico.Técnica del foso o perimetral. | La tasa de recurrencia fue del 16% para la enfermedad primaria y del 50% para la enfermedad recurrente. Las tasas libres de tumor a 5 años fueron del 80% para los tumores primarios y del 56% para los tumores recurrentes. |
| Thomas et al.*,40 | 2007 | 10 | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | Ninguna recidiva durante el seguimiento (34 meses). | |
| Rodríguez-Jiménez et al.14 | 2020 | 7† | Estudio prospectivo de cohortes en España.Multicéntrico.Todas las técnicas de PMMS. | Ninguna recidiva durante una mediana de seguimiento de 0,9 años. | |
| Kofler et al.23 | 2021 | 25 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | 28% de recidivas durante un seguimiento de 4 años. | |
| Carcinoma anexial microquístico | Thomas et al.*,40 | 2007 | 25 | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | Tasa de recidiva local del 12% durante un seguimiento medio de 39 meses. |
| Palamaras et al.90 | 2010 | 10 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | 10% de recidivas (período de seguimiento no especificado). | |
| Rodríguez-Jiménez et al.14 | 2020 | 10 | Estudio prospectivo de cohortes en España.Multicéntrico.Todas las técnicas de PMMS. | 1/10 (10%) recurrencias durante una mediana de seguimiento de 0,9 años. | |
| Kofler et al.23 | 2021 | 4 | Estudio retrospectivo.Unicéntrico.Técnica de Tübingen. | 50% de recurrencias durante un seguimiento medio de 4 años. | |
| Carcinoma sebáceo | Yount et al.102 | 1994 | 6 | Retrospectivo comparando MMS vs PMMS.Único centro.Técnica de Tübingen. | Diagnóstico correcto con MMS sólo en el 50% frente a PMMS.Una recidiva con enfermedad metastásica en el grupo MMS, 0 en el grupo PMMS durante un periodo de seguimiento de 56,8 meses. |
| Callahan et al.92 | 2004 | 9* | Retrospectivo. Comparación entre PMMS y ELA.Unicéntrico.Técnica no especificada. | Durante un seguimiento medio de 57 meses, dos pacientes (14%) presentaron recidiva local tras la ELA, y 1 paciente (7%), recidiva tumoral tras la PMMS. | |
| Thomas et al.40 | 2007 | 3* | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | No hubo recidivas durante el periodo de seguimiento (no especificado). | |
| While et al.91 | 2014 | 17 | Estudio retrospectivo.Unicéntrico.Técnica no especificada. | 3 recidivas (17,65%) durante un seguimiento medio de 5 años, una de las cuales falleció por enfermedad diseminada. | |
| Rodríguez-Jiménez et al.14 | 2020 | 3a | Estudio prospectivo de cohortes en España.Multicéntrico.Todas las técnicas de PMMS. | Ninguna recidiva durante el periodo de seguimiento (mediana de 0,9 años). | |
Abreviaturas: MMS, cirugía micrográfica de Mohs; PMMS, cirugía controlada microscópicamente embebida en parafina; FXA, fibroxantoma atípico; SDP, sarcoma dérmico pleomórfico.
El carcinoma de células de Merkel (CCM) es uno de los tumores más agresivos en la dermato-oncología. Existen pocos estudios que evalúen la MMS para este tumor. Estudios recientes han estudiado la no inferioridad de la MMS sobre la ELA, sin embargo, los pacientes tratados con MMS tuvieron una menor probabilidad de ser sometidos a una biopsia de ganglio centinela83,84. Encontramos 5 estudios sobre la PMMS en el CCM: 4 estudios retrospectivos23,85-87 y 1 estudio prospectivo14. Se resumen en la tabla 714,23,40,85,86. La serie con mayor número de pacientes (n=22) tratados con PMMS informó de una tasa de recurrencia <5%86.
Enfermedad de Paget extramamariaLa enfermedad de Paget extramamaria tiende a extenderse intraepidérmicamente con múltiples focos clínicamente mal definidos. Recientemente se han demostrado tasas más bajas de recurrencia con la MMS88. Encontramos 4 estudios de PMMS en la enfermedad de Paget extramamaria (Tabla 7): 3 estudios retrospectivos23,40,89 y 1 estudio prospectivo14. El estudio con la muestra más grande (n=25)23 mostró una tasa de recurrencia del 28% durante un seguimiento medio de 4 años.
Carcinoma anexial microquísticoEl carcinoma anexial microquístico es un tumor muy poco frecuente con capacidad invasiva local e incluso a distancia. Nuestra búsqueda encontró 4 estudios sobre la PMMS para tratar el carcinoma anexial microquístico: 3 estudios retrospectivos23,40,90 y 1 estudio prospectivo14. No hay estudios que comparen la MMS con la PMMS. En el grupo de la PMMS, las series de datos informan de tasas de recurrencia entre el 0% y el 30% en un seguimiento de casi 5 años (tabla 7).
Carcinoma sebáceoLos estudios sobre la MMS en el carcinoma sebáceo son escasos. Estudios recientes han mostrado una menor tasa de recidiva, pero sin mejora de la supervivencia, a los 5 y 10 años con MMS. Nuestra búsqueda dio como resultado 5 estudios sobre la PMMS en el carcinoma sebáceo: 4 estudios retrospectivos34,40,91,92 y 1 estudio prospectivo14. El estudio con el mayor tamaño muestral (n=17) informó de 3 recidivas (17,65%) en un seguimiento medio de 5 años91 (tabla 7).
DiscusiónLa MMS es una variante de tratamiento eficaz para numerosas neoplasias cutáneas. Ha alcanzado una superioridad significativa frente a la ELA para tratar el cáncer cutáneo no melanoma recurrente y de alto riesgo93. Sin embargo, es necesario superar múltiples dificultades para realizar la MMS, y la PMMS puede ser más fácil de aplicar y presenta ventajas significativas16. Los exámenes histopatológicos pueden diferir al comparar las secciones congeladas frente a las de parafina. En un estudio clásico de 258 muestras analizadas de ambas formas, se observó que el diagnóstico inicial de la biopsia difería de los diagnósticos de Mohs congelado y de la sección de parafina en el 20% de los casos94. Debemos mencionar que, aunque tanto la MMS convencional como la PMMS analizan teóricamente el 100% de los márgenes, en la actualidad, en numerosas ocasiones se observan “falsos negativos” en las secciones congeladas, debido a la menor calidad tisular de estas secciones. Por el contrario, los cortes en parafina suelen ofrecer una mejor calidad tisular, permitiendo analizar pequeños restos tumorales y reduciendo las tasas de falsos negativos16,20,95. En cuanto a su eficacia, la PMMS ha demostrado una menor tasa de recurrencia frente a la MMS en el manejo del CBC en ECR31,33,34. En el caso del CEC, ningún estudio ha comparado la MMS con la PMMS. Sin embargo, un estudio reciente afirmó que en el 27,8% de los CEC reevaluados, que habían sido tratados con MMS y que presentaban márgenes libres, se observó la presencia de restos tumorales tras el estudio con inmunohistoquímica de las secciones, y que no se habían detectado mediante HE. Por lo tanto, la PMMS podría desempeñar un papel fundamental a través de la inmunohistoquímica diferida, y en la detección de patrones atípicos16,94. La PMMS ha mostrado tasas de recidiva que oscilan entre el 3% y el 10% a los 5 años19,23,27,28,39-41,43. Las secciones congeladas de MMS son generalmente insuficientes para analizar los tumores melanocíticos87, y la PMMS ha mostrado tasas más bajas de recidiva en el LM y en LMM frente a la ELA68. En cuanto a la supervivencia, aunque algunos estudios no mostraron una mayor tasa de supervivencia global con MMS y PMMS frente a ELA en el tratamiento del LM y el LMM96, estudios recientes han revelado una mayor supervivencia global en pacientes tratados con PMMS frente a la ELA, especialmente en las localizaciones de cabeza y cuero cabelludo7,97. En cuanto a tumores infrecuentes como el DFSP, se han descrito menores tasas de recurrencia con la PMMS frente a la MMS72. Sin embargo, los datos en casos primarios no encontraron diferencias en la supervivencia global de los pacientes tratados con ELA frente a la PMMS98. En cuanto al CCM, no se ha podido demostrar que la PMMS presente una menor tasa de recurrencia o una mejor supervivencia que la MMS14,23,40,85,86, pero puede permitir la realización de márgenes más estrechos y menos complicaciones funcionales y estéticas. Dada la dificultad del examen in vivo y la posibilidad de fracaso en el análisis de tumores poco frecuentes, la PMMS se ha propuesto como la técnica de elección para la escisión del FXA, el SDP, la enfermedad de Paget extramamaria y el carcinoma sebáceo, entre otros. Sin embargo, la mayoría de los datos encontrados en la literatura aluden a series pequeñas.
En cuanto a las desventajas de la PMMS, destacan la necesidad de realizar varios procedimientos quirúrgicos, así como la posibilidad de causar cambios “arquitectónicos” de la pieza debido a la colocación de los hilos de sutura99. Sin embargo, el cierre inmediato del defecto es posible. Éste puede realizarse mediante injertos de piel o por medio de biomembranas, dejando una cura por segunda intención o mediante el cierre primario, entre otras técnicas que no produzcan distorsiones anatómicas significativas16. En estos casos, se recomienda tomar fotografías del defecto quirúrgico antes y después de la reconstrucción para conseguir una correlación topográfica exacta si se encuentra un margen positivo. En cualquier caso, las reconstrucciones complejas están desaconsejadas hasta que se informe que todos los márgenes están libres de tumor. Aunque la PMMS puede requerir la realización de múltiples intervenciones quirúrgicas en días diferentes, lo que podría aumentar los costes, la disminución de las recidivas frente a otras técnicas y, por tanto, la necesidad de realizar posteriormente grandes cirugías, junto con las complicaciones funcionales y estéticas, podría ser, a largo plazo, más rentable: desde luego se requieren más estudios acerca de la rentabilidad de la PMMS. En la realización de la PMMS es fundamental una comunicación buena y fluida entre el dermatólogo y el patólogo, para evitar largos tiempos de espera que pueden aumentar la ansiedad del paciente a la espera de los resultados histopatológicos. En nuestro hospital contamos con una amplia experiencia en la realización tanto de la MMS como de la PMMS, e incluso en ocasiones combinamos ambas técnicas durante la resección de un tumor complejo o de gran tamaño, o en zonas anatómicas concretas.
Debemos mencionar que en un estudio realizado recientemente no se encontraron complicaciones postoperatorias importantes con la PMMS frente a la MMS100.
LimitacionesLa presente revisión bibliográfica está limitada por el hecho de que se trata de una revisión narrativa y no de una RS de la literatura médica científica disponible en la actualidad, ni de un MA. Asimismo, muchos de los estudios incluidos tienen muestras de pequeño o mediano tamaño, un diseño retrospectivo, metodologías heterogéneas o utilizan técnicas quirúrgicas diferentes. Además, la terminología de MMS vs PMMS es, en ocasiones, controvertida en la literatura, solapándose ambos términos en numerosos artículos. Estos factores dificultan la extrapolación o generalización de nuestros hallazgos.
ConclusionesLa resección completa con márgenes quirúrgicos libres es la regla de oro en el tratamiento del cáncer de piel. La PMMS requiere una formación mínima para el cirujano dermatológico, el técnico de patología y el patólogo. La PMMS tampoco requiere equipamiento especial, y puede ser muy útil y eficaz para tratar diversas neoplasias cutáneas, tanto tumores frecuentes como el CBC, el CEC o el LMM, así como neoplasias raras como DFSP o FXA, entre otras. Las técnicas de la PMMS permiten además un mejor análisis de los restos tumorales que la MMS y podrían reducir la tasa de falsos negativos. Queremos destacar que puede adoptarse incluso en pequeños hospitales o clínicas y reducir significativamente el riesgo de resección tumoral incompleta, y/o recidiva local.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos agradecer a Elena Morgado las imágenes facilitadas para este artículo.