La tricoscopia es una herramienta esencial en el examen de las alopecias. La semiología elaborada durante las últimas décadas ha contribuido a la comprensión patogénica y al diagnóstico diferencial entre las distintas formas de alopecia. Todos los signos tricoscópicos tienen su base en la patogenia de la alopecia examinada. En el presente artículo, examinamos la correlación entre los principales hallazgos tricoscópicos de las alopecias no cicatriciales y la base histopatológica que sustenta esos signos tricoscópicos.
Trichoscopy is an essential tool in the evaluation of alopecia. The current compilation of trichoscopic signs in this setting helps distinguish between different forms of hair loss and has improved our understanding of the pathogenic mechanisms involved. The trichoscopic signs are always linked to the pathogenic mechanisms of the alopecia being examined. We examine correlations between the main trichoscopic and histopathologic findings in nonscarring alopecias.
La tricoscopia es una herramienta muy útil en la evaluación de los distintos tipos de alopecia. La semiología tricroscópica refleja los cambios microscópicos del folículo piloso en relación con alteraciones de la dermis y epidermis perifolicular. Por ello, el conocimiento de estos últimos facilita la comprensión de los primeros, así como el entendimiento de la patogenia de la enfermedad y el diagnóstico diferencial con otras formas de alopecia.
En este artículo abordamos la correlación entre la histopatología de los principales tipos de alopecias no cicatriciales y los signos tricoscópicos más destacados en la literatura (tabla 1). Todas las imágenes (clínicas e histopatológicas) pertenecen a casuística nuestra y se han obtenido los correspondientes permisos.
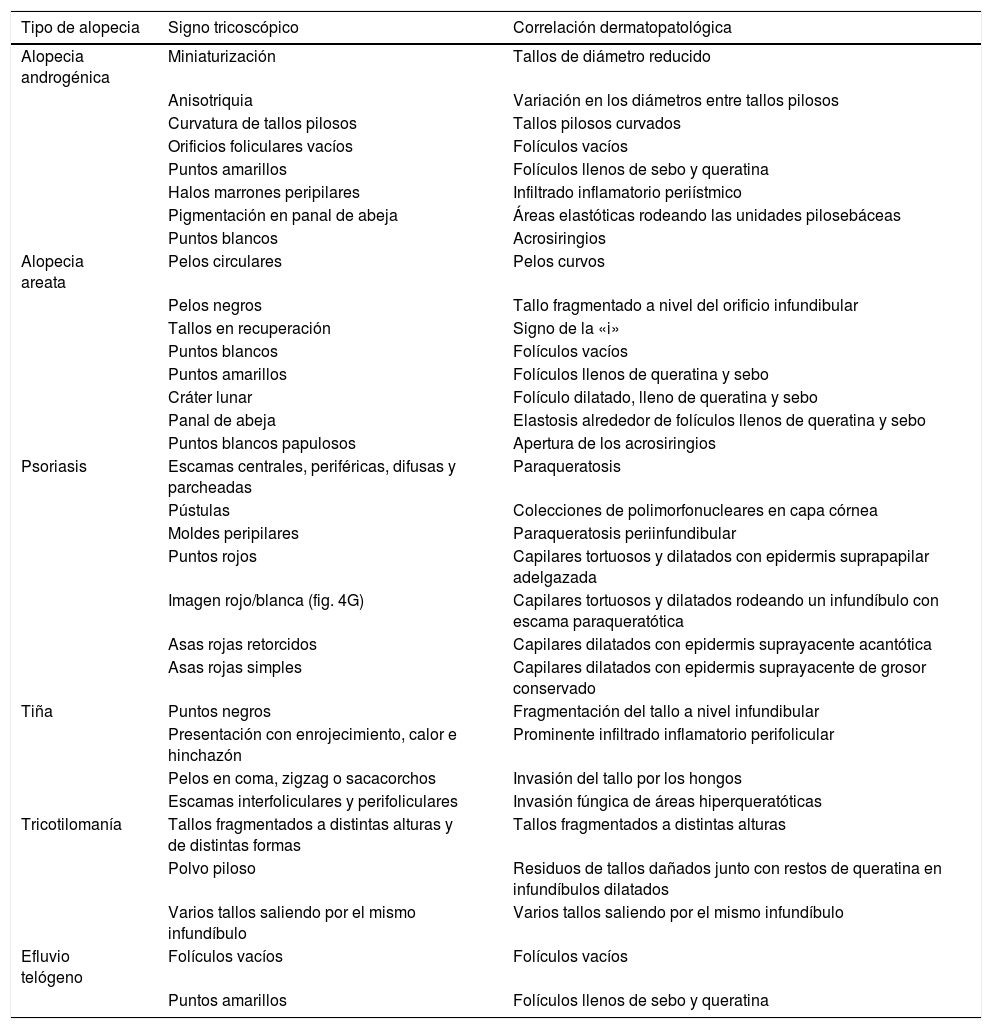
Correlación entre los principales signos tricoscópicos de las alopecias no cicatriciales y los hallazgos histopatológicos correspondientes
| Tipo de alopecia | Signo tricoscópico | Correlación dermatopatológica |
|---|---|---|
| Alopecia androgénica | Miniaturización | Tallos de diámetro reducido |
| Anisotriquia | Variación en los diámetros entre tallos pilosos | |
| Curvatura de tallos pilosos | Tallos pilosos curvados | |
| Orificios foliculares vacíos | Folículos vacíos | |
| Puntos amarillos | Folículos llenos de sebo y queratina | |
| Halos marrones peripilares | Infiltrado inflamatorio periístmico | |
| Pigmentación en panal de abeja | Áreas elastóticas rodeando las unidades pilosebáceas | |
| Puntos blancos | Acrosiringios | |
| Alopecia areata | Pelos circulares | Pelos curvos |
| Pelos negros | Tallo fragmentado a nivel del orificio infundibular | |
| Tallos en recuperación | Signo de la «i» | |
| Puntos blancos | Folículos vacíos | |
| Puntos amarillos | Folículos llenos de queratina y sebo | |
| Cráter lunar | Folículo dilatado, lleno de queratina y sebo | |
| Panal de abeja | Elastosis alrededor de folículos llenos de queratina y sebo | |
| Puntos blancos papulosos | Apertura de los acrosiringios | |
| Psoriasis | Escamas centrales, periféricas, difusas y parcheadas | Paraqueratosis |
| Pústulas | Colecciones de polimorfonucleares en capa córnea | |
| Moldes peripilares | Paraqueratosis periinfundibular | |
| Puntos rojos | Capilares tortuosos y dilatados con epidermis suprapapilar adelgazada | |
| Imagen rojo/blanca (fig. 4G) | Capilares tortuosos y dilatados rodeando un infundíbulo con escama paraqueratótica | |
| Asas rojas retorcidos | Capilares dilatados con epidermis suprayacente acantótica | |
| Asas rojas simples | Capilares dilatados con epidermis suprayacente de grosor conservado | |
| Tiña | Puntos negros | Fragmentación del tallo a nivel infundibular |
| Presentación con enrojecimiento, calor e hinchazón | Prominente infiltrado inflamatorio perifolicular | |
| Pelos en coma, zigzag o sacacorchos | Invasión del tallo por los hongos | |
| Escamas interfoliculares y perifoliculares | Invasión fúngica de áreas hiperqueratóticas | |
| Tricotilomanía | Tallos fragmentados a distintas alturas y de distintas formas | Tallos fragmentados a distintas alturas |
| Polvo piloso | Residuos de tallos dañados junto con restos de queratina en infundíbulos dilatados | |
| Varios tallos saliendo por el mismo infundíbulo | Varios tallos saliendo por el mismo infundíbulo | |
| Efluvio telógeno | Folículos vacíos | Folículos vacíos |
| Puntos amarillos | Folículos llenos de sebo y queratina |
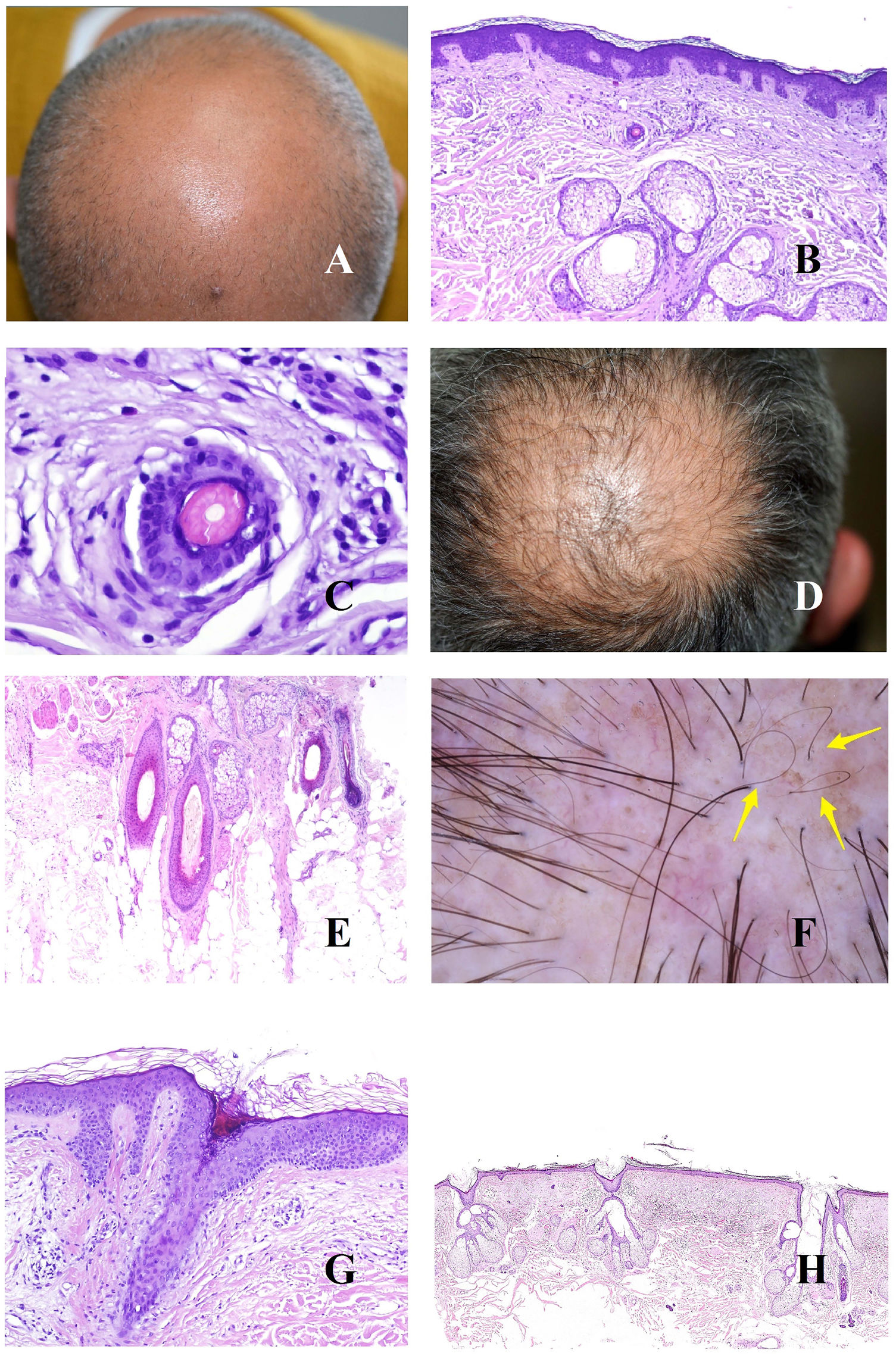
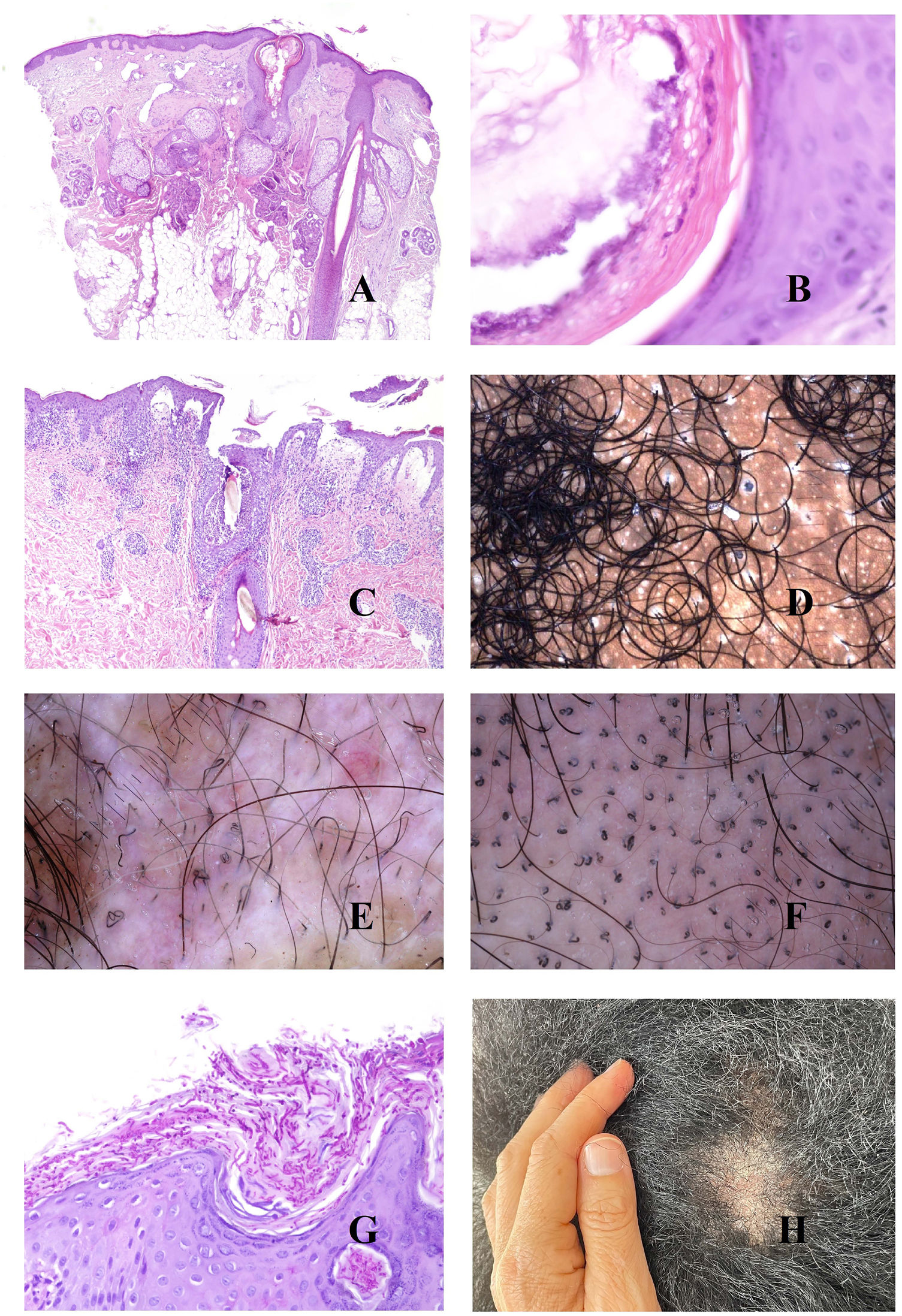
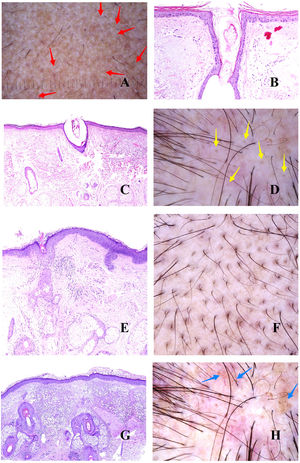
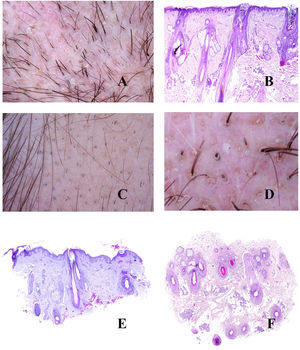
La base patogénica de la alopecia androgénica es un acortamiento del ciclo del folículo piloso1, con incremento de los folículos vellosos, y alteración de la ratio terminal/velloso, que se vuelve en muchos casos inferior a 4/1. Una ratio inferior a 3/1 se considera diagnóstica2. La miniaturización es evidente en la tricoscopia (fig. 1A), pero también en la biopsia, donde los tallos presentan un grosor inferior al de la vaina radicular interna (fig. 1B y C).
A: Alopecia androgénica. Numerosos tallos miniaturizados. B: Alopecia androgénica mostrando un folículo piloso miniaturizado en la parte alta de la dermis. En comparación, las gándulas sebáceas parecen tener un gran tamaño, a pesar de ser de morfología normal (hematoxilina-eosina ×40). C: Un detalle del folículo miniaturizado muestra el tallo piloso con un grosor menos que el de la vaina radicular interna (hematoxilina-eosina ×400). D: Alopecia androgénica. Anisotriquia, con gran variabilidad entre los diámetros de los tallos. E: Alopecia androgénica. Aunque la anisotriquia no puede ser fácilmente evaluada en la biopsia, la variabilidad entre el diámetro de los tallos a veces se ve incluso en biopsias pequeñas (hematoxilina-eosina ×40). F: Alopecia androgénica. Ocasionales pelos circulares. G: Alopecia androgénica. Los pelos circulares suelen estar por encima de la epidermis en la mayoría de los casos (hematoxilina-eosina ×40). H: Alopecia androgénica. Abundancia de folículos pilosos vacíos, sin tallo (hematoxilina-eosina ×20).
La abundancia de folículos vellosos también es la base de uno de los signos precoces de la alopecia androgénica: la anisotriquia3, definida como una variación de los diámetros de los tallos pilosos superior al 20% en varones y al 10% en mujeres (fig. 1D). Aunque, obviamente, la anisotriquia no se puede valorar en una biopsia, sí que observamos la coexistencia de tallos de distintos diámetros (fig. 1E).
Los tallos de los folículos vellosos, al ser débiles y delgados, se curvan con facilidad (fig. 1F). Estos suelen estar por encima de la epidermis (fig. 1G), pero en ocasiones pueden quedar atrapados bajo ella4.
Además de los folículos vellosos, se verán orificios foliculares vacíos, sin tallo piloso (fig. 1H), fácilmente identificables también en la tricoscopia5 (fig. 2A). En ocasiones, sin embargo, los orificios foliculares aparecen llenos de otros materiales, como sebo y queratina (fig. 2B y C), viéndose en la tricoscopia como puntos amarillos (fig. 2D)3.
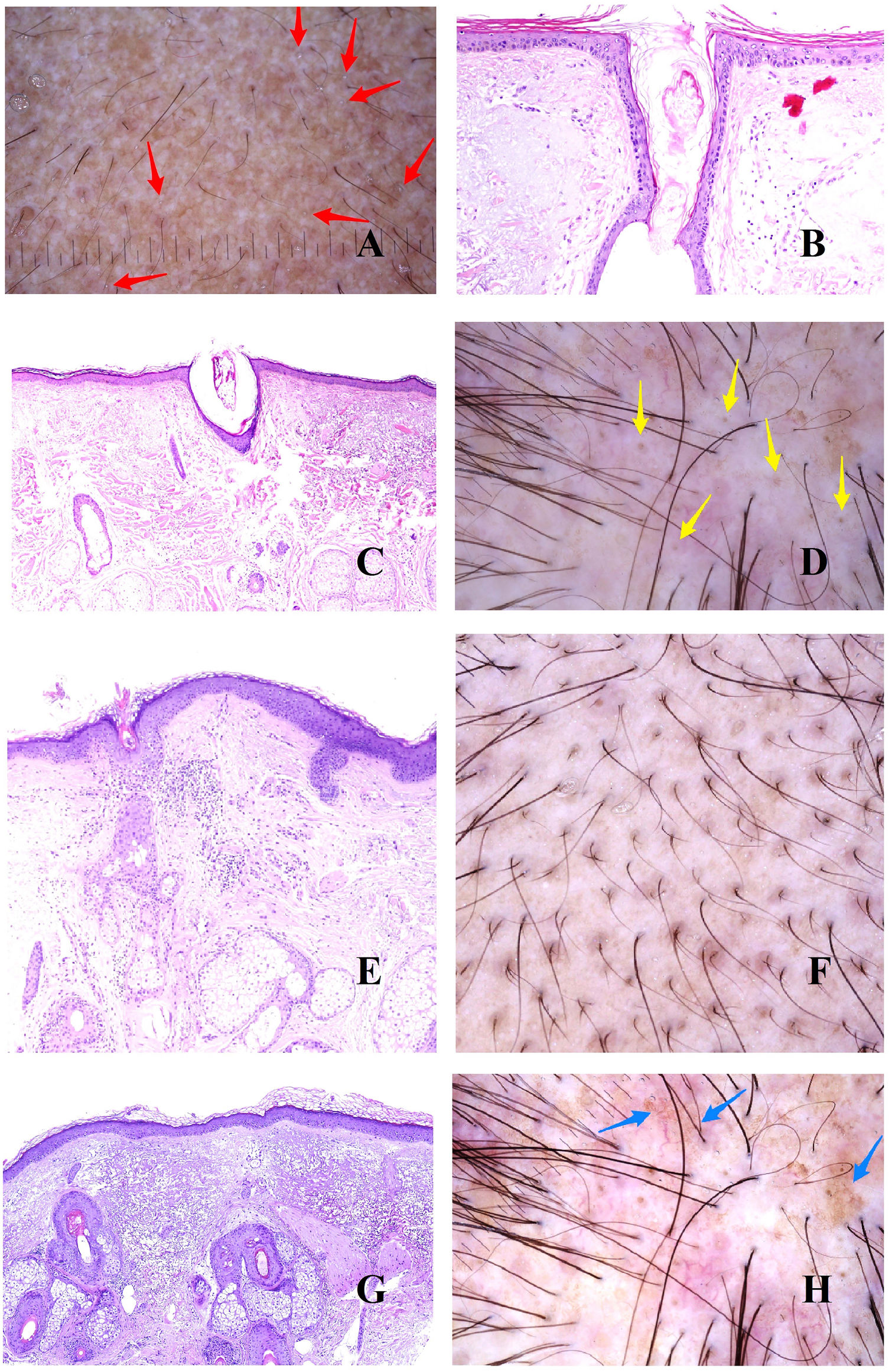
A: Alopecia androgénica. Las flechas rojas marcan los puntos blancos de los acrosiringios. Los puntos blancos más anchos corresponden a folículos pilosos vacíos. B y C: Alopecia androgénica. En ocasiones, los infundíbulos foliculares sin tallo aparecen llenos de secreción sebácea y de queratina (B: hematoxilina-eosina ×100; C: hematoxilina-eosina ×20). D: Alopecia androgénica. Puntos amarillos correspondientes a los infundíbulos sin tallos llenos de secreción sebácea y queratina. E: Alopecia androgénica. Discreto infiltrado inflamatorio linfohistiocitario en torno al istmo del folículo (hematoxilina-eosina ×40). F: Alopecia androgénica. Halo marronáceo en torno a la salida de los tallos. G: Alopecia androgénica. Intensa elastosis solar dérmica rodeando los folículos pilosos miniaturizados (hematoxilina-eosina ×20). H: Alopecia androgénica. Panal pigmentado «en panal de abeja».
En las biopsias de alopecia androgénica, no es infrecuente encontrar un discreto infiltrado linfocitario alrededor del istmo (fig. 2E), lo cual es percibido en la tricoscopia como halos marrones peripilares (fig. 2F).
A medida que un individuo va perdiendo su cabello y se extienden las áreas alopécicas, el cuero cabelludo expuesto empieza a padecer los rigores de la radiación solar, incrementándose la elastosis dérmica. Las zonas elastóticas presentan un tono marronáceo en la tricoscopia3,5. Como quiera que las áreas elastóticas rodean los folículos vellosos remanentes con sus glándulas sebáceas preservadas (de coloración amarillenta) (fig. 2G), el resultado es un patrón pigmentado «en panal de abeja» en torno a pápulas amarillentas (fig. 2H)6.
En este contexto de elastosis y muy baja densidad folicular, las glándulas ecrinas se verán con mucha facilidad, y especialmente la salida de sus acrosiringios, viéndose en la tricoscopia como puntos blancos3 (fig. 2A).
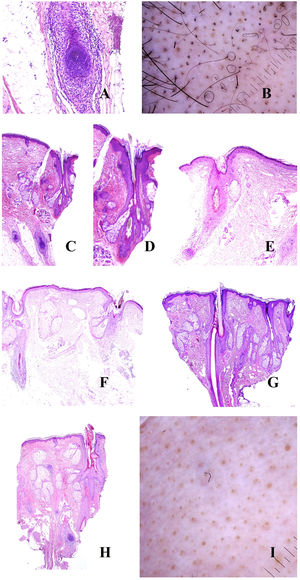
Alopecia areataEn la patogenia de la alopecia areata, desempeña un papel crucial la aparición de un infiltrado linfocitario autoinmune dirigido contra el bulbo folicular (fig. 3A), en relación con la pérdida del estatus de inmunidad del mismo7. Esto tendrá tres consecuencias fundamentales sobre el ciclo del folículo.
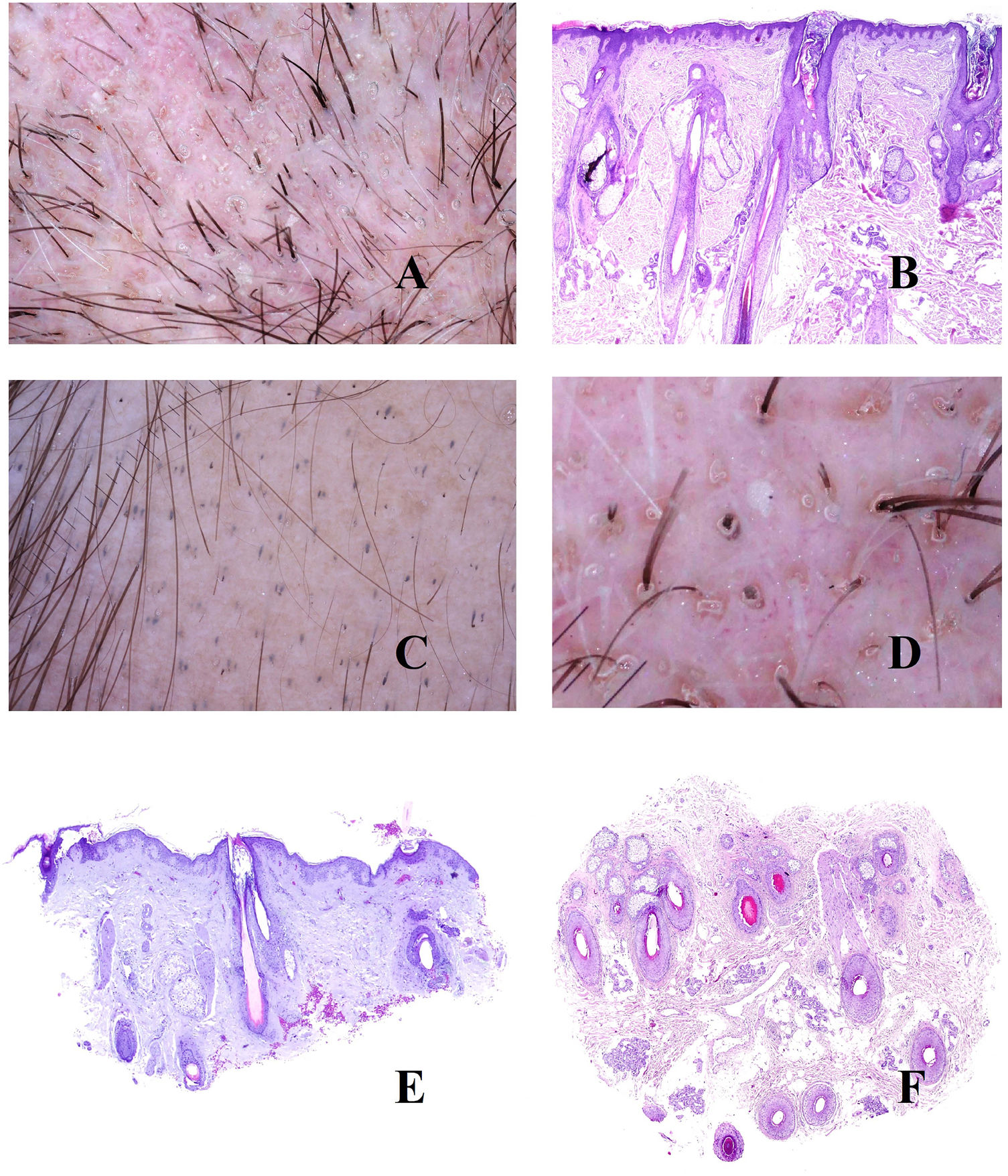
A: Alopecia areata. Infiltrado inflamatorio intenso peribulbar (hematoxilina-eosina ×100). B: Alopecia areata. Numerosos pelos en círculos. También se ven pelos fragmentados y puntos negros. C: Alopecia areata. Infitrado inflamatorio en torno a los bulbos. Dos tallos pilosos salen por el mismo infundíbulo (hematoxilina-eosina ×20). D: Alopecia areata. Detalle de la salida de dos tallos por el mismo infundíbulo (hematoxilina-eosina ×40). E: Alopecia areata. Evidencia del infiltrado inflamatorio peribulbar. El tallo piloso aparece fragmentado (hematoxilina-eosina ×20). F: Alopecia areata. Tallo piloso fragmentado en la salida del infundíbulo (hematoxilina-eosina ×20). G: Alopecia areata. Folículo piloso nuevo empujando al antiguo (hematoxilina-eosina ×20). H: Alopecia areata. Infundíbulo lleno con secreción sebácea y queratina (hematoxilina-eosina ×20). I: Alopecia areata. Numerosos puntos amarillos junto con algún ocasional pelo distrófico.
En primer lugar, un acortamiento del ciclo folicular. Esto traerá consigo el incremento del número de folículos vellosos en detrimento de los terminales. Sin embargo, la ratio velloso/terminal no alcanza los valores de la alopecia androgénica. En la biopsia pueden verse folículos con pelos que muestran tendencia a curvarse. Esto se percibe en la tricoscopia como pelos circulares8,9 (fig. 3B). De hecho, un gran número de pelos circulares es casi diagnóstico de alopecia areata9,10.
La segunda consecuencia patogénica será la distrofia de la fase anágena. Esto se manifestará de dos maneras. Por un lado, con la salida de dos o más tallos pilosos de cada infundíbulo (fig. 3C y D). Por otro lado, con la fragmentación de los tallos8 (fig. 3E y B). Cuando esta última se produce justo en el orificio infundibular (fig. 3F), se verá clínicamente como un punto negro8,9,11,12 (fig. 3B), que es uno de los hallazgos más frecuentes en alopecia areata13. La variabilidad entre los tallos fragmentados nunca es tan acentuada como la que se observa en la tricotilomanía13. No está claro cómo se producen estas fragmentaciones, pero una hipótesis es que la inflamación puede condicionar su adelgazamiento progresivo hasta romperse a nivel supraepidérmico13. Por ello, los tallos de la alopecia areata pueden adoptar a veces un patrón moniletrix-like13.
Cuando una alopecia areata empieza a recuperarse, se observa el folículo nuevo empujando desde el viejo (fig. 3G). Los nuevos tallos emergiendo se ven en la tricoscopia como tallos de final puntiagudo13. Durante el proceso de ascenso del nuevo tallo, el tallo piloso antiguo será desplazado hacia arriba, hasta que tan solo represente un pequeño segmento en la parte alta del tallo nuevo (el punto de una letra «i»). Esto se conoce como el signo de la «i», y es un buen indicador de recuperación de la alopecia. Los tallos pilosos en recuperación pueden también, como hemos mencionado más arriba, curvarse sobre sí mismos (pelos circulares o «en cola de cerdo»)13.
La tercera consecuencia patogénica de la inflamación bulbar es la prolongación de la fase telogénica. Esto traerá como consecuencia la abundancia de folículos vacíos (kenogen), que se verán en la tricoscopia como puntos blancos9. Al igual que sucedía en la alopecia androgénica, los infundíbulos pueden aparecer también llenos de queratina y sebo (fig. 3H), viéndose en la tricoscopia como puntos amarillos8,9,11,12 (fig. 3I). Al tener contenido de sebo, estos puntos amarillos no se verán en pacientes preadolescentes9. Una de las características de los puntos amarillos de la alopecia areata es su distribución regular, agregados en grupos de dos o tres, reflejando el número de tallos pilosos por unidad folicular13. Si estos infundíbulos sufren un ensanchamiento, el resultado será una imagen tricoscópica simulando un cráter. Este signo de los «cráteres lunares» se ha descrito en la alopecia areata severa14. Además, si los puntos amarillos se presentan sobre piel fotoexpuesta en pacientes de fototipo alto, entonces pueden acompañarse de pigmentación «en panal de abeja»13 debido a la elastosis rodeando a los folículos, al igual que hemos descrito en la alopecia androgénica.
También, en este tipo de alopecia, las aperturas ecrinas serán fácilmente identificables en la tricoscopia como puntos blancos papulosos.
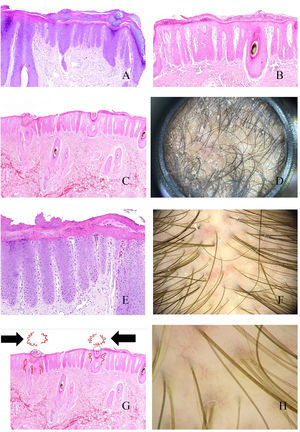
PsoriasisLa alopecia psoriásica es una entidad controvertida, dado el solapamiento clínico con la dermatitis seborreica.
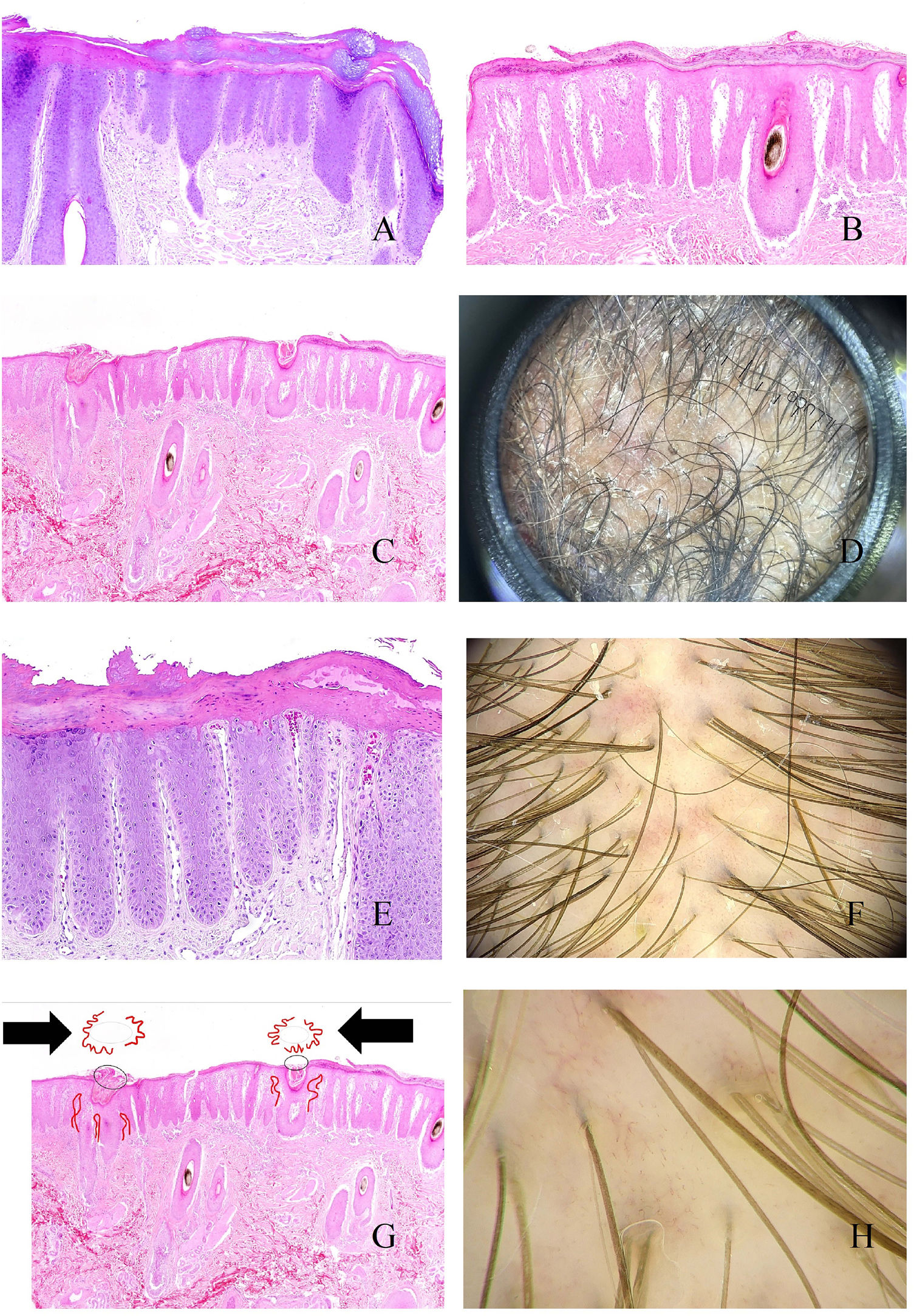
Al igual que en otras partes de la piel, el cuero cabelludo muestra un engrosamiento epidérmico por alargamiento de las crestas interpapilares (fig. 4A). Por encima, y en el estrato córneo, será fácil percibir las láminas paraqueratóticas de tamaños variables (fig. 4B), lo que se correlaciona con los patrones tricoscópicos descritos: escamas centrales, periféricas, difusas y parcheadas15. Cuando estas escamas muestran abscesos de polimorfonucleares, la condición puede verse en forma de pústulas16.
A: Alopecia en psoriasis. Engrosamiento epidérmico a expensas de las crestas interpapilares (hematoxilina-eosina ×20). B: Alopecia en psoriasis. Escama paraqueratótica (hematoxilina-eosina ×20). C: Alopecia en psoriasis. En esta biopsia, las escamas paraqueratóticas muestran localización infundibular (hematoxilina-eosina ×20). D: Alopecia en psoriasis. Moldes peripilares correspondientes a escamas de pataqueratosis infundibulares eliminadas con el crecimiento del tallo (cortesía de la Dra. Nerea Landa). E: Alopecia en psoriasis. Los vasos de la dermis papilar aparecen tortuosos y dilatados. Mientras que los de la derecha están en zonas de gran adelgazamiento epidérmico suprapapilar y se verán como asas rojas retorcidos, los de la izquierda están bajo una epidermis de un grosor un poco más conservado, y se verán en la tricoscopia como asas rojas simples (hematoxilina-eosina ×40). F: Puntos rojos (cortesía del Dr. David Saceda). G: Cuando las asas capilares papilares tortuosas aparecen rodeando una escama paraqueratótica, se produce una imagen muy característica en la tricoscopia (hematoxilina-eosina ×20). H: Vasos tortuosos (cortesía del Dr. David Saceda).
En ocasiones, las escamas paraqueratóticas aparecen preferentemente localizadas en los infundíbulos (fig. 4C), rodeando la salida de los tallos pilosos, y siendo eliminadas con el tallo en forma de moldes peripilares (fig. 4D).
En la dermis papilar, los capilares se ven tortuosos y dilatados (fig. 4E). Debido al adelgazamiento epidérmico suprapapilar, estos capilares serán percibidos como puntos rojos en el examen tricoscópico15 (fig. 4F). Cuando los capilares tortuosos rodean un infundíbulo que contiene una escama paraqueratótica, se producirá una imagen tricoscópica muy característica (fig. 4G)15. En ocasiones, los capilares dilatados se ven en zonas de acantosis epidérmica, sin tanto adelgazamiento suprapapilar, en forma de asas rojas retorcidos15,16 (fig. 4H). Por el contrario, los capilares bajo la epidermis de grosor más conservado se verán como asas rojas simples15,16.
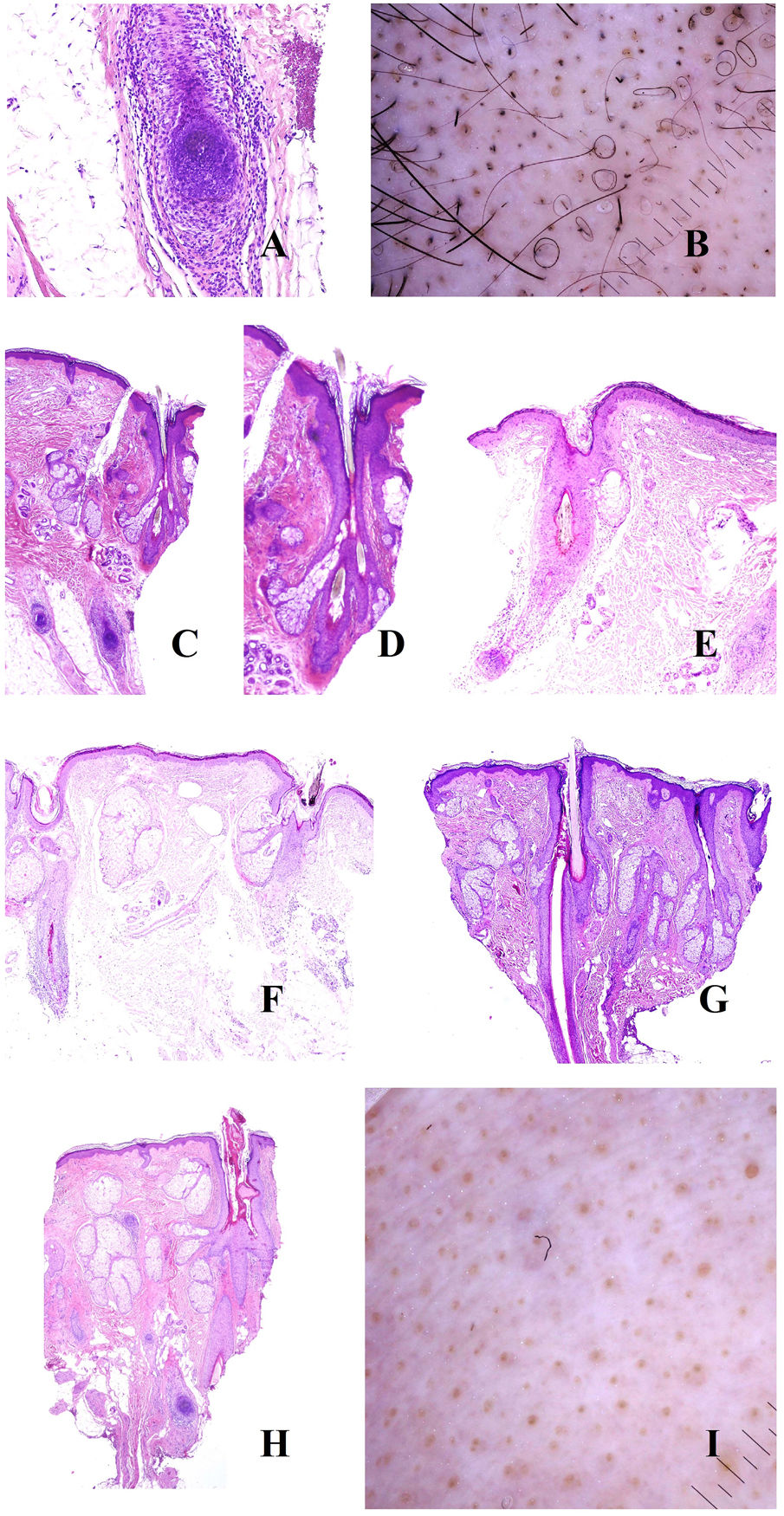
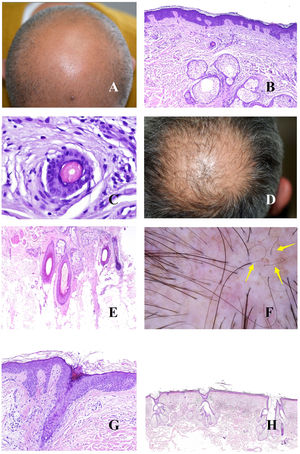
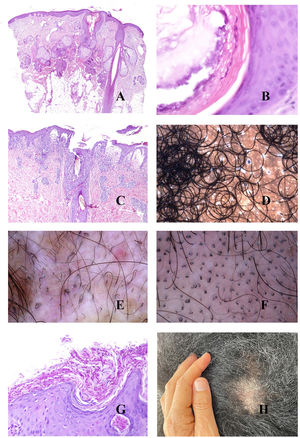
Tiña del cuero cabelludoLos microorganismos fúngicos suelen invadir el estrato córneo epidérmico o infundibular (fig. 5A y B) pero también en ocasiones el propio tallo, propiciando su fragmentación a distintos niveles (fig. 5C). Cuando el tallo se rompe justo en la apertura del infundíbulo, la tricroscopia mostrará puntos negros17,18 (fig. 5D).
A y B: Tiña del cuero cabelludo. Invasión fúngica de la queratina del infundíbulo (A: hematoxilina-eosina ×20; B: hematoxilina-eosina ×400). C: Fragmentación del tallo en un caso de tiña del cuero cabelludo (hematoxilina-eosina ×20). D: Tiña del cuero cabelludo. Puntos negros. E: Tiña del cuero cabelludo. Numerosos pelos en «sacacorchos». F: Tiña del cuero cabelludo. Numerosos pelos «en coma». G: Tiña del cuero cabelludo. Escama queratótica con muy abundante cantidad de microorganismos fúngicos (hematoxilina-eosina ×200). H: Tiña del cuero cabelludo. Escamas peri- e interfoliculares (cortesía de la Dra. Nerea Landa).
Algunas presentaciones clínicas son muy inflamatorias, con enrojecimiento, calor e hinchazón. Esto se correlaciona histopatológicamente con un prominente infiltrado inflamatorio perifolicular, muchas veces de tipo mixto agudo y crónico.
La invasión directa del tallo por los hongos puede alterar su forma y arquitectura, dando lugar a los pelos en coma, zigzag o en sacacorchos17,18 (fig. 5E y F). Por el contrario, la invasión fúngica de áreas hiperqueratóticas dará lugar a escamas interfoliculares y perifoliculares17,18 (fig. 5G y H).
TricotilomaníaPor el efecto mecánico, los tallos pilosos se rompen a distintas alturas en esta entidad, un hecho evidenciable tanto en la tricoscopia como en la biopsia (fig. 6A)9,19, adoptando a veces la forma de pelos «en interrogante», «en exclamación», «en tulipán» o «en llama»9,19. Aunque la presencia de tallos rotos no es un signo patognomónico de tricotilomanía, ya que puede verse en otras entidades como la alopecia areata, la tiña o la tricorrexis nodosa, en ninguna de estas últimas entidades se ve una variabilidad tan alta en las formas y longitudes de los cabellos como se ve en la tricotilomanía19. La rotura a distintos niveles puede verse también en la tricoscopia, con la evidencia de algunos tallos rotos por debajo de la superficie cutánea19. De igual manera, las porciones finales de los tallos rotos varían mucho en su forma, siendo frecuente la tricoptilosis (final del pelo dividido o deshilachado)19. Este último signo, no obstante, suele ser una característica de los tallos más cortos19.
A: Tricotilomanía. Tallos rotos a distintos niveles. B: Tricotilomanía. Depósito de pigmento melánico en el tallo folicular de la izquierda. Los dos infundíbulos de la derecha aparecen dilatados y con gran contenido queratínico. C: Tricotilomanía. Presencia de «polvo piloso» (hair dust) en muchos de los infundíbulos. D: Tricotilomanía. La tricoscopia muestra algunos pelos «en V». E y F: Efluvio telógeno. Folículos pilosos en telógeno junto a folículos pilosos vacíos, evidenciados tanto en cortes verticales como horizontales (E: hematoxilina-eosina ×20; F: hematoxilina-eosina ×20).
Dos signos útiles en la identificación de las fracturas del tallo son la hemorragia y el depósito de pigmento. La hemorragia se ve en los cortes histológicos como sangre separando dos fragmentos del pelo. Cuando esta zona se corta horizontalmente, la imagen simula una hamburguesa, mientras que en cortes longitudinales simula un perrito caliente. Por otro lado, el depósito de melanina en el tallo (fig. 6B) es muy orientativo, pero no patognomónico, ya que puede observarse en alopecias con lesión endógena del tallo como, por ejemplo, la alopecia areata.
Cuando los residuos de tallos dañados se acumulan junto con restos de queratina en los infundíbulos dilatados (fig. 6B), el resultado es el «polvo piloso» (hair dust) de la tricoscopia9,19,20 (fig. 6C). El polvo piloso debe distinguirse de los «puntos sucios» evidenciados en niños sanos19. El polvo piloso se distingue por su coloración uniforme, su pulverización fina y su proximidad a tallos que muestran otros signos de daño mecánico19.
No es infrecuente que uno o más tallos rotos emerjan de la misma apertura folicular20 (fig. 6D).
Efluvio telógenoEn el efluvio telógeno, un estímulo variado (cirugía, enfermedad severa, parto, dieta extrema, medicaciones diversas…) causa una masiva migración de folículos desde la fase anágena a la telógena2. El tricrograma mostrará una abundancia de tallos pilosos de morfología telogénica.
Mientras que las biopsias de efluvio telógeno agudo pueden ser bastante anodinas, en las biopsias de efluvio telógeno crónico, tanto si se hacen en sección horizontal como vertical, pueden evidenciarse folículos en telógeno junto con folículos vacíos (fig. 6D y E). En condiciones normales, los folículos en telógeno no representan más del 10%. Por el contrario, en las biopsias de efluvio telógeno, pueden alcanzar el 20-30%2.
Normalmente la caída del tallo es casi inmediatamente seguida del crecimiento de un nuevo tallo. Es en aquellos casos en los que el crecimiento de nuevo pelo no es inmediato en los que se pueden ver folículos vacíos o llenos de sebo (puntos amarillos), indistinguibles de los vistos en alopecia androgénica21. En caso de duda, el tricrograma puede resultar de gran utilidad.
Los nuevos tallos pilosos en recuperación pueden verse en la tricoscopia como finos y puntiagudos9,21, los cuales, cuando están presentes en número alto, son característicos del efluvio telógeno agudo21.
Aunque cierto porcentaje de pelos vellosos puede acompañar al efluvio telógeno, una ratio de pelos terminales/vellosos inferior a 4/1 debe hacer pensar en una alopecia androgénica más que en un efluvio.
Los infiltrados linfocitarios perifoliculares no son raros en el efluvio telógeno. Esto se correlaciona con el hallazgo de la pigmentación marrón peripilar (también vista en la alopecia androgénica)21.
La mayoría de los autores coinciden en que la tricoscopia del efluvio telógeno no es diagnóstica21, y que se trata de un diagnóstico de exclusión22.
ConclusionesEl conocimiento de los hallazgos histopatológicos evidenciados en cada una de estas entidades ayuda a la comprensión de los hallazgos tricoscópicos, así como al diagnóstico diferencial entre entidades que pueden llegar en ocasiones a mostrar un gran solapamiento clínico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.